Linfoma Canino: do diagnóstico à
terapêutica
Dissertação de Mestrado em Medicina Veterinária
Vera Cristina Ferreira Pereira
Orientador:
Professora Doutora Felisbina Luísa Queiroga Co-orientador:
Professor Doutor Pachi Clemente
Linfoma Canino: do diagnóstico à
terapêutica
Dissertação de Mestrado em Medicina Veterinária
Vera Cristina Ferreira Pereira
Orientador:
Professora Doutora Felisbina Luísa Queiroga Co-orientador:
Professor Doutor Pachi Clemente
Composição do Júri:
Presidente - Doutora Maria Madalena Vieira Pinto Vogais - Doutora Felisbina Luísa Queiroga
Doutora Isabel Cristina Ribeiro Pires
ii
"A compaixão para com os animais é das mais nobres virtudes da
natureza humana."
iii RESUMO
A doença oncológica surge com uma crescente preocupação em Medicina Veterinária e o linfoma, ou linfossarcoma, é uma das neoplasias mais comuns no cão. Os linfomas representam um grupo variado de neoplasias que têm em comum a sua origem, nos linfócitos, e que resultam da alteração e proliferação malignas dos mesmos em órgãos linfóides sólidos. A sua etiologia é multifatorial e apesar de haver grupos etários e raças mais afetados, qualquer animal pode vir a sofrer de linfoma. Os sinais clínicos são variáveis, de acordo com o tipo anatómico de linfoma. O diagnóstico pode ser feito com métodos clássicos, como citologia ou biópsia, mas, em casos duvidosos, novas técnicas como a citometria de fluxo ganham força. O tratamento adotado é maioritariamente o quimioterápico, com possibilidade de recurso a diferentes protocolos.
Este trabalho visa fazer uma revisão atualizada sobre linfoma e expôr e discutir quatro casos clínicos. Este estudo tem como objetivo avaliar os métodos de diagnóstico e o tratamento, a partir da evolução clínica dos animais em questão.
Palavras-chave: oncologia; linfoma canino; sistema hematopioético; citologia; protocolo quimioterápico.
iv ABSTRACT
The oncologic disease is a growing concern in veterinary medicine, and lymphoma, or lymphosarcoma, is one of the most common malignancies in the dog. Lymphomas are a diverse group of neoplasms whose origin is in lymphocytes and that result from their alteration and proliferation in lymphoid solid organs. Its etiology is multifactorial and despite having races and age groups who are more affected, any animal may suffer from lymphoma. Clinical signs change according to the anatomical type of lymphoma. The diagnosis can be made by using more classic methods like cytology or biopsy, but in doubtful cases, new techniques, such as flow cytometry, are gaining strength. The most used treatment is the chemotherapy, with the possibility of using different protocols.
This purpose of this paper is to do an updated review on lymphoma and present and discuss four clinical cases. This study also aims to evaluate the diagnostic methods and treatment, from the clinical course of the animals involved.
Keywords: oncology; canine lymphoma; hematopoietic system; cytology; chemotherapic protocol.
v ÍNDICE GERAL
ÍNDICE DE QUADROS ...viii
ÍNDICE DE FIGURAS ... x
ÍNDICE DE GRÁFICOS ... x
LISTA DE SIGLAS E ABREVIATURAS ... xi
AGRADECIMENTOS ... xiv 1. INTRODUÇÃO ... 1 2. EPIDEMIOLOGIA ... 1 3. ETIOLOGIA ... 1 4. CLASSIFICAÇÃO ... 2 4.1. Classificação anatómica ... 2 4.2. Classificação histopatológica ... 4 4.3. Classificação imunofenotípica ... 5 5. APRESENTAÇÃO CLÍNICA ... 6 5.1. Linfoma multicêntrico ... 6 5.2. Linfoma alimentar ... 7 5.3. Linfoma cutâneo ... 7 5.4. Linfoma mediastínico ... 8 5.5. Linfoma extranodal ... 8 6. SÍNDROMES PARANEOPLÁSICAS ... 9 7. TÉCNICAS DE DIAGNÓSTICO ... 10 7.1. Exame físico ... 11
7.2. Hematologia, bioquímica sérica e análise de urina ... 11
7.3. Citologia aspirativa com agulha fina ... 12
7.4. Biópsia ... 15
7.5. Imagiologia ... 15
7.6. PCR ... 17
7.7. Citometria de fluxo ... 18
7.8. Outras técnicas de diagnóstico ... 20
8. ESTADIAMENTO ... 20
9. DIAGNÓSTICOS DIFERENCIAIS ... 21
10. TRATAMENTO ... 21
10.1. Quimioterapia anti-neoplásica ... 22
vi
10.1.2. Tratamento do linfoma não multicêntrico ... 30
10.2. Radioterapia ... 30
10.3. Cirurgia ... 31
10.4. Outras formas de tratamentos ... 32
11. PROGNÓSTICO ... 33
11.1. Fatores epidemiológicos ... 33
11.2. Fatores clínicos ... 33
11.3. Fatores relativos à classificação... 33
11.4. Fatores moleculares e genéticos ... 34
12. OBJETIVOS ... 36
13. APRESENTAÇÃO DOS CASOS CLÍNICOS ... 37
13.1. Caso Clínico número 1 ... 37
13.1.1. Identificação ... 37 13.1.2. Anamnese ... 37 13.1.3. Exame físico ... 38 13.1.4. Diagnósticos diferenciais ... 38 13.1.5. Exames complementares ... 38 13.1.6. Diagnóstico... 40 13.1.7. Tratamento ... 40 13.1.8. Evolução clínica ... 40
13.2. Caso clínico número 2 ... 44
13.2.1. Identificação ... 44 13.2.2. Anamnese ... 44 13.2.3. Exame físico ... 44 13.2.4. Diagnósticos diferenciais ... 45 13.2.5. Exames complementares ... 45 13.2.6. Diagnóstico... 46 13.2.7. Tratamento ... 46 13.2.8. Evolução clínica ... 46
13.3. Caso clínico número 3 ... 49
13.3.1. Identificação ... 49
13.3.2. Anamnese ... 49
13.3.3. Exame físico ... 49
13.3.4. Diagnósticos diferenciais ... 49
vii
13.3.6. Diagnóstico... 51
13.3.7. Tratamento ... 51
13.3.8. Evolução clínica ... 51
13.4. Caso clínico número 4 ... 52
13.4.1. Identificação ... 52 13.4.2. Anamnese ... 52 13.4.3. Exame físico ... 53 13.4.4. Diagnósticos diferenciais ... 53 13.4.5. Exames complementares ... 53 13.4.6. Diagnóstico... 55 13.4.7. Tratamento ... 55 13.4.8. Evolução clínica ... 55
14. DISCUSSÃO DOS CASOS CLÍNICOS ... 58
15. CONCLUSÃO ... 65
16. REFERÊNCIAS BIBLIOGRÁFICAS ... 66
17. ANEXOS ... 73
Anexo 1: Tabela para cães de conversão de peso (Kg) para área de superfície corporal (m2). Adaptado de North e Banks (2009b) ... 73
Anexo 2: Resultado da citometria de fluxo da Desy ... 74
viii ÍNDICE DE QUADROS
Quadro 1: Classificação de Kiel de linfoma. Adaptado de Morris e Dobson (2001). ... 4
Quadro 2: National Cancer Institute Working Formulation para linfoma. Adaptado de Morris e Dobson (2001). ... 4
Quadro 3: Sinais clínicos e alterações físicas relativas aos diferentes tipos de linfoma extranodal em cães e gatos. Adaptado de Couto (2009b). ... 9
Quadro 4: Tumores comuns e síndromes paraneoplásicas hematológicas associadas. Adaptado de North e Banks (2009a). ... 10
Quadro 5: Tumores comuns e síndromes paraneoplásicas não hematológicas associadas. Adaptado de North e Banks (2009a). ... 10
Quadro 6: Características citológicas das células neoplásicas. Adaptado de Couto (2009a) ... 15
Quadro 7: Estadiamento clínico do linfossarcoma canino pela OMS. Adaptado de Thilakaratne et al. (2010). ... 21
Quadro 8: Diagnósticos diferenciais de linfoma. Adaptado de Vail e Young (2007). ... 21
Quadro 9: Protocolos com recurso a um único fármaco. Adaptado de Chun (2009). ... 24
Quadro 10: Protocolo quimioterápico combinado curto da Universidade de Wisconsin-Madison para cães com linfoma. Adaptado de Vail (2011). ... 25
Quadro 11: Protocolos quimioterápicos comummente utilizados no tratamento do linfossarcoma canino. Adaptado de Dhaliwal et al. (2003b). ... 26
Quadro 12: Protocolo quimioterápico LMP utilizado no tratamento de linfoma de cães na Ohio State Veterinary Teaching Hospital. Adaptado de Couto (2009b)... 27
Quadro 13: Protocolos quimioterápicos de resgate utilizados no tratamento de linfoma de cães na Ohio State Veterinary Teaching Hospital. Adaptado de Couto (2009b). ... 29
Quadro 14: Medição dos linfonodos periféricos aumentados no seu maior diâmetro em centímetros (cm) com régua antropométrica, na primeira consulta da Lula. ... 38
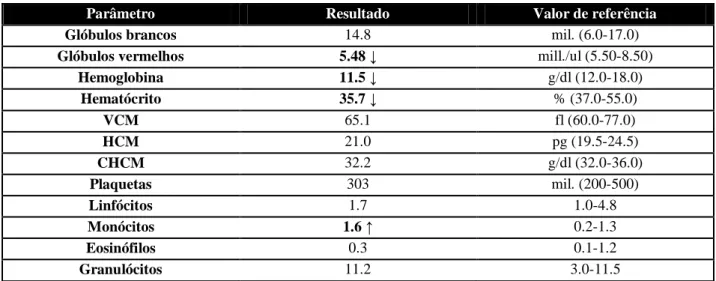
Quadro 15: Resultados do hemograma da Lula na primeira consulta. ... 39
Quadro 16: Tratamento e evolução clínica da Lula... 40
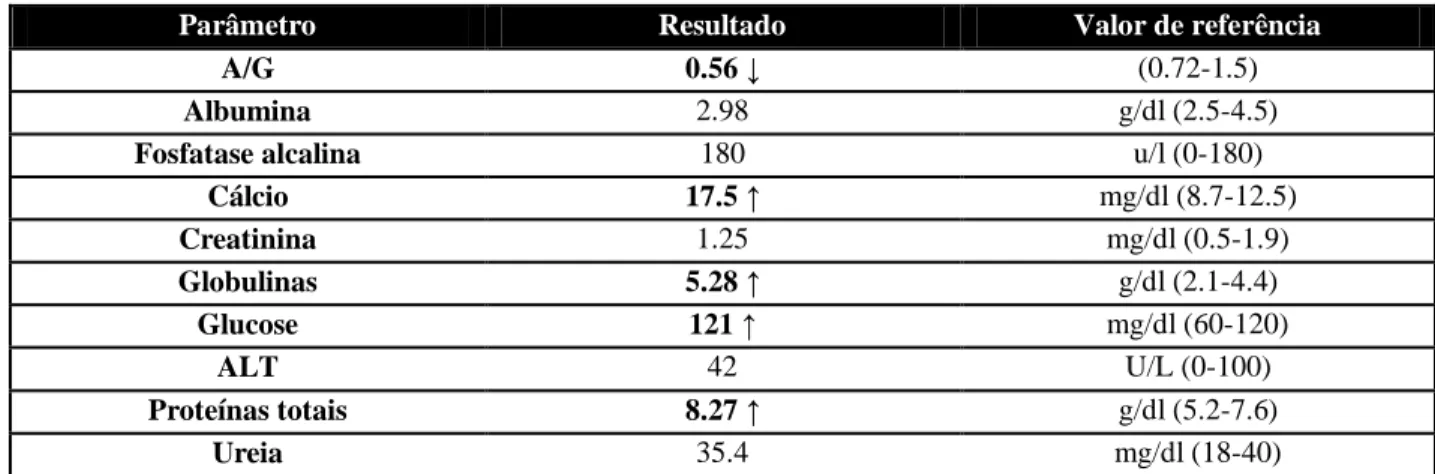
Quadro 17: Resultado da bioquímica sérica da Lula no dia 29/03/12. ... 42
Quadro 18: Resultados da bioquímica sérica da Lula do dia 19/04/12. ... 43
Quadro 19: Resultados do ionograma da Lula no dia 19/04/12. ... 43
Quadro 20: Medição dos linfonodos superficiais aumentados em centímetros (cm) no seu maior diâmetro com uma régua antropométrica, na primeira consulta da Luna. ... 45
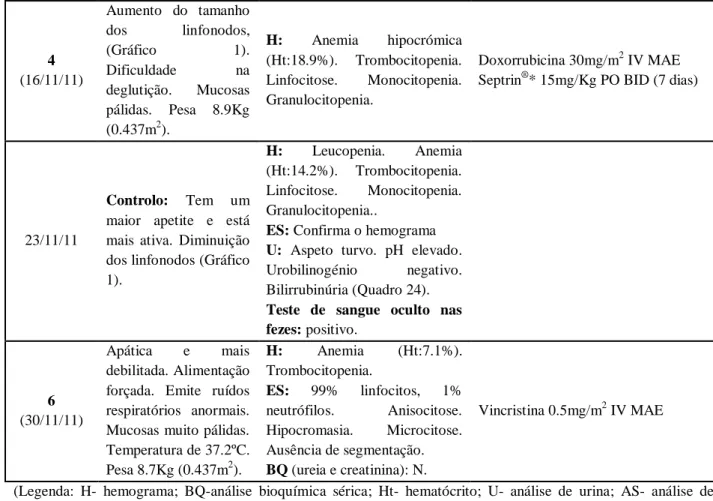
Quadro 21: Resultados do hemograma da Luna na primeira consulta. ... 45
Quadro 22: Tratamento e evolução clínica da Luna. ... 46
ix
Quadro 24: Resultados da análise de urina da Luna no dia 23/11/11. ... 48
Quadro 25: Resultados do hemograma da Luna no dia 04/12/11. ... 48
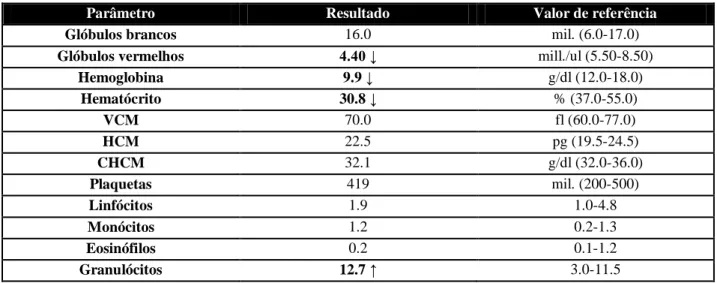
Quadro 26: Resultados do hemograma da Desy na primeira consulta ... 50
Quadro 27: Tratamento e evolução clínica da Desy ... 51
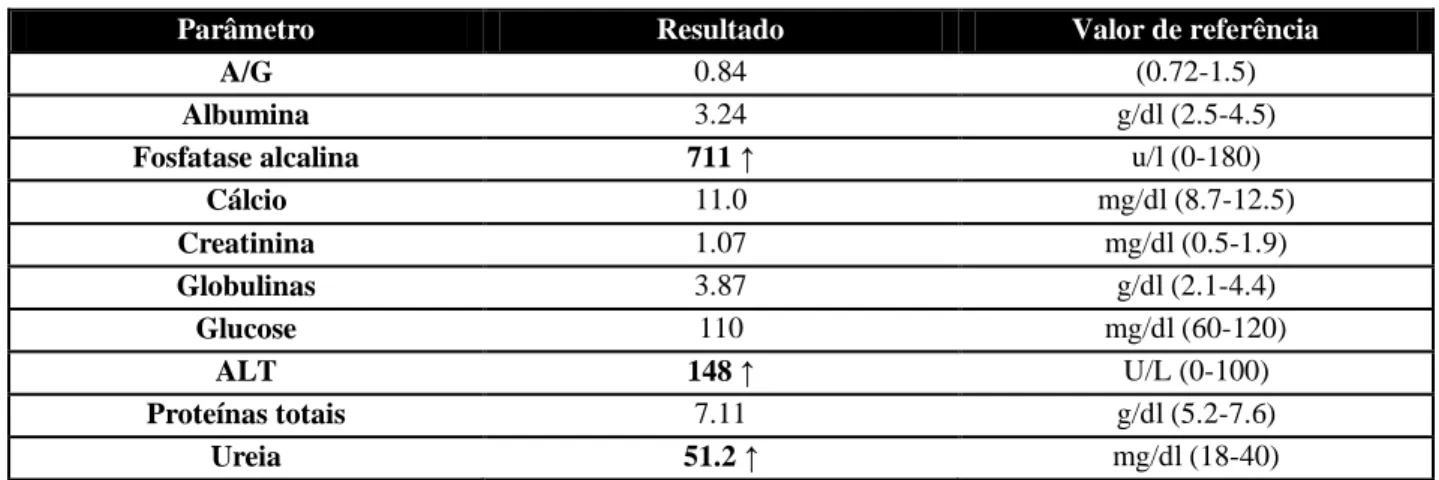
Quadro 28: Resultados do hemograma do Thor na primeira consulta. ... 54
Quadro 29: Resultados da bioquímica sérica do Thor na primeira consulta. ... 54
Quadro 30: Resultado do ionograma do Thor na primeira consulta. ... 54
x ÍNDICE DE FIGURAS
Figura 1: Placas e nódulos no abdómen de um cão com linfoma cutâneo epiteliotrópico. Adaptado de
Paterson (2008) ... 8
Figura 2: Nódulos múltiplos no dorso de um Labrador com linfoma cutâneo não epiteliotrópico. Adaptado de Medleau e Hnilica (2006) ... 8
Figura 3: Esquema representativo do método de realização de aspiração com agulha fina. Adaptado de Morris e Dobson (2001) ... 13
Figura 4: Imagem citológica de aspirado de linfonodo normal com predomínio de linfócitos maduros. Adaptado de Rakich e Latimer (2011)... 14
Figura 5: Imagem citológica de um aspirado de um linfonodo de um cão com linfoma. Adaptado de Bienzle (2011) ... 14
Figura 6: Imagem radiográfica de tórax na projeção latero-lateral direita da Lula, na primeira consulta. 39 Figura 7: Imagem radiográfica de abdómen na projeção latero-lateral direita da Lula, na primeira consulta. ... 39
Figura 8: Imagem radiográfica de tórax na projeção latero-lateral direita da Lula no dia 03/11/11 ... 41
Figura 9: Imagem radiográfica de tórax na projeção ventro-dorsal da Lula no dia 29/03/12 ... 42
Figura 10: Imagem radiográfica de tórax na projeção latero-lateral direita da Lula no dia 29/03/12 ... 42
Figura 11: Imagem radiográfica de tórax na projeção latero-lateral direita da Lula no dia 19/04/12 ... 43
Figura 12: Imagem citológida do aspirado ganglionar da Desy com coloração Diff-Quick® e ampliação de 40x ... 50
Figura 13: Imagem citológida do aspirado ganglionar do Thor com coloração Diff-Quick® e ampliação de 40x ... 55
ÍNDICE DE GRÁFICOS Gráfico 1: Variação do tamanho dos linfonodos superficiais da Luna ao longo do tratamento. Medição em centrímetros feita com régua antropométrica no maior diâmetro do linfonodo ... 47
xi LISTA DE SIGLAS E ABREVIATURAS
® Marca Registada
↑ Superior ao valor máximo de referência ↓ Inferior ao valor mínimo de referência < Inferior
µm Micrómetro
A/G Rácio albumina-globulinas Ad6 Adenovírus serótipo 6 ALT Alanina Aminotransferase BID A cada 12 horas
bpm Batimentos por minuto BQ Bioquímica sérica BUN Blood Urea Nitrogen
CD Clusters of differentiation
CF Citometria de Fluxo
CHCM Concentração da hemoglobina corpuscular média CHOP Ciclofosfamida, doxorrubicina, vincristina e prednisona CID Coagulação Intravascular Disseminada
COAP Ciclofosfamida, vincristina, citosina arabinosídeo e prednisona COP Ciclofosfamida, vincristina e prednisona
COPLA Ciclofosfamida, vincristina, prednisona, L-asparaginase, doxorrubicina e clorambucilo DNA Ácido Desoxirribonucleico
DNA-EP Eletroporação do DNA DRM Doença Residual Mínima
dTERT Telomerase transcriptase reversa canina DTIC Dacarbazina
ES Esfregaço sanguíneo
et al. et alli
FA Fosfatase Alcalina H Hemograma
HCV Hospital Clinico Veterinário CEU Universidad Cardenal Herrera HCM Hemoglobina corpuscular média
Ht Hematócrito IM Intramuscular IV Intravenoso
LMP Clorambucilo, metotrexato e prednisona MAD Membro anterior direito
xii
MAE Membro anterior esquerdo MMP Matriz de metaloproteinases MPD Membro posterior direito MPE Membro posterior esquerdo MRP Proteína Resistente a Drogas MVD Densidade de microvascularização NK Natural Killer
OMS Organização Mundial de Saúde
PARR PCR for antigen receptor rearrangements
PCR Reação em Cadeia da Polimerase PD Polidipsia
PE Linfonodo pré-escapular PO Per os
PU Poliúria QOD A cada 48 horas RNA Ácido Ribonucleico rpm Respirações por minuto SC Subcutâneo
SID A cada 24 horas
SM Linfonodo submandibular SNC Sistema Nervoso Central TERT Telomerase transcriptase reversa U Análise de urina
UI Unidades Internacionais
UTAD Universidade de Trás-os-Montes e Alto Douro VCM Volume corpuscular médio
xiii
xiv AGRADECIMENTOS
Agradeço à Professora Doutora Felisbina Luísa Queiroga, minha orientadora, por ter aceitado acompanhar o meu trabalho nesta fase final de curso. Obrigada pela prontidão, pela disponibilidade e apoio.
Agradeço ao Professor Pachi Clemente pelos ensinamentos, pela experiência transmitida, mas sobretudo pelo entusiasmo contagiante e marcante com que cativa quem o rodeia. Obrigada por ter aceitado co-orientar esta tese e, apesar da distância, ter acompanhado o meu trabalho.
Obrigada a todos os professores e clínicos do Hospital Veterinário da UTAD por tudo o que ensinaram e pela partilha de experiência. Um agradecimento especial à Professora Doutora Justina Prada pela pronta ajuda nesta tese.
Agradeço a todos os alunos, professores, veterinários residentes e profissionais do Hospital Clínico Veterinario CEU Universidad Cardenal Herrera por me terem recebido de braços abertos e terem ajudado e apoiado sempre que necessário. Obrigada por tudo o que me ensinaram. Um agradecimento especial à Mireia pelo incentivo, amparo e cuidado.
Agradeço ao corpo clínico do Hospital Veterinário do Baixo Vouga pela aprendizagem, pela experiência e pelos ensinamentos que me foram proporcionados durante o estágio.
Obrigada aos meus colegas de curso, especialmente aos meus amigos e colegas da turma 3, pelos 5 anos maravilhosos, pela amizade, pela cumplicidade, pela entreajuda e pelos bons momentos.
Um obrigada especial às minhas amigas e companheiras de curso, estágio e de casa, Olga e Hélia. Obrigada pelo apoio, pelo ombro amigo, pelas gargalhadas e pelo companheirismo. Agradeço também ao Tiago por toda a ajuda, por estar presente nos momentos difíceis e ter a palavra certa no momento certo.
Aos meus amigos de sempre: Filipa, Sissa e Pimenta, obrigada pelo incentivo, pela preocupação, pelo apoio e ânimo nas alturas de maior desalento.
Agradeço ao Rui pela infinita paciência nos últimos meses e por todos os dias em que esteve ao meu lado. Obrigada pela amizade, por todos os bons momentos… obrigada por tudo!
xv
Obrigada à minha família, pelo carinho, pela compreensão e apoio. Um agradecimento especial ao tio Agostinho e tia Laida, e respetivas famílias, pelo cuidado e preocupação e pela força que souberam dar quando necessário.
Obrigada aos meus pais e irmão por acreditarem em mim, por incentivarem e estarem sempre presentes ao longo da minha vida. Obrigada Pais por tudo o que por mim fizeram, fazem e farão. Obrigada por me fazerem sentir que tudo posso e tudo consigo. E quando um “obrigada” parece não ser suficiente para tudo o que pretendo transmitir, fico-me por esta simples frase: a vós devo o que sou!
Por fim, e como não poderia deixar de ser, agradeço a todos os meus bichos por tornarem a minha vida tão boa e alegre e por serem, como todos os bichos, simples e genuinos. Obrigada por terem despertado em mim a vontade de realizar este sonho.
1 1. INTRODUÇÃO
Os linfomas representam um grupo variado de neoplasias que têm em comum a sua origem, nos linfócitos, e que resultam da alteração e proliferação malignas dos mesmos em órgãos linfóides sólidos, tais como os linfonodos, baço e fígado (Vail e Young, 2007; Couto, 2009b; Bryan, 2010; Vail, 2010).
O linfoma é uma das neoplasias mais comuns no cão, com uma percentagem que se situa entre 7 e 24% de entre todas as neoplasias, sendo que a estimativa da incidência anual se encontra entre 13 e 24% e com tendência a aumentar. Esta doença linfoproliferativa neoplásica representa cerca de 80 a 90% das neoplasias hematopoiéticas (Morris e Dobson, 2001; Dobson et
al., 2002; Vail e Young, 2007; Vail, 2011).
2. EPIDEMIOLOGIA
Os cães afetados pelo linfoma incluem-se maioritariamente no grupo etário que vai desde a meia-idade à idade geriátrica, com uma média que se situa entre os 6 e os 9 anos. Os animais com menos de 4 anos são os menos afetados (Hahn et al.,1994; Sueiro et al., 2004; Sözmen et
al., 2005; Turek et al., 2008; Miller et al.,2009; Wolfesberger et al., 2012).
O género não surge como um fator de risco (Vail, 2011). No entanto, as cadelas não castradas apresentam uma menor incidência de linfoma, o que sugere um papel importante das hormonas femininas no não desenvolvimento da doença (Villamil et al., 2009).
Todas as raças podem apresentar a doença, contudo o Boxer, Bull Mastiff, Basset Hound, São Bernardo, Scottish Terrier, Airedale Terrier, Bulldog, Labrador Retriver, Rottweiler, Cocker Spaniel e Golden Retriver apresentam uma maior incidência. As raças que parecem ser menos afetadas são a Dachshund, a Pomeranian e a Chihuahua (Edwards et al., 2003; Modiano et al., 2005; Vail e Young, 2007; Couto, 2009b; Miller et al.,2009).
3. ETIOLOGIA
A etiologia do linfoma é considerada multifatorial, pois não foi identificado um fator único como causador desta neoplasia (Couto, 2009b). Contudo, é evidente uma componente genética, uma vez que há raças mais predispostas. A prevalência de células B e células T nas
2
doenças linfoproliferativas neoplásicas difere entre raças (Modiano et al., 2005) e a raça de cães Boxer é mais afetada por linfoma de células T (Lurie et al., 2008b), o que apoia a existência de uma componente hereditária.
O meio ambiente foi estudado no sentido de encontrar fatores etiológicos. Um estudo de Takashima-Uebelhoer et al. (2012) avaliou a associação entre químicos utilizados em casa e o risco de linfoma canino. Os resultados não demonstraram ligação entre o uso de produtos para controlo de pulgas e carraças e o linfoma canino. Pelo contrário, a exposição a produtos específicos de cuidado de relva foi relacionada com uma maior risco de desenvolvimento da doença. A hipótese do desenvolvimento de linfoma devido à exposição ao herbicida 2,4-D no cão doméstico é analisada por Hayes et al. (1995), não provando este que tal relação seja causadora desta neoplasia.
Para além dos fatores já enunciados, a origem do linfoma também poderá estar associada a: habitação na proximidade de áreas industriais, exposição a fortes campos magnéticos, medicação imunossupressiva (ciclosporina), atopia (surge relacionada com o linfoma cutâneo) e fatores infeciosos (Tomley et al., 1983; Bryan, 2010; Vail, 2010; Vail, 2011).
4. CLASSIFICAÇÃO
O linfoma canino pode ser classificado de acordo com a distribuição anatómica da neoplasia, com a morfologia celular e aspeto histológico e ainda de acordo com o imunofenotipo (Morris e Dobson, 2001).
4.1. Classificação anatómica
O sistema de classificação mais antigo do linfoma canino é o que o caracteriza tendo em conta o local anatómico da doença. Deste modo, o linfoma é classificado, por ordem decrescente de incidência, em: multicêntrico, alimentar, cutâneo, mediastínico e extranodal (Dahliwal et al., 2003a).
A forma multicêntrica do linfoma canino tem uma incidência de 80% de entre todos os tipos de linfoma no cão e caracteriza-se por uma linfadenomegália generalizada, com ou sem o envolvimento do fígado, baço e medula óssea. Parece haver um maior risco de linfoma multicêntrico nos machos, na raça Rottweiler e nos animais na faixa etária da meia-idade (Jagielski et al., 2002; Couto, 2009b; Vail, 2011).
3
O tipo anatómico de linfoma mais frequente depois do multicêntrico, é o alimentar, que se pode apresentar sob três formas de infiltração gastrointestinal: solitária, difusa ou multifocal, cada uma com ou sem o envolvimento da medula óssea. O linfoma alimentar representa aproximadamente 7% de todos os linfomas e é mais frequente nos canídeos do sexo masculino (Vail e Young, 2007; Couto, 2009b; Vail, 2010). Num estudo de Rassnick et al. (2009) a média de idades de animais com linfoma alimentar foi de 10 anos e o imunofenotipo mais comummente encontrado foi o T.
O linfoma cutâneo atinge 6% dos animais com linfoma e pode ter uma de duas formas: a epiteliotrópica ou a não-epiteliotrópica. Ambas as formas são pouco comuns em cães, sendo os animais geriátricos os mais afetados. As raças Scottish Terrier e Golden Retriver são mais predispostas à forma epiteliotrópica (Medleau e Hnilica, 2006; Vail, 2011).
A forma anatómica que surge em quarta posição em termos de ocorrência é a mediastínica, com uma incidência de cerca de 3% de entre todos os tipos de linfoma. O linfoma mediastínico caracteriza-se por uma linfadenomegália dos linfonodos mediastínicos craniais e/ou timo, com ou sem envolvimento da medula óssea. Cerca de 20% dos cães com linfoma multicêntrico também apresentam linfadenomegália destes linfonodos, mas a hipercalcémia é mais comum na forma mediastínica, assim como o fenótipo de células T (Vail e Young, 2007; Couto, 2009b; Vail, 2010).
A par da forma mediastínica, está a forma extranodal, com uma incidência semelhante, de cerca de 3%. O linfoma extranodal pode afetar qualquer órgão ou tecido (renal, ocular, sistema nervoso central (SNC), ossos, testículos, bexiga, coração e cavidade nasal). O linfoma ocular surge frequentemente associado à forma multicêntrica da neoplasia e, pelo contrário, o linfoma renal é muito raro no cão. O linfoma neural pode apresentar-se sob três formas clínicas diferentes: linfoma epidural solitário, linfoma do neurópilo (ou verdadeiro linfoma do SNC) e linfoma dos nervos periféricos (Vail e Young, 2007; Couto, 2009b; Vail, 2011).
Duas formas raras de linfoma são o linfoma hepatoesplénico e o linfoma intravascular. O linfoma hepatoesplénico caracteriza-se pela ausência de linfadenomegália periférica e afeção do fígado, baço e medula óssea. Os linfócitos são frequentemente de imunofenotipo T e a doença revela-se agressiva e com má resposta ao tratamento. O linfoma intravascular é uma doença multisistémica caracterizada pela proliferação de linfócitos neoplásicos confinados ao lúmen dos vasos sanguíneos de pequeno e médio calibre e pela inexistência de uma massa neoplásica primária extravascular. Esta forma de linfoma deriva maioritariamente de células T e ocorre
4
preferencialmente nos vasos sanguíneos do SNC (Wick e Mills, 1991; McDonough et al., 2002; Vail e Young, 2007).
4.2. Classificação histopatológica
A classificação histopatológica é complexa e há vários esquemas de classificação histológica no linfoma não-Hodgkin de humanos aplicados ao linfoma a canino, todos eles com o objetivo de ligar o tipo de célula ao prognóstico. Os esquemas que têm demonstrado maior valor prognóstico são o de Kiel (Quadro 1) e o sistema Nacional Cancer Institute Working
Formulation (Quadro 2) (Morris e Dobson, 2001; Vail, 2010).
Quadro 1: Classificação de Kiel de linfoma. Adaptado de Morris e Dobson (2001).
Baixo grau de malignidade
Linfocítico
Linfoplasmocítico, linfoplasmocitóide Centrocítico
Centroblástico/centrocítico (folicular/difuso) Não classificado
Alto grau de malignidade
Centroblástico
Linfoblástico (tipo Burkitt, tipo celular complexo) Imunoblástico
Não classificado
Quadro 2: National Cancer Institute Working Formulation para linfoma. Adaptado de Morris e Dobson (2001).
Baixo grau de malignidade
Linfocítico de células pequenas
Folicular predominantemente de células pequenas clivadas Folicular misto de células clivadas pequenas e grandes
Grau intermédio de malignidade
Folicular predominantemente de células grandes Difuso de células pequenas clivadas
Difuso misto de células clivadas grandes e pequenas Difuso de células grandes (clivadas e não clivadas)
Alto grau de malignidade
Imunoblástico
Linfoblástico (complexo e não complexo) Células pequenas não clivadas (Burkitt)
No sistema mais recente da Organização Mundial de Saúde (OMS), os tumores são classificados em baixo, intermédio ou alto grau. Os linfomas de baixo grau, compostos por
5
células pequenas e um baixo índice mitótico, tipicamente progridem de forma lenta, são pouco responsivos à quimioterapia e estão associados a tempos de sobrevivência elevados. Em contraste, os linfomas de graus intermédio e alto, com uma taxa mitótica alta, progridem rapidamente mas são mais responsivos à quimioterapia (Vail, 2011). Valli et al. (2011) revela que os médicos veterinários patologistas, mesmo os que não são especialistas em hematopatologia, podem atingir um alto grau de precisão na utilização do sistema de classificação da OMS para linfomas caninos.
4.3. Classificação imunofenotípica
Imunofenotipicamente, os linfomas podem ser de células B, de células T ou nulos, sendo a maioria dos linfomas do primeiro tipo (Modiano et al., 2005; Siedlecki et al., 2006). O linfoma imunofenotipicamente nulo é aquele cuja origem não pode ser especificada como de células B ou T por não exprimir marcadores suficientes de um dos tipos ou por exprimir ambos os marcadores, de células B e de células T (Arespacochaga et al., 2007). Os linfomas de células T têm um pior prognóstico, pois respondem pior ao tratamento, sendo o tempo de sobrevida menor relativamente aos de células B (Ponce et al., 2004; Wilkerson et al., 2005). A prevalência dos diferentes imunofenotipos pode variar entre diferentes raças (Lurie et al., 2008b). A idade média dos animais que apresentam linfomas de células T e de células B é semelhante. Contudo, os animais com imunofenotipo nulo são ligeiramente mais velhos (Modiano et al., 2005).
A imunofenotipagem das células linfóides permite identificar combinações de vários marcadores de superfície celular, os clusters of differentiation (CD), tais como o CD79a (marcador dos linfócitos B) ou CD3 (marcador dos linfócitos T), para isto é utilizada uma grande variedade de anticorpos. Além da distinção entre linfócitos B e T, a imunofenotipagem permite diferenciar doença linfoproliferativa reativa de doença linfoproliferativa neoplásica. Desta forma, uma população linfóide policlonal ou reativa terá várias combinações diferentes de marcadores de superfície, indicando diferentes tipos de células B e T dentro de uma população celular em proliferação. Uma população monoclonal ou neoplásica de células linfóides será composta por células com um imunofenotipo homogéneo, onde os marcadores são idênticos ou muito semelhantes em todas as células (Dickinson, 2008).
A classificação imunofenotípica pode ser realizada por imunohistoquímica, imunocitoquímica, citometria de fluxo (CF) ou reacção em cadeia da polimerase (PCR) para clonalidade. A CF tem a vantagem de permitir obter resultados com amostras pequenas obtidas
6
por técnicas pouco invasivas, enquanto a imunohistoquímica, por se basear na arquitetura do linfonodo, possibilita a identificação de subtipos celulares (Wilkerson et al., 2005; Couto, 2009b).
O imunofenotipo pode ainda ser relacionado com o tipo histológico de linfoma. A maior parte dos linfomas de células B são centroblásticos e polimórficos, contudo uma pequena parte são tipo Burkitt, que têm um mau prognóstico. Os linfomas de células T mostram-se, predominantemente, dos tipos pleomórfico misto e linfoblástico, havendo uma pequena parte de linfomas deste imunofenotipo que se inclui no tipo histológico de células pequenas claras, que têm o maior tempo de sobrevivência de entre todos os tipos histológicos (Ponce et al., 2004).
Atualmente, na prática clínica, o facto de um linfoma ser de células B ou T não altera o tipo de tratamento que pode ser feito, mas é essencial para um diagnóstico preciso e também poderá ajudar na decisão do dono para prosseguir com um tratamento (Turek et al., 2008; Valli
et al., 2011).
5. APRESENTAÇÃO CLÍNICA
A apresentação clínica do linfoma é muito variável, dependendo da localização anatómica e da extensão do tumor. No entanto, o sinal clínico mais comum é a linfadenomegália generalizada. Apresentações menos comuns incluem casos restritos ao baço ou ao baço e ao fígado (Vail, 2011).
5.1. Linfoma multicêntrico
Os animais com linfoma multicêntrico apresentam uma linfadenomegália solitária ou generalizada, com linfonodos móveis e indolores à palpação, que pode ser acompanhada por hepato e/ou esplenomegália e envolvimento da medula óssea ou outros órgãos. A maioria dos casos encontra-se clinicamente bem, apresentando os restantes, que geralmente estão associados ao imunofenotipo T, sinais inespecíficos, tais como perda de peso, anorexia e letargia. Há ainda animais que apresentam: dispneia e tosse, por compressão das vias respiratórias pelos linfonodos aumentados; formação de edema da cabeça, que ocorre quando o aumento dos linfonodos provoca a diminuição do retorno venoso através da veia cava cranial - síndrome da veia cava - e por obstrução da drenagem linfática (Vail e Young, 2007; Turek et al., 2008; Couto, 2009b).
7
Aproximadamente 20% dos cães afetados apresentam sinais de hipercalcémia - polidipsia, poliúria, anorexia, vómito, constipação, depressão, fraqueza muscular e arritmias cardíacas. Uma percentagem menor de animais apresenta sinais de gamopatia monoclonal - hemorragias, tromboembolismo, lesões oculares e sinais neurológicos (Morris e Dobson, 2001).
5.2. Linfoma alimentar
Os animais com linfoma alimentar podem apresentar como sinais clínicos: vómitos, diarreia, anorexia, perda de peso, disquésia ou tenesmo. Pode haver também obstruções, completas ou não, que podem levar a peritonites secundárias causadas por rupturas intestinais. Na palpação abdominal poderá ser possível sentir massas abdominais, linfonodos mesentéricos aumentados e ansas intestinais espessadas. Raras vezes pode haver protusão de pólipos linfóides através do ânus em cães com linfoma colorectal (Morris e Dobson, 2001; Turek et al., 2008; Couto, 2009b). A hipoalbuminémia foi um achado comum neste tipo de linfoma num estudo de Rassnick et al. (2009).
5.3. Linfoma cutâneo
O linfoma cutâneo pode ser primário (com origem na pele) ou secundário (associado a linfoma encontrado maioritariamente em outro local do corpo), sendo que o primeiro se subdivide em duas formas, a epiteliotrópica e a não-epiteliotrópica (Morris e Dobson, 2001).
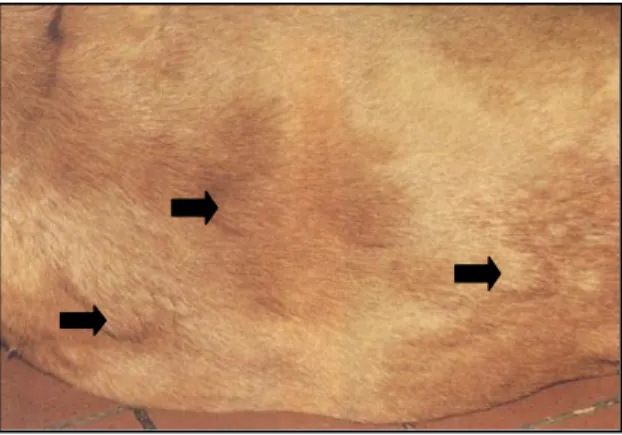
A forma epiteliotrópica de linfoma cutâneo, ou mycosis fungoides, tem origem nos linfócitos T. A forma não-epiteliotrópica, ou dérmica, é mais agressiva e pode surgir a partir de linfócitos T ou B. As lesões cutâneas que é possível encontrar no linfoma epiteliotrópico são placas múltiplas ou solitárias ou nódulos de tamanho muito variável (Figura 1). Pode ainda haver despigmentação e ulceração das junções mucocutâneas e lesões mais generalizadas como eritema, alopécia, descamação e prurido. As almofadas plantares podem apresentar hiperqueratose, ulceração ou despigmentação. O animal pode ainda apresentar estomatite. A maior parte dos casos desenvolve-se de forma lenta e progressiva e pode ocorrer linfadenomegália periférica e sinais de envolvimento sistémico. O linfoma não-epiteliotrópico distingue-se por apresentar, usualmente, nódulos múltiplos e firmes que se podem estender da derme ao tecido subcutâneo (Figura 2) e podem ser alopécicos e ulcerados. Os tumores podem apresentar as formas ansiforme ou serpiginosa e as lesões ocorrem mais frequentemente no
8
tronco, cabeça e extremidades. O prurido e o envolvimento oral são raros e é possível haver sinais clínicos de envolvimento sistémico (Medleau e Hnilica, 2006; Paterson, 2008).
O linfoma cutâneo secundário apresenta células linfóides na derme que têm semelhanças morfológicas com histiócitos. O imunofenotipo pode ser B ou T, dependendo isto do tipo de linfoma primário (Morris e Dobson, 2001).
Figura 1: Placas e nódulos no abdómen de um cão com linfoma cutâneo epiteliotrópico. Adaptado de Paterson (2008).
Figura 2: Nódulos múltiplos no dorso de um Labrador com linfoma cutâneo não epiteliotrópico. Adaptado de Medleau e Hnilica (2006).
5.4. Linfoma mediastínico
A linfadenomegália mediastínica anterior característica deste tipo anatómico de linfoma é acompanhada, ocasionalmente, por efusão pleural e infiltração da medula óssea, que podem agravar a sintomatologia já existente. Os sinais clínicos presentes, provocados pela compressão exercida pelos linfonodos em diferentes estruturas, são: tosse, dispneia, regurgitação, síndrome de Horner uni ou bilateral e deslocamento dorsocaudal dos focos de auscultação cardíaca e respiratória. Alguns animais apresentam ainda edema marcado da cabeça, membros anteriores e pescoço, resultado da síndrome da veia cava ou da invasão da veia cava cranial por células tumorais (Morris e Dobson, 2001; Vail e Young, 2007; Couto, 2009b).
5.5. Linfoma extranodal
A apresentação clínica do linfoma extranodal depende da localização do mesmo (Couto, 2009b), como apresentado no quadro 3.
9
Quadro 3: Sinais clínicos e alterações físicas relativas aos diferentes tipos de linfoma extranodal em cães e gatos. Adaptado de Couto (2009b).
Órgão afectado Apresentação clínica Alterações físicas
SNC Sintomatologia nervosa Sinais neurológicos
Olho Cegueira, fotofobia Uveíte, descolamento da retina, glaucoma
Rim PU/PD, azotemia, eritrocitose (só nos cães) Renomegália, massas renais
Pulmão Tosse, dispneia Alterações radiográficas
(Legenda: SNC- sistema nervoso central; PU- poliúria; PD- polidipsia)
6. SÍNDROMES PARANEOPLÁSICAS
A síndrome paraneoplásica mais significativa no linfoma é a hipercalcémia, que ocorre em, aproximadamente, 15% de todos os cães com esta neoplasia e em cerca de 50% dos cães com envolvimento mediastínico e/ou imunofenotipo de células T. Desta forma, o local mais comum do linfoma em cães com hipercalcémia é o mediastino cranial, seguido pela medula óssea. Esta síndrome paraneoplásica caracteriza-se clinicamente por anorexia, perda de peso, fraqueza muscular, letargia, poliúria, polidipsia e, raras vezes, coma (North e Banks, 2009a). Num estudo retrospetivo de Messinger et al. (2009), num grupo de animais verificou-se que a causa mais comum de hipercalcémia foi a neoplasia (58%) e dentro deste grupo, a mais frequentemente diagnosticada foi o linfoma, correspondente a 78% dos casos.
Embora a hipercalcémia seja a síndrome paraneoplásica mais importante, a anemia também surge relacionada com o linfoma canino. Esta alteração hematológica está presente, aquando do diagnóstico, em cerca de 32% dos animais com esta neoplasia. Em 90% dos casos, a anemia é normocrómica e normocítica e anemias mais severas aparecem associadas a menores tempos de sobrevivência (Miller et al., 2009).
Devido à grande heterogeneidade desta doença, muitas outras síndromes podem ser encontradas (Quadros 4 e 5) e incluem, entre outras, gamopatias monoclonais e policlonais, citopenias imunitárias, polineuropatias, caquexia tumoral e hipoglicemia. A trombocitopenia pode ser encontrada em 30-50% dos casos (Couto, 2009b; North e Banks, 2009a; Sorenmo et al., 2010; Vail, 2011).
10
Quadro 4: Tumores comuns e síndromes paraneoplásicas hematológicas associadas. Adaptado de North e Banks (2009a).
Síndrome paraneoplásica Tumor
Anemia Linfoma, leucemia, mieloma múltiplo, hemangiossarcoma, carcinoma intestinal, etc.
Trombocitopenia Linfoma, leucemia, mieloma múltiplo, hemangiossarcoma, etc.
Pancitopenia Linfoma, leucemia, tumor das células de Sertoli, tumor das células granulosas Eosinofilia Mastocitoma, linfoma, sarcomas, carcinoma da bexiga
CID Hemangiossarcoma, carcinoma inflamatório, carcinoma da tiróide, linfoma, leucemia, qualquer tumor avançado
Policitemia Carcinoma renal/ linfoma Leucocitose Linfoma, hemangiossarcoma (Legenda: CID- Coagulaçao Intravascular Disseminada)
Quadro 5: Tumores comuns e síndromes paraneoplásicas não hematológicas associadas. Adaptado de North e Banks (2009a).
Síndrome paraneoplásica Tumor
Hipercalcémia Linfoma, leucemia, mieloma múltiplo, carcinoma das células escamosas, adenocarcinoma dos sacos anais, doença histiocítica, carcinomas metastáticos Hipoglicémia Insulinoma, leiomiomas/sarcomas, carcinoma hepático, hemangiossarcoma
Febre Linfoma, leucemia, tumores sólidos, etc Caquexia Linfoma, leucemia, qualquer tumor avançado Hiperviscosidade Mieloma múltiplo, linfoma, leucemia
Neuromuscular Timoma, linfoma, insulinoma, carcinoma pancreático, carcinoma prostático, etc. Osteopatia hipertrófica Osteossarcoma, carcinoma metastático
Pele Mastocitoma, feocromocitoma, hemangiossarcoma, cistadenocarcinoma renal Hiperhistaminémia Mastocitoma
Renal Linfoma, mieloma múltiplo, adenocarcinoma dos sacos anais, qualquer tumor avançado
7. TÉCNICAS DE DIAGNÓSTICO
Perante a suspeita de linfoma, deve ser realizado um conjunto de exames básicos: hemograma, bioquímica sérica e análise de urina. Dependendo da apresentação clínica, há outros exames que devem ser feitos, tais como citologia aspirativa dos linfonodos (quando aumentados), radiografias torácicas e abdominais, ecografia e biópsia. Os métodos moleculares de diagnóstico têm muita utilidade quando utilizados depois dos métodos tradicionais e se estes não confirmam o diagnóstico (Dickinson, 2008; Couto, 2009b; North e Banks, 2009b).
11 7.1. Exame físico
Um exame físico completo deve incluir palpação cuidada dos linfonodos acessíveis, abrangendo os que são palpáveis através do toque retal. Devem ser avaliados a localização e o tamanho dos linfonodos afetados através de uma medição precisa. Estas medições mais tarde servirão de base para avaliar a evolução do tamanho dos linfonodos. As mucosas devem ser inspecionadas, com o intuito de procurar sinais de palidez, icterícia, petéquias e ulceração, uma vez que estes sinais podem indicar anemia ou trombocitopenia secundárias a mielonefrite ou doenças imunomediadas ou podem ser indício de falha de órgãos ou uremia. A palpação abdominal pode revelar organomegália, espessamento da parede intestinal ou linfadenomegália dos linfonodos mesentéricos. A auscultação torácica pode revelar a presença de uma massa mediastínica, efusão pleural ou ambos. Deve também ser feito um exame ocular que inclua avaliação do fundo do olho que pode revelar alterações como uveíte, hemorragia da retina e infiltração ocular (Vail, 2010; Marconato, 2011).
7.2. Hematologia, bioquímica sérica e análise de urina
O hemograma, a bioquímica sérica e a análise de urina devem ser efetuados em todos os animais com linfoma cujos proprietários estejam a considerar iniciar um tratamento pois, apesar de não serem diagnósticos, podem ajudar nesta decisão. A bioquímica sérica e o hemograma podem, no entanto, apresentar alterações muito inespecíficas (Couto, 2009b).
O hemograma tem muita utilidade em casos confirmados de linfoma, uma vez que ajuda a determinar o estadio da doença e estabelece uma base dos parâmetros hematológicos, com a qual é possível comparar resultados futuros e avaliar o grau de imunossupressão causada pelo tratamento. As alterações ao nível do hemograma resultam da infiltração da medula óssea e baço por células neoplásicas, cronicidade da doença ou alterações paraneoplásicas imunomediadas. As alterações hematológicas comuns em caso de linfoma são: anemia não regenerativa, leucocitose, neutrofilia (com ou sem desvio à esquerda), monocitose, trombocitopenia, citopenias isoladas ou combinadas e células linfóides anormais no esfregaço de sangue periférico, entre outras. A linfocitose é rara e quando presente, é de baixa magnitude (Morris e Dobson, 2001; Couto, 2009b).
As alterações bioquímicas encontradas em animais com linfoma normalmente refletem o local anatómico envolvido. Por esta razão, a avaliação bioquímica deve incluir BUN/creatinina, enzimas hepáticas (ALT e FA), eletrólitos e eletroforese de proteínas. Níveis aumentados de
12
ureia e creatinina podem ocorrer secundariamente à infiltração renal do tumor, nefrose hipercalcémica e desidratação. Da mesma forma, alterações nos parâmetros hepáticos sugerem que o fígado também estará afetado pelo tumor. Pelo facto de a hipercalcémia ser a síndrome paraneoplásica mais significativa no linfoma canino, quando há hipercalcémia de origem desconhecida, o linfoma deve estar no topo da lista de diagnósticos diferenciais. Os níveis de hipercalcémia são ainda úteis em casos já diagnosticados e em tratamento, para verificar a resposta à terapia. Nos linfomas de células B é frequente haver aumento das globulinas, normalmente monoclonal (Morris e Dobson, 2001;Vail, 2010).
A análise de urina é uma parte dos exames básicos que permite avaliar a função renal e o trato urinário, pelo que alterações a este nível indicam envolvimento do sistema urinário (Vail e Young, 2007).
7.3. Citologia aspirativa com agulha fina
A avaliação citológica de uma amostra obtida por aspiração com agulha fina é um método comum, útil e valioso para o diagnóstico de linfoma. A aspiração com agulha fina implica menos riscos e custos do que a biópsia cirúrgica, motivos pelos quais a antecede quase sempre na avaliação de massas ou órgãos suspeitos de estarem afetados. Muito frequentemente, um diagnóstico citológico definitivo permite a instauração rápida de um tratamento específico. A citologia aspirativa com agulha fina é normalmente diagnóstica em casos de linfoma extranodal, uma vez que os linfoblastos não estão, em casos normais, presentes nestes órgãos (Dickinson, 2008; Couto, 2009a; North e Banks, 2009b).
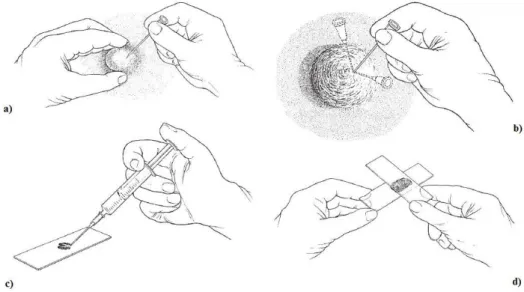
A aspiração com agulha fina consiste na obtenção de uma única amostra utilizando uma agulha de pequeno calibre (23 ou 25 Gauge) com o comprimento adequado ao órgão alvo ou massa. Esta agulha pode ser acoplada a uma seringa ou não (Figura 3). Se a seringa for utilizada, a sucção deve ser efetuada três ou quatro vezes. Se o tamanho da massa ou órgão o permitir, a seringa deve ser redirecionada duas ou três vezes. Antes de retirar a agulha, a sucção deve ser cessada, para que não haja aspiração de sangue na retirada da seringa e assim evitar a contaminação da amostra. A seringa é então separada da agulha e enchida de ar, para posteriormente se acoplar novamente à agulha e expelir a amostra para a lâmina. Quando está a ser usada apenas a agulha (Figura 3a), esta deve ser inserida quatro a seis vezes (Figura 3b), em diferentes direções. Posteriormente, uma seringa cheia de ar deve ser acoplada à agulha (Figura 3c) para assim expelir a amostra para a lâmina (Couto, 2009a).
13
Figura 3: Esquema representativo do método de realização de aspiração com agulha fina: a) fixar o linfonodo/massa com uma mão; b) inserir e redirecionar a agulha fina no linfonodo várias vezes; c) encher a seringa de ar e depois acoplá-la à agulha, expelindo o conteúdo da agulha para uma lâmina; d) realizar o esfregaço. Adaptado de Morris e Dobson (2001).
Um problema frequente que pode ocorrer pela aspiração com agulha fina de linfonodos, e que pode impedir o diagnóstico definitivo, é não se conseguir obter um número suficiente de células linfóides intactas. Isto pode ocorrer por não se atingir o tecido alvo ou por uma aspiração inadequada do linfonodo. Quando o número de células é suficiente, também pode ocorrer uma má preservação das mesmas. Isto pode suceder pelo exercício de uma pressão negativa excessiva aplicada na seringa na aspiração ou excesso de pressão quando se faz o esfregaço. As células linfóides, em particular as neoplásicas, são frágeis, podendo ruturar com facilidade. Para melhorar a proporção de células intactas, muitos clínicos adotam o método “livre de seringa” na aspiração dos linfonodos (Figura 3). Este método proporciona uma quantidade abundante de tecido e, ao só utilizar a seringa para forçar o ar através da agulha, para empurrar o seu conteúdo para a lâmina, as células sofrem um trauma mínimo (Dickinson, 2008; North e Banks, 2009b).
Para determinar rapidamente se a amostra é suficiente e de qualidade, muitos clínicos optam por fazer uma preparação seca ao ar e corada pelo método Diff-Quik® para uma visualização imediata, antes de enviar as lâminas a um médico veterinário patologista. Um esfregaço de boa qualidade terá uma grande quantidade de células intactas distribuídas em monocamada. Isto permitirá o reconhecimento, com clareza, da morfologia celular (Dickinson, 2008).
14
As células que se encontram em citologias de linfonodos normais (Figura 4) são predominantemente (75 a 90%) linfócitos maduros. Estas células têm aproximadamente 7 a 10 µm de diâmetro (1 a 1.5 vezes o diâmetro de um eritrócito) e têm cromatina densa e ausência de nucléolos. As células restantes são macrófagos, linfoblastos, células plasmáticas e outras células imunitárias (Couto, 2009a).
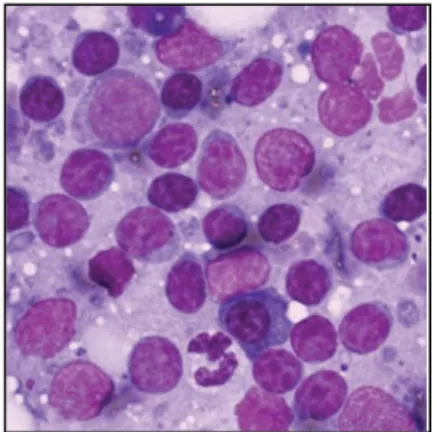
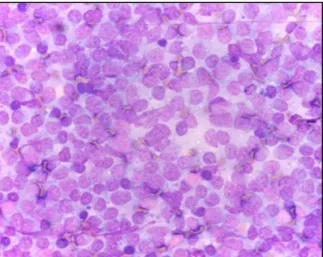
As células neoplásicas têm uma ou mais características das apresentadas no quadro 6. Numa citologia de um linfonodo aumentado de um animal com linfoma é possível encontrar, entre outras, as seguintes alterações: populações celulares com uma morfologia uniforme e semelhante; mais de 50% dos linfócitos encontram-se na forma imatura (as células linfóides neoplásicas são duas ou três vezes maiores do que as células linfóides normais maduras); volume citoplasmático variável, mas rácios núcleo:citoplasma elevados; figuras mitóticas presentes de forma frequente; e presença de vacúolos e nucléolos evidentes (Figura 5). Os linfomas de células pequenas são difíceis de identificar através de citologia (Argyle e Milne, 2008; Dickinson, 2008; Couto, 2009a; Whitney e Berent, 2010).
Figura 4: Imagem citológica de aspirado de linfonodo normal com predomínio de linfócitos maduros. Adaptado de Rakich e Latimer (2011).
Figura 5: Imagem citológica de um aspirado de um linfonodo de um cão com linfoma. Adaptado de
15
Quadro 6: Características citológicas das células neoplásicas. Adaptado de Couto (2009a)
Características citológicas das células neoplásicas
Núcleo grande Anisocitose
Padrão fino de cromatina Vacúolos citoplasmáticos Um ou mais nucléolos Basofilia citoplasmática
Anisocariose Células gigantes multinucleadas
Núcleo moldável Fagocitose
Monomorfismo Heterotopia
Pleomorfismo
7.4. Biópsia
A biópsia assume um papel importante no diagnóstico do linfoma quando as citologias são inconclusivas e tem a vantagem de proporcionar informações sobre as características estruturais do tecido afetado (Dickinson, 2008).
O tipo de biópsia varia com a natureza do tecido afetado: se forem os linfonodos, o indicado é a extirpação completa, para que se possa aceder a toda a estrutura do linfonodo e ver a delimitação do tecido neoplásico; se forem órgãos internos, as biópsias cirúrgicas são uma boa escolha, se essa opção for viável para o animal; no caso do fígado ou rins, a biópsia cirúrgica tem a vantagem de proporcionar uma visualização direta da lesão e permite que uma maior amostra seja obtida; relativamente ao baço, a obtenção de amostras representativas pode ser um desafio, motivo pelo qual frequentemente se opta pela explenectomia e envio de todo o órgão para avaliação histológica, o que aumenta as possibilidades de obter uma amostra representativa da lesão; a biópsia da medula óssea é feita por aspiração com agulha fina e deve ser realizada quando os resultados da hematologia revelam citopenias inexplicáveis ou células anormais em circulação. Se a biópsia cirúrgica não é uma escolha, uma biópsia ecoguiada pode ser uma boa opção para atingir o órgão/zona suspeita de estar afetada (Dickinson, 2008; Turek et al., 2008).
7.5. Imagiologia
A radiografia é necessária para auxiliar no diagnóstico em determinados tipos anatómicos de linfoma, como o mediastínico, renal, espinal e alimentar. A avaliação radiográfica torácica e abdominal tem uma importância vital para determinar o envolvimento de linfonodos ou órgãos e no estadiamento da forma multicêntrica. Esta técnica de diagnóstico deve fazer parte do banco de dados mínimo a ser feito, com três radiografias torácicas nas projeções ventro-dorsal e latero-laterais direita e esquerda (Morris e Dobson, 2001; Turek et al., 2008).
16
As alterações radiográficas observáveis em animais com linfoma variam nas diferentes formas anatómicas mas, em geral, são secundárias a linfadenomegália ou organomegália. A infiltração de outros órgãos pode levar a alterações radiográficas adicionais (Couto, 2009b).
Aproximadamente 60 a 75% dos cães com linfoma multicêntrico apresentam alterações nas radiografias torácicas (um terço tem evidência de infiltração pulmonar; e dois terços têm linfadenomegália torácica e aumento do mediastino cranial). Os animais com linfoma multicêntrico podem ter como alterações: linfadenomegália esternal e/ou traqueobronquiolar; infiltrado pulmonar intersticial, broncoalveolar ou misto; efusão pleural (rara); linfadenomegália intra abdominal (linfonodos mesentéricos ou ilíacos); hepatomegália; esplenomegália; nefromegália; ou massas intra abdominais. Na prática clínica, em casos típicos de linfoma multicêntrico canino, o recurso à imagiologia limita-se frequentemente às radiografias torácicas, porque não existe diferença prognóstica entre cães nos estadios III (linfadenomegália generalizada) e IV (envolvimento do fígado e/ou do baço com ou sem estadio III) (Quadro 7). Contudo, a presença de linfadenomegália no mediastino cranial é prognosticamente significativa (Vail e Young, 2007; Couto, 2009b).
Radiograficamente, o linfoma mediastínico caracteriza-se, geralmente, por uma massa no mediastino anterior com ou sem efusão pleural. O linfoma alimentar só em menos de 50% dos casos apresenta alterações a nível das radiografias abdominais, que são, na maioria das vezes hepatomegália, esplenomegália e massas abdominais. Contudo, as radiografias de contraste positivo do trato gastrointestinal superior detetam alterações na maior parte dos animais com linfoma da forma alimentar (Couto, 2009b).
Para além da radiografia, outra técnica imagiológica valiosa em termos de diagnóstico é a ecografia. O seu interesse é maior em animais com suspeita de linfoma intra abdominal, sendo também importante na avaliação de massas mediastínicas e estruturas linfóides e órgãos aumentados. Relativamente ao estadiamento, a ecografia também se pode revelar útil, uma vez que alterações encontradas na ecogenicidade do parênquima dos órgãos geralmente refletem mudanças na textura do órgão secundárias a infiltrações metastáticas. A aspiração com agulha fina e a biópsia do tipo Tru-cut podem ser realizadas com o recurso à ecografia (biópsia eco-guiada) (Couto, 2009b).
A tomografia computorizada, a tomografia computorizada com emissão de positrões e a ressonância magnética são técnicas de imagiologia mais avançadas que têm uma utilização crescente em medicina veterinária no linfoma canino (Vail e Young, 2007).
17 7.6. PCR
Os métodos moleculares de diagnóstico, como o PCR, têm vantagens, como a objetividade e as altas sensibilidade e especificidade que ainda não são de 100%, porque os
primers de PCR utilizados não detetam alguns genes recetores de determinados tumores.
Contudo, com o desenvolver do método, níveis mais elevados de sensibilidade e especificidade podem ser atingidos. Esta técnica tem a desvantagem de ter elevados custos (Dickinson, 2008; Gelain et al., 2008; Avery, 2009; Couto, 2009b).
Apesar das vantagens, o PCR não substitui os meios de diagnóstico tradicionais e menos dispendiosos e não pretende posicionar-se entre as técnicas de diagnóstico de primeira linha sendo, na maioria das vezes, desnecessário. Esta técnica de diagnóstico surge com uma importância elevada nos casos ambíguos em que os métodos convencionais não são capazes de dar uma resposta quanto ao diagnóstico (Dickinson, 2008; Avery, 2009).
Os testes baseados na técnica PCR envolvem primeiramente a amplificação de DNA ou RNA. Os produtos do PCR são depois separados por tamanho e, em alguns casos, por sequência, com recurso a vários métodos. A presença de um produto de PCR de tamanho único é indicativa de clonalidade, enquanto a presença de produtos de PCR de tamanhos diferentes indica um processo reativo (Avery, 2009).
Em medicina veterinária, o teste de clonalidade que se baseia no PCR é chamado de PCR
for antigen receptor rearrangements (PARR) e, na prática, é mais comummente utilizado para a
distinção entre populações de linfócitos reativos (policlonais) relativamente a populações de linfócitos neoplásicos (monoclonais), o que permite diferenciar doença linfoproliferativa reativa de doença linfoproliferativa neoplásica (ex. linfoma). É assim evidente o auxílio que pode prestar no diagnóstico. A única doença não neoplásica que, em cães, pode causar expansão monoclonal de linfócitos é a erhlichiose (Ehrlichia canis), que aparentemente, é sempre de células T (Avery, 2009; Couto, 2009b; Thilakaratne et al., 2010).
Os resultados do PCR podem também estabelecer prognósticos, isto porque permitem saber se a população celular em estudo tem na sua origem células B ou células T e os linfomas com origem nas células T têm um pior prognóstico. Apesar do PARR poder dar informações quanto à linhagem celular a partir da qual se desenvolveram as células neoplásicas, se o diagnóstico de linfoma não for ambíguo, a CF, a imunocitoquímica e a imunohistoquímica são testes melhores para determinar o imunofenotipo porque podem dar muito mais informações (Ponce et al., 2004; Wilkerson et al., 2005; Gelain et al., 2008; Avery, 2009; Couto, 2009b; Rebhun et al., 2010; Thilakaratne et al., 2010).
18
A análise de clonalidade através do PCR tem a vantagem de poder ser levada a cabo com amostras relativamente pequenas obtidas por aspiração com agulha fina e recolha de sangue periférico (métodos pouco invasivos) ou biópsia (Avery, 2009; Couto, 2009b; Thilakaratne et al., 2010).
Quanto ao estadiamento, o PCR não tem utilidade. Contudo, os seus resultados podem determinar relações entre tumores que surgem em tempos diferentes no mesmo animal e detetar mutações. Esta técnica permite ainda estimar o número de células linfóides neoplásicas presentes entre as células da medula óssea a ser infundidas nos transplantes autólogos de medula óssea (Yamazaki et al., 2008; Avery, 2009).
A doença residual mínima (DRM) é definida como as células neoplásicas residuais que resistem às terapias anti-cancerígenas e que são consideradas a origem da recidiva do tumor. Uma grande parte dos cães alcança a remissão clínica com um tratamento inicial de quimioterapia, contudo, a maior parte deles morre em consequência da recidiva. O exame físico (tamanho normal dos linfonodos e ausência de organomegália) não é suficiente para determinar com precisão a presença de remissão. Assim o PCR pode ser usado para detetar a DRM e, desta forma, monitorizar a resposta à terapia, a remissão ou detetar antecipadamente recidivas, uma vez que o exame microscópico é frequentemente incapaz de reconhecer uma população neoplásica residual sempre que esta seja < 1% do total de células. Esta deteção precoce de recidivas poderá possibilitar o início de um protocolo de resgate, ainda antes de uma linfadenomegália (Yamazaki et al., 2008; Avery, 2009; Thilakaratne et al., 2010; Sato et al., 2011b).
7.7. Citometria de fluxo
A citometria de fluxo é um método valioso que usa a imunofenotipagem para identificar as combinações de marcadores de superfície celular em dezenas de milhares de células num meio fluído para obter informações acerca da população celular (Dickinson, 2008).
A diferenciação entre linhagens de células neoplásicas e células não neoplásicas pode ser feita pela expressão de moléculas CD utilizando um amplo painel de marcadores e as propriedades de dispersão de luz das células analisadas pela CF (Wilkerson et al., 2005). A deteção da expressão aumentada ou diminuída de antigénios comuns das células linfóides pode ser útil para confirmar a clonalidade e para distinguir a expansão linfocítica neoplásica da não-neoplásica (Comazzi et al., 2006).
19
A avaliação de uma amostra utilizando a CF permite a imunofenotipagem da população celular. A avaliação da linhagem celular (T, B ou NK) é importante na classificação do linfoma, uma vez que pode ser preditiva do prognóstico e da resposta ao tratamento. A classificação é baseada na deteção de células T (CD3, CD5, CD4 ou CD8) e células B (CD79a, CD20, CD21, IgM ou IgG) (Couto, 2009b; Comazzi e Gelain, 2011).
As vantagens deste método incluem permitir simultaneamente a avaliação de um grande número de células e o registo de vários parâmetros para células individuais como o tamanho, complexidade e características imunofluorescentes. Em comparação com outros métodos de imunofenotipagem, a CF é fácil de realizar e rápida na obtenção de resultados (Comazzi e Gelain, 2011).
Esta técnica tem como desvantagem o facto de os equipamentos terem um elevado custo, o que não permite a sua disponibilidade na maior parte das clínicas. Outra limitação é que, mesmo com ótimos procedimentos de recolha de amostras, as amostras de baço, fígado e pele podem ser difíceis de processar, devido à baixa celularidade ou à rutura das células aquando da manipulação (Comazzi e Gelain, 2011).
O uso da CF em medicina veterinária tem um valor limitado na definição dos diferentes estadios e subestadios de maturação devido à ausência de anticorpos específicos para este efeito. Contudo, alguns antigénios são expressos em diferentes intensidades em diferentes células linfóides, assim, a avaliação quantitativa da expressão dos antigénios pode ser útil para determinar a maturação celular. Em alguns linfomas caninos são detetadas expressões anormais dos antigénios, o que significa que a identificação precisa dos antigénios CD nos linfócitos malignos poderá vir a ser de grande importância na previsão do curso da doença e, consequentemente, na terapia que deve ser adotada (Gelain et al., 2008).
O estudo de Gelain et al. (2008) tenta perceber o valor da citometria relativamente à citologia convencional, e revela que a CF pode ser útil para a confirmação do diagnóstico de linfoma, uma vez que permite adicionar informações úteis sobre a morfologia das células neoplásicas e identificar marcadores antigénicos e fenótipos anormais. Contudo, não dispensa a citologia, pois em adição ao exame citológico, melhora a classificação do linfoma. Isto pode ser vantajoso para melhor prever o comportamento biológico da neoplasia, uma vez que alguns subtipos de linfoma são usualmente associados a um pior prognóstico, e para definir com mais sensibilidade o estadio e DRM (Ponce et al., 2004).
20 7.8. Outras técnicas de diagnóstico
Em animais com suspeita de linfoma no SNC, é aconselhável a realização de análise do fluido cérebroespinal e técnicas imagiológicas avançadas, como ressonância magnética e tomografia computorizada. A descoberta de um alto número de células linfóides neoplásicas e um aumento da concentração das proteínas numa amostra de fluido cérebroespinal é diagnóstico de linfoma. Pela má acessibilidade, o diagnóstico de massas extradurais usualmente requer a colheita cirúrgica de amostras para citologia e histopatologia (Couto, 2009b).
Quando o linfoma do trato intestinal é a hipótese mais provável, é indicada a realização de uma biópsia com recurso a endoscópio ou laparotomia e biópsia de espessura total. Para diagnosticar linfoma cutâneo, pode ser realizada citologia com material obtido por aposição da lâmina diretamente na lesão, aspiração com agulha fina ou biópsia com punch (Turek et al., 2008).
8. ESTADIAMENTO
Uma vez estabelecido o diagnóstico de linfoma, deve ser determinada a extensão da doença. Para tal é importante que seja feito: aspiração com agulha fina ou biópsia de medula óssea; radiografias torácicas e abdominais, para determinar o envolvimento interno da doença; e ecografia por si só ou para guiar procedimentos como biópsia e aspiração com agulha fina, que pode ser útil para avaliar o envolvimento do fígado, baço ou linfonodos mesentéricos. Um sistema de classificação concebido pela OMS (Quadro 7), baseado no linfoma multicêntrico, tem sido usado nos últimos vinte anos para o estadiamento de linfoma em cães e gatos, encontrando-se a maior parte dos cães (> 80%) nos estádios III-IV. O estadiamento também pode influenciar decisões no que toca ao tratamento. Contudo, se o proprietário pretende seguir para o tratamento, independentemente do estadio ou prognóstico, alguns destes testes diagnósticos não são necessários, sendo a terapia iniciada depois de confirmado o diagnóstico (Couto, 2009b; North e Banks, 2009b; Vail, 2011).
21
Quadro 7: Estadiamento clínico do linfossarcoma canino pela OMS. Adaptado de Thilakaratne et al. (2010).
Estadio Características
I Um único linfonodo afetado ou tecido linfóide num único órgão (excluindo a medula óssea). II Mais de um linfonodo afetado na mesma área regional.
III Linfadenomegália generalizada.
IV Envolvimento do fígado e/ou do baço com ou sem estadio III.
V Manifestações sanguíneas e envolvimento da medula óssea e/ou extranodal (com ou sem estadios I-IV).
Sub-estadios a. Qualquer estadio sem sinais clínicos sistémicos. b. Qualquer estadio com sinais clínicos sistémicos.
9. DIAGNÓSTICOS DIFERENCIAIS
Os diagnósticos diferenciais de linfoma (Quadro 8) variam de acordo com a forma anatómica da doença (Vail, 2010).
Quadro 8: Diagnósticos diferenciais de linfoma. Adaptado de Vail e Young (2007).
Tipo de linfoma Diagnósticos diferenciais
Linfoma Multicêntrico
Infeções disseminadas (ex. bacterianas, víricas, parasitárias, fúngicas, rickettsiose, leishmaniose).
Doenças imunomediadas (ex. dermatopatias, vasculites, poliartrites, lupus). Tumores metastizados nos linfonodos.
Outros tumores hematopoiéticos (ex. leucemia, mieloma múltiplo, histiocitose maligna ou sistémica).
Linfoma Mediastínico
Outros tumores (ex. timoma, quemodectoma, carcinoma da tiróide ectópica, carcinomatose pleural, granulomatose linfomatóide pulmonar).
Doenças infeciosas (ex. doença granulomatosa, piotórax). Outros: insuficiência cardíaca congestiva, quilotórax, hemotórax. Linfoma
Alimentar
Outros tumores gastrointestinais, corpos estranhos, linfangiectasia, enterite linfocítica plasmocítica, micose sistémica, ulceração gastrointestinal.
Linfoma Cutâneo
Dermatites infeciosas (ex. pioderma avançado). Dermatites imunomediadas (ex. pênfigos). Outras neoplasias cutâneas.
Linfoma
Extranodal Dependentes do órgão/sistema afetado.
10. TRATAMENTO
O linfoma é uma doença maioritariamente sistémica que, por isso, requer um tratamento sistémico, como a quimioterapia anti-neoplásica. Contudo há exceções, tais como linfoma solitário nodal ou solitário extranodal, em que o tratamento local, como radioterapia ou cirurgia, é mais indicado. Nestes casos, dado a possibilidade de disseminação da doença, a quimioterapia pode ser indicada como complemento ao tratamento local (Vail, 2011).