FACULDADE
DE
CIÊNCIAS
E
TECNOLOGIA
Grupo
de
Disciplinas
de
Ecologia
da
Hidrosfera
De t e rm ina ç ã o da susc e pt ibilida de de
biofilm e s de
List e ria m onoc yt oge ne s
a
a ge nt e s sa nific a nt e s
António
Clara
Abreu
Afonso
Lourenço
Dissertação apresentada na Faculdade de Ciências e Tecnologia da Universidade Nova de Lisboa para obtenção do grau de Mestre em Tecnologia Alimentar
Orientadora: Professora Doutora Maria Luisa Lopes de Castro e Brito
Co‐Orientador: Professor Doutor José Paulo Sampaio
A realização deste trabalho contou com o contributo de diversas pessoas a quem expresso o meu sincero agradecimento.
À Professora Luisa Brito, por ser minha orientadora. Pelo apoio, amizade e incentivo desde sempre.
Ao Professor José Paulo Sampaio por ter aceite ser meu co-orientador
Ao Professor Santos Oliveira pelas preciosas sujestões que deu para o meu trabalho, nomeadamente sobre a análise do comportamento dos isolados a baixas temperaturas.
Ao Eng. João Madanelo por ter facultado os agentes desinfectantes e por conversas esclarecedoras sobre rotinas de higienização em queijarias tradicionais.
À Ana Carla Silva pelos conhecimentos que me transmitiu durante todo o trabalho laboratorial.
À Sofia Barracas pela colaboração na primeira abordagem aos ensaios em biofilmes.
À Elsa Neves por me ter ensinado a metodologia de PFGE e pela tipagem e alguns isolados.
Ao André Barata e Marta Neto pelos conhecimentos transmitidos e boa vizinhança de bancada.
À D.ª Helena Nunes e D.ª Manuela Rodrigues pela ajuda essencial que prestaram na preparação de material.
À Isabel e todos os estagiários do laboratório de microbiologia do ISA, em especial à “Ruti” (Rute Coutinho) e à “Catrina” (Catarina Fonseca), pela boa disposição e bom ambiente de trabalho.
À Professora Ana Luisa Fernando pela disponibilidade no esclarecimento de todas as questões relacionadas com o mestrado
Às minhas colegas e ao meu colega de mestrado.
À minha família.
A capacidade de formação de biofilmes por Listeria monocytogenes foi avaliada, em 29 isolados
caracterizados molecularmente (multiplex PCR e PFGE), com base no método do cristal violeta e no
método das placas MBEC™. Os resultados sugerem a ausência de relação entre o grupo filogenético
dos isolados, a sua origem, ou pulsotipo e a respectiva capacidade de formação de biofilme.
Em biofilmes mistos com Pseudomonas aeruginosa, produzidos a partir de inóculos com igual
concentração das duas espécies, a população final de L. monocytogenes representou 0,1% do valor
total de células viáveis no biofilme. A determinação dos valores de concentração mínima de
erradicação do biofilme (CMEB) de quatro agentes desinfectantes industriais (dois clorados, um acetato
de alquilamina e um ácido fosfórico) foi efectuada para biofilmes produzidos a 37 ºC e a 12 ºC,
tendo-se verificado uma menor susceptibilidade dos biofilmes produzidos a 12 ºC, particularmente os mistos.
Ao contrário do anteriormente verificado com células planctónicas, o agente clorado T66 foi o mais
eficaz na remoção de biofilmes de L. monocytogenes, quer em monocultura, quer em co-cultura com P.
aeruginosa.
Estes resultados confirmam a ideia de que o estado séssil do microrganismo contaminante deverá ser
considerado em estudos de susceptibilidade a agentes sanificantes.
The biofilm forming ability of Listeria monocytogenes was evaluated on 29 isolates, previously
characterized by multiplex PCR and PFGE, using a crystal violet based method and the MBEC™ plate
method. The obtained results suggest that there is no relation between the philogenetic group of the
isolates, their origin, their pulsotype nor their ability to form biofilm.
Mixed culture biofilms of L. monocytogenes and Pseudomonas aeruginosa, grown from inocula with
equal concentration of both species, had a final population of L. monocytogenes that represented 0,1 %
of the total viable counts. The Minimum biofilme eradication concentration (MBEC) of four industrial
disinfectants (two chlorine based, one alkyl amine acetate and one phosforic acid) was determined on
biofilms produced at 37 ºC and 12 ºC. The biofilms produced at 12 ºC were less susceptible, especially
for mixed culture biofilms.
On opposite to previous findings on planktonic cells, the chorine based agent T66 was the most
effective for the eradication of biofilms of L. monocytogenes either in pure culture or in mixed culture
with P. aeruginosa.
These results confirm the idea that the biofilm state of the contaminants should be considered in the
evaluation of theirs susceptibility to sanitizer agents.
ATCC – American Type Culture Collection
BP – Agente desinfectante Basotop (Henkel Ecolab)
CBISA – Colecção de Bactérias do Instituto Superior de Agronomia
CECT – Collección Española de Cultivos Tipo;
CIP – Collection de l’ Institut Pasteur
CMB – Concentração Mínima Bactericida
CMEB – Concentração Mínima de Erradicação de Biofilmes
CMI – Concentração Mínima Inibitória
DD – Agente desinfectante Basochlor DD (Langlois)
IBB –Institute for Biotechnology and Bioengineering (Instituto superior Técnico)
MBEC™ – MBEC™ Physiology and Genetics (P&G) assay – For Minimum Biofilm eradication Concentration assay using the Calgary Biofilm device
PCR – Polimerase Chain Reaction - Reacção em cadeia da polimerase
PEC – Polímeros Extra Celulares
PFGE – Pulsed Field Gel Electrophoresis - electroforese em campo pulsado
T66 – Agente desinfectante Topax 66 (Henkel Ecolab)
T99 – Agente desinfectante Topax 99 (Henkel Ecolab)
Td – Tempo de Duplicação
UFC – Unidade Formadora de Colónias
UPGMA – Unweighted-Pair Group Matching Algorithm
1 Introdução ...9
1.1 Caracterização do microrganismo Listeria monocytogenes ... 9
1.2 Listeriose ... 11
1.3 Definição de biofilme ... 13
1.4 Factores que influenciam a formação de biofilme ... 15
1.4.1 Tipo de microrganismo ... 15
1.4.2 Características do fluido ... 16
1.4.3 Tipo de material da superfície e o seu estado de conservação ... 18
1.5 Etapas da formação de biofilmes ... 19
1.6 Detergentes e desinfectantes ... 20
1.7 Resistência e resposta a compostos antimicrobianos ... 21
1.8 Estudo dos biofilmes ... 23
1.9 Enquadramento e objectivos do trabalho ... 26
2 Materiais e métodos ... 27
2.1 Estirpesutilizadas ... 27
2.2 Agentes desinfectantes... 28
2.3 Meios de Cultura ... 29
2.3.1 Meios Líquidos ... 29
2.3.2 Meios Sólidos ... 29
2.4 Soluções ... 31
2.4.1 Soluções para Multiplex Polimerase Chain Reaction -MPCR ... 31
2.4.2 Soluções para electroforese em campo pulsado -Pulsed Field Gel Electrophoresis (PFGE) ... 32
2.4.3 Soluções para ensaios pelo método das placas MBEC™ ... 34
2.5 Condições de crescimento ... 34
2.5.1 Em meio sólido ... 34
2.5.2 Em meio líquido ... 34
2.6 Ensaios Prévios ... 35
2.6.1 Confirmação dos isolados ... 35
2.6.2 Serotipagem molecular: Multiplex Polimerase Chain Reaction -MPCR ... 35
2.6.3 Electroforese em campo pulsado do DNA das estirpes - Pulsed Field Gel Electrophoresis (PFGE) ... 37
2.6.6 Optimização das condições de crescimento e recuperação de biofilmes ... 42
2.7 Formação de biofilme e resposta aos agentes desinfectantes ... 43
2.7.1 Método do cristal violeta ... 43
2.7.2 Avaliação da capacidade de formação de biofilmes e de resposta aos desinfectantes pelo método das placas MBEC™ ... 45
2.8 Interpretação e análise dos resultados ... 50
2.8.1 PFGE ... 50
2.8.2 Avaliação da capacidade de formação de biofilmes e determinação da CMEB ... 50
3 Resultados e discussão ... 52
3.1 Ensaios preliminares ... 52
3.1.1 Confirmação dos isolados ... 52
3.1.2 Serotipagem molecular (MPCR) ... 52
3.1.3 PFGE do DNA dos isolados ... 54
3.1.4 Características cinéticas dos isolados ... 56
3.1.5 Obtenção de inóculos de concentração padronizada ... 59
3.1.6 Optimização das condições de crescimento e recuperação dos biofilmes ... 60
3.2 Formação de biofilme e resposta aos agentes desinfectantes ... 61
3.2.1 Capacidade de formação de biofilme pelo método do cristal violeta ... 61
3.2.2 Avaliação da capacidade de formação de biofilmes e de resposta aos desinfectantes pelo método das placas MBEC™ ... 63
4 Conclusões ... 71
5 Bibliografia ... 73
6 Cibergrafia ... 79
Anexo I ... 80
Anexo II ... 81
Fig. 1.1 - Processo de formação do biofilme ... 20
Fig. 1.2 - Dispositivos utilizados no estudo de biofilmes. ... 23
Fig. 1.3 - Representação esquemática e fotográfica das placas “MBEC™ ... 24
Fig. 2.1 - Microplate reader model 680, Bio Rad ... 41
Fig. 2.2 - Spectronic 21 ... 41
Fig. 2.3 - Espectro de absorção do cristal violeta e respectiva estrutura química ... 43
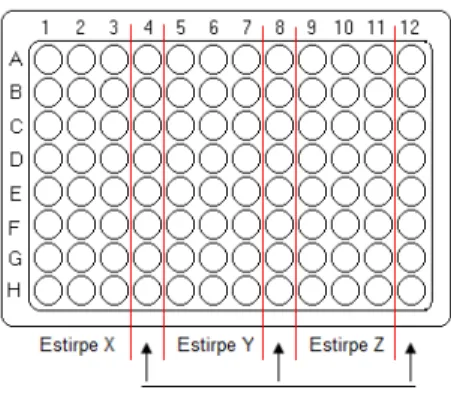
Fig. 2.4 - Disposição dos isolados nas microplacas utilizadas para a avaliação da capacidade de formação de biofilme pelo método do cristal violeta. ... 44
Fig. 2.5 - Placa de crescimento do biofilme ... 45
Fig. 2.6 - Placa de teste ... 46
Fig. 2.7 - Esquema geral do ensaio para a quantificação do biofilme formado e avaliação da CMEB ... 49
Fig. 3.1 - Placa de meio agar de sangue de cavalo (A) e de meio de cultura CHROMagar™ Listeria (B). ... 52
Fig. 3.2 - Electroforese em gel de agarose de fragmentos de DNA obtidos por multiplex PCR. ... 53
Fig. 3.3 - Dendrograma utilizando o coeficiente de Dice e o método de aglomeração baseado na distância média não ponderada (UPGMA) para 26 isolados de L. monocytogenes, com diferentes origens, e para três estirpes de referência, com base nos perfis de macrorestrição obtidos com as enzimas ApaI e AscI, respectivamente ... 55
Fig. 3.4 – Curvas de crescimento em microplaca (200 µl em TSB) para as estirpes de L. monocytogenes CBISA 3107, 3845, 3849, 3880 e P. aeruginosa PAO1. ... 56
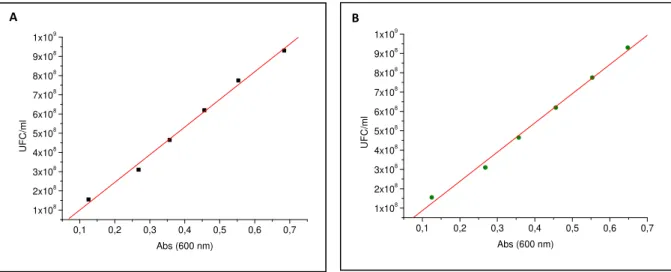
Fig. 3.5 - Rectas de calibração para L. monocytogenes 3001 (A) e P. aeruginosa PAO1 (B) em meio de cultura TSB. ... 59
Fig. 3.6 – Valores médios dos logaritmos do número de UFCs por peg correspondentes a biofilmes de três culturas puras de L. monocytogenes após sete tempos de sonicaçãodos pegs: 30 segundos, 1, 2, 4, 5, 6, 10 e 15 minutos ... 61
Fig. 3.7 - Formação de biofilme em microplacas: método do cristal violeta após 24 horas de incubação. ... 62
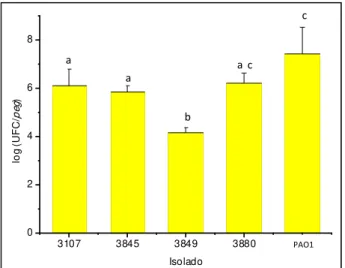
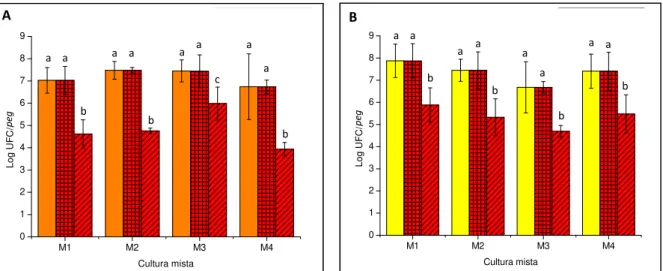
Fig. 3.8 - Valores médios dos logaritmos do número de UFCs por peg, em meio TSA-YE, correspondentes a biofilmes de culturas puras de L. monocytogenes e de P. aeruginosa, formados a 37 ºC durante 24 horas. ... 63
Fig. 3.9 - Valores médios dos logaritmos do número de UFCs por peg, correspondentes a biofilmes de culturas puras de L. monocytogenes e de P. aeruginosa, formados a 12 ºC durante 7 dias. ... 65
Quadro 1.1 – Identificação fenotípica do género Listeria ... 9
Quadro 2.1 - Estirpes bacterianas utilizadas ... 27
Quadro 2.2 – Caracterização dos agentes desinfectantes utilizados ... 28
Quadro 2.3 – Sequência dos primers utilizados ... 35
Quadro 2.4 - Composição da mistura de reacção ... 36
Quadro 2.5 – Descrição do programa utilizado no termociclador ... 36
Quadro 2.6 – Condições de utilização dos agentes testados ... 47
Quadro 3.1 - Serogrupos obtidos por multiplex PCR para os diferentes isolados testados ... 53
Quadro 3.2 – Regressão linear dos pontos da curva de crescimento em fase exponencial. ... 58
Quadro 3.3 – Taxa específica de crescimento e tempo de duplicação dos isolados ... 58
Quadro 3.4 - Equação das rectas de calibração obtidas (Fig. 4.5) para CBISA 3001 e CBISA 4076... 59
1 Introdução
1.1 Caracterização do microrganismo Listeria monocytogenes
Listeria monocytogenes foi descrita em 1926, por Murray, Webb e Swan como Bacterium
monocytogenes, o agente causal da leucocitose mononuclear em coelhos. É um microrganismo ubíquo
no ambiente, tendo sido isolado de água doce e de água salgada, de solos, de esgotos, de material
vegetal em decomposição, de silagens, de fezes de animais e de humanos (Farber e Peterkin, 1991). O
material vegetal em decomposição é considerado como o habitat natural destas bactérias
(Vásquez-Boland et al., 2001).
Esta espécie pertence ao Reino Bacteria; Filo Firmicutes; classe Bacilli; Ordem Bacillales; Família
Listeriaceae; Género Listeria. Este género é caracterizado por bastonetos não esporulados com 0,4 μm
de diâmetro e 1 a 1,5 μm de comprimento, Gram + com baixo conteúdo G+C (38%) no seu genoma.
Actualmente, fazem parte do género Listeria seis espécies: Listeria monocytogenes, Listeria ivanovii,
Listeria innocua, Listeria seeligeri, Listeria welshimeri e Listeria grayi. As principais características
destas espécies são apresentadas no Quadro 1.1.
Quadro 1.1 – Identificação fenotípica do género Listeria (adaptado de Gasanov et al., 2005)
Característica L.
monocytogenes
L. innocua
L. ivanovii
L. seeligeri
L. welshimeri
L. grayi
Hemólise + - + + - -
Catalase + + + + + +
Oxidase - - - - - -
Fe
rmen
tação
de
: L- Ramnose + +/- - - +/- +/-
Manitol - - - - - +
D-Xilose - - + + + -
α- Metil-Manose + + - - + +
Patogenicidade em murganhos + - + - - -
Em agar nutritivo (24 - 48 horas), as colónias do género Listeria apresentam 0,5 a 1,5 mm de diâmetro
e uma cor azul acinzentada, quando observadas com luz directa, e reflexos azul esverdeados, quando
observadas com luz oblíqua (Seeliger e Jones, 1986).
L. monocytogenes é um patogénio psicrotrófico com a capacidade de crescer numa vasta gama de
temperaturas, de 1 a 45 ºC. A sua temperatura óptima de crescimento situa-se entre 30 e 37 ºC
flagelos peritriquiais (Seeliger e Jones, 1986). L. monocytogenes é um microrganismo anaeróbio
facultativo. Para valores de pH inferiores a 4,3 usando o HCl como acidificante, o crescimento de L.
monocytogenes é inibido. Verifica-se crescimento em meios com uma concentração salina (NaCl) de
10% (m/v), podendo sobreviver em meio com 16% (m/v) de NaCl e pH 6, durante um ano (Adams e
Moss, 2000). As metodologias moleculares e a serotipagem têm sido usadas em estudos
epidemiológicos como uma técnica universal para a caracterização de L. monocytogenes. Os 13
diferentes serótipos de L. monocytogenes (1/2a, 1/2b, 1/2c, 3a, 3b, 3c, 4a, 4ab, 4b, 4c, 4d, 4e e 7)
estão divididos em três linhagens I, II e III. Os serótipos 1/2a, 3a, 1/2c e 3c pertencem à linhagem I os
serótipos 1/2b 3b 7 4b 4d 4e pertencem à linhagem II enquanto o 4a e 4c pertencem à linhagem III
(Doumith, et al., 2004a).
Os serótipos 3a, 3b, 3c,4a, 4ab, 4c, 4e, 4d, e 7 são pouco frequentes em alimentos e raramente
implicados em casos de listeriose (Doumith, et al., 2004a). Os serótipos 1/2a, 1/2b e 4b são os mais
identificados em alimentos e casos de listeriose, sendo que se verifica alguma variabilidade na
predominância destes.
Grenwood et al. (1991) verificou uma prevalência dos serótipos 1/2 (58%) enquanto o serótipo 4b
apresentou uma prevalência de 33%. Gilbreth, et al. (2005) em alimentos prontos a comer detectou a
presença do serovar 1/2a em aproximadamente 60% dos isolados e do serovar 1/2b em
aproximadamente 26,5% dos isolados. No entanto Leite et al. (2006) verificou a prevalência do serovar
4b em 69,1% dos isolados de queijo ou de queijaria enquanto o serovar 1/2a 1,1%, o serovar 1/2b 17%
e o serovar 1/2c em 12,8%. Também Chambela et al. (2007) por análise de 213 isolados do género
Listeria recolhidos em queijarias verificou a prevalência do serovar 4b em 52% dos isolados e dos
serovares 1/2 ou dos serovares raros em 24 % dos isolados.
As características patogénicas desta bactéria, tornam este microrganismo particularmente preocupante
para a indústria alimentar. A compreensão dos factores relevantes para a capacidade de sobrevivência
deste microrganismo, não só nos alimentos mas também no ambiente industrial, nos equipamentos e
linhas de processamento, torna-se essencial para o controlo eficaz desta bactéria.
A vasta gama de condições em que L. monocytogenes é capaz de sobreviver, bem como a capacidade
deste microrganismo de formar biofilmes à superfície de equipamentos e utensílios pode possibilitar a
ocorrência de isolados persistentes conduzindo a contaminações recorrentes em qualquer etapa do
processo alimentar. De acordo com Lou e Yousef (1997), as células expostas a condições de stress
podem tornar-se mais resistentes em condições adicionais de stress. A escolha da natureza,
concentração de uso e modo de aplicação dos agentes sanificantes deve ter em conta a capacidade de
L. monocytogenes para aderir a superfícies na forma de biofilmes, uma vez que estes possuem um
1.2 Listeriose
A listeriose é definida como a doença infecciosa provocada por espécies do género Listeria. São
consideradas patogénicas as espécies L. monocytogenes e L. ivanovii, sendo no entanto a primeira
mais identificada como o agente causal da listeriose humana, e a segunda da listeriose animal. Existe,
no entanto, o relato de pelo menos um caso de listeriose humana, na Suíça, provocado por L. seeligeri
(Rocourt et al., 1987).
A listeriose é considerada uma doença bacteriana grave, já que apresenta taxas de mortalidade, nos
seres humanos, entre 20 e 40% (Farber e Peterkin, 1991). A população de risco inclui grávidas;
pessoas com o sistema imunitário comprometido, por medicação supressora, por medicação
anti-cancerígena, ou pelo Vírus da Imunodeficiência Humana (VIH); doentes de cancro, em especial
leucemia; diabéticos; asmáticos; doentes com cirrose ou úlceras.
As ocorrências de listeriose podem dividir-se em dois grandes grupos: casos de listeriose feto-maternal
e neonatal, e casos de listeriose em adultos. Os casos de listeriose feto-maternal e neonatal resultam
da infecção do feto através da placenta. Esta infecção conduz, habitualmente, ao aborto, em especial
após o quinto mês de gestação, a nados mortos, ou a recém-nascidos apresentando infecção
generalizada. A infecção é geralmente assintomática na mãe, podendo, no entanto, provocar sintomas
semelhantes a uma gripe ligeira, fadiga, dores musculares, dores nas articulações e de cabeça. Apesar
de menos frequentemente, também se verificam casos, que se manifestam uma a oito semanas após o
parto, caracterizados por meningites e, em alguns casos, por gastroenterites e pneumonias resultantes
da aspiração, pelo recém-nascido, do líquido amniótico (Vásquez-Boland et al., 2001; McLauchlin et al.,
2004).
Os casos de listeriose em adultos caracterizam-se na sua maioria (55 a 70% dos casos), por
afectarem o sistema nervoso central provocando meningites, encefalites e endocardites, mas também
pela ocorrência de septicemias (Vásquez-Boland et al., 2001). A incidência em adultos aumenta com a
idade, sendo a idade média dos adultos infectados superior a 55 anos. Os homens apresentam uma
maior incidência acima dos quarenta anos, no entanto, uma vez que a incidência nas mulheres é
superior durante os anos férteis, a distribuição entre sexos é semelhante (McLauchlin et al., 2004).
Actualmente, em Portugal, as ocorrências de listeriose não são de declaração obrigatória pelo que não
existe informação estatística sobre o seu número. Em Inglaterra e na Escócia, entre os anos de 1995 e
1999, a incidência de listeriose situou-se entre 1,7 a 2,4 casos por milhão de habitantes por ano,
(McLauchlin et al., 2004). Em França e nos Estados Unidos da América, entre 1983 e 2001, estes
valores foram de 5,4 e 9,4 casos, respectivamente.
Em Setembro 2008 uma empresa Canadiana fez uma recolha de todos os produtos cárneos
monocytogenes em alguns dos produtos. Em resultado desta contaminação, foi detectado um surto de
listeriose que registou 56 casos confirmados, dos quais 20 conduziram à morte dos infectados [1].
Por ano, nos EUA verificam-se aproximadamente 76 milhões de casos de doenças alimentares 2500
das quais devidas a L. monocytogenes (Doyle, 2001).
O Centro de Controlo e Prevenção de Doenças dos Estados Unidos da América (CDC), estima que
desses 76 milhões casos 325000 resultaram em hospitalizações e 5000 resultaram em mortes. Estudos
realizados no mesmo país em 1995 estimaram que o custo de 3,3 – 12 milhões de casos, por ano, de
doenças alimentares, foi de 6,5- 35 mil milhões de dólares.
Dados da Organização Mundial de Saúde (OMS) revelam que os custos médicos durante cinco surtos
de doenças alimentares no Reino Unido, em 1996, foram de 300- 700 milhões de Libras.
Segundo McLauchlin et al., (2004) a ocorrência de listeriose subclínica, caracterizada por sintomas
semelhantes a gripe, alterações cutâneas e oculares, bem como o incompleto diagnóstico de alguns
casos, por vezes só detectáveis por necrópsia, e ainda a escassa pesquisa microbiológica nos fetos
abortados, com pouco tempo de gestação, poderão mascarar a real incidência desta doença.
A maior parte dos casos de listeriose humana aparece esporadicamente, estando 80 a 90% dos casos
relacionados com a ingestão de alimentos contaminados pela bactéria. (Anónimo, 2005).
Os alimentos tipicamente relacionados com a possível presença de L. monocytogenes são os produtos
provenientes de leite cru, mariscos, ovos bem como vegetais e alimentos prontos a comer (Little e
Gillespie, 2008).
A maioria dos casos esporádicos de listeriose humana parecem ser causados pelos serótipos 1/2a,
1/2b e 4b enquanto os surtos estão associados às estirpes do serótipo 4b.
Vários estudos tem averiguado o potencial virulento de isolados de L. monocytogenes (Takeuchi et al.,
2003; Neves et al., 2008) no entanto, todos os serovares são considerados patogénicos ainda que se
verifique a existência de isolados com baixo potencial de virulência.
As mudanças nas exigências alimentares dos consumidores obrigam a novos métodos de
processamento e conservação dos alimentos. Estes novos hábitos alimentares levam ao aparecimento
de agentes patogénicos emergentes bem como de novos vias de contaminação (Beuchat 1998). O
crescente afastamento entre a produção e o consumo, tanto em tempo como em distância, bem como
a preferência dos consumidores por produtos “naturais”, sem conservantes e sujeitos a um número
mínimo de processos de conservação, coloca a ênfase não só na qualidade da matéria-prima, mas
também na manutenção desta qualidade durante o processamento, através do controlo da
contaminação e do crescimento microbiano em locais mais vulneráveis e de uma higienização eficaz
1.3 Definição de biofilme
A definição de biofilme foi proposta em 1976 por K. C. Marshall como sendo uma camada de fibrilas de
polímeros extracelulares, que permite às bactérias aderirem a superfícies. Em 1978, Costerton et al.
observando sistemas aquáticos estabeleceram que um biofilme é constituído por células individuais ou
em microcolónias embebidas numa matriz exopolimérica de natureza polissacarídea
predominantemente aniónica, que medeia a aderência. Em 1990, Characklis e Marshall descrevem
características espaciais e de heterogeneidade temporal do biofilme, bem como o envolvimento de
substâncias abióticas e inorgânicas. Em 1995, demonstrou-se que a aderência das bactérias a uma
superfície desencadeava a expressão de genes que controlam a produção de componentes
necessários para o processo de aderência. (Costernon e Lappin-Scott, 1995).
Actualmente, é de aceitação geral a definição proposta por Donlan et al., (2002) que define biofilme
como sendo uma comunidade microbiana séssil caracterizada por células irreversivelmente aderentes
a um substrato ou entre elas, embebidas numa matriz de substâncias poliméricas extracelulares por
elas produzidas e que apresentam alterações fenotípicas no que respeita a taxas de crescimento e
expressão génica.
Estima-se que mais de 90% dos microrganismos vivem sob a forma de biofilmes (Costerton et al.,
1987) e praticamente não existe nenhuma superfície que não possa ser ou vir a ser colonizada por
bactérias (Characklis e Marshall, 1990).
Os biofilmes em natureza podem ter um elevado nível de organização, existir tanto em comunidades
puras, como em comunidades de multi-espécies, formar uma única camada ou uma estrutura
tridimensional e apresentarem-se na forma de agregados, como flocos ou grânulos (Bagge et al.,
2001).
A ubiquidade das bactérias na forma séssil sugere que esta forma de existência apresenta vantagens
de sobrevivência ou vantagens selectivas sobre a existência planctónica Donlan et al. (2002).
Jefferson (2004) aponta quatro principais factores que explicam a existência das bactérias na forma de
biofilme. Segundo o autor, o biofilme pode constituir o modo natural de existência das bactérias. O
crescimento das bactérias em laboratório, no estado planctónico, é feito em condições óptimas que não
se verificam no meio natural. O autor sugere que a existência de uma superfície adequada é o
suficiente para desencadear a produção de um biofilme.
O biofilme é apontado, como mecanismo de defesa que permite proteger as células das camadas
internas de forças de cisalhamento geradas pela passagem dos fluidos, bem como da predação e da
fagocitose.
A formação de biofilme permite a colonização e manutenção das células num nicho favorável. Em
permite não só a acumulação de glucose, mas também a fixação das células num ambiente cujas
condições são propícias ao crescimento.
Finalmente, é apontado ainda que a existência das bactérias em biofilme possibilita a actuação em
comunidade das células que o constituem. As células, ao crescerem em biofilme, apresentam
heterogeneidade fenotípica o que pode ser interpretado como especialização e divisão de funções, à
semelhança do que se verifica nos organismos multicelulares.
As bactérias segregam moléculas sinalizadoras designadas de auto indutoras, que se vão acumulando
no meio, à medida que população cresce a sua densidade aumenta. Quando são atingidos níveis
críticos, são induzidas alterações na expressão dos genes bacterianos (Bassler, 2002).
Estão descritos três mecanismos de comunicação entre bactérias, designada de “quórum sensing”.
As moléculas auto-indutoras das bactérias Gram + são geralmente pequenos péptidos modificados,
que são enviados para o exterior da célula através transporte activo. Estas moléculas interagem com a
membrana celular por via das proteínas da membrana. Verifica-se então uma cascata de fosforilações
que culmina na activação das proteínas que regulam a transcrição dos genes alvo. Estes péptidos
podem também conduzir à lise de uma parte da população, com a consequente libertação de DNA, que
pode, posteriormente, ser assimilado por células naturalmente competentes, constituindo-se assim
também um mecanismo importante de transferência horizontal de genes. A libertação de DNA no meio
garante, por si só, o aumento das substâncias poliméricas promovendo assim o desenvolvimento do
biofilme (Matsukawa et al., 2004).
O mecanismo típico de comunicação em bactérias Gram – envolve a síntese de moléculas auto
indutoras específicas, e a difusão passiva destas moléculas através da membrana citoplasmática, com
e acumulação intra e extracelular. Quando é atingida a concentração crítica, estas moléculas ligam-se
a uma proteína de ligação ao DNA da família LuxR criando um complexo que controla, positiva ou
negativamente a transcrição (Spoering et al., 2006). O ”quórum sensing” constitui assim um importante
factor no desenvolvimento e nas características dos biofilme.
Os polímeros extracelulares, além de criarem uma estrutura tridimensional que protege as bactérias
também fornecem um sistema de canais que armazena os nutrientes e minerais necessários para a
sua sobrevivência.
A composição química dos PEC, também conhecidas por glicocalix, é muito complexa e heterogénea,
sendo maioritariamente composta por polissacáridos (até 65%). (Wimpenny et al., 1993) mas também
por outras substâncias, como proteínas, minerais, nutrientes e ácidos nucleicos. Quando a bactéria se
encontra num meio hidratado, o glicocalix é predominantemente água (Costerton et al., 1985).
Os polissacáridos secretados pelas células variam de organismo para organismo. A maioria deste
polissacáridos são polianiónicos devido à presença de ácidos urónicos (D-glucuronico, D-galacturonico,
e ácido manuronico) e piruvatos de ligação cetónica (Agle, 2006). A estrutura primária dos
geralmente constituída por hélices agregadas. Estes polissacáridos apresentam-se em cadeias longas,
com uma massa molecular da ordem dos 0,5 – 2 × 106 Da. As forças electrostáticas e as pontes de
hidrogénio caracterizam as ligações destes polissacáridos (Agle, 2006).
1.4 Factores que influenciam a formação de biofilme
O desenvolvimento do biofilme é condicionado pela superfície de aderência, pela disponibilidade de
nutrientes, pela composição da comunidade microbiana, pelas características hidrodinâmicas do meio,
pelas interacções interespecíficas e pelo transporte celular (Chmielewski et al., 2003).
As condições do meio, tais como temperatura, composição, pressão, pH e oxigénio dissolvido, também
afectam a composição dos biofilmes (O’Toole et al., 2000).
1.4.1 Tipo de microrganismo
As bactérias devido às suas características como dimensões microscópicas, elevadas taxas de
crescimento, grande capacidade de adaptação e produção de substâncias e de estruturas
extracelulares que as protegem do meio circundante são de entre todos os microrganismos,
consideradas como excelentes produtoras de biofilme (Characklis e Marshall, 1990).
Os biofilmes em natureza são geralmente constituídos por várias espécies. Estes biofilmes são
geralmente de dimensões superiores e mais estáveis do que os biofilmes de uma única espécie.
A organização das células no biofilme misto não é aleatória, sendo que as células se distribuem nos
biofilmes mistos com base na sua capacidade de sobrevivência em micro-nichos criados no próprio
biofilme e com base nas relações simbióticas que se estabelecem. Verifica-se assim uma organização
em função das necessidades de cada espécie (Agle, 2006).
Vários estudos sugerem que a associação de L. monocytogenes com outros géneros bacterianos
promove a colonização de superfícies. Sasahara et al. (1993) verificaram este efeito com vários
isolados do género Pseudomonas. Bremer et al. (2001) verificaram o mesmo efeito com bactérias do
género Flavobacterium.
A flora existente numa unidade industrial pode no entanto ter um impacto negativo no desenvolvimento
dos biofilmes de L. monocytogenes, pelo que a existência de microrganismos inibidores poderá explicar
a não contaminação de determinadas unidades industriais (Carpentier e Chassaing, 2004)).
Leriche e Carpentier (2000) verificaram a inibição de aderência de L. monocytogenes em aço inox em
cultura mista com Staphylococcus sciuri. Carpentier e Chassaing (2004) num estudo sobre o efeito de
monocytogenes constataram o efeito negativo ou nulo da grande maioria, tendo apenas detectado
quatro isolados, Kocuria varians CCL 73, Staphylococcus capitis CCL 54, Stenotrophomonas
maltophilia CCL 47 e Comamonas testosteroni CCL 24, cuja associação com L. monocytogenes
conduzia ao aumento (0,5 a 1 log) da capacidade de produção de biofilme por parte de L.
monocytogenes. O aumento verificado foi atribuído a um aumento da aderência e como resultado de
crescimento.
Estes autores constataram ainda a inexistência de correlação entre a quantidade de PEC formados
pelos isolados e o seu efeito em L. monocytogenes concluindo assim sobre a importância da natureza
dos PEC em detrimento da sua quantidade.
Zhao et al. (2004) efectuaram um estudo testando 413 isolados obtidos apartir de 12 biofilmes de
calhas de esgoto industriais com vista a detecção de isolados com acção bactericida ou inibitória sobre
L. monocytogenes. Destes isolados, que compreendiam bactérias e leveduras, foram identificados 24
isolados (21 bactérias e 3 leveduras) dos quais se destacaram posteriormente 9 isolados bacterianos
por produzirem uma eficiente redução, controlo ou eliminação de L. monocytogenes. Os autores
identificaram em especial duas bactérias lácticas que apresentavam os genes que codificam para a
nisina A e B com potencial para controlar os biofilmes de L. monocytogenes.
1.4.2 Características do fluido
1.4.2.1 Velocidade de escoamento/regime de escoamento
O regime de escoamento do fluido ao qual o biofilme está sujeito tem um forte efeito na sua estrutura e
propriedades. O regime laminar ou turbulento afecta os balanços de massa, no interior do biofilme, não
só por condicionar o seu desenvolvimento, mas também por condicionar as taxas de remoção de
substratos (Cogan et al., 2004).
Simões et al. (2003) verificou em Pseudomonas fluorescens que os biofilmes formados em regime
turbulento apresentavam maior actividade, menos quantidade de PEC por grama de biofilme e maior
conteúdo proteico que os biofilmes formados em regime laminar.
Ebrahimi et al. (2005) utilizando como modelo para a formação de biofilme um reactor de secção
quadrada verificaram, que ao contrário do esperado, a formação do biofilme iniciava-se pela zona de
maior turbulência, ao centro e não nos cantos, concluindo que as forças de cisalhamento não são o
factor dominante, sobrepondo-se a estas o facto de nos cantos se verificarem condições de escassez
1.4.2.2 Temperatura
Em L. monocytogenes a temperatura regula a síntese de muitos factores de virulência bem como a
expressão de “genes ambientais” que podem conduzir a alterações na superfície da célula (Leimeister
– Wachter et al., 1992; Liu et al., 2002) podendo afectar a aderência.
A carga superficial das células e a sua hidrofobicidade têm um papel importante na etapa inicial de
aderência microbiana (Van Lsdrecht et al., 1990). Uma vez que a hidrofobicidade da célula é modelada
pelas condições em que decorre o crescimento nomeadamente de temperatura, este factor pode
condicionar fortemente o desenvolvimento dos biofilmes.
A hidrofilicidade da superfície celular de L. monocytogenes é superior quando cultivada a temperaturas
de 8 -10 ºC, em comparação com a temperatura de 30 ºC (Chavant et al., 2002). Este facto foi também
comprovado por Di Bonaventura et al. (2008) que verificaram um aumento da hidrofobicidade com um
aumento da temperatura, registando diferenças significativas quando a incubação era efectuada a 37
ºC ou a 22, 12 e 4 ºC.
Moltz et al. (2005) verificaram que quando comparada a incubação a 20 e a 37 ºC o número de células
no biofilme era superior após duas horas de incubação a 20 ºC, invertendo-se, no entanto, o resultado
quando a incubação era prolongada até às 20 horas. L. monocytogenes apresenta capacidade de
formação de biofilmes a temperaturas de refrigeração. Norwood et al. (2005) verificaram este facto em
aço inox, cultura pura e cultura mista, a 4 ºC. Quando comparado o crescimento a 4, 18 e 30 ºC
verificaram maiores valores de aderência para temperaturas superiores.
1.4.2.3 pH
O pH condiciona o processo de aderência microbiano uma vez que altera as propriedades
electrostáticas não só das superfícies, mas também dos microrganismos.
Um pH baixo devido à presença de ácido láctico estimula a aderência de L. monocytogenes a aço inox.
À medida que o pH desce ocorre protonação dos grupos negativos da superfície da célula (Mafu et al.,
1999).
1.4.2.4 Concentração de nutrientes
Actualmente, e ao contrário de muitas outras bactérias a maioria dos estudos indica a preferência de L.
monocytogenes para formar biofilmes em condições de riqueza de nutrientes. Stepanovic et al. (2004)
diluído (1/20). Pelo contrário, quando testada Salmonella sp. verificou-se um maior desenvolvimento do
biofilme em meio diluído.
Blackman et al. (1996) verificaram que L. monocytogenes produzia uma quantidade muito superior de
biofilme em meio TSB quando comparado com o crescimento em meio de cultura definido, ainda que
as respectivas populações de células planctónicas atingissem valores semelhantes. Os mesmos
autores verificaram ainda uma diminuição da aderência para baixas concentrações de ferro no meio.
Takhistov et al. (2004) verificaram a tendência de crescimento dos biofilmes de L. monocytogenes no
sentido de zonas de maior densidade de nutrientes.
1.4.3 Tipo de material da superfície e o seu estado de conservação
A capacidade de L. monocytogenes para formar biofilmes numa grande variedade de superfícies como
aço inox, nitrilo, borrachas, PVC, polipropileno, teflon, nylon e vidro encontra-se bem documentada
(Blackman et al., 1996; Beresford et al., 2001; Chavant et al., 2002; Pan et al., 2006; Di Bonaventura et
al., 2008).
O estudo da capacidade de aderência às superfícies é de extrema importância, permitindo adequar
correctamente os materiais empregues nos equipamentos industriais.
Cumliffe et al. (1999) verificou a influência da hidrofobicidade das superfícies na capacidade de
aderência de L. monocytogenes. Ao tratar uma superfície de sílica com diferentes revestimentos com
hidrofobicidades diferentes concluíram que a aderência era mais fraca para superfícies hidrofílicas.
Chavant et al. (2002) comparou superfícies de aço inox, de natureza hidrofílica, com um polímero de
natureza hidrofóbica tendo, no entanto, verificado grande capacidade da estirpe usada em colonizar as
duas superfícies. Quando o estudo foi realizado à temperatura de incubação de 8 ºC verificou-se uma
maior colonização em aço inox. Este facto foi justificado com da hidrofilicidade da superfície celular a
essa temperatura.
O efeito da rugosidade é por si só de difícil estudo, uma vez que é de difícil distinção o efeito deste
factor de outros implicados na aderência bacteriana como a hidrofobicidade do material. De um modo
geral, assume-se que a aderência das bactérias é feita preferencialmente a superfícies rugosas e
desgastadas que, ao acumularem água e nutrientes, proporcionam nichos ideais ao desenvolvimento
bacteriano (Bryers, 2000). No entanto, Tide et al. (1999) não verificaram diferença na aderência inicial
de L. monocytogenes a aço inox polido ou não polido.
Acções de higienização prolongadas podem conduzir à deterioração dos materiais e facilitar a
ancoragem das bactérias em nichos em que se encontram mais protegidas. A escolha dos materiais
empregues deve ter em conta este facto, permitindo aos materiais resistir convenientemente às
1.5 Etapas da formação de biofilmes
A formação de biofilmes bacterianos ocorre em duas fases distintas. Uma fase de aderência e uma
fase de maturação.
Sempre que um corpo estranho é colocado num meio líquido a sua superfície inicial é modificada pela
absorção de água, proteínas, lípidos, sais inorgânicos e outros compostos. Este fenómeno designa-se
por condicionamento superficial, é caracterizado por um aumento da concentração de nutrientes junto à
superfície quando comparada com a fase líquida (Kumar et al., 1998).
Uma superfície, uma vez condicionada tem as suas propriedades permanentemente alteradas pelo que
as afinidades de um microrganismo para uma superfície condicionada, ou não, podem ser bastante
diferentes.
A aderência na sua fase inicial, é de natureza reversível e geralmente mediada por interacções não
específicas como interacções hidrofóbicas, para superfícies abióticas, ou através de ligações
moleculares especificas (lecitinas, adesinas) para tecidos vivos ou desvitalizados.
A aderência inicial tem lugar com a aproximação do microrganismo da superfície, quer seja
aleatoriamente, em resultado do escoamento do fluído, ou através da própria mobilidade do
microrganismo. Quando é atingida uma distância crítica, geralmente inferior a 1 nm, a aderência fica
dependente do balanço de forças atractivas e repulsivas entre as duas superfícies. Estas forças
incluem forças electrostáticas, interacções hidrofóbicas, forças de Van der Walls, entre outras. As
forças electrostáticas tendem a favorecer a repulsão, uma vez que a maioria das bactérias e das
superfícies inertes estão carregadas negativamente. As forças hidrofóbicas são as mais relevantes no
processo de aderência inicial.
Durante esta fase inicial, as bactérias apresentam movimento Browniano podendo as células ser
removidas das superfícies apenas pela acção de forças de cisalhamento do fluído.
A segunda fase de aderência é caracterizada pela formação de PEC. Até então, os microrganismos
encontravam-se fracamente aderentes. Os PEC ao complexarem-se com os materiais da superfície e,
ou, com os receptores específicos localizados em pili, fibras ou fibrilas, consolidam a aderência dos
microrganismos. Nesta segunda fase de aderência estão envolvidas forças como as de interacção
dipólo-dipólo, pontes de hidrogénio, ligações iónicas, ligações covalentes e interacções hidrofóbicas
(Kumar et al., 1998).
O processo de maturação do biofilme inicia-se assim que as células se encontram irreversivelmente
ligadas. Inicialmente, formam-se microcolónias que, ao desenvolverem-se, coalescem formando
camadas de células que cobrem as superfícies. Ao se multiplicarem e morrerem os microrganismos
e as PEC geradas pelas bactérias interagem com moléculas orgânicas e inorgânicas criando o
O crescimento do biofilme não é ilimitado. Factores como a disponibilidade de nutrientes para as
células do interior do biofilme bem como a acumulação de metabolitos tóxicos ou outros factores como
o valor de pH interno e a difusão de oxigénio no interior do biofilme, limitam o seu desenvolvimento.
Também a superfície do biofilme é caracterizada por uma dinâmica própria. Quando é atingida uma
massa crítica, as zonas mais externas do biofilme libertam células na forma planctónica que podem
colonizar outras superfícies. A dinâmica dos biofilmes encontra-se esquematicamente ilustrada na Fig.
1.1.
Fig. 1.1 ‐ Processo de formação do biofilme
(adaptado de Xavier et al., 2003)
1.6 Detergentes e desinfectantes
A necessidade de tornar a produção o mais rentável possível leva a que exista a tendência, a nível
industrial, de maximizar os tempos de produção, minimizando a frequência e o tempo das operações
de higienização.
As falhas nos procedimentos de higienização nas indústrias alimentares bem como o deficiente
desenho dos equipamentos proporciona o frequente aparecimento de L. monocytogenes, tanto na
Para além de originar problemas em higiene, a acumulação de biofilmes nas indústrias alimentares
pode provocar perdas de eficiência em permutadores de calor, perda de carga nas tubagens e
aceleração da deterioração dos materiais. (Matilla-Shandhom e Wirtanen, 1992).
Assim, é necessário garantir que os programas de higienização utilizados assegurem acções
mecânicas e químicas eficazes e que as temperaturas e tempos de contacto com os produtos
sanificantes permitam uma acção antimicrobiana adequada (Wirtanen et al., 2003). Chmielewski e
Frank (2006) apontam a importância do tempo de contacto, concentração do agente, temperatura de
aplicação do agente mas também das forças exercidas na aplicação (regime laminar ou turbulento) e a
eficiência e sensibilização dos trabalhadores responsáveis pelas operações de limpeza e desinfecção
de equipamentos e superfícies, como factores essenciais a um eficaz plano de higienização.
Os desinfectantes podem ser designados, genericamente, por agentes biocidas. São agentes químicos,
em geral de largo espectro, utilizados com a função de inactivar microrganismos em superfícies e
objectos inanimados, em que alguns também se destinam à remoção física de materiais orgânicos.
Idealmente, um desinfectante deve ter um espectro alargado (bactérias Gram+ e Gram-, esporos,
fungos, vírus e priões), actuar em baixa concentração (diluição elevada) e de preferência na presença
de matéria orgânica. Deve ser tóxico para os agentes infecciosos e, no entanto, ser seguro para os
manipuladores nas doses recomendadas. Não deve destruir, nem provocar desgaste em superfícies
comuns. Deve ser estável em armazenamento, sem odor ou de odor agradável, ser solúvel em água e
em lípidos e possuir uma baixa tensão superficial que permita a fácil penetração nas reentrâncias das
superfícies. Além disto, o seu custo deve ser o mais baixo possível (Prescott et al., 1999). Os agentes
químicos devem ser capazes de dissolver os PEC para permitir a remoção das células ou então serem
capazes de penetrar os PEC inactivando as células (Chmielewski e Frank, 2006).
As questões ambientais impõem que, cada vez mais, a biodegradabilidade dos agentes
antimicrobianos seja um parâmetro a ter em conta aquando da sua selecção. O regulamento (CE) N.º
648/2004 de 31 (Anónimo, 2004) alterado pelo Regulamento (CE) n.º 907/2006 (Anónimo, 2006) impõe
aos estados membros que a partir de 8 de Outubro de 2005, os surfactantes utilizados, tanto a nível
doméstico como industrial, sejam totalmente biodegradáveis.
Os principais princípios activos dos biocidas são os compostos fenólicos e seus derivados; os álcoois;
os halogéneos, de entre os quais se destaca o cloro; os metais pesados; os compostos quaternários de
amónio; os aldeídos e gazes esterilizantes como o óxido de etileno (Prescott et al., 1999).
1.7 Resistência e resposta a compostos antimicrobianos
A resposta dos microrganismos aos agentes utilizados para o seu controlo, tem sido desde há muito
dos microrganismos quer a nível clínico quer industrial. Cloete (2003) define resistência como a
capacidade, temporária ou permanente, de um organismo e da sua descendência se manterem viáveis
e/ou se multiplicarem sob condições que destruiriam ou inibiriam outros membros da mesma estirpe. O
termo persistência é mais vago e traduz a constatação do isolamento repetido da mesma estirpe, ao
longo do tempo num dado local (Pan et al., 2006).
A relação entre a persistência de determinados isolados e a sua resposta aos biocidas industriais tem
sido largamente estudada em especial em células planctónicas com determinações de concentração
mínima inibitória (CMI) e concentração mínima bactericida (CMB) (Lundén et al., 2003, Lourenço et al.,
2009). No entanto, a capacidade de formação de biofilme das estirpes é apontada como um factor
decisivo na resposta aos agentes biocidas (Holah et al., 2002).
A maior resistência dos biofilmes aos compostos antimicrobianos, quando comparada com as células
planctonicas, é geralmente apontada com sendo o resultado de três principias factores: efeito protector
da matriz do biofilme; taxas de crescimento lentas; e expressão de genes de resistência específicos
(Lewis, 2001). A matriz de exopolímeros constitui uma barreira à acção dos compostos
antimicrobianos, não só por limitar a sua difusão, mas também por se ligar a estes. A carga negativa
dos exopolissacáridos constitui uma barreira importante, em especial para os compostos de carga
positiva. A acção de barreira à difusão poderia constituir apenas um adiar da acção do agente
antimcrobiano até que este se encontrasse em equilíbrio em todo o biofilme no entanto, no caso dos
compostos que se degradam e perdem actividade, este mecanismo é particularmente importante. Pan
et al. (2006) sugerem que o contacto do biofilme com determinados agentes biocidas pode alterar a
matriz extracelular, ou mesmo induzir a produção de diferentes polímeros extracelulares. Segundo
estes autores a acção dos biocidas pode ainda ser dificultada, como resultado dos detritos e das
células mortas resultantes da sua aplicação.
De um modo, geral é possível dizer que os agentes antimicrobianos apresentam o seu máximo de
eficácia contra células em rápido crescimento. As baixas taxas de crescimento que se verificam no
interior do biofilme podem constituir um mecanismo de resistência. No entanto, é contraposto que esta
diferença não estará só ligada às taxas de crescimento mas também a existência de células
persistentes no interior dos biofilmes. Brooum et al. (2000) verificaram que após uma redução na
população de um biofilme de P. aeruginosa de 3-4 log, o aumento da dose de antibiótico não produzia
efeitos.
A expressão alterada de genes de resistência é também apontada como razão para a resposta das
células nos biofilmes. Em especial para bactérias Gram -, como P. aeruginosa, a expressão do factor σ
RpoS como resposta a elementos de stress desencadeia alterações fisiológicas que podem constituir
protecção. Este factor, tradicionalmente associado à fase estacionário de crescimento, é induzido por
Os mesmos autores apontam ainda o contributo do aumento da expressão de genes ligados a bombas
de efluxo, e da alteração no perfil de proteínas de membrana, como responsáveis pela indução de um
fenótipo característico do biofilme.
1.8 Estudo dos biofilmes
As metodologias empregues para o estudo in vitro dos biofilmes são variadas e condicionam os
resultados obtidos dificultando a sua comparação. De um modo geral é possível distinguir entre as
metodologias que se baseiam na quantificação directa ou indirecta do biofilme formado e os métodos
de visualização dos biofilmes.
As metodologias podem ser divididas em função do modo como é efectuado o crescimento do biofilme,
em cultura contínua ou em batch; e quanto ao
método de recuperação do biofilme. O
crescimento de biofilmes em cultura contínua
pode ser feito utilizando dispositivos como o “CDC
Biofilm Reactor” (Fig. 1.2). Este dispositivo
permite submeter várias superfícies de diversos
materiais a forças de cisalhamento controladas.
Outros métodos como o “BST biofilm anular
Reactor” (Fig. 1.2) que consiste num cilindro
externo estático e num cilindro interno móvel
circulando o fluído entre eles; ou o “Drip Flow
Reactor” (Fig. 1.2) usado para a formação de
biofilmes em condições de baixas forças de
cisalhamento permitem fazer o crescimento dos
biofilmes em cultura contínua.
Os métodos que utilizam a cultura batch são também diversos, como o “Robinson Modified Device”,
reactores de disco e outros métodos que se baseiam na utilização de microplacas de 96 poços.
Os métodos de recuperação das células dos biofilmes são diversos podendo esta ser efectuada por
raspagem, sonicação ou utilização do vortex. Tal como reporta Djordevic et al. (2002) alguns
investigadores apontam a raspagem como capaz de remover 97% das células aderentes a aço inox, a
utilização do vortex com uma eficácia de remoção de 99% em tubos de silicone.
Fig. 1.2 ‐ Dispositivos utilizados no estudo de biofilmes.
Da esquerda para a direita: “CDC Biofilm Reactor”; “BST biofilm anular Rector”. Em baixo: “Drip Flow Reactor”
Os métodos que se baseiam na coloração para quantificar o biofilme tem como principal vantagem não
possuírem a operação de dissociação das células do biofilme. Assim, são evitados os erros por defeito
na quantificação resultantes de má dissociação do biofilme (Pettit et al., 2005).
Entre os métodos que se baseiam na coloração pode-se destacar os que fazem uso de corantes como
o cristal violeta (Djorvick et al., 2002; Borucki et al., 2003) ou Alamar blue (Pettit et al., 2005). O método
do cristal violeta baseia-se na coloração, seguida de extracção com um solvente do corante ligado e
subsequente medida da absorção deste. No caso do Alamar Blue a quantificação do biofilme é feita
pela alteração de cor registada em resultado da redução por FMNH2, FADH2, NADH, NADPH e
citocromos.
Em 2007, Chavant et al. propuseram um novo método para avaliar o potencial de formação de
biofilmes por bactérias. Este método baseia-se na capacidade de imobilização de leitos de natureza
magnética pelas células sésseis impedindo a movimentação destes quando sujeitos a forças de
atracção magnéticas. Dois outros métodos semelhantes para crescimento e teste dos biofilmes em
microplacas são o “Calgary Biofilm Device” e o método descrito por Knobloch et al. (2002) para a
determinação do “Minimal attachment killing - MAK”.
O “Calgary biofilm device” é um sistema patenteado em 2006 para a avaliação da susceptibilidade de
biofilmes a agentes antimicrobianos que utiliza placas de 96 poços cuja tampa apresenta
protuberâncias de poliestireno cada um com uma área média de 108,9 mm e uma parte inferior que
consiste na base de uma microplaca de 96 poços (Fig. 1.3). As 96 protuberâncias idênticas ficam em
contacto com o meio de cultura durante o período de incubação num agitador orbital permitindo o
desenvolvimento do biofilme. O biofilme pode então ser sujeito a testes com agentes antimicrobianos e
quantificado pela remoção através de sonicação (Ceri et al., 1999).
A visualização dos biofilmes pode ser feita com recurso a várias técnicas de microscopia como a
microscopia de contraste, microscopia de epifluorescência, microscopia de transmissão microscopia de
varrimento electrónico, contudo, estes métodos possuem algumas limitações, devido à resolução e há
utilização de solventes como álcool, acetona e xileno. No caso da microscopia de varrimento e de
transmissão electrónica, uma vez que a água não é compatível com o vácuo necessário para utilizar a
radiação de electrões, utiliza o álcool para gradualmente desidratar a espécie a examinar. Como, a
matriz de exopolímeros é constituída por 95% de água, o processo de desidratação vai alterar a
amostra, aparecendo mais como um conjunto de fibras do que como uma matriz densa e gelatinosa
rodeando as células (Donlan e Costerton, 2002).
O uso da microscopia electrónica de varrimento e de corantes específicos de polissacáridos como o
ruténio vermelho permitiram identificar a natureza das fibras extracelulares que constituem os biofilmes
e perceber melhor a natureza da associação entre as células. (Stickler et al., 1998)
Em alternativa, a microscopia de varrimento de laser confocal, fornece uma inspecção tri-dimensional e
uma reconstrução por computador do biofilme maduro sem uma grande distorção da estrutura (Dunne,
2002). Para a quantificação de células que estão aderidas a superfícies a microscopia de
epifluorescência é uma excelente opção, visto utilizarem-se substâncias fluorescentes como o
alaranjado de acrinina para coloração directa das células, permitindo assim a sua observação. (Costa,
1999).
1.9 Enquadramento e objectivos do trabalho
Trabalho anterior realizado no Laboratório de Microbiologia do ISA, no âmbito do projecto nº 292,
PO AGRO 8.1-1º Concurso, INIAP permitiu identificar, em queijarias tradicionais, estirpes persistentes
de L. monocytogenes responsáveis pela sistemática contaminação dos queijos (Leite et al., 2006).
Trabalho posterior da equipa, realizado no âmbito do projecto POCI/SAU-ESP/56243/2004, com células
planctónicas destas estirpes e de outras esporádicas nas referidas instalações mostraram que a
resistência ou a adaptação aos agentes desinfectantes em uso não parecia ser a causa de tal
persistência (Lourenço et al. 2009). Estas estirpes existirão, muito provavelmente, na forma de
biofilmes e daí a sua dificuldade de remoção.
No combate à formação de biofilmes recorre-se, frequentemente, à aplicação de desinfectantes
industriais. Mas para cada agente desinfectante, é necessário conhecer, não só a susceptibilidade das
células planctónicas aos desinfectantes (avaliada através da CMI - concentração mínima inibitória, ou
da CMB - concentração mínima bactericida) mas também, a susceptibilidade das células sésseis
através da determinação da concentração mínima de erradicação do biofilme (CMEB).
Este trabalho terá como objectivo avaliar a capacidade de formação de biofilme de diversos isolados de
L. monocytogenes através de dois métodos distintos de produção de biofilme, tendo em vista eventuais
relações entre a capacidade de formação de biofilme, a origem do isolado ou o seu perfil molecular.
Foram ainda produzidos biofilmes com P. aeruginosa PAO1 usada frequentemente como modelo para
produção de biofilmes de forma a avaliar o comportamento de L. monocytogenes em cultura mista.
Constituiu ainda objectivo deste trabalho a determinação da concentração mínima de erradicação de
biofilmes de quatro desinfectantes utilizados na indústria alimentar para biofilmes de cultura pura de L.
monocytogenes em cultura mista com vista à identificação do produto mais eficaz na eliminação deste
patogénio alimentar. Neste estudo, será utilizado um modelo para formação de biofilmes muito recente,
o “Calgary Biofilm Device”. Este trabalho permitirá identificar as estratégias mais eficazes para a
remoção deste agente patogénico dos ambientes industriais, através da identificação dos produtos
mais adequados para a erradicação de biofilmes de estirpes persistentes de nichos ecológicos
específicos.
2 Materiais e métodos
2.1 Estirpes utilizadas
Quadro 2.1 ‐ Estirpes bacterianas utilizadas
Isolado
CBISAa Espécie Origem
3001 L. monocytogenes CECT4032b
3004 L. monocytogenes CECT936b
3007 L. monocytogenes CIP 104 794c
3008 L. innocua NCTC11288d = ATCC33090e
3077 L. monocytogenes Queijo de leite de ovelha - Produtor C 3096 L. monocytogenes Queijo de leite de ovelha - Produtor C 3102 L. monocytogenes Queijo de leite de ovelha - Produtor D 3107 L. monocytogenes Tábua da câmara de maturação - Produtor D 3119 L. monocytogenes Queijo de leite de ovelha - Produtor B 3130 L. monocytogenes Queijo de leite de ovelha - Produtor B 3169 L. monocytogenes Queijo de leite de ovelha – Produtor F 3172 L. monocytogenes Escova de lavagem de queijos - Produtor A 3176 L. monocytogenes Queijo de leite de ovelha – Produtor E
3183 L. monocytogenes Leite de Tanque – Produtor A
3188 L. monocytogenes Filtro de ordenha manual - Produtor A 3192 L. monocytogenes Filtro de ordenha mecânica - Produtor D 3204 L. monocytogenes Filtro de ordenha manual - Produtor E 3219 L. monocytogenes Queijo de leite de ovelha – Produtor E 3230 L. monocytogenes Queijo de leite de ovelha – Produtor E
3845 L. monocytogenes Humana
3846 L. monocytogenes Humana
3849 L. monocytogenes Humana
3851 L. monocytogenes Humana
3858 L. monocytogenes Humana
3859 L. monocytogenes Humana
3880 L. monocytogenes Queijo de leite de ovelha – Produtor E 3900 L. monocytogenes Queijo de leite de ovelha – Produtor E
3972 L. monocytogenes Humana
3991 Salmonella enterica serovar Braenderup Institute Pasteur – Laboratoire de Listeria
3999 L. monocytogenes Salada de alface e tomate
4009 L. monocytogenes Salada de alface e tomate
4076 Pseudomonas aeruginosa PAO1 Instituto Superior Técnico – IBBf
28
2.2 Agentes desinfectantes
Quadro 2.2 – Caracterização dos agentes desinfectantes utilizados
Agente Fabricante Propriedades pH Densidade
Recomendações de Utilização
Concentração Tempo Temperatura
T99 Henkel
Ecolab
Detergente desinfectante líquido de acção espumante, com 5 a 15% de acetato de alquilamina
9
(1%, 20 ºC) 0,99 g/cm3
2 – 3 % (v/v)
0,5%-1% (v/v)
10 – 20 min
Mais de 20 min
Temperatura ambiente
T66 Henkel
Ecolab
Detergente líquido alcalino clorado, com acção desinfectante e
espumante.
11,8
(1%) 1,13 g/cm3 2 – 5% (v/v) 15 min
Enxaguamento prévio com água a 40-60 ºC
DD Langlois
Detergente desinfectante em pó alcalino clorado, com acção desinfectante e espumante.
11,8
(1%) - 0,5 – 2% (m/v) 10 – 15 min
Aplicação a 70-80 ºC para utensílios c/gordura.
Aplicação a 40-50 ºC para utensílios s/ gordura
BP Henkel Ecolab
Detergente desincrustante líquido ácido, com acção desinfectante e não espumante.
1,7± 0,2 (1%)
1,147±
2.3 Meios de Cultura
2.3.1 Meios Líquidos
1) TSB
Dissolver 30 g de meio TSB (“Tryptone Soya Broth”) desidratado (Biokar Diagnostics,
Beauvais, França) num litro de água destilada.
Autoclavar durante 20 minutos a 121 ºC.
2) MH
Dissolver 22 g de meio Mueller Hinton (AES Laboratoire, Bruz, França) num litro de água
destilada.
Autoclavar durante 10 minutos à temperatura de 121 ºC, ou durante 15 minutos a 116 ºC, de
acordo com as instruções do fabricante.
2.3.2 Meios Sólidos
1) TSA-YE
Dissolver 30 g de meio TSB (“Tryptone Soya Broth”) desidratado num litro de água destilada.
Adicionar 6 g de extracto de levedura (Oxoid, Hampshire, UK).
Juntar 18 g de ágar-ágar.
Autoclavar durante 20 minutos a 121 ºC.
Arrefecer em banho termostatizado à temperatura de 50 ºC.
Distribuir em caixas de Petri e deixar solidificar em câmara de fluxo laminar.
Conservar a 4 ºC até utilização.
2) BHIA
Dissolver 37 g de meio BHI (“Brain Heart Infusion”) desidratado (Biokar Diagnostics, Beauvais,
França) num litro de água destilada.
Juntar 18 g de ágar-ágar.
Autoclavar durante 20 minutos a 121 ºC
Arrefecer em banho termostatizado à temperatura de 50 ºC.
Distribuir em caixas de Petri e deixar solidificar em câmara de fluxo laminar.
3) Agar Nutritivo
Dissolver 1 g de meio de extracto de carne desidratado (Biokar Diagnostics, Beauvais, França)
num litro de água destilada.
Juntar 2 g de extracto de levedura (Oxoid, Hampshire, UK)
Juntar 5 g de peptona (Oxoid, Hampshire, UK)
Juntar 5 g de cloreto de sódio (Panreac, Barcelona, Espanha)
Juntar 18 g de ágar-ágar.
Autoclavar durante 20 minutos a 121 ºC.
Arrefecer em banho termostatizado à temperatura de 50 ºC.
Distribuir em caixas de Petri e deixar solidificar em câmara de fluxo laminar.
Conservar a 4 ºC até utilização.
4) Agar de Sangue de cavalo
Distribuir em caixas de Petri 12 ml de Agar Nutritivo e deixar solidificar em câmara de fluxo
laminar.
Dissolver 20 g de base de agar de Sangue (Oxoid, Hampshire, UK) em 500 ml de água
destilada.
Autoclavar durante 20 minutos a 121 ºC.
Arrefecer em banho de água a 50 ºC.
Adicionar 25 ml de sangue de cavalo desfibrinado (Probiológica, Belas, Portugal).
Adicionar, a cada uma das placas preparadas com 12 ml de agar nutritivo, 18 ml desta mistura e
deixar solidificar em câmara de fluxo laminar.
Conservar a 4 ºC até utilização.
5) CHROMagar™ Listeria
Meio Base: Adicionar a quantidade pré-pesada de meio desidratado CHROMagar™ Listeria
(CHROMagar, Paris, França) (12,875 g) a 250 ml de água destilada num frasco autoclavável
com uma barra magnética.
Dissolver o pó lentamente, com o auxilio de uma placa de agitação.
Autoclavar a 121 ºC durante 20 min.



![Fig. 2.3 ‐ Espectro de absorção do cristal violeta e respectiva estrutura química [2]](https://thumb-eu.123doks.com/thumbv2/123dok_br/16631059.740745/44.892.181.683.350.562/fig-espectro-absorção-cristal-violeta-respectiva-estrutura-química.webp)