Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação Stricto Sensu em Ciências
Genômicas e Biotecnologia
AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA E
ANTIBIOFILME DE PEQUENOS PEPTÍDEOS
CATIÔNICOS CONTRA KLEBSIELLA PNEUMONIAE
B
RASÍLIA
-
DF
2015
SUZANA MEIRA RIBEIRO
AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA E ANTIBIOFILME DE
PEQUENOS PEPTÍDEOS CATIÔNICOS CONTRA KLEBSIELLA PNEUMONIAE
Tese apresentada ao Programa de Pós-Graduação Stricto Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para obtenção do Título de Doutor em Ciências Genômicas e Biotecnologia.
Orientador: Prof. Dr. Octávio Luiz Franco
Co-Orientadora: Profa. Dra. Susana Elisa Moreno
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
R484a Ribeiro, Suzana Meira.
Avaliação da atividade antimicrobiana e antibiofilme de pequenos peptídeos catiônicos contra Klebsiella pneumoniae. / Suzana Meira Ribeiro – 2015.
92 f.; il.: 30 cm
Tese (Doutorado) – Universidade Católica de Brasília, 2015.
Orientação: Prof. Dr. Octávio Luiz Franco
Coorientação: Profa. Dra. Susana Elisa Moreno
1. Biotecnologia. 2. Biofilmes. 3. Peptídeos catiônicos. 4. Carbapenemase. I. Franco, Octávio Luiz Franco, orient. II. Moreno, Susana Elisa, coorient. III. Título.
AGRADECIMENTOS
Ao meu orientador Prof. Dr. Octávio Luiz Franco, pelo incentivo e pela amizade durante o doutorado.
À Prof. Dra. Susana Moreno pelas valiosas sugestões.
Ao orientador no exterior, Prof. Dr. Robert Hancock, por abrir as portas de seu laboratório e permitir que eu desenvolvesse parte de meu projeto de pesquisa;
Aos amigos e colegas Beverlie e César, por todo o apoio com os experimentos com animais e com os experimentos com biofilmes e, sobretudo pela amizade;
À Susan, pela recepção e cuidado durante minha permanência no Canadá.
À Sarah, Fany, Florian, Aline e Ngan, por fazer o dia-a-dia no laboratório do Prof. Hancock mais divertido.
Aos demais colegas do grupo de microbiologia e imunologia do laboratório do Prof. Dr. Robert Hancock, pelas sugestões de melhoria dos experimentos.
À Diego Azevedo, por auxiliar nos experimentos nos primeiros anos do doutorado
Aos amigos Betty, Thais, Michelle e Osmar, pelo suporte emocional durante toda a minha estadia fora do Brasil;
As amigas Alícia, Vivian, Amanda, Simone, Mariana e ao amigo Bruno, pelas palavras encorajadoras;
Aos demais amigos do CAPB, por todo apoio;
RESUMO
Referência: RIBEIRO, Suzana M. Avaliação da atividade antimicrobiana e antibiofilme de pequenos peptídeos catiônicos contra Klebsiella pneumoniae. Tese (Doutorado em Ciências Genômicas e Biotecnologia) – Universidade Católica de Brasília, Brasília, 2015.
Klebsiella pneumoniae resistente a múltiplos antibióticos, que produzem a enzima K. pneumoniae carbapenemase (KPC), estão se tornando uma causa comum de infecções em centros de cuidado a saúde. Além disso, K. pneumoniae pode desenvolver biofilmes multicelulares, que levam o aumento da resistência adaptativa a antibióticos. Aqui foi descrito a atividade antimicrobiana e antibiofilme de peptídeos catiônicos sintéticos contra isolados de K. pneumoniae susceptível e resistente a carbapenens em ensaios in vitro e in vivo. Usando ensaios de microplaca estático, foi observado que a concentração dos peptídeos IDR-1018, DJK-5 e DJK-6, requerida para prevenir a formação de biofilmes de isolados resistentes foi abaixo da concentração inibitória mínima (CIM) desses peptídeos. Experimentos de fluxo de célula confirmaram a atividade antibiofilme dos peptídeos contra biofilmes pré-formados de diferentes isolados de K. pneumoniae produtores de KPC e, em alguns casos, os peptídeos induziram morte celular. Combinações de DJK-6 e antibióticos β-lactâmicos, incluindo o carbapenem meropenem, também preveniram o crescimento planctônico e a formação de biofilmes do isolado produtor de KPC 1825971. Interessantemente, o peptídeo DJK-6 foi capaz de aumentar, em pelo menos 16 vezes, a habilidade de meropenem erradicar biofilmes pré-formados desse isolado. Embora, essa combinação tenha sido efetiva in vitro, nenhuma redução da carga bacteriana foi observada em modelo murino de infecção pulmonar por K. pneumoniae. Os resultados dos peptídeos HHC-10 e IDR-1018 (os quais inibiram o crescimento bacteriano in vitro a concentração que apresentou baixa citotoxicidade) foram contrastantes entre os dois modelos de infecção pulmonar (significando redução ou não redução da carga bacteriana). Outras abordagens utilizando os peptídeos IDR-1018 profilaticamente ou o peptídeo IDR-1002 (efetivo em inibir o crescimento bacteriano in vitro) após a infecção, também foram incapazes de reduzir a carga bacteriana em pulmões de camundongos. Apesar da inefetividade em modelo agudo de infecção pulmonar, o uso de peptídeos catiônicos, tal como DJK-6, para potencializar a atividade de β-lactâmicos, incluindo meropenem, representa uma estratégia promissora para prevenir a formação de biofilmes ou eliminar biofilmes existentes tanto em equipamentos médicos quanto em superfícies do corpo.
ABSTRACT
Reference: RIBEIRO, Suzana M. Evaluation of antimicrobial and antibiofilm activity of small cationic peptides against Klebsiella pneumoniae. 93. Thesis (PhD in Genomic Science and Biotecnology) – Universidade Católica de Brasília, Brasília, 2015.
Multi-drug resistant Klebsiella pneumoniae that produce the enzyme K. pneumoniae carbapenemase (KPC) are becoming a common cause of infections in health care centers. Furthermore, Klebsiella can develop multicellular biofilms, which lead to elevated adaptive antibiotic resistance. Here, it was described the antimicrobial and anti-biofilm activities of synthetic cationic peptides against K. pneumoniae strains susceptible and carbapenens resistant through in vitro and in vivo assays. By using static microplate assays, it was observed that the concentration of the peptides IDR-1018, DJK-5 and DJK-6 required to prevent biofilm formation by these clinical isolates was below the minimum inhibitory concentration (MIC) of these peptides. Flow cell experiments confirmed the anti-biofilm activity of the peptides against 2 day-old biofilms of different KPC producing isolates and, in some cases, the peptides induced biofilm cell death. Combinations of DJK-6 together with β-lactam antibiotics, including the carbapenem meropenem, also prevented planktonic growth and biofilm formation of KPC producing strain 1825971. Interestingly, the peptide DJK-6 was able to enhance, by at least 16-fold, the ability of meropenem to eradicate pre-formed biofilms formed by this strain. Although, this combination between meropenem, DJK-6 was effective in vitro, any reduction of bacterial load was observed in murine lung model of infection. Similarly, the peptides HHC-10, IDR-1018 e IDR-1002 was effective in vitro, but ineffective in vivo. The results in vivo, using the peptides HHC-10 and IDR-1018 after infection were contrasting (significant reduction or non-reduction of bacterial load) between two models of lung infection. Others approaches using the peptides IDR-1018 prophylactically or the peptide IDR-1002 (effective in inhibit bacterial growth) before the induction of the infection, as a preventive approach or IDR-1002 (peptide that reduced the bacterial counts in vitro) after infection, also was unable to reduce the bacterial load in lungs of mice. Despite ineffective in acute model of lung infection, the use of cationic peptides, such DJK-6, to potentiate the activity of β-lactams including meropenem, represents a promising strategy to prevent biofilm formation or eliminate existent biofilms both in medical devices and in body surfaces.
LISTA DE ILUSTRAÇÕES
Figura 1- Micrografia de escaneamento eletrônico, mostrando um isolado de K. pneumoniae resistente a carbapenem interagindo com uma célula branca humana. Crédito: National Institute of Allergy and Infectious Diseases, National Institute of Health (NIH), Estados Unidos (Dsiponível em: http://directorsblog.nih.gov/2014/09/18/new-strategies-in-battle-against-antibiotic-resistance/) ... 16 Figura 2- Epidemiologia de bactérias produtoras da enzima K. pneumoniae carbapenemase
(adaptado de MUNOZ-PRICE et al., 2013). ... 18 Figura 3- Aspectos envolvidos no desenvolvimento de biofilmes. Gradiente de cores na seta
(de preto para branco), corresponde ao decréscimo de nutrientes ou de oxigênio no biofilme. ... 19 Figura 4 - Biofilmes clinicamente relevantes associados a doenças. (a) Lugares frequentes onde
ocorre infecções relacionadas a biofilmes em dispositivos médicos e em tecidos macios. (b) Infecção na articulação periprostética no joelho com uma ferida aberta. (c) Infecção periprostética das articulações do joelho com prótese exposta. (d) Catéter venoso central causando infecção sanguínea. (e) Catéter urinário com uma infecção relacionada ao entupimento do cateter. (f) Comunidade bacteriana intracelular formada por Escherichia coli isolado de urina humana em modelo murino. (g) Úlcera no pé infectado. (h) Biofilme formado por P. aeruginosa em pulmão com fibrose cística consiste de grupos de células não aderidas ao epitélio (adaptado de RÖMLING et al., 2014). ... 22 Figura 5. Abordagens utilizadas para prevenir a formação de biofilmes ou alvejar biofilmes
Figura 10 - Determinação do inóculo infectante de K. pneumoniae1825971 em camundongos C57/BL6 através do modelo de infecção pulmonar II. Os animais foram infectados por via intranasal com K. pneumoniae. Após 24 h do tratamento, os animais foram sacrificados e citocinas foram dosadas nos pulmões e no sangue. Terapias em dose única foram iniciadas 3 h após a indução da pneumonia. Os animais (4 camundongos / grupo) foram tratados por instilação com os peptídeos ou água estéril (controle de crescimento). Análises estatísticas consistiram de análise de variância de um fator com pós-teste de Bonferroni (*, P<0,05; **, P<0,01; ***, P<0,001; relativo ao controle não tratado). ... 53 Figura 11 - Efeito de DJK-6 e meropenem em modelo murino de infecção. Camundongos
C57/BL6 foram infectados com 30 L da suspensão de K. pneumoniae KPC 1825971 e tratados 3h após a infecção. Animais foram tratados com 30 L da suspensão bacteriana através da rota intranasal. A, Uso de 8 mg. Kg-1 de meropenem. B, uso de 20 mg. Kg-1 . Análises estatísticas foram desenvolvidas através da análise de variância (ANOVA) seguida pelo teste Bonferroni para comparação das médias. ... 54 Figura 12 - Atividade hemolítica dos peptídeos HHC-10, IDR-1018 sobre eritrócitos humanos.
As barras representam desvio padrão. Triton-X (1%) representa o controle positivo, representando 100% de lise celular e tampão fosfato (0,01M, pH 7,4) foi usado como controle negativo. Indolicidina foi usado como controle positivo de atividade hemolítica. ... 56 Figura 13 - Concentração de bactérias nos pulmões de camundongos BALB/c. Os animais
foram infectados por via intranasal com K. pneumoniae (1X108 UFC por camundongo). Após 24 h do tratamento, os animais foram sacrificados e citocinas foram dosadas nos pulmões e no sangue. Terapias em dose única foram iniciadas 3 h após a indução da pneumonia. Os animais (5 camundongos / grupo) foram tratados por instilação intranasal com salina (0,9%), tobramicina (12 mg.Kg-1) HHC-10 (4,75 mg.kg-1, 9,5 mg.kg-) e IDR-1018 (4,75 mg.kg-1, 9,5 mg.kg-1). A, uso de HHC-10 a 4,75 mg.Kg-1; B, uso de HHC-10 a 9,5 mg.Kg-1; C, uso de IDR-1018 a 4,75 mg.Kg-1; uso de IDR-1018 a 9,5 mg.Kg-1. Análises estatísticas consistiram de análise de variância de um fator com pós-teste de Bonferroni (*, P<0,05; **, P<0,01; ***, P<0,001; relativo ao controle não tratado). ... 57 Figura 14. Níveis IL-6 homogenato dos pulmões de camundongos BALB/c. Os animais foram
infectados por via intranasal com K. pneumoniae (1X108 UFC por camundongo). Após 24 h do tratamento os animais foram sacrificados e citocinas foram dosadas nos pulmões. Terapias em dose única foram iniciadas 3 h após a indução da pneumonia. Os animais (5 camundongos / grupo) foram tratados por instilação intranasal com salina (0,9%), tobramicina (10 mg.Kg-1) HHC-10 (4 mg.Kg-1, 8 mg.Kg-1 ou 16 mg.Kg-1) e IDR-1018 (4 mg.Kg-1, 8 mg.Kg-1 ou 16 mg.Kg-1). A, uso de HHC-10 a 4,75 mg.Kg-1; B, uso de HHC-10 a 9,5 mg.Kg-1; C, uso de IDR-1018 a 4,75 mg.Kg-1; uso de IDR-1018 a 9,5 mg.Kg-1. Análises estatísticas consistiram de análise de variância de um fator com pós-teste de Bonferroni (*, P<0,05; **, P<0,01; ***, P<0,001; relativo ao controle não tratado). ... 58 Figura 15 - Níveis IL-6 no soro de camundongos BALB/c. Os animais foram infectados por via
Figura 16 -Níveis de TNF-α no pulmão de camundongos BALB/c. Os animais foram infectados por via intranasal com K. pneumoniae (1X108 UFC por camundongo). Após 24 h tratamento, os animais foram sacrificados e citocinas foram dosadas nos pulmões. Terapias em dose única foram iniciadas 3 h após a indução da pneumonia. Os animais (5 camundongos / grupo) foram tratados por instilação intranasal com solução salina (0,9%), tobramicina (10 mg.Kg-1) HHC-10 (4 mg.Kg-1, 8 mg.kg-1 ou 16 mg.Kg-1) e IDR-1018 (4 mg.Kg-1, 8 mg.kg-1 ou 16 mg.Kg-1). A, uso de HHC-10 a 4,75 mg.Kg-1; B, uso de HHC-10 a 9,5 mg.Kg-1; C, uso de IDR-1018 a 4,75 mg.Kg-1; uso de IDR-1018 a 9,5 mg.Kg-1. Análises estatísticas consistiram de análise de variância de um fator com pós-teste de Bonferroni (*, P<0,05; **, P<0,01; ***, P<0,001; relativo ao controle não tratado). ... 60 Figura 17–Avaliação dos peptídeos HHC-10 e IDR-1018 em modelo murino de infecção.
Camundongos BALB/c foram infectados com 30 L da suspensão de K. pneumoniae ATCC 13883 e tratados 3h após a infecção. Animais foram tratados com 30 L da suspensão bacteriana através da rota intransal. Análises estatísticas consistiram de análise de variância de um fator com pós-teste de Bonferroni (*, P<0,05; **, P<0,01; ***, P<0,001; relativo ao controle não tratado). ... 61 Figura 18 - Efeito do peptídeo IDR-1018 em modelo murino de infecção. Camundongos
C57/BL6 foram infectados com 30 L da suspensão de K. pneumoniae ATCC 13883 e tratados 3 h após a infecção. (A) Animais foram tratados com 30 L da suspensão bacteriana através da rota intranasal. (B) Animais foram tratados com 250 μL da suspensão bacteriana através da rota intravenosa. Análises estatísticas foram desenvolvidas através da análise de variância (ANOVA) seguida pelo teste Bonferroni para comparação das médias. ... 62 Figura 19. Efeito do peptídeo IDR-1018 e IDR-1002 em modelo murino de infecção.
LISTA DE TABELAS
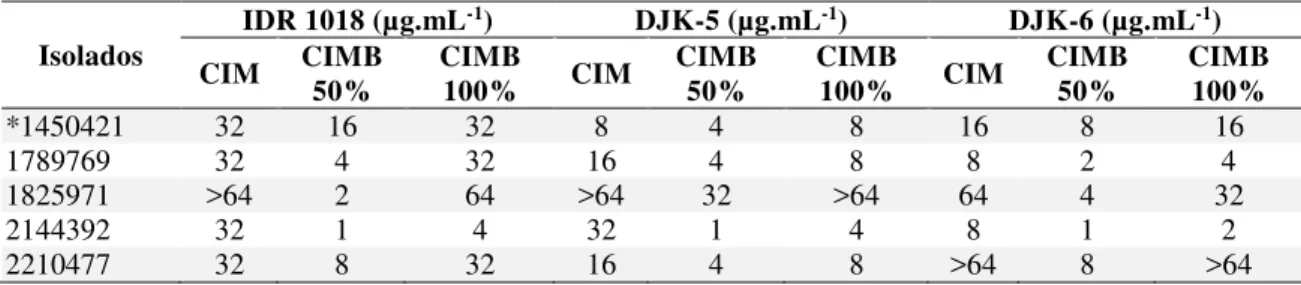
Tabela 1 – Peptídeos catiônicos sintéticos usados nesse trabalho ... 34 Tabela 2- Susceptibilidade de isolados de KP-KPC a diferentes antibióticos. CIM
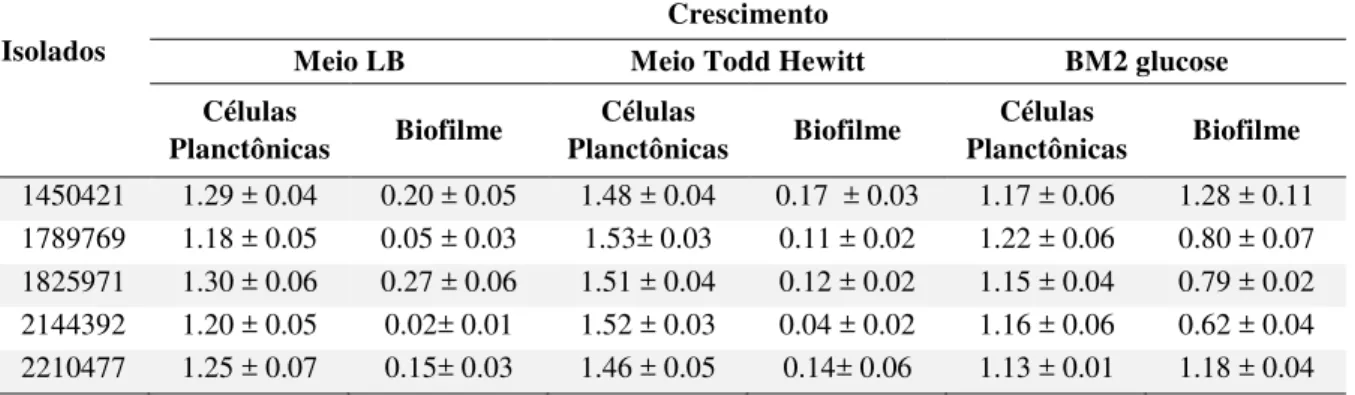
(Concentração Inibitória Mínima). S, suscetível; R, resistente e I, intermediário. ... 43 Tabela 3 - Avaliação da formação de biofilmes de isolados KP-KPC em diferentes meios. Os
ensaios foram desenvolvidos em microplacas de 96 poços. O crescimento das células planctônicas foi medido a 600 nm e de biofilmes a 595 nm. Os números em parênteses representam o desvio padrão. ... 44 Tabela 4 - Triagens de diferentes peptídeos antimicrobianos contra KP-KPC 1450421. CIM
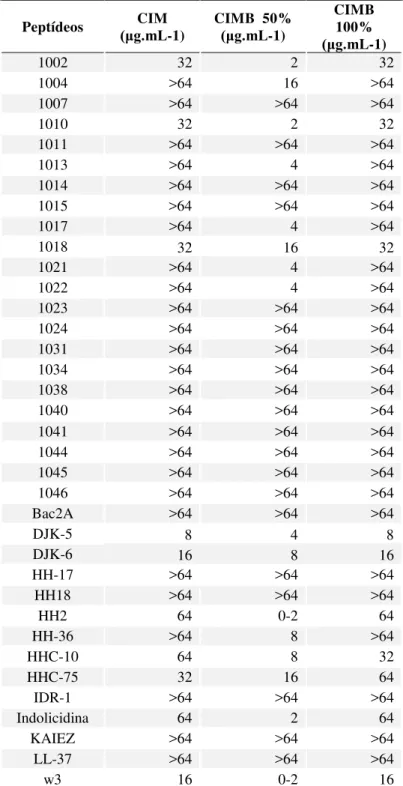
(Concentração Inibitória Mínima), CIMB (Concentração Inibitória Mínima de Biofilmes) para prevenir 50% ou 100% da formação de biofilmes... 45 Tabela 5 - Avaliação da atividade antimicrobiana de peptídeos para prevenir o crescimento
planctônico e a formação de biofilmes de isolados de KP-KPC em ensaios realizados em microplacas. CIM (Concentração Inibitória Mínima), MIBIC (Concentração Inibitória Mínima de Biofilmes) para prevenir 50% ou 100% da formação de biofilmes. ... 46 Tabela 6. Avaliação da atividade antimicrobiana de peptídeos para prevenir o crescimento de
células planctônicas e de biofilmes de KP-KPC 1825971 em ensaios de microplaca e o efeito da combinação entre o peptídeo DJK-6 e antibióticos convencionais. Índice de concentração inibitória fracionada (ICIF). Nota: Nesses experimentos, a concentração para inibir o crescimento das células planctônicas e para prevenir a formação de biofilmes foi a mesma. Sin, sinergia; Ind, indiferente. ... 49 Tabela 7 – Avaliação da atividade antimicrobiana dos peptídeos HHC-10, 1018 e IDR-1002 contra cepas de K. pneumoniae. (-) não testado. ... 55 Tabela 8 - Avalição da combinação entre HCC-10 e IDR-1018. Índice de concentração
SUMÁRIO
1 INTRODUÇÃO ... 14
2 REVISÃO DE LITERATURA ... 16
2.1 O PATÓGENO KLEBSIELLA PNEUMONIAE ... 16
2.2 BIOFILMES E INFECÇÕES ... 19
2.2.1 Perfil de biofilmes formados por K. pneumoniae ... 23
2.2.2 Papel dos fatores ambientais na formação de biofilmes de K. pneumoniae ... 24
2.3 BIOFILMES: MECANISMOS DE RESISTÊNCIA E TOLERÂNCIA A ANTIMICROBIANOS ... 25
2.3.1 K. pneumoniae e resistência de biofilmes a antimicrobianos ... 27
2.4 ESTRATÉGIAS PARA PREVENIR OU COMBATER BIOFILMES ... 28
2.5 ESTRATÉGIAS ANTIBIOFILME BASEADA EM PEPTIDEOS ... 29
3 MATERIAL E MÉTODOS ... 33
3.1 CEPAS BACTERIANAS ... 33
3.2 SÍNTESE DE PEPTÍDEOS ... 33
3.3 SUSCEPTIBILIDADE DE ISOLADOS CLÍNICOS DE K. PNEUMONIAE A ANTIBIÓTICOS, TRIAGEM DE CARBAPENEMASES E DETECÇÃO DE GENES DE BLAKPC ... 35
3.4 FORMAÇÃO DE BIOFILMES E CONCENTRAÇÃO INIBITÓRIA MÍNIMA DE CÉLULAS PLANCTÔNICAS E BIOFILMES ... 35
3.5 ENSAIOS DE SINERGISMO ENTRE PEPTÍDEOS E ANTIBIÓTICOS EM MICROPLACA ... 36
3.6 AVALIAÇÃO DA ATIVIDADE ANTIBIOFILME DE PEPTÍDEOS CATIÔNICOS SOBRE BIOFILME PRÉ-FORMADOS ... 36
3.7 ENSAIOS DE DISPERSÃO DE BACTÉRIAS A PARTIR DE BIOFILMES ... 37
3.8 DETERMINAÇÃO DA CONCENTRAÇÃO INIBITÓRIA MÍNIMA DE PEPTÍDEOS HHC-10 e 1018 CONTRA K. PNEUMONIAE ATCC 13883 ... 37
3.9 AVALIAÇÃO DO EFEITO COMBINADO ENTRE PEPTÍDEOSHHC-10 E IDR-1018 CONTRA K. PNEUMONIAE ATCC 13883 ... 38
3.10 ENSAIO HEMOLÍTICO ... 38
3.11 MODELO MURINO DE INFECÇÃO PULMONAR ... 39
3.11.1 Modelo de infecção pulmonar I ... 39
3.11.2 Dosagem de citocinas ... 40
3.11.3 Modelo de infecção pulmonar II ... 40
3.11.4 Análises estatísticas ... 41
4 RESULTADOS ... 42
4.1 AVALIAÇÃO DE PEPTÍDEOS ANTIMICROBIANOS SOZINHOS OU COMBINADOS CONTRA BIOFILMES FORMADOS POR K. PNEUMONIAE RESISTENTE A CARBAPENENS ... 42
4.1.1 Susceptibilidade de K. pneumoniae produtoras de KPC a múltiplos antibióticos e avaliação da formação de biofilmes em diferentes meios ... 42
Antibiótico ... 43
4.1.2 Efeito de pequenos peptídeos catiônicos na prevenção e erradicação de biofilmes
de KP-KPC ... 44
4.1.3 Estudos de sinergia para prevenir ou erradicar biofilmes de KP-KPC ... 48
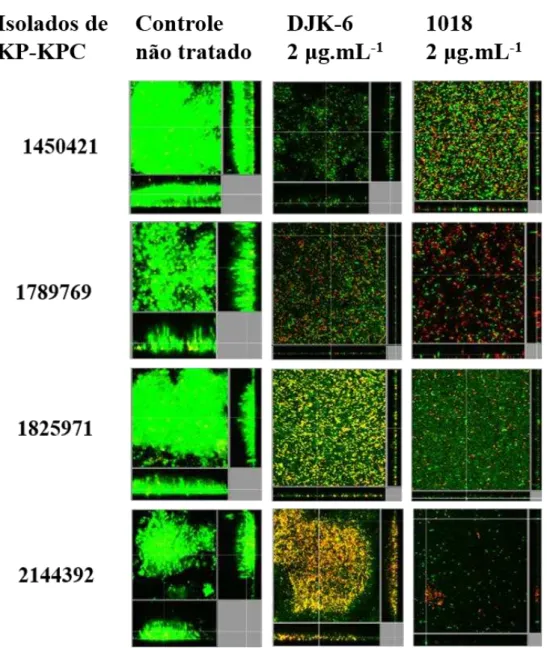
4.1.4 Estudos de dispersão de bactérias a partir de biofilmes ... 52
4.1.5 Avalição in vivo dos efeitos da combinação do peptídeo DJK-6 e meropenem ... 53
4.2 AVALIAÇÃO DE PEPTÍDEOS CATIÔNICOS HHC-10, IDR-1018 E 1002 CONTRA K. PNEUMONIAE ... 55
4.2.1 Atividade antimicrobiana de HHC-10, IDR-1018 e IDR-1002 contra K. pneumoniae susceptível e resistente a carbapenem ... 55
4.2.2 Atividade Hemolítica de HHC-10 e IDR 1018 ... 56
4.2.3 Avaliação do efeito dos peptídeos HHC-10 e IDR-1018 no tratamento de infecção pulmonar (modelo I) em camundongos BALB/c infectados com K. pneumoniae ATCC 13883 56 4.2.4 Avaliação do efeito dos peptídeos HHC-10 e IDR-1018 na modulação da resposta imune em camundongos BALB/c infectados (infecção pulmonar, modelo I) com K. pneumoniae ATCC 13883 ... 57
4.2.5 Avaliação do efeito dos peptídeos HHC-10 e IDR-1018 no tratamento de infecção pulmonar (modelo II) em camundongos BALB/c infectados com K. pneumoniae ATCC 13883 61 4.2.6 Avaliação do efeito protetor de IDR-1018 em camundongos BALB/c infectados K. pneumoniae ATCC 13883 em modelo de infecção pulmonar (Modelo II) ... 62
4.2.7 Avaliação do efeito do IDR-1018 e IDR-1002 no tratamento de infecção pulmonar (modelo II) em camundongos Black C57BL6 infectados com K. pneumoniae KPC 1825971 ... 63
5 DISCUSSÃO ... 64
6 CONCLUSÃO GERAL E PERSPECTIVAS ... 70
7 REFERÊNCIAS ... 71
APÊNDICES ... 81
Apêndice A: Capítulos de livros ... 81
Apêndice B: Artigos publicados ... 85
1 INTRODUÇÃO
Klebsiella pneumoniae consiste é uma bactéria Gram negativa, encapsulada, oportunista, membro da família Enterobacteriaceae (PODSCHUN; ULLMANN, 1998) que tem se tornado causa significante de diferentes infecções, incluindo meningite, pneumonia, infecção sistêmica e urinária (DAI et al., 2014; PAGANO et al., 2014; PODSCHUN; ULLMANN, 1998; TUON et al., 2013; WALKER et al., 2013). Casos fatais associados a essa espécie são altos (>50%) entre pacientes com infecções sistêmicas (ABRAHAM BORER et al., 2009; GOPI PATEL et al., 2008; SNITKIN et al., 2012). O tratamento dessas infecções pode ser difícil, uma vez que as bactérias produtoras da enzima KPC (K. pneumoniae carbapenemase) são resistentes a
antibióticos β-lactâmicos, incluindo carbapenens, os quais são considerados antibióticos de
última geração (MCKENNA, 2013). Adicionalmente, essas bactérias são frequentemente resistentes a outros antibióticos. Como consequência da resistência, falhas no tratamento de infecções se tornam frequentes, contribuindo assim para aumento das taxas de morbidade e mortalidade (ABRAHAM BORER et al., 2009; GASINK et al., 2009; QURESHI et al., 2012). A tigeciclina e polimixinas (polimixna B e colistina) são as opções disponíveis contra cepas produtoras de carbapenemase (HIRSCH; TAM, 2010). Entretanto já foram identificadas cepas de K. pneumoniae resistentes a esses antibióticos (KONTOPOULOU et al., 2010; SPANU et al., 2012).
pública, a maioria das pesquisas está centrada no desenvolvimento de agentes antimicrobianos para inibir bactérias planctônicas. Assim, é essencial explorar novos paradigmas para terapia antimicrobiana e antibiofilme contra patógenos resistentes a antibióticos.
Peptídeos catiônicos representam um conceito promissor, uma vez que muitos deles têm mostrado efetividade antimicrobiana, antibiofilme e imunomodulatória. Esses compostos têm emergido recentemente como um tratamento antibiótico alternativo a bactérias resistentes a antibióticos (MANSOUR; PENA; HANCOCK, 2014). Alguns desses peptídeos, tal como o 1018, podem atuar na defesa do hospedeiro como agentes imunomoduladores, apresentando propriedades curativas de feridas, anti-infecciosas e anti-inflamatórias, independentemente da atividade antimicrobiana direta (MANSOUR; PENA; HANCOCK, 2014). Recentemente, foi observado que alguns peptídeos catiônicos anfipáticos podem prevenir e/ou erradicar biofilmes bacterianos de uma maneira independente da atividade antimicrobiana direta contra bactérias planctônicas (DE LA FUENTE-NÚÑEZ et al., 2012, 2014b; OVERHAGE et al., 2008). Um estudo subsequente demonstrou que um peptídeo antibiofilme apresentava habilidade em agir sinergicamente com vários antibióticos disponíveis no mercado, revelando-se assim, como uma nova abordagem para potencialização de antibióticos contra biofilmes bacterianos (REFFUVEILLE et al., 2014). Interessantemente, tem se observado que alguns peptídeos que são ineficientes como antimicrobianos são potentes antibiofilmes. Baseado nesses estudos, nós hipotetizamos que os peptídeos catiônicos formariam a base para novas terapias antimicrobianas ou antibiofilmes que seriam efetivas sozinhas ou em combinação com antibióticos convencionais contra K. pneumoniae, susceptível ou resistente a carbapenens. Diante disso, nosso objetivo geral foi avaliar a efetividade de peptídeos catiônicos sozinhos
ou combinados com outros antimicrobianos (antibióticos ou peptídeos) contra K. pneumoniae em experimentos in vitro e in vivo. Nossos objetivos específicos consistiram
em: (i) avaliar a formação de biofilmes por K. pneumoniae resistentes a carbapenens; (ii)
2 REVISÃO DE LITERATURA
2.1 O PATÓGENO KLEBSIELLA PNEUMONIAE
Klebsiella pneumoniae (Enterobacteriaceae) é um patógeno oportunista, associado a
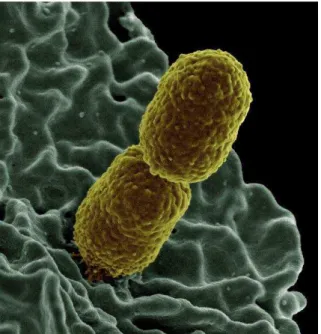
numerosos casos de infecções em todo o mundo, incluindo infecções sanguíneas, meningite, infecção pulmonar e infecção no sistema urinário. K. pneumoniae é uma bactéria Gram-negativa em forma de bastonete, encapsulada e que não apresenta motilidade (Figura 1). O gênero Klebsiella, foi nomeado por Trevisan (1985) em homenagem ao microbiologista alemão Edwin Klebs (BRISSE, 2006). Essa bactéria foi descrita por Friedländer em 1982 no pulmão de um paciente que morreu de pneumonia (BRISSE, 2006). K. pneumoniae pode ser encontrada em uma variedade de ambientes, como água, solo, plantas e superfícies mucosas de mamíferos (BRISSE, 2006). Em humanos, K. pneumoniae é considerada habitante comensal inofensivo da microbiota intestinal, mas em situações nas quais o sistema imune encontra-se enfraquecido, ela pode se tornar oportunista e causar infecções (BOLL et al., 2012; GUO et al., 2012).
Figura 1- Micrografia de escaneamento eletrônico, mostrando um isolado de K. pneumoniae resistente a
K. pneumoniae, juntamente com outras poucas bactérias, tem sido reconhecida como um patógeno do grupo “ESKAPE” (Enterococcus faecium, Staphylococcus aureus, Klebsiella
pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa e Enterobacter spp.),
acrônimo que se refere ao verbo da língua inglesa “escape”, significando que essas bactérias
frequentemente “escapam” da ação dos antibióticos. Uma preocupação particular reside entre
aquelas bactérias resistentes a carbapenens, conhecidos como antibióticos de último recurso. A emergência de β-lactamases de amplo espectro (enzimas que conferem resistência a vários antibióticos β-lactâmicos) impôs uma grande preocupação para tratar infecções causadas por K. pneumoniae (PATERSON; BONOMO, 2005). Inicialmente, muitas estipes de K.
pneumoniae produtoras de β-lactamases de espectro estendido permaneceram susceptíveis a
combinação de antibióticos β-lactâmicos e inibidores de β-lactamases, mas posteriormente,
cepas resistentes a essas opções de tratamento foram selecionadas (PATERSON; BONOMO, 2005). Nesse período carbapenens eram a escolha mais apropriada para tratar as bactérias resistentes (ARNOLD et al., 2011). Entretanto, as mesmas se tornaram também resistentes a esses antibióticos, e hoje, as opções para tratar infecções causadas principalmente por bactérias Gram-negativas são limitadas.
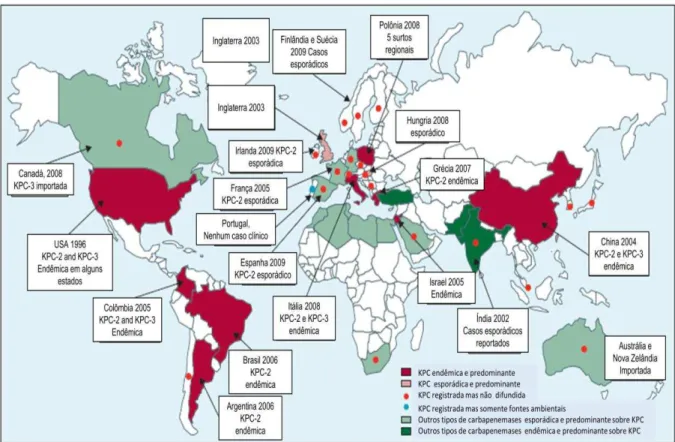
Atualmente, resistência a carbapenem, especialmente devido à enzima K. pneumoniae carbapenemase (KPC) é considerada como uma ameaça para a população mundial (ROBILOTTI; DERESINSKI, 2014). Essa enzima recebeu tal nome porque foi primeiramente encontrada em K. pneumoniae (ROBILOTTI; DERESINSKI, 2014). Mas hoje, KPC tem sido descrita em várias Enterobacteriaceas e em outras bactérias Gram-negativas, incluindo membros do grupo ESKAPE como P. aeruginosa (JÁCOME et al., 2012; POIREL et al., 2010) e A. baumannii (ROBLEDO et al., 2010).
essa enzima, blaKPC, atualmente está presente em todos os continentes. (MUNOZ-PRICE et al., 2013). Diferentes tipos de enzimas carbapenemases podem conferir resistência a antibióticos β-lactâmicos. Em alguns países como os Estados Unidos, Brasil, Argentina, Colômbia, China, Israel e Grécia a enzima KPC-2 é considerada endêmica e predominante (MUNOZ-PRICE et al., 2013) (Figura 2). Infelizmente, a luta contra tais bactérias resistentes pode ser difícil e pode se tornar pior, considerando que bactérias resistentes aos antibióticos podem formar biofilmes, uma forma de vida resistente (PRADEEP KUMAR; EASWER; MAYA NANDKUMAR, 2013).
Figura 2- Epidemiologia de bactérias produtoras da enzima K. pneumoniae carbapenemase (MUNOZ-PRICE et
2.2 BIOFILMES E INFECÇÕES
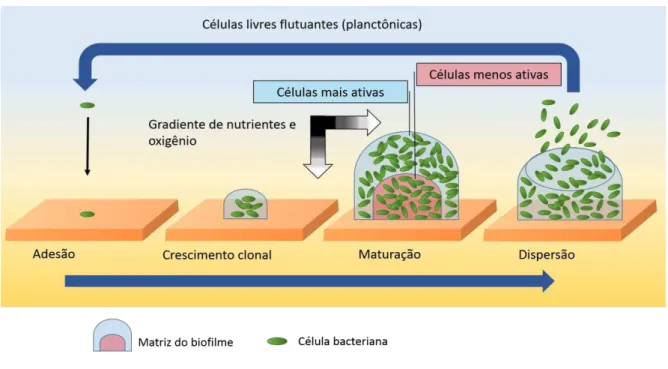
Biofilmes consistem em uma complexa comunidade de microrganismos cercados por uma matriz de polissacarídeos, DNA extracelular e proteínas. Eles podem se formar através da fixação de células em superfícies sólidas ou em cultura líquida (BJARNSHOLT et al., 2013; SCHLEHECK et al., 2009). Após o desenvolvimento do biofilme, células que constituem o mesmo, podem se dispersar para colonizar outros ambientes e assim, construir novas comunidades de biofilmes (Figura 2).
Figura 3-Aspectos envolvidos no desenvolvimento de biofilmes. Gradiente de cores na seta (de preto para branco), corresponde ao decréscimo de nutrientes ou de oxigênio no biofilme.
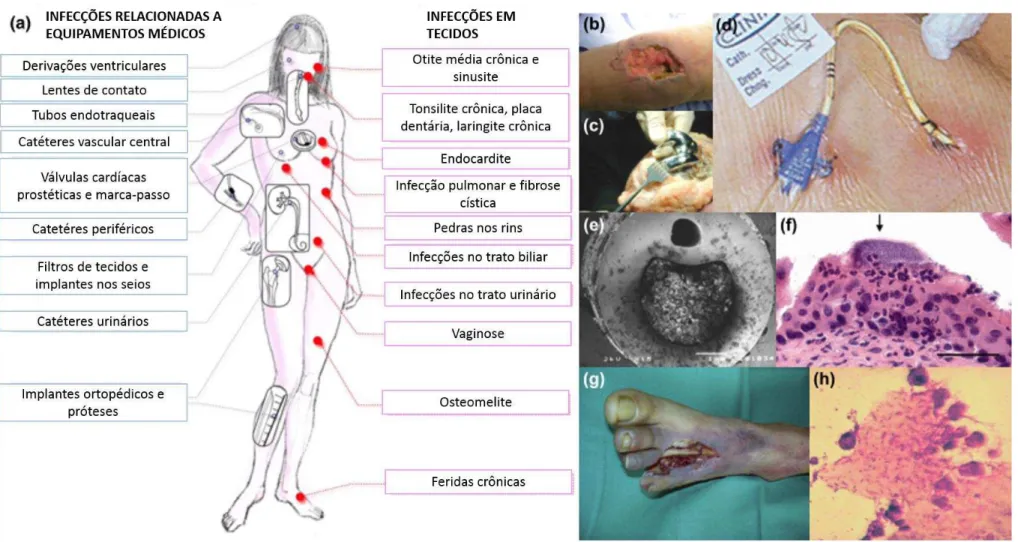
planctônico. Biofilmes apresentam ocorrência universal, podendo se formar em qualquer ambiente — desde superfícies de uma rocha presente em um rio, tubulações de sistema de distribuição de água, equipamentos médicos até superfícies do corpo humano (Figura 4) (LAPPIN-SCOTT; BURTON; STOODLEY, 2014).
Biofilmes podem crescer em qualquer parte do corpo humano, como por exemplo, dentes, pulmões, feridas e sistema urinário. Eles também podem crescer em equipamentos médicos, como catéteres, tubos endotraqueais, implantes (HØIBY et al., 2011), representando uma potencial fonte de infecção (Figura 4). Observações têm mostrado que muitas infecções recorrentes entre pacientes que requerem o uso de catetéres urinários, por exemplo, são devido à formação de biofilmes nos mesmos.
Esse perfil bacteriano tem sido associado a infecções crônicas devido sua aumentada resistência a antibióticos, desinfetantes e componentes do sistema de defesa do organismo hospedeiro (HØIBY et al., 2010). Estudos têm mostrado que células em biofilmes podem ser até 1000 vezes ou mais resistentes aos antibióticos em relação a células em suspensão (CERCA et al., 2005). Normalmente, altas doses de antibióticos são requeridas para destruir biofilmes.
Por exemplo, 5000 μg. mL-1 de ampicilina mostrou-se capaz de matar rapidamente células
planctônicas de K. pneumoniae, entretanto essa mesma concentração foi incapaz de causar qualquer dano no biofilme formado por essa bactéria (ANDERL; FRANKLIN; STEWART, 2000).
(BJARNSHOLT, 2013a). Normalmente para tratar infecções crônicas, altas doses de antibióticos são requeridas, implicando em maior possibilidade de efeitos tóxicos em decorrência da terapia antimicrobiana.
Figura 4 - Biofilmes clinicamente relevantes associados a doenças. (a) Lugares frequentes onde ocorre infecções relacionadas a biofilmes em dispositivos médicos e em tecidos macios. (b) Infecção na articulação periprostética no joelho com uma ferida aberta. (c) Infecção periprostética das articulações do joelho com prótese exposta. (d) Catéter venoso central causando infecção sanguínea. (e) Catéter urinário com uma infecção relacionada ao entupimento do cateter. (f) Comunidade bacteriana intracelular formada por
2.2.1 Perfil de biofilmes formados por K. pneumoniae
Biofilmes formados por K. pneumoniae são considerados um problema particular em ambientes médicos. Eles têm sido encontrados colonizando equipamento, especialmente catéteres urinários (CHATTERJEE et al., 2014) e tubos endotraqueais (SONG et al., 2013). Espécies de Klebsiella têm sido encontradas como dominantes em biofilmes derivados de tubos endotraqueais de recém-nascidos intubados (SONG et al., 2013). Estudos com isolados provenientes de diversas fontes de infecções tem mostrado habilidade para crescer como biofilme em experimentos in vitro (BANDEIRA et al., 2014; NAPARSTEK et al., 2014) e in
vivo (CHEN et al., 2014), confirmando assim o potencial dessa bactéria formar biofilme
infeccioso.
Tem sido observado que biofilmes de K. pneumoniae se desenvolvem por crescimento clonal e não pelo recrutamento de células planctônicas. Experimentos de competição (através de isolados corados com corantes amarelo ou azul, misturados na mesma razão) mostraram que biofilmes de K. pneumoniae consistia de células coradas com amarelo ou com azul e não com uma mistura dessas duas células (que seria esperado se células planctônicas fossem recrutadas para formar biofilmes) (SCHROLL et al., 2010).
Estudos têm mostrado que biofilmes formados por K. pneumoniae são heterogêneos (Figura 3). Bactérias em áreas mais periféricas são mais ativas que aquelas situadas no meio do biofilme (SINGLA; HARJAI; CHHIBBER, 2014; WENTLAND et al., 1996). Acredita-se que esse perfil, comum em outras espécies, possa ser resultado da expressão gênica diferencial em reposta as condições ambientais que circundam o biofilme e as células dentro do mesmo (MCDOUGALD et al., 2012) ou também possa ser consequência de mutações as quais podem conferir diferenças genotípicas e fenotípicas entre células do biofilme (MCDOUGALD et al., 2012).
2.2.2 Papel dos fatores ambientais na formação de biofilmes de K. pneumoniae
Diferente de muitos outros microrganismos patogênicos, K. pneumoniae são onipresentes na natureza. Essa bactéria tem sido encontrada em diversos ambientes, incluindo corpo humano e animal, plantas (PALUS et al., 1996), esgoto (PRADO et al., 2008), águas de superfície (PODSCHUN et al., 2001) e muitos outros. Acerca das interações sociais, K. pneumoniae pode coexistir com outros organismos através de interações harmônicas (como comensal, regulando o sistema imune) (LAU; HUFFNAGLE; MOORE, 2008; LITTMAN; PAMER, 2011) ou através de interações desarmônicas (como patógenos, causando infecções) (KANEVSKY-MULLARKY et al., 2014; KIM et al., 2014; QURESHI et al., 2014; TUGAL et al., 2014). Para crescer e viver como biofilme nessas condições, K. pneumoniae conta provavelmente com várias estratégias que permitem essas bactérias se fixarem em superfícies, se protegerem contra estresses ambientais (como ataque da resposta imune do hospedeiro, dessecação e variação de temperatura e pH) e competir com outros microrganismos por recursos. Uma vez que biofilmes são associados a infecções em humanos e animais, a compreensão de como K. pneumoniae responde a esses fatores, poderia trazer informações como prevenir ou alvejar a formação de biofilme por essa bactéria.
Em relação à formação de biofilmes, tem sido observado que o meio e o substrato podem influenciar a produção de componentes extracelulares e a densidade de biofilmes formados por K. pneumoniae. Estudos mostraram que a fímbrias do tipo 1 apresentaram regulação descendente, em células do isolado K. pneumoniae C3091 formando biofilmes e crescendo em meio FAB sobre lamínulas de borosilicato (SCHROLL et al., 2010). Entretanto, outros estudos mostraram que esse mesmo isolado, crescendo em urina sobre catéteres urinários foi capaz de produzir fímbria tipo 1 (STAHLHUT et al., 2012). Embora houvesse diferença experimental entre esses dois trabalhos, é possível que meio e substrato exibissem um importante papel na expressão da fímbria tipo 1. A composição da urina poderia ter promovido a adesão da fímbria tipo 1 no cateter urinário
Diferenças no meio de crescimento também podem influenciar a produção de biomassa de biofilmes bacterianos. Investigações mostraram que K. pneumoniae produziu uma biomassa maior de biofilmes em meio LB suplementado com NaCl do que em LB suplementado com 0,4% de glicose, 0,4% de caso-aminoácidos (CHEN et al., 2014a). Esses estudos também mostraram que concentrações de sais de bile entre 0,8 e 1 % induzem a produção de uma maior biomassa (aproximadamente 2 unidades de absorbância a densidade ótica de 550/595 nm) de biofilmes em comparação com baixas concentrações desses sais (que entre 0-0,4% apresenta cerca de 0,5-1,0 unidades de absorbância a densidade ótica de 550/5595 nm).
2.3 BIOFILMES: MECANISMOS DE RESISTÊNCIA E TOLERÂNCIA A
ANTIMICROBIANOS
Múltiplos fatores estão envolvidos na resistência ou tolerância de biofilmes a antimicrobianos. Biofilmes podem apresentar mecanismos de tolerância física, fisiológica e adaptativa, os quais permitem a sobrevivência dos mesmos a agentes antimicrobianos, por um longo tempo de exposição. Adicionalmente, mecanismos envolvendo resistência convencional a antibióticos, tais como inativação ou modificação de antimicrobianos, alteração de alvos, aos quais os antibióticos se ligam e aumento da atividade de bomba de efluxo (a qual elimina o antibiótico da célula bacteriana) podem somar para dificultar a eliminação de biofilmes por agentes antimicrobianos (BJARNSHOLT et al., 2013).
A tolerância física se deve a matriz que constitui o biofilme bem como a sua estrutura tridimensional. A entrada de antimicrobianos pode ser limitada com o aumento de biomassa de biofilmes. Entretanto, acredita-se que a matriz do biofilme impeça a difusão de antimicrobianos apenas por um curto tempo de exposição a antibióticos. Assim, em longos períodos de exposição, a barreira proporcionada pela matriz não apresentaria efeito substancial na proteção de biofilmes (STEWART, 1996; WALTERS et al., 2003).
A tolerância fisiológica é determinada pelo estado metabólico da bactéria. À medida que a biomassa de biofilme aumenta, células que se localizam nas regiões mais internas passam a ter menos acesso a oxigênio e nutrientes, afetando a atividade metabólica dessas células (MCDOUGALD et al., 2012). Como consequência, biofilmes podem apresentar populações heterogêneas de microrganismos: aquelas que crescem aerobicamente, aquelas que crescem anaerobicamente e aquelas que são dormentes. Alguns antibióticos, como aminoglicosideos,
fluoroquinilonas e β-lactâmicos, não funcionam bem em condições hipóxicas (baixo teor de
et al., 2003) e por isso, somente são capazes de afetar células microbianas que se encontram na periferia de biofilmes. Antibióticos como ciprofloxacina e tetraciclina, são capazes de matar células bacterianas que são mais metabolicamente ativas, normalmente encontradas na periferia de biofilmes. Em contrapartida, colistina age melhor sobre células menos metabolicamente ativas, as quais são encontradas no interior do biofilme (PAMP et al., 2008).
A tolerância adaptativa pode conferir resistência temporária a antibióticos (podendo mudar de acordo com a exposição a antibióticos) (MCDOUGALD et al., 2012). Populações de bactérias no biofilme podem responder diferencialmente a presença de antibióticos no biofilme. Esse tipo de tolerância pode ser específica ou não específica a um grupo particular de antibiótico. Como exemplo de tolerância específica, pode ser citado a indução da transcrição de genes codificadores de β-lactamases em resposta a presença de antibióticos β-lactâmicos (BAGGE et al., 2004; DIBDIN et al., 1996). β-lactamases podem inativar β-lactâmicos, prejudicando sua difusão pelo interior do biofilme, ou mesmo mudar os padrões farmacocinéticos e farmacodinâmicos de atividade antimicrobiana (HENGZHUANG et al., 2011). Como exemplo de tolerância não específica, pode ser citado a regulação positiva de bombas de efluxo induzida por várias classes de antibióticos (BJARNSHOLT et al., 2013).
A resistência convencional pode ser conferida por mutações ou por aquisição de genes de resistência a partir de outras bactérias. Esses mecanismos podem ocorrer antes ou após a formação de biofilmes. Bactérias resistentes a antibióticos podem formar biofilmes muitos mais resistentes a antibióticos, do que bactérias susceptíveis a esses compostos. Por exemplo, isolados de K. pneumoniae resistentes a gentamicina (concentração inibitória mínima, CIM >32 μg.mL), mostrou um substancial aumento na resistência no estado de biofilme (> 234 vezes)
em comparação com isolados susceptíveis (CIM <32 μg.mL) (NAPARSTEK et al., 2014).
Estudos têm mostrado que, a taxa de mutação de bactérias em biofilmes é maior do que em bactérias crescendo planctonicamente. A mutabilidade em culturas de biofilmes de Staphylococcus aureus e S. epidermidis, por exemplo, é aumentada em 60 ou 4 vezes respectivamente quando comparado a culturas planctônicas dessas bactérias. Isso tem sido explicado pelo aumento do estresse oxidativo que pode levar a danos no DNA (RYDER;
CHOPRA; O’NEILL, 2012). A transferência de genes por conjugação em biofilmes, também
2.3.1 K. pneumoniae e resistência de biofilmes a antimicrobianos
Estudos envolvendo antibióticos têm mostrado que biofilmes de K. pneumoniae são frequentemente mais resistentes que células planctônicas (ANDERL; FRANKLIN; STEWART, 2000), que tolerância a antibiótico é mais alta em biofilmes mais velhos (SINGLA; HARJAI; CHHIBBER, 2013) e que biofilmes de isolados resistentes a antibióticos são mais tolerantes a antibióticos do que biofilmes de isolados susceptíveis (NAPARSTEK et al., 2014).
Investigações têm indicado diferentes mecanismos pelos quais biofilmes formados por K. pneumoniae resistem a antibióticos, quando comparado a sua forma planctônica. Antibióticos como ciprofloxacina e ampicilina, por exemplo, podem se difundir por biofilmes resistentes a concentrações desses antibióticos que rapidamente matam células planctônicas (ANDERL; FRANKLIN; STEWART, 2000). Acredita-se que esses antibióticos movam-se através de espaços ou canais presentes no interior do biofilme (ZAHLLER; STEWART, 2002). Embora, o biofilme como um todo, resista a esses antibióticos, células da interface de biofilmes formados por K. pneumoniae tem sua morfologia espacialmente afetada (se tornando mais longas) quando comparada ao controle (ZAHLLER; STEWART, 2002). Esses estudos indicam que a fisiologia de células bacterianas, poderia influenciar a tolerância de biofilmes a antibióticos e não a tolerância física imposta pela matriz extracelular do biofilme. Limitação de oxigênio e nutrientes poderia diminuir a atividade metabólica das bactérias e assim como observado na fase estacionária de bactérias planctônicas, células com baixa atividade poderiam apresentar uma maior tolerância a ação de antibióticos (ANDERL et al., 2003; GILBERT; COLLIER; BROWN, 1990).
2.4 ESTRATÉGIAS PARA PREVENIR OU COMBATER BIOFILMES
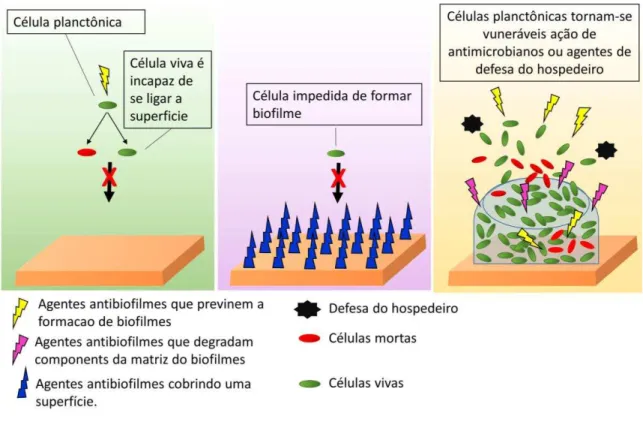
Na área clínica, combater biofilmes associados a infecções é extremamente importante. Nessa frente, duas estratégias podem ser utilizadas no combate aos mesmos, quando a remoção cirúrgica não pode ser realizada: (i) prevenir que células planctônicas formem biofilmes ou (ii) alvejar biofilmes existentes, enfraquecendo-os, desagregando-os ou matando diretamente as células do biofilme (Figura 5). A combinação dessas estratégias pode ser mais efetiva no controle de biofilmes (MCDOUGALD et al., 2012).
Prevenir que bactérias planctônicas formem biofilmes é ideal, porque é mais fácil para os antibióticos ou defesas do hospedeiro alvejar células bacterianas isoladas do que células bacterianas em biofilmes (BJARNSHOLT et al., 2013). Enquanto combater biofilmes existentes, é mais difícil, porque em alguns casos, o processo inflamatório é indetectável (BJARNSHOLT, 2013), dificultando assim, o diagnóstico precoce. Portanto, uma opção seria evitar que bactérias formem biofilmes em equipamentos médicos.
Para prevenir que células bacterianas formem biofilmes, (i) superfícies podem ser cobertas com agentes antibiofilmes ou (ii) células bacterianas planctônicas podem ser diretamente alvejadas com agentes antibiofilmes presentes no meio de cultura. Nas duas situações, os agentes antibiofilmes com propriedades antimicrobianas podem levar a morte da célula bacteriana, impedindo assim a sua fixação em superfícies (BJARNSHOLT, 2013). Enquanto a utilização de agentes antibiofilmes (apenas com propriedades antiadesivas) podem atuar, inibindo ou prejudicando estruturas ou compostos extracelulares bacterianos que permitem a sua adesão em superfícies. Uma desvantagem de materiais cobertos com antibiofilmes é que eventualmente, esses agentes podem se desprender da superfície. Além disso, materiais provenientes do hospedeiro, como por exemplo, as proteínas Tamm-Horsfall (uma proteína abundante na urina), poderia cobrir catéteres (RAFFI et al., 2012) com agentes antibiofilmes, facilitando assim a formação de biofilme microbianos. Nesse caso seria importante também prevenir a adesão de materiais provenientes do hospedeiro. A otimização das abordagens antibiofilmes pode ser promissora para prevenir infecções relacionadas a biofilmes (DESROUSSEAUX et al., 2013).
susceptíveis a ação de agentes antimicrobianos ou o ataque do hospedeiro. Muitos desses agentes, além de reduzir a biomassa de biofilmes também podem prevenir que células microbianas formem biofilmes. Outros agentes antibiofilmes são capazes de matar células dos biofilmes impedindo permanentemente que novos biofilmes sejam formados.
Figura 5. Abordagens utilizadas para prevenir a formação de biofilmes ou alvejar biofilmes existentes.
2.5 ESTRATÉGIAS ANTIBIOFILME BASEADAS EM PEPTÍDEOS
milhares de peptídeos (provenientes de diversos organismos) que diferem substancialmente em tamanho (10-100 resíduos de aminoácidos), carga (+2 a +9), sequência, estrutura (α-hélice; folha-β; mistura de α-β, e não- α- β, compreendendo estruturas lineares) e atividade (antibacteriana, antifúngica, antiparasítica, antiviral, entre outras) (WANG; LI; WANG, 2009; não WANG; WANG, 2004). A diversidade desses compostos tem providenciado bases para desenhar, otimizar e desenvolver novos peptídeos antimicrobianos (FJELL et al., 2012).
O modo de ação dos PAMs contra bactérias envolve pelo menos três mecanismos que são atualmente conhecidos. PAMs podem inativar células bacterianas por alvejar processos físicos e metabólicos fundamentais desses organismos. Esses compostos podem se ligar de forma eletrostática a membrana plasmática e assim levar ao rompimento da mesma e/ou alvejar alvos intracelulares e assim inibir a transcrição, tradução e outros processos e também podem afetar a parede celular por interferir em vias biossintéticas responsáveis pela formação de componentes essenciais da parede celular, como peptideoglicanos e lipopolissacarídeos, comprometendo assim a replicação bacteriana (YOUNT e YEAMAN, 2013).
Embora PAMs naturais tenham um amplo espectro de atividade, eles podem apresentar algumas limitações que incluem: (i) toxicidade, (ii) instabilidade (iii) alto custo de produção e (iv) mecanismo de ação incompletamente compreendido. Adicionalmente forte atividade in vitro pode algumas vezes não predizer forte atividade in vivo (MARR et al., 2006). Muitos desses peptídeos podem ser antagonizados por cátions monovalentes e divalentes, polímeros polianiônicos como glicosaminoglicanos e mucinas e, além disso, alguns peptídeos podem ser suscetíveis a proteases, comprometendo assim a sua atividade (HANCOCK e SAHL, 2006). O enfraquecimento da atividade antimicrobiana dos PAMs nessas condições indica que esses compostos poderiam agir primariamente como imunomoduladores e não na morte direta de microrganismos (FJELL et al., 2012; WANG, 2010). Após essas descobertas, muitos estudos foram realizados para compreender melhor a habilidade imunomodulatória desses peptídeos.
Com o objetivo de potencializar a atividade antimicrobiana e sobrepor limitações inerentes a muitos peptídeos, muitos pesquisadores têm aplicado abordagens de desenho racional de PAMs. Essa estratégia, tem permitido o desenvolvimento de novos e pequenos PAMs (reduzindo assim os custos na produção desses compostos) que apresentam atividade antimicrobiana melhorada e com baixa toxicidade a células humanas (PORTO et al., 2012). Isso tem permitido a geração de bibliotecas que arquivam centenas de peptídeos, tais como os peptídeos da série HH e HHC — peptídeos baseados em bactenecina (Bac2A) bovina e indolicidina, ambos isolados de neutrófilos bovinos (HANCOCK, 2013). Esses estudos também têm permitido o desenvolvimento de peptídeos antimicrobianos sintéticos com atividade regulatória da defesa inata, mais conhecidos como IDRs (Innate Defense Regulatory Peptides) (WIECZOREK et al., 2010).
Em adição a habilidade de combater células bacterianas planctônicas, de forma direta (antimicrobiana) ou indireta (imunomodulatória), alguns PAMs são capazes de prevenir a formação de biofilmes bacterianos ou mesmo dispersar e matar biofilmes pré-existentes. Com base nessas descobertas, atividade antibiofilmes tem sido testada entre muitos PAMs. Muitos peptídeos que são mais efetivos como imunomoduladores, os PDHs, têm também se mostrado capazes de inibir a formação de biofilme bacteriano a concentrações menores do que aquelas requeridas para inibir células planctônicas. O peptídeo LL-37, que apresenta atividade imunomodulatória e fraca atividade antimicrobiana, por exemplo, foi capaz de prevenir a formação de biofilme e desagregar biofilmes de P. aeruginosa a uma concentração 16 vezes menor do que a concentração necessária para inibir o crescimento planctônico dessa bactéria (OVERHAGE et al., 2008). Essas observações, em seguida levaram a triagem de bibliotecas de peptídeos, objetivando selecionar e testar a atividade antibiofilme. Tal seleção, revelou que o peptídeo 1037 apresenta fraca atividade antimicrobiana (CIM igual 304 µg.mL-1), mas moderada atividade antibiofilme (DE LA FUENTE-NÚÑEZ et. al., 2012). Outros estudos mostraram que o peptídeo IDR-1018 (nomeado 1018 em artigos sobre antibiofilmes), apresentou uma atividade antibiofilme potente contra P. aeruginosa, E. coli, Acinetobacter baumannii, K. pneumoniae, S. aureus resistente a meticilina, Salmonella typhimurium e Burkholderia cenocepacia a concentrações abaixo de suas CIMs (DE LA FUENTE-NÚÑEZ et. al., 2014)
que é completamente resistente a peptídeos conhecidos como antimicrobianos (e a maioria dos antibióticos convencionais), permitiu ao professor Hancock e seu grupo, a demonstração de uma propriedade intelectual, única, separada e distinta das atuais patentes com peptídeos antimicrobianos. Eles identificaram pequenos peptídeos resistentes a proteases, incluindo uma série de peptídeos nomeados como DJK, os quais apresentam potente atividade antibiofilme contra muitas bactérias.
O mecanismo de ação antibiofilme de peptídeos não é completamente conhecido. Estudos recentes, mostraram que o peptídeo 1018 inibe (p)ppGpp (guanosina pentafosfato), um importante composto sinalizador, envolvido na resposta ao estresse, que permite o desenvolvimento de biofilmes bacterianos (DE LA FUENTE-NÚÑEZ et al., 2014). A ausência de (p)ppGpp pode afetar a divisão celular, morfologia e motilidade e a patogenicidade de bactérias (SONG et al., 2004; THOMPSON et al., 2006). Alvejar especificamente essa resposta de estresse, para prevenir ou reduzir biofilmes, poderia representar uma importante estratégia para busca de novos compostos antibiofilmes.
3 MATERIAL E MÉTODOS
3.1 CEPAS BACTERIANAS
Isolados clínicos de K. pneumoniae 1825971 (obtido do aspirado endotraqueal), 1789769, 2144392, 2210477 e 1450421 (obtidos do sangue) foram plaqueados em Ágar Mueller Hinton e incubados por 18-24 h a 37 ºC. Os mesmos foram confirmados como cepas de K. pneumoniae através do método automático MicroScan WalkAway (Siemens Healthcare Systems) de acordo com as instruções do fabricante. Testes padrões bioquímicos foram usados para confirmação das espécies. Isolados foram preservados a -70ºC com 8% de dimetil sulfóxido. K. pneumoniae ATCC 13883 foi obtido da American Type Culture Collection.
3.2 SÍNTESE DE PEPTÍDEOS
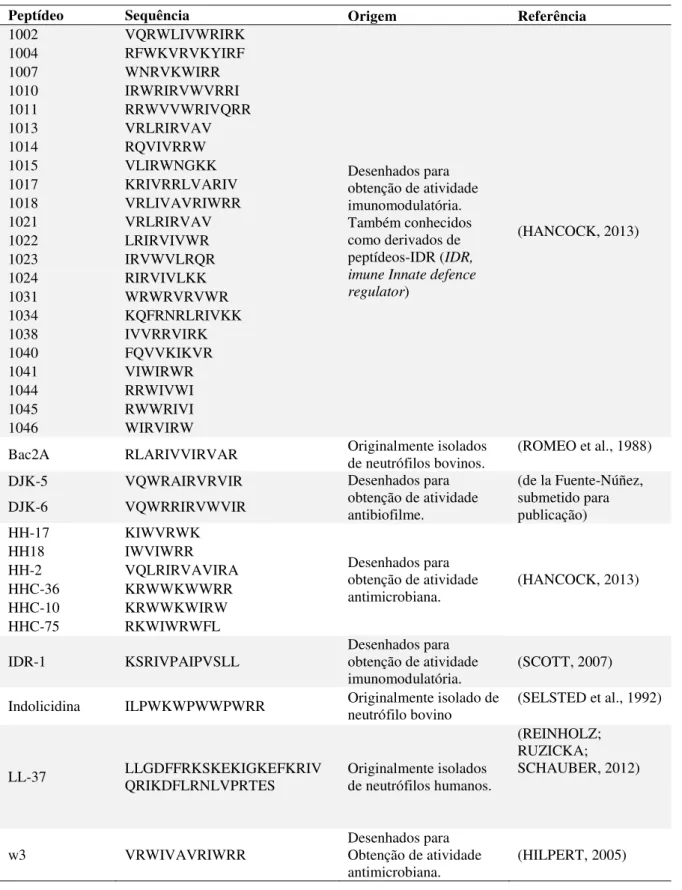
Os peptídeos descritos na Tabela 1, foram sintetizados por CPC Scientific através da fase sólida 9-fluorenilmetilcarbonila (FMOC) e purificado (>95% de pureza) usando cromatografia líquida de alta eficiência. A massa molecular dos peptídeos foi confirmada por espectrometria de massa.
Tabela 1 –Peptídeos catiônicos sintéticos usados nesse trabalho
Peptídeo Sequência Origem Referência
1002 VQRWLIVWRIRK
Desenhados para obtenção de atividade imunomodulatória. Também conhecidos como derivados de peptídeos-IDR (IDR, imune Innate defence regulator)
(HANCOCK, 2013)
1004 RFWKVRVKYIRF
1007 WNRVKWIRR
1010 IRWRIRVWVRRI
1011 RRWVVWRIVQRR
1013 VRLRIRVAV
1014 RQVIVRRW
1015 VLIRWNGKK
1017 KRIVRRLVARIV
1018 VRLIVAVRIWRR
1021 VRLRIRVAV
1022 LRIRVIVWR
1023 IRVWVLRQR
1024 RIRVIVLKK
1031 WRWRVRVWR
1034 KQFRNRLRIVKK
1038 IVVRRVIRK
1040 FQVVKIKVR
1041 VIWIRWR
1044 RRWIVWI
1045 RWWRIVI
1046 WIRVIRW
Bac2A RLARIVVIRVAR Originalmente isolados de neutrófilos bovinos. (ROMEO et al., 1988)
DJK-5 VQWRAIRVRVIR Desenhados para
obtenção de atividade antibiofilme.
(de la Fuente-Núñez, submetido para publicação)
DJK-6 VQWRRIRVWVIR
HH-17 KIWVRWK
Desenhados para obtenção de atividade
antimicrobiana. (HANCOCK, 2013)
HH18 IWVIWRR
HH-2 VQLRIRVAVIRA
HHC-36 KRWWKWWRR
HHC-10 KRWWKWIRW
HHC-75 RKWIWRWFL
IDR-1 KSRIVPAIPVSLL Desenhados para obtenção de atividade
imunomodulatória. (SCOTT, 2007) Indolicidina ILPWKWPWWPWRR Originalmente isolado de neutrófilo bovino (SELSTED et al., 1992)
LL-37 LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES Originalmente isolados de neutrófilos humanos.
(REINHOLZ; RUZICKA;
SCHAUBER, 2012)
w3 VRWIVAVRIWRR Desenhados para Obtenção de atividade
3.3 SUSCEPTIBILIDADE DE ISOLADOS CLÍNICOS DE K. PNEUMONIAE A ANTIBIÓTICOS, TRIAGEM DE CARBAPENEMASES E DETECÇÃO DE GENES DE BLAKPC
Os testes de susceptibilidade foram desenvolvidos usando o método automático Micro Scan Walk Away. Os limites de susceptibilidade foram interpretados de acordo com os protocolos do CLSI (CLSI, 2012). Detecção de resistência devido à produção de carbapenemase foi realizada através do teste de Hodge modificado. K. pneumoniae ATCC 700603 foi usada como controle negativo e K. pneumoniae IOC (cepa produtora de carbapenemases obtida da coleção de culturas do Instituto Oswaldo Cruz) foi usada como controle positivo. Ensaios de reação em cadeia polimerase (PCR, polymerase chain reaction) foram desenvolvidos para identificar genes blaKPC. Iniciadores específicos (F, 5’
-TGTCACTGTATCGCCGTC e R, 5’ -CTCAGTGCTCTACAGAAAACC) foram usados sob
condições padrões dos ensaios de PCR para detectar blaKPC (YIGIT et al., 2001). As cepas usadas como controle para o teste de Hodge foram as mesmas usadas para o controle negativo e positivo para ensaios de PCR.
3.4 FORMAÇÃO DE BIOFILMES E CONCENTRAÇÃO INIBITÓRIA MÍNIMA DE
CÉLULAS PLANCTÔNICAS E BIOFILMES
acima, entretanto, diferença nos ensaios de susceptibilidade as bactérias foram crescidas na presença do tratamento. O método de microdiluição para peptídeos catiônicos (WIEGAND; HILPERT; HANCOCK, 2008), foi usado para determinar a CIM e a concentração inibitória mínima que previne 50% ou 100% da formação de biofilme (CIMB).
3.5 ENSAIOS DE SINERGISMO ENTRE PEPTÍDEOS E ANTIBIÓTICOS EM
MICROPLACA
Combinações entre DJK-6 e antibióticos foram desenvolvidas para acessar o efeito sinergístico através de ensaios de microdiluição em microplacas de 96 poços. Nesse ensaio, o peptídeo foi diluído ao longo das linhas enquanto os antibióticos foram diluídos ao longo das colunas. O crescimento planctônico e a formação de biofilmes foram acessados como descrito acima. Os resultados foram expressados como índice de concentração inibitória fracionada (ICIF), que é determinado como segue: ICIF= [A]/CIMA + [B]/CIMB, onde CIMA eCIMB são as CIM dos compostos antimicrobianos sozinhos [A] e [B] são as CIMs de A e B quando combinados. ICIF foi interpretado como segue: ICIF <0.5, efeito sinergístico; 0.5<ICIF <1, efeito aditivo; 1<ICIF<2, efeito indiferente. A mesma abordagem foi usada para calcular o MBIC a 100 %. Os antibióticos usados nesse ensaio, incluíram: imipenem (Merck) e meropenem (Sigma, Aldrich), cefotaxima (Sigma, Aldrich), cefepima (Bristol), piperacilina (Lerdele), polimixina B (Sigma, Aldrich), sulfato de colistina (Sigma, Aldrich) e amicacina (Bristol).
3.6 AVALIAÇÃO DA ATIVIDADE ANTIBIOFILME DE PEPTÍDEOS CATIÔNICOS
SOBRE BIOFILME PRÉ-FORMADOS
foi mantida por 3h sem fluxo. Após esse tempo, o meio foi bombeado através do sistema a razão constante de 0,5 rpm por 48 h. Em seguida, os tratamentos foram diluídos no meio BM2 e bombeado através do sistema por 24 h. Células em biofilmes foram coradas usando o kit de viabilidade bacteriana LIVE/DEAD BacLight (Molecular Probes, Eugene, OR) antes dos experimentos de microscopia. SYTO-9 (fluorescência verde, células vivas) e iodeto de propídio (fluorescência vermelha, células mortas) foi usada a razão de 1:5 (v/v). Análises microscópicas foram desenvolvidas através de microscopia confocal com escaneamento a laser (Olympus, Fluoview FV1000) e reconstruções tridimensionais foram geradas usando o pacote do software Imaris (Bitplane AG).
3.7 ENSAIOS DE DISPERSÃO DE BACTÉRIAS A PARTIR DE BIOFILMES
Os ensaios de dispersão foram realizados para verificar o efeito de peptídeos catiônicos na dispersão de células bacterianas a partir de biofilmes pré-formados. Brevemente, as contagens de células bacterianas foram realizadas de amostras provenientes dos experimentos do fluxo de células como descrito acima. Umas alíquotas de 1,5 mL do fluxo proveniente da câmara foram coletadas de todos os tratamentos em tempos específicos (tempo 0, depois de 3h e em 20 h de experimento). As amostras foram diluídas serialmente (10x) e 10 μL de cada diluição foram plaqueados em meio LB-ágar. As placas foram incubadas a 37 оC por 18 h e as contagens das colônias foram desenvolvidas para obtenção de UFC.mL-1 a cada tempo.
3.8 DETERMINAÇÃO DA CONCENTRAÇÃO INIBITÓRIA MÍNIMA DE PEPTÍDEOS
HHC-10 e 1018 CONTRA K. PNEUMONIAE ATCC 13883
A concentração inibitória mínima (CIM) foi determinada utilizando o método de microdiluição em caldo de acordo M7-A6 do National Committee for Clinical Laboratory Standards (CLSI, 2012) em microplaca de 96 poços. Brevemente, os peptídeos foram preparados e diluídos a uma concentração duas vezes superior à concentração final desejada.
Em seguida 50 μL de cada diluição dos peptídeos foram adicionados nos poços da microplaca
foram incubadas a 37°C sob agitação constante e a leitura da densidade óptica (D.O. 600 nm) foi realizada a cada 30 min no leitor de microplacas BioTek.
3.9 AVALIAÇÃO DO EFEITO COMBINADO ENTRE PEPTÍDEOSHHC-10 E
IDR-1018 CONTRA K. PNEUMONIAE ATCC 13883
Os peptídeos HHC-10 e IDR-1018 foram utilizados sozinhos ou em combinação. O ensaio de susceptibilidade foi desenvolvido pelo método de microdiluição, de acordo com as recomendações do CLSI (CLSI, 2012). O efeito da combinação dos peptídeos foi avaliado pelo método de ensaio de microdiluição em tabuleiro de xadrez (PILLAI, 2005). Resumidamente, as diluições dos agentes antibacterianos foram preparadas em concentrações 4X, uma vez que ocorreu a diluição 1:4 das amostras testadas quando combinadas com o inóculo bacteriano.
Brevemente, 25 μL de cada concentração da série de diluição de HHC-10 foram combinados
com 25 μL de cada concentração de uma série de diluição de IDR-1018. Posteriormente 50 μL
da suspensão bacteriana com aproximadamente 1x106 UFC.mL-1 foram adicionados aos poços
da microplaca com 50 μL das combinações. O crescimento bacteriano foi observado após incubação das microplacas a 37°C. As placas foram observadas após 18h e os resultados foram expressos como índice de concentração inibitória fracionada (ICIF), que é determinado como segue: ICIF= [A]/CIMA + [B]/CIMB, onde CIMA e CIMB são as CIM dos compostos antimicrobianos sozinhos [A] e [B] são as CIMs de A e B quando combinados. ICIF foi interpretado como segue: ICIF <0.5, efeito sinergístico; 0.5<ICIF <1, efeito aditivo; 1<ICIF<2, efeito indiferente.
3.10 ENSAIO HEMOLÍTICO
1996). A placa foi incubada a temperatura ambiente por uma hora. Hemoglobina liberada foi monitorada a 415 nm no leitor de microplacas. Porcentagem de hemólise foi calculada como segue: % hemólise = 100 × [[( PA Abs − B Abs ) − ( N Abs − B Abs )]/[ P Abs − N Abs − B Abs ]], onde PA, B, N e P denotam respectivamente peptídeo antimicrobiano, branco (tampão fosfato, sem eritrócitos), controle negativo (eritrócitos sem nenhum tratamento) e controle positivo (eritrócitos tratados com Triton-X). Os experimentos foram realizados em triplicata.
3.11 MODELO MURINO DE INFECÇÃO PULMONAR
A atividade antimicrobiana dos peptídeos testados foi realizada in vivo através duas metodologias de infecção pulmonar, as quais são descritas nos tópicos 3.111 e 3.11.2. O modelo de infecção pulmonar I, foi realizado de acordo com o projeto aprovado pelo comitê de ética no uso animal do Instituto de Ciências Biológicas de Brasília (número de aprovação
102087/2012) enquanto o modelo de infecção pulmonar II foi realizado de acordo com o
protocolo A13-0227, aprovado pelo Comitê de Cuidado Animal da Universidade de British Columbia (CCAUBC) em direto acordo com as recomendações do Conselho Canadense de Cuidado Animal. O uso do segundo modelo, visou confirmar os resultados obtidos com uso do modelo I. Diferenças experimentais existentes entre esses dois modelos refletem os padrões que foram adotados durante o desenho experimental e/ou a conformidade com os regulamentos do conselho de ética de cada localidade onde os experimentos foram desenvolvidos.
3.11.1 Modelo de infecção pulmonar I
Camundongos Balb/C com 5-6 semanas de idade foram obtidos do Centro Multidisciplinar para Investigação Biológica na área da Ciência em Animais de Laboratório (CEMIB) da UNICAMP e foram mantidos no biotério da Universidade Católica de Brasília por uma semana. Eles foram separados em grupos de cinco animais por gaiola e mantidos sob temperatura constante (22°C) com 12h claro/escuro e alimentados com ad libitum e água. Os
camundongos (fêmeas) foram sedados por via intraperitoneal com quetamina (50 mg.Kg-1) e
-1) e o antibiótico tobramicina (12 mg.kg-1) foram administrados por via intranasal (50 µL por
camundongo) em dose única após 3 h da indução de pneumonia. Os camundongos foram eutanasiados após 24 h da realização do tratamento. Os pulmões e sangue foram coletados para análises microbiológicas e dosagem de citocinas. Os pulmões inteiros foram coletados e homogeneizados em 1 mL de solução salina estéril a 0,9%. Um volume de 10 µL dos homogenatos foram depositados em meio Ágar Muller-Hinton, após a realização de diluições seriadas 1:10, para estimação do número de CFU.g-1 de tecido pulmonar -1.
3.11.2 Dosagem de citocinas
Inflamação no pulmão foi avaliada através da liberação de citocinas pró-inflamatórias interleucina-6 (IL-6) e fator alfa de necrose tumoral (TNF-α). Os homogenatos dos pulmões foram centrifugados a 5000 rpm por 15 min. O sobrenadante foi utilizado para determinação de citocinas. As citocinas também foram dosadas no soro obtido a partir do sangue coletado por meio de punção cardíaca. Esses ensaios foram realizados de acordo com o kit ELISA (USA, e técnica ELISA). Os níveis de citocinas foram expressos em picogramas por mililitro (pg.mL-1).
3.11.3 Modelo de infecção pulmonar II
Camundongos fêmeas BalbC (Jackcson Laboratory) ou machos Black C6/57 (Laboratório Horwitz), com 5-6 semanas de idade, foram mantidos no laboratório de experimentação animal da Universidade de British Columbia. Para os experimentos de infecção pulmonar, os camundongos foram anestesiados com 3-5% de isofluorano. Em seguida, 30 μL (1x108 UFC/animal) da suspensão (em solução salina) de K. pneumoniae ATCC 13883 ou KPC 1825971 foram administrados por via intranasal. Os peptídeos foram administrados por via
intranasal (30 μL, em dose única) ou por via injetável, 3 h após a infecção ou 4h antes da
infecção. O controle positivo de crescimento bacteriano consistiu em animais infectados e tratados com agua estéril livre de endotoxina. O controle de esterilidade do experimento consistiu em animais não infectados, instilados com 30 μL de solução salina e tratados com 30
μL de água estéril e livre de endotoxina. Os camundongos foram eutanasiados 24 h após a
tecido. Alíquotas do homogenato foram diluídas serialmente a razão de 1:100 (v/v) em solução salina e, 10 μL de cada diluição foram plaqueados em placas contendo LB ágar, para determinação UFC.g-1 nos pulmões.
3.11.4 Análises estatísticas
4 RESULTADOS
4.1 AVALIAÇÃO DE PEPTÍDEOS ANTIMICROBIANOS SOZINHOS OU
COMBINADOS CONTRA BIOFILMES FORMADOS POR K. PNEUMONIAE
RESISTENTE A CARBAPENENS
4.1.1 Susceptibilidade de K. pneumoniae produtoras de KPC a múltiplos antibióticos e
avaliação da formação de biofilmes em diferentes meios
Observamos que os isolados clínicos de K. pneumoniae de pacientes admitidos em hospitais de Brasília foram resistentes a múltiplos antibióticos (Tabela 2). Todos os isolados foram positivos para a produção de carbapenemase de acordo com o teste de Hodge modificado. Em seguida, genotipagem e sequenciamento mostraram que todos os isolados abrigavam genes
Antibiótico
Isolados de K. pneumoniae produtores de KPC
1450421 1789769 1825971 2144392 2210477
CIM Interpretação CIM Interpretação CIM Interpretação CIM Interpretação CIM Interpretação
Amikacina <=16 S <=16 S 32 I <=16 S 32 I
Ampicilina >16 R >16 R >16 R >16 R >16 R
Ampicilina/ Sublactam >16/8 R >16/8 R >16/8 R >16/8 R >16/8 R
Aztreonam >16 R >16 R >16 R >16 R >16 R
Cefepime >16 R >16 R >16 R >16 R >16 R
Cefotaxima >32 R >32 R >32 R >32 R >32 R
Cefotetan >32 S >32 R >32 R 32 I 32 R
Ceftazidima >16 R >16 R 16 R 8 I >16 R
Ceftriaxona >32 R >32 R >32 R >32 R >32 R
Cefuroxima >16 R >16 R >16 R >16 R >16 R
Cefalotina >16 R >16 R >16 R >16 R >16 R
Ciprofloxaxina >2 R >2 R >2 R >2 R >2 R
Ertapenem >4 R >4 R >4 R >4 R >4 R
Gentamicina >8 R >8 R >8 R >8 R >8 R
Imipinem >8 R >8 R >8 R >8 R >8 R
Levoflotaxina >4 R <=2 S 4 I >4 R >4 R
Meropenem >8 R >8 R >8 R 8 R >8 R
Nitrofurantoina >64 R >64 R 64 I >64 R >64 R
Piperacillina >64 R >64 R >64 R >64 R >64 R
Piperacillina/ tazobactam >64 R >64 R >64 R >64 R >64 R
Tetraciclina >8 R 8 I 8 I <=4 S >8 R
Tigeciclina <=2 S <=2 S <=2 S <=2 S <=2 S
Tobramicina 8 I >8 R >8 R >8 R >8 R
Trimetoprima/