INTRODUÇÃO
Os dois métodos de diagnósticos mais freqüentemente utilizados em Brasília, no rastreamento e detecção do papilomavírus humano - HPV e suas lesões celulares são: a citologia oncológica – CO, tanto pelo método de Papanicolaou, em maior escala, quanto pela técnica em meio líquido e o exame de captura híbrida – CH, este em certos casos específicos e em número restrito. A CO normalmente é utilizada como exame de eleição, para o exame preventivo para câncer de colo uterino. A critério do médico ginecologista, está cada vez mais freqüente a solicitação do exame de captura híbrida – CH, que detecta a presença do ácido desoxirribonucléico – DNA do HPV, para verificação de existência do vírus e o risco inerente baseado em sua tipagem. A indicação clássica de CH é a ocorrência de ASC-US na citologia, que significa alterações citológicas de difícil caracterização do ponto de vista de previsão de evolução maligna. A presença de HPV de alto risco - AR, detectada por método de biologia molecular – BM elucida o problema, porque AR persistente significa prognóstico de evolução para o câncer, conseqüentemente conduta médica agressiva e presença de HPV de baixo risco – BR significa conduta médica expectante, com acompanhamento.
A magnitude e relevância da questão podem ser avaliadas ao considerarmos que cerca de um quarto de toda população, isto é, todas as mulheres que iniciaram a vida sexual, possuem indicação de realização de exame preventivo contra o câncer de colo uterino, inicialmente uma vez por ano e depois, caso haja três resultados negativos, de três em três anos, durante toda a vida. Por estas estimativas, exame de CO, em tese, é realizado no Brasil, cerca de 35 milhões de vezes, movimentando cifra considerável de valores.
exames clínicos com mesmo objetivo provocam embaraços entre os médicos e conseqüentemente insegurança entre as pacientes. A divergência, nestes casos, causa um problema bastante sério no consultório médico.
Nas vezes em que estes dois métodos apresentam resultados díspares, o diagnóstico do HPV por Reação em Cadeia de Polimerase - PCR poderia apresentar-se como um terceiro método rotineiro.
Apesar de mais dispendioso, trabalhoso e demorado que os dois anteriores, a PCR pode dar mais subsídios e tornar consistente a decisão de conduta médica clínica ou cirúrgica.
Em decorrência, são propostos para este trabalho experimental, os objetivos a seguir relacionados, partindo do fato de que as amostras selecionadas para serem analisadas, tiveram como requisito, ou seja, como critério de inclusão, possuir discordância entre os resultados contemporâneos da CO e da CH.
OBJETIVOS
OBJETIVO GERAL
Avaliar a confiabilidade e a aplicabilidade da metodologia utilizando a Reação em Cadeia de Polimerase - PCR no Diagnóstico de papilomatose humana - HPV em casos de divergência entre resultados de captura híbrida - CH e citologia oncológica - CO.
OBJETIVOS ESPECÍFICOS
1) Analisar, por realização de PCR, amostras cujos resultados de exames por métodos de CH foram discordantes dos resultados de citologia CO para diagnóstico de HPV.
2) Co-relacionar os métodos de CO e PCR e estabelecer o grau de concordância/discordância entre os métodos, partindo de amostras cujos resultados de exames por métodos de CH foram discordantes dos resultados de CO para diagnóstico de HPV.
3) Co-relacionar os métodos de CH e PCR e estabelecer o grau de concordância/discordância entre os métodos, partindo de amostras cujos resultados de exames por captura foram discordantes dos resultados de CO para diagnóstico de HPV.
4) Testar os parâmetros de associação nas amostras analisadas, agrupadas da seguinte maneira:
2) Relação entre exame de CH e PCR
CAPÍTULO 1. HPV E CÂNCER DE COLO UTERINO
O câncer decorrente da doença papilomatosa de colo uterino apresenta alta taxa de mortalidade. Representa sério problema de saúde pública mundial porque o HPV apresenta incidência e prevalência muito altas, o que implica em custos financeiros e sociais vultosos, tanto na prevenção quanto no tratamento clínico de paciente em todas as fases da doença.
Métodos diagnósticos mais precisos, como a Reação em Cadeia de Polimerase – PCR, quando aplicados em situações especiais, especialmente no caso de divergência entre outros métodos diagnósticos, ocasionarão resultados que melhor se aplicam às políticas de saúde pública, visando diminuir a mortalidade causada pelo HPV.
HPV é a abreviatura do termo inglês “human papillomavirus”. É o causador do condiloma acuminado, doença cuja designação tem origem do grego “kondilus”, que significa redondo, além do sufixo “oma”, de tumor e do latim “acuminare”, que significa tornar pontudo ou mais precisamente “acuminatum”, que significa pontiagudo. Os termos papilomatose e condilomatose são usados indistintamente para designar a doença causada pelo HPV.
1.1. EPIDEMIOLOGIA DA PAPILOMATOSE HUMANA POR HPV
1.1.1 Incidência e Prevalência
Dados divulgados pelo Ministério da Saúde estabeleceram a taxa de incidência de câncer de colo uterino no Brasil de 26,78/100.000 e de mortalidade de por câncer de colo de 8,68/100.000 em 1999. Nos Estados Unidos a incidência é de 15/100.000 para população branca e de 34/100.000 para a população negra. Dados da Organização Mundial de Saúde estimam que no mundo 500.000 novos casos de câncer de colo uterino surgem a cada ano e metade das mulheres acometida morrerá desta doença. Estima-se que é a causa de 11% dos cânceres globais na mulher(CARVALHO et al, 2000).
A infecção por HPV é a terceira mais comum das doenças sexualmente transmissíveis, superadas pela infecção por clamídia e pela tricomoníase, segundo o CDC (Center for Disease Control and Prevention). Aproximadamente 15 tipos de HPV, dos 200 conheidos, causam virtualmente todos os casos de câncer cervical, sendo que o tipo 16 é responsável por 50% dos casos. Nos EUA dados epidemiológicos sobre o HPV demonstram que 1.4 milhões de americanos possuem verrugas genitais; cinco milhões possuem lesões colposcópicas; 14 milhões possuem resultados positivos para DNA, embora não apresente lesão; 81 milhões possuem anticorpos para HPV, mas não possuem DNA ou lesões. Ao todo 75% da população adulta americana foi exposta(SCHIFFMANet al, 2003).
FIGURA 1 – Prevalência de HPV e Incidência de Câncer Cervical por Idade 0 5 10 15 20 25
15-19 20-24 25-29 30-34 35-39 40-44 45-49 50-54 55-59 60-64 >65 Age (years) HP V P reval en c e (% ) 0 2 4 6 8 10 12 14 16 18 20 HPV Cancer C ase s p er 1 00, 000
Fonte: NCI SEER Data,
1990-94; Melkert et al., 1993. Int J Canc 53:919.
O HPV atinge cerca de 25% das mulheres nos primeiros 10 anos de atividade sexual e o risco de aquisição durante toda a vida é de 80%(HELEY, 2003). Um estudo estabelece que 40% das mulheres em idade universitária que procuraram uma clínica da própria universidade em que estudavam estavam infectadas com o HPV (WINER et alli, 2003 ). FIGURA1.
No Brasil, mais especificamente no Estado de Goiás, na Região Centro-Oeste, segundo trabalho de Rabelo-Santos e colaboradores, o tipo 16 é o que prevalece, seguido pelo do tipo 18, nas neoplasias intra-epiteliais cervicais e nos cânceres invasivos (RABELO-SANTOS et alli, 2003).
resultados negativos indicam que pode haver infecção abaixo do limite de detecção ou comprometimento do epitélio basal não amostrado(SELLORS et alli, 2003).
1.1.2. Associação Epidemiológica entre HPV e Câncer
A oncogênese pelo HPV é um evento muito mais raro que a própria infecção pelo HPV e ocorre um longo intervalo entre a infecção e o surgimento de câncer, sendo que na grande maioria dos casos há o desaparecimento espontâneo vírus (JI et alli, 1991). A progressão para o câncer cervical quando ocorre, geralmente demora um período de 10 a 20 anos após o estabelecimento da infecção pelo HPV (LEHTINEN et alli, 2003). Por estes fatos, durante muitos anos houve dúvidas acerca da real associação da transformação maligna da papilomatose e sua correlação com a presença do HPV (RASTKAR et alli, 1982).
Atualmente existe consistente associação epidemiológica entre HPV e câncer e entre lesões provocadas por HPV e sua precurção ao câncer. Além das evidentes associações estabelecidas por rigorosos estudos multicêntricos, os mecanismos biológicos para a oncogênese do HPV atualmente elucidados, tornam perfeitamente plausível esta associação (SCHIFFMAN et al, 2003).
Mas mesmo estabelecida a associação, é aceito que a infecção por HPV somente é insuficiente para causar o câncer, porque fatores adicionais são requeridos para o surgimento da neoplasia(PINTO et alli, 2002). Dentre os co-fatores estabelecidos para o surgimento do câncer cervical estão: alta paridade, uso de contraceptivos hormonais, fumo, infecção por outras doenças sexualmente transmissíveis (DST), fatores dietéticos, nutricionais e baixa condição sócio-econômica(CASTELLSAGUE et alli, 2002).
1.2. FISIOPATOLOGIA DA INFECÇÃO POR HPV
1.2.1. Transmissão
A transmissão do HPV entre a pessoa infectada e a não infectada ocorre pelo contato físico, geralmente sexual. Durante o contato com uma pessoa infectada há inoculação do HPV, que atinge o núcleo das células basais do epitélio pavimentoso estratificado do colo uterino ou outro epitélio da região genital, através de micro lacerações. Lesões de mucosas em recém-nascidos por transmissão intraparto são descritas(GILES, 2003).
Dois trabalhos muito recentes, de Day e colaboradores e Bousarghin e colaboradores, pesquisadores norte americanos e franceses respectivamente, propuseram que a entrada do HPV na célula ocorre por endocitose mediada por receptor clatrina (clathrin) dependente. Os primeiros autores ainda estabeleceram que o tempo de cinética de internalização foi surpreendentemente lento (t1/2 de aproximadamente 4 horas) se comparado ao tempo típico
deste ligante (t1/2 de 5-15 minutos)(DAY et alli, 2003).
Os primeiros sinais de transcrição do genoma viral surgem geralmente ao redor de 4 semanas após a inoculação, mas o período de incubação pode variar de 3 a 18 meses. As lesões provocadas pelo HPV podem persistir por semanas, meses ou anos. Existem indícios que esta variação está tanto relacionada com as condições do hospedeiro quanto com o tipo de vírus. Isto pode ser verificado ao analisar o que ocorre com pacientes com imunodeficiências, porque são portadores de lesões mais exuberantes e persistentes(HILDESHEIM et al, 2002).
O estado epissomal não replicativo do vírus pode ser mantido mesmo após a penetração celular e este estado corresponde à infecção latente. Não se sabe ao certo quais os fatores que determinam o estado de infecção latente, mas o período de tempo para o início da replicação viral pode depender do funcionamento da maquinaria metabólica da célula hospedeira ou da ruptura do gene E2 viral, como será detalhado adiante(SANCLEMENTE et al, 2002).
diferenciam, também ocorre acúmulo de vírus replicados nas células superficiais. A quantidade de DNA nestas células aumenta em direção à superfície do epitélio ao invés de diminuir. Ocorre nesta fase acúmulo de material protéico relacionado ao capsídeo e ao genoma e também ocorre acúmulo de ácidos nucléicos(PAYNE et alli, 1996).
Os limites visuais clínicos dos estágios da infecção pelo HPV são tênues e se sobrepõe. Não existe consenso na correlação clínica entre o aspecto da lesão e o grau de evolução. As dificuldades técnicas para identificação viral dificultam o estabelecimento e da distinção entre as diversas fases características: infecção latente, oculta, persistente e recorrente. Para o estabelecimento dos estágios evolucionários das lesões provocadas por HPV utilizam-se métodos citológicos e histológicos.
1.2.2. A Biologia do HPV
O HPV é um vírus de formato icosaédrico, isto é, apresenta 20 facetas, sendo que alguns autores comparam seu formato a uma “bola de golfe”. Este aspecto foi observado através de ME. Seu interior possui um formato próprio, semelhante a um cromossomo. O capsídeo esférico externo que o envolve mede entre 45 (YUTSUDO et alli, 1982) a 55 nanômetros, segundo diversos autores.
O HPV é um vírus com mais de 200 tipos identificados. (HELEY, 2003). Mais de oitenta por cento dos tipos de HPV tiveram seu DNA completamente seqüenciado. A tipagem é baseada na seqüência de ácidos nucléicos. Uma variação maior que 10% da seqüência caracteriza um novo tipo de vírus. Variação entre 2 e 10% caracteriza um subtipo e variação menor que 2% é considerado uma variante (polimorfismo). O número assinalado na designação do tipo viral é baseado na ordem cronológica do descobrimento e não tem relação com a patogenia.
É um vírus da família Papovaridae, que é largamente distribuído nos vertebrados superiores, mas é espécie específica. Apresenta tropismo pelo epitélio escamoso e geralmente está associado a verrugas e papilomas. Dentre os papilomavírus mais comuns estão o papilomavírus bovino, que também causa câncer naquele animal, o papilomavírus de coelho - CRPV (cottontail rabbit papillomavírus), também cancerígeno e o de galináceos. Estes três são muito utilizados como modelos experimentais em pesquisas sobre condilomatose.
1.2.3. O Genoma e a Biologia Molecular do HPV
O genoma do HPV é de DNA, de cadeia dupla circular combinado com histonas, possui aproximadamente 8Kb e organiza-se similarmente em todos os papilomavírus. Somente uma fita é transcrita durante a replicação. O genoma do vírus é constituído por dois segmentos principais, E e L, totalizando oito genes. Estes seguimentos ou genes possuem ORF’s (opening reading frames) caracterizadas e codificam as proteínas virais (STREECK, 2002).FIGURA 2.
FIGURA 2 – Esquema do Genoma do HPV – Epissomo
E6
E7
E2 E4
E5 L1
L2
E1
URR transformation
transformation
episome replication late cytoplasmic
protein
transcriptional regulator capsid
proteins
P97
Fonte: Unger, E. R.; Human Papillomaviruses: Natural History and Virology, Papillomavirus Section, Centers for Disease Control and Prevention, November 29, 2001
Suas ORF’s são nomeadas em relação aos genes do papilomavírus bovino. Os genes iniciais (E de “early”) são os E1 a E7, com exceção do E3, que não ocorre no HPV. Aproximadamente 45% do genoma é constituído pela parte E, que tem como função a transcrição de RNA para a tradução de proteínas relacionadas com a própria replicação do genoma e também com proteínas repressoras e indutoras, responsáveis pelo controle da expressão gênica. As estruturas das proteínas expressas pelos genes do HPV já estão caracterizadas, inclusive por difração de raio X. Os genes iniciais (E) expressam proteínas que apresentam as seguintes funções: E1 – replicação viral e manutenção do epissomo(HUGHES et al, 1993); E2 – Regulação transcricional e atua como co-fator para a replicação viral (HEGDE, 2002); E4 – A proteína codificada pelo gene E4 modifica a trama de queratina intracelular e provoca a liberação do papilomavírus(ROBERTS et alli, 1993); E5 – Interface com receptores de fator de crescimento (BUBB et alli, 1988); E6 – Transformante de proteína, degrada p53 (THOMAS et alli, 1996) e E7 – Transformante de proteína e liga-se a Rb (PAHEL et alli, 1993). O colapso da citoqueratina mediado por proteínas expressadas pelo gene E4 viral parece ser responsável pela vacuolização, característica da célula infectada (NASSERI et alli, 1987).
tecidos, muito utilizada como alvo na identificação viral em métodos que utilizam biologia molecular.
Os restantes 15% do genoma, entre os segmentos L e E, é denominada região URR (upstream regulatory region), também chamada long control region (LCR) ou non-coding region (NCR) e contém elementos regulatórios transcricionais e de replicação.
O genoma viral pode ocorrer no interior da célula envolto por capsídeo, na forma epissomal não envolvida por capsídeo e não integrado ao genoma ou ainda integrado ao genoma celular. Informações sobre a necessidade de inserção viral ao DNA da célula hospedeira para a replicação viral são conflitantes. Para alguns autores, o estado de acoplamento ao genoma celular é necessário para a replicação viral, mas a infecção viral pode permanecer latente e o vírus permanecer por muito tempo envolto no capsídeo (PICKEN et al, 1987). A replicação viral em altas taxas, a transcrição de genes tardios (L) e a produção de virion estariam limitadas a diferenciação celular.
Segundo alguns outros autores, para que haja a replicação viral não é necessária a inserção do genoma viral no genoma hospedeiro, podendo haver replicação do vírus no estado epissoma (LAPORTA et al, 1982). Estes acreditam que a integração viral ao genoma da célula hospedeira não é parte do ciclo de vida normal e ocorre randomicamente no cromossomo hospedeiro. O vírus se replicaria mesmo sem se incorporar ao DNA da célula hospedeira.
O resultado da inserção do vírus ao genoma celular é a imortalização das células em cujo HPV foi incorporado, pelo menos enquanto o hospedeiro estiver vivo. A imortalização é no sentido de que estas células infectadas pelo HPV adquirem a capacidade de reprodução contínua e com número de vezes indefinido(MUNGER et al, 2002).
É característico no genoma circular viral o ponto específico de quebradura entre os genes E1-E2 (“disruption”). Isto provoca uma desregulação anormal da expressão E6/E7. Ocorre o “nocaute” no gene E2 do DNA viral. E2 é responsável por reprimir a transcrição dos genes virais E6 e E7, como citado anteriormente. Quando há a inserção do genoma viral ao genoma celular hospedeiro, ocorre super expressão dos genes E6 e E7. Este mecanismo parece estar associado a oncogênese, mas a ruptura e a expressão anormalmente regulada não é indispensável para a oncogênese(ROMANCZUK et al, 1992).
Alguns autores acreditam que os estados físicos do DNA do vírus são diferentes nas lesões benignas e malignas. Nas primeiras, ele está presente na forma epissomal e em múltiplas cópias. Já nas lesões malignas ele integra-se ao genoma da célula hospedeira formando uma ligação estável e perdendo a capacidade de se replicar de maneira autônoma (LEHN et alli, 1988).
1.2.4. Transformação de Células Normais em Células Malignas pelo HPV
É sabido que células normais cultivadas submetidas a tratamento com carcinogênicos químicos, irradiação ou certos vírus podem alterar sua morfologia e suas propriedades de crescimento. Vírus, associado a substâncias químicas e radiação são as maiores causas de câncer. Vários vírus cancerígenos foram descobertos. A ação carcinogênica viral associa-se a alterações genéticas nos processos de reprodução e diferenciação celular. Durante o processo natural do ciclo vital, células normais replicam e diferenciam em diferentes tipos e então morrem. Nas células cancerosas, pelo contrário, o controle genético é falho e elas reproduzem descontroladamente formando um tumor (CAVENEE, 1995).
Na transformação de células normais em células malignas estão envolvidas duas categorias de genes: os oncogenes, que são “genes do câncer”, presente nas células hospedeiras e normalmente estão desativados, por ausência de efetores, de promotores, por metilação, por ação de genes repressores e por ligação com proteínas repressoras, por enovelamento do DNA, por associação destes fatores, além de outros motivos e os proto-oncogenes (c-onc), que são genes normais envolvidos no ciclo de regulação celular. No caso de oncogênese viral, os oncogenes virais, que são parte do genoma viral (v-onc), também estão envolvidos.(MILLER et alli, 1990).
passam a ser tumorigênicas quando as proteínas expressas pelos v-onc E6 e E7 são expostos a oncogenes celulares ativados (CHENG et alli, 2002).
O HPV de alto risco causa câncer cervical porque o DNA destes HPV interage com o genoma do hospedeiro, dentro do núcleo, alterando o processo de reprodução e diferenciação celular. O HPV especificamente tem como mecanismo de ação a interação e a inativação dos genes repressores de tumores p53 e p105-RB. O HPV, atua ainda promovendo a degradação de genes ou bloqueando sua função. As proteínas E6 e E7 são produzidas pelos v-onc do HPV, como citado acima, resultado da perda da função repressora do gene E2 do HPV, quando do rompimento do genoma viral circular epissomal (MILDE-LANGOSCH et al, 2003).
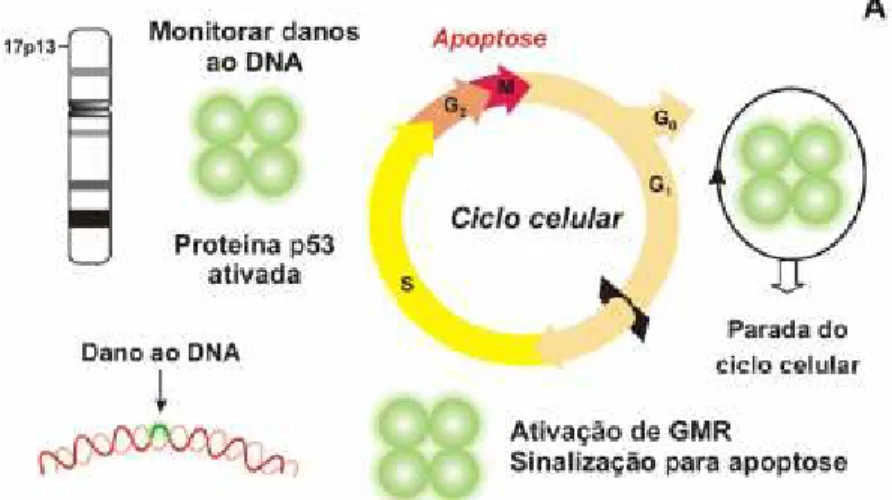
FIGURA 3 – AÇÃO DA PROTEÍNA p53 NO CICLO CELULAR
A) A proteína p53 é codificada pelo gene p53, localizada no cromossomo 17p13. Esta proteína tem a função de parar o ciclo celular no caso de identificação de danos no DNA. No caso de danos extensos, p53 pode induzir a apoptose
B) A proteína viral E6 se liga a E6AP que funciona como ubiquitina, degradando p53, impedindo que genes do mecanismo de reparo – GMR atuem.
Fonte: Teodoro, A.M et col.; HPV e Câncer. O Papel do Papilomavírus na Carcinogênese. Biotec. Cenc.& Desenvolv. Ano 5, Número 29 - Novembro/Dezembro 2002, em www.biotecnologia.com.br, consultado em 09/11/2003
Na ausência de interferência, a proteína expressa pelo gene Rb, a proteína Rb, quando não fosforilada, liga-se ao complexo de transcrição E2F, que é um promotor da
repressor retinoblastoma, Rb, é o mestre do controle protéico do ciclo celular, que governa a entrada da célula na fase de síntese de DNA (fase S) (CHO et alli, 2002).
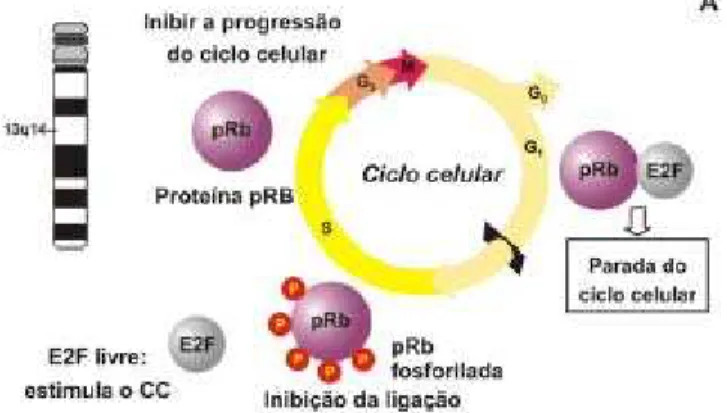
FIGURA 4 – AÇÃO DA pRb SOBRE O CICLO CELULAR
A) Proteína pRb é codificada pelo Gene Rb1localizada no cromossomo 13q14. A ligação de pRB com o fator de transcrição E2F paralisa a progressão no ciclo celular. A fosforilação de pRb libera o E2F
B) Proteína E7 se liga a pRb que inibe a ligação com E2F, tornando constante a ação do fator de transcrição.
Fonte: Teodoro, A.M et col.; HPV e Câncer. O Papel do Papilomavírus na Carcinogênese. Biotec. Cenc.& Desenvolv. Ano 5, Número 29 - Novembro/Dezembro 2002, em www.biotecnologia.com.br, consultado em 09/11/2003
encontrados predominantemente nos condilomas, expressariam proteínas com menor afinidade que os vírus de alto risco, tipos 16, 18 e 31 por exemplo, encontrados principalmente nas lesões sub-clínicas. Parece que os tipos de HPV que provocam lesões verrucosas na região genital não provocam câncer. Os tipos sub-clínicos (especialmente os 16 e 18) são os que mais freqüentemente estabelecem anormalidades epiteliais de alto grau, também são os que mais potencialmente causam câncer cervical (HELEY, 2003).
Outro aspecto importante do controle da expressão gênica que vem sendo recentemente discutido é a atuação da Proteína Ativadora 1 (AP1), um dímero, que também se apresenta como homodímero e se liga ao DNA entre os fatores de transcrição c-Jun, JunB e JunD ou ainda, por heterodímeros que se ligam a membros da família gênica Fos, por mecanismo chamado zíper de leucina (“leucine zipper”). AP1 é um importante fator iniciador de transcrição identificada como proteína ligada ao DNA que se acopla a seqüências de genes humanos meallothioneína II A. As proteínas componentes de AP1 são codificadas por um conjunto de genes conhecidos como “imediatos–precoces” (immediate-early), que podem ser ativados por uma variedade de fatores de crescimento e genes ativadores de mitoses através de diferentes vias de sinalização. Até recentemente AP1 era considerado um fator de transcrição expresso na maioria dos tecidos, para regular genes virais e celulares conhecidos, o que evidenciava que AP1 poderia estar envolvido em regulação de genes alvo específico. AP1 desempenharia então crucial papel durante a expressão dos genes iniciais (Early) na infecção pelo papillomavirus, particularmente dos oncogenes E6 e E7 (VELAZQUEZ TORRES et al, 2002).
centrossomo em células com aparência fenotípica normal. A oncoproteína E6 acarreta centrômeros supranumerários em células multinucleadas. O defeito primário na duplicação do centrossomo induzido por E7 pode estar ligado à habilidade de E7 romper os elos regulatórios que governam a maquinaria do ciclo de divisão celular e o início da duplicação do centrossomo, pois E7 tem sido implicado na desregulação da atividade CDK2, que é o maior determinante da iniciação da duplicação do centrômero. Nos estágios iniciais da carcinogênese cervical, observa-se anormalidade do centrômero induzida por HPV, mitose multipolar e aneuploidia, que aumentam com a conversão maligna. Isto sugere que oncoproteínas HPV induzidas aumentam a instabilidade do cromossomo e o risco de alterações pode facilitar o progresso carcinogênico (DUENSING et al, 2002).
1.2.5. Linhagens Celulares com HPV Integrada ao Genoma
Visando especificamente utilização em pesquisas científicas, foram desenvolvidas linhagens celulares que contêm em seu genoma seqüências nucleotídicas do papilomavírus. A linhagem de células de carcinoma cervical CaSki contém entre 500 a 600 cópias do DNA do HIV 16 por cada célula e a linhagem Hela contém entre 20 a 50 cópias do DNA do HPV 18 por cada célula. Outras linhagens como HeCat e SiHa (uma a duas cópias por célula do HIV16) também são usadas em experimentos. Normalmente, nos experimentos que visam avaliar testes de para detecção do HPV, utiliza-se este tipo de linhagem como controle positivo (CHARDONNET et alli, 1995). O sequenciamento complete do genoma do HPV de algumas destas linhagens já foi realizado(MEISSNER, 1999).
Diversos autores correlacionam uma maior incidência de ocorrência de câncer de colo uterino em populações cujas mulheres estão submetidas à influência dos seguintes co-fatores: contracepção hormonal (ACO), provavelmente porque fatores hormonais influenciam a transcrição do genoma do HPV (GREEN et alli, 2003)(MORRISON et alli, 2003); nicotina e cotidina no muco cervical, relacionada com cigarros fumados (MCCANN et alli, 1992), por poder transformar o tecido infectado pelo HPV mais susceptível de mutação e diminuir a população de células de Langerhans, responsáveis pela apresentação de antígenos às células responsáveis pela resposta imunitária da epiderme, facilitando a aquisição da infecção pelo HPV (FREGA et alli, 2003); estado imunitário deficiente por carências nutricionais, entre elas as de vitaminas A (POTISCHMAN et al, 1996), Vitamina C, beta-caroteno e ácido fólico, por aumentar o risco de infecção pelo HPV (ISONO et al, 1991) e durante a gestação, com maior incidência em gestantes diabéticas e uma menor detecção da infecção no pós-parto (SZEPIETOWSKA et alli 2002).
1.3 - MORFOLOGIA DA LESÃO POR HPV
A infecção freqüentemente é transiente e não associada a nenhum sintoma. Quando se manifesta macroscopicamente, são responsáveis por verrugas vulgares, por verrugas anogenitais e ainda papilomas da nasofaringe e do trato digestivo. O HPV é responsável por lesões clinicamente evidentes, infecções sub-clínicas e latentes. A infecção latente representa a fase durante o período de incubação do vírus, que pode se estender indefinidamente, assim como a fase final da regressão da lesão.
dos cânceres humanos é genomicamente instável, com perda ou ganho freqüente de cromossomos e perda da heterozigosidade. As células infectadas pelo HPV não fogem a regra e apresentam-se com as seguintes alterações: exibem figuras de mitose anormais, pleomorfismo nuclear, valores cromossomais aneuplóides (número cromossomal anormal) e alteração arquitetural dos cromossomos. (FURUTA et alli, 2003), além de disqueratose. FIGURA 5.
FIGURA 5 – Transformação Maligna em Processo de Múltiplos Passos
Observa-se a invasão do estroma pelo epitélio, alterando a morfologia e adquirindo característica invasiva (de baixo para cima).
CAPÍTULO 2 - DIAGNÓSTICO DA DOENÇA PAPILOMATOSA
2.1. DIAGNÓSTICO TRADICIONAL
Existem várias formas de se fazer o diagnóstico do HPV: A primeira e mais comum é a identificação da lesão pelo exame físico. O próprio paciente pode detectar a lesão, pois se houver verruga na área externa da pela, ele pode vê-la. O médico geralmente não tem dificuldade de diagnosticar lesões grandes. Sendo o condiloma acuminado a expressão da infecção pelo HPV, o diagnóstico clínico em geral é feito através da visualização das lesões características. A lesão vaginal e cervical causadas pelo papilomavírus normalmente é assintomática até atingirem estados de malignidade avançada. É uma doença silenciosa.
Durante o diagnóstico clínico, o médico pode utilizar-se de artifícios para tentar evidenciar as lesões. O mais comum é corar o colo uterino com solução de iodo. É o chamado teste de Schiller. As células normais do colo uterino produzem glicogênio, que têm afinidade por iodo. Células displásicas não se coram normalmente. Outro recurso é o da colposcopia, detalhado na figura 6.
Além do exame clínico, o segundo tipo de diagnóstico é executado através de exames laboratoriais. As alterações morfológicas celulares descritas refletem o efeito citopático do vírus; contudo sua presença pode ser determinada através de vários métodos, sendo que cada um dependente do estágio biológico em que se encontra a infecção.(MOORE et alli, 2003).
São os métodos: a) Colposcopia
c.1) Biópsia
c.2) Anátomo patológico de peças d) Imuno-histoquímica e imuno-citoquímica e) Biologia molecular
d.1) Hibridização in situ
d.2) Reação de Cadeia Polimerase (PCR) d.3) Captura Híbrida.
2.1.1. Colposcopia
A colposcopia constitui-se em um método de análise por ampliação de imagem por aparelho cerca de cinco a trinta vezes, com exame do material in vivo, utilizando-se vários tipos de filtros de luz, corantes e reagentes que realçam os aspectos das lesões por HPV.
As lesões são melhores observadas quando se utiliza o colposcópio, tanto sobre a região genital interna e externa das mulheres quanto na região genital do homem. Para ressaltar as lesões pode-se utilizar produtos como o ácido acético 5%, corante de Schiller (à base de iodo iodetado ou lugol), adrenalina, bem como utilizar filtros de cores verdes, vermelhos e outros recursos nas áreas suspeitas. Observam-se áreas não coradas, acetobrancas, aspecto de mosaico, vasos atípicos e outras alterações.
(comparado à anormalidade histológica) foi de 80% e o valor preditivo negativo para impressão de colposcopia benigna foi de 68%. A sensibilidade da colposcopia para detectar qualquer lesão foi de 89% e a especificidade de 52%. A sensibilidade para CIN 2/3 foi de 56% (MASSAD et al, 2003).FIGURA 6.
FIGURA 6 – IMAGEM COLPOSCÓPICA DE COLO UTERINO
SEM UTILIZAÇÃO DE FILTRO
UTILIZAÇÃO DE FILTRO VERDE
O colposcópio é um aparelho que amplia a imagem de 5 a 30 vezes e permite a visualização do epitélio. Podem ser utilizados substâncias aglutinantes, vaso constritor e filtros de cores. Neste caso observa-se uma lesão na borda inferior do colo, de margem nítida e na margem superior aspecto de mosaico, com pontilhados esbranquiçados, sugestiva de lesão de alto grau – NIC 2 ou NIC 3.
Fonte:
Portanto a colposcopia tem papel fundamental na orientação da biópsia e não como método de diagnóstico primário.
2.1.2. Citologia
A citologia vem sendo utilizada há muitos anos, desde a década de 1950, como método primário de diagnóstico preventivo, pois, até o momento, é o mais apropriado para “screening”. (rastreamento para diagnóstico em grandes populações), levando-se em consideração a relação custo benefício e eficácia. A coleta de amostras de células do colo uterino é o método mais utilizado para o rastreamento da doença em mulheres, mas protocolos para rastreamento em homens ainda não estão estabelecidos por consenso (O'MEARA, 2002).
Em Brasília é a forma de diagnóstico predominante, representando certamente mais que 99% dos métodos. É a forma de diagnóstico principal e praticamente exclusiva para rastreamento utilizada na rede pública de saúde, basicamente utilizando-se os meios de coloração tradicionais de Papanicolaou. No Distrito Federal, segundo dados da Secretaria de Saúde, são realizados anualmente cerca de 800.000 exames desta natureza. Os exames realizados pela rede pública de saúde são gratuitos para a população e possuem um custo estimado para órgãos públicos da ordem de seis reais por unidade.
Variações do método citológico tradicional como a citologia monocamada (monolayer ou Thin-Prep ®), leitura computadorizada de lâminas e outras formas, vêm sendo desenvolvidas, mas parece que nenhum método superou ainda o convencional, porque apresentam menos resultados falso positivos e falso negativos(COSTE et alli, 2003).
A citologia esfoliativa é um método não invasivo, indolor e relativamente barato. É realizado por análise de amostra obtida por raspado de mucosa vaginal e do colo uterino, mas pode ser colhido material de várias áreas do corpo. O material é aplicado sobre uma lâmina de vidro de microscópio comum, colocada sob conservante, em frasco porta lâmina contendo álcool ou utilizando-se fixadores em spray. A lâmina é analisada em laboratório ou local onde se dispõe de um microscópio ótico, após coloração. As amostras não necessitam serem colhidas diretamente das lesões. A qualidade do material colhido depende da técnica de coleta e dos locais anatômicos em que são colhidas. Pode-se utilizar hastes de algodâo, escovas, espátulas ou lavagem. O epitélio basal normalmente não está incluído na coleta esfoliativa. Na técnica de preparação das laminas normalmente usa-se coloração de Papanicolaou. Neste caso, as células coradas apresentam três aspectos diferentes: os núcleos tornam-se azul, o citoplasma verde e vermelho.
A citologia monocamada, uma técnica alternativa ao método de Papanicolaou, é realizada sobre material onde são eliminados artefatos como células inflamatórias, muco e sangue. O material deve ser colhido, armazenado em frasco com líquido próprio, de acordo com especificação do laboratório fabricante do kit (WANG, et alli, 2002).
A coloração de Papanicolaou produz três cores básicas - azul (núcleos), verde (citoplasma) e vermelho (citoplasma). Após a coloração as lâminas são montadas com bálsamo. Para realização de exames a serem corados pelo método de Papanicolaou (exames colpocitológicos e a grande maioria dos outros materiais).
Durante a citologia oncótica, a ênfase é dada na identificação de coilocitose e disqueratose. A relação do HPV com a coilocitose observada por citologia já está confirmada. Coilócitos são observados em todos os casos de papilomatose em que as partículas virais foram detectadas experimentalmente, mas o inverso nem sempre ocorre, isto é, nem sempre que há coilócito se detecta o HPV. Possivelmente o número de HPV nestes casos esteja abaixo do limiar de detecção. A coilocitose é caracterizada por zona perinuclear transparente, bem delimitada, circundada por um halo citoplasmático.
Na atipia celular é diagnosticada quando ocorre a presença de coilocitose, hipercromia, aumento do volume e irregularidade do contorno do núcleo. Pode haver um ou mais núcleos. Nos critérios de definição de ASCUS, é utilizado o aumento nuclear (2.5 a 3,0 o tamanho normal de núcleos de células intermediárias), a hipercromasia nuclear moderada e o “esfumaçamento” do contorno nuclear, com moderada variação no tamanho nuclear e espículas, além de dois, mas não três de todos estes critérios, que são resultados dos efeitos citopáticos do papillomavirus (WILLIAMS et alli, 1997).
2.1.2.1. Interpretação do Diagnóstico Citológico
A forma de interpretar a citologia esfoliativa evoluiu bastante desde a classificação de Papanicolaou, que estabeleceu resultados divididos em Classes I a V. Classe I – Normal, Classe II - Inflamatório inespecífico, Classe III – Displasia, Classe IV – Ca in situ e Classe V – Câncer invasivo. Por muito tempo foi popular a interpretação da OMS, que representou uma evolução à de Papanicolaou. Ela diferia basicamente da classificação de Papanicolaou porque, em última análise, sub-dividiu a Classe III, que representava a displasia, em três sub-classes: displasia leve, moderada e grave, além de diferenciar o câncer (classe V) entre adenocarcinoma e carcinoma de células escamosas. Surgiu então o termo NIC - Neoplasia intraepitelial cervical e NICI, NICII e NICIII (CIN – cervical intraepihtelial neoplasia, CINI, CINII e CINIII). Naquela época, o estabelecimento da NIC em três classes foi fundamental para a racionalização da conduta, pois a NICI poderia ser conduzida de maneira mais expectante e a NICIII de maneira mais agressiva. Desta forma evitava-se gastos e mutilações desnecessários (KOSS, 1989).Quadro 1.
e ganharam popularidade. (HSIL equivale à HGSIL e LSIL à LGSIL) (LEVINE et alli, 2003).69 FIGURA 7.
QUADRO 1 – CORRELAÇÃO ENTRE SISTEMAS DE NOMENCLATURA DE ALTERAÇÕES EM CITOLOGIA ONCOLÓGICA
Malignidade não
epitelial
---
Classe V Neoplasia
Anormalidade Cel
Glandular
AGCUS, AdenoCA
Adenocarcinoma
(AdenoCA)
SCCA
Invasivo SCCA
Classe V
HSIL or CIS
Carcinoma
in Situ
(CIS)
Classe IV
HSIL
Severa (NIC III)
HSIL
Mod (NIC II)
LSIL (Inclui HPV)
Leve (NIC I)
ASCUS
Anormal Cel Epitél
Escamoso
Displasia
Classe III
Alterações Reativas
Atipia
Classe II - inflamatório
WNL
Normal
Classe I
SISTEMA
BETHESDA
WHO SYSTEM (ou NIC)
PAPANICOLAOU
divide em ASC-US (e AGC-US), LGSIL e HGSIL, além de Ca in situ – CIS, Ca invasivo – SCCA e adenocarcinoma. Quando o citologista detecta ASC-US significa imprecisão
FIGURA 7 – IMAGEM DE CÉLULA POSSIVELMENTE INFECTADA POR HPV (ASC-US)
Citologia Oncológica – CO corada pelo método de Papanicolaou, de paciente de 24 anos, nulípara, com último exame há mais de 3 anos, sem antecedentes, fumante até 1 ano e usuária de anticoncepcional. Diagnóstico de ASC-US, com núcleo eosinofílico, aumentado de 2 a 3 vêzes, embora com abundante citoplasma.
Fonte: www.cervicalhealthonline.org/dunton/
diagnóstica. O grande avanço da classificação TBA foi que, ao estabelecer HGSIL, tornou sem sentido NIC II e NIC III, que não possuíam condutas clínicas diferentes de CIS. Sabe-se hoje que HGSIL possui prognóstico de evolução maligna sempre e associação epidemiológica com HPV de alto risco. LGSIL, que está associado ao HPV de baixo ou de alto risco, dependendo do caso, evolui para HGSIL em 15% dos casos, mas na grande maioria das vezes regride, mesmo sem tratamento (SMITH, 2002).
Ressalta-se que o exame citológico é um exame de rastreamento e não de diagnóstico definitivo. Somente três exames negativos consecutivos (um a cada ano por três anos) asseguram que naquele momento não ocorre lesão.
Em Brasília ainda predominam os resultados de citologia que utilizam as denominações anteriores ao estabelecimento do Sistema de Betesda.
2.1.3. Histopatologia
A histopatologia é a técnica de análise de tecidos orgânicos, realizada por preparo de material corado em bloco de parafina, seguida de clivagem do material em fatias muito finas, em aparelho denominado micrótomo. Geralmente são utilizados colorações com os corantes hematoxilina e eosina, mas existem diversos outros tipos de coloração. O material é montado em lâminas de vidro, coberta com lamínula, fixada em bálsamo e observada em microscópio ótico. Existem variações como a biópsia de congelação e outras técnicas.
inflamatório mononuclear, além de congestão e ectasia vascular (VACHER-LAVENU, 2001). FIGURA 8.
FIGURA 8 – Imagem de Histopatologia de Tecido Infectado por HPV com NIC III
Observa-se neste corte de exame histopatológico obtido de biópsia dirigida por colposcopia, espículas e alterações teciduais compatíveis com neoplasia de epitélio escamoso, invasão de membrana basal, consistente com NIC 3.
Fonte: www.cervicalhealthonline.org/dunton/
2.1.4. Biópsia
superficial da lesão e a camada basal do epitélio. A biópsia não é aplicável a “screening” por motivos evidentes.
A análise histológica do material colhido durante a biópsia de colo proporciona correlação direta entre a doença e a presença ou ausência do vírus. Como ponto desfavorável, o material analisado pode representar amostra com área relativamente limitada da lesão, embora no material colhido por biópsia esteja presente a membrana basal, cuja análise subsidia o estabelecimento do estadiamento do câncer cervical. A análise da integridade da membrana basal possibilita a verificação de invasão estromal ou não, com conseqüência para o estabelecimento do grau de comprometimento do paciente, caso exista o câncer.
Na interpretação do resultado da biópsia, o aspecto mais importante, além da caracterização da presença de células carcinomatosa, é a verificação da integridade da membrana basal. No Ca in situ, a membrana basal não foi ultrapassada. No caso de Ca micro-invasivo, a lesão não atingiu a 3 mm, sem comprometimento vascular ou linfático (1973) ou comprometimento de 5mm com no máximo 7mmde extensão (FIGO – 1985).
A crítica que pode ser feita à biópsia é que o ginecologista ao realizá-la, pode retirar uma área de lesão que possui integridade epitelial, ao passo que se fosse retirada uma área adjacente, apesar de não haver lesão tão exuberante, naquele local a membrana basal poderia não estar íntegra. A biópsia deve ser orientada por colposcopia, porque a probabilidade de se retirar a área principal da lesão aumenta. A inobservância deste pequeno detalhe pode implicar, no caso de realização de biópsia fora do local principal da lesão, com conseqüências nos diagnósticos e condutas clínicas totalmente diferentes das indicadas. Alguns autores preconizam a realização de biópsia em quatro quadrantes do colo uterino, quando do resultado de citologia compatível com lesão pré-maligna, mas pode-se incorrer no mesmo erro citado, ou seja, não se biopsiar no local principal da lesão (BALDAUF et alli, 1997).
Consiste no exame de peças anatômicas maiores que a biópsia, geralmente resultado de “conizações” do colo uterino ou da amputação do colo, além de órgãos inteiros. Utiliza-se a técnica de preparo de material histológico rotineira.
2.1.5.1. Imuno-histoquímica e Imuno-citoquímica
Utilizam-se anticorpos policlonais ou monoclonais contra antígenos específicos de vários tipos de HPV, que detectam partículas virais (o revestimento protéico – capsídeo), quando presentes em lesões virais, por ocasião da realização de exames cito ou histológicos de materiais, desde que haja infecção (LLOYD et alli, 1984). Mesmo que tenha havido congelamento, fixação em formol, preparo citológico ou inclusão em parafina, o exame imunio-químico pode ser feito. Como detecta o capsídeo, apresenta especificidade alta, mas baixa sensibilidade, porque só detecta o HPV na fase epissomal. No caso de incorporação do genoma viral ao do hospedeiro, como ocorre nas lesões de alto grau e no câncer, este método pode apresentar falso negativo (DALLENBACH-HELLWEG et al, 1991).
Comercialmente é apresentado pool de anticorpos para HPV tipos 6, 11 e 18 e apenas para tipo 18. Pode obter-se preparados comerciais inespecíficos com anticorpos grupo-específico usando partículas de HPV1, CRPV ou bovine papillomavirus (BPV) ou homogenizado de diferentes tecidos tumores.
(imuno-fluorescência direta ou indireta) ou enzimas (técnica que emprega imunoglobulinas marcadas com enzimas, tais como a peroxidase e fosfatase alcalina). Podem ser usadas técnicas com peroxidase-antiperoxidase (PAP) e avitina-biotina-peroxidase (ABC), esta de uso mais comum atualmente.
Os resultados observados nas lesões pelo HPV, são positividade nas camadas superficiais do epitélio, especificamente no núcleo dos coilócitos e células com disqueratose principalmente.
2.2. DIAGNÓSTICO POR BIOLOGIA MOLECULAR
Os métodos designados como de biologia molecular realizam a detecção molecular do HPV, isto é, identificam o HPV pela presença de seqüência de ácidos nucléicos característicos de seu DNA através de sondas (HUBBARD, 2003).
Denomina-se hibridização o fato de haver anelamento (acoplamento) entre as bases complementares de DNA, timina (T), guanina (G), citosina (C) e adenina (A) com bases complementares de RNA, uracila (U), guanina, citosina e adenina. Naturalmente, as purinas (A e G) tendem a formar ligações por pontes de hidrogênio com as pirimidinas (T do DNA e U do RNA e C). O nome híbrido vem do fato de se fazer um anelamento entre moléculas de DNA e de RNA. Para que se possa visualizar a hibridização das moléculas de DNA e RNA, são usadas sondas, preferencialmente não radioativas (quimioluminescência), para que se possa amplificar o efeito da reação. As sonda não necessariamente ligam-se a todo o DNA, mas ao contrário, são pequenas seqüências específicas de RNA que se hibridizam a limitados pontos complementares específicos.
A hibridização "in situ" é uma técnica utilizada visando especialmente a identificação e detecção de vírus, tais como HPV, vírus de Epstein-Barr, vírus da hepatite B, usada ainda para verificação de presença de outros agentes infecciosos em tecidos suspeitos de infecção e de tipos especiais de cromossomos.
Esta técnica é menos sensível do que a técnica que utiliza a PCR (polymerase chain reation) porém mais sensível que a imuno-histoquímica. O material utilizado na hibridização in situ pode ser fixado em formol, incluído em parafina, congelado ou preparado para exame citológico, mas deve ser processado para a verificação do HPV, isto é, a amostra deve ser coletada e preparada em lâminas utilizando um tipo especial de cola, que evite a soltura das células durante o preparo (HOSONE et alli, 1995) .
A hibridização in situ detecta a forma epissomal do vírus e a forma integrada ao DNA hospedeiro, além de possuir sondas específicas para HPV de alto e baixo risco (AUTILLO-TOUATI et alli, 1998).
A otimização da visualização da reação entre as moléculas de DNA ou RNA em estudo e as sondas, é feita por associação a moléculas radioativas, fluorescentes ou tiramina biotiniladas (EVANS et alli, 2003).
A sensibilidade teórica estimada é de 300 cópias de vírus por célula, mas pode ser aumentada com a quimioliminescência (LORIMIER et alli, 1993).
2.2.2 - Reação em Cadeia de Polimerase (PCR)
“revolução” na ciência, com extraordinário impulso nas técnicas de biologia molecular (MULLIS, 1990).
A reação em cadeia de polimerase consiste em três etapas cíclicas: desnaturação, anelamento e extensão. Utiliza-se dois “primers” criados ou escolhidos, que possuem seqüências de nucleotídeos complementares aos sítios de ligação de interesse nas pontas 3` de cada uma das seqüências do DNA fita dupla a serem reproduzidas. Os primers servem como iniciadores da complementação da seqüência, mediada pela enzima DNA polimerase. O material necessário à reação é preparado e colocado em um aparelho chamado ciclador térmico. Nele, a temperatura é elevada até cerca de 94°C, quando ocorre a desnaturação (separação da dupla fita de DNA modelo). Posteriormente ocorre o anelamento. A enzima Taq polimerase, uma DNA polimerase termo resistente, obtida da bactéria Thermus aquaticus, promove a extensão (adição dos nucleotídeos complementares na seqüência a partir do primer, no sentido 5`para 3`da cadeia em formação), ao mesmo tempo em que a temperatura é baixada par cerca de 40°C. O ciclo se repete várias vezes e a cada ciclo é praticamente dobrado o número da seqüência de nucleotídeos de interesse no aparelho.
Para a PCR de HPV, mais de 100 métodos já estão atualmente patenteados. As mais comuns são as que utilizam primers que amplificam parte do gene L1, que possui uma região mais conservada, isto é, com menor número de polimorfismo, embora primers para outras regiões estejam disponíveis. Manos e colaboradores descreveram os primers MY09/11 (MANOS et alli, 1994)e Walboomers e colaboradores os primers GP5+/GP6+ (JACOBS et alli, 1995). O primeiro foi por nós utilizados, porque é o mais consagrado entre eles.
A grande desvantagem da PCR em relação aos outros métodos é a sua complexidade, que reflete no seu alto custo para aplicação como método diagnóstico em grande escala, embora sua sensibilidade mais alta que os outros métodos.
Não se tem conhecimento de realização comercial de exames de PCR para diagnóstico de HPV no Distrito Federal, embora existam laboratórios que realizam comercialmente estes exames em capitais próximas como Goiânia, em Goiás e em outros centros no país. O custo comercial está ao redor de 250 a 350 reais.
2.2.3. Captura Híbrida (CH)
O método de Captura Híbrida utilizada em nosso meio é o Hybrid Capture II; HC-II, Digene Co® (Digene Corporation, Silver Spring, Maryland, USA). Ele utiliza também o fato de haver anelamento (acoplamento) entre as bases complementares de DNA, como descrito acima. No caso específico da Captura Híbrida, para que se possa visualizar a hibridização das moléculas de DNA e RNA, é usada sonda não radioativas que apresenta quimioluminescência (LORINCZ, 1996).
Este método utiliza-se uma microplaca onde anticorpos “capturam” espécimes híbridos (de DNA fragmentado hibridizado com RNA complementar ao DNA do HPV). Os anticorpos monoclonais (específicos) para os híbridos RNA/DNA do HPV, conjugados com fosfatase alcalina, são detectados por um substrato quimioluminescente, sendo colocados sobre a placa. Um anticorpo possui várias moléculas de fosfatase alcalina acoplada, assim como, vários anticorpos conjugados ligam-se a um híbrido, formando um complexo. Este complexo fixa na parede da placa (tubo). A detecção do complexo é realizada por quimioluminescência ultra-sensível. A unidade de luz relativa (RLU) é a medida utilizada para se quantificar a luz emitida, através do aparelho luminômetro.
São utilizados dois grupos de sondas na captura híbrida, o grupo A, que possui sondas para os HPV de baixo risco (sub-tipos 6, 11, 42, 43 e 44) e do grupo B, que possui sondas para HPV de alto risco (sub-tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 e 68). O fabricante do produto não especifica a região genômica da hibridização.
etc.) que não seja DNA ou RNA e fragmenta a molécula de DNA em curtas seqüências de bases nitrogenadas para facilitar a hibridização.
Na rede pública de saúde do Distrito Federal não é utilizado o método de captura híbrida. Via de regra, apenas pacientes atendidas em clínicas privadas, seja pacientes particulares ou conveniadas realizam este exame. Não existem estimativas acerca do número de exames realizados no Distrito Federal anualmente. O custo comercial pode variar de 200 reais, repassado aos laboratórios por entidades de planos de saúde a 350 reais, cobrados de pacientes particulares não conveniadas.
2.2.3.1. Interpretação dos Resultados
O teste de captura híbrida é tanto qualitativo quanto quantitativo, embora a quantidade de HPV numa amostra guarde também relação com o volume de material coletado. A quimioluminescência é medida e estabelecido valor de corte (“cut of”) de 1,0 de RUL. Se o valor medido pelo luminômetro for maior que 1,0, o resultado é considerado positivo. O resultado deve conter o teste para os dois grupos de vírus, de alto e de baixo risco.
A sensibilidade teórica é de 1 pg/ml de DNA-HPV, o que equivale a 0,1 cópia do vírus por célula (CLAVEL et alli, 1998).
2.2.4. Microarray para HPV
O HPV oligonucleotide microarray system ® (Biomedlab Co., Korea) detectou 15 tipos de HPV de alto risco (HPV-16/-18/-31/-33/-35/-39/-45/-51/-52/-56/-58/-59/-66/-68/-69) e 7 tipos de HPV de baixo (HPV-6/-11/-34/-40/-42/-43/-44) em estudos realizados em pacientes coreanos, no Department of Pathology, College of Medicine, Pochon CHA University, Kyonggi-do, South Korea (AN et alli, 2003). Neste mesmo estudo, ocorreram 10 casos em que mais de um tipo de HPV de baixo risco foi detectado na mesma paciente e um caso em que três tipos de HPV.
Outros estudos coreanos recentes, do Department of Pathology, Yonsei University College of Medicine, Seoul, Korea, mostraram não haver diferença significante entre a detecção de HPV por diagnóstico citopatológico e por microarraste (CHO et alli , 2003). e da Division of Gynecologic Oncology and Department of Obstetrics & Gynecology, Kangnam St. Mary's Hospital, The Catholic University of Korea, Seoul, Korea, demonstrou que comparações feitas entre a captura híbrida - HPV DNA detection system (Hybrid Capture II; HC-II, Digene Co.) e o microarraste são altamente comparáveis na detecção do HPV (KIM et alli, 2003).
CAPÍTULO 3.DIAGNÓSTICO DE PAPILOMATOSE HUMANA POR REAÇÃO EM CADEIA DE POLIMERASE EM CASOS DE DIVERGÊNCIA ENTRE
RESULTADOS DE CAPTURA HÍBRIDA E CITOLOGIA ONCOLÓGICA – ESTUDO EXPERIMENTAL
3.1. MATERIAIS E MÉTODOS
3.1.1. Tipo de Estudo
O estudo é experimental, laboratorial, duplo cego, com análises qualitativa e quantitativa.
3.1.2. População de Estudo
3.1.2.1. Descrição
O material analisado foi originário do colo uterino de 82 pacientes, cuja idade variou entre 22 e 73 anos (média de 43 anos) escolhidas de forma aleatória, atendidas em consultórios de serviços privados de clínica ginecológica, situados em Brasília, no Distrito Federal, Brasil. Tratava-se de mulheres submetidas a exame ginecológico, que procuraram espontaneamente serviço de saúde visando realizar exame preventivo para câncer de colo uterino e que foram pré-selecionadas para o estudo por apresentarem o critério de inclusão.
O critério de inclusão de amostras das pacientes no estudo, foi a existência de laudos de captura híbrida - CH e de citologia oncológica - CO que apresentaram divergência, realizado com intervalo inferior a 30 (trinta) dias, com resultados de exames relacionados à presença de papilomavírus humano – HPV incompatíveis um com o outro.
A discordância se enquadrava em uma das possibilidades a seguir:
1 - CH positiva para qualquer risco (alto risco – AR e/ou baixo risco - BR) e CO normal 2 - CH negativa e CO suspeita (compatível, ASCUS ou ASGUS).
3 - CH negativa e CO NIC I 4 - CH negativa e CO NIC II
5 – CH negativa e CO NIC III ou mais grave 6 - CH positiva para baixo risco e CO NIC I 7 - CH positiva para baixo risco e CO NIC II
8 - CH positiva para baixo risco e CO NIC III ou mais grave
A escolha das pacientes para a inclusão no estudo não considerou a distribuição de idade, paridade, fatores de risco para câncer de colo uterino, tais: como fumo; estado nutricional; número de parceiros; paridade e presença de outra DST – doença sexualmente transmissível associada.
3.1.2.3. Abordagem para Coleta de Amostras, Ficha para Coleta de Dados e Estocagem
das Amostras
3.1.2.3.1. Coleta
O período de coleta e captação das amostras foi de novembro de 2003 a agosto de 2004. As amostras biológicas eram colhidas de colo uterino de pacientes, utilizando o método de raspagem com escovas multi-cerdas cônicas, estéreis de uso único, da marca Kolplast, lacradas e confeccionadas para este fim, adquiridas em lojas especializadas. Todo o material, necessário a coleta e conservação, compunha o “kit de coleta”. Estavam incluídos no kit, além da escova descrita, um microtubo de dois mL, com tampa rosqueável protegido com o’ring emborrachado de vedação, contendo 600 µL de solução de lise A (vide lista de materiais – reagentes) e uma FCD.
Para a introdução das cerdas das escovas contendo o material biológico dentro do microtubo rosqueável, a ponta da escova com a cerda era separada da haste por quebra ou corte com tesoura. A ponta, com o raspado, permanecia dentro do frasco hermeticamente fechado. O material, após a coleta pelo médico, ficava acondicionado em geladeira a 4ºC, nos consultórios, durante um a dois dias, até serem recolhidos e levados, em geladeiras de isopor com gelo, ao Laboratório de Biologia Molecular do Curso de Pós-graduação em Ciências Genônicas e Biotecnologia da Universidade Católica de Brasília.
3.1.2.3.2. Ficha para Coleta de Dados
As instruções seguidas pelos médicos, que realizavam a coleta de material do colo uterino, constante na FCD foram as seguintes:
“1 – Paciente com abstinência sexual de 3 dias e ausência de menstruação.
2 – Coletar antes da aplicação de qualquer produto, como ácido acético e iodo (no caso de colposcopia) ou de efetuar qualquer exame como toque. Não fazer assepsia prévia.
3 – Caso ocorra discreto sangramento da área do colo coletada, não haverá prejuízo para o resultado do exame.
4 – Retirar o excesso de muco do colo uterino (se houver) com chumaço de algodão seco em pinça Cherron.
5 – Introduzir a escova descartável estéril no canal do colo de modo que as cerdas penetrem um a dois centímetros, rodar três vezes no mesmo sentido. (No caso de gestantes, colher material só da parte externa do colo uterino)
6 – Raspar também, com a ponta da escova, a região ectocervical.
7 – Sem encostar a escova em outro local, introduza as cerdas no tubete com a solução de conservação e quebre a haste de modo que se possa rosquear a tampa com a ponta quebrada dentro do tubete.
8 – Agitar o tubete vigorosamente por 20 segundos, para homogeneizar a amostra.
9 – Recoloque o tubete com a ponta da escova no plástico e a Solicitação de Exame para HPV por PCR preenchida.”
A instrução de armazenamento foi a seguinte:
“1 – Guardar sob refrigeração. Não é necessário congelamento”.
3.1.2.3.3. Estocagem das Amostras
As amostras de material vaginal eram guardadas no Laboratório de Biologia Molecular, em tubos previamente identificados, com conservante, composta pela solução A do kit de extração descrito abaixo. As amostras permaneciam estocadas a 4º C, até o início do processamento e eram processadas em periodicidade semanal. A quantidade de amostras processadas por bateria na semana variou, conforme a disponibilização pelos médicos colaboradores, de três a doze.
3.1.3. Detecção do HPV e seus Subtipos
3.1.3.1. - A citologia
Os exames de CO foram realizados por diversos laboratórios particulares do Distrito Federal, de livre escolha pelas pacientes, de tal modo que um viés nos resultados, provocado por variações decorrentes de subjetividade específica de um ou poucos cito-patologistas, fossem anulados. As técnicas de citologia foram as clássicas, com coloração de Papanicolaou em 57 e camada fina (thin layer) ou citologia líquida em 13, das 70 amostras em que os resultados foram analisados estatisticamente. (Vide FIGURA 7 no item 2,1.2. Citologia)
3.1.3.2. Captura Híbrida – CH
3.1.3.3. A Reação em Cadeia de Polimerase
As condições gerais em que foram realizadas as extrações de DNA e as amplificações de material genômico foram padronizadas. Sempre eram realizadas em ambientes especialmente limpos, desinfetados com álcool e preparados para esta finalidade. Utilizavam-se materiais diferentes, como jogos de pipetas, além de proceder com técnicas de manipulação de material estéril.
Para o preparo das soluções componentes da PCR em todas as reações, os procedimentos gerais foram repetidos. Foi utilizado, em cada reação, via de regra, 25 ng de amostra de DNA no interior do microtubo para PCR de 200 µL. Era preparado um volume de mistura de soluções para reação de PCR vislumbrando o total de amostras da bateria (Master Mix), acrescido quantidade para uma amostra extra, como margem de segurança, devido a efeitos inerentes a possível variação ao pipetar. Antes da colocação dos tubos no termociclador, as soluções de PCR eram sempre centrifugadas e agitadas para homogeneização do conteúdo.
Não foi necessário utilizar óleo mineral na solução de PCR, porque foi utilizado termociclador com tampa aquecida. Todos os tubos foram mantidos no gelo durante o procedimento.
inseridos na cuba, com até 14 poços de 3X1mm, suficiente para amostras de 3 µL, com utilização de um ou dois pentes no gel, por cuba, conforme SAMBROOK (1998).
Para aplicação de DNA no gel, visando a quantificação, 02 µL de DNA extraído, eram adicionadas a 01 µL de tampão de carregamento de amostras 10X. O volume total aplicado em cada poço do gel foi de 3 µL. As condições de corrida foram de 80 V e 115 mA, ajustadas na fonte de eletricidade, durante 30 a 50 min. Nos poços laterais, eram colocados DNA previamente quantificados para comparação. Estimativa-se a concentração e rendimento da extração. As amostras de DNA, após a corrida no gel, foram comparadas com o padrão de quantificação, nas concentrações de 25, 50 e 100 ng/µL, durante a exposição do gel ao UV no transiluminador, sendo realizado a documentação fotográfica digital. Para a verificação de presença de DNA amplificado, as condições gerais e os volumes de material eram as mesmas.
3.1.3.3.1. Extração de DNA
Dois meios de extração foram utilizados. Usou-se o Easy –DNA TM Kit da empresa Invitrogem Life Tecnologies, como método de primeira escolha e o método denominado extração por fenol/clorofórmio, descrito abaixo, como alternativa.
re-suspensão. O excedente era conservado a –20ºC, no próprio microtubo com tampa rosqueável, para eventualidades de re-extração.
A metodologia de extração pelo método Easy –DNA TM Kit era baseada na lise provocada pela solução A e subseqüente incubação a 65ºC. Os lipídeos e as proteínas eram precipitados e extraídos por adição da solução B e clorofórmio. A solução era centrifugada para separação em duas fases, com uma interface sólida separando-as. O DNA ficava na parte superior, na fase aquosa clara; as proteínas e os lipídeos ficavam na fase sólida intermediária e o clorofórmio na fase inferior. O DNA era removido, após precipitação em etanol e re-suspendido em tampão TE.
Nas amostras cuja quantificação da extração mostrava que o rendimento era inferior a 10 ng/µL, realizava-se a extração com fenol/clorofórmio.
O procedimento de extração pelo método de fenol/clorofórmio era feito com a seguinte técnica: Pipetado 300 µl de amostra em microtubo estéril, era adicionado 200 µL de solução de lise (72 µL NaCl 5M, 20 µL NaOH 0,2M, 10 µL de SDS 10% e 98 µL de água miliQ), acrescentado 30 µL de proteinase K 2 mg/mL e encubado a 37ºC por duas horas. O material podereia ser guardado a -20ºC ou logo em seguida submetido a extração orgânica. Ao microtubo, era acrescentado solução fenol–clorofórmio-álcool isoamílico, denominada clorofane, na proporção 25:24:1 e misturado por cerca de cinco minutos. O microtubo era centrifugado sob refrigeração a 4ºC a 12.000 rpm por 5 min, ocorrendo, ao final, formação de três camadas. A camada inferior era desprezada com o auxílio de pipeta. O processo de centrifugação e retirada da camada inferior era repetido. Para retirar o fenol usou-se uma mistura de clorofórmio (480 µL) e álcool isoamílico 24:1 denominado clorofil. Ao sobrenadante era adicionado 40 µL de acetato de sódio 3M (pH 5,2) e 1mL de etanol absoluto (2,5 X vol). O tubo era deixado a -20ºC por um mínimo de 16 horas, para precipitação. O microtubo era, a seguir, centrifugado sob refrigeração a 12.000 rpm por 5 min. Realizava-se a retirada do sobrenadante, lavava-se com etanol 70% e centrifugava-se da mesma maneira, por duas vezes. O álcool era retirado com pipeta e deixado secar naturalmente a temperatura ambiente. O precipitado era re-suspendido em 60 µL de TE e colocado a -20ºC.
3.1.3.3.2. Análise do DNA Extraído
Para confirmação de existência de material genômico humano e ausência de substâncias inibidora de PCR, foi realizado o controle interno das amostras extraídas, através de PCR para partes do gene da Glyceraldehyde-3-phosphate dehydrogenase - GAPDH, utilizando-se primers previamente desenhados, conforme a seqüência: GAPDH - 5' AAG GCT GGG GCT CAT TTG 3’ e GAPDHr - 5’ GTG TGG TGG GGG ACT GAG 3’.
A visualização da amplificação com primers GAPDH era feita em gel de agarose a 1%, preparado como descrito no item anterior.
No caso de insucesso da PCR com primers de GAPDH, tentava-se a reação novamente, variando a concentração de DNA extraído na reação de PCR. No caso de novo insucesso, realizava-se nova extração com método utilizando fenol/clorofórmio utilizando-se o material reservado.
As condições de amplificação do GAPDH, para as fases às quais o termociclador foi regulado foram as seguintes:
1- Pré-desnaturação a 94ºC por 2 minutos 2- Desnaturação a 94ºC por 30 segundos 3- Anelamento a 58ºC por 45 segundos 4- Extensão a 72ºC por 40 segundos 5- Pós-estensão a 72ºC por 5 minutos 6- Número de ciclos – 32.
Nas amplificações do DNA envolvendo o GAPDH, os componentes de uma reação (que multiplicado pelo número de reações a serem realizadas formavam o Máster Mix) foram: 2,5 mmol/L de MgCl2, 200 µmol/L de cada dNTPs 10X, 10 µmol/L de mistura de primer (05
amostras contendo DNA e, como controle positivo, a amostra tida como padrão ouro de extração (número 6), que em todos os testes, sempre se apresentou positivo para PCR.
A reação de PCR da amostra número 6 havia sido previamente comparada com uma amostra padrão de DNA de células Hela e células SeHa, submetidas a PCR com primers para GAPDH. As linhagens celulares humanas Hela e SeHa são originárias células cancerosas de colo uterino e possuem sabidamente infecção viral por diferentes subtipos de HPV. Tanto as amostras de células SeHa, células Hela e da amostra 6 foram amplificadas por PCR utilizando-se primers GADDH. (Vide item 1.2.5.)
3.1.3.3.3. Amplificação por PCR do DNA do HPV
As condições de amplificação do GAPDH, para as fases às quais o termociclador foi regulado foram as seguintes:
1 Pré-desnaturação a 94ºC por 5 minutos 2 Desnaturação a 94ºC por 30 segundos 3 Anelamento a 58ºC por 60 segundos 4 Extensão a 72ºC por 60 segundos 5 Pós-estensão a 72ºC por 5 minutos 6 Número de ciclos – 35.
Nas amplificações do DNA envolvendo o HPV, os componentes de uma reação foram: 0,75 de MgCl2 a 50 mM; 18,75 de solução com dNTPs, mistura de primer, glicerol e KCl
água em substituição às amostras contendo DNA e como controle positivo a amostra de DNA plasmídico derivado de pUC contendo seqüência genérica de papilomavírus, com bandas correspondentes a HPV oncogênico e não oncogênico.
3.1.4. Análise Estatística
A análise foi realizada no Laboratório de Estatística do Curso de Pós-graduação em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília,
O teste de correlação para dados não paramétricos de Fisher foi aplicado após a conversão de dados qualitativos em qualitativos.
Para aplicação das metodologias utilizadas na análise estatística dos resultados, os grupos foram formados baseados inicialmente na similaridade dos resultados de CO, pois as anotações constantes nas FCD eram bastante heterogêneas, ora utilizando a classificação de Papanicolaou, ora sistema NIC e ainda utilizando a terminologia do sistema Bethesda. Foi necessário realizar a consolidação e transformação de dados qualitativos em quantitativos, para possibilitar a aplicação da metodologia estatística.
3.2. RESULTADOS
Neste estudo, as análises das amostras baseadas em métodos que utilizam técnicas de biologia molecular – BM, propiciaram revelação da positividade e da negatividade para papilomavírus humano – HPV. Os procedimentos de citologia oncológica – CO e de captura híbrida – CH foram realizados conforme o item 3.3.1. Citologia e 3.3.2. Captura Híbrida e os resultados estão apresentados nas tabelas a seguir.
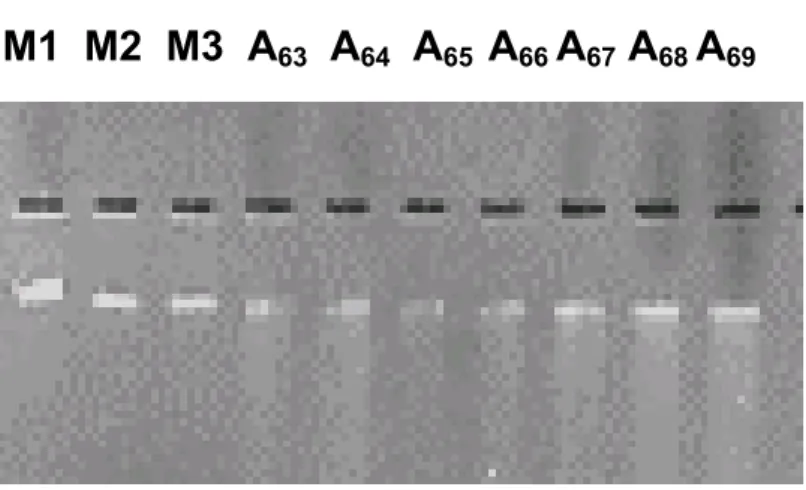
A visualização da extração de DNA das amostras de colo uterino pode ser observada na FIGURA 9. A quantificação das amostras de número 29 a 32 foram mostradas como exemplos.
FIGURA 9 - QUANTIFICAÇÃO DE DNA GENÔMICO OBTIDO DE EXTRAÇÃO DE MATERIAL DE COLO UTERINO.
M1 M2 M3 A
63A
64A
65A
66A
67A
68A
69Gel de agarose a 1%. As denominações M1, M2 e M3
correspondem a marcadores moleculares de DNA
humano, correspondendo a quantidade de 25, 50 e 100
ng, enquanto as legendas A63 a A69 são os perfis da