Sistema melatonérgico como alvo do
peptídeo β
-amiloide
The melatonergic system as a target of
amyloid-β
peptide
São Paulo
Sistema melatonérgico como alvo do
peptídeo β
-amiloide
The melatonergic system as a target of
amyloid-β
peptide
Tese apresentada ao Instituto de
Biociências da Universidade de São
Paulo, para a obtenção de Título de
Doutor em Ciências, na Área de
Fisiologia Geral.
Orientadora:
Prof
aDr
aRegina Pekelmann Markus
São Paulo
!!
!! !!!!!!!Cecon,!Erika!!
!!!!!!!!!!!!Sistema!Melatonérgico!como!Alvo!do!Peptídeo!β;Amiloide!/!Erika!! !!!!!!!Cecon!;!orientadora!Dra.!Regina!P.!Markus.!;;!São!Paulo,!2014.! !!!!!!!!!!!157!f.!!
!!!!!!!!!!!!Tese!(Doutorado)!–!Instituto!de!Biociências!da!Universidade!de!! !!!!!!!São!Paulo.!Departamento!de!Fisiologia.!
!
1.!!Glândula!pineal.!2.!Doença!de!Alzheimer.!3.!Melatonina.!I.!!! !!!!!!!!Universidade!de!São!Paulo.!Instituto!de!Biociências.!Departamento!de!! !!!!!!!!Fisiologia.!II.!Título.!!
_________________________
_________________________
Prof.(a) Dr.(a)
Prof.(a) Dr.(a)
_________________________
_________________________
Prof.(a) Dr.(a)
Prof.(a) Dr.(a)
“Agir, eis a inteligência verdadeira. Serei o que quiser.
Mas tenho que querer o que for.
O êxito está em ter êxito, e não em ter condições de êxito.
Condições de palácio tem qualquer terra larga,
mas onde estará o palácio se não o fizerem ali?”
tem colocado em meu caminho e por iluminar minha trajetória.
Agradeço a todos da minha
família
, que sempre me ofereceram apoio e amor
incondicionais e compreenderam a distância que por vezes se fez necessária durante
a execução deste projeto. Tenho muito orgulho em fazer parte desta família tão
unida, vocês são meu porto-seguro. Agradeço principalmente ao meu pai
Antonio
Carlos
e à minha mãe
Sueli
por todo incentivo, apoio e por serem meu maior
exemplo de que não existem limites nas conquistas quando há esforço e dedicação. À
minha irmã
Letícia
e meu cunhado
Chicão
, por serem também exemplos de
dedicação e por compartilharem comigo o gosto pela ciência, sempre me apoiando.
Ao meu afilhado
Luigi
, por alegrar e iluminar nossas vidas com sua presença. E ao
meu noivo
Elton
, por toda a paciência, companheirismo, cumplicidade e
compreensão ao longo de todos esses anos.
Agradeço especialmente a todos aqueles que em algum momento
participaram desta jornada no
laboratório de Cronofarmacologia
. Aos amigos
Pedro, Eduardo, Daiane, Marina, Camila, Marco, Cláudia, Leila, Sanseray, Michelle,
Eliana, Flávia, Adriessa, Eugênia, Gabis, Letícia, Luis e Luciana, por todos os
momentos compartilhados e pelos diferentes ensinamentos que me proporcionaram.
Aos técnicos Eduardo e Débora, por todo o auxílio prestado, pela amizade e por
tornarem o laboratório um lugar muito agradável de se trabalhar. A todos os novos
membros desta família, obrigada pela compreensão nesses últimos meses. Agradeço
ainda a todos do laboratório do
Institut Cochin
, pela hospitalidade e por todo
aprendizado durante os 4 meses de convivência, e ao professor
Ralf Jockers
, por
todo apoio, orientação, auxílio e contribuição a este trabalho.
Agradeço aos professores Pedro, Luciana e Zulma, pelas contribuições no
desenvolvimento deste projeto, por toda orientação e amizade. E agradeço em
especial à professora
Regina
, pela orientação ao longo de todos esses anos e também
por tantos outros ensinamentos que contribuíram muito para meu crescimento
pessoal e profissional, muito obrigada pela amizade e confiança.
Agradeço aos demais laboratórios e funcionários de Dep. de Fisiologia por
todo o auxílio prestado e pela ótima convivência.
Agradeço ainda ao apoio financeiro das agências FAPES, CAPES e CNPq,
INTRODUÇÃO
... 13
1.
A
NATOMIA E FISIOLOGIA DO SISTEMA MELATONÉRGICO... 14
1.1 A glândula pineal
... 14
1.2 Efeitos da melatonina
... 20
1.3 Mecanismos de ação da melatonina
... 23
2.
I
NTERAÇÕES ENTRE O SISTEMA MELATONÉRGICO E O SISTEMA IMUNOLÓGICO:
O EIXO IMUNE-
PINEAL... 29
2.1 Fator de transcrição NFKB
... 32
3.
S
ISTEMA MELATONÉRGICO EM CONDIÇÕES PATOLÓGICAS–
D
OENÇA DEA
LZHEIMER... 37
3.1 Peptídeo
β
-amiloide
... 40
CONCLUSÕES
... 46
RESUMO
... 47
ABSTRACT
... 49
REFERÊNCIAS BIBLIOGRÁFICAS
... 52
ANEXO 1 ... 82
Aβ peptídeo beta amiloide
APP proteína precursora amiloide
AA-NAT enzima arilalquilamina N-acetiltransferase
ACh acetilcolina
ASMT enzima acetilserotonina metiltransferase
AD doença de Alzheimer
AFMK N1-acetil-N2-formil-5-metoxiquinuramina
AMK N1-acetil-5-metoxiquinuramina
AMPA receptor de ácido α-amino-3-hidroxi-5-metil-4-isoxazolepropiônico
AMPc monofosfato cíclico de adenosina
AP-1 proteína ativadora 1
AT2 receptor de angiotensina II
ATP adenosina trifosfato
BCG Bacilo Calmette-Guerin
BRET transferência de energia bioluminescente por ressonância
COX enzima ciclooxigenase
CREB proteína de ligação ao elemento responsivo ao AMPc
DAMPs padrões moleculares associados a dano
DMEM do inglês, Dulbecco’s modified Eagle’s medium
DNA ácido desoxirribonucleico
EMSA ensaio de eletromobilidade em gel
GABA ácido gama-aminobutírico
GAPDH enzima gliceraldeído-3-fosfato desidrogenase
GPCR receptor acoplado à proteína G
GSK3 enzima glicogênio sintase quinase
HIOMT enzima hidroxindol-O-metiltransferase
HFIP 1,1,1,3,3,3-hexafluoro-2-propanol
ICAM molécula de adesão intercelular
I-Mel 2-iodomelatonina
IFN interferon
IκB proteína inibitória kappa B
IKK enzima quinase de IKB
IL interleucina
IP3 inositol trifosfato
MAPK enzimas quinases ativadas por mitógenos
MEK enzima MAP quinase-quinase regulada por sinal extracelular
ERK enzima quinase regulada por sinal extracelular
mACh receptor colinérgico muscarínico
µM micromolar
mM milimolar
MTR receptor de melatonina
NAS N-acetilserotonina
nACh receptor colinérgico nicotínico
NF-κB fator nuclear kappa B
NK células natural killers
nM nanomolar
NMDA receptor de N-metil D-aspartato
NSQ núcleo supraquiasmático
PAMPs padrões moleculares associados a patógenos
PDTC pirrolidinaditiocarbamato
PKA proteína quinase dependente de AMPc
PKC proteína quinase depende de cálcio
PLC enzima fosfolipase C
pM picomolar
PVN núcleo paraventricular hipotalâmico
RNA ácido ribonucleico
RNAm RNA mensageiro
RLuc enzima Renilla luciferase
ROR/RZR família de receptores nucleares do ácido retinóico
ROS espécies reativas de oxigênio
SNC sistema nervoso central
TAD domínio de transativação
TLR receptores do tipo toll
TNF fator de necrose tumoral
VCAM molécula de adesão de célula vascular
INTRODUÇÃO
“Só sabemos com exatidão quando sabemos pouco; à medida que vamos
adquirindo conhecimentos, instala-se a dúvida.”
INTRODUÇÃO
A melatonina é o hormônio produzido pela glândula pineal de maneira
rítmica, em sincronia com a informação luminosa ambiental. A função cronobiótica
da melatonina, atuando no ajuste de processos fisiológicos rítmicos ao ciclo
claro/escuro ambiental é certamente sua função mais conhecida. No entanto, as
propriedades desta molécula vão muito além de seus efeitos cronobióticos,
apresentando uma grande variedade de ações, muitas das quais são de grande
potencial terapêutico. A glândula pineal, o hormônio melatonina e os receptores
específicos que medeiam as ações da melatonina compõem o chamado sistema
melatonérgico. Diversos estudos têm demonstrado que este sistema encontra-se
alterado em diversas patologias, especialmente no caso da doença neurodegenerativa
conhecida como a doença de Alzheimer (AD, do inglês
Alzheimer’s disease
), em que é
relatada uma redução drástica na produção de melatonina pela glândula pineal
desde os primeiros estágios da doença e alteração na expressão dos receptores de
melatonina em algumas áreas encefálicas. Ampliar o entendimento dos mecanismos
de ação que mediam a disfunção do sistema melatonérgico permitirá não só uma
melhor compreensão da fisiopatologia de AD, como também uma caracterização de
possíveis marcadores biológicos dos estágios iniciais da doença. Além disso, o
conhecimento das alterações do sistema melatonérgico nesta patologia é
fundamental para o desenvolvimento de protocolos terapêuticos com o uso
coadjuvante de melatonina ou seus análogos no tratamento de pacientes com doença
1.
Anatomia e fisiologia do sistema melatonérgico
1.1 A glândula pineal
A glândula pineal foi primeiramente descrita por Galeno, no século II, com
base nas descrições prévias feitas pelo anatomista grego Herophilus (325-280 a.C.). O
nome “pineal” advém da descrição de seu formato de pinha,
pinea
em latim. Por ser
uma estrutura única no cérebro, contrapondo-se às demais estruturas que são
bilaterais, e pela sua posição central no cérebro de humanos, foi postulado que a
pineal exercesse um papel também central, controlando o fluxo dos pensamentos
entre os hemisférios cerebrais (revisto por Axelrod, 1974). Séculos depois, já em 1662,
o filósofo francês René Descartes (1596-1650) também atribuiu à pineal uma função
metafísica, segundo a qual este órgão ímpar seria a sede da alma, o local onde o
espírito animal se integraria ao corpo físico, controlando seus movimentos e
percepções. Seu relato dizia ainda que a glândula pineal recebia as informações
provenientes dos nossos olhos sobre o mundo real, gerando e transmitindo ao resto
do corpo a resposta adequada que deveria ser executada (revisto por Arendt, 1995).
Nota-se que a descrição feita por Descartes pelo método dedutivo estava bem
adequada ao que sabemos atualmente sobre a função da pineal, na medida em que a
considerou um importante elo de ligação entre o mundo exterior e o meio interno.
Por muito tempo acreditou-se que a pineal de humanos era somente um
órgão vestigial, correspondente ao órgão parietal (ou “terceiro olho”) que tem função
de fotorrecepção nos vertebrados inferiores (Dandy, 1915; Oksche, 1965). A primeira
função da pineal foi descrita em 1917, com a observação de que extratos de pineais
dermatologista Aaron B. Lerner isolou o composto ativo presente nestes extratos e o
denominou de melatonina (Lerner
et al.
, 1958, 1960). Estudos subsequentes
caracterizaram rapidamente a via de síntese e metabolização desse novo hormônio,
os locais onde ocorre sua produção e até mesmo o caráter rítmico com que a pineal o
produz (Lerner
et al
., 1960; Axelrod & Weissbach, 1961; Quay, 1963, 1964; Klein &
Weller, 1970).
A glândula pineal é um órgão neuroendócrino, diferenciado durante o
desenvolvimento embrionário a partir de uma evaginação do teto do terceiro
ventrículo. A pineal corresponde também a um dos órgãos circunventriculares, o que
implica que está localizada fora da barreira hematoencefálica. Anatomicamente, a
pineal é descrita como parte do epitálamo e, portanto, do diencéfalo. Na maioria dos
mamíferos a glândula pineal situa-se dorsalmente à região caudal do diencéfalo,
entre as comissuras habenular e posterior, ocupando uma posição bem centralizada
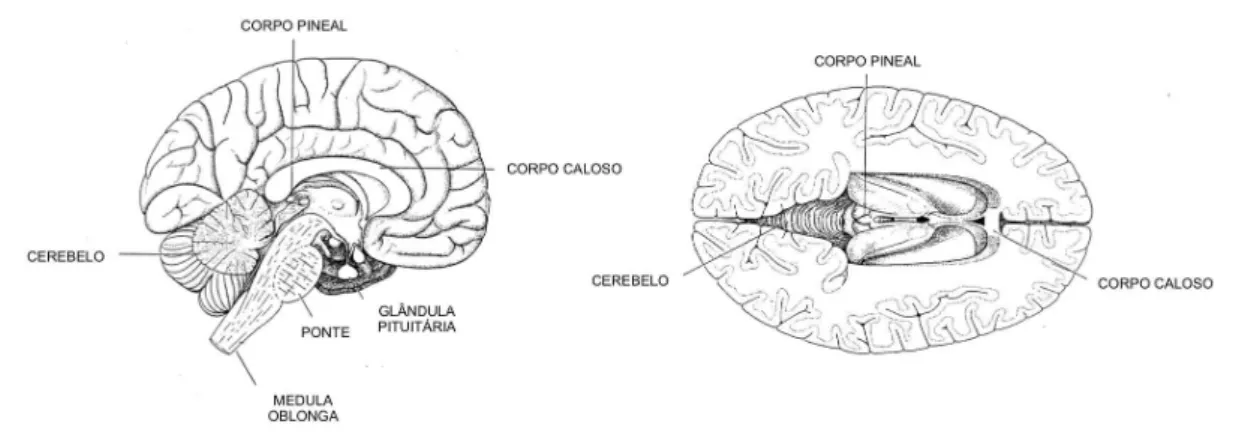
no encéfalo, conforme observa-se na figura 1. Nos roedores, a glândula apresenta
uma forma mais alongada e localização mais superficial devido a uma migração do
órgão na direção dorso-caudal, mas sua porção profunda mantém-se na região
circunventricular (Møller & Baeres, 2002). Estruturalmente, a glândula pineal é
composta por diversos tipos celulares, sendo que aproximadamente 80% das células
são neuroendócrinas, denominadas de pinealócitos. Essas células têm a mesma
origem ectodérmica que células neuronais e são responsáveis pela produção de
melatonina (Arendt, 1995; Ekström & Meissl, 2003). Também fazem parte da pineal
as células gliais, mais especificamente astroglia e microglia (Pedersen
et al
., 1993; Sato
Figura 1 –Posição central da glândula pineal no cérebro humano. À esquerda, corte sagital com visualização lateral do encéfalo; à direita, corte horizontal e visualização pela face superior (adaptado de Wurtman & Axelrod, 1965).
A glândula pineal é um dos componentes do sistema de temporização interno
dos verterbrados, seu hormônio – a melatonina – é uma importante eferência do
relógio biológico central. Esse sistema garante organização temporal nas funções
fisiológicas, permitindo ao organismo antecipação e adaptação aos fenômenos
cíclicos ambientais, como o dia e noite e as estações do ano (Menaker
et al
., 1997). A
produção de melatonina pela glândula pineal obedece um ritmo circadiano,
apresentando concentrações plasmáticas baixas na fase de claro ambiental e altas na
fase de escuro. O pico de melatonina noturno é, portanto, o sinal endócrino que
traduz a presença e a duração do escuro ambiental, permitindo que o organismo
distinga entre dia e noite e entre as estações do ano.
Anatomicamente, a regulação da atividade da glândula pineal depende de
conexões multissinápticas que transmitem a informação fótica ambiental até a pineal.
Através do trato retino-hipotalâmico a informação luminosa captada pela retina é
transmitida
aos
núcleos
supraquiasmáticos
hipotalâmicos
(NSQs),
que
correspondem ao relógio biológico central de mamíferos (Inouye & Kawamura,
passando pela coluna intermédio lateral da medula. Essa informação chega então à
glândula pineal através das fibras simpáticas que a inervam, provenientes do gânglio
cervical superior (Teclemariam-Mesbah
et al.
, 1999). Durante a fase de claro
ambiental, a sinalização GABAérgica (ácido gama-aminobutírico) entre os neurônios
dos NSQs e do PVN inibe a propagação da via neste ponto, enquanto que na fase de
escuro este bloqueio deixa de ocorrer e as fibras simpáticas que inervam a glândula
liberam os neurotransmissores noradrenalina e ATP (adenosina trifosfato) (Klein
et
al
., 1983; Mortani-Barbosa
et al
., 2000). A sinalização desencadeada pela
noradrenalina nos pinealócitos induz a síntese de melatonina e é reponsável pelo
caráter rítmico da atividade endócrina da pineal.
A ativação de receptores
β
1-adrenérgicos pela noradrenalina, que são
receptores de membrana acoplados à proteína G estimulatória (G
s), induz aumento
nos níveis intracelulares de AMPc (monofosfato cíclico de adenosina), ativando a
proteína kinase A (PKA) e o fator de transcrição CREB (do inglês,
cAMP response
element binding protein
). Nos pinealócitos de roedores, este fator regula positivamente
a transcrição gênica da enzima arilalquilamina N-acetiltransferase (AA-NAT),
essencial na via biossintética da melatonina (Baler
et al
., 1997). Já em primatas, o gene
de AA-NAT é constantemente transcrito e a proteína é rapidamente degradada.
Neste caso, a cascata de sinalização β-adrenérgica leva à fosforilação da enzima
AA-NAT por PKA, possibilitando sua ligação à proteína chaperona 14-3-3, formando um
complexo funcionalmente ativo e protegido contra ação proteassomal durante o
escuro ambiental (Schomerus
et al
., 2000). Além da indução da atividade da AA-NAT
ocorrer somente no escuro, a luz exerce efeito inibitório sobre esta enzima, visto que
exposição à luz durante a fase de escuro induz rapidamente sua degradação na
portanto, resultante da regulação transcricional (no caso de roedores) ou
pós-traducional (no caso de primatas) da enzima AA-NAT. A noradrenalina pode ainda
ativar receptores do tipo α
1-adrenérgicos que, embora não sejam capazes de induzir
a síntese de melatonina por si só, potenciam o efeito induzido pela ativação
β-adrenérgica, via sinalização pela proteína G
qe aumento de cálcio intracelular (Klein
et al
., 1983; Ho
et al
., 1988). A ativação de receptores purinérgicos do tipo P2Y
1pelo
co-transmissor ATP também pontencia a atividade neuroendócrina da pineal
induzida por noradrenalina via aumento de cálcio intracelular (Ferreira
et al
., 1994,
2003).
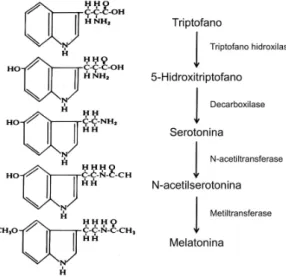
A melatonina é uma indolamina derivada do aminoácido triptofano. Sua
síntese inicia-se com a captura do triptofano da corrente sanguínea, que é
hidroxilado a 5-hidroxitriptofano (5-HTP), cuja descarboxilação dá origem à
serotonina (5-hidroxitriptamina), neurotransmissor relevante em várias sinapses
centrais e no trato gastrointestinal (revisto por Domínguez-López
et al
., 2012;
Gershon, 2013). Na presença da enzima-chave AA-NAT a serotonina é convertida em
N-acetilserotonina (NAS), precursora da melatonina que também é liberada na
corrente sanguínea. Por fim, sob ação da enzima acetilserotonina metiltransferase
(ASMT), também conhecida como hidroxindol-O-metiltransferase (HIOMT), a NAS é
metilada e forma a melatonina (Simonneaux & Ribelayga, 2003). A figura 2 detalha a
cascata enzimática que compõe a via de biossíntese de melatonina, apresentando a
estrutura bioquímica de cada molécula, enquanto que a figura 3 ilustra o caráter
rítmico dessa produção, seja em animais de hábito diurno, como os humanos, ou de
Figura 2 – Via de biossíntese da melatonina. Cascata enzimática da metabolização do aminoácido triptofano até a formação de melatonina.