Universidade Federal de Ouro Preto Núcleo de Pesquisas em Ciências Biológicas Programa de Pós-Graduação em Biotecnologia
Marcos Vinicius Simi Almeida
Envolvimento do íon cálcio na resposta ao estresse ácido em Saccharomyces cerevisiae
Marcos Vinicius Simi Almeida
Envolvimento do íon cálcio na resposta ao estresse ácido em Saccharomyces cerevisiae
Dissertação de Mestrado
Orientador: Prof. Dr. Ieso de Miranda Castro
Dissertação apresentada ao Programa de Pós-graduação em Biotecnologia do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do título de Mestre em Biotecnologia, área de concentração Biotecnologia Industrial.
A447e Almeida, Marcos Vinicius Simi.
Envolvimento do íon cálcio na resposta ao estresse ácido em
Saccharomyces cerevisiae [manuscrito] / Marcos Vinicius Simi Almeida. -
2014.
xi, 54f.: il.; colo.; grafs.; tabs.
Orientador: Prof. Dr. Ieso de Miranda Castro.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Programa de Pós-Graduação em Biotecnologia. Área de concentração: Biotecnologia.
1. Cálcio - Teses. 2. Saccharomyces cerevisiae - Teses. 3. Stress
(Fisiologia) - Estresse ácido - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Agradecimentos
Ao prof. Dr. Ieso de Miranda Castro, pela oportunidade, orientação e por partilhar comigo um pouco de seu vasto conhecimento.
Aos meus pais, pelo amor incondicional e por acreditarem em todas as minhas decisões. Amo vocês!
Ao Caio, pelo companheirismo e por deixar alegres e mais leves todos os momentos difíceis.
Ao prof. Dr. Rogelio Lopes Brandão, pela colaboração e disponibilidade.
À Zezé, pelo cuidado, carinho e apoio a qualquer hora.
Às antigas amizades, Sabeline, Ananda, Audalice e Lara, pelo incentivo e “puxões de orelha”.
Às novas amizades, Diogo, Heloá e Débora, pessoas já mais que especiais. Sentirei saudades!
Aos colegas de mestrado e do LBCM, pela vivência e troca de experiências. Sucesso aos que ficam!
Aos professores e funcionários do NUPEB, pela dedicação.
Ao prof. Dr. Rodrigo Resende e ao Anderson do Laboratório de Sinalização Celular e Nanobiotecnologia da UFMG, pela receptividade e grande ajuda.
À CAPES, FAPEMIG e CNPq, pelo financiamento da pesquisa.
Envolvimento do íon cálcio na resposta a estresse ácido em
Saccharomyces cerevisiae
RESUMO
Para manter sua capacidade produtiva, as células de leveduras precisam adaptar-se às mudanças ambientais que ocorrem durante o processo produtivo. A resposta a baixo pH é de interesse, pois tal exposição ocorre sob condições industriais como no tratamento ácido para redução de contaminação bacteriana antes da reciclagem celular em processos fermentativos. Semelhante à resposta a ácidos orgânicos, a resistência a ácidos inorgânicos envolve mudanças da permeabilidade de membrana, extrusão ativa de H+ e modulação da expressão gênica. O presente trabalho estudou a participação do íon cálcio na resposta ao estresse ácido na levedura Saccharomyces cerevisiae. Os resultados obtidos mostram elevação transitória dos níveis citoplasmáticos de Ca2+ desencadeada por pulso ácido e que esta mudança decorre do influxo de cálcio extracelular e da mobilização vacuolar do íon. Testes de viabilidade celular sugerem que a tolerância da S. cerevisiae a estresse ácido envolve a ativação da via de sinalização da calcineurina dependente de Ca2+/calmodulina e consequente regulação da expressão de alguns genes mediada pelo fator de transcrição Crz1p/Tcn1p. A tolerância dos mutantes nulos da via de sinalização da quinase Snf1p, responsável pela utilização de fontes alternativas de carbono, foi menor em relação à cepa parental BY4741, sugerindo a participação desta via na resposta a baixo pH. Em conjunto, os resultados mostram a importância das vias de sinalização da fosfatase calcineurina e da quinase Snf1p para a resposta da S. cerevisiae a estresse ácido.
Calcium involvement in acid stress response in
Saccharomyces
cerevisiae
ABSTRACT
To maintain their productive capacity, yeasts cells need to adapt to environmental changes that occur during production process. Acid stress response is of interest, because such exposure occurs under industrial conditions, such as the acidic treatment to reduce bacterial contamination before cell recycling in fermentation process. Resembling the response to organic acids, resistance to inorganic acids exposure involves changes in membrane permeability, active extrusion of H+ and gene expression modulation. The present work studied ion calcium involvement in acid stress response in Saccharomyces cerevisiae. Results show that there is transient elevation of cytoplasmic Ca2+ levels triggered by acid pulse and this happens through influx of extracellular calcium and vacuolar mobilization. Cell viability tests suggest that tolerance of S. cerevisiae to acid stress involves the Ca2+/calmodulin-dependent calcineurin pathway activation and subsequent gene expression regulation mediated by the transcription factor Crz1p/Tcn1p. The tolerance of null mutants of the kinase Snf1p signaling pathway, responsible for the use of alternative carbon sources, was lower compared to the parental strain BY4741, suggesting the involvement of this pathway in response to low pH. Together, the results show the importance of calcineurin and Snf1p signaling pathways to S. cerevisiae response to acid stress.
Lista de figuras
Figura 1: Via de sinalização da calcineurina dependente de Ca2+/calmodulina e transportadores de cálcio...13
Figura 2: Via de sinalização da quinase Snf1p...15
Figura 3: Representação da fotoproteína aequorina...20
Figura 4: Sinal de cálcio em Saccharomyces cerevisiae BY4741 utilizando o método da aequorina...25
Figura 5: Sinal de cálcio em Saccharomyces cerevisiae BY4741 utilizando o indicador de cálcio Oregon Green® 488 BAPTA-1, AM...27
Figura 6: Sinal de cálcio induzido por pulso ácido (HCl pH4,1) na cepa parental BY4741 e nos mutantes nulos de canais de cálcio mid1Δ, cch1Δ e yvc1Δ, utilizando o ensaio do indicador Oregon Green® 488-1 BAPTA, AM...29
Figura 7: Sinal de cálcio em BY4741 induzido por pulso ácido (HCl pH4,1) na presença de 4mM finais de EGTA, ou 5mM finais de Mg2+, ou 8mM finais de BAPTA, AM, utilizando o ensaio do indicador Oregon Green® 488-1 BAPTA, AM...29
Figura 8: Efeito do estresse ácido (HCl pH2,0 + 86mM de NaCl) na viabilidade celular de mutantes de canais de cálcio...30
Figura 9: Viabilidade celular de mutantes da via da calcineurina e da cepa parental BY4741 incubada com o inibidor de calcineurina FK506, expostos a estresse ácido (HCl pH2,0 + 86mM de NaCl)...31
Figura 10: Crescimento da cepa parental BY4741 e dos mutantes da via da calcineurina em meio SD completo pH2,5...32
Figura 11: Viabilidade celular de mutantes da via da Snf1p após 30 minutos de exposição a HCl pH2,0 + 86mM de NaCl...33
Lista de tabelas
Tabela 1: Cepas de Saccharomyces cerevisiae utilizadas no trabalho...18
Lista de abreviaturas
ANOVA: análise de variância ATP: adenosina trifosfato CaM: calmodulina
CDRE: elementos de resposta dependentes de calcineurina (do inglês calcineurin-depedent response elements)
CWI: integridade de parede celular (do inglês cell wall integrity) DO: densidade óptica
DMSO: dimetilsulfóxido
EUROSCARF: European Saccharomyces cerevisiae Archive for Functional Analysis GSR: resposta a estresse em geral (do inglês general stress response)
IP3: inositol-1,4,5-trifosfato PKA: proteína quinase A PKC: proteína quinase C pH: potencial hidrogeniônico
Índice
1.Introdução ... 1
1.1.Leveduras Saccharomyces cerevisiae ... 1
1.1.1.A produção de bioetanol em números ... 2
1.2.Situações de estresse ... 3
1.2.1.Resposta a estresses em S. cerevisiae ... 4
1.2.2.O estresse ácido em S. cerevisiae ... 5
1.2.3.Mecanismos de resposta ao estresse ácido provocado por ácidos inorgânicos fortes... 7
1.3.Cálcio ... 10
1.3.1.A via da calcineurina e os transportadores de cálcio ... 11
1.4.A via de sinalização da proteína Snf1p ... 14
1.4.1.Interação entre Snf1p e cálcio ... 16
2.Objetivos ... 17
2.1.Objetivo geral ... 17
2.2.Objetivos específicos ... 17
3.Metodologia ... 18
3.1.Cepas utilizadas ... 18
3.2.Condições de cultivo ... 19
3.3.Monitoramento de cálcio citoplasmático ... 19
3.3.1.Ensaio da aequorina ... 19
3.3.2.Ensaio do indicador Oregon Green® 488 BAPTA-1, AM ... 21
3.4.Teste de viabilidade celular ... 22
3.5.Curva de crescimento ... 23
3.6.Reprodutibilidade e análise estatística ... 23
4.Resultados ... 24
4.1.Elevação dos níveis intracelulares de cálcio, induzidos por pulso ácido, utilizando a técnica da aequorina ... 24
4.2.Elevação dos níveis de Ca2+ citosólico induzida por pulso ácido utilizando o indicador Oregon Green® 488 BAPTA-1,AM ... 26
4.4.Importância dos canais de cálcio para a viabilidade das células expostas
a tratamento ácido (HCl pH2,0 mais 86mM de NaCl) ... 30
4.5.Participação da via de sinalização da calcineurina dependente de Ca2+/calmodulina na resposta a estresse ácido ... 31
4.6.Participação da via de sinalização da quinase Snf1 na resposta a estresse ácido ... 32
5.Discussão ... 34
6.Conclusões ... 37
7.Perspectivas ... 38
8.Referências bibliográficas ... 39
9.Anexo ... 54
1.Introdução
Leveduras Saccharomyces cerevisiae são amplamente utilizadas em processos fermentativos para a produção de etanol combustível e bebidas. Entretanto, para manter a capacidade produtiva, a levedura deve adaptar-se e sobreviver às mudanças ambientais que ocorrem durante o processo produtivo, entre elas a exposição a ácidos inorgânicos fortes. Células eucariotas respondem aos estímulos externos através de uma complexa rede de vias de sinalização, sendo que o íon cálcio participa da transdução de sinais e regulação de diversos processos fisiológicos, incluindo resposta a estresses. Em S. cerevisiae, já foi descrito o envolvimento do Ca2+, por exemplo, na resposta a estresses alcalino, salino e oxidativo. Contudo, pouco se encontra na literatura sobre sua atuação em condições de estresse ácido.
1.1.Leveduras Saccharomyces cerevisiae
As leveduras são fungos unicelulares presentes em praticamente toda a superfície terrestre, podendo ser encontradas associadas a vegetais, animais e substratos fornecedores de açúcar em ambientes onde poucos outros microrganismos podem desenvolver-se (Phaff & Starmer, 1987). Sem habilidade fotossintética e dependentes de fontes de carbono providas por outros organismos, as leveduras são fundamentais em processos biológicos como a decomposição de matéria orgânica e a fermentação de carboidratos (Phaff, 1990).
(Nasheuer et al., 2002; Brocard-Masson & Dumas, 2006; Biddick & Young, 2009; Karathia et al., 2011).
Além de ser alvo de pesquisas de base, a S. cerevisiae desempenha importantes papéis de interesse econômico e ambiental. Registros de modelos de fermentação encontrados em papiros e esculturas do Antigo Egito mostram que as leveduras estão presentes na alimentação do homem desde a época em que se estabeleceu a prática agrícola. Atualmente, as leveduras participam de processos biotecnológicos de caráter ambiental (biorremediação de resíduos, utilização de subprodutos industriais, controle biológico e bioabsorção de metais), na produção de fármacos, na secreção de proteínas bioativas e na fermentação (panificação e produção de bebidas e bioetanol) (Walker, 1998). A S. cerevisiae possui características fisiológicas e bioquímicas que favorecem seu uso em todos os processos citados e é classificada como Generally Regarded as Safe (GRAS) pela Food and Drug Administration (FDA), um critério para aplicações de microrganismos nas áreas alimentícia e farmacêutica.
Leveduras da espécie S. cerevisiae possuem alta tolerância ao etanol e são capazes de crescer rapidamente em presença de oxigênio e sob a anaerobiose característica da fermentação em larga-escala (Knauf & Kraus, 2006). Em ambas as condições, convertem açúcar em etanol e dióxido de carbono por meio de metabolismo fermentativo, além de produzirem compostos secundários como álcoois superiores e ésteres (Kobayachi et al., 2008). Por esses motivos a S. cerevisiae é o microrganismo mais utilizado nas indústrias de bebidas e etanol.
1.1.1.A produção de bioetanol em números
seu emprego e reforça a importância de que seja promovido em bases competitivas (BIOETANOL, 2008).
A produção do etanol acontece por meio de biomassa que contenha quantidade significativa de amido ou açúcares fermentáveis. Nos processos que utilizam trigo, milho ou outro cereal, é necessária a conversão enzimática do amido em glicose antes da fermentação. Esta etapa é dispensável na produção que tem a cana-de-açúcar ou a beterraba como matérias-primas, visto que tais vegetais são fontes diretas de sacarose. Há ainda uma terceira alternativa, ainda em desenvolvimento, baseada na hidrólise de materiais celulósicos (Mussato et al., 2010). Após a extração, os açúcares liberados são então fermentados pela S. cerevisiae e o vinho resultante é destilado para separação do bioetanol.
Segundo dados da Food and Agriculture Organization (FAO), a produção de cana-de-açúcar tem crescido desde a década de 1990, bem como a de etanol, e representa um dos cultivos comerciais mais importantes do mundo. O Brasil é um dos maiores produtores mundiais de cana-de-açúcar e etanol (FAO, 2014) e nos últimos dois anos ultrapassou os Estados Unidos na exportação desse biocombustível (MDIC, 2014). O Ministério da Agricultura contabilizou em primeiro de março deste ano cerca de 650 milhões de toneladas de cana moídas na safra 2013/2014 e quase 28 milhões de metros cúbicos de etanol produzidos (MAPA, 2014). Com o aumento da produção e da demanda pelo bioetanol, produtores e Estado continuam interessados em artifícios que reduzam ainda mais os custos do processo, incluindo aqueles que melhorem a capacidade produtiva da S. cerevisiae.
1.2.Situações de estresse
ambientais (Gash et al., 2000; Causton et al., 2001). Entender a resposta das células às mudanças ambientais é de interesse, pois pode fornecer indícios dos aparatos moleculares que as permitem adaptarem a novos ambientes e dos mecanismos envolvidos no remodelamento da expressão gênica que ocorre em resposta a esses estímulos (Causton et al., 2001).
1.2.1.Resposta a estresses em S. cerevisiae
Organismos multicelulares podem usar órgãos e tecidos especializados para proporcionar um ambiente interno relativamente estável e homogêneo, enquanto que organismos unicelulares, como as leveduras Saccharomyces cerevisiae, utilizam mecanismos autônomos para a adaptação às mudanças ambientais drásticas. A expressão gênica necessária para a manutenção do meio intracelular ideal em um determinado ambiente pode ser diferente daquela necessária em outra situação. Assim, quando as condições ambientais mudam abruptamente, a célula deve ajustar rapidamente sua expressão gênica para se adaptar às novas condições (Gash et al., 2000). Vários sistemas de regulação são implicados na modulação destas respostas, mas a rede completa de reguladores de respostas ao estresse e os detalhes de suas ações, incluindo os sinais que eles ativam e os alvos que eles regulam, continuam sendo alvos de estudos (Gash et al., 2000).
Alguns estudos identificaram uma sequência de nucleotídeos comum aos promotores de genes induzidos por estresse conhecida como Elemento de Resposta a Estresse (Stress Response Element, STRE), sugerindo que estes genes são regulados pelo mesmo fator de transcrição (Kobayashi & McEntee, 1990; Kobayashi & McEntee, 1993; Marchler et al., 1993). Os fatores de transcrição Msn2p e Msn4p foram hipoteticamente considerados como responsáveis pela regulação de genes contendo STRE. Tal hipótese foi confirmada pela maior sensibilidade de cepas com mutações nos genes MSN2 e MSN4 em condições variadas de estresse e pela down regulation de genes envolvidos na resposta a esses estresses (Martinez-Pastor et al., 1996; Schmitt & McEntee, 1996; Boy-Marcotte et al., 1998; Moskvina et al., 1998). Desta forma, Msn2p e Msn4p passaram a ser conhecidos como fatores
resposta a estresses ambientais estão envolvidos em uma ampla variedade de processos importantes para, por exemplo, adaptação a redução de fontes de carbono, presença de íons, espécies reativas de oxigênio, variações de pH e temperatura e manutenção da integridade de estruturas celulares (Gash et al., 2000; Causton et al., 2001;Gash, 2003).
A localização nuclear de Msn2p e Msn4p é regulada pela proteína quinase A (PKA). Uma vez ativa, a PKA fosforila os fatores regulando negativamente sua entrada no núcleo da célula. Isso impede a transcrição dos genes que possuem STRE em seu promotor e diminui a resposta a estresses (Marchler et al., 1993; Boy-Marcotte et al., 1998; Gorner et al., 1998).
Outras vias de sinalização também estão envolvidas na regulação da expressão gênica para adaptação a mudanças ambientais. A via da proteína quinase C (PKC) é ativada em resposta a alterações na parede celular que podem ser provocadas por várias condições, incluindo choques térmicos e osmóticos (Levin & Bartlett-Heubusch, 1992; Kamada et al., 1995; Heinisch et al, 1999; Nierras & Warner, 1999). A ativação da cascata da PKC desencadeia mudanças na expressão gênica, reorganização do citoesqueleto e regulação do ciclo celular, indicando envolvimento desta via na resposta a condições estressantes que podem danificar estruturas celulares (Gray et al., 1997; Delley & Hall, 1999; Jung & Levin, 1999; Harrison et al., 2001). A via de sinalização sensível a alta osmolaridade (via HOG) é ativada sobretudo para a sobrevivência da célula a choques hiperosmóticos (Alexander et al., 2001; Teiger et al., 2001), mas a sua interação com outras vias e participação na resposta a outros estresses também têm sido relatadas (Saito & Tatebayashi, 2004; Hohmann, 2009; Rodriguez-Peña et al., 2010; Wang et al., 2011; Lucena et al., 2012). Há ainda outras vias de regulação da expressão gênica envolvidas na adaptação a mudanças ambientais, como a sinalização por cálcio e a via da proteína Snf1p, que serão melhor discutidas posteriormente.
1.2.2.O estresse ácido em S. cerevisiae
forma liofilizada como probiótico para o tratamento de diarreias. De acordo com a
Organização Mundial de Saúde, probióticos “são organismos vivos que, quando
administrados em quantidades adequadas, conferem benefício à saúde do
hospedeiro”.
Esta levedura, quando oralmente administrada, alcança o intestino onde reduz a atuação de enteropatógenos. Os mecanismos propostos pelos quais a S. boulardii controla a doença diarréica são variados. Encontram-se na literatura, por exemplo, inibição e/ou neutralização de toxinas de C. difficile (Castagliuolo et al., 1996, 1999), E. coli e V. cholerae (Dias et al., 1995), modulação da resposta imunológica do hospedeiro (Qamar et al., 2001) e até mesmo ligação e internalização da toxina do vibrião colérico pela levedura (Brandão et al., 1998; Neves et al., 2002).
Para que a S. boulardii exerça seu papel probiótico, ela deve ser capaz de responder e sobreviver à passagem pelo estômago, onde será exposta a estresse ácido quando entrar em contato com o suco gástrico de pH 2,0. Segundo Fietto e colaboladores (2004), S. boulardii é uma S. cerevisiae, mas com diferenças metabólicas e fisiológicas. Uma das diferenças é a maior viabilidade em meio ácido da S. boulardii em relação à cepa de laboratório S. cerevisiae W303, observada por
Sant’Ana e colaboradores em 2009.
Durante a produção de bebidas e etanol, a S. cerevisiae é exposta a condições estressantes, como mudanças de temperatura (Daquinag et al., 2007), escassez de nutrientes (Trabalzini et al., 2003), presença de espécies reativas de oxigênio (Zhao et al., 2014), variações de pH (Melo et al., 2010) e o próprio aumento da concentração de etanol (Araki et al., 2009), que podem comprometer a eficiência da fermentação.
A S. cerevisiae cresce muito melhor em meios ácidos do que em neutros ou alcalinos (Ariño, 2010). Entretanto, a exposição das células a baixo pH pode causar a desnaturação de proteínas e consequente perda de funções e morte celular. Nos processos fermentativos, a levedura é submetida a estresse ácido tanto pela exposição a ácidos orgânicos fracos, quanto a ácidos inorgânicos fortes.
microbiota, além de competir com a levedura por nutrientes, produz ácidos orgânicos que podem ser tóxicos e diminuem o pH do meio fermentativo. Algumas bactérias, por exemplo, produzem ácidos acético e lático na presença de sacarose e são capazes de reduzir a capacidade produtiva da levedura.
Para reduzir a contaminação bacteriana na indústria alimentícia, os ácidos acético e lático também são adicionados como conservantes, assim como os ácidos succínico, sórbico e cítrico. Os mecanismos de resposta a ácidos orgânicos fracos já são mais estudados e incluem transformação química dos mesmos, extrusão de prótons, redução da permeabilidade de membrana plasmática e modulação da expressão gênica (Kapteyn et al., 2001; Piper et al., 2001; Guadalupe Cabral et al., 2004; Lawrence et al., 2004; Schüller et al., 2004; Kawahata et al., 2006; Mira et al., 2010).
Na indústria de etanol são utilizadas outras alternativas para inibir o crescimento bacteriano: o emprego de antibióticos (Wheals et al., 1999) e o tratamento das células de S. cerevisiae com ácido inorgânico (Melo et al., 2010). Neste tratamento, a levedura é recolhida após o término da fermentação e lavada com solução aquosa de ácido sulfúrico de pH aproximadamente igual a 2,5. A manutenção da viabilidade celular da levedura durante esse procedimento é essencial para que ela conserve seu potencial produtivo e possa ser reutilizada em outras etapas fermentativas, o que é atrativo, do ponto de vista financeiro, para o produtor de etanol.
1.2.3.Mecanismos de resposta ao estresse ácido provocado por ácidos inorgânicos fortes
em vacúolos, as H+-ATPases contribuem para manter a neutralidade do pH citosólico (Portillo, 2000).
A função básica da H+-ATPase de membrana plasmática é gerar um gradiente eletroquímico de prótons através de transporte ativo que requer clivagem de ATP. Consequentemente, o bombeamento de prótons do citoplasma para o meio extracelular energiza transportadores secundários importantes para a captação de nutrientes e manutenção da homeostase iônica (Serrano et al., 1986; Rao et al., 1993). Além disso, a ativação da H+-ATPase é essencial para o crescimento celular e sobrevivência da S. cerevisiae em meio ácido graças à manutenção da homeostase de pH (Serrano et al., 1986; Eraso & Gancedo, 1987).
O gene ENA1 de S. cerevisiae codifica uma bomba de sódio de membrana plasmática também dependente de ATP e responsável pela extrusão de íons Na+ e também K+ e Li+ (Ruiz & Ariño, 2007). Diferente de PMA1, que tem expressão constitutiva, ENA1 é expresso de forma influenciada por condições alcalinas, por Na+ e por Li+ e é imprescindível para a sobrevivência da célula em maiores concentrações de sódio.
Sant’Ana e colaboradores (2009) testaram a viabilidade celular de S. boulardii e S. cerevisiae W303 em diferentes concentrações de sódio e em meio gástrico simulado (solução aquosa de HCl pH 2,0 suplementada com 86mM de NaCl). A S. boulardii apresentou menor viabilidade em maiores concentrações de Na+, por possuir menor expressão de ENA1 quando comparada à S. cerevisiae, mas se mostrou mais viável nas condições ácidas. Além disso, a presença de Na+ em baixas concentrações encontradas no suco gástrico conferiu proteção às células das leveduras contra o estresse ácido através da estabilização do potencial de
membrana (Sant’Ana et al., 2009).
Recentemente, nosso grupo avaliou a viabilidade celular e ativação da H+ -ATPase de membrana em diferentes mutantes expressando diferentes números de cópias do gene ENA1. Nossos resultados mostraram uma correlação entre os níveis de ENA1 e a atividade de Pma1p em resposta a choque ácido. Quanto menor a expressão de ENA1, maior a atividade da H+-ATPase e, consequentemente, maior a viabilidade celular em baixo pH (Brandão et al., 2014).
plasmática (Pma1p). A H+-ATPase é ativada por dois principais fatores, glicose e pH, mas estresses desencadeados por etanol, ácidos orgânicos e temperatura também são capazes de aumentar a atividade da proteína (Portillo, 2000) e seu funcionamento requer gasto de energia através da clivagem de ATP.
Os carboidratos de reserva energética, trealose e glicogênio, também têm sido estudados em resposta a baixos pHs. A trealose é um dissacarídeo não redutor encontrado em fungos, bactérias, algas, insetos, plantas e leveduras e é acumulada na fase estacionária de divisão celular para ser mobilizada em períodos de retomada de crescimento. Durante a fase exponencial e em condições adequadas, os níveis de trealose são baixos, mas observa-se acúmulo e posterior consumo do dissacarídeo em condições de estresse, pois outra função atribuída a este é a de proteção celular, estabilizando membranas e prevenindo a desnaturação de proteínas (Singer & Lindquist, 1998; Sola-Penna & Meyer-Fernandes, 1998; Mahmud et al., 2010; Trevisol et al., 2011). O glicogênio é um polissacarídeo constituído exclusivamente por monômeros de glicose que, diferentemente da trealose, é acumulado quando há glicose abundante e sua mobilização ocorre na fase estacionária durante a privação de nutrientes (François & Parrou, 2001). Na presença de glicose, há ativação da proteína quinase A (PKA) que fosforila os fatores de transcrição Msn2p e Msn4p. Estes fatores reconhecem e se ligam à sequência de nucleotídeos STRE encontrada no promotor de genes envolvidos na resposta a estresse, regulando a expressão. A fosforilação e consequente saída destes fatores do núcleo culminam na menor adaptação a mudanças ambientais (Estruch, 2000; Görner et al., 2002; Rolland et al., 2002; Casado et al., 2011). O acúmulo de glicogênio na ausência de Msn2p e Msn4p sugere então uma ligação entre a resposta a estresses variados e a mobilização de glicogênio (Smith et al., 1998).
o estresse subletal (Mahmud et al., 2010), assim como as células submetidas a um tratamento prévio em pH ácido foram mais resistentes a altas concentrações de ácido acético (Giannattasio et al., 2005) e a congelamento (Chu-Ky et al., 2013).
As respostas a mudanças ambientais envolvem diversas vias de sinalização. Quando a S. cerevisiae é exposta a pH alcalino, por exemplo, há envolvimento de várias vias para a adaptação celular (Ariño; 2010). A participação de diferentes vias e a interação entre elas também têm sido estudadas em resposta a pH ácido. Melo e colaboradores (2010) observaram a importância da ativação da via de resposta a estresses em geral (General Stress Response pathway, GSR) para a sobrevivência de células de S. cerevisiae a estresse ácido e maior tolerância de uma cepa devido a uma deficiência na ativação da via da PKA em resposta a H2SO4.
Durante o crescimento, a via de integridade da parede celular (Cell Wall Integrity, CWI) é ativada para ajustar a parede celular ao aumento de volume e permitir a divisão (Levin, 2005). A CWI também responde quando há danos no invólucro da célula devido a mudanças ambientais e estresses (Saito & Tatebayashi, 2004). As alterações na parede celular são detectadas pelos sensores Wsc1-4p e Mid2p e desencadeiam síntese de β-1,3 glucana e ativação da proteína quinase C (PKC) que ativa a cascata das quinases ativadas por mitose (MAPK), levando à expressão de genes envolvidos na biossíntese e reparo de parede celular (Chen & Thorner, 2007; Fuchs & Mylonakis, 2009). A CWI também pode interagir com a via HOG, envolvida na resposta a choque osmótico, e a interação destas duas com outras vias, incluindo a via da calcineurina dependente de cálcio, vem sendo observada como fator para aumento da tolerância a diferentes estresses (Saito & Tatebayashi, 2004; Claret et al., 2005; Kullas et al., 2007; Hohmann, 2009; Rodriguez-Peña et al., 2010; Wang et al., 2011; Lucena et al., 2012).
1.3.Cálcio
aumento destes níveis é necessário para ativação das vias de sinalização sensíveis ao cátion (Carafoli, 1987; Cunningham, 2011). Em leveduras, a variação de cálcio citoplasmático ocorre, em parte, através do canal de membrana Mid1p/Cch1p e do canal vacuolar Yvc1p (Catterall, 2000; Palmer et al., 2001; Denis & Cyert, 2002; Tokes-Fuzesi et al., 2002) e pode ser observada, por exemplo, quando há exposição a feromônios (Iida et al., 1990; Muller et al., 2001) e glicose (Nakajima-Shimada et al., 1991; Trópia et al., 2006).
O cálcio também participa da resposta celular a condições estressantes. Em S. cerevisiae, já foi relatada a participação do íon em estresses alcalino, oxidativo, salino e osmótico através da via de sinalização da calcineurina, sendo o fator de transcrição Crz1p/Tcn1p o principal regulador da expressão gênica dependente da variação de cálcio citoplasmático (Matsumoto et al., 2002; Serrano et al., 2002; Viladevall et al., 2004; Popa et al., 2010).
1.3.1.A via da calcineurina e os transportadores de cálcio
Em leveduras, o cálcio regula a expressão gênica se ligando à proteína calmodulina (CaM) que ativa as quinases Cmk1p e Cmk2p (Moser et al., 1996) e a fosfatase calcineurina (Cyert, 2003). Enquanto Cmk1p e Cmk2p estão basicamente envolvidas em processos relacionados a crescimento e divisão celular e resposta a feromônios (Moser et al., 1996; Wang et al., 2011), a calcineurina ativa o fator de transcrição Crz1p que regula a expressão de mais de 160 genes relacionados à síntese de lipídeos e parede celular, transporte de íons, tráfico vesicular e codificação de proteínas sinalizadoras (Yoshimoto et al., 2002; Cyert, 2003).
Quando a célula é estimulada, há aumento dos níveis de cálcio que se ligará à proteína calmodulina, alterando sua conformação tridimensional. A calmodulina interage então com a fosfatase calcineurina, ativando-a. A calcineurina possui uma subunidade catalítica codificada pelos genes CNA1 e CNA2 e uma subunidade regulatória codificada pelo gene CNB1 (Rusnak & Mertz, 2000). Uma vez ativada, ela desfosforila o fator de transcrição Crz1p/Tcn1p, permitindo sua entrada no núcleo da célula onde reconhecerá e se ligará à sequência de nucleotídeos denominada elementos de resposta dependentes de calcineurina (CDRE) presente nos promotores de genes envolvidos em respostas a estresses, induzindo a transcrição dos mesmos (Matheos et al., 1997; Stathopoulos & Cyert, 1997).
1.4.A via de sinalização da proteína Snf1p
A carência de glicose e outras fontes de carbono também caracteriza uma situação de estresse que desencadeia respostas mediadas pela ativação de vias de sinalização. A via da proteína Snf1p é requerida para adaptação de leveduras a limitação de glicose e utilização de fontes alternativas de carbono, como sacarose, galactose e etanol (Gancedo, 1998; Carlson, 1999) e desempenha papel durante esporulação, crescimento e envelhecimento celular (Honigberg & Lee, 1998; Ashrafi et al., 2000; Cullen & Sprague, 2000; Kuchin et al., 2002).
1.4.1.Interação entre Snf1p e cálcio
Além do papel primordial da via de sinalização da Snf1p na escassez de nutrientes, a sua ativação tem sido observada também em resposta a outros estresses. A deleção do gene SNF1 ou a não ativação da via reduziram a tolerância da S. cerevisiae a íons tóxicos, estresse salino, choque térmico, alcalinização do meio e estresse oxidativo (Dubacq et al., 2004; Portillo et al., 2005; Hong & Carlson, 2007; Ohdate et al., 2010; Casamayor et al., 2012).
A interação da via da Snf1p com o aumento da concentração citosólica de cálcio também tem chamado atenção. Ruiz e colaboradores (2008) demonstraram que a adição de Ca2+ externo e consequente ativação da via da calcineurina é capaz de suprimir o fenótipo decorrente damutação de SNF1 em estresse alcalino durante limitação de glicose. Ohdate e colaboradores (2010) sugeriram a influência do Ca2+ na fosforilação de Snf1p e atuação da quinase na regulação da transcrição de genes envolvidos na resposta a estresse oxidativo. Hong e Carlson (2007) observaram não somente a ativação de componentes da via de mobilização de fontes alternativas de carbono frente a estresses alcalino, salino e oxidativo, mas também a fosforilação de Snf1p nessas condições independentemente das três quinases da via. Estes autores demonstraram ativação de Snf1p no triplo mutante sak1Δelm1Δtos3Δ, superexpressando uma quinase de mamíferos dependente de Ca2+/calmodulina.
2.Objetivos
2.1.Objetivo geral
Estudar a participação do íon cálcio na resposta a estresse ácido em Saccharomyces cerevisiae.
2.2.Objetivos específicos
a. Verificar a ocorrência de uma elevação transitória de Ca2+ desencadeada por um choque ácido.
b. Monitorar o fluxo citoplasmático de Ca2+ mediante um choque ácido, em diferentes mutantes, para determinar a principal fonte do cátion: influxo extracelular ou mobilização vacuolar.
c. Demonstrar a importância da via de sinalização da calcineurina dependente de Ca2+/calmodulina para a manutenção da viabilidade celular em pH ácido.
3.Metodologia
3.1.Cepas utilizadas
As cepas de Saccharomyces cerevisiae utilizadas neste trabalho foram a cepa parental BY4741 e os mutantes da via de sinalização da calcineurina, mutantes envolvidos no transporte de cálcio externo para o citoplasma da célula e na mobilização de cálcio vacuolar e mutantes da via da Snf1p, provenientes da coleção EUROSCARF (http://web.uni-frankfurt.de/fb15/mikro/euroscarf/). Utilizou-se também a cepa BY4741 transformada com o plasmídeo pVTU carreando o gene da apoproteína apoaequorina (Tabela 1).
Tabela 1: Cepas de Saccharomyces cerevisiae utilizadas no trabalho.
Cepa Genótipo Fonte
BY4741 MATa his3Δ1 leu2Δ0 lis2Δ0 ura3Δ0 Euroscarf
LBCM541 BY4741 + pVTU/AEQ LBCM
YKL190W BY4741 cnb1::KanMX4 Euroscarf
YNL027W BY4741 crz1::KanMX4 Euroscarf
YNL291C BY4741 mid1::KanMX4 Euroscarf
YGR217W BY4741 cch1::KanMX4 Euroscarf
YOR087W BY4741 yvc1::KanMX4 Euroscarf
YDR477W BY4741 snf1::KanMX4 Euroscarf
YER129W BY4741 sak1::KanMX4 Euroscarf
YKL048C BY4741 elm1::KanMX4 Euroscarf
3.2.Condições de cultivo
Para todos os procedimentos, as células foram pré-inoculadas em 5mL de meio YPD (2% de peptona, 1% de extrato de levedura e 2% de glicose), e crescidas em um shaker orbital a 200rpm, 30ºC, overnight. O crescimento celular foi monitorado por densidade óptica (DO) a 600nm.
3.3.Monitoramento de cálcio citoplasmático
Para monitorar o aumento de cálcio citoplasmático (sinal de cálcio) foram utilizados dois procedimentos distintos.
3.3.1.Ensaio da aequorina
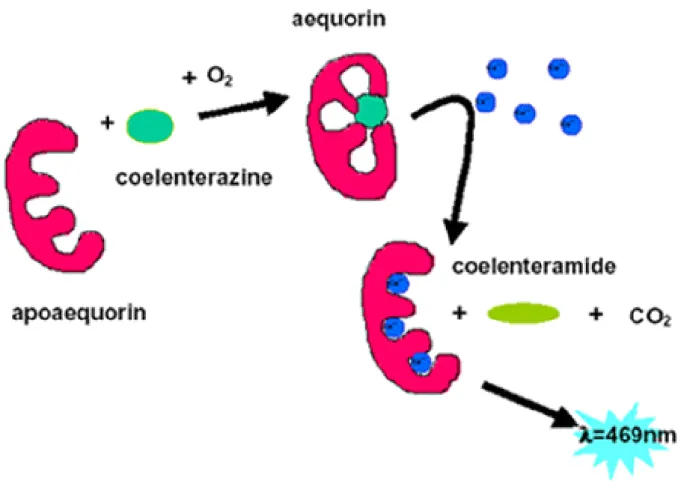
Figura 3: Representação da fotoproteína aequorina. A apoaequorina se liga ao grupo prostético coelenterazina formando o complexo aequorina. Na presença de cálcio, a coelenterazina é deslocada na forma de coelenteramida em uma reação de oxidação, liberando luz. Fonte: Mithöfer & Mazars, 2002.
O teste da aequorina foi realizado como descrito previamente (Tisi et al., 2002) com algumas modificações. Células transformadas com o plasmídeo pVTU carreando o gene da apoaequorina foram crescidas em 50mL de meio YPD até DO 1,0, centrifugadas (4750×g 5 minutos), lavadas duas vezes em tampão MES/Tris 0,1M pH6,5 e ressuspensas em 1,0mL do mesmo tampão. Para reconstituição da aequorina, as células foram incubadas com 50µM de coelenterazina (Molecular Probes, solução estoque 1µg/µL em metanol) por 90 minutos a 30°C no escuro.
Depois da incubação, as células foram divididas em dez alíquotas de 100μL e
luminômetro e a emissão de luz foi monitorada em luminômetro Berthold Lumat LB 9501/16, em intervalos de um segundo, por 60 segundos antes do pulso ácido (ou de glicose, ou de KCl) e por mais dez minutos após os pulsos.
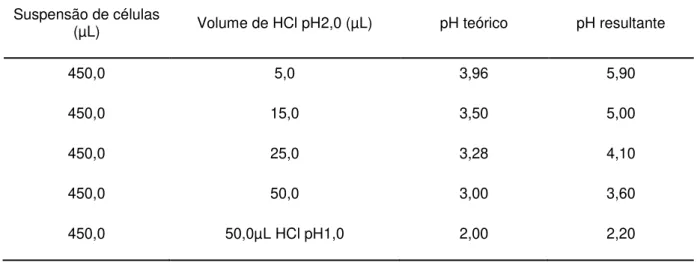
O volume de ácido utilizado para os diferentes pHs testados foi determinado previamente como mostra a tabela 2.
Tabela 2: Volumes de solução aquosa de HCl pH2,0 utilizados nos ensaios de sinal de cálcio.
Suspensão de células
(µL) Volume de HCl pH2,0 (µL) pH teórico pH resultante
450,0 5,0 3,96 5,90
450,0 15,0 3,50 5,00
450,0 25,0 3,28 4,10
450,0 50,0 3,00 3,60
450,0 50,0µL HCl pH1,0 2,00 2,20
3.3.2.Ensaio do indicador Oregon Green® 488 BAPTA-1, AM
O indicador fluorescente de cálcio Oregon Green® 488 BAPTA-1, AM (Molecular Probes) também foi utilizado para monitorar o sinal de cálcio. A estrutura molecular deste indicador baseia-se no quelante de cálcio BAPTA com algumas modificações para incorporação de grupos fluoróforos. O indicador na forma esterificada passa pela membrana plasmática e é desesterificado por esterases não específicas no citoplasma da célula, tornando-se ativo. Este indicador é menos sensível a mudanças de pH (Takahashi et al., 1999; Thomas et al., 2000).
as células foram lavadas três vezes por centrifugação, ressuspensas em 1,0mL do tampão e deixadas em repouso por 30 minutos para permitir a desesterificação do indicador no interior da célula por esterases não específicas. A suspensão de células foi então dividida em dez alíquotas de 100µL que foram centrifugadas. Cada alíquota foi ressuspensa no momento da leitura em 450µL água Milli-Q, para os experimentos de choque ácido (adição de solução aquosa de HCl pH2,0), ou em MES/Tris 0,1M pH6,5 para os controles positivo (adição de glicose na concentração final de 0,1M) e negativo (adição de KCl na concentração final de 15mM). As suspensões de células foram transferida para uma placa de 24 poços e a fluorescência foi monitorada no aparelho Varioskan® Flash Multimode Reader (Thermo Scientific) na função fluorímetro, em intervalos de um segundo, por 60 segundos antes do pulso ácido (ou de glicose, ou de KCl) e por mais dez minutos após os pulsos.
Quando utilizados, o quelante de cálcio EGTA e o íon magnésio foram adicionados à suspensão de células 15 minutos antes da leitura (4mM finais de EGTA ou 5mM finais de MgCl2). O quelante de cálcio interno, BAPTA, AM, foi adicionado à suspensão de células na concentração final de 8mM e procedeu-se uma incubação por 30 minutos para entrada e desesterificação citoplasmática da molécula antes de submissão das células a um pulso ácido.
3.4.Teste de viabilidade celular
86mM de NaCl no tratamento ácido foi feita com o intuito de diminuir a morte celular
(Sant’Ana et al., 2009).
Em experimentos com o inibidor de calcineurina FK506, o mesmo foi adicionado à cultura, na concentração de 1µg/mL, quando esta apresentava uma DO 0,5.
3.5.Curva de crescimento
Para monitorar o crescimento celular em meio ácido, as células foram inoculadas em meio SD completo contendo 2% de glicose, pH2,5. Iniciaram-se os experimentos com uma DO inicial de 0,1 e as culturas foram incubadas em um agitador orbital a 200rpm a 30ºC. O crescimento foi acompanhado por leituras de densidade óptica, por 60 horas em intervalos de 4 horas.
3.6.Reprodutibilidade e análise estatística
4.Resultados
4.1.Elevação dos níveis intracelulares de cálcio, induzidos por pulso ácido, utilizando a técnica da aequorina
Para monitorar a elevação transitória de cálcio citoplasmático frente a pulso ácido, foi realizado primeiramente o ensaio com uma fotoproteína sensível a cálcio, aequorina, usando-se a cepa S. cerevisiae BY4741. Como controle positivo, um pulso de glicose foi utilizado, visto que já se conhecia a indução do aumento dos níveis de Ca2+ pelo açúcar (Trópia et al., 2006). Como esperado, os resultados mostram claramente uma elevação transitória dos níveis de cálcio após adição de 0,1M de glicose (Figura 4a). A emissão de luz decorrente de pulso ácido foi muito menor quando comparada ao controle positivo e influenciada pela redução do pH. Quanto mais ácido, menor a intensidade do sinal observado, sendo que em pH 2,2 não se detecta um sinal (Figura 4b). Como controle negativo, foi utilizado um pulso de 15mM finais de KCl e não se observa um sinal de cálcio.
4.2.Elevação dos níveis de Ca2+ citosólico induzida por pulso ácido utilizando o
indicador Oregon Green® 488 BAPTA-1,AM
Como alternativa ao ensaio da aequorina, o monitoramento do fluxo citoplasmático de cálcio foi realizado utilizando o indicador fluorescente Oregon Green® 488 BAPTA-1, AM.
4.3.Elevação dos níveis de Ca2+ citosólico em mutantes envolvidos no influxo e
mobilização do íon cálcio
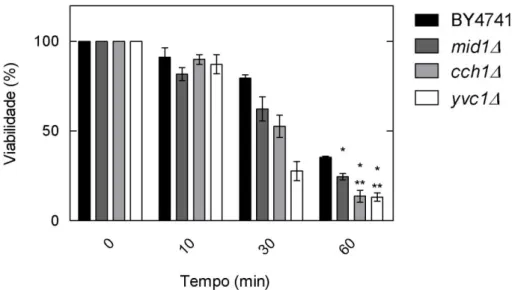
Por induzir os melhores sinais de cálcio em relação aos outros pulsos, o pH4,1 foi escolhido para determinar a principal fonte da elevação dos níveis de Ca2+ em resposta a estresse ácido. O teste do indicador Oregon Green foi usado para os mutantes nulos das proteínas que compõem o canal de cálcio de membrana, cch1Δ
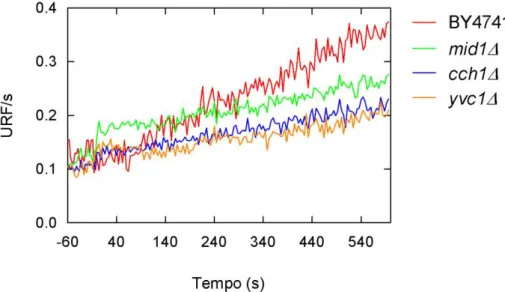
e mid1Δ, e do canal de cálcio vacuolar, yvc1Δ. A figura 6 mostra que todos os mutantes apresentam um aumento da concentração de Ca2+ inferior ao sinal apresentado pela cepa parental BY4741. O resultado também sugere que o sinal é mais afetado negativamente nos mutantes yvc1Δ e cch1Δ do que em mid1Δ.
Figura 6: Sinal de cálcio induzido por pulso ácido (HCl pH4,1) na cepa parental BY4741 e nos mutantes nulos de canais de cálcio mid1Δ, cch1Δ e yvc1Δ, utilizando o ensaio do indicador Oregon Green® 488-1 BAPTA, AM.
4.4.Importância dos canais de cálcio para a viabilidade das células expostas a tratamento ácido (HCl pH2,0 mais 86mM de NaCl)
Os mutantes nulos de canais de cálcio, mid1Δ, cch1Δ e yvc1Δ, passaram por testes de viabilidade celular para verificação da tolerância a estresse ácido (solução de HCl pH 2,0 suplementada com 86mM de NaCl). A suplementação com NaCl foi feita para redução da morte celular, possibilitando melhor contagem de colônias no final do experimento (Sant’Ana et al., 2009). Os resultados estão expressos em porcentagem, considerando o tempo 0 (antes do estresse) como 100% de viabilidade. Após dez minutos de exposição à solução de HCl pH2,0 suplementada com 86mM de NaCl, já é possível notar redução da viabilidade celular de todas as cepas, o que fica mais evidente a partir de 30 minutos, quando já se observa menor viabilidade dos mutantes em relação à cepa parental (Figura 8). Com 60 minutos de exposição, nota-se diferença significativa da viabilidade dos mutantes quando comparados à BY4741, indicando que o aumento do cálcio citosólico é necessário para a resposta ao estresse ácido em S. cerevisiae em meio ácido e confirmam a importância do cálcio externo e da mobilização de cálcio interno para a resposta.
4.5.Participação da via de sinalização da calcineurina dependente de Ca2+/calmodulina na resposta a estresse ácido
Testes de viabilidade celular em meio ácido também foram executados com os mutantes da via da calcineurina, cnb1Δ e crz1Δ. A figura 9 mostra redução da viabilidade das cepas a partir de dez minutos de exposição a estresse ácido. O efeito do estresse ácido é mais perceptível a partir de 30 minutos de exposição. Em 60 minutos observa-se claramente uma menor tolerância dos mutantes quando comparados à BY4741. O bloqueio da via pela adição de 1µg/mL do inibidor de calcineurina FK506 levou à menor resistência da cepa parental em relação ao controle.
A figura 10 mostra o crescimento da BY4741 e dos mutantes cnb1Δ e crz1Δ
em meio SD completo pH2,5. O menor crescimento dos mutantes quando comparados à cepa parental confirma a importância da via da calcineurina para a resposta ao estresse ácido. Um experimento controle em pH6,5 foi realizado e não apresentou crescimento significativamente diferente entre os mutantes e a cepa parental.
Figura 10: Crescimento da cepa parental BY4741 e dos mutantes da via da calcineurina em meio SD completo pH2,5. *Significância em relação à BY4741.
4.6.Participação da via de sinalização da quinase Snf1 na resposta a estresse ácido
A figura 11 ilustra a viabilidade celular após 30 minutos de tratamento ácido dos mutantes nulos de componentes da via da proteína quinase Snf1p (snf1Δ,
5.Discussão
No presente trabalho, foi analisada a participação do íon cálcio na resposta a estresse ácido provocado por ácidos inorgânicos. A concentração citoplasmática de cálcio em condições ideais é relativamente baixa e aumenta quando as células são submetidas a um estresse ambiental. Esse aumento transitório dos níveis de cálcio é fundamental para a ativação das vias reguladas pelo íon, incluindo a via da calcineurina. Para monitorar o aumento de cálcio citoplasmático decorrente de pulsos ácidos, foram utilizadas duas técnicas. No ensaio da fotoproteína sensível a cálcio, aequorina, houve um evidente aumento de luminescência desencadeado por um pulso de 0,1M final de glicose (Figura 4a). Quando comparados ao controle positivo, os sinais de cálcio induzidos por diferentes pHs ácidos mostraram-se muito menores, sendo que em pH2,2 não foi possível detectar emissão de luz (Figura 4b). Quando os pulsos de glicose foram executados em meio ácido, notou-se que quanto menor o pH, menor foi o aumento de luminescência (Figura 4a), o que confirma a sensibilidade do ensaio da aequorina a variações de pH como alguns estudos já haviam sugerido (Viladevall et al., 2004; Zhang et al., 2012).
Os mutantes do canal de cálcio de membrana plasmática, mid1Δ e cch1Δ, e do canal de cálcio vacuolar, yvc1Δ, apresentaram menores elevações de fluorescência induzida por um pulso de pH4,1 quando comparados à cepa parental BY4741 (Figura 6). Estresses hiperosmótico e oxidativo induzem elevação dos níveis de cálcio principalmente através da liberação das reservas vacuolares (Matsumoto et al., 2002; Popa et al., 2010), enquanto pulsos alcalinos desencadeiam principalmente a entrada de Ca2+ externo (Viladevall et al., 2004; Wang et al., 2011). Nossos resultados, porém, indicaram emissões muito semelhantes de fluorescência nos mutantes cch1Δ e yvc1Δ e um pouco maiores no mutante mid1Δ. Embora Cch1p e Mid1p façam parte do mesmo complexo proteico, Popa e colaboradores (2010) observaram diferenças nos sinais de cálcio em ambos os mutantes, o que permitiu sugerir uma maior importância de Cch1p para a passagem de cálcio pela membrana plasmática. No presente trabalho, os ensaios realizados na cepa parental BY4741 em presença dos quelantes de cálcio externo EGTA ou interno BAPTA, AM, ou do cátion competidor Mg2+, mostram uma redução do sinal de cálcio (Figura 7), sugerindo que tanto o influxo extracelular quanto a mobilização vacuolar de cálcio estão envolvidos no aumento dos níveis do íon em pH ácido.
Nos ensaios de viabilidade celular, os mutantes de canais de cálcio apresentaram menor viabilidade em relação à cepa parental BY4741 já a partir de 30 minutos de exposição a pH ácido. Além disso, observa-se tolerância um pouco maior do mutante mid1Δ em relação a cch1Δ e yvc1Δ (Figura 8). Ao se comparar resultados de viabilidade e resultados de sinal de cálcio, é possível sugerir que o canal de cálcio Mid1p é menos importante para o influxo de cálcio externo que o canal Cch1p.
2002; Viladevall et al., 2004; Popa et al., 2010). Lucena e colaboradores (2012) demonstraram uma menor viabilidade do mutante crz1Δ exposto a ácido sulfúrico pH2,5, corroborando nossos resultados de que o aumento transitório dos níveis de cálcio ativa a calcineurina em baixo pH e regula a expressão gênica em resposta a estresse ácido através do fator de transcrição Crz1p.
6.Conclusões
Nossos resultados mostram aumento da concentração citosólica de cálcio frente a um pulso ácido e esta elevação é devida tanto ao influxo de cálcio extracelular quanto à mobilização de cálcio vacuolar. Os níveis aumentados de cálcio livre ativam a via da calcineurina dependente de Ca2+/calmodulina que é importante para o crescimento e manutenção da viabilidade celular de Saccharomyces cerevisiae em pH ácido através da regulação da expressão gênica pelo fator de transcrição Crz1p. Além disso, a via de mobilização de fontes alternativas de carbono também parece estar envolvida na maior tolerância de S. cerevisiae a baixo pH e, aparentemente, a ativação de Snf1p é feita principalmente pela quinase Elm1p.
7.Perspectivas
Estudar o envolvimento de outras proteínas na variação dos níveis citosólicos de cálcio e na tolerância da S. cerevisiae frente a estresse ácido, como a quinase Arg82p (responsável pela fosforilação de IP3 a IP4 e IP5) e as quinases dependentes de calmodulina Cmk1p e Cmk2p.
Demonstrar a atividade da quinase Snf1p em condições de estresse ácido, confirmando os resultados de viabilidade celular.
8.Referências bibliográficas
Alexander, M. R., Tyers, M., Perret, M., Craig, B. M., Fang, K. S., Gustin, M. C.
(2001). ”Regulation of cell cycle progression by Swe1p and Hog1p following
hypertonic stress.” Mol Biol Cell 12(1): 53-62.
Araki, Y., Wu, H., Kitagaki, H., Akao, T., Takagi, H., Shimoi, H. (2009). "Ethanol stress stimulates the Ca2+-mediated calcineurin/Crz1 pathway in Saccharomyces cerevisiae." J Biosci Bioeng 107(1): 1-6.
Ariño, J. (2010). "Integrative responses to high pH stress in S. cerevisiae." OMICS
14(5): 517-523.
Ashrafi, K., Lin, S. S., Manchester, J. K., Gordon, J. I. (2000). "Sip2p and its partner snf1p kinase affect aging in S. cerevisiae." Genes Dev 14(15): 1872-1885.
Basilio, A. C., Araujo, P. R., Morais, J. O., Silva Filho, E. A., de Morais Jr., M. A., Simões, D. A. (2008). "Detection and identification of wild yeast contaminants of the industrial fuel ethanol fermentation process." Curr Microbiol 56(4): 322-326.
Basso, L. C., de Amorim, H. V., de Oliveira, A. J., Lopes, M. L. (2008). "Yeast selection for fuel ethanol production in Brazil." FEMS Yeast Res 8(7): 1155-1163.
Biddick, R. & Young, E. T. (2009). "The disorderly study of ordered recruitment." Yeast 26(4): 205-220.
BIOETANOL (2008). Bioetanol de cana-de-açúcar: energia para o desenvolvimento
sustentável Rio de Janeiro: BNDES. 316p. Disponível em:
http://www.bioetanoldecana.org
Boy-Marcotte, E., Perrot, M., Bussereau, F., Boucherie, H., Jacquet, M. (1998).
“Msn2p and Msn4p control a large number of genes induced at the diauxic transition which are repressed by cyclic AMP in Saccharomyces cerevisiae.” J Bacteriol 180(5): 1044-1052.
Brandão, R. L., Castro, I. M., Bambirra, E. A., Amaral, S. C., Fietto, L. G., Tropia, M. J., Neves, M. J., Dos Santos, R. G., Gomes, N. C., Nicoli, J. R. (1998). "Intracellular signal triggered by cholera toxin in Saccharomyces boulardii and Saccharomyces cerevisiae." Appl Environ Microbiol 64(2): 564-568.
Brandão, R. L., Rosa, J. C. C., Nicoli, J. R., Almeida, M. V. S., Carmo, A. P., Queirós, H. T., Castro, I. M. (2014). “Investigating acid stress response in different Saccharomyces strains.” Journal of Mycology 2014: 1-9.
Brocard-Masson, C. & Dumas, B. (2006). "The fascinating world of steroids: S. cerevisiae as a model organism for the study of hydrocortisone biosynthesis." Biotechnol Genet Eng Rev 22: 213-252.
Carafoli, E. (1987). "Intracellular calcium homeostasis." Annu Rev Biochem 56: 395-433.
Carlson, M. (1999). "Glucose repression in yeast." Curr Opin Microbiol 2(2): 202-207.
Casado, C., Gonzalez, A., Platara, M., Ruiz, A., Arino, J. (2011). "The role of the protein kinase A pathway in the response to alkaline pH stress in yeast." Biochem J
438(3): 523-533.
Casamayor, A., Serrano, R., Platara, M., Casado, C., Ruiz, A., Arino, J. (2012). "The role of the Snf1 kinase in the adaptive response of Saccharomyces cerevisiae to alkaline pH stress." Biochem J 444(1): 39-49.
Castagliuolo, I., LaMont, J. T., Nikulasson, S. T., Pothoulakis, C. (1996). "Saccharomyces boulardii protease inhibits Clostridium difficile toxin A effects in the rat ileum." Infect Immun 64(12): 5225-5232.
Causton, H. C., Ren, B., Koh, S. S., Harbison, C. T., Kanin, E., Jennings, E. G., Lee, T. I., True, H. L., Lander, E. S., Young, R. A. (2001). "Remodeling of yeast genome expression in response to environmental changes." Mol Biol Cell 12(2): 323-337.
Chen, R. E. & Thorner, J. (2007). "Function and regulation in MAPK signaling pathways: lessons learned from the yeast Saccharomyces cerevisiae." Biochim Biophys Acta 1773(8): 1311-1340.
Chu-Ky, S., Vaysse, L., Liengprayoon, S., Sriroth, K., Le, T.-M. (2013). “Acid adaptation for improvement of viability of Saccharomyces cerevisiae during
freeze-drying.” Inter J Food Sci Tech 48: 1468-1473.
Claret, S., Gatti, X., Doignon, F., Thoraval, D., Crouzet, M. (2005). "The Rgd1p Rho GTPase-activating protein and the Mid2p cell wall sensor are required at low pH for protein kinase C pathway activation and cell survival in Saccharomyces cerevisiae." Eukaryot Cell 4(8): 1375-1386.
Cullen, P. J. & Sprague, G. F., Jr. (2000). "Glucose depletion causes haploid invasive growth in yeast." Proc Natl Acad Sci U S A 97(25): 13619-13624.
Cunningham, K. W. & Fink, G. R. (1994). "Calcineurin-dependent growth control in Saccharomyces cerevisiae mutants lacking PMC1, a homolog of plasma membrane Ca2+-ATPases." J Cell Biol 124(3): 351-363.
Cunningham, K. W. (2011). "Acidic calcium stores of Saccharomyces cerevisiae." Cell Calcium 50(2): 129-138.
Cyert, M. S. (2003). "Calcineurin signaling in Saccharomyces cerevisiae: how yeast go crazy in response to stress." Biochem Biophys Res Commun 311(4): 1143-1150.
Daquinag, A., Fadri, M., Jung, S. Y., Qin, J., Kunz, J. (2007). "The yeast PH domain proteins Slm1 and Slm2 are targets of sphingolipid signaling during the response to heat stress." Mol Cell Biol 27(2): 633-650.
Delley, P. A. & Hall, M. N. (1999). “Cell wall stress depolarizes cell growth via
Denis, V. & Cyert, M. S. (2002). "Internal Ca2+ release in yeast is triggered by hypertonic shock and mediated by a TRP channel homologue." J Cell Biol 156(1): 29-34.
Dias, R. S., Bambirra, E. A., Silva, M. E., Nicoli, J. R. (1995). "Protective effect of Saccharomyces boulardii against the cholera toxin in rats." Braz J Med Biol Res
28(3): 323-325.
Dubacq, C., Chevalier, A., Mann, C. (2004). "The protein kinase Snf1 is required for tolerance to the ribonucleotide reductase inhibitor hydroxyurea." Mol Cell Biol 24(6): 2560-2572.
Eraso, P. & Gancedo, C. (1987). "Activation of yeast plasma membrane ATPase by acid pH during growth." FEBS Lett 224(1): 187-192.
Estruch, F. (2000). "Stress-controlled transcription factors, stress-induced genes and stress tolerance in budding yeast." FEMS Microbiol Rev 24(4): 469-486.
FAO [Internet]. “Food and Agriculture Organization of the United Nations.” Acesso em: abril de 2014. Disponível em: http://www.faostat3.fao.org
Fietto, J. L., Araujo, R. S., Valadao, F. N., Fietto, L. G., Brandao, R. L., Neves, M. J., Gomes, F. C., Nicoli, J. R., Castro, I. M. (2004). "Molecular and physiological comparisons between Saccharomyces cerevisiae and Saccharomyces boulardii." Can J Microbiol 50(8): 615-621.
Francois, J. & Parrou, J. L. (2001). "Reserve carbohydrates metabolism in the yeast Saccharomyces cerevisiae." FEMS Microbiol Rev 25(1): 125-145.
Fuchs, B. B. & Mylonakis, E. (2009). "Our paths might cross: the role of the fungal cell wall integrity pathway in stress response and cross talk with other stress response pathways." Eukaryot Cell 8(11): 1616-1625.
Gancedo, J. M. (1998). "Yeast carbon catabolite repression." Microbiol Mol Biol Rev
62(2): 334-361.
Gash, A. P. (2003). “The environmental stress response: a common yeast response to diverse environmental stresses.” In: Hohmann, S. & Mager, W. H., editors, Yeast Stress Responses. Topics in Current Genetics 1. Berlin: Springer, 11-70.
Giannattasio, S., Guaragnella, N., Corte-Real, M., Passarella, S., Marra, E. (2005). "Acid stress adaptation protects Saccharomyces cerevisiae from acetic acid-induced programmed cell death." Gene 354: 93-98.
Goffeau, A., Barrell, B. G., Bussey, H., Davis, R. W., Dujon, B., Feldmann, H., Galibert, F., Hoheisel, J. D., Jacq, C., Johnston, M., Louis, E. J., Mewes, H. W., Murakami, Y., Philippsen, P., Tettelin, H., Oliver, S. G. (1996). "Life with 6000 genes." Science 274(5287): 546, 563-547.
Görner, W., Durchschlag, E., Martinez-Pastor, M. T., Estruch, F., Ammerer, G.,
Hamilton, B., Ruis, H., Schüller, C. (1998). ”Nuclear localization of the C2H2 zinc finger protein Msn2p is regulated by stress and protein kinase A activity.” Genes Dev
12(4): 586-597.
Görner, W., Durchschlag, E., Wolf, J., Brown, E. L., Ammerer, G., Ruis, H., Schuller, C. (2002). "Acute glucose starvation activates the nuclear localization signal of a stress-specific yeast transcription factor." EMBO J 21(1-2): 135-144.
Gray, J. V., Ogas, J. P., Kamada, Y., Stone, M., Levin, D. E., Herskowitz, I. (1997).
”A role for the Pkc1 MAP kinase pathway of Saccharomyces cerevisiae in bud
emergence and identification of a putative upstream regulator.” EMBO J 16(16): 4924-4937.
Guadalupe Cabral, M., Sa-Correia, I., Viegas, C. A. (2004). "Adaptative responses in yeast to the herbicide 2-methyl-4-chlorophenoxyacetic acid at the level of intracellular pH homeostasis." J Appl Microbiol 96(3): 603-612.
Harrison, J. C., Bardes, E. S., Ohya, Y., Lew, D. J. (2001). ”A role for the
Pkc1p/Mpk1p kinase cascade in the morphogenesis checkpoint.” Nat Cell Biol 3(4): 417-420.
Hedbacker, K. & Carlson, M. (2008). "SNF1/AMPK pathways in yeast." Front Biosci
Heinisch, J. J., Lorberg, A., Schmitz, H. P., Jacoby, J. J. (1999). “The protein kinase
C-mediated MAP kinase pathway involved in the maintenance of cellular integrity in Saccharomyces cerevisiae.” Mol Microbiol 32(4): 671-680.
Hohmann, S. (2009). "Control of high osmolarity signalling in the yeast Saccharomyces cerevisiae." FEBS Lett 583(24): 4025-4029.
Hong, S. P. & Carlson, M. (2007). "Regulation of snf1 protein kinase in response to environmental stress." J Biol Chem 282(23): 16838-16845.
Honigberg, S. M. & Lee, R. H. (1998). "Snf1 kinase connects nutritional pathways controlling meiosis in Saccharomyces cerevisiae." Mol Cell Biol 18(8): 4548-4555.
Iida, H., Yagawa, Y., Anraku, Y. (1990). "Essential role for induced Ca2+ influx followed by [Ca2+]i rise in maintaining viability of yeast cells late in the mating pheromone response pathway. A study of [Ca2+]i in single Saccharomyces cerevisiae cells with imaging of fura-2." J Biol Chem 265(22): 13391-13399.
Jung, U. S. & Levin, D. E. (1999). ”Genome-wide analysis of gene expression regulated by the yeast cell wall integrity signalling pathway.” Mol Microbiol 34(5): 1049-1057.
Kamada, Y., Jung, U. S., Piotrowski, J., Levin, D. E. (1995). ”The protein kinase C -activated MAP kinase pathway of Saccharomyces cerevisiae mediates a novel
aspect of the heat shock response.” Genes Dev 9(13): 1559-1571.
Kapteyn, J. C., ter Riet, B., Vink, E., Blad, S., De Nobel, H., Van Den Ende, H., Klis, F. M. (2001). "Low external pH induces HOG1-dependent changes in the organization of the Saccharomyces cerevisiae cell wall." Mol Microbiol 39(2): 469-479.
Karathia, H., Vilaprinyo, E., Sorribas, A., Alves, R. (2011). "Saccharomyces cerevisiae as a model organism: a comparative study." PLoS One 6(2): e16015.
Kendall, J. M. & Badminton, M. N. (1998). “Aequorea victoria bioluminescence moves
into an exciting new era.” Trends Biotechnol 16(5): 216-224.
Knauf, M. & Kraus, K. (2006). “Specific yeasts developed for modern ethanol production.” Sugar Industry 131(11): 753-758.
Kobayashi, N. & McEntee, K. (1990). “Evidence for a heat shock transcription factor -independent mechanism for heat shock induction of transcription in Saccharomyces cerevisiae.” Proc Natl Acad Sci USA 87(17): 6550-6554.
Kobayashi, N. & McEntee, K. (1993). ”Identification of cis and trans components of a novel heat shock stress regulatory pathway in Saccharomyces cerevisiae.” Mol Cell Biol 13(1): 248-256.
Kobayashi, M., Shimizu, H., Shioya, S. (2008). “Beer volatile compounds and their
application to low-malt beer fermentation.” J Biosci Bioeng 106(4): 317-323.
Kuchin, S., Vyas, V. K., Carlson, M. (2002). "Snf1 protein kinase and the repressors Nrg1 and Nrg2 regulate FLO11, haploid invasive growth, and diploid pseudohyphal differentiation." Mol Cell Biol 22(12): 3994-4000.
Kullas, A. L., Martin, S. J., Davis, D. (2007). "Adaptation to environmental pH: integrating the Rim101 and calcineurin signal transduction pathways." Mol Microbiol
66(4): 858-871.
Lawrence, C. L., Botting, C. H., Antrobus, R., Coote, P. J. (2004). "Evidence of a new role for the high-osmolarity glycerol mitogen-activated protein kinase pathway in yeast: regulating adaptation to citric acid stress." Mol Cell Biol 24(8): 3307-3323.
Levin, D. E. & Bartlett-Heubusch, E. (1992). “Mutants in the S. cerevisiae PKC1 gene display a cell cycle-specific osmotic stability defect.” J Cell Biol 116(5): 1221-1229.
Levin, D. E. (2005). "Cell wall integrity signaling in Saccharomyces cerevisiae." Microbiol Mol Biol Rev 69(2): 262-291.