UNIVERSIDADE TÉCNICA DE LISBOA
INSTITUTOSUPERIORDEAGRONOMIA
Produção de Triacilgliceróis Estruturados Catalisada por Lipases
Imobilizadas
Tese Apresentada para Obtenção do Grau de Doutor em Engenharia Alimentar
Orientador: Doutora Maria Suzana Leitão Ferreira Dias Vicente
Co-orientador: Doutora Paula Maria Nunes Alberto Carrasquinho Pires Cabral
Constituição do Júri:
Presidente: Reitor da Universidade Técnica de Lisboa
Vogais Doutor Francisco Valero Barranco, professor catedrático da Universidade Autónoma de Barcelona, Espanha
Doutora Helena Margarida Nunes Pereira, professora catedrática do Instituto Superior de Agronomia da Universidade Técnica de Lisboa
Doutora Maria Suzana Leitão Ferreira Dias Vicente, professora auxiliar do Instituto Superior de Agronomia da Universidade Técnica de Lisboa
Doutor Alberto José Delgado dos Reis, Investigador auxiliar do Laboratório Nacional de Energia e Geologia
Doutora Paula Maria Nunes Alberto Carrasquinho Pires Cabral, professora adjunta do Instituto Superior de Engenharia da Universidade do Algarve
Patrícia Alexandra Reis Nunes Cabrita
Lisboa 2011
A
GRADECIMENTOSA realização deste trabalho só foi possível com o apoio de algumas pessoas, às quais quero manifestar o meu sincero agradecimento.
Um especial agradecimento à Professora Suzana Ferreira Dias pela sua amizade, orientação científica, disponibilidade e optimismo, que sempre me incentivaram e nunca me deixaram desistir mesmo nos momentos mais difíceis.
À Professora Paula Pires-Cabral, por todo o apoio na co-orientação desta tese, assim como a amizade com que sempre pude contar nos bons e maus momentos.
Ao Professor Franscisco Valero pelo apoio e disponibilidade demonstrada durante a realização dos ensaios de acidólise com a lipase r-LRO.
À Fundação para a Ciência e a Tecnologia (FCT) pela atribuição de uma bolsa de doutoramento (SFRH/BD/39280/2007).
À Novozymes A/S (Dinamarca) pela dádiva de “Lipozyme TL IM”, “Lipozyme RM IM” e Novozytme 435”, sem as quais este trabalho não teria sido possível.
Ao Instituto Superior de Engenharia da Universidade do Algarve, instituição onde sou docente a tempo integral com exclusividade, e ao Centro de Engenharia dos Biossistemas (CEER) pelo apoio institucional e financeiro para realização da parte prática desta tese.
Aos Professores Francisco Calhau, Célia Quintas e Ilídio Mestre pela possibilidade de integrar o Plano de Formação do ISE da Universidade do Algarve, tornando assim possível a realização prática desta tese.
Um especial agradecimento aos colegas Ludovina Galego, Fernando Bento, Vera Gonçalves, Vera Francisco, Teresa Cavaco, Clarisse Ramalho e Teresa Soeiro, cujo apoio foi fundamental para a realização da parte prática desta tese.
À minha amiga Carla Tecelão um agradecimento muito especial por toda a amizade, apoio, ajuda e incentivo ao longo deste período.
.d ocu -tra c .d ocu -tra c
Ao Pedro, por ter sido a pessoa que mais me ajudou ao longo deste período. Agradeço a ajuda, o carinho e a compreensão que sempre estiveram presentes nos bons e maus momentos.
À minha filha Teresa que é a principal razão por todo este esforço.
Aos meus pais, pelas palavras amigas e de incentivo. Se aqui cheguei a eles tenho que agradecer.
Aos meus sogros, por todo o apoio e afecto, que minimizaram as minhas ausências junto da minha filha.
Finalmente um agradecimento colectivo para todos os docentes e não docentes do ISE que de alguma forma contribuíram para a execução deste trabalho.
.d ocu -tra c .d ocu -tra c
R
ESUMONeste estudo, pretendeu-se produzir lípidos estruturados (LE) por catálise enzimática, nomeadamente triacilgliceróis do tipo MLM, constituídos por ácidos gordos de cadeia média (M) nas posições sn-1 e sn-3, e um ácido gordo de cadeia longa (L) na posição interna. Estes LE foram obtidos por acidólise de ácido caprílico (C8:0) ou ácido cáprico (C10:0) com azeite virgem extra, em n-hexano e em meio livre de solvente. As reacções de acidólise foram catalisadas por preparações comerciais de lipases imobilizadas de Thermomyces lanuginosa, de Rhizomucor miehei e de Candida antarctica, respectivamente “Lipozyme TL IM”, “Lipozyme RM IM” e “Novozym 435”. As incorporações de M foram geralmente mais elevadas em meios sem solvente (19,9-30,4 mol-%) comparativamente com as obtidas em presença de n-hexano (13,6-21,9 mol-%). A “Lipozyme RM IM” foi o biocatalisador mais estável em ensaios de reutilizações sucessivas (tempo de meia vida, t1/2, de 299h).
Como alternativa às lipases comerciais, testou-se também a lipase sn-1,3 selectiva heteróloga de Rhizopus oryzae (r-ROL), expressa numa estirpe mutante de Pichia pastoris. Esta lipase foi imobilizada em Eupergit® C, sepiolite modificada e em Lewatit® VP OC 1600. A Lewatit® VP OC 1600 foi o suporte de imobilização que permitiu uma maior estabilidade operacional da r-ROL, quando reutilizada em ensaios sucessivos, com re-hidratação entre cada ensaio (t1/2
=234h). Conclui-se que a r-ROL é uma lipase que pode ser utilizada como catalisador da acidólise para produção de MLM.
Palavras-chave: Ácido caprílico; ácido cáprico; acidólise; azeite; biorreactor descontínuo; estabilidade operacional; lipase imobilizada; lípidos dietéticos; lípidos estruturados; triacilgliceróis estruturados.
.d ocu -tra c .d ocu -tra c
Production of structured triacylglycerols catalysed by immobilized lipases
A
BSTRACTThe aim of this study was the production of structured lipids (SL) containing medium-chain fatty acids (M) in positions sn-1,3 and long-chain fatty acids (L) in the sn-2 position(MLM type). These SL were obtained by acidolysis of virgin olive oil with caprylic or capric acid in
n-hexane or in solvent-free media.
Acidolysis reactions were catalysed by commercial lipase preparations from Thermomyces
lanuginosa, Rhizomucor miehei and Candida antarctica (“Lipozyme TL IM”, “Lipozyme RM
IM” and “Novozym 435”, respectively). The higest incorporation values of M were obtained in solvent-free media (19.9-30.4 mol%) than in the presence of n-hexane (13.6- 21.9 mol%). “Lipozyme RM IM” presented the best operational stability in consecutive batches (half-life time, t1/2, of 299h).
The sn-1,3 selective recombinant Rhizopus oryzae lipase (r-ROL), produced by the methylotrophic yeast Pichia pastoris, was tested as alternative for the commercial lipases. The r-ROL was immobilized in Eupergit® C, in modified sepiolite or in Lewatit® VP OC 1600. Lewatit® VP OC 1600 showed to be the best support for r-ROL immobilization, since higher operational stability was observed when this lipase preparation was reused in consecutive batches with rehydration between batches (t1/2 =234h). r-ROL is a feasible biocatalyst for the
production of MLM by acidolysis.
Key-words: acidolysis; batch bioreactor; caprylic acid; capric acid; dietetic lipids, immobilised lipase; olive oil; operational stability; structured lipids; triacylglycerols.
.d ocu -tra c .d ocu -tra c
Í
NDICEG
ERAL Pág. Agradecimentos i Resumo iii Abstract iv Índice geral vÍndice de figuras vii
Índice de quadros ix
Lista de abreviaturas e símbolos do Capítulo I. e Capítulo VI. xi Lista de artigos elaborados no âmbito da presente tese xii
Capítulo I.
Introdução Geral 1
1.1. Enquadramento do tema e objectivos 2
1.2. Propriedades fisiológicas dos ácidos gordos 4
1.3. Lípidos Estruturados com propriedades funcionais 6 1.3.1. Produção de Lípidos Estruturados por via química 9 1.3.2. Produção de Lípidos estruturados por via enzimática 10
1.3.3. Produção de lípidos estruturados por acidólise 12
1.3.4. Parâmetros que influenciam a actividade e estabilidade enzimáticas 14 1.4. Importância do azeite na produção de lípidos estruturados 16
1.5. Estabilidade operacional 17
1.6. Referências Bibliográficas 19
Capítulo II.
Production of olive oil enriched with medium chain fatty acids catalysed by
commercial immobilised lipases 28
Capítulo III.
Production of MLM-Type structured lipids catalyzed by immobilized heterologous
Rhizopus oryzae lipase 37
.d ocu -tra c .d ocu -tra c
Capítulo IV.
Optimized production of MLM triacylglycerols catalyzed by immobilized heterologous
Rhizopus oryzae lipase
44
Capítulo V.
Batch operational stability of immobilized heterologous Rhizopus oryzae lipase during
acidolysis of virgin olive oil with medium-chain fatty acids 54 Capítulo VI.
Conclusões e perspectivas de trabalho futuro 77
6.1. Conclusões gerais 78
6.2. Perspectiva de trabalho futuro 84
.d ocu -tra c .d ocu -tra c
Í
NDICE DEF
IGURASPág. Capítulo II. Production of olive oil enriched with medium chain fatty acids
catalysed by commercial immobilised lipases
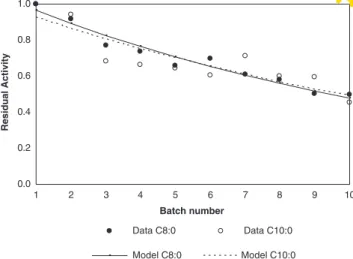
Figura 1. Residual activity (ratio of activities at batch n:batch1) of Lipozyme RM IM at the end of each consecutive 23-h batch, when acidolysis of olive oil with caprylic acid (C8:0) or capric acid (C10:0) was performed in
solvent-free media. 32
Figura 2. Residual activity (ratio of activities at batch n:batch1) of Lipozyme TL IM at the end of each consecutive 23-h batch, when acidolysis of olive oil with caprylic acid (C8:0) or capric acid (C10:0) was performed in
solvent-free media. 33
Figura 3. Residual activity (ratio of activities at batch n:batch1) of Novozym 435 at the end of each consecutive 23-h batch, when acidolysis of olive oil with caprylic acid (C8:0) or capric acid (C10:0) was performed in
solvent-free media. 33
Capítulo III. Production of MLM-Type structured lipids catalyzed by immobilized heterologous Rhizopus oryzae lipase
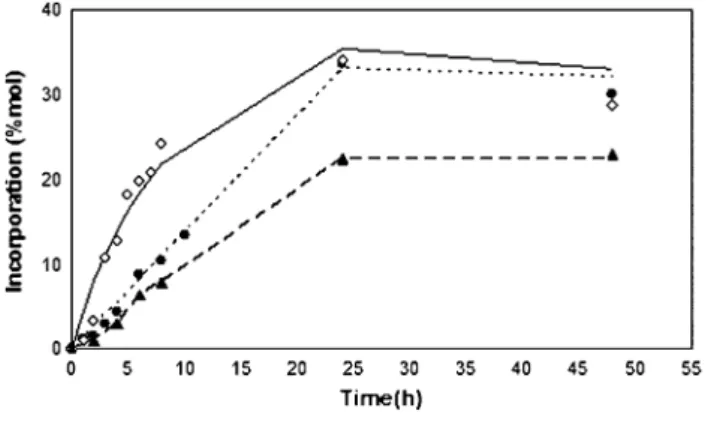
Figura 1. Effect of reaction time on the incorporation of caprylic acid (C8:0) or capric acid (C10:0) into olive oil (molar ratio olive oil: free fatty acid of 1:2) catalyzed by 5% and 10% of rROL immobilized in Eupergit® C, at
40ºC, in solvent-free media 41
Figura 2. Residual activity of rROL immobilized in Eupergit® C at the end of each consecutive 23-h batch, when acidolysis of olive oil with caprylic acid
(C8:0) or capric acid (C10:0) was performed. 41
Capítulo IV. Optimized production of MLM triacylglycerols catalyzed by immobilized heterologous Rhizopus oryzae lipase
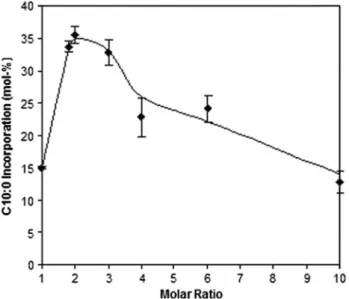
Figura 1. Effect of molar ratio C10:0/olive oil on C10:0 incorporation catalyzed by r-ROL immobilized in Eupergit® C, after 24 h at 40ºC and 400 rpm in solvent-free media. The numbers 1-10 on the x-axis correspond to molar
ratios of 1:1, to 10:1, respectively. 49
.d ocu -tra c .d ocu -tra c
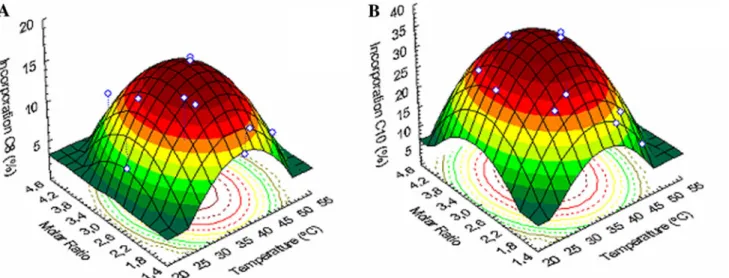
Figura 2. Response surface fitted to the production of MLM TAG from acidolysis of virgin olive oil with caprylic (A) or capric acids (B) catalyzed by the
r-ROL immobilized in Eupergit® C. 50
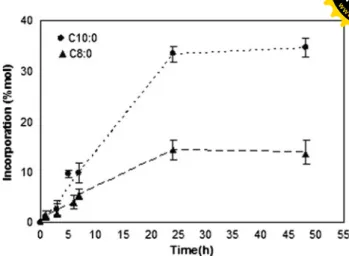
Figura 3. Time-course of acidolysis of olive oil with caprylic acid (C8:0) or capric
acid (C10:0) under optimal conditions predicted by the models. 51
Capítulo V. Batch operational stability of immobilized heterologous Rhizopus oryzae lipase during acidolysis of virgin olive oil with medium-chain fatty acids
Figura 1. Residual activity of r-ROL immobilized in Eupergit® C, with rehydratation of the biocatalyst, at the end of each consecutive 23-h batch, when acidolysis of olive oil with caprylic (C8:0) or capric acid
(C10:0) was performed. 76
Figura 2. Residual activity of r-ROL immobilized in Lewatit VP OC 1600, with or without rehydratation of the biocatalyst, at the end of each consecutive 23-h batch, when acidolysis of olive oil capric acid (C10:0) was
performed. 77
.d ocu -tra c .d ocu -tra c
Í
NDICE DEQ
UADROSPág. Capítulo II. Production of olive oil enriched with medium chain fatty acids
catalysed by commercial immobilised lipases
Quadro 1. Incorporation of caprylic (C8:0) or capric (C10:0) acid into TAG of olive oil, in solvent or solvent-free media, catalyzed by different commercial immobilized lipases (mol %; mean ± SD, n = 3). For each acid, different letters mean that the results are significantly different at a
p value 0.05. 31
Quadro 2. Pancreatic lipase catalyzed sn-2 positional analysis of native and
modified olive oil. 31
Quadro 3. Deactivation models and respective half-life times estimated for the biocatalysts used in 10 consecutive 23-h batches of acidolysis of virgin olive oil with caprylic or capric acids in solvent-free medium. 32 Capítulo III. Production of MLM-Type structured lipids catalyzed by
immobilized heterologous Rhizopus oryzae lipase
Quadro 1. Immobilization yield of heterologous and native ROL immobilized in
Eupergit C or in modified sepiolite.
40 Quadro 2. Incorporation of caprylic or capric acid (mol-%) into TAG of olive oil,
catalyzed by immobilized heterologous and native ROL immobilized in Eupergit® C or in modified sepiolite (Mean ± SD, n = 3). For each acid, different letters mean that the incorporation values are significantly different at a p value 0.05; conversely, results indicated by the same letter mean that they are not significantly different at this p value. 40 Quadro 3. Deactivation model equations, time delay and half-life for the
heterologous Rhizopus oryzae lipase immobilized in Eupergit® C. 42 Quadro 4. The sn-2 Positional fatty acid composition (mol-%) of olive oil and
modified olive oil, obtained by 24 h acidolysis of virgin olive oil with caprylic (C8:0) or capric (C10:0) acids in solvent-free media, at 40ºC, catalyzed by the heterologous ROL immobilized in Eupergit® C. 42
.d ocu -tra c .d ocu -tra c
Capítulo IV. Optimized production of MLM triacylglycerols catalyzed by immobilized heterologous Rhizopus oryzae lipase
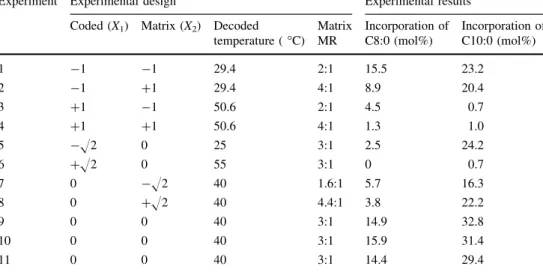
Quadro 1. Experimental design matrix used (CCDR) as a function of molar ratio medium chain fatty acid/triacylglycerols (MR) and temperature and the experimental results of acidolysis of olive oil with C8:0 or C10:0 after 24 h reaction catalyzed by r-ROL immobilized in Eupergit® C. 48 Quadro 2. Linear and quadratic effects of factors and of interaction, and respective
p-levels (values between brackets), of molar ratio medium chain fatty acids/ triacylglycerols (MR) and temperature (T) on the acidolysis of olive oil with C8:0 or C10:0, catalyzed by r-ROL immobilized in
Eupergit® C. 50
Quadro 3. Model equations for the response surfaces fitted to the production of MLM from the acidolysis of olive oil with caprylic (C8:0) or capric acid (C10:0) catalyzed by r-ROL immobilized in Eupergit® C and respective
R2 and R2adj. 50
Quadro 4. Fatty acid composition of olive oil (mol-%) and modified olive oil TAG
produced under optimized conditions by RSM. 51
.d ocu -tra c .d ocu -tra c
LISTA DE ABREVIATURAS E SÍMBOLOS DO CAPÍTULO I E DO CAPÍTULO VI
aw – Actividade da água
AG – Ácido gordo
CLA – “Conjugated linolenic acid” – ácido linolénico conjugado DAG - “Diacylglycerols” - diacilgliceróis
DHA – Ácido docosa-hexenóico, C22:6 EPA - Ácido eicosa-pentenóico, C20:5
GLA – “Gamma linolenic acid” – ácido gama linolénico
HDL – “High Density Lipoproteins” – lipoproteínas de alta densidade LE – Lípido Estruturado
LDL - “Low Density Lipoproteins” – lipoproteínas de baixa densidade
Omega-3 PUFA – “Omega-3 Polyunsaturated Fatty Acids” - ácidos gordos polinsaturados ómega-3
MAG – “Monoacylglycerols” - monoacilgliceróis
PUFA – “Polyunsaturated Fatty Acids”- ácidos gordos polinsaturados r-LRO – Lipase heteróloga de Rhizopus orizae
TAG – “Triacylglycerols” – triacilgliceróis t ½ - tempo de meia vida
.d ocu -tra c .d ocu -tra c
L
ISTA DEA
RTIGOSE
LABORADOS NOÂ
MBITO DAP
RESENTET
ESEArtigo 1
Nunes, P.A., Pires-Cabral, P., Ferreira-Dias, S., (2011) Production of olive oil enriched with médium chain fatty acids catalysed by commercial immobilised lipases. Food Chemistry, 127: 993-998.
Artigo 2
Nunes, P.A., Pires-Cabral, P., Guillen, M., Valero, F., Luna, D., Ferreira-Dias,S.(2011) Production of MLM-Type structured lipids catalyzed by immobilized heterologous Rhizopus
oryzae lipase. J. Am. Oil Chem. Soc., 88: 473-480.
Artigo 3
Nunes, P.A., Pires-Cabral, P., Guillen, M., Valero, F., Ferreira-Dias, S., Optimized
production of MLM triacylglycerols catalyzed by immobilized heterologous Rhizopus oryzae lipase. J. Am. Oil Chem. Soc. (publicado online)
Artigo 4
Nunes, P.A., Pires-Cabral, P., Guillen, M., Valero, F., Ferreira-Dias, S., Batch operational stability of immobilized heterologous Rhizopus oryzae lipase during acidolysis of virgin olive oil with medium-chain fatty acids. (BEJ-11-00780R1, submetido).
.d ocu -tra c .d ocu -tra c
Capítulo I.
Introdução Geral
.d ocu -tra c .d ocu -tra c
1.1. Enquadramento do tema e objectivos
Os óleos e gorduras, em quantidades adequadas e numa dieta equilibrada, são imprescindíveis ao organismo humano. No entanto, a ingestão em excesso deste tipo de produto apresenta também aspectos negativos, provocando problemas de obesidade devido ao elevado valor calórico (Howlett, 2008). Dietas desequilibradas, nomeadamente ricas em gorduras, podem contribuir para o desenvolvimento de doenças crónicas, nomeadamente as doenças cardiovasculares, cancro e a diabetes tipo 2, que são as principais causas de morte nos países mais industrializados. As modificações do estilo de vida com adopções de regimes alimentares muito ricos em gorduras saturadas e sal, e pobres em frutos e vegetais frescos, associados ao sedentarismo e stresse, fizeram com que aumentasse a obesidade e hipertensão arterial (Gunstone, 2008).
As dietas ricas em certos alimentos podem constituir um factor de protecção no aparecimento de algumas doenças. Surgem desta forma os alimentos funcionais que contêm uma ou mais substâncias fisiologicamente activas que, em quantidades suficientes e adequadas, promovem a saúde e o bem-estar (Howlett, 2008).
Os lípidos são constituintes essenciais da dieta alimentar devido ao seu elevado valor energético, são fonte de vitaminas lipossolúveis (A, D, E e K) e ácidos gordos (AG) essenciais (ácido linoleico e ácido alfa-linolénico). Nos últimos anos, a Indústria Alimentar tem procurado obter gorduras naturais e mais saudáveis de acordo com as exigências do consumidor. Têm surgido novos óleos e gorduras com elevado interesse nutricional e dietético designados por lípidos estruturados (LE).
Os LE podem ser definidos como sendo triacilgliceróis (TAG) que sofrem reestruturação, por métodos químicos ou enzimáticos, com o objectivo de alterar a composição e/ou distribuição posicional dos AG na molécula de glicerol (Xu, 2000). Estes lípidos modificados apresentam características nutracêuticas e/ou terapêuticas ímpares que justificam a sua aplicação em áreas como a produção de gorduras de baixo valor calórico ou a nutrição infantil (Lee e Akoh, 1998).
Existe um interesse crescente na produção de LE para fins nutricionais e dietéticos. Dentro destes produtos, há a destacar os TAG modificados em relação à sua composição original, nomeadamente os constituídos por AG de cadeia média (M) nas posições sn-1 e sn-3 do glicerol e AG funcionais de cadeia longa insaturados (L) na posição sn-2, ou seja, TAG do tipo MLM (Lee e Akoh, 1998). Os AG de cadeia média são constituídos por cadeias com 6 a 12 átomos de carbono (e.g., ácidos capróico, C6:0,
.d ocu -tra c .d ocu -tra c
caprílico, C8:0, cáprico, C10:0, e láurico, C12:0) enquanto os de cadeia longa apresentam 14 a 24 átomos de carbono nas suas moléculas, quer sejam saturadas quer insaturadas (Osborn e Akoh, 2002).
Estes LE podem ser sintetizados por catálise enzimática, nomeadamente por acidólise entre um TAG de cadeia longa e AG livres de cadeia média, catalisada por lipases com selectividade sn-1,3 (Akoh, 1995).
O objectivo principal do estudo realizado no âmbito desta tese consiste na produção de LE ricos em ácido oleico em posição sn-2 e em ácidos de cadeia média, nas posições sn-1 e sn-3 do TAG obtidos por acidólise entre o azeite, um óleo vegetal rico em ácido oleico, e ácidos caprílico ou cáprico, catalisada por lipases imobilizadas com selectividade sn-1,3..
Numa primeira fase, realizaram-se ensaios de acidólise entre azeite e ácido caprílico ou cáprico, catalisada por preparações comerciais das lipases imobilizadas de
Thermomyces lanuginosa, de Rhizomucor miehei e de Candida antarctica,
respectivamente, “Lipozyme TL IM”, “Lipozyme RM IM” e “Novozym 435”, produzidas pela Novozymes A/S. Estas lipases têm sido utilizadas com sucesso em reacções de acidólise (Akoh and Yee, 1997; Xu et al., 2002; Lai et al., 2005; Öztürk et
al., 2010). Enquanto as preparações lipásicas “Lipozyme TL IM” e “Lipozyme RM IM”
são reconhecidas com sn-1,3 selectivas, a “Novozym 435” apresenta regioselectividade apenas nalguns sistemas reaccionais (Tecelão et al, 2010). Os ensaios foram realizados em reactores descontínuos de mistura completa, pretendendo-se investigar os seguintes aspectos:
- Influência da presença de solvente (n-hexano) no meio reaccional no rendimento da reacção de acidólise catalisada pelos diferentes catalisadores comerciais;
- Estabilidade operacional dos bicatalisadores anteriormente referidos, em reutilizações sucessivas em reactor descontínuo com mistura total.
- Selectividade sn-1,3 apresentada pelas diferentes preparações lipásicas comerciais, na acidólise de azeite virgem com ácido caprílico ou cáprico.
Com base nos resultados obtidos, pretendeu-se seleccionar as condições reaccionais mais adequadas à reacção de acidólise entre o azeite e os ácidos gordos de
.d ocu -tra c .d ocu -tra c
cadeia média e o biocatalisador comercial que apresentasse maior actividade de acidólise e a maior estabilidade operacional (artigo 1: Nunes et al., 2011a).
Na segunda fase deste estudo realizaram-se ensaios de acidólise utilizando a preparação enzimática da lipase recombinante de Rhizopus oryzae (r-ROL) expressa numa estirpe mutante de Pichia pastoris, imobilizada em Eupergit® C, como alternativa às lipases comerciais, de elevado custo. Esta lipase heteróloga foi produzida pelo grupo do Prof. Francisco Valero da Universidade Autónoma de Barcelona, Espanha, e os trabalhos desenvolvidos no âmbito da (i) “ Rede Ibero-Americana para a Extracção e
Transformação Enzimática de Ingredientes Funcionais e Nutracêuticos de Plantas Regionais e Agro-resíduos (ENZNUT)”, Acção CYTED 108RT0346, e (ii) da acção
bilateral integrada Portugal-Espanha E-29/11, ”Produção de Aromatizantes e de
Lípidos Estruturados para a Indústria Alimentar, utilizando como Biocatalisador uma Lipase Microbiana Recombinante”.
Estes ensaios com a r-ROL imobilizada em Eupergit® C decorreram sob condições reaccionais semelhantes às utilizadas com as preparações enzimáticas comerciais “Lipozyme TL IM”, “Lipozyme RM IM” e “Novozym 435”, em meio livre de solvente ou em presença de n-hexano. Realizaram-se ainda ensaios de estabilidade operacional em reactores descontínuos de mistura total (artigo 2: Nunes et al., 2011b). Com esta preparação lipásica, procedeu-se à modelação da reacção de acidólise em função da composição do meio reaccional e da temperatura da reacção, através da metodologia das superfícies de resposta (artigo 3: Nunes et al., 2012). Uma vez que a estabilidade operacional de um biocatalisador depende do suporte de imobilização, do seu grau de hidratação e do método de imobilização utilizados, avaliou-se ainda a estabilidade operacional da lipase recombinante de Rhizopus oryzae imobilizada em Eupergit® C e em Lewatit VP OC 1600, com e sem hidratação entre reutilizações sucessivas (artigo 4: Nunes et al., 2012, submetido).
1.2. Propriedades fisiológicas dos ácidos gordos
Os AG utilizados na síntese de LE podem ser de cadeia curta, média ou longa. Consoante o comprimento da cadeia assim serão as características dos lípidos
.d ocu -tra c .d ocu -tra c
estruturados sintetizados e as respectivas propriedades benéficas na saúde do consumidor (Osborn e Akoh, 2002).
Os AG de cadeia curta são constituídos por cadeias com 2 a 6 átomos de carbono e são também designados por AG voláteis. As fontes destes AG são normalmente o leite de vaca e a manteiga. Devido à sua solubilidade em água, ao tamanho molecular e à sua cadeia curta, são mais rapidamente absorvidos no estômago (Akoh, 1998).
As fontes primárias dos AG de cadeia média (M) são as gorduras de côco e de palma. Estes AG são transportados preferencialmente pela veia porta até ao fígado onde, pela sua solubilidade superior à dos AG de cadeia longa, são metabolizados tão rapidamente como a glucose. Uma vez que estes ácidos gordos não são facilmente re-esterificados em novos triacilgliceróis, apresentam uma baixa tendência para se acumularem nos tecidos adiposos, com benefícios claros no controlo da obesidade. Neste contexto, os triacilgliceróis do tipo MLM apresentam interesse dietético pelo seu menor valor calórico (5-7 kcal/g) comparativamente aos óleos e gorduras convencionais (9 kcal/g), sendo também fontes alimentares importantes para pessoas com insuficiência pancreática (Smith et al., 1994; Osborn e Akoh, 2002).
Os AG de cadeia longa (L) estão presentes em óleos de origem vegetal e marinho e também em gorduras de origem animal. Estes AG são absorvidos e metabolizados mais lentamente do que os ácidos gordos de cadeia curta e de cadeia média, não sendo absorvidos e transportados no sangue devido ao seu carácter hidrofóbico. A sua absorção tem que ser feita primeiro através da incorporação em micelas com entrada posterior nas células intestinais e entrada no sistema linfático (Osborn e Akoh, 2002).
O ácido linoleico (C18:2n-6) é um AG de cadeia longa ómega-6 que pode ser encontrado na maioria dos óleos vegetais e em sementes de plantas, é um AG essencial que pode sofrer desnaturação e originar o ácido araquidónico (C20:4n-6). Outro grupo de AG designa-se por ómega-3, entre os quais se destaca o ácido linolénico (C18:3n-3), que podemos encontrar em óleos como o de soja e o de linhaça. Os ácidos gordos ómega-3 são fundamentais para o crescimento e desenvolvimento humano e deverão ser incluídos na dieta alimentar. O ácido eicosapentenóico (C20:5 n-6), EPA, e o ácido docosa-hexenóico (C22:6n-3), DHA, presentes em óleos de peixe, são também AG polinsaturados (PUFA) com elevado interesse para a produção de lípidos estruturados. Com efeito, as dietas ricas em AG polinsaturados do tipo ómega-3 aumentam os níveis das lipoproteínas de alta densidade (HDL), que removem o excesso de colesterol dos
.d ocu -tra c .d ocu -tra c
tecidos para o fígado e permitem a sua eliminação por via biliar. Estes AG também reduzem os níveis das lipoproteínas de baixa densidade (LDL) que transportam o colesterol para os tecidos (Osborn e Akoh, 2002).
Os AG ómega-9, dos quais se destaca o ácido oleico (C18:1n-9), presente em muitos óleos vegetais, nomeadamente no azeite, não são ácidos gordos essenciais, mas possuem um papel importante na redução dos níveis de colesterol no organismo (Osborn e Akoh, 2002). O ácido linoleico conjugado (C18:2), CLA (“conjugated linoleic acid”), é outro AG polinsaturado que possui duas ligações duplas conjugadas. Este AG está presente na gordura animal, principalmente na gordura do leite e na carne de animais ruminantes e tem sido utilizado na produção de lípidos estruturados devido às suas propriedades anticancerígenas (Osborn e Akoh, 2002).
O ácido gama-linolénico (GLA, “gamma-linolenic acid”) é um precursor da prostaglandina 1 (PGE1) e do ácido hidroxi-dihomo-gama-linolénico (DGLA) que possui propriedades anti-inflamatórias, anti-trombóticas e anti-tumorais (Lumor e Akoh, 2005). A sua síntese a partir do ácido linoleico é de apenas 10% sendo benéfica a sua ingestão na forma de suplemento alimentar. Este ácido gordo está presente no óleo extraído a partir das sementes de borragem e de prímula (Senanayake e Shahidi, 2002).
Os AG saturados de cadeia longa poderão estar associados ao aumento dos níveis de colesterol no sangue. No entanto, o ácido esteárico (C18:0) tem um efeito neutro em relação aos níveis de colesterol no sangue, principalmente devido ao seu ponto de fusão ser superior à temperatura do corpo humano, e, por outro lado, por sofrer alteração da sua estrutura in vivo originando ácido oleico.
O nível de colesterol no sangue é considerado como um dos factores de risco mais importantes, para o qual contribui uma elevada ingestão de gorduras saturadas. A ingestão de gorduras animais devido à sua composição em AG saturados, poderá contribuir para a acumulação de colesterol nas artérias e consequentemente problemas coronários.
1.3. Lípidos Estruturados com propriedades funcionais
O Japão foi o país pioneiro na produção e comercialização de alimentos funcionais. Introduziu este termo em meados dos anos 80 em referência aos alimentos
.d ocu -tra c .d ocu -tra c
processados contendo ingredientes que auxiliam funções específicas do corpo, além de serem nutritivos. Os alimentos funcionais passaram a ser conhecidos como “ alimentos para uso específico de saúde” (FOSHU – foods for specific health use) obedecendo a requisitos obrigatórios que comprovam a sua efectividade na promoção da saúde e na segurança alimentar. Nos Estados Unidos da América a categoria de alimentos funcionais não é reconhecida legalmente. No entanto, a American Dietetic Association (ADA) considera os alimentos fortificados e modificados como alimentos funcionais devido aos seus efeitos potencialmente benéficos sobre a saúde. O Comité de Alimentos e Nutrição do Institute of Medicine (IOM/FNB – Food and Nutrition Board, 1994) definiu alimentos funcionais como “qualquer alimento ou ingrediente que possa proporcionar um benefício à saúde além dos nutrientes tradicionais que contém” (Hasler, 1998).
As propriedades funcionais, nutricionais e organolépticas das gorduras naturais dependem (i) da sua composição em AG saturados e insaturados, (ii) do comprimento as cadeias dos AG, e (iii) da distribuição organizada desses AG nos TAG (posições sn-1,3 ou sn-2) (Xu, 2000).
Alguns LE fazem parte de alimentos e, simultaneamente, têm uma acção benéfica para a saúde através de uma acção de prevenção ou de tratamento de doenças, apresentando propriedades nutracêuticas.
A ingestão de LE, com propriedades nutracêuticas, tem efeitos benéficos na saúde do consumidor, nomeadamente (i) pelo aumento da digestibilidade e adequada absorção de ácidos gordos essenciais, (ii) no crescimento das crianças, favorecendo a calcificação e desenvolvimento dos ossos, (iii) na diminuição do risco de ocorrência de doenças cardiovasculares, assim como (iv) no controlo sobre os factores de envelhecimento (Hasler, 1998).
A investigação que vem sendo desenvolvida na área dos alimentos funcionais tem proporcionado o aparecimento de novos produtos que constituem a interface entre os alimentos e os fármacos. O conhecimento adquirido sobre os alimentos funcionais representa um enorme desafio sendo a sua utilização uma ferramenta importante na promoção da saúde, longevidade e qualidade de vida (Andlauer e Fürst, 2002).
Num LE, a composição em AG e a localização destes nos TAG determinam o seu metabolismo e consequentemente os benefícios para a saúde. A posição dos AG nos TAG é muito importante, nomeadamente no que se refere à sua digestão, durante a qual
.d ocu -tra c .d ocu -tra c
são produzidos sn-2 MAG e ácidos gordos livres no intestino, devido à acção da lipase pancreática. Estes dois compostos são posteriormente absorvidos pelos enterócitos. As células da mucosa intestinal re-esterificam os sn-2-MAG conjuntamente com os ácidos gordos de origem exógena e endógena para originarem novos TAG, sendo estes posteriormente excretados na linfa. A velocidade da hidrólise dos TAG pela lipase pancreática depende do comprimento da cadeia e do estado de saturação dos ácidos gordos presentes nas posições 1 e 3, sendo os TAG de cadeia média degradados mais rapidamente do que os de cadeia longa. Consequentemente, a produção de LE contendo ácidos gordos previamente seleccionados e em posições específicas tem despertado o interesse de vários investigadores (Straarup e Hoy, 2000).
A relação entre a localização dos ácidos gordos nos TAG e função nutricional destes lípidos sugere que o processo de interesterificação ou de acidólise pode melhorar o perfil nutricional de TAG específicos.
Os lípidos modificados por apresentarem características funcionais e/ou terapêuticas ímpares têm aplicação em áreas como a produção de gorduras de baixo valor calórico, assim como em nutrição infantil. A área da nutrição infantil e, em particular, a preparação de fórmulas sucedâneas do leite materno, tem merecido a atenção de muitos grupos de investigação e começa a ter expressão ao nível da indústria alimentar (Willis e Marangoni, 1998).
A ingestão de LE de baixo valor calórico previne a obesidade. Normalmente, estes lípidos modificados são constituídos por ácidos gordos de cadeia média, como são o caso dos ácidos capróico, caprílico e cáprico, que não se depositam no tecido adiposo e são directamente metabolizados no fígado. Akoh e Yee (1997) produziram um LE com baixo valor calórico através da interesterificação de tristearina com tricaprina (C10:0) ou tricaprilina (C8:0) com uma lipase com selectividade sn-1,3.
As dietas que contêm LE constituídos por ácidos gordos de cadeia média e ácido linoleico permitem uma melhor absorção dos ácidos gordos essenciais em doentes com fibrose quistica. Estes LE fornecem de forma eficiente um suplemento de ácido linoleico e de energia a partir dos ácidos gordos de cadeia média, que constituem o substrato preferencial do metabolismo oxidativo (Bell et al., 1997).
Os TAG contendo em simultâneo AG de cadeia média e ácidos gordos polinsaturados podem funcionar como lípidos terapêuticos, úteis nas nutrições entérica (alimentação feita através do tubo digestivo) e parentérica (alimentação intravenosa). As misturas físicas de TAG obtêm-se a partir da mistura de diferentes óleos ou gorduras
.d ocu -tra c .d ocu -tra c
contendo diferentes TAG (cadeia curta, média ou longa) sem que ocorra qualquer modificação destes lípidos. Recentemente, estas misturas físicas foram substituídas por LE contendo TAG do tipo MLM. A ingestão destes LE vai fornecer ácidos gordos essenciais de cadeia longa e, simultaneamente, permitirá a libertação mais lenta e controlada de ácidos gordos de cadeia média na corrente sanguínea (Babayan, 1987). Os TAG estruturados contendo ácidos gordos de cadeia média são úteis porque sofrem uma hidrólise e uma absorção pelo organismo mais rápidas do que os TAG que contêm ácidos gordos de cadeia longa. Estes LE com ácidos gordos de cadeia média possuem várias vantagens relativamente aos óleos naturais e às misturas físicas de TAG, tais como a função imunitária melhorada, diminuição do risco de cancro, prevenção de trombose, diminuição do nível de colesterol, prevenção da obesidade através da redução de peso, entre outros (Osborn e Akoh, 2002).
A estrutura e composição dos AG dos LE condicionam o seu metabolismo. Lee
et al. (2000) demonstraram que, apesar da composição em AG ser semelhante em
lípidos modificados por catálise enzimática e em misturas físicas de lípidos, o metabolismo destes lípidos é diferente devido à estrutura dos TAG e à composição em ácidos gordos na posição sn-2. No estudo realizado por estes autores, o óleo de soja foi modificado através da incorporação de ácido caprílico (C8:0) nas posições sn-1 e sn-3, mantendo-se os ácidos gordos de cadeia longa na posição sn-2. O lípido estruturado produzido foi comparado com uma mistura física de soja e tricaprilina, tendo os autores concluído deste estudo que a localização do ácido caprílico (C8:0) nos TAG é importante para o seu metabolismo.
1.3.1. Produção de Lípidos Estruturados por via química
A produção de LE por interesterificação química é um processo que facilmente pode ser sujeito a um aumento de escala permitindo, desta forma, a sua viabilidade económica. Contudo, o catalisador utilizado (normalmente constituído por um metal alcalino) não possui especificidade, pelo que não é possível controlar a posição dos ácidos gordos no produto final obtido (Willis e Marangoni, 1998). Este processo químico necessita de temperaturas elevadas, entre 70 e 150ºC, pressão reduzida e condições anidras. As trocas de grupos acilo processam-se ao acaso com formação de produtos secundários indesejáveis e consequente decréscimo do rendimento da reacção.
.d ocu -tra c .d ocu -tra c
Além disso, os produtos da reacção podem conter resíduos de catalisador (Moreno et
al., 2004).
A síntese química de LE consiste numa reacção de troca de radicais acilo e envolve a hidrólise de uma mistura de TAG de cadeia média e TAG de cadeia longa e posterior re-esterificação ao acaso com mistura de AG de cadeias média e longa, que entretanto se formaram (Akoh, 1998, Lee e Akoh, 1998). No final do processo de síntese química de LE, obtêm-se os TAG pretendidos e vários outros produtos indesejados difíceis de remover (Akoh, 1998).
1.3.2. Produção de Lípidos Estruturados por via enzimática
As reacções catalisadas por lipases (triacilglicerol acil-hidrolase, EC 3.1.1.3.) ocorrem sob condições suaves, a temperaturas inferiores a 70ºC e pressão atmosférica, e com maior selectividade do que as catalisadas quimicamente (Xu, 2000). Desta forma, a utilização de lipases na produção de LE poderá constituir uma vantagem para a indústria alimentar.
As lipases são enzimas activas em interfaces óleo-água em sistemas reaccionais heterogéneos. Estas enzimas catalisam a hidrólise de ésteres em meio aquoso, mas em meio orgânico de baixa actividade de água, podem catalisar reacções de esterificação e interesterificação
A reacção de interesterificação por lipases com selectividade sn-1,3 permite um maior controlo da posição ocupada pelos ácidos gordos polinsaturados (PUFA) nos TAG produzidos, mantendo-os na posição sn-2, com benefícios nutricionais, o que seria inviável por catálise inorgânica (Camacho Páez et al., 2002).
As reacções catalisadas por lipases são uma combinação entre reacções de esterificação e reacções de hidrólise (reacção inversa). A água formada durante a reacção de esterificação pode ser continuamente removida do meio reaccional para que seja minimizada a reacção de hidrólise e se obtenha um maior rendimento relativo à esterificação. O excesso de água no meio reaccional favorece a hidrólise e origina a acumulação de glicerol, AG livres, MAG e DAG. No entanto, a presença de água é essencial para a catálise enzimática, especialmente no que se refere à actividade da enzima (Xu, 2000).
.d ocu -tra c .d ocu -tra c
Os LE podem ser produzidos por catálise enzimática, por acção de lipases em presença de solvente orgânico, no qual os substratos são solúveis e a hidrólise pode ser minimizada. O tipo de solvente orgânico utilizado pode afectar a cinética da reacção, a eficiência da enzima e a sua estabilidade operacional (Akoh et al., 1997). Os solventes hidrofílicos ou polares podem penetrar no núcleo hidrofóbico das proteínas e alterar a sua estrutura funcional. Além disso, a interacção entre o solvente orgânico e a água ligada à enzima pode conduzir à ruptura destas ligações e à inevitável desactivação enzimática por remoção da monocamada de água que envolve a enzima e é essencial à manutenção da sua estrutura activa. Os solventes hidrofóbicos causam uma menor inactivação da enzima em reacções de esterificação (Klibanov, 1989).
A maioria das lipases possui uma actividade óptima entre os 30 e os 40ºC. O aumento da temperatura provoca a desnaturação da enzima devido à quebra de ligações, nomeadamente, as pontes de sulfureto. Este processo pode ser evitado através da utilização de meios reaccionais sem água ou, através da imobilização da enzima que lhe confere uma maior termoestabilidade. Além da temperatura, outros factores afectam a actividade enzimática e o rendimento das reacções catalisadas por lipases, como por exemplo o pH no microambiente aquoso da enzima, a carga enzimática, o tempo de reacção, a especificidade da enzima relativamente aos substratos, a razão molar de substratos, assim como o comprimento das cadeias dos substratos (Akoh, 1998).
As lipases apresentam diferentes preferências em relação à natureza dos ácidos gordos e à sua posição nos TAG. Esta selectividade permite classificá-las em (i) lipases não selectivas, que não apresentam selectividade em relação à posição dos ácidos gordos, actuando ao nível das três posições da molécula de acilglicerol ou (ii) lipases com selectividade sn-1,3, que catalisam a libertação de ácidos gordos apenas das posições externas da molécula de TAG, originando, por hidrólise, ácidos gordos livres, 1,2 (2,3)-DAG e 2-MAG (Xu, 2000).
As lipases utilizadas em reacções de síntese de LE provêm maioritariamente de fontes microbianas e possuem regioselectividade sn-1,3 (Akoh, 1995).
A produção de lípidos estruturados por via enzimática apresenta várias vantagens face à alternativa por via química, das quais se destacam a poupança de energia e a minimização da degradação térmica (Osborn e Akoh, 2002).
Actualmente, encontram-se disponíveis lipases geneticamente modificadas e que podem ser utilizadas na síntese de LE. A biotecnologia pode, desta forma, reduzir os custos associados à catálise enzimática com lipases e tornar a produção de LE
.d ocu -tra c .d ocu -tra c
economicamente mais viável. Através da sua imobilização em suportes adequados, de modo a que possam ser utilizadas em reactores contínuos ou reutilizadas em descontínuo, é possível reduzir o preço das lipases e tornar o proceeso viável a nível industrial. Assim, os principais objectivos da imobilização das enzimas são os seguintes: (i) estabilização do biocatalisador; (ii) maior facilidade de recuperação do biocatalisador do meio reaccional e no controlo do tempo de reacção; (iii) possibilidade de utilização das lipases em sistemas contínuos e reutilização em sistemas descontínuos; (iv) concentração de grandes quantidades de biocatalisador num pequeno volume de reactor, o que contribui para a intensificação dos processos (Eigtved et al., 1986).
1.3.3. Produção de lípidos estruturados por acidólise
A acidólise entre um TAG do tipo LLL e AG de cadeia média (M) caracteriza-se por ser um processo simples e directo de síntese de TAG do tipo MLM. Esta reacção ocorre em dois passos, ambos catalisados por lipases: um primeiro passo de hidrólise do TAG seguido de um segundo passo de esterificação do DAG formado com o ácido gordo livre (Xu, 2003).
A síntese de TAG do tipo MLM a partir de TAG do tipo LLL e de ácidos gordos livres de cadeia média (M) envolve as seguintes reacções:
1) Hidrólise do TAG do tipo LLL que origina a formação de DAG (LL-OH) e ácidos gordos livres de cadeia longa (L):
LLL + H2O LL-OH + L
2) Esterificação dos DAG (LL-OH) com os AG livres de cadeia média (M) e formação de TAG mono-substituídos (LLM):
LL-OH + MH LLM + H2O
3) Hidrólise dos TAG mono-substituídos (LLM) que origina DAG (OH-LM) e AG livres de cadeia longa (L):
.d ocu -tra c .d ocu -tra c
LLM + H2O OH-LM + L
4) Esterificação dos DAG (OH-LM) com os AG livres de cadeia média (M) e formação de TAG do tipo MLM:
OH-LM + M MLM + H2O
A produção de LE do tipo MLM, catalisada por lipases imobilizadas, tem sido estudada nos últimos anos por diversos investigadores, quer em presença de solvente orgânico, quer na ausência do mesmo (Fomuso e Akoh, 2002; Kim et al., 2002; Senanayake e Shahidi, 2002; Nagao et al., 2003, Moreno et al., 2004; Nascimento et al., 2004; Kim e Akoh, 2005; Lai et al., 2005; Kim e Akoh, 2006; Hita et al., 2007; Feltes
et al., 2009).
A síntese de TAG do tipo MLM por acidólise entre um TAG rico em ácido eicosapentenóico (EPA) em posição sn-2 (“EPAX 4510TG”, da Pronova Biocare, Norway) e ácido caprílico, foi catalisada pela preparação comercial de lipase de
Rhizomucor mehei imobilizada (“Lipozyme RM IM”) com selectividade sn-1,3, quer
em descontínuo num reactor tubular com recirculação, quer em contínuo (Moreno et al., 2004). A produção de LE contendo ácidos caprílico, esteárico e linoleico, por acidólise da trilinoleína com os ácidos caprílico e esteárico, em n-hexano, catalisada pela “Lipozyme RM IM”, permitiu obter um produto final que apresenta propriedades físicas adequadas à incorporação em óleos e molhos para temperar (Sellapan e Akoh, 2001).
Fomuso e Akoh (2002) enriqueceram os TAG do azeite nas posições 1 e 3 com ácido caprílico (43% mol) por acidólise catalisada pela “Lipozyme RM IM”. A optimização da acidolise entre óleo de milho e ácido caprílico catalisada pela lipase de
Thermomyces lanuginosa (“Lipozyme TL IM”) em presença de n-hexano permitiu a
incorporação de 21,5 mol-% de ácido caprílico nos TAG do tipo MLM (Öztürk et al., 2010).
A produção de LE tem sido catalisada por outras lipases, como seja a lipase nativa de Rhizopus oryzae, utilizada na síntese de TAG do tipo MLM por acidólise de óleos ricos em ácido gama-linolénico ou em ácido araquidónico e ácido caprílico (Kawashima et al., 2002; Nagao et al., 2003). Uma nova lipase de Pichia lynferdii NRRL Y-7723 foi utilizada com sucesso em reacções de acidólise entre óleo de
.d ocu -tra c .d ocu -tra c
borragem e ácido caprílico: após 24 h de reacção 47,5 mol-% de ácido caprílico foi incorporado no óleo (Kim et al., 2010).
A maioria dos LE disponíveis comercialmente é produzida por interesterificação química como são o caso do “Structolipid” produzido pela Pharmacia & Upjohn AB (Suécia) que contém AG de cadeias média e longa, e do “Caprenin” constituído pelos ácidos caprílico, cáprico e beénico, produzido pela Procter & Gamble (E.U.A.) (Rubin
et al., 2000; Webb e Sanders, 1991).
Através de técnicas de engenharia genética foi possível a produção de “Laurical” pela empresa Calgene (Monsanto Co.) contendo na sua composição 65% de ácido láurico (12:0) (Davies, 1996).
A produção à escala industrial de LE por catálise enzimática ainda se depara com alguns problemas relacionados com a purificação do produto final, elevado custo das lipases comerciais e, por vezes, baixa eficiência dos processos disponíveis.
Como exemplos de implementação dos processos de acidólise enzimática à escala industrial, são de referir: (i) a produção de sucedâneos de manteiga de cacau pela Unilever e Fuji Oil, (ii) a produção de “BetapolTM”, pela Lipid Nutrition (Holanda) e de InFat TM, fabricado pela Advanced Lipids, que são substitutos de gordura do leite humano (http//www.betapol.com, Abril 2012; http//www.advancedlipids.com, Abril 2012).
1.3.4. Parâmetros que influenciam a actividade e estabilidade enzimáticas
A actividade e estabilidade das lipases são influenciadas por vários factores, destacando-se a temperatura, a actividade da água (aw), a agitação, a pressão, a
composição do meio reaccional, a presença de solventes orgânicos, de agentes oxidantes, e de compostos inibidores da actividade enzimática (e.g. produtos de oxidação lipídica, ácidos gordos livres, pigmentos e iões metálicos) (Correia e Ferreira-Dias, 1998; Xu et al., 1998).
A temperatura é um parâmetro que influencia a actividade catalítica das enzimas e verifica-se que a velocidade de reacção aumenta até um valor máximo, a partir do qual decresce com o seu aumento. Um aumento de temperatura para valores extremos pode desnaturar completa e irreversivelmente as enzimas (Illanes, 1999). Para muitas enzimas a desnaturação inicia-se a 40-50ºC. No entanto, existem enzimas termorresistentes que
.d ocu -tra c .d ocu -tra c
desnaturam apenas a temperaturas mais elevadas. As preparações comerciais das lipases imobilizadas de Thermomyces lanuginosa, de Rhizomucor miehei e de Candida
antarctica, respectivamente, “Lipozyme TL IM”, “Lipozyme RM IM” e “Novozym
435”, produzidas pela Novozymes A/S, apresentam elevada actividade e estabilidade térmicas adequadas à modificação de óleos e gorduras por via enzimática (Hamam e Shahidi, 2006; Osório et al., 2006; Osório et al., 2008; Chopra e Sambaiah, 2009; Kim
et al., 2002; Zhao et al., 2007).
A água é necessária à acção enzimática permitindo que a enzima mantenha uma conformação nativa e cataliticamente activa. A água participa directa ou indirectamente nas pontes de hidrogénio e nas forças de van der Walls que mantêm a conformação nativa do biocatalisador (Klibanov, 1986). Este parâmetro é muito importante porque determina a velocidade de reacção, rendimento em produto final, a especificidade do bicatalisador, a estabilidade térmica e possivelmente a estabilidade operacional do biocatalisador (Yamane, 1988).
A actividade da água (aw) é uma medida da água disponível de um sistema e
corresponde à relação entre a pressão de vapor da água desse sistema (P) e a pressão de vapor de água pura no ar saturado à mesma temperatura (Po), (Parker e Birch, 1983).
Em geral, as lipases apresentam maior actividade na esterificação e na interesterificação dos lípidos em meios de aw entre 0,2 e 0,5, ou mesmo em meios quase
isentos de água (aw de 0,064 a 0,11), dependendo do biocatalisador utilizado e da
reacção (Ferreira-Dias e Fonseca, 1995; Adlercreutz et al., 2002; Nascimento et al., 2004; Osório et al., 2001; Petersson et al., 2007). Contudo, algumas lipases apresentam o seu máximo de actividade na esterificação ou interesterificação a valores de aw
superiores a 0,5 e em alguns casos a valores de aw próximos de 1, onde seria de esperar
que ocorresse apenas reacção de hidrólise (Ferreira-Dias et al., 2003; Petersson et al., 2007; Pires-Cabral et al., 2007). No entanto, na reacção de acidólise entre azeite e ácido cáprico catalisada pela lipase “Lipozyme TL IM” o aumento de aw originou uma maior
incorporação de ácido cáprico na posição sn-2 dos TAG através da migração do grupo acilo (Oh et al., 2009).
Existem estudos referentes a inactivação/inibição das lipases em presença de elevados teores de AG livres. Em reacções de acidólise, o aumento da razão dador do grupo acilo/TAG resulta, em geral, em níveis superiores de incorporação de AG no TAG. No entanto, ocorrerá simultaneamente um aumento do custo do processo
.d ocu -tra c .d ocu -tra c
associado à recuperação do substrato remanescente e do produto. Além disso, a utilização de concentrações elevadas de AG livres como substrato pode ter um efeito inibitório sobre as lipases (Jennings e Akoh, 2000; Camacho-Paez et al., 2003, Tecelão
et al., 2011).
As reacções de acidólise podem ocorrer na presença de solvente orgânico ou na sua ausência. Os principais objectivos da utilização de solvente orgânico imiscível com água, no meio reaccional, são: (i) dissolver ésteres e outros compostos hidrofóbicos, permitindo trabalhar a temperaturas próximas da ambiente mesmo com substratos hidrofóbicos de elevado ponto de fusão (ii) facilitar a extracção e recuperação dos produtos hidrofóbicos e (iii) deslocar a reacção no sentido desejado. A presença do solvente no meio reaccional pode também reduzir o efeito inibitório de substratos e/ou produtos, através da partição entre as fases aquosa e orgânica de sistemas bifásicos.
No entanto, o recurso a um solvente orgânico leva a um aumento da complexidade do sistema e eventualmente a uma maior dificuldade na recuperação e purificação dos produtos. A escolha do solvente deverá ter em conta a sua biocompatibilidade e aceitação por parte da indústria alimentar. A toxicidade molecular do solvente é usualmente avaliada através do logaritmo do coeficiente de partição do solvente num sistema padrão n-octanol/água (log P), conhecido como parâmetro de Hansch, que é um indicador do grau de hidrofobia do solvente em causa. Solventes com log P inferiores a 2 são considerados tóxicos, enquanto aqueles com log P superiores a 4 são considerados biocompatíveis (Laane et al., 1987). Neste contexto, o n-hexano tem sido utilizado em sistemas catalisados por lipases, apresentando um log P de 3,5.
Nalguns sistemas, o meio reaccional é apenas formado pelos substratos e a reacção enzimática ocorre na ausência de solvente tornando o processo enzimático mais económico. Contudo, quando os substratos apresentam elevados pontos de fusão, a reacção deverá decorrer a temperatura acima desse valor, o que obriga à utilização de lipases termorresistentes.
1.4. Importância do azeite na produção de lípidos estruturados
O consumo de azeite tem aumentado em todo o mundo devido principalmente às suas excelentes propriedades organolépticas e nutracêuticas (El Riachy et al., 2011).
O azeite constitui a principal fonte de gordura na dieta Mediterrânica substituindo as gorduras de origem animal, associadas a doenças graves. Vários estudos
.d ocu -tra c .d ocu -tra c
epidemiológicos têm confirmado uma maior longevidade dos consumidores de uma dieta Mediterrânica em relação a outros europeus e americanos através da prevenção do aparecimento de doenças crónicas e degenerativas. Apesar de outros factores influenciarem a longevidade associada à zona do Mediterrâneo, nomeadamente a actividade física, vários estudos têm demonstrado que o consumo de azeite virgem está relacionado com benefícios nutricionais e na saúde (Garcia-González et al., 2008).
Os compostos presentes no azeite em maior concentração são os TAG, encontrando-se os diacilgliceróis (DAG), os monoacilgliceróis (MAG) e os AG livres presentes em menores concentrações. Os AG que constituem os TAG são o ácido palmítico (P, 7,5-20 %), o ácido esteárico (S, 0,5-5 %), o ácido palmitoleico (Pl, 0.3-3.5 %), o ácido oleico (O, 55-85 %), o ácido linoleico (L, 7,5-20 %) e o ácido linolénico (Ln, 0-1,5 %). Os TAG do azeite possuem elevadas concentrações de ácido oleico, apresentado TAG do tipo OOO (40-59 %), POO (12-20 %), OOL (12,5-20 %), POL (5,5-7 %) e SOO (3-7 %) (Boskou,2002).
Os compostos antioxidantes presentes no azeite são os tocoferóis, os pigmentos (carotenóides e clorofilas) e compostos fenólicos. Estes compostos activam os mecanismos de defesa, retardam o envelhecimento, têm um efeito anticancerígeno, previnem o aparecimento de arterosclerose, de obesidade, de doenças hepáticas e inflamatórias, entre outras doenças (Servili e Montedoro, 2002). Estes componentes minoritários do azeite têm um papel relevante na qualidade e caracterização dos diferentes azeites (Moreno e Mitjavilab, 2003).
O azeite apresenta características especiais que o tornam num substrato interessante para a produção de lípidos estruturados do tipo MLM. O ácido oleico e o linoleico, presentes nos TAG do azeite, encontram-se esterificados principalmente na posição sn-2 pelo que são facilmente absorvidos. Os LE obtidos a partir da acidólise do azeite com ácidos gordos de cadeia media apresentarão benefícios nutricionais, nomeadamente benefícios de absorção, devido à presença de AG de cadeia média nas posições sn-1 e sn-3 dos TAG (Fomuso e Akoh, 2002).
1.5. Estabilidade operacional
A utilização de lipases imobilizadas em suportes permite a sua reutilização em reactores descontínuos, ou a sua aplicação em processos em contínuo, de forma a
.d ocu -tra c .d ocu -tra c
igualar o seu preço aos custos energéticos associados aos processos correntes por catálise química (Brady et al, 1988). A selecção de uma enzima imobilizada que apresente elevada estabilidade operacional constitui um factor importante na optimização dos processos biotecnológicos. A estabilidade operacional da preparação enzimática vai depender, não só do carácter hidrofílico/hidrofóbico do suporte, assim como da natureza da reacção química e dos substratos nela envolvidos. A imobilização enzimática confere maior estabilidade ao biocatalisador em relação ao pH e à temperatura, assim como permite a sua reutilização em reactores descontínuos ou a sua aplicação em contínuo e posterior recuperação tornando desta forma os bioprocessos mais económicos (Lee e Akoh, 1998).
A estabilidade operacional das enzimas imobilizadas é um aspecto fundamental a considerar quando se pretende implementar sistemas em contínuo ou sistemas descontínuos com reutilizações sucessivas do biocatalisador, que utilizam preparações enzimáticas cujo elevado preço tem um peso importante na economia do processo.
A estabilidade operacional de uma enzima está relacionada com a desnaturação reversível e irreversível do biocatalisador durante o processo, mas tem como característica o facto de ser medida na presença de substrato(s) e produto(s) da reacção. O substrato e o produto poderão ter um efeito estabilizador da conformação nativa da enzima e consequentemente aumentar a estabilidade enzimática.
A redução da actividade enzimática poderá dever-se a vários efeitos, nomeadamente: (i) efeitos conformacionais e estereoquímicos, em que a interacção do substrato com a enzima é afectada por alteração conformacional da própria enzima ou devido a impedimento estereoquímico; (ii) efeitos de partição, causados por interacções electrostáticas ou hidrófobas entre a matriz de suporte e o substrato; (iii) efeitos de transferência de massa, que advêm das resistências difusionais ao transporte do(s) substrato(s) do macroambiente até ao centro activo e do transporte do(s) produto(s) do centro activo para o macroambiente (Doran, 1995).
A desactivação do biocatalisador durante o tempo de operação pode ocorrer devido a desnaturação térmica, dessorção da enzima do suporte sólido, desintegração ou solubilização do suporte, ou ainda por acção de outros factores desnaturantes (Doran, 1995). O biocatalisador a utilizar num dado sistema reaccional deverá apresentar uma actividade catalítica elevada e que essa seja mantida durante longos períodos de utilização. Desta forma, será possível tornar os processos enzimáticos economicamente viáveis e competitivos com os processos químicos.
.d ocu -tra c .d ocu -tra c
1.6. Referências Bibliográficas
Adlercreutz, D., Budde, H., Wehtje, E. (2002). Synthesis of phosphatidylcholine with defined fatty acid in the sn-1 position by lipase-catalyzed esterification and transesterification reaction. Biotechnol. Bioeng., 78:403-411.
Akoh, C.C. (1995) Structured lipids - enzymatic approach. Inform. 6: 1955-1061.
Akoh, C.C., Huang, K. (1995) Enzymatic synthesis of structured lipids: Transesterification of triolein and caprylic acid. J. Food Lipids. 2: 219-230.
Akoh, C.C., Yee, L.N. (1997) Enzymatic synthesis of position-specific low-calorie structuredlipids. J. Am. Oil Chem. Soc. 74(11): 1409-1413.
Akoh, C.C. (1998) Structured lipids. In: Akoh CC and Min DB, editors. Food Lipids
Chemistry, Nutrition, and Biotechnology. New York: Marcel Dekker. pp. 699-727.
Andlauer, W., Fürst, P. (2002) Nutraceuticals: a piece of history, present status and outlook. Food Res. Int. 35: 171-176.
Babayan, V.K. (1987) Medium chain triglycerides and structured lipids. Lipids. 22: 417-420.
Bell, S.J., Bradley, D. Forse, R.A, Bistrain, B.R. (1997) The new dietary fats in health and disease. J. Am. Dietetic. Assoc. 97 (3): 280-286.
Boskou, D. (2002) Olive oil, In: Gunstone F. D., editor. Vegetable Oils in Food
Technology: Composition, Properties and Uses, CRC Press, USA, pp.244-277.
Camacho Páez, B., Robles Medina, A., Camacho Rubio, F., González Moreno, P., Molina Grima, E. (2002) Production of structured triglycerides rich in n-3 polyunsaturated fatty acids by the acidolysis of cod liver and caprylic acid in a packed-bed reactor; equilibrium and kinetic. Chem. Eng. Sci. 57: 1237-1249.
.d ocu -tra c .d ocu -tra c
Camacho Paez, B., Robles Medina, A., Camacho Rubio, F., Estebán Cerdán, L., Molina Grima, E. (2003) Kinetics of lipase-catalysed interesterification of triolein and caprylic acid to produce structured lipids. J. Chem. Technol. Biotechnol. 78:461-470.
Correia, A.C. e Ferreira-Dias, S. (1998) The effect of impurities of crude olive residue oil on the operational stability of the Candida rugosa lipase immobilized in polyurethane foams, In: A. Ballesteros, F.J. Plou, J.L. Iborra, P. Halling (eds). Stability
and Stabilization of Biocatalysts. Elsevier, Amsterdam, Netherlands, pp71-76.
Davies, H.M. (1996). Engineering new oilseed crops from rapeseed.. In: J. Janick (ed.), Progress in new crops. ASHS Press, Alexandria, VA, pp. 299-306.
Doran, P.M. (1995) Bioprocess Engineering Principles. Academic Press: pp. 336-341; 352-363.
Eigtved, P., Hansen, T.T., Sakaguchi, H. (1986). Characteristics of immobilized lipase in esther synthesis and effects of water and temperature in various reactions. AOCS/JAOCS Meeting, Honolulu.
El Riachy, M., Priego-Capote, F., Léon, L., Rallo, L., Castro, M.D.L. (2011) Hydrophilic antioxidants of virgin olive oil. Part 1. Eur. J. Lipid Sci. Technol. 113:678-691.
Feltes, M.M.C., de Oliveira Pitol, L., Gomes Correia, J.F., Grimaldi, R., Block, J.M., Ninow, J.L. (2009) Incorporation of médium chain fatty acids into fish oil by chemical and enzymatic interesterification. Grasas y Aceites 60:168-176.
Ferreira-Dias, S. (2010). Enzymatic production of functional fats, In: A. Pandey, C. Larroche, C.R. Soccol, E. Gnansounou, P. Nigam (eds), Comprehensive Food
Fermentation Biotechnology, Vol II., Asiatech Publishers Inc., New Deli (India), pp.
608-641.
Ferreira-Dias, S., Correia, A.C., da Fonseca, M.M.R. (2003) Response surface modelling of glycerolysis catalysed by Candida rugosa lipase immobilized in different
.d ocu -tra c .d ocu -tra c
polyurethane foams for the production of partial glycerides, J. Mol. Catal. B: Enzym. 21:71-80.
Ferreira-Dias, S., Fonseca, M.M.R. (1995) Production of monoglycerides by glycerolysis of olive oil with immobilized lipase: effect of the water activity, Bioprocess
Eng., 12(5):327-337.
Fomuso, L.B., Akoh, C.C. (2002) Lipase-catalyzed acidolysis of olive oil and caprylic acid in a bench-scale packed bed bioreactor. Food Res. Int. 35: 15-21
Garcia-González, D., Aparricio-Ruiz, R., Aparicio, R. (2008) Virgin olive oil – chemical implications on quality and health. Eur. J. Lipid Sci. Technol. 110:602-607.
Giese, J. (1996). Fats, oils and fat replacers. Food Technol., pp. 78-83.
Gunstone, F.D. (2008) Nutritional Properties, In: Gunstone F. D.(ed) Oils and fats, in
the food industry, Willey-Blackwell United Kingdom, pp.89-112.
Hasler, C.M. (1998) Functional foods: their role in disease prevention and health promotion. Food Technol. 52(11):63-70.
Hita, E., Robles, A., Camacho, B., Ramírez, A., Esteban, L., Jiménez, M.J., Muñio, M.M., Gozález, P.A., Molina, E. (2007) Production of structured triacylglycerols (STAG) rich in docosahexaenoic acid (DHA) in position 2 by acidolysis of tuna oil catalyzed by lipases, Process Biochem. 42:415-422.
Howlett, J. (2008) Functional Foods: From Science to Health and Claims. P. Aggett, eds., ILSI Europe publications, pp.36.
Illanes, A. (1999) Stability of biocatalysts. Electron. J. Biotechn. 2(1)1-9.
Jennings, B.H., Akoh C.C. (1999) Enzymatic modification of triacylglycerols of high eicosapentaenoic and docosahexaenoic acids content to produce structured lipids. J. Am.
Oil Chem. Soc. 76:1133-1137.
.d ocu -tra c .d ocu -tra c