UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS DE RIBEIRÃO PRETO
Clonagem, expressão e caracterização do fator estimulador de
colônia de granulócito humano recombinante (rhG-CSF) em
Escherichia coli
.
Fillipe Luiz Rosa do Carmo
RESUMO
Carmo, F. L. R. Clonagem, expressão e caracterização do fator estimulador de
colônia de granulócito humano recombinante (rhG-CSF) em Escherichia coli. Ribeirão Preto, 2014. 52f. Dissertação de Mestrado. Faculdade de Ciências Farmacêuticas de Ribeirão Preto – Universidade de São Paulo, Ribeirão Preto, 2014.
O sistema de expressão em Escherichia coli foi o primeiro a ser utilizado para
produzir produtos farmacêuticos recombinantes e tem muitas vantagens quando comparado com sistemas eucarióticos, como o fácil cultivo, baixo custo e alto potencial de produção. O fator estimulador de colônias de granulócito (G-CSF) atua principalmente promovendo a maturação dos neutrófilos e estimulando sua atividade fagocítica e quimiotática, além de estar envolvido com o processo de segmentação nuclear dessas células. O fator estimulador de colônias de granulócitos humano recombinante (rhG-CSF) tem sido produzido por engenharia genética em Escherichia coli, e é usado no tratamento de diversas patologias, sobretudo em neutropenias provocadas pela quimioterapia usada no tratamento de tumores, pela radioterapia e pelo uso de drogas que suprimem a produção de células mieloides. Desse modo, o presente estudo teve como objetivo a expressão da proteína
rhG-CSF em bactérias Escherichia coli. A clonagem do gene rhG-CSF no vetor de
expressão pET-28a(+) foi realizada nos sítios de restrição das enzimas EcoRI e XhoI, e a expressão da proteína recombinante em cepas de bactéria Escherichia coli BL21DE3 foi obtida com sucesso. A proteína rhG-CSF, fundida à cauda de seis histidinas, foi purificada com êxito e identificada pelas técnicas de Western Blotting e por espectrometria de massas. São necessários estudos para avaliar a integridade estrutural e atividade biológica da proteína produzida, que se confirmada, possibilita que esta seja produzida em escala piloto.
1 INTRODUÇÃO
As células sanguíneas se originam de um precursor comum, a célula-tronco
hematopoiética. Esse precursor comum origina dois tipos de progenitores celulares
que são as células progenitoras da linhagem mieloide e células progenitoras da
linhagem linfoide.
Células progenitoras linfoide podem ser comprometidas com a formação dos
linfócitos B ou com a formação dos linfócitos T. As células progenitoras da linhagem
mieloide se diferenciarão em linhagens comprometidas com a formação de
hemácias e plaquetas (linhagem eritroide-megacariocítica) e com a formação de
granulócitos e monócitos (linhagem granulocítica-monocítica), e dessa forma geram
células conhecidas como Unidades Formadoras de Colônia (CFU). Por serem mais
diferenciadas, as CFU originarão apenas alguns tipos celulares, como monócitos,
macrófagos, células dendríticas, megacariócitos e os granulócitos. Os granulócitos
são assim denominados por possuírem grânulos densamente coráveis no
citoplasma. Entre eles estão os eosinófilos, basófilos e os neutrófilos, células
responsáveis pela resposta imune inata na defesa contra bactérias e fungos (ZAGO,
2001).
Durante o processo de diferenciação celular, as citocinas têm um papel
primordial por estimularem o desenvolvimento e a proliferação de células
precursoras. São glicoproteínas secretadas por células do sistema imune ou por
outros tipos celulares em resposta a uma estimulação (ZAGO, 2001; ALBERTS,
2011). Muitas dessas citocinas são chamadas fatores de estimulação de colônias,
pois foram originalmente testadas pela sua habilidade de estimular o crescimento e
o desenvolvimento de várias colônias leucocíticas ou eritroides da medula óssea.
Estas citocinas são secretadas pelo estroma que é o espaço medular
constituído por fibroblastos, adipócitos, macrófagos, linfócitos, células endoteliais e
matriz extracelular. O estroma constitui o microambiente que possibilita o
Figura 1. Ilustração esquemática do processo geral de hematopoese. Fonte: (Adaptado Celgene 2014)
1.1 O Fator estimulador de colônias de granulócito humano
O fator estimulador de colônias de granulócitos humano (hG-CSF, em inglês,
human Granulocyte Colony Stimutating Factor), é uma citocina hematopoiética de
grande importância que atua promovendo a maturação dos neutrófilos e estimulando
sua atividade fagocítica e quimiotática, além de estar envolvido com o processo de
segmentação nuclear dos neutrófilos maduros (GOUGH et al, 1997; BABALOLA et
al, 2004; WITTMAN et al, 2006).
A primeira linha de defesa celular contra agentes infecciosos compreende os
granulócitos polimorfonucleares, os macrófagos e células NK (Natural Killer)
(KURITZKES et al, 1998; WITTMAN et al, 2006). Assim, o hG-CSF é de suma
importância, pois estimula e regula a proliferação, sobrevivência e diferenciação das
células precursoras de neutrófilos na medula óssea (HARTUNG T. et al, 1998) que
atuarão nessa primeira linha de defesa do organismo contra agentes infecciosos
(METCALF et al, 1986; HÜBE et al , 2003). Outra característica do hG-CSF é a
pró-inflamatórias por monócitos e macrófagos ativados (HARTUNG et al, 1998;
BONEBERG et al, 2002; BARREDA et al, 2004).
Os monócitos e macrófagos são as células que mais produzem hG-CSF,
entretanto também é produzido por fibroblastos, células endoteliais e linfócitos T, .
(JANEWAY et al, 2000; BARREDA et al, 2004). A produção e liberação desta
citocina encontram-se aumentadas após estimulo com lipopolissacarídeos, que é um
componente da parede celular de bactérias Gram negativas, pelas interleucinas
(IL-1,IL-3 e IL-4), Fator de necrose Tumoral (TNF-α) e também pelo fator estimulador
de granulócitos e macrófagos (GM-CSF) (GOMES et al, 2012)
1.2 Caracterização molecular do G-CSF humano e recombinante hG-CSF
O gene que codifica para o G-CSF em humanos está localizado no
cromossomo 17q21-22 (SIMMERS et al, 1987) A forma nativa da proteína G-CSF é
glicosilada, o que confere resistência à degradação por proteases, garantindo
estabilidade à molécula.. Contudo, as formas nativa e a não-glicosilada apresentam
atividade biológica (OH-EDA et al, 1990).
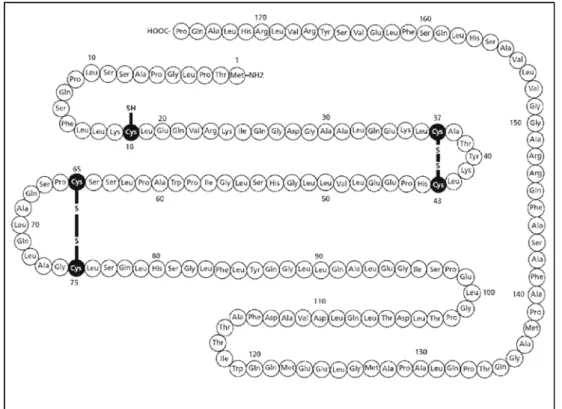
A proteína recombinante hG-CSF (rhG-CSF) é uma molécula monomérica
que possui uma sequência de 174 aminoácidos e tem peso molecular de
aproximadamente 18,8 kDa. A molécula contém um resíduo de cisteína livre em sua
forma reduzidana posição 17 e duas pontes dissulfeto (Cys36, 42 e Cys64, 74), assim
como na proteína hG-CSF, essas características são importantes para a estabilidade
estrutural da proteína, dobramento correto da cadeia de aminoácidos e sua atividade
biológica (LU et al, 1989).
A estrutura secundária da molécula contém aproximadamente 69% de α
-hélice, 4% de folha-ß, 5% de ß-curvatura, sendo que o restante da molécula ainda
não foi caracterizado (LU et al, 1989). Além disso, é composta por quatro hélices,
denominada A, B, C e D. A hélice A forma-se entre os resíduos 11-39, a B entre
Figura 2. Estrutura do fator estimulador de colônias de granulócitos recombinante humano (rhG-CSF) Fonte: (Annavarapu modificado 2014)
1.3 O fator estimulador de colônias de granulócitos humano recombinante
Biofármacos são as substâncias e/ou drogas medicinais produzidas pelo
emprego da biotecnologia, principalmente pela tecnologia de DNA recombinante.
São proteínas ou ácidos nucléicos utilizados para fins terapêuticos ou de diagnóstico
in vivo. São homologas às proteínas humanas ou têm alto grau de semelhança com
as mesmas. Contudo, para dizer que uma proteína terapêutica é um biofármaco,
deve-se avaliar qual foi o bioprocesso utilizado na sua obtenção, pois eles são
produzidos por outros métodos, do quê pela extração direta de fontes biológicas
nativas (não-modificadas) (WALSH et al, 2005; WANG et al, 1999).
O gene G-CSF humano foi clonado e expressado primeiramente por dois
grupos de pesquisa (Nagata 1986; Souza 1986). O grupo de pesquisa liderado por
Larry Souza clonou o gene do G-CSF e produziu a proteína recombinante,
facilitando significativamente tanto o estudo dos seus efeitos no sistema
hematopoiético como o entendimento da biologia desse fator (HAMMERLING et al
Figura 3. Sequência de aminoácidos (estrutura primária) do rhG-CSF (Filgrastima). Fonte: Sandoz - Zarzio® 2011
O desenvolvimento do rhG-CSF produzido em bactérias Escherichia coli,
apresentou uma sequência de aminoácidos idêntica ao G-CSF humano, exceto por
uma metionina N-terminal adicional, e pela a ausência de O-glicosilação no resíduo
de Thr 133, que não é essencial para a atividade biológica dessa molécula. Essa
forma não glicosilada é comercialmente conhecida como Filgrastim, existe outro
produto no mercado que é o rhG-CSF glicosilado, denominado comercialmente de
Lenograstim, obtido da expressão em células de mamíferos (CODEVILLA et al.,
2004).
1.4 Uso clínico e sua importância
Como o rhG-CSF regula a produção da linhagem neutrofílica, seu uso está
associado a pacientes que apresentam o quadro neutropenia. Ambos os fatores
produzidos, Filgrastim e o Lenograstim, se ligam a receptores específicos da membrana
de progenitores mieloides, promovendo a proliferação e diferenciação da linhagem
et al, 2008; GOMES et al, 2012). Assim, as aplicações clínicas mais estudadas do
rhG-CSF foram realizadas principalmente com a finalidade de melhora da neutropenia
(ASANO, 1998). Sua administração em humanos promove aumento dose-dependente
nos níveis de neutrófilos circulantes, sobretudo por reduzir o tempo de maturação da
célula progenitora até o neutrófilo maduro (VANZ et al, 2008; GOMES et al; 2012).
Após a liberação pelo Food and Drug Administration (FDA) nos Estados
Unidos, o biofármaco foi usado com finalidade de diminuir a incidência de infecções
associadas com neutropenia induzida por quimioterapia usada no tratamento de
tumores, pela radioterapia e pelo uso de drogas que suprimem a produção de
células mieloides (HARTUNG, 1998). Uma das maiores causas de morbidade e
mortalidade em pacientes com câncer, que passam por tratamento de quimioterapia,
é a associação do quadro de neutropenia com a gravidade das infecções ao qual o
paciente esta suscetível (GARCÍA-CARBONERO et al; 2001).
As áreas de investigação para o uso do biofármaco rhG-CSF, incluem
mielossupressão após o uso da quimioterapia contra o câncer seguido de
transplantes autólogo ou alogênico da medula óssea (OHNO et al, 1991). O
rhG-CSF também tem sido experimentado em tratamentos de várias neutropenias
crônicas associadas com a anemia aplástica, síndromes mielodisplásicas,
neutropenia idiopática, neutropenia cíclica (HANADA e ONO, 1990).
Na última década, outros alvos para o uso de hG-CSF vem sendo
apresentados com sucesso, como reforçar o sistema imunológico em pacientes com
HIV, pneumonia, infecções decorrentes da diabetes, leucemia e neutropenia febril
(KURITZKES et al, 1998; HAROUSSEAU et al, 2000; GARCÍA-CARBONERO et al;
2001; BABALOLA et al, 2004). Estudos demonstram que o hG-CSF pode ser
utilizado com resultados satisfatórios para o tratamento de infecções em pacientes
não neutropênicos, como medida para fortalecer sua defesa imune, bem como
prevenção (KURITZKES et al, 1998; WITTMAN et al, 2006). Relatos também
sugerem benefícios em caso de peritonites e infecção tecidual em ratos e
camundongos (WITTMAN et al, 2006).
Um estudo realizado em camundongos sugere que citocinas hematopoéticas,
como G-CSF, melhoram a função cardíaca e reduzem a taxa de mortalidade após o
infarto do miocárdio (HARADA et al, 2005). Essa ação é possível devido ao efeito
protetor sobre os cardiomiócitos, a promoção da angiogênese e a prevenção da
1.5 Produção do biofármaco
O sistema de expressão em Escherichia coli foi o primeiro a ser utilizado para
produzir produtos farmacêuticos recombinantes e tem muitas vantagens quando
comparado aos sistemas eucarióticos, como o fácil cultivo, baixo custo e alto
potencial de produção (VANZ et al, 2008; GOMES et al, 2012; BASSO et al, 2013).
Entre os diversos sistemas de expressão heteróloga disponíveis, a bactéria E. coli é
um dos mais atraentes devido ao seu rápido crescimento em meio de cultura, sua
genética bem descrita e a disponibilidade de inúmeros vetores bacterianos e cepas
mutantes (VANZ et al, 2008; GOMES et al, 2012; BASSO et al, 2013).
A expressão de proteínas recombinante no sistema da E. coli apresenta
algumas desvantagens, como a dificuldade da expressão citoplasmática da proteína
de interesse, o que pode acarretar na proteína com uma conformação indesejável e
possivelmente sem atividade biológica desejada. A bactéria apresenta alto conteúdo
de endotoxinas, que podem degradar a proteína recombinante expressa. Algumas
combinações de códons são encontradas em baixa frequência em E. coli , podendo
prejudicar a tradução da proteína, e como alternativa ao problema do uso
preferencial de códons (codon usage) pode ser realizado a otimização do codons. O
sistema também não permite fazer modificações pós-traducionais, o que acaba
limitando seu uso para proteínas que não necessitam dessas alterações químicas.
Durante o processo de expressão de proteínas recombinantes no sistema
procarioto a expressão em níveis elevados resulta, muitas vezes, na deposição da
proteína desejada na forma inativa de agregados insolúveis, conhecidos como
corpos de inclusão (BANEYX e MUJACIC, 2004; JEVSEVAR et al, 2005). A
conformação da proteína, também pode ser prejudicada pelo o uso de promotores
fortes e altas concentrações de indutores, que apesar de permitir uma alta produção
de proteína, em alguns casos, acaba afetando o dobramento correto da proteína
(JeVSEVAR et al, 2005).
Algumas estratégias podem ser usadas para evitar a formação dos corpos de
inclusão, uma delas é realizar a expressão do gene a baixas temperaturas, o que
resulta na diminuição do grau de transcrição, tradução e redução da força de
interação hidrofóbica, a qual contribui para o dobramento errôneo da proteína
(JEVSEVAR et al, 2005; CHALMERS et al, 1990; VASINA et al, 1997). Promotores
proteína alvo, alcançado um dobramento adequado da proteína alvo (JEVSEVAR et
al, 2005).
Os agregados de proteínas recombinantes não possuem atividade biológica e
se faz necessário realizar protocolos para solubilizá-los e devolver a conformação
ativa da proteína por renaturação in vitro para então purificá-la (VALLEJO, 2004).
1.6 Brasil e patentes
O uso rhG-CSF como um medicamento biotecnológico, começou em 1989. O
laboratório americano AMGEN, que patenteou o processo (Patente US 4,810,643) ,
lançou no mercado o produto nomeado como Neupogem® (Filgrastima) (NAGATA et
al, 1986; SOUZA, 1989).Em 1991, a agência reguladora dos Estados Unidos U. S.
FDA aprovou o uso clínico do rhG-CSF, com a finalidade de diminuir a incidência de
infecções associadas à neutropenia induzida por quimioterapia de pacientes com
câncer. No Brasil esse medicamento foi registrado pela Agência Nacional de
Vigilância Sanitária em 2002. O biofármaco se encontra disponível para uso
terapêutico no Brasil sob os nomes comercias de: Filgrastine® (Blausiegel),
Filgrastim® (Biosintética), Granomax® (Dr. Reddys), Granulokine® (Roche),
Myograf® (Bergamo), Leucin® (Bergamo) e Tevafilgras® (Teva).
Em 2006 a Filgrastima, produzida pelo laboratório Amgem Inc, perdeu sua
proteção por patente. Ao longo dos anos com a expiração das patentes sobre
medicamentos desenvolvidos por tecnologia recombinante, surge a possibilidade
para a produção desses medicamentos, conhecidos na Europa pelo termo
“biosimilar” e nos EUA pela expressão “follow-on biologic product” ou “follow on
proteins”. , Esses biofármacos devem ter sua segurança e a eficácia comprovadas e
serem equivalentes. Esses medicamentos não são considerados medicamentos
“genéricos”, uma vez que os testes exigidos para desenvolver estes produtos são
muito mais rigorosos que os realizados para um genérico tradicional produzido por
síntese química.
O Programa Inova Saúde é uma iniciativa do Ministério da Ciência,
Tecnologia e Inovação (MCTI) e da Finep, em cooperação com o Ministério da
Saúde (MS), o BNDES e o CNPq, que teve início em abril de 2013, com duração
projetos de PD&I em farmoquímicos obtidos por processos de síntese química,
biotecnológicos e extrativos, para desenvolvimento de medicamentos, novos ou
genéricos, tanto para atendimento às demandas do Sistema Único de Saúde (SUS),
quanto para o atendimento ao mercado nacional e internacional (Finep - Inova
Saúde).
O programa está inserido no Plano Inova Empresa e destina R$ 3,6 bilhões
para as atividades de inovação do Complexo da Saúde para que haja uma
diminuição efetiva da dependência tecnológica do Brasil em relação ao fornecimento
de importantes insumos utilizados no campo da saúde humana (Finep - Inova
Saúde).
Em Brasília, no dia 18 de Junho de 2014, foram apresentadas as medidas da
política industrial que será adotada nos próximos anos. Um aspecto importante são
as margens de preferência de 25%, nas compras Governamentais para todos os
setores, inclusive do Complexo Saúde que abrange medicamentos (Biofármacos),
materiais e equipamentos, para ser aplicada nos processos de licitação para
produtos manufaturados e serviços nacionais. Essas medidas terão validade até
2020 (Tabela 1).
Tabela 1: Margem de Preferência aplicada nos processos de licitação para produtos produzidos no Brasil. (Fonte: Receita Federal do Brasil 2014)
Produto Medicamentos
Fármacos
Biofármacos
Materiais e equipamentos
Margem de preferência
COMPLEXO SAÚDE
Valor 8% 20% 25%
8%, 15%, 20% e 25%
SETOR
Como os medicamentos biotecnológicos possuem alto valor, esses produtos
respondem por parcela importante dos gastos do Sistema Único de Saúde (SUS)
com medicamentos. Cerca de um terço dos recursos aplicados na política de
medicamentos pelo governo federal é destinado a esses medicamentos
considerados excepcionais. De acordo com dados do IMS health, o Ministério da
Saúde, o governo federal investiu R$ 2 bilhões para a aquisição de medicamentos
biotecnológicos no ano de 2011, e em 2012 MS gastou R$ 9,4 bilhões com
Entre 2011 e 2013, o total de financiamentos aprovados pelo BNDES para o
complexo industrial da saúde, denominação que abrange tanto a cadeia
farmacêutica como os fabricantes de equipamentos médicos — cresceu 275%. No
ano de 2013, foi aprovado R$ 1,47 bilhão para o setor. Desse total, R$ 1,22 bilhão
(83%) foi destinado a empreendimentos de biotecnologia. Como mostrado, foi
gerado um novo cenário para empresas nacionais trazendo a oportunidade de
investimentos nesse novo espaço de atuação, e consequentemente, estimular o
desenvolvimento do setor nacional de biotecnologia (VANZ et al, 2008; GOMES et
al, 2012).
Todo o medicamento não produzido no Brasil é importado pelo governo e está
inserido no Programa de Assistência Farmacêutica do SUS como medicamento
excepcional. Tais medicamentos possuem alto custo e são administrados para
doenças, geralmente raras, cujo tratamento deve ser continuado (ENCARNAÇÃO,
2005; MINISTÉRIO DA SAÚDE, 2009). Especificamente para o rhG-CSF, o
investimento do governo federal no período de janeiro de 2006 a agosto de 2007 foi
de R$ 4.807.489,78, e durante os anos de 2011 e 2012 o SUS gastou o equivalente
a R$ 2.487.355,20 com as importações deste medicamento (DATASUS 2013), isso
corresponde a 46% de todo o gasto do governo brasileiro com importação de
medicamentos. No entanto, o produto representa apenas 4% da variedade de
remédios adquiridos.
Foi demonstrado em um estudo que a implantação da produção da proteína
rhG-CSF no Brasil pode levar a uma diminuição de custos até cerca de 90% nos
valores pagos em compras governamentais, o que corrobora com a importância do
desenvolvimento da tecnologia para produção deste medicamento no Brasil
(ENCARNAÇÃO, 2005; MINISTÉRIO DA SAÚDE, 2009). Nesse contexto, fica
evidente a importância do desenvolvimento da tecnologia para obtenção da proteína
recombinante rhG-CSF, visando uma futura produção de produtos biotecnológicos
nacional, possibilitando ter uma indústria brasileira forte, inovadora e competitiva
7 CONCLUSÕES
• A estratégia de otimização de códons, em combinação com a síntese, do
gene correspondente a sequência da proteína rhG-CSF para expressão em
bactérias Escherichia coli demonstrou-se apropriada e evitou limitações para
o processo de expressão;
• A proteína rhG-CSF foi expressa em bactérias Escherichia coli da linhagem
BL21(DE3);
• A proteína rhG-CSF, fundida à cauda de seis histidina foi purificada por
cromatografia de afinidade em condição desnaturante;
• Foi possível verificar a identidade da proteína produzida por Western Blotting
e por espectrometria de massas.
• A produção da proteína na ausência da IPTG mostrou-se viável, o que pode
9 REFERÊNCIAS
BIBLIOGRÁFICAS
AKASHI, H. Synonymous codon usage in Drosophila melanogaster: natural selection and translational accuracy. Genetics, v.136, p. 927–935, 1994.
ALBERTS, B.; JOHNSON, A.; LEWIS, J.; et al. Biologia molecular da célula, 5.ed. Porto Alegre: Artmed, 2011.
ALTSCHUL, S. F.; THOMAS L. M.; ALEJANDRO A. S.; et al, Gapped BLAST and
PSI-BLAST: a new generation of protein database search programs. Nucleic Acids
Research, v.25, p.3389-3402, 1997.
ASANO S. The rationale for therapeutical use of recombinant human G-CSF. In:
Yamamura Y, ed. Recent progress in cytokine research. Tokyo: Medicine Review
Course, p. 135-150, 1988.
BABALOLA, C.; NIGHTINGALE, C.; NICOLAU, D.; Adjunctive efficacy of granulocyte colony stimulating factor on treatment of Pseudomona aeruginosa pneumonia in
neutropenic and non-neutropenic hosts. Journal of Antimicrobial Chemotherapy,
v. 53, n. 6, p.1098-100, 2004.
BANEYX, F.; MUJACIC, M. Recombinant protein folding and misfolding in Escherichia Coli. Nature Biotechnology, v.22, n. 11, p. 1399-408, 2004.
BARREDA, DR.; HANINGTON, PC.; BELOSEVIC, M.; Regulation of myeloid
development and function by colony stimulating factors. Developmental &
Comparative Immunology, v. 28, n. 5, p. 509-54, 2004.
BASSO, A. M. M.; GROSSI DE SÁ, M. F.; PELEGRINI, P. B. Biopharmaceutical and Biosimilar Products in Brazil: From Political To Biotechnological Overview. Journal of Bioequivalence & Bioavailability,v.5, p. 060-066, 2013.
BERLEC, A.; STRUKELJ, B. Current state and recent advances in biopharmaceutical production in Escherichia coli, yeasts and mammalian cells. Journal of Industrial Microbiology and Biotechnology, v. 40, n. 3, p. 257-74, 2013.
BONEBERG, E.; HARTUNG, T. Molecular aspects of anti-inflammatory action of G-CSF. Inflammation Research, v. 51, n. 3, p. 119-28, 2002.
BRASIL. Agência Nacional de Vigilância Sanitària. Resolução RE nº 1316, de 23 de Julho de 2002. Diário Oficial da União, 2002.
CHALMERS, J. J.; KIM, E.; TELFORD, J.N.; WONG, E. Y.; et al. Effect of
temperature on Escherichia Coli overproducing β-lactamase or human epidermal
growth factor. Applied and Environmental Microbiology, v. 56, n. 1, p.104-111,
1990.
CODEVILLA, C. F.; BARTH, T.; BRUM JÚNIOR, L.; FRONZA, M.; DALMORA, S. L. Biological potency evaluation and characterization of rhG-CSF in pharmaceutical
products. Revista Brasileira de Hematologia e Hemoterapia, v. 26, p. 104-108,
2004.
DATA SUS [Internet]. [cited 2013 Oct 1];Available from: www.datasus.gov.br
ENCARNAÇÃO, A.; ALMEIDA, C.; BRUM, P.; KARELE, S. Projeto de uma planta
para a produção de G-CSF recombinante. Rio de Janeiro (Brasil): Universidade
Federal do Rio de Janeiro, 2005.
EYRE-WALKER, A.; BULMER, M. Reduced synonymous substitution rate at the star of Enterobacterial genes. Nucleic Acids Research, v. 21, p. 4599-4603, 1993.
FRIEHS, K. Plasmid Copy Number and Plasmid Stability. Advances in Biochemical
Engineering Biotechnology, v.86, p.47–82, 2004.
GARCÍA-CARBONERO, R.; MAYORDOMO, J. I.; TORNAMIRA, M. V.; et al. Granulocyte colony-stimulating factor in the treatment of high-risk febrile neutropenia: a multicenter randomized trial. Journal of the National Cancer Institute, v. 93, n. 1, p. 31-38, 2001.
GOEDDEL, D. V. Systems for heterologous gene expression. Methods in
Enzymology, v. 185, p. 3-7, 1990.
GOMES, F. R.; MALUENDA, A. C.; TÁPIAS, J. O.; OLIVEIRA, F. L.; et al. Expression of recombinant human mutant granulocyte colony stimulating factor
(Nartograstim) in Escherichia coli. World Journal of Microbiology and
GOUGH, A.; CLAPPERTON, M.; ROLANDO, N.; et al. Randomised placebo-controlled trial of granulocyte colony-stimulating factor in diabétic foot infection. Lancet, v.350, n. 9081, p. 855-859, 1997.
GUTIERREZ, A.P.; MILLS, N.J.; SCHREIBER, S. J.; ELLIS, C. K. A physiologically based tritrophic perspective on bottom-up top-down regulation of populations. Ecology, v. 75, p. 2227-2242, 1994.
HAKI, G. D.; RAKSHIT, S. R. Developments in industrially important thermostable enzymes: a review. Bioresource Technology, v. 89, p. 17-34, 2003.
HALE, R. S., THOMPSON, G. Codon optimization of the gene encoding a domain from the human type 1 neurofibromin protein results in three fold improvement in expression level in Escherichia coli. Protein Expression and Purification, v. 12, p. 185–188, 1998.
HAMMERLING, U.; KROON, R.; SJÖDIN, L. In vitro bioassay with enhanced
sensitivity for human granulocyte colony-stimulating factor. Journal of
pharmaceutical and biomedical analysis,v. 13, n. 1, p. 9-20, 1995.
HANADA, T.; ONO, I. Disappearance of neutrophil ascillation in a child with cyclic neutropenia after treatment with recombinant human granulocyte colony-stimulating factor. European Journal of Haematology, v. 45, p. 181-182, 1990.
HANNING, G.; MAKRIDES, S. C. Strategies for optimizing heterologous protein expression in Escherichia coli”, Trends in Biotechnology, v.16, p.54-60, 1998,.
HARADA, M.; QIN, Y.;, TAKANO, H.; MINAMINO, T.; et al. G-CSF prevents cardiac remodeling after myocardial infarction by activating the Jack-Stat pathway in cardiomyocites. Nature Medicine, v. 11, n. 3, p. 305-311, 2005.
HARTUNG, T.; AULOCK, S.; VON, W. A. Role of granulocyte colony-stimulating factor in infection and inflammation. Medical Microbiology and Immunology, v.187, n. 2, p. 61–69, 1998.
HU, X.; SHI, Q.; YANG, T.; JACKOWSKI, G. Specific replacement of consecutive AGG codons results in high level expression of human cardiac troponin T in Escherichia coli. Protein Expression and Purification, v. 7, p. 289–293, 1996.
HÜBEL, K.; ENGERT, A. Clinical applications of granulocyte colony-stimulating
factor: a update and summary. Annals of Hematology, v. 82, n. 4, p. 207–213,
2003.
IKEMURA, T. Correlation between the abundance of Escherichia coli transfer RNAs and the occurrence of the respective codons in its protein genes: a proposal for a
synonymous codon choice that is optimal for the E. coli system. Journal of
Molecular Biology, v. 151, p. 389-409, 1981.
IKEMURA, T.; OZEKI, H. Codon usage and transfer RNA contents: organism specific codon choice patterns in reference to the isoacceptor contents. Cold Spring Harbor Symposia on Quantitative Biology, v. 47, p. 1087-1097, 1982.
IKEMURA, T. Codon usage and transfer-RNA content in unicellular and multicellular organisms. Molecular Biology and Evolution, v. 2, p. 13-34, 1985.
JANA, S.; DEB, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Applied Microbiology and Biotechnology, v. 67, n. 3, p. 289-98, 2005.
JANEWAY, C.; TRAVERS, P.; WALPORT, M.; SHLOMCHIK, M. Imunobiologia: o sistema imunológico na saúde e na doença. 4. ed. Porto Alegre: Artmed; 2000.
JEONG, K. J.; LEE, S. J. Secretory production of human granulocyte colony-stimulating factor in Escherichia coli. Protein Expression and Purification, v. 23, p. 311–318, 2001.
JEVSEVAR, S.; GABERC-POREKAR, V.;, FONDA, I.; et al. Production of nonclassical inclusion bodies from which correctly folded protein can be extracted. Biotechnology Progress, v. 21, n. 2, p. 632-639, 2005.
KOMASTU, Y., MATSUMOTO, T.; KUGA, T.; et al. (1987). cloning of granulocyte colony stimulating factor cDNA and its expression in Escherichia coli. Japanese Journal of Cancer Research, v. 78, p. 1179–1181, 1987.
KRISHNA D. V.; RAO, J. V.; NARASU, M. L.; et al. Optimization of the AT-content of codons immediately downstream of the initiation codon and evaluation of culture conditions for high-level expression of recombinant human G-CSF in Escherichia coli. Molecular Biotechnology, v. 38, p. 221–232, 2008.
KURITZKES, D.; PARENTI, D.; WARD, D.; et al. Filgrastim prevents severe neutropenia and reduces infective morbity in patients with advanced HIV infection: results of a randomized, multicenter, controlled trial. Aids, v. 12, p. 65-74, 1998.
LI, M.; FAN, H.; LIU, J.; WANG, M.; WANG, L.; et al. High pH solubilization and chromatography-based renaturation and purification of recombinant human granulocyte colony-stimulating factor from inclusion bodies. Applied Biochemistry and Biotechnology, v. 166, p. 1264–1274, 2012
LU, H. S.; BOONE, T. C.; SOUZA, L. M.; LAI, P. H.; Disulfide and secondary structure of recombinant human granulocyte colony-stimulating factor. Archives of Biochemistry and Biophysics, v. 268, n. 1, p. 81-92, 1989.
MAKRIDES, S. C. Strategies for Achieving High-Level Expression of Genes in Escherichia coli. Microbiological Reviews, v. 60, n. 3, p. 512–538, 1996.
MARSTON, F. A. The purification of eukaryotic polypeptides synthesized in Escherichia coli. Biochemical Journal, v. 240, p.1–12, 1986.
METCALF. D.; The molecular biology and functions of the granulocyte-macrophage colony stimulating factors. Blood, v. 67, n. 2, p. 257–267, 1986.
MINISTÉRIO DA SAÚDE [homepage on the Internet]. Disponível em: http:// portal.saude.gov.br/saude. [2009 out 20].
NAGATA, S.; TSUCHIYA, M.; ASANO, S.; et al. Molecular cloning and expression of cDNA for human granulocyte colony-stimulating factor. Nature, v. 5, n. 319, p. 415-418, 1986.
OH-EDA, M.; HASEGAWA, M.; HATTORI, K.; et al. O-linked sugar chain of human granulocyte colony-stimulating factor protects it againstpolymerization and denaturation allowing it to retain its biological activity. The Journal of Biological Chemistry, v. 265, n. 20, p. 11432–11435, 1990.
OHNO, R.; TOMONAGA, M.; KOBAYASHI, T.; et al. Effect of granulocyte colony-stimulating factor after intensive induction therapy in relapsed or refractory acute leukemia. The New England Journal of Medicine, v. 323, p. 871-877, 1991.
PAVLOV, A. R.; PAVLOVA, N. V.; KOZYAVKIN, S. A.; SLESAREV, A. I. Recent developments in the optimization of thermostable DNA polymerases for efficient applications. Trends in Biotechnology, v. 22, n. 5, p. 253-260, 2004.
PERRIÈRE, G.; GOUY, M.; GOJOBORI, T. NRSub: a non-redundant data base for the Bacillus subtilis genome. Nucleic Acids Research, v. 25, p. 5525-5529, 1994.
POGGE VON STRANDMANN, E.; ZOIDL, C.; NAKHEI, H.; et al. A highly specific and sensitive monoclonal antibody detecting histidine-tagged recombinant proteins. Protein Engineering, Design and Selection, v. 7, p. 733–735, 1995.
RAMOS, C. R.; ABREU, P. A.; NASCIMENTO, A. L.; et al. A high-copy T7 Escherichia coli expression vector for the production of recombinant proteins with a
minimal N-terminal His-tagged fusion peptide. Brazilian Journal of Medical and
Biological Research, v. 37, p. 1103-1109, 2004.
RAMYA, M.; SELVARAJAN, E. Purification of human recombinant granulocyte colony stimulating factor from Escherichia coli. African Journal of Biotechnology, v. 11, n. 50, p. 11104-11109, 2012.
SAMBROOK, J.; FRITSCH, E.; MANIATIS, T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harb Lab Press, p. 20−25, 1989.
SONG, J.A.; HAN, K.Y.; AHN, K.Y.; et al. Proteolysis and synthetic strategy of human
G-CSF in Escherichia coli BL21(DE3), Enzyme and Microbial Technology, v. 45,
p.7-14, 2009.
SHARP, P. M.; LI W. H. The codon adaptation index - a measure of directional
synonymous codon usage bias, and its potential applications. Nucleic Acids
SHUMAN, S. Novel Approach to Molecular Cloning and Polynucleotide Synthesis Using Vaccinia DNA Topoisomerase. The Journal of Biological Chemistry, v. 269, p. 32678-32684, 1994.
SILVA, M. Clonagem, Expressão e Purificação das Proteínas de superfície, PsaA e Fragmentos de PspA de Streptococcus pneunoniae. São Paulo, SP, 2005. Tese de doutorado em Ciências (Biotecnologia). USP/Instituto Butantan, SP.
SIMMERS, R. N.; WEBBER, L. M.; SHANNON, M. F.; et al. Localization of the G-CSF gene on chromosome 17 proximal to the breakpoint in the t(15;17) in acute promyelocytic leukemia. Blood, v. 70, n. 1, p. 330–332, 1987.
SONG, J. A.; HAN, K. Y.; PARK, J. S.; et al. Human G-CSF synthesis using stress-responsive bacterial proteins. FEMS Microbiology Letters, v. 296, p.60-66, 2009.
SOUZA, L. Production of pluripotent granulocyte colony-stimulating factor.1989. Patente US 4,810,643.
SOUZA, L. M.; BOONE, T. C.; GABRILOVE, J.; et al. Recombinant human granulocyte colony-stimulating factor: effects on normal and leukemic myeloid cells. Science, v. 232, n. 4746, p. 61-65, 1986.
SPADA, S.; WALSH, D. G. Directory of Approved Biopharmaceutical Products. CRC Press, 2005.
TERPE, K. Overview of bacterial expression systems for heterologous protein production: from molecular and biochemical fundamentals to commercial systems. Applied Microbiology and Biotechnology, v. 72, p. 211–223, 2006.
U.S. Food and Drug Administration [homepage on the Internet]. Disponível em: http:// www.accessdata.fda.gov.[2009 jul 06].
VALLEJO, L. F.; RINAS, U. Strategies for the recovery of active proteins through refolding of bacterial inclusion body proteins. Microbial Cell Factories, v. 3, p. 1-11, 2004.
VASINA, J.; BANEYX, F. Expression of aggregation-prone recombinant proteins at low temperature: a comparative study of the Escherichia coli cspA and tac promoter systems. Protein Expression and Purification, v. 9, p. 211-218, 1997.
WALSH, G. Biopharmaceuticals: biochemistry and biotechnology. Hoboken, N.J.: John Wiley & Sons, 2nd edition. New York: Wiley, 2003.
WANG, W.; Instability, stabilization, and formulation of liquid protein pharmaceuticals. International Journal of Pharmaceutics. v. 185, n. 2, p.129-188, 1999.
WITTMAN, B.; HORAN, J.; LYMAN, G. H. Prophylactic colony-stimulating factor in children receiving myelosupressive chemotherapy: a meta-analysis of randomized controlled trials. Cancer Treatment Reviews, v. 32, n.4, p. 289-303, 2006.
YANG, Z.; ZHANG, L.; ZHANG, Y.; et al. Highly Efficient Production of Soluble Proteins from Insoluble Inclusion Bodies by a Two-Step-Denaturing and Refolding Method. PLoS ONE 6(7): e22981. 2011
ZAGO, M.; FALCÃO, R.; PASQUINI, R. Hematologia: fundamentos e prática. São Paulo: Atheneu, 2001.
ZAHA, A.; FERREIRA, H. B.; PASSAGLIA, L. M. P. Biologia Molecular Básica. 2nd Edição. Porto Alegre, p. 75-87, 2003.