HELIENE GONÇALVES ALVARENGA
Identificar e isolar células reticulares fibroblásticas em
linfonodos humanos
Dissertação apresentada à Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Mestre em Ciências
Programa de Alergia e Imunopatologia Orientadora: Dra. Luciana Cavalheiro Marti
SÃO PAULO
HELIENE GONÇALVES ALVARENGA
Identificar e isolar células reticulares fibroblásticas em
linfonodos humanos
Dissertação apresentada à Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Mestre em Ciências
Programa de Alergia e Imunopatologia Orientadora: Dra. Luciana Cavalheiro Marti
Versão corrigida
(Versão original disponível na Faculdade de Medicina)
SÃO PAULO
Dados Internacionais de Catalogação na Publicação (CIP)
Preparada pela Biblioteca da
Faculdade de Medicina da Universidade de São Paulo
reprodução autorizada pelo autor
Alvarenga, Heliene Gonçalves
Identificar e isolar células reticulares fibroblásticas em linfonodos humanos / Heliene Gonçalves Alvarenga. -- São Paulo, 2015.
Dissertação(mestrado)--Faculdade de Medicina da Universidade de São Paulo. Programa de Alergia e Imunopatologia.
Orientadora: Luciana Cavalheiro Marti.
Descritores: 1.Linfonodos 2. Células estromais 3.Células estromais mesenquimais 4.Célula reticular fibroblástica
LISTA DE FIGURAS
Figura 1 - Estrutura do linfonodo
Figura 2 - Homeostase celular do linfonodo e subtipos de FRCs segundo sua localização
Figura 3 - Principais mecanismos de ação das FRCs na ativação da resposta imune e na
tolerância periférica
Figura 4 - Análise anatomopatológica e histoquímica de linfonodos (LNs) humanos
Figura 5 - Expressão de gp38 na zona de células T
Figura 6 - Perfil de expressão fenotípica das células isoladas a partir de linfonodos
humanos
Figura 7 - Expressão de gp38 em células isoladas a partir de linfonodos humanos
Figura 8 - Separação física de FRCs e DNCs (Cell Sorting) proveniente de linfonodos
humanos
Figura 9 - Diferenciação de FRCs e DNCs em condrócito, adipócito e osteócito
Figura 10 - Proliferação de linfócitos alogênicos após co-cultivo com FRCs e DNCs
Figura 11 - Expressão do receptor de quimiocina CCR7 nos linfócitos alogênicos após
co-cultivo com FRCs e DNCs
Figura 12 - Expressão do receptor de quimiocina CXCR4 nos linfócitos alogênicos
após co-cultivo com FRCs e DNCs
Figura 13 - Expressão do receptor de quimiocina CCR5 nos linfócitos alogênicos após
co-cultivo com FRCs e DNCs
Figura 14 - Expressão do receptor de quimiocina CCR6 nos linfócitos alogênicos após
LISTA DE TABELAS
Tabela 1 - Característica amostral
Tabela 2 - Painel utilizado na identificação e caracterização das FRCs
Tabela 3 - Painel utilizado na identificação, caracterização e avaliação de moléculas de
homing em linfócitos
LISTA DE ABREVIATURAS
AIRE Gene regulador de autoimunidade (do inglês, Autoimmune regulator gene)
Ang Angiomotina (do inglês, Angiomotin)
APC Célula apresentadora de antígeno (do inglês, Antigen-presenting cell)
BEC Célula endotelial sanguínea (do inglês, Blood endothelial cell)
CLEC-2 Receptor de lecitina do tipo C (do inglês, C-type lectin-like receptor 2)
COX Cicloxigenase (do inglês, Cyclooxygenase)
CTM Células-tronco mesenquimais (do inglês, Mesenchymal stem cells)
DC Células dendríticas (do inglês, Dendritic cells)
DEAF1 Fator auto-regulatório epidérmico deformado (do inglês, Deformed
epidermal autoregulatory fator 1)
DF1-VAR1 DF1 variante proveniente de um splicing alternativo (do inglês, Alternatively
spliced variant in DF1)
DNC Células estromais duplo negativas para gp38 e CD31 (do inglês,
Double-negative cells)
EAE Experimental encefalomielite autoimune (do inglês, Experimental
autoimmune encephalomyelitis)
ECM Componentes da matriz extracelular (do inglês, Extracellular components
matriz)
EMT Transição epitélio-mesenquima (do inglês, Epithelial-mesenchymal
transition)
FDC Células dendríticas foliculares (do inglês, Follicular dendritic cells)
FMO Fluorescência menos uma (do inglês, Fluorescence minus one)
FRC Célula reticular fibroblástica, (do inglês, Fibroblastic reticular cells)
FRC-DN FRC duplo-negativo para PDGFRα e CD141
FRC-DP FRC duplo-positivo para PDGFRα e CD141
HBSS Solução balanceada de Hank (do inglês, Hank's balanced salt solution)
HE Hematoxilina e eosina
HEV Vênula do endotélio alto (do inglês, High vein endotelial)
HGF Fator de crescimento de hepatócitos (do inglês, Hepatocyte growth factor)
IDO Indolamina 2-3 desoxigenase (do inglês, Indoleamine 2, 3-dioxygenase)
IL1Rap Proteína acessória do receptor de IL1 (do inglês, IL1 Receptor accessory
protein)
iNOS Óxido nítrico sintase induzível (do inglês, Inducible nitric oxide synthase)
JAM-C Molécula de adesão juncional (do inglês, Junctional adhesion molecule)
Kb Kilobase
LEC Célula endotelial linfática (do inglês, Lymphatic endothelial cell)
LIF Fator inibidor de leucemia (do inglês, Leukemia inhibitory fator)
LN Linfonodo ou nódulo linfático (do inglês, Lymph node)
MALT Tecidos linfóides associado à mucosas (do inglês, Mucosa-associated
lymphoid tissue)
Mc1 Meio de cultura celular
Mc2 Meio de congelamento celular
MHC Complexo principal de histocompatibilidade (do inglês, Major
histocompatibility complex)
MIX Solução enzimática
MRC Células reticulares marginais (do inglês, Marginal reticular cells)
NK Natural-killers
NO Óxido nítrico (do inglês, Nitric oxide)
OLS Órgãos linfóides secundários
P Passagem celular
p75NGFR Receptor do fator de crescimento neural p75 (do inglês, p75 Nerve growth
factor receptor)
PBS Tampão fosfato-salino (do inglês, Phosphate buffered saline)
PDGFRα Receptor do fator de crescimento derivado de plaqueta (do inglês,
Platelet-derived growth factor receptor)
PD-L Ligante de morte programada (do inglês, Programmed death-ligand)
PDPN Podoplanina (do inglês, Podoplanin)
PGE Prostaglandina E2 (do inglês, Prostaglandin E2)
PTA Antígenos de tecidos periféricos (do inglês, Peripheral tissues antigens)
SCF Fator de células-tronco (do inglês, Stem-cell fator)
SCS Seio subcapsular (do inglês, Subcapsular sinus)
SP Sangue periférico
TGF Fator de crescimento transformante (do inglês, Transforming growth fator)
TH Células T auxiliares (do inglês, T helper cells)
TLR Receptor semelhante ao Toll (do inglês, Toll like receptor)
TLT Tecidos linfoides terciários
TNF Fator de necrose tumoral (do inglês, Tumor Necrosis Fator)
TRCs FRC da zona de células T
Treg Células T reguladoras (do inglês, Regulatory T cells)
TTG Transglutaminase tecidual (do inglês, Tissue transglutaminase)
VEGF Fator de crescimento endotelial vascular (do inglês, Vascular Endothelial
LISTA DE SÍMBOLOS
µg Micrograma
µL Microlitro C Grau Célsius
cm Centímetro
g Força Centrifuga Relativa
mL Mililitros
RESUMO
Alvarenga HG. Identificar e isolar células reticulares fibroblásticas em linfonodos humanos [Dissertação]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2015.
Células reticulares fibroblásticas (FRCs, gp38+ e CD31-) e células duplo negativas
(DNCs, gp38- e CD31-) são células estromais encontradas em órgãos linfoides
secundários, como linfonodos. Enquanto as FRCs têm sido amplamente estudadas, pouco
se sabe ainda sobre DNCs. Apesar da função estrutural das FRCs nos linfonodos já estar
bem estabelecida, estudos recentes indicam que as FRCs também desempenham um papel
fundamental em processos imunológicos, por exemplo, migração celular, ativação e
qualidade da resposta imune, além da participação na tolerância periférica. Outra célula
estromal em constante estudo são as células-tronco mesenquimais (CTMs),
principalmente encontradas na medula óssea. FRCs e CTMs compartilham similaridades,
como por exemplo: são células estromais encontradas em órgãos linfoides, apresentam
morfologia e características semelhantes quando cultivadas in vitro e têm participação na
resposta imune por mecanismos semelhantes. As CTMs são provenientes de um órgão
linfoide primário, cuja função principal não está diretamente relacionada à resposta
imunológica, entretanto, de acordo com inúmeros trabalhos, estas células possuem
capacidade de interferir na ativação de várias células do sistema imunológico. Nossa
hipótese é de que as FRCs e DNCs, que se encontram em um órgão linfoide secundário,
cuja função principal remete a resposta imunológica, apresentem também um papel
regulador, descrito na literatura como tolerância periférica e contração de uma resposta
imunológica já estabelecida. Em nosso estudo mostramos que FRCs e DNCs foram
isoladas a partir de linfonodos humanos e devidamente caraterizadas. Esclarecemos que
FRCs e DNCs atendem todos os critérios mínimos propostos pela sociedade internacional
de terapia celular para serem consideradas células-tronco estromais. Além disso,
mostramos que FRCs e DNCs influenciam a proliferação in vitro de linfócitos alogênicos
e a expressão de moléculas de homing como CXCR4 e CCR6 por estas células. Portanto,
contribuímos de forma inédita para o entendimento funcional das FRCs e DNCs, visto
que estudos em humanos envolvendo estas células são escassos.
Descritores: 1.Linfonodos 2.Células sstromais 3.Células estromais mesenquimais
ABSTRACT
Alvarenga HG. Identify and isolate fibroblastic reticular cells in human lymph nodes [Dissertation]. São Paulo: “Faculdade de Medicina, Universidade de São Paulo”; 2015.
Fibroblastic reticular cells (FRCs, gp38+ e CD31-) and double-negative cells (DNCs,
gp38- e CD31-) are stromal cells found in secondary lymphoid organs, such as lymph
nodes. While the FRCs have been widely studied, little is known about DNCs. Although
the structural function of FRCs in lymph nodes is well established, recent studies indicate
that FRCs also play a key role in several immunological processes, beyond their
involvement in peripheral tolerance, for example: cell migration and active and
differatiation of de immune response . Another stromal cell population under much
investigation comprise mesenchymal stem cells (MSCs), mainly found in the bone
marrow. These cells share similarities with FRCs and DNCs, for example: they are
estromal cells found in lymphoid organs, they develop similar morphology and
characteristics when cultured in vitro and they participate in the immune response sharing
similar mechanisms. MSCs are derived from a primary lymphoid organ which the major
function is not diretly related to immune response, but numerous studies have shown that
these cells can interfere in the activation of various cells of the immune system. Our
hypothesis is that FRCs and DNCs, mainly found in secondary lymphoid organs, have
immune regulatory roles on the mecanisms determineds peripheral tolerance and
contraction of the immune response. In our study we show the isolation of FRCs and
DNCs from human lymph nodes and their phenotypic characterization. We confirmed
that FRCs and DNCs meet all minimum criteria proposed by the International Society of
Cell Therapy to be considerated as stromal stem cells. Furthermore, we show that FRCs
e DNCS influence the in vitro proliferation of the allogeneic lymphocytes and the homing
molecules expression, such as CXCR4 and CCR6 on these cells. Therefore, we
contributed in an unpublished manner to the functional understanding of FRCs and
DNCs, since human studies involving these cells are scarce.
Keywords: 1.Lymph nodes 2.Stromal cells 3.Mesenchymal stromal cells 4.Fibroblastic
SUMÁRIO
LISTA DE FIGURAS
LISTA DE TABELAS
LISTA DE ABREVIATURAS
LISTA DE SÍMBOLOS
RESUMO
ABSTRACT
SUMÁRIO
INTRODUÇÃO ... 1
1.1 Órgãos linfoides secundários ... 1
1.2 Estrutura e composição celular dos linfonodos ... 1
1.3 Célula Reticular Fibroblástica ... 3
1.3.1 Expressão de gp38 como marcador de população de células reticulares fibroblásticas ... 4
1.3.2 Diversidade Fenotípica ... 5
1.3.3 Diversidade Funcional ... 9
1.3.3.1 Ativação da resposta imune ... 9
1.3.3.2 Tolerância periférica ... 12
1.4 Células reticulares fibroblásticas e células-tronco mesenquimais ... 15
1.5 Células-tronco mesenquimais ... 15
1.5.1 Imunomodulação ... 16
2 HIPÓTESE GERAL ... 20
3 JUSTIFICATIVA ... 20
4 OBJETIVOS ... 20
4.1 Geral ... 20
4.2 Específicos ... 21
5 MATERIAIS E MÉTODOS ... 21
5.1 Características amostral... 21
5.2 Análise anatomopatológica e histoquímica ... 21
5.3 Obtenção de células estromais e linfócitos a partir de linfonodos humanos ... 22
5.4 Cultivo celular ... 23
5.5 Obtenção de linfócitos alogênicos a partir de sangue periférico ... 24
5.6 Obtenção, cultivo e caracterização de CTMs ... 24
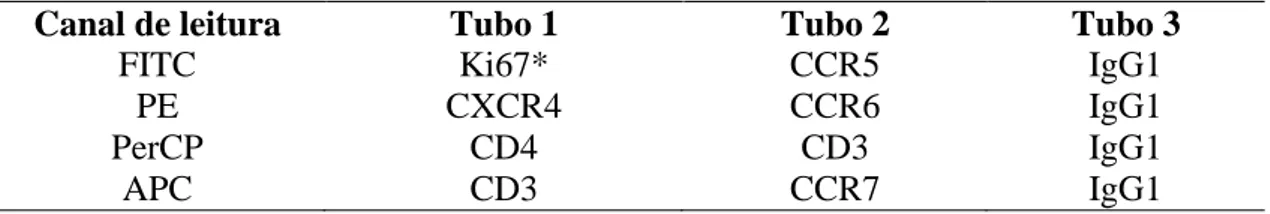
5.8 Caracterização imunofenotípica de FRCs, DNCs e linfócitos por citometria de fluxo ... 25
5.9 Separação celular... 27
5.10 Diferenciação em três linhagens mesodérmicas ... 27
5.10.1 Diferenciação adipogênica ... 27
5.10.2 Diferenciação osteogênica ... 28
5.10.3 Diferenciação condrogênica ... 28
5.11 Métodos de coloração histoquímica ... 29
5.11.1 Oil-red ... 29
5.11.2 Alizarin-red ... 29
5.11.3 Toluidene-blue ... 29
5.12 Análises de FACs ... 29
5.13 Análise estatística ... 30
6 RESULTADOS ... 30
6.1 A análise anatomopatológica e imunohistoquimica dos linfonodos evidenciou sua morfologia e integridade ... 30
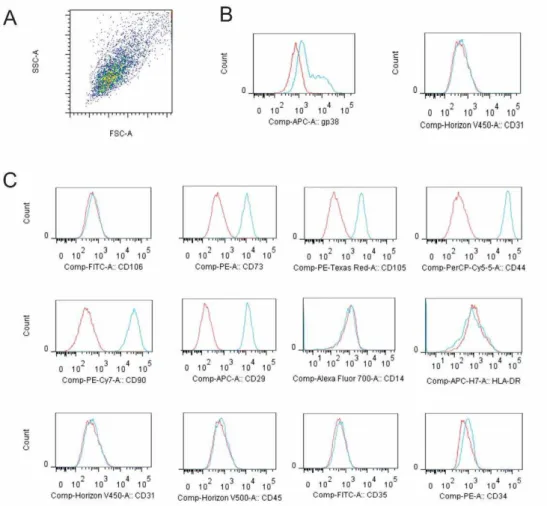
6.2 Células estromais isoladas de linfonodos humanos assemelharam-se imunofenotípicamente às CTMs ... 33
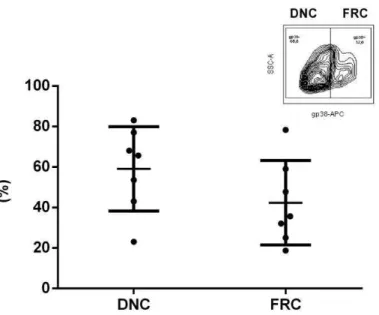
6.3 As células estromais isoladas a partir de linfonodos humanos são FRCs e DNCs ... 34
6.4 Separação das FRCs e DNCs por cell sorting ... 34
6.5 FRCs e DNCs são capazes de se diferenciar em populações de origem mesodérmica: adipócito, osteócito e condrócito ... 35
6.6 Influência das FRCs e DNCs na proliferação e expressão das moléculas de homing em linfócitos alogênicos (Ensaio funcional) ... 37
6.6.1 A presença de FRC e DNC diminui a proliferação de linfócitos alogênicos provenientes do linfonodo ... 37
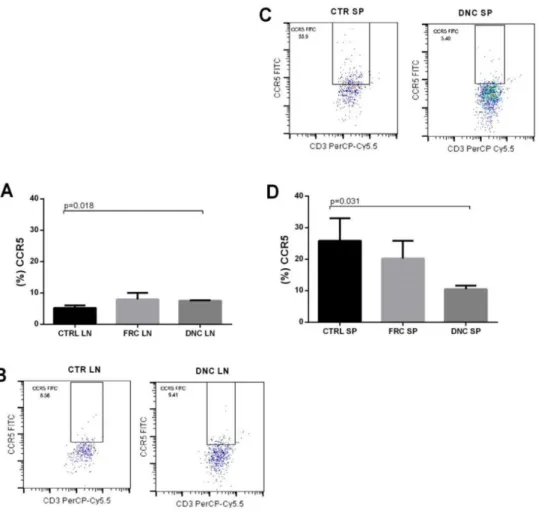
6.6.2 FRCs e DNCs alteram a expressão das moléculas de homing nos linfócitos alogênicos ... 38
7 DISCUSSÃO ... 43
8 CONCLUSÃO ... 48
9 ANEXO ... 48
9.1 CARACTERIZAÇÃO DAS FRCS SEGUNDO OS MARCADORES, QUIMIOCINAS E CITOCINAS SECRETADAS ... 48
10 REFERÊNCIAS BIBLIOGRÁFICAS ... 51
1
INTRODUÇÃO
1.1 Órgãos linfoides secundários
Órgãos linfoides secundários (OLS) são responsáveis por favorecer as interações
celulares necessárias para o início da resposta imunológica. Os OLS compreendem o
baço, os linfonodos (do inglês Lymph Node, LN) e os tecidos linfoides associados as
mucosas digestiva, respiratória e urinária (MALT), como as placas de Peyer e as tonsilas.
Tecidos linfoides terciários (TLT), são sítios anatômicos que, em circustâncias normais,
contêm poucos linfócitos, mas quando estimulados podem ser tomados por estas células,
embora apresentam características e organização celular diferente a dos OLS. O LN é o
órgão que recebe fluidos extracelulares (linfa ou liquido linfático) através dos vasos
linfáticos que drenam todos os tecidos e órgãos do organismo. O LN é envolto por uma
cápsula de revestimento formado por tecido conjuntivo e abaixo dela está localizado o
seio subcapsular (do inglês Sinus Subcapsular, SCS) onde os vasos linfáticos terminam
trazendo a linfa. Esta transporta moléculas, antígenos, microrganismos, linfócitos e
células apresentadoras de antígeno (do inglês Antigen-presenting cell, APCs) dos tecidos,
órgãos e/ou de outros LNs.
Os LNs exercem três funções principais. A primeira delas é a captação de
moléculas, debris celulares e microorganismos, por exemplo, células dendríticas (do
inglês Dendritic Cells, DCs) no LN fagocitam potenciais patógenos e produzem
mediadores imunes inatos como o interferon (IFN) do tipo I, outras citocinas e radicais
derivados do oxigênio e nitrogênio e ativam a imunidade inata. Estes mecanismos de
resposta imune rápida reduzem o número de patógenos enquanto a resposta imune
adaptativa se desenvolve. A segunda função dos LNs é proporcionar o encontro entre as
DCs que estão apresentando determinados antígenos e os respectivos linfócitos
antígeno-específicos. Por último, nos LNs são produzidos fatores de sobrevivência e de
diferenciação de linfócitos (Junt et al, 2008). Os LNs têm uma estrutura de sustenção de
fibras, principalmente de colágenos, que se dispõem em trabéculas ou malha solta sobre
a qual se dispõe e movimentam as células.
1.2 Estrutura e composição celular dos linfonodos
Há nos LNs além das células do sistema imune, uma variedade de células
2 ambientes especializados para responder aos desafios antigênicos em diferentes
momentos da reposta imune.
O LN pode ser dividido em três regiões. Região cortical, que inclui o SCS – onde
estão principalmente localizadas as DCs, o seio peritrabecular e os folículos linfoides,
também conhecidos como zona de predominância de linfócitos B. Nos folículos são
encontradas as células dendríticas foliculares (do inglês Follicular Dendritic Cells,
FDCs) que constituem uma população de DCs com características próprias. Região
paracortical, com grande densidade de linfócitos e predominância de linfócitos T situa-se
ao lados dos folículos. Região medular, onde os linfócitos e plasmócitos formam os
cordões medulares, observa-se os seios medulares linfáticos e encontram-se presentes os
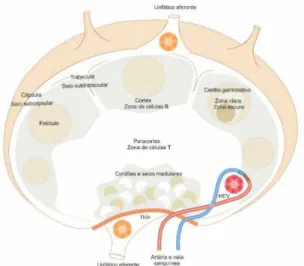
vasos linfático e sanguíneo (Figura 1).
Na zona de células B, além dos linfócitos B e de algumas células T, estão presentes
as FDCs, as quais produzem a quimiocina CXCL13, que atrai para os folículos os
linfócitos B que expressam CXCR5. Além disso, as FDCs podem estar envolvidas na
homeostase, ativação e diferenciação de linfócitos B (Muller e Germain, 2009).
Na região paracortical, se localiza a zona de predomínio de células T que é rica
em APCs. Na zona de células T, além das APCs e linfócitos T, encontramos as células
reticulares fibroblásticas (do inglês Fibroblastic Reticular Cells, FRCs), as quais formam
canais condutores que se estendem por toda a zona de células T, desde o SCS até as
vênulas do endotélio alto (do inglês High Endotelial Venule, HEV). Os canais condutores
apresentam uma porção exterior formada pelas FRCs, e uma porção interna onde se
encontram as fibras de colágeno e proteínas da matriz extracelular, as quais são
produzidas pelas FRCs (Junt et al, 2008). Este canal é capaz de transportar proteínas de
baixo peso molecular em seu interior (Crivellato e Mallardi, 1997; Junt et al, 2008). As
FRCs também regulam a migração e a sobrevivência de células T, por meio da produção
de CCL19, CCL21 e IL7. Células T virgens e DC maduras que expressam CCR7 são
atraídas pelas quimiocinas CCL19 e CCL21 contribuindo para a delimitação da zona de
células T (Junt et al, 2008).
Entre o SCS e a zona de células B, são encontradas as células reticulares marginais
(do inglês Marginal Reticular Cells, MRC), que também formam uma rede capaz de
entregar antígenos a partir do SCS para os linfócitos B foliculares, participando da captura
e distribuição de antígenos. Além de estruturar um canal funcional, as MRCs também são
3 As células endoteliais também fazem parte deste microambiente, e podem ser
identificadas como células endoteliais linfáticas (do inglês Lymphatic Endothelial Cell,
LEC) e as células endoteliais sanguíneas (do inglês Blood Endothelial Cell, BEC) (Muller
e Germain, 2009). As LECs estão presentes no interior dos vasos linfáticos e as BECs são
encontradas no interior de vasos sanguíneos. Ambos os tipos celulares são indispensáveis
para a constante recirculação de linfócitos em SLOs (Junt et al, 2008; Luther et al, 2011).
A disposição celular encontrada no LN é favorável à resposta imune. Antígenos
livres ou APCs, após a fagocitose de antígenos, são carreados e/ou migram aos LNs pelos
vasos linfáticos. A linfa chega ao LN pelo vaso aferente e é liberada na região cortical.
Ao entrar no LN, a linfa se espalha pelo SCS e atinge a zona de células B e T, onde os
antígenos livres são capturados por APCs residentes e ocorre o encontro dos linfócitos e
das APCs que apresentam antígeno-específico (Junt et al, 2008). Já os linfócitos oriundos
do sangue periférico (SP) entram no interior do LN passando pelas HEV na região
medular (Muller e Germain, 2009). A migração celular e o tempo em que os linfócitos
permanecem no LN são determinados por moléculas responsáveis pela retenção destas
células no órgão e por quimiocinas produzidas principalmente por FRC e FDC, formando
microambientes adequados e proporcionando, de forma homeostática, a ativação e a
diferenciação de células essenciais para a resposta imune.
Figura 1. Estrutura do linfonodo. Representação esquemática dos principais componentes estruturais do
linfonodo.
1.3 Célula Reticular Fibroblástica
Apesar da função estrutural das FRCs nos LNs já estar bem estabelecida, estudos
4 processos imunológicos, por exemplo, migração celular, ativação e qualidade da resposta
imune, além da participação na tolerância periférica (Sobocinski, 2010; Siegert et al,
2011; Onder et al, 2012). Múltiplas funções e uma variedade de características
imunofenotípicas das FRCs são descritas. Porém, uma associação clara entre função e
fenótipo não foi ainda relatada. Marcadores clássicos, como a expressão de gp38 e
ausência de CD31 são bem descritos em camundongos; no entanto, vários outros
marcadores foram descritos para as FRCs nos últimos anos tanto em camundongos como
em humanos, permitindo classificá-las em diversos subtipos.
1.3.1 Expressão de gp38 como marcador de população de células reticulares
fibroblásticas
Podoplanina (PDPN) é uma proteína transmembrana do tipo mucina (Astarita et
al, 2012; Wicki e Christofori, 2006) cujas funções incluem a participação no
desenvolvimento de alguns órgãos, motilidade celular, tumorogênese e metástase. A
síntese desta proteína é controlada pelo gene PDPN, constituído por 34,2 kilobases (Kb)
e 8 éxons (Raica et al, 2008). PDPN é o nome comumente utilizado, porém vários grupos, em momentos distintos, descreveram genes ortólogos ou idênticos como: TIα, hTIα-2, randam-2, E11, OTS8, Aggrus, gp36 (Vanderbilt et al, 2008), gp38 (Farr et al, 1992),
gp40 (Zimmer et al, 1997), PA2.26 (Gandarillas et al, 1997), RTI40 (Gonzalez e Dobbs,
1998) e nesse trabalho utilizaremos a nomenclatura de gp38. Este gene foi descrito por
diversos autores como sendo expresso em FRCs (revisado em Alvarenga e Marti, 2014).
A presença de gp38 em FRC foi inicialmente descrita por Farr et al em 1992.
Desde então, diversos estudos adotaram a gp38 para a classificação e identificação das
FRCs em conjunto com a exclusão de CD31, auxiliando na distinção das FRCs de outros
tipos celulares que expressam o gp38, como as LECs.
A participação da gp38 no desenvolvimento de órgãos pode ser variável. Nos rins,
a gp38 é expressa em células epiteliais do glomérulo, conhecidas como podócitos, e
parece ser essencial para a filtração glomerular (Ijelaar et al, 2008; Navarro-Núñez et al,
2013). No sistema nervoso central a gp38 é necessária para a formação correta do plexo
coroide e é altamente expressa em tumores cerebrais (Astarita et al, 2012; Navarro-Núñez
et al, 2013).
No coração, a gp38 é necessária para o desenvolvimento normal, especialmente
5 A gp38 também participa no desenvolvimento pulmonar e maturação efetiva das células
epiteliais alveolares do tipo I. No intestino não há ainda uma função específica
determinada, porém a gp38 é expressa na lamina própria. Em órgãos linfoides, é
necessária para a formação e organização adequada, principalmente na arquitetura
vascular linfática e indução da migração de DC nos LNs. Além disso, a gp38 está
altamente expressa no estroma de OLS e em tecidos linfoides ectópicos (Astarita et al,
2012).
Nos OLS está bem estabelecida a expressão da gp38 nas LECs, FRCs e FDC. A
expressão da gp38 também foi descrita em células T auxiliares 17 (do inglês T helper,
Th) que são as células com grande potencial inflamatório, mas também atuam na
formação de centros germinativos (Astarita et al, 2012; Navarro-Núñez et al, 2013). Há
expressão de gp38 em subtipos de macrófagos, além dessa proteína também participar de
mecanismos de agregação plaquetária (Astarita et al, 2012).
O ligante da gp38 é o receptor de lecitina do tipo C (CLEC-2), expresso
principalmente em plaquetas e DCs, mas também pode estar presente em neutrófilos,
células T, macrófagos (Astarita et al, 2012), monócitos, células natural-killer (NK)
(Navarro-Núñez et al, 2013) e linfócitos B (Acton et al, 2012; Navarro-Núñez et al,
2013). Nas DCs, a ligação gp38/CLEC-2, promove a motilidade das DCs, que saem dos
sítios periféricos e migram até a zona de células T no LN (Astarita et al, 2012). Em células
mielóides, a sinalização de CLEC-2 pelo seu ligante parece aumentar a produção de IL10,
sugerindo sua participação no término da inflamação (Navarro-Núñez et al, 2013).
Em câncer, a gp38 tem sido amplamente estudada e a sua expressão foi
correlacionada com o aumento da linfangiogênese, a presença de metástase e
consequentemente com o mau prognóstico. Esta molécula pode estar super expressa em
vários tipos tumorais e parece aumentar a atividade das Rho GTPases. Entretanto, o
mecanismo exato da sua ação não está completamente elucidado (Astarita et al, 2012,
Raica et al, 2008; Navarro-Núñez et al, 2013; Wicki e Christofori, 2006).
1.3.2 Diversidade Fenotípica
No LN as FRC podem ser fusiformes, estreladas ou altamente alongadas
dependendo da sua localização (Clark, 1962). Estas células são encontradas nas regiões
cortical e medular do LN e podem estar em contato umas com as outras e com vários
6 foliculares (Clark, 1962; Crivellato e Mallardi, 1997). Além da variação morfológica, as
FRC podem apresentar características fenotípicas distintas de acordo com a posição que
ocupam neste órgão (Crivellato e Mallardi, 1997).
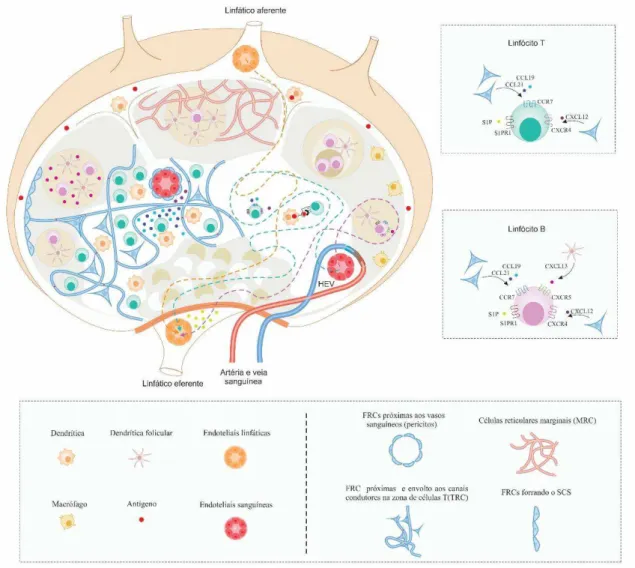
Link e colaboradores e colaboradores (2007) descreveram quatro subtipos de
FRCs em LNs de roedores, segundo sua localização: as FRC presentes na zona de células
T (TRCs), próximas aos canais condutores e envolta a esses canais, FRCs forrando o SCS
e FRCs próximas aos vasos sanguíneos (pericitos). Adicionalmente, existe ainda outro
subtipo de FRC localizado logo abaixo da cápsula do LN, as MRCs. Diferente das FRCs,
as MRCs expressam CXCL13, MAdCAM-1 e altos níveis de RANK-L (Mueller e
Germain, 2009; Luther et al, 2011; Hess et al, 2012) (Figura 2).
Figura 2. Homeostase celular do linfonodo e subtipos de FRCs segundo sua localização: FRC próximas
7 Em áreas corticais, as FRCs estão associadas ao SCS, de acordo com o seu papel
funcional nesta região. As FRCs corticais são polarizadas, apresentando um polo
receptivo que recolhe moléculas solúveis (antígenos, citocinas, neuropeptídios, lipídeos,
produtos microbianos) do lúmen do SCS e um polo de entrega que fica em contato com
linfócitos e outras células não linfoides ao longo das HEVs localizadas no parênquima
cortical (Anderson e Shaw, 1993; Crivellato e Mallardi, 1997).
Somente a expressão da gp38 não é suficiente para identificar as FRC murinas,
pois este marcador também é expresso por FDCs e LECs. LECs são diferenciadas pela
expressão de CD21, CD31 e LYVE-1; já as FDCs se diferem das FRCs pela sua
localização e expressão de CD21, CD35, C4 (FDC-M2) e BP-3, Mfge8 (FDC-M1),
CD16, CD23, CD32. Porém, as FRCs e FDCs podem se assemelhar na expressão dos
marcadores, CD54, CD106 e CD157 (Link et al, 2011; Luther et al, 2011; Sierget et al,
2011; Mueller e Germain, 2009).
A identificação das FRCs murinas é feita com base em um conjunto de
marcadores, alguns expressos por estas células e outros que auxiliam na exclusão de
outros tipos celulares. FRCs murinas são classicamente caracterizadas pela expressão de
gp38 e ausência de CD31, bem como pela secreção das quimiocinas CCL19, CCL21 e da
citocina IL7. Porém, na última década vários estudos identificaram marcadores adicionais
para estas células presentes em LNs de diferentes espécies (Anexo 1).
Além dos subtipos de FRC classificados segundo sua localização, outros dois
marcadores capazes de subclassificar as FRCs foram descritos em primatas, o receptor do
fator de crescimento neural p75 (do inglês Nerve Growth Factor Receptor, p75NGFR) e
a transglutaminase tecidual (do inglês Tissue Transglutaminase, TTG). FRCs são
positivas para p75NGFR, um membro da família do receptor de fator de necrose tumoral
(do inglês Tumor Necrosis Fator, TNF), e todas as subpopulações de FRCs descritas
segundo sua localização são positivas para TTG, uma enzima envolvida em vários
processos fisiológicos e patológicos, como apoptose de linfócitos e outros tipos celulares,
e ativação de citocinas pró-inflamatórias (Steele et al, 2009). Embora a expressão TTG
represente um marcador de subtipos de FRCs classificados segundo sua localização, a
expressão de p75NGFR não foi reportada em um subtipo específico.
Thomazy et al (2003) utilizaram a identificação da expressão de TTG em FRCs,
que previamente havia sido descrita como FRCs capazes de induzir a produção de
8 normais em comparação aos neoplásicos. Existem algumas condições em que a rede de
FRC fica aberta, permitindo a alta circulação de células e solutos ao redor do folículo,
sendo este estado correlacionado com o pico de reações no centro germinativo e aumento
da expressão de TTG. Em outras situações esta rede fica fechada limitando a migração de
células do SCS, e a expressão de TTG permanece restrita às células do SCS. O padrão de
TTG encontrado no estroma de diferentes tipos de linfoma sugere que ocorre alteração
destes padrões dinâmicos na maioria dos tipos tumorais.
Frontera et al (2011) descreveram que as FRCs expressam a molécula de adesão
juncional (do inglês Junctional Adhesion Molecule, JAM-C), receptor do fator de
crescimento derivado de plaqueta (do inglês Platelet-derived Growth Factor Receptor, PDGFRα) e trombomodulina (CD141). A expressão destas moléculas pode subdividir as FRCs em três subtipos com distinta capacidade secretória das quimiocinas CCL19,
CCL21 e do fator de célula estromal (do inglês stromal cell-derived fator,
SDF)/CXCL12: uma subpopulação mais escassa de células que expressa níveis intermediários de PDGFRα e CD141, e dois subtipos com maior número de célula denominada FRC duplo-negativo (FRC-DN) ou FRC duplo-positivo (FRC-DP) para
ambos os marcadores. A expressão de JAM-C é restrita às FRCs-DP e está associada à
secreção das quimiocinas CCL19, CCL21 e CXCL12. Desta forma, um papel funcional
diferenciado pode ser atribuído ao subtipo FRC-DP, devido à associação descrita da
expressão de JAM-C com maior produção de quimiocinas e a consequente retenção de
linfócitos nos LN.
Apesar do progresso rápido nos últimos anos, a caracterização das FRCs
encontra-se incompleta, e ainda não há um conencontra-senso sobre os marcadores adequados para sua
subclassificação. Também não está bem esclarecido se as diferentes subpopulações de
FRC podem ser agrupadas pela expressão comum dos vários marcadores utilizados ou se
a expressão diferencial pode ser devida ao estado de ativação ou à sua localização no LN.
Ainda não existe, portanto, uma conclusão de quais marcadores são capazes de
diferenciá-las de acordo com uma função distinta. Diante da diversidade de fenótipos em murinos e
humanos, a definição das subpopulações de FRCs permitiria avaliar a existência de
funções exclusivas ou compartilhadas por células com morfologias e padrões de
expressão distintos. Estudos futuros poderão esclarecer estas relações, bem como a
9
1.3.3 Diversidade Funcional
Embora consideradas originalmente como células de suporte no LN, nas últimas
décadas tem-se proposto que as FRCs possam ter funções adicionais (Tykocinski et al,
1983), como por exemplo, suporte para migração e sobrevivência de linfócitos, possível
participação na ativação e controle da resposta imune ou na tolerância periférica (Fletcher
et al (b), 2011), entretanto, trabalhos mais aprofundados serão necessários para
estabelecer a abrangência destes achados. Além disso, ainda não há consenso sobre a
correspondência fenotípica e funcional das subpopulações destas células. Porém a
investigação de um possível papel imunomodulador é de grande interesse, devido à
possível influência sobre a regulação da resposta imune e estabelecimento da tolerância
periférica.
1.3.3.1 Ativação da resposta imune
O envolvimento com o sistema imunológico faz das FRCs células de grande
importância na resposta imune em curso (Hara et al, 2006). A rede reticular formada
pelas FRCs pode ser favorável à resposta imune adaptativa de várias formas, pode
funcionar como uma base física para reações imunológicas in vivo, onde as FRCs
promovem simultaneamente força mecânica para o tecido e fornece espaço para a
migração das células do sistema imune, e também atuam como barreira física para a
compartimentalização do LN, prevenindo uma interação desordenada ou crescimento
descontrolado (Hara et al, 2006; Katakai et al, 2004). Além disso, pequenos antígenos
podem ser drenados pelos canais condutores formados pelas FRCs, tanto para a zona de
células T, quanto para a zona de células B levando a captura de antígenos pelas células B
e DCs residentes (Luther et al, 2011). Moléculas de alto peso molecular são incapazes de
entrar no lúmen dos canais formados pelas FRCs e permanecem retidas em macrófagos
próximos ao SCS. A exclusão das grandes moléculas pode se restringir ao tipo de sinal
emitido pelos canais condutores, evitando assim o acesso de alguns agentes patogênicos
(Mueller e Germain, 2009).
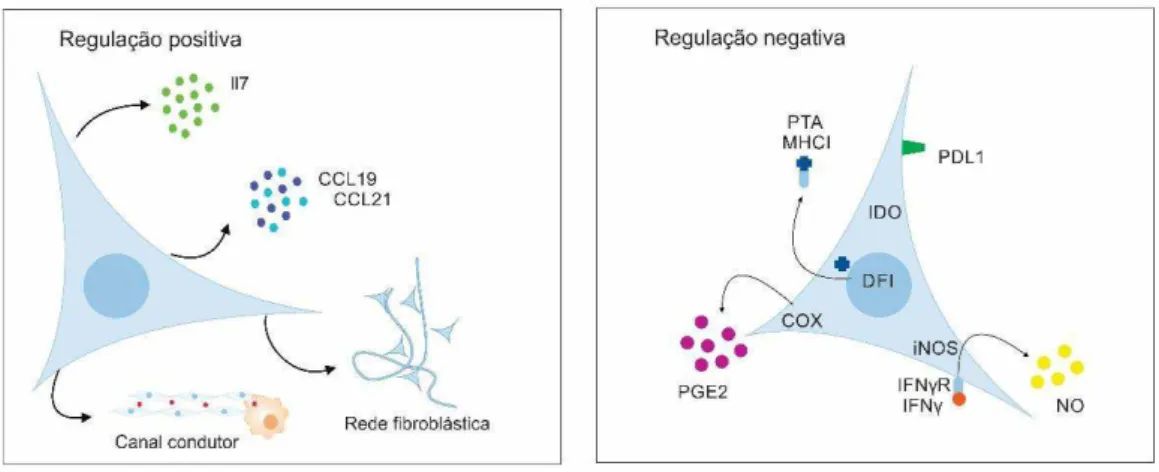
Classicamente as FRCs murinas são conhecidas por secretar CCL19, CCL21 e
IL7, embora estudos mais recentes relatem a produção de outras citocinas envolvidas na
homeostase e sobrevivência de linfócitos, como IL6 e IL15 (Katakai et al, 2004; Hara et
al, 2006; Luther et al, 2011; Steele et al, 2009; Link et al, 2007). Algumas quimiocinas
10 níveis quando em estado de repouso e aumentam essa expressão em resposta a estímulos, como TNFα. Outras ainda são expressas apenas após o estímulo inflamatório, como TNFα, IFN , IL1 ou lipopolissacarídeo (LPS) (Anexo 1).
As quimiocinas CCL19 e CCL21 produzidas pelas FRCs favorecerem a resposta
imune co-estimulando a ativação de células T, aumentando a interação entre células T e
DCs, promovendo a maturação das DCs, estimulando endocitose e apresentação de
antígeno pelas DCs, além de promover a extensão de dendritos em DCs maduras (Mueller
e Ahmed, 2008; Mueller e Germain, 2009). DCs ativadas produzem as quimiocinas CCL3
e CCL4, as quais recrutam células T (antígeno-específicas raras) que migram de forma
direcionada pelas FRCs. Portanto, a interação de FRCs, DCs e quimiocinas ajuda a primar
a resposta imune (Mueller e Germain, 2009). Vale ressaltar que as FRCs podem regular
positivamente não só a migração e a homeostase das células T, como também há indícios
de que elas influenciem o início da diferenciação de células T efetoras e de memória
(Siegert e Luther, 2012).
A IL7 é um fator de sobrevivência que atua nas células T naive e auxilia a
manutenção do repertório e imunocompetência. As TRCs murinas isoladas de LNs
apresentam a expressão gênica dez vezes maior das quimiocinas CCL19 e CCL21 quando
comparada às BECs e células estromais duplo negativas (DNC, gp38-CD31-) e dez vezes
mais IL7 que outro tipo celular presente no LN (Link et al, 2007). Além dos efeitos sobre
os linfócitos T e B, evidências recentes indicam que a IL7 pode ter um impacto sobre o
desenvolvimento das DC e células natural-killers T (NKT) (Onder et al, 2012). A IL7
também pode contar com a ação aditiva das quimiocinas na indução da sobrevivência
celular. Tanto a quimiocina CCL19 quanto CCL21 são capazes de aumentar a
sobrevivência de células T naive, embora a CCL19 tenha se mostrado mais potente que a
CCL21. Estes dados sugerem que a secreção de IL7 e CCL19 é suficiente para a
manutenção da sobrevivência de células T (Link et al, 2007). Porém não se sabe ainda se
tais efeitos sobre a sobrevivência celular são compartilhados por outras citocinas. Estes
dados sugerem que a indução da sobrevivência celular pela FRC não é devido a único
fator, via ou mecanismo de ação. Ressaltando um papel funcional para FRCs que vai além
de suporte estrutural.
Durante a resposta imunológica, um número significativo de linfócitos são
primados e expandidos. Com a eliminação progressiva dos antígenos, são ativados
11 resposta imune). A morte celular antígeno-induzida é um dos mecanismos que faz com
que o número de linfócitos volte aos níveis próximos da pré-ativação, e então alguns dos
linfócitos que sobrevivem se diferenciam em linfócitos de memória. As quimiocinas
CCL19 e CCL21 também podem promover morte celular antígeno-induzida em células
T ativadas, sugerindo que a diminuição destas quimiocinas nos tecidos linfoides contribua
com estágios tardios da resposta imune. É também interessante pensar que o estímulo
constante ou altas doses de CCL19 e CCL21 talvez inibam a ativação, proliferação ou
função das células T (Muller e Ahmed, 2008).
Em condições homeostáticas, a FRC encontrada na zona de células T e nos
cordões medulares é o principal tipo celular estromal que expressa o fator de crescimento
endotelial vascular (do inglês Vascular Endothelial Growth Fator, VEGF) nos LNs. O
VEGF apresenta um papel central na manutenção e proliferação de células endoteliais
vasculares, incluindo HEVs (Chyou et al, 2008; Mueller e Germain, 2009).
LNs mesentéricos e drenantes de pele parecem apresentar uma composição
estromal distinta. Embora a quantidade de BECs, LECs, DNC e MRCs seja semelhante
em ambos os locais, as TRCs parecem estar presentes em maior proporção com perfil
diferenciado nos LNs drenantes de pele. Nos LNs mesentéricos, as FRCs apresentam
redução significativa na expressão de várias citocinas e quimiocinas importantes, como,
IL6, IL7, CXCL9, CXCL10, IL1 receptor proteína acessória (IL1Rap), receptor de
activina IIA, VEGF-A, LIF e c-KIT-ligante. Já nos LNs drenantes da pele, as FRCs
expressaram altos níveis de IL1R1 e de IL1Rap, mas não expressam o análogo IL1RN.
Também foi previamente descrito que FRCs respondem ao receptor semelhante ao Toll 3
(do inglês Toll-like Receptor, TLR), sugerindo que estas células reajam rapidamente à
infecção (Fletcher et al (b), 2011). Somente células do estroma de LNs mesentéricos
apresentam expressão do ácido retinóico metabólito da vitamina A. Células T ativadas
neste ambiente estromal apresentam um fenótipo de migração (do inglês, homing) para o tecido intestinal expressando α4 7 e CCR9. Células do estroma de LNs mesentéricos induzem respostas de IgA consistentes. Estes dados também indicam que o estroma pode
dirigir o tipo e a qualidade das respostas imunes em OLSs (Mueller e Germain, 2009).
Em conjunto, estes dados sugerem que as FRCs podem contribuir com a resposta
imune através da regulação da migração celular nos LNs, indução da sobrevivência
linfocitária, qualidade da apresentação de antígenos e de um possível direcionamento da
12 que explorem a heterogeneidade funcional destas, ou de subpopulações específicas,
permitirão o correto dimensionamento da relevância destas células na regulação de
processos imunes.
1.3.3.2 Tolerância periférica
Algumas células do estroma expressam vários antígenos de tecidos periféricos (do
inglês Peripheral Tissues Antigens, PTA) e estão envolvidas na manutenção da tolerância
periférica, principalmente através da deleção de células T auto-reativas (Turley et al,
2010; Fletcher et al (b), 2011; Lukacs-Kornek et al, 2011; Siegert e Luther, 2012). Em
OLS, os antígenos podem ser apresentados às células T pelas células provenientes do
sangue (como linfócitos B), ou por células da linfa (como DC) e ainda por células
residentes (como DC residentes) (Turley et al, 2010).
A expressão do gene regulador de autoimunidade (do inglês Autoimmune
Regulator Gene, AIRE) em FRCs ainda é controversa. Enquanto alguns estudos relatam
a expressão de AIRE em células estromais, mas não especificamente em FRCs (Mueller,
Germain 2009; Turley et al, 2010; Fletcher et al (b), 2011; Luther et al, 2011; Hess et al,
2012; Malhota et al, 2012), Siergert et al (2012), relataram que AIRE pode ser expresso
em baixos níveis em FRCs. Segundo Turley et al (2010), embora o gene AIRE seja
expresso em algumas células estromais do LN, este parece não controlar a expressão de
PTAs em FRCs e LECs. No entanto, FRCs e LECs expressam o DEAF1, um fator de
transcrição regulado pelo gene DF1 que controla a expressão de aproximadamente 300
genes em LNs pancreáticos, dos quais 75% são classificados como PTAs. Apesar de
AIRE e DEAF1 serem similares, apresentam mecanismos diferentes ao controlar a
expressão de PTAs (Turley et al, 2010). Em camundongos NOD existem pelo menos duas
isoformas de DF1, o DF1 canônico e o DF1 variante proveniente de um splicing
alternativo (do inglês Alternatively Spliced Variant in DF1, DF1-VAR1). O DF1
canônico é capaz de se translocar para o núcleo e regular a transcrição de PTAs, já o DF1-
VAR1 é expresso no citoplasma e pode se ligar ao DF1 canônico sequestrando este para
o citoplasma, desta forma inibindo a transcrição dos PTAs (Fletcher et al (b), 2011; Yip
et al, 2009).
As FRCs podem induzir tolerância nas células T através da expressão de antígenos
próprios ou limitar a resposta de células T aos antígenos não próprios através da expressão
13 de forma indireta pela redução da imunogenicidade de DCs (Siegert e Luther, 2012). Ao
contrário das APCs clássicas, a estimulação de TLR em células do estroma induz um
fenótipo mais tolerogênico que imunogênico, sendo possível que isto proteja a estrutura
dos LNs contra danos auto-reativos durante a ativação de células T. A atividade
tolerogênica de células estromais pode ocorrer mesmo na ausência de APCs (Turley et al,
2010).
Além da participação da FRCs na tolerância periférica através da expressão de
PTAs, as FRCs são altamente responsivas ao IFN produzido por células T e respondem
com o aumento na transcrição do gene NOS2, codificando a enzima óxido nítrico sintase
induzível (do inglês Inducible Nitric Oxide Synthase, iNOS). A enzima iNOS participa
da produção de nitrito, o qual é capaz de bloquear a progressão do ciclo celular das células
T. Estas observações colocam as FRCs como reguladoras da ativação de células T através
do contato direto com células T produtoras de IFN- (Sierget et al 2011). TNF-α apresenta
uma ação sinérgica ao IFN- na indução da síntese de iNOS (Siegert e Luther, 2012). É
provável que células Th2 sejam insensíveis ao efeito antiproliferativo das FRCs por não
produzirem IFN- . Este é um possível mecanismo de manutenção da integridade do tecido
linfoide, dada a capacidade da resposta Th1 em danificar mais o tecido quando comparada
à resposta Th2. O efeito inibitório induzido em células T pelas FRCs ocorre em
aproximadamente 24 horas, prazo este que correspondente ao tempo necessário para a
produção inicial de IFN- em células T (Khan et al, 2011).
A produção de óxido nítrico (do inglês Nitric Oxide, NO) por FRCs e LECs é
fortemente regulada e requer um segundo sinal fornecido pelo TNF-α e pelo contato
direto com as células T ativadas. Este processo não afeta a ativação precoce das células
T (Lukacs-Kornek et al, 2011). O efeito inibitório das FRCs pode afetar tanto células T
CD8+ quanto células T CD4+ (Sierget et al, 2011). O NO pode regular negativamente as
células T através da nitrosilação de diversos resíduos de aminoácidos levando à
diminuição do complexo receptor de célula T (do inglês T Cell Receptor, TCR). A
depleção, pela enzima iNOS, do seu substrato L-arginina disponível, poderia inibir as
células T através da diminuição de expressão do CD3ζ. O NO também pode bloquear
diretamente a fosforilação da proteína STAT5 interferindo assim na sinalização da via da
IL2 (Siegert e Luther, 2012). Dentre os muitos efeitos do NO, esta molécula pode
diferenciar células T CD4+ ativadas em células T reguladoras (do inglês Regulatory T
14 sido descrito que FRCs podem se assemelhar às células Tregs em diferentes condições,
nos experimentos realizados por Lukacs-Kornec et al (2011), as células Tregs Foxp3+ e
a citocina IL10 foram dispensáveis para o efeito inibitório das FRCs.
O IFN se destaca como um importante regulador funcional das FRCs, por sua capacidade de induzir iNOS, indolamina 2-3 desoxigenase (do inglês, Indoleamine 2,
3-dioxygenase, IDO) 1, ligante de morte programada (do inglês, Programmed death-ligand,
PD-L) 1 e várias moléculas envolvidas na apresentação de antígenos. Usualmente IFN
é a principal citocina pró-inflamatória, por atuar em vários aspectos da resposta imune
como na ativação de macrófagos, na depleção de patógenos intracelulares e aumento da expressão das moléculas de MHC. Entretanto, o IFN também pode atuar em funções imuno-reguladoras, modulando negativamente a expressão de enzimas proteolíticas,
diminuindo o recrutamento de células inflamatórias tais como neutrófilos, inibindo a
diferenciação em Th17, além de regular positivamente a diferenciação de células Tregs em certas circunstâncias. Assim como o IFN , outras citocinas pró-inflamatórias, como a IL1- e o TNF-α produzidas pelas DC ativadas também levam à indução de iNOS nas
FRCs (Siegert e Luther, 2012).
Sierget et al (2011) sugerem que o papel inibitório das FRCs se dê pela ação de
no mínimo três moléculas a iNOS e a cicloxigenase (do inglês, Cyclooxygenase, COX) 1
e 2. A COX-2 é a enzima limitante da velocidade da geração de prostanóides, incluindo
a prostaglandina E2 (PGE2), que pode tanto aumentar quanto suprimir a imunidade de
células T (Siegert e Luther, 2012). FRCs iNOS-/- não apresentam nenhuma atividade
supressora, aumentando a proliferação de células T. Além disso, a inibição da COX-1 e
2 também é capaz de reduzir o efeito supressivo das FRCs (Sierget et al, 2011). Sierget
e Luther (2012) propõem que as FRCs sejam estimulas por citocinas ao produzir NO
temporariamente inibindo a proliferação de células T. Esse grupo também propõe um
modelo em que as FRCs se comuniquem de forma bidirecional tanto com linfócitos
quanto com DC para aumentar a eficiência da resposta imune; entretanto, durante a
resposta aguda, as FRCs limitariam a proliferação e atividade inflamatória das células T.
O efeito da FRC na imunidade de células T também tem sido relacionado com a
expressão de PD-L1, levando a modulação da resposta de células T CD8+ (Sierget et al
2011). PD-L1 e IDO desempenham papéis importantes no desenvolvimento de células
Tregs e células supressoras mielóides, podendo conectar as FRCs com a produção,
15 celulares do sistema imunológico têm subtipos que suprimem ou regulam a imunidade
adaptativa, como as células T e B reguladoras, DC reguladoras e macrófagos M2 ativados.
Por isso, não é surpreendente que as FRCs sejam reguladoras positivas e negativas da
imunidade adaptativa (Figura 3). Neste contexto, as células estruturais podem agir como
sensores mecânicos e químicos da resposta de células T em curso em um órgão inflamado
e ajustar a dinâmica das populações para assegurar o crescimento ordenado do tecido e a
manutenção das estruturas funcionais (Siegert e Luther, 2012).
Figura 3. Principais mecanismos de ação das FRCs na ativação da resposta imune e na tolerância
periférica.
1.4 Células reticulares fibroblásticas e células-tronco mesenquimais
Além das FRC, outro tipo celular estromal muito estudado são as células-tronco
mesenquimais (CTM). Ambas as células são estromais encontradas em órgãos linfoides;
a CTM compõe o estroma da medula óssea - um órgão linfoide primário, já a FRC
colabora na formação do estroma do baço e linfonodo, que são órgãos linfoides
secundários. Tanto as CTMs quanto as FRC apresentam morfologia fibroblástica e são
aderentes ao plástico. Embora os relatos sejam isolados, a literatura descreve
características semelhantes nessas células. Entretanto, estudos com descrição
comparativa ou experimentos que avaliem estas semelhanças ainda não foram realizados.
1.5 Células-tronco mesenquimais
CTMs foram inicialmente descritas no início da década de 70 por Friedenstein
como células estromais que compõe a medula óssea. Porém estas células podem estar
distribuídas em diversos outros tecidos, como, músculo, gordura, folículos capilares,
16 pulmão, fígado, intestino, líquido amniótico, membrana sinovial e mama (Gebler et al,
2012; Huang et al, 2011; Keating, 2012; Nery, 2013).
CTMs são geradas no folheto germinativo intermediário dos tecidos embrionários,
esta origem é chamada mesodérmica (Huang et al, 2011; Murray et al 2013; Slukvin e
Vodyanik, 2011; Ucelli et al, 2008). CTMs são células indiferenciadas que possuem a
capacidade de auto renovação e de diferenciação em células de origem mesodérmica
como: células do tecido ósseo (osteócitos), células do tecido adiposo (adipócitos) e
células do tecido cartilaginoso (condrócitos) (Bieback et al, 2012; Gebler et al, 2012;
Huang et al, 2011; Keating, 2012). São descritos vários marcadores para as CTMs, ou
seja, essas células devem apresentar expressão positivas para CD9, CD29, CD44, CD54,
CD61, CD63, CD71, CD90, CD97, CD98, CD99, CD105, CD106, CD146, CD155,
CD166, CD276 e CD304, e negativa para CD14, CD34, CD45 e CD133 (Nery et al,
2013).
Embora as CTMs possam variar quanto à expressão de seus marcadores, perfil de
expressão gênica e propriedades funcionais, a Sociedade de Terapia Celular Internacional
(ISCT) sugeriu critérios mínimos para a caracterização destas células que incluem:
aderência ao plástico, expressão de CD105, CD73 e CD90, e não expressão de CD45, CD34, CD14 ou CD11b, CD79α ou CD19, CD31 e HLA-DR, além da capacidade de diferenciação nas três linhagens mesodérmicas clássicas: condrócitos, adipócitos e
osteócitos (Dominici et al, 2006).
Muita importância tem-se dado às CTMs devido aos seus efeitos terapêuticos
reportados em alguns estudos. Grande parte destes artigos referem-se ao potencial
imunomodulador ou pró-regenerativo destas células e estes resultados levaram à
intensificação de estudos das CTM em contextos terapêuticos (Bieback et al, 2012).
1.5.1 Imunomodulação
As propriedades imunomodulatórias das CTMs tem sido foco de uma variedade
de estudos que demonstram efeito terapêutico em modelos animais experimentais de
diversas doenças inflamatórias e autoimunes. Porém os mecanismos exatos de como as
CTMs regulam o sistema imunológico ainda não estão completamente compreendidos.
Sabe-se que as CTMs são capazes de interagir com muitos tipos celulares do sistema
imune, tanto com células relacionadas com a imunidade inata quanto com células
17 diferenciação e a função destas células. Dentre as células sensíveis a seus efeitos
encontram-se os monócitos/macrófagos, DC, NK, células T e B (Bieback et al, 2012;
Gebler et al, 2012; Keating, 2012; English, 2013; English e Wood, 2013).
CTMs expressam os receptores de quimiocinas CCR1, CCR4, CCR7, CXCR5 e
CCR10, que podem estar envolvidos em sua migração, de acordo com o gradiente
quimiotático (Gebler et al, 2012). Os efeitos mediados pela CTMs sobre as células imunes
abrangem diversos mecanismos, e dentre esses se destaca a secreção de fatores solúveis.
Vários fatores de efeito parácrino são secretados pelas CTMs, como, fatores de
crescimento, citocinas, quimiocinas e hormônios. Dentre esses, as citocinas IL-6, IL-10,
o fator inibidor da leucemia (do inglês leucemia inhibitory fator, LIF), o fator de
célula-tronco (do inglês stem-cell fator, SCF), fator transformador de crescimento beta (do inglês
transforming growth factor TGF-), VEGF, fator de crescimento de hepatócitos (HGF), Jagged 1 e angiomotin 1 (Ang 1) (Gebler et al, 2012).
O microambiente pode ser modulado através da secreção de fatores
imunossupressores pelas CTMs, tais como, IL-10, TGF-, VEGF, HLA-G solúvel, HGF,
IDO, NO e PGE-2 (Gebler et al, 2012; English, 2013). Além disso, as CTMs são capazes
de alterar o perfil de citocinas de outras células, como DCs, NKs e células Th1 e Th2,
suprimindo a secreção das citocinas pró-inflamatórias, como IFN- , IL1- e TNF-α e
aumentando a secreção das citocinas anti-inflamatórias, como a IL-10 (Gebler et al,
2012).
É conhecido que TLR-2, 3, 4, 7 e 9 são expressos em CTMs, bem como a
participação destes receptores na ação imunomoduladora destas células. A ativação
desses receptores pelos respectivos ligantes interfere no perfil secretório das CTMs e pode
influenciar na proliferação, diferenciação, migração e sobrevivência de outras células do
sistema imunológico (Gebler et al, 2012; English et al, 2013). Além disso, os TLRs
participam na polarização das CTMs para fenótipo pró-inflamatório ou supressivo
conforme a ativação de TLR 4 ou 3 respectivamente (Keating, 2012; English, 2013;
English e Wood, 2013).
Outro componente da imunidade inata que influencia os efeitos das CTMs é o
sistema complemento (English et al, 2013; English e Wood, 2013). CTMs migram em
resposta aos componentes C1q, C3a, e C5a. Um efeito protetor ao dano oxidativo é
instituído nas CTMs através da estimulação dos receptores de C3a e C5a. Altos níveis de
18 expressam CD59, uma proteína regulatória do sistema complemento, também relacionada
com o fator H que protege contra a lise causada pelo sistema complemento (English e
Wood, 2013).
CTMs inibem a proliferação de células NK ativadas por IL-2, através do contato direto e dos mediadores TGF-, HLA-G solúvel e PGE-2 (Gebler et al, 2012; Keating,
2012). Também são capazes de influenciar a função efetora de células NK, como a
citotoxicidade contra células infectadas que é acompanhada de redução na secreção de
IFN- . Estes efeitos estão associados com a redução da expressão dos receptores de
ativação da NK, mediada principalmente por PGE2 e IDO (Gebler et al, 2012). Estudos
que avaliam as interações entre células NK e CTMs mostram que estas afetam a
proliferação das células NK, entretanto estas atuam sobre as CTMs podendo influenciar
sua sobrevivência (Gebler et al, 2012; English et al, 2013).
DCs geradas na presença de CTMs secretam baixos níveis de IL-12 e TNF-, altos níveis de IL-1 e IL-10, além de expressarem baixos níveis de MHC classe II, das
moléculas co-estimulatórias CD40, CD80, CD83 e CD86, e do CCR7 in vitro e in vivo
(English, 2013; Gebler et al, 2012; English e Wood, 2013). Estas alterações conferem às
DCs um fenótipo mais tolerogênico que não se mostrou reversível mediante a estimulo
com LPS (Gebler et al, 2012; English et al, 2013).
Vários estudos suportam a ideia de que as CTMs inibem ou interferem na
diferenciação das DCs, e é consenso que este efeito é mediado por PGE-2, porém ainda
é discordante a participação da IL-6 e a dependência de contato (English, 2013; Gebler et
al, 2012; English et al, 2013; English e Wood, 2013). Entretanto, o estágio de
desenvolvimento, a variação do microambiente e condições específicas podem
influenciar no efeito que as CTMs exercem sobre as DC, por exemplo, efeito discrepante
é observado na diferenciação da DC convencional e da DC plasmacitóide (English, 2013;
English et al, 2013).
Diversos estudos mostram que as CTMs são capazes de modular a proliferação,
ativação e função, tanto de linfócitos autólogos quanto alogênicos in vitro e in vivo
(English e Wood, 2013). In vitro, as CTMs inibem a proliferação de células T ativadas
por mitógenos, anticorpos CD3 e CD28 ou alo-antígenos, mostrando que o efeito
antiproliferativo das CTMs ocorre de forma independente do método de ativação e não é
restrita ao MHC. Quando na presença das CTMs, linfócitos apresentam uma reduzida
19 na fase G0/G1 do ciclo celular (Gebler et al, 2012). Este efeito pode ser explicado pela
hiporegulação da ciclina D2 e não expressão de moléculas co-estimulatórias, resultando
em anergia de células T sem indução de apoptose, onde a ausência de apoptose é
justificada pela secreção de IL-7 por CTMs (Gebler et al, 2012; Normanton et al, 2014).
Além disso, CTMs também são capazes de influenciar a diferenciação de células T
auxiliares em favor de subpopulações com perfil anti-inflamatório, por exemplo, a
produção de IL-10 pelas CTMs favorece a expressão do fator de transcrição Foxp3 e supressão do RORt, favorecendo a diferenciação de células Treg ao invés de células
Th17 (English e Wood, 2013).
São descritos ainda outros importantes fatores envolvidos na indução de células
Tregs (CD4+ ou CD8+, CD25+ e Foxp3+) promovida por CTMs, como os mediadores
PGE-2, TGF- 1 e contato direto (Gebler et al, 2012; English, 2013). Por fim, as moléculas
HLA-G e B7-H4, constitutivamente expressas em CTMs, estão envolvidas com o seu
efeito imunossupressor sobre a ativação das células T, proliferação e/ou citotoxicidade
mediada por células T e NK (Gebler et al, 2012). Contudo, parece que os mecanismos
de inibição de células T são variáveis conforme a espécie, por exemplo, em humanos e
em macacos a principal via de inibição é através da ativação da enzima IDO e consequente
depleção de triptofano, já em camundongos ocorre via NO sintetizado pela ativação da
enzima iNOS (Keating, 2012).
Poucos estudos avaliam os efeitos das CTMs sobre as células B, porém sabe-se
que em diferentes condições a CTM é capaz de bloquear a proliferação de células B,
influenciar a produção de anticorpos e inibir as quimiocinas responsáveis por sua
migração (Gebler et al, 2012; English et al, 2013; English e Wood, 2013). Todavia, a
expressão de moléculas co-estimulatórias e a secreção de citocinas não é afetada (Gebler
et al, 2012). Entretanto, English et al (2013) relatam que em modelo animal de lúpus
eritematoso sistêmico, as CTMs não inibem a produção de auto-anticorpos, pelo
contrário, agravam a doença aumentando seus níveis, mostrando que efeitos adversos
podem ser observados em circunstancias especificas e que mais estudos são necessários.
De acordo com os vários aspectos descritos, percebe-se que as CTM e FRC
compartilham similaridades. Ambas as células estão presentes em órgãos linfoides,
apresentam morfologia e características semelhantes quando cultivadas in vitro. Além
disso, tem sido reportado o envolvimento de ambos os tipos celulares na resposta imune
20 As CTMs são provenientes da medula óssea, um órgão linfoide primário, cuja
função principal não está relacionada à resposta imunológica, entretanto de acordo com
inúmeros trabalhos, estas células possuem capacidade de interferir na ativação de várias
células do sistema imunológico. Assim sendo, acreditamos que as FRCs, que se
encontram em um órgão linfoide secundário o LN, cuja função principal é a resposta
imunológica, apresentem também um papel regulador, descrito na literatura como
tolerância periférica e contração de uma resposta imunológica já estabelecida.
Ressaltamos a escassez de estudos em humanos envolvendo as FRCs e também
as DNCs a qual, mesmo em modelos murinos, muito pouco ainda se sabe. A falta de
consenso encontrada na literatura e a carência de estudos em humanos destas células nos
instiga a avaliar o envolvimento de FRCs e DNCs com a resposta imunológica em
humanos.
2 HIPÓTESE GERAL
Nossa hipótese é que as FRCs derivadas de linfonodos humanos de forma similar
às FRCs murinas e às CTMs humanas exercem papel regulatório sobre a resposta
imunológica.
3 JUSTIFICATIVA
A elucidação da função e do real potencial das FRCs na espécie humana pode
proporcionar conhecimento do desenvolvimento da resposta imune. Em modelos murinos
existem fortes evidências da participação destas células na tolerância periférica,
entretanto estudos sobre as populações de FRC de espécie humana são escassos.
4 OBJETIVOS
4.1 Geral
Isolar e caracterizar fenotípica e funcionalmente as células estromais de LNs
humanos, mais precisamente as FRCs e as DNCs. Comparar as características
21
4.2 Específicos
Isolar as FRCs e DNCs de LNs humanos periféricos e mesentéricos livres de
patologias, e caracterizá-las fenotipicamente por citometria de fluxo e pela potencialidade
de diferenciação em células da linhagem mesodérmica.
Verificar a influência que as FRCs e DNCs exercem na proliferação e na expressão
de moléculas de homing em linfócitos alogênicos derivados de LN e SP, mediante
co-cultivo.
5 MATERIAIS E MÉTODOS
5.1 Características amostral
As amostras do presente estudo foram coletadas de procedimentos cirúrgicos,
onde os linfonodos eram removidos de pacientes com diferentes diagnósticos clínicos.
Estes órgãos foram submetidos ao exame histopatológico, a fim de averiguar se estavam
saudáveis ou comprometidos com doença (Tabela 1).
Tabela 1. Característica amostral. Linfonodo (LN). Sem sucesso no estabelecimento da linhagem (-).
Sucesso no estabelecimento da linhagem (+).
Amostra Diagnóstico clínico do paciente Resultado
anatomopatológico
Cultura celular
LN Periféricos
LN 3 Neoplasia laríngea Negativo +
LN 4 Neoplasia laríngea Negativo +
LN 9 Neoplasia mamária Negativo -
LN 15 Neoplasia mamária Negativo +
LN Mesentéricos
LN 1 Cistoadenofibroma seroso de ovario Negativo -
LN 2 Cistoadenofibroma seroso de ovario Negativo -
LN 5 Neoplasia retosigmoide Negativo +
LN 6 Adenocarcinoma de reto Metástase +
LN 7 Doador saudável (Fígado) Negativo +
LN 8 Doador saudável (Fígado) Negativo +
LN 10 Diverticulite Negativo +
LN 11 Diverticulite Negativo +
LN 12 Diverticulite Negativo +
LN 13 Diverticulite Negativo +
LN 14 Neoplasia pancreática Negativo +
5.2 Análise anatomopatológica e histoquímica
O exame anatomopatológico foi realizado pelo Laboratório de Patologia Clínica