www.jped.com.br
ARTIGO
ORIGINAL
A
double-blinded
randomized
trial
on
growth
and
feeding
tolerance
with
Saccharomyces
boulardii
CNCM
I-745
in
formula-fed
preterm
infants
夽
Lingfen
Xu
a,
Yun
Wang
b,
Yang
Wang
a,
Jianhua
Fu
a,
Mei
Sun
a,
Zhiqin
Mao
a,∗e
Yvan
Vandenplas
caDepartamentodePediatria,ShengjingHospital,ChinaMedicalUniversity,Shenyang,China bDepartamentodePediatria,QingdaoWomenandChildren’sHospital,Qingdao,China cUZBrussel,DepartamentodePediatria,VrijeUniversiteitBrussel,Bruxelas,Bélgica
Recebidoem21demaiode2015;aceitoem10deagostode2015
KEYWORDS
Feeding (in)tolerance; Growth; Necrotizing enterocolitis; Preterminfant; Probiotic; Sepsis
Abstract
Objective: Theuseofprobioticsisincreasinglypopularinpretermneonates,astheymay pre-ventnecrotizingenterocolitis(NEC)sepsisandimprovegrowthandfeedingtolerance.Thereis onlylimitedliteratureonSaccharomycesboulardiiCNCMI-745(S.boulardii)inpreterminfants.
Method: A prospective, randomized, case-controlled trial with the probiotic S. boulardii
(50mg/kgtwice daily)was conductedinnewbornswithagestationalageof30to37weeks andabirthweightbetween1,500to2,500g.
Results: 125neonateswereenrolled;63inthetreatmentand62inthecontrolgroup.Weight gain(16.14±1.96vs.10.73±1.77g/kg/day,p<0.05)andformulaintakeatmaximalenteral feeding(128.4±6.7vs.112.3±7.2mL/kg/day,p<0.05)weresignificantlyhigherinthe inter-ventiongroup.Onceenteralfeedingwasstarted,thetimeneededtoreachfullenteralfeeding wassignificantlyshorterintheprobioticgroup(0.4±0.1vs.1.7±0.5days,p<0.05).Therewas nosignificantdifferenceinsepsis.NECdidnotoccur.NoadverseeffectsrelatedtoS.boulardii
wereobserved.
DOIserefereaoartigo:
http://dx.doi.org/10.1016/j.jped.2015.08.013
夽 Comocitaresteartigo:XuL,WangY,WangY,FuJ,SunM,MaoZ,etal.Adouble-blindedrandomizedtrialongrowthand feeding tolerancewithSaccharomycesboulardiiCNCMI-745informula-fedpreterminfants.JPediatr(RioJ).2016;92:296---301.
∗Autorparacorrespondência.
E-mail:maozq@sj-hospital.org(Z.Mao).
Conclusion: Prophylacticsupplementation ofS.boulardiiatadoseof50mg/kgtwice aday improved weight gain, improved feedingtolerance, andhadno adverseeffects inpreterm infants>30weeksold.
© 2016 Sociedade Brasileira de Pediatria. Published by Elsevier Editora Ltda. This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/ licenses/by-nc-nd/4.0/).
PALAVRAS-CHAVE
(In)Tolerância dealimentac¸ão; Crescimento; Enterocolite necrosante;
Neonatoprematuro; Probiótico;
Sepse
Ensaioduplo-cegorandomizadosobrecrescimentoetolerânciadealimentac¸ãocoma
SaccharomycesboulardiiCNCMI-745emneonatosprematurosalimentados
comfórmula
Resumo
Objetivo: Ousodeprobióticosestácadavezmaispopularemneonatos prematuros,jáque podempreveniraenterocolitenecrosante(ECN)easepseeaumentarocrescimentoea tole-rância dealimentac¸ão.Há apenas umaliteraturalimitada sobreaSaccharomycesboulardii
CNCMI-745(S.boulardii)emneonatosprematuros.
Método: Umensaiodecaso-controleprospectivorandomizadocomoprobióticoS.boulardii
(50mg/kg duas vezespor dia)foi feitocomrecém-nascidos comidade gestacionalde 30 a 37semanasepesoaonascerentre1.500e2.500g.
Resultados: Foramincluídos 125neonatos,63nogrupodetratamentoe62nodecontrole. O ganho de peso (16,14±1,96 em comparac¸ão com 10,73±1,77g/kg/dia, p<0,05) e a ingestão de fórmula com nutric¸ão enteral máxima (128,4±6,7 em comparac¸ão com 112,3±7,2mL/kg/dia, p<0,05) foramsignificativamente maioresno grupo deintervenc¸ão. Assim queanutric¸ãoenteral foiiniciada, otempo necessário paraatingir anutric¸ão ente-ralcompletafoisignificativamentemenornogrupoprobiótico(0,4±0,1emcomparac¸ãocom 1,7±0,5dia,p<0,05).Nãohouvediferenc¸asignificativaemsepse.NãoocorreuECN.Nãofoi observadoefeitocolateralrelacionadoàS.boulardii.
Conclusão: Asuplementac¸ãoprofiláticadeS.boulardiiemumadosede50mg/kgduasvezes pordiamelhorouoganhodepeso,aumentouatolerânciadealimentac¸ãoenãoteveefeito colateralemneonatosprematuros>30semanasdeidade.
© 2016 Sociedade Brasileira de Pediatria. Publicado por Elsevier Editora Ltda. Este é um artigo Open Access sob a licença de CC BY-NC-ND (http://creativecommons.org/ licenses/by-nc-nd/4.0/).
Introduc
¸ão
A func¸ão da barreira gastrointestinal (GI), a motilidade intestinal, a imunidade da mucosa e a capacidade diges-tiva/de absorc¸ão são significativamente subdesenvolvidas noneonatoprematuro.1 Osneonatosprematuros
apresen-tamumriscomaiordedesenvolvercrescimentodeficiente, infecc¸ões hospitalares e enterocolite necrosante (ECN) e de desenvolver uma microbiota intestinal diferente de neonatosamamentadosdeformasaudável.1,2Essaestá
rela-cionadaaumamaiorincidênciadepartocesáreo,reduc¸ão daexposic¸ãoàmicrobiotamaterna,aumentodaexposic¸ão a organismos que colonizam unidades de terapia inten-siva neonatais (UTINs), (várias rodadas de) antibióticos e atraso na nutric¸ão enteral.3É debatida uma func¸ão dos
probióticos nocuidadode recém-nascidos prematuros.Os probióticossãodefinidoscomo‘‘microrganismosvivosque, quando administrados em quantidades adequadas, conce-dembenefíciosàsaúdedohospedeiro’’.4Emboraosrelatos
deaumentodocrescimentoereduc¸ãodaincidênciadeECN sejam animadores, muitos aspectos sobre os mecanismos deac¸ãoainda nãosãoclaros.5,6 Osestudosusam
diferen-tes cepas e dosagens, dificultam conclusões baseadas em evidências.5---7
Atéagora, ospesquisadoresnormalmente selecionaram cepas pertencentes a espécies bacterianas naturalmente presentes na flora intestinal, como os lactobacilos ou bifidobactérias.8 A Saccharomyces boulardii CNCM I-745
(S. boulardii)é uma levedura probiótica isolada dacasca defrutascomolichias,produzidasnaIndochina.9AS.
bou-lardiifoimalestudadaemneonatosprematurosecombaixo peso ao nascer. O objetivo deste estudo foi avaliar se a
S. boulardii administrada em recém-nascidos prematuros alimentados com fórmulas com menos de 30 semanas de idadegestacionalmelhorariaoganhodepesoeoresultado clínico.
Métodos
Inclusãodepacientes
protocolodoestudofoi aprovadopeloComitêdeÉtica do HospitalUniversitário.
O tamanho da amostra havia sido calculado antes do início do estudo para um nível de significância p<0,05 (bilateral) com uma potência de 80% (=0,2) para esti-marotamanhodaamostranecessário,comdesviopadrão de ganhode peso de 9g/dia em ambos os grupos e uma diferenc¸anoganhodepesode5g/diaentreosdoisgrupos. Issoresultouemumtamanhodaamostrade125neonatos, considerandoumataxadedesistênciade20%.
Critériosdeinclusãoeexclusão
Oscritériosdeinclusãoforamneonatosnascidosnohospital alimentadoscomfórmulacomidadegestacionalde30a37 semanasepesoaonascerentre1.500e2.500g.
Os critérios de exclusão foram patologias neona-tais graves, como complicac¸ões graves no nascimento, malformac¸ões GI, anomalias cromossômicas, imunodefici-ência conhecida, hidropsia fetal, cateter venoso central, antifúngicos e probióticos. Todos os pacientes incluídos receberamnutric¸ão parenteral e/ou fórmulapara prema-turos.Nenhumneonatorecebeuleitematerno.Anutric¸ão enteraloutrófica mínima foiiniciada assim que possível, com1mL/kg/dia.Anutric¸ãoenteralmínimaéapráticade fornecercomoalimentac¸ãoumpequenovolumede alimen-tosenteraisparaestimularodesenvolvimentodotratoGI imaturo do neonato prematuro; isso melhora a atividade da enzima GI, a liberac¸ão de hormônios, o fluxo sanguí-neo,amotilidadeeafloramicrobiana.Osbenefíciosclínicos incluemmelhorianatolerânciaaoleite,maiorcrescimento pós-natal,reduc¸ão da sepse sistêmica e menor tempode internac¸ão.10Assimqueanutric¸ãoenteralmínimafoi
tole-rada, o paciente foi aleatoriamente alocado para um de doisgrupos àrazãode1/1 (S. boulardiiougrupode con-trole).Arandomizac¸ãofoifeitadeacordocomumaordem dealocac¸ãoaleatóriadeterminadaporcomputadorelevou emconsiderac¸ãoopesoaonascer.Ovolumedaalimentac¸ão foiaumentadoquandobemtoleradodeacordocomo pro-tocololocal.
Intervenc¸ão
Ogrupo de intervenc¸ão recebeuS. boulardii CNCM I-745, administradaduasvezespordiacomomedicac¸ãoseparada, não misturada com a fórmula, a uma dose de 50mg/kg (Bioflor®;CMSShenzhenKangzhePharmaceuticalCo.Ltd.,
Shenzhen,China,fabricadopela Biocodex,Paris, Franc¸a); 50mg são cerca de 109 unidades formadoras de colônias
(UFC)).A dose do probiótico foi obtida de estudos ante-riores em neonatos.11 Nada foi administrado nogrupo de
controle.Operíododoestudoseencerravano28◦diaapós onascimentoouquandooneonatorecebiaaltahospitalar, casofossepossível,maiscedo.Contudo,adurac¸ãomínima daintervenc¸ão erade pelo menossete dias. Foram cole-tados dados observacionais e clínicos de rotina de todos os neonatos. O estudo cego foi possível porque a equipe deenfermagemqueadministrou aS.boulardiiaos neona-tosnãoestava envolvida nocuidado diárioe a equipede
atendimentoneonatalnãoestavacientedasatribuic¸õesde randomizac¸ão.
Resultado
Osresultados primáriosforamparâmetrosdecrescimento de curto prazo: ganho de peso (g/kg/dia) e crescimento linear (cm/semana). Os resultados secundários incluíam: dias de nutric¸ão parenteral necessários para alcanc¸ar a nutric¸ão enteral completa, volume tolerado de nutric¸ão enteralmáxima(mL/kg/dia)edurac¸ãodainternac¸ão(dias). Aintolerânciadealimentac¸ãofoidefinidaquandoovômito eosresíduosgástricosforamconsideradosmuito importan-tes. As complicac¸ões foram definidas como incidência de ECN (definidacomo suspeita ouestágio deBell positivoII ousuperior)esepse(definidacomohemoculturapositiva).9
Estatísticas---Registro
Os dados foram coletados e incluídos em uma base de dados estatística (SPSS, versão 16.0, IBM, Armonk, EUA). Osdadosestãoapresentadoscomomédia±desviopadrão. Osdadosdemográficosevariáveis deprocedimentoforam analisados com o teste tou teste qui-quadrado. Foi con-siderado que um valor de P<0,05 indica uma diferenc¸a estatisticamente significativa. Este estudo não foi finan-ciado por fontes externas e foi registrado no website
https://clinicaltrials.govcomonúmeroNCT02310425.
Resultados
Descric¸ãodopaciente
Foramalimentados comfórmula125neonatos prematuros inscritos e aleatoriamentealocados; 63pacientes recebe-ram S. boulardii assim que puderam tolerar a nutric¸ão enteralmínima e62neonatosforamincluídosnogrupode controle; 25(20%)pacientesforamconsiderados desisten-tes (12 (19,1%) no grupo que recebeu S. boulardii e 13 (20,1%)nogrupodecontrole(fig.1).Osmotivospara desis-tência foram retirada doconsentimento (n=9), perda no acompanhamento (n=11), cateter venoso central (n=1), sífilis congênita (n=1) e inclusões inadequadas (artresia intestinal congênita [n=2], trissomia do cromossomo 21 [n=1]);51indivíduos puderamser analisadosnogrupode intervenc¸ão e 49 nogrupo de controle. As características de todososneonatos na entradado estudoestão listadas natabela1enãoapresentaramdiferenc¸aestatisticamente significativa.
A S. boulardii foi administrada pela primeira vez 2,63 dias após o nascimento (intervalo: um a seis dias; em 46 neonatos em três dias, apenas em cinco neonatos entre o dia quatro e o dia seis). O número total de dias deadministrac¸ãodeS. boulardiifoi,em média,25,3dias (intervalo:novea28dias).
Tolerânciadealimentac¸ão
Randomizado
Grupo S. boulardii
Grupo C: sem probióticos
Desistência Desistência
Alocados para o grupo S. boulardii
Alocados para o grupo C Neonatos prematuros e com baixo peso ao nascer que atenderam aos
critérios de inclusão n = 125
Figura1 Fluxogramadoestudo.
Tabela 1 Características (média+1 DP) dos neonatos incluídos
S.boulardii Controle
Pesoaonascer(g) 1947±54 1957±51 Idadegestacional
(semanas)
33+0,72 33+1,04
Meninos/Meninas 27/24 24/25
Dificuldades respiratórias
5 6
Hiperbilirrubinemia(n◦
(%))
16(31,4%) 14(28%)
Bilirrubinamáximatotal (mol/L)
18,5±2,2 19,4±2,8
Anemia(n◦(%)) 23(45,1%) 25(51,0%)
Tratamentocom antibióticos(n◦(%))
11(21,6%) 9(18,4%)
Dificuldadesrespiratórias:incluisíndromedodesconforto
respi-ratórioesíndromedopulmãoúmido.
S,Saccharomyces;p>0,05(todos)
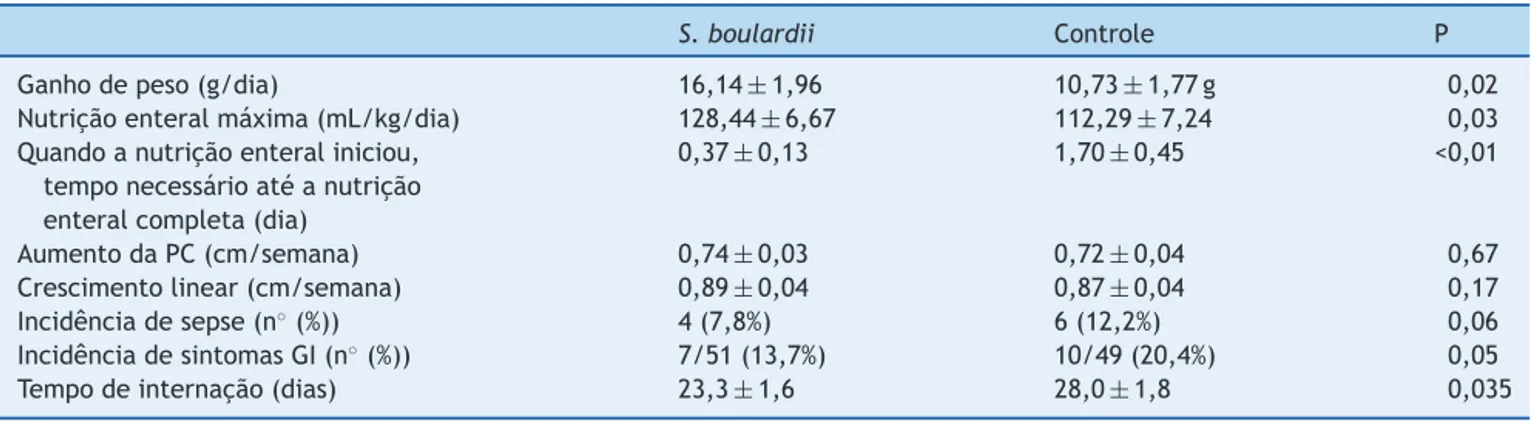
p<0,05)foimaiornogrupoquerecebeuS.boulardiidoque nogrupode controlee o temponecessário paraatingir a nutric¸ão enteral completa (0,4±0,1em comparac¸ão com 1,7±0,5dia, p<0,05)foi menornogrupo deintervenc¸ão doquenogrupodecontrole(tabela2).
Crescimentoetempodeinternac¸ão
O ganho de peso no grupo que recebeu S.boulardii
foi de 16,14±1,96g/kg/dia em comparac¸ão com 10,73±1,77g/kg/dia (p<0,05) no grupo de controle. Não houve diferenc¸a significativa em crescimento linear, crescimentodoperímetrocefálico,incidênciadedistensão abdominale incidência de sepse (tabela 2). O tempo de internac¸ãodogrupoS. boulardiifoimaiscurto(p=0,035) (tabela2).NenhumneonatodesenvolveuECN.
Efeitosadversos
Nenhumprematurodesenvolveufungemia.Nenhumareac¸ão adversaàS.boulardiifoirelatada.
Discussão
Mostramosque a S. boulardii pode ser administrada com seguranc¸aem neonatosprematurose quemelhora a tole-rânciadealimentac¸ãooraleoganhodepeso.Emneonatos atermo,provou-sequeafórmulacomplementadacom Lac-tobacillus(L.) rhamnosus GGaumentou o ganhode peso, porémfórmulascomplementadascomBifidobacterium(B.) longum, B. animalis subsp. lactis e L. reuteri não cau-saram o mesmo efeito.11---13 Em neonatos prematuros, a
administrac¸ão de B. breve tambémmelhorou o ganhode peso.14Osmecanismospormeiodosquaisoganhodepeso
éafetadoaindanãoestãoclaros.
AS.boulardiiéeficaznotratamentodeváriasdoenc¸asGI relacionadasàpresenc¸adepatógenosbacterianosevirais.15
Ela compete com patógenos por locais de ligac¸ão e pro-duz umaampla gamade substâncias antimicrobianas.16 A
S.boulardiitemcapacidadedeproduzirpoliaminas, subs-tânciasessenciaisaocrescimentoeàdiferenciac¸ãocelular, e de melhorar a maturac¸ão, refletida em maiores níveis deexpressão enzimática.17 A S. boulardiié umalevedura
Tabela2 Comparac¸ãodopesodeganho,crescimento (média+1DP),tolerânciadealimentac¸ão,eventosadversos(sepse, sintomasgastrointestinais)edurac¸ãodainternac¸ãoentreoS.boulardiieogrupodecontrole
S.boulardii Controle P
Ganhodepeso(g/dia) 16,14±1,96 10,73±1,77g 0,02
Nutric¸ãoenteralmáxima(mL/kg/dia) 128,44±6,67 112,29±7,24 0,03
Quandoanutric¸ãoenteraliniciou, temponecessárioatéanutric¸ão enteralcompleta(dia)
0,37±0,13 1,70±0,45 <0,01
AumentodaPC(cm/semana) 0,74±0,03 0,72±0,04 0,67
Crescimentolinear(cm/semana) 0,89±0,04 0,87±0,04 0,17
Incidênciadesepse(n◦(%)) 4(7,8%) 6(12,2%) 0,06
IncidênciadesintomasGI(n◦(%)) 7/51(13,7%) 10/49(20,4%) 0,05
Tempodeinternac¸ão(dias) 23,3±1,6 28,0±1,8 0,035
queaumentadeformasignificativaaatividadedasenzimas metabólicasna mucosaintestinal,estimula a secrec¸ãode enzimashidrolisantesdedissacarídeos,participano meta-bolismoenaabsorc¸ãodecarboidratoseestimulaaproduc¸ão deIgAsecretóriocomoresultadodeumefeitotróficosobre amucosa intestinal.18 Além disso, a S. boulardiipromove
a estabilidade do microbioma intestinal e reduz a possi-bilidade de má absorc¸ão causada por distúrbios GI.19 A
translocac¸ãodaS.boulardiinãofoirelatada; pelo contrá-rio, foi relatado que a S. boulardii reduz a translocac¸ão bacteriana.20 Com base nessas propriedades, trabalhamos
comahipótesedequeaS.boulardiipodemelhoraro cres-cimentoeosresultadosclínicosemneonatosprematurosou combaixopesoaonascer.
Apesar devários ensaiosclínicos sugeriremfortemente umlugarparaaS.boulardiinaprevenc¸ãoenotratamento devárias doenc¸as GI em adultos e crianc¸as, osdados em neonatosprematurossãolimitados.18 Afórmula
suplemen-tadadaS.boulardiimostrou-sebemtoleradaporneonatos prematuroseapresentouefeitosbenéficossobreo microbi-omaGI,tornou-oparecidocomodosbebêsamamentados.11
Osensaiosclínicosemneonatosprematurostambém sugeri-ramqueaS.boulardiiapresentoumelhorianatolerânciade alimentac¸ãoereduziuoriscodesepse.21,22Afimdeatingir
ocrescimentoidealdeumprematuro,oobjetivoéimitaro crescimentointrauterinoaomesmotempoemqueseobtém umresultado funcionalcomparável a nascidos a termo.23
Recomenda-seumganhode peso de15 a 20g/kg/dia,de comprimentode0,7a1,0cm/semanaedeperímetro cefá-licode0,7cm/semana.24,25 NogrupoS. boulardii,o ganho
de peso médio foi de 16,14g/kg/dia, crescimento linear de 0,9cm/semana e aumento do perímetro cefálico de 0,7cm/semana,respectivamente.Oganhodepesonogrupo decontrolefoide10,73g/kg/dia,abaixodarecomendac¸ão. O número de dias para alcanc¸ar a nutric¸ão enteral com-pleta foi menor no grupo S. boulardii do que no grupo de controle. O maior ganho de peso provavelmente está relacionadoàmelhoriadatolerânciadealimentac¸ão. Obser-vamos que a incidência de vômito, volume de resíduos gástricose distensãoabdominal(‘‘sintomasGI’’,tabela2) diminuíramnogrupodeintervenc¸ãoemcomparac¸ãocomo grupodecontrole,emboranãohouvessediferenc¸a estatís-ticasignificativa.O tempodeinternac¸ão totalnohospital nogrupoS. boulardiifoimaiscurtodoqueo dogrupode controle.
Não observamos uma diferenc¸a significativa no cresci-mento linear e na evoluc¸ão doperímetro cefálico, o que pode estar relacionado ao curto período de intervenc¸ão de um mês. Outras limitac¸ões deste estudo são a falta deinformac¸õessobrecaracterísticasclínicaspós-nataisdos neonatos,que podemserfatoresqueinfluenciamo resul-tado, como o índice de persistência do canal arterial, hemorragia intraventricular e outros. Faltam informac¸ões sobre o número de neonatos com fatores predisponentes paraECN,sepseououtrosproblemascomopré-eclâmpsia, usopré-nataldeesteroides,rupturaprematurade membra-nase partocesáreo. A ausênciadeamamentac¸ãoé outra fragilidadedoestudo.
UmarecenterevisãoCochranerelatou24ensaiosclínicos sobreprobióticosemneonatosprematuroseconcluiuqueos ensaioseramaltamentevariáveisnoquedizrespeitoaos cri-tériosdeinclusão(pesoaonascer,idadegestacional),risco
básicodeECN, cronograma,dose, formulac¸ão dos probió-ticos eregimesdealimentac¸ão.8 Asuplementac¸ãoenteral
comprobióticosreduziusignificativamenteaincidênciade ECNgrave(estágioIIousuperior)(riscorelativo[RR]típico 0,43,intervalodeconfianc¸a[IC]de95%0,33a0,56;20 estu-dos,5.529neonatos)edemortalidade(RRtípicode0,65,IC de95%0,52a0,81;17estudos,5.112neonatos).8Deacordo
comessametanálise,nãohaviaevidência deumareduc¸ão significativade sepse hospitalar (RRtípico de 0,91,IC de 95% 0,80 a 1,03; 19 estudos,5.338 neonatos).8 Em nosso
ensaio,nenhumprematurodesenvolveuECN;isso provavel-menteestárelacionadoaofatodequeaidadegestacional parainclusãoerade30-37semanasequeoECNocorrecom maisfrequênciaemneonatosnascidoscomumaidade ges-tacional menor. Ensaiosclínicosanterioresmostraram que asuplementac¸ãocomS.boulardiinãoreduziuaincidência deóbitonemdeECNemneonatoscommuitobaixopesoao nascer,masmelhorouatolerânciadealimentac¸ãoereduziu oriscodesepseclínica,aomesmotempoemquenãoforam observados efeitos adversos relacionados à ingestão de
S.boulardii.21,22
AS.boulardiiteveumefeitoprotetorcontravários pató-genosentéricospordoismecanismosprincipais:produc¸ãode fatoresqueneutralizamastoxinasbacterianasemodulac¸ão dacélulahospedeira,oquesinalizaaviaimplicadana res-posta pró-inflamatória durante a infecc¸ão bacteriana.18,19
Além disso, a S. boulardii pode aumentar a atividade das células T reguladoras e secrec¸ão de IgA de célu-las do epitélio e das criptas intestinais e melhorar a protec¸ãointestinalpormeioderegulac¸ãoimmune.18Neste
estudo,nãohouvediferenc¸aestatisticamentesignificativa na incidência de sepse entre os dois grupos (4/51 em comparac¸ão com 6/49). Esse achado está de acordo com aanálisedeCochrane,mostraqueosensaiosclínicos incluí-dos não relataram infecc¸ão sistêmica com o organismo probiótico suplementar.8 A fungemia de S. boulardii foi
relatadaempacientescomacessovenosocentral.18 Neste
ensaio clínico,nãohouvecasodefungemiae nãoocorreu efeito colateral. Osautores da recente revisão Cochrane concluíram que a versão atualizadadas evidências dispo-níveis justifica fortemente uma alterac¸ão na prática, o que significa que os probióticos devem ser administrados em neonatos prematuros para diminuir o risco de ECN e mortalidade.8
Emconclusão,osresultadosdesteestudomostramqueo usoprofiláticodeS.boulardiiemneonatosprematuros ace-leraoganhodepesoemelhoraatolerânciadealimentac¸ão. Esses dadosconfirmam umaanálise retrospectiva recente que concluiu que os probióticos melhoram a tolerância de alimentac¸ão e levam a um crescimento geral melhor em neonatos prematuros.26 Pela primeira vez, sugere-se
maiorganhodepesoemneonatosprematurosque recebe-ram S. boulardii. São necessários futuros ensaios clínicos duplo-cegos controladospor placebo paraconfirmar esses dados.
Conflitos
de
interesse
Referências
1.ColladoMC,CernadaM,NeuJ,Pérez-MartínezG,GormazM, VentoM.Factorsinfluencinggastrointestinaltractand micro-biota immune interaction in preterm infants. Pediatr Res. 2015;77:726---31.
2.SchwiertzA,GruhlB,LöbnitzM,MichelP,RadkeM,BlautM. Developmentoftheintestinalbacterialcompositionin hospita-lizedpreterminfantsincomparisonwithbreast-fed,full-term infants.PediatrRes.2003;54:393---9.
3.ChauhanM,HendersonG,McGuireW.Enteralfeedingforvery lowbirthweightinfants:reducingtheriskofnecrotising ente-rocolitis.ArchDisChildFetalNeonatalEd.2008;93:F162---6.
4.FoodandAgricultureOrganizationoftheUnitedNations(FAO), WorldHealthOrganization(WHO).Guidelinesfortheevaluation ofprobioticsinfood.ReportofaJointFAO/WHOWorkingGroup ondraftingguidelinesfortheevaluationofprobioticsinfood. London,Ontario,Canada:FAO,WHO;2002.
5.Deshpande G, Rao S, Patole S. Probiotics for prevention of necrotising enterocolitisin pretermneonates with very low birthweight:asystematicreviewofrandomisedcontrolled tri-als.Lancet.2007;369:1614---20.
6.Wang Q, Dong J, Zhu Y. Probiotic supplement reduces risk of necrotizing enterocolitis and mortality in preterm very low-birth-weightinfants:anupdatedmeta-analysisof20 ran-domized,controlledtrials.JPediatrSurg.2012;47:241---8.
7.DeshpandeGC,RaoSC,KeilAD,PatoleSK.Evidence-based gui-delinesforuse ofprobioticsinpretermneonates.BMC Med. 2011;9:92.
8.AlFalehK,AnabreesJ.Probioticsforpreventionofnecrotizing enterocolitisinpreterminfants.CochraneDatabaseSystRev. 2014;4:CD005496.
9.Vendt N, Grünberg H, Tuure T, Malminiemi O, Wuolijoki E, Tillmann V, et al. Growth during the first 6 months of life in infants using formula enriched with Lactobacillus rham-nosus GG: double-blind,randomized trial. JHum NutrDiet. 2006;19:51---8.
10.SenterreT.Practiceofenteralnutritioninverylowbirthweight andextremelylowbirthweightinfants.WorldRevNutrDiet. 2014;110:201---14.
11.CostalosC,SkouteriV,GounarisA,SevastiadouS,Triandafilidou A,EkonomidouC,etal.Enteralfeedingofprematureinfants withSaccharomycesboulardii.EarlyHumDev.2003;74:89---96.
12.Puccio G, Cajozzo C, Meli F, Rochat F, Grathwohl D, Stee-nhoutP.Clinicalevaluationofanewstarterformulaforinfants containingliveBifidobacteriumlongumBL999andprebiotics. Nutrition.2007;23:1---8.
13.WeizmanZ,AlsheikhA.Safetyandtoleranceofaprobiotic for-mulainearlyinfancycomparingtwoprobioticagents:apilot study.JAmCollNutr.2006;25:415---9.
14.KitajimaH,SumidaY,TanakaR,YukiN,TakayamaH,Fujimura M.Earlyadministration ofBifidobacteriumbreve topreterm infants:randomisedcontrolledtrial.ArchDisChildFetal Neo-natalEd.1997;76:F101---7.
15.ElmerGW.Probiotics:‘‘livingdrugs’’.AmJHealthSystPharm. 2001;58:1101---9.
16.TalaricoTL,CasasIA,ChungTC,DobrogoszWJ.Productionand isolationofreuterin,agrowthinhibitorproducedby Lactoba-cillusreuteri.AntimicrobAgentsChemother.1988;32:1854---8.
17.ButsJP.Polyamines inmilk,inbioactivefactorsinmilk.Ann Nestle.1996;54:98---104.
18.VandenplasY,SalvatoreS,VieiraM,DevrekerT,HauserB. Pro-bioticsininfectiousdiarrhoeainchildren:aretheyindicated? EurJPediatr.2007;166:1211---8.
19.McFarlandLV.Systematicreviewandmeta-analysisof Saccha-romyces boulardii in adultpatients. World J Gastroenterol. 2010;16:2202---22.
20.Villar-García J,Hernández JJ,Güerri-Fernández R,González A, Lerma E, Guelar A, et al. Effect of probiotics ( Saccha-romycesboulardii)onmicrobialtranslocationandinflammation inHIV-treatedpatients:adouble-blind,randomized, placebo--controlledtrial.JAcquirImmuneDeficSyndr.2015;68:256---63.
21.SerceO,BenzerD,GursoyT,KaratekinG,OvaliF.Efficacyof
Saccharomycesboulardiionnecrotizingenterocolitisorsepsis inverylowbirthweightinfants:arandomisedcontrolledtrial. EarlyHumDev.2013;89:1033---6.
22.Demirel G, Erdeve O, Celik IH, Dilmen U. Saccharomyces boulardii for prevention of necrotizing enterocolitis in pre-terminfants: a randomized, controlledstudy.Acta Paediatr. 2013;102:e560---5.
23.Agostoni C,BuonocoreG, CarnielliVP,DeCurtis M,Darmaun D,DecsiT,etal.Enteralnutrientsupplyforpreterminfants: commentaryfromtheEuropeanSocietyofPaediatric Gastro-enterology,HepatologyandNutritionCommitteeonNutrition. JPediatrGastroenterolNutr.2010;50:85---91.
24.GeorgieffMK.Nutrition.In:MacDonaldMG,SeshiaMM,Mullet MD,editors.Avery’sneonatologypathophysiologyand manage-mentofthenewborn.6ed.Philadelphia:LippincottWilliams andWilkins;2005.p.380---1.
25.UhingMR,Das UG.Optimizinggrowthinthepreterminfant. ClinPerinatol.2009;36:165---76.