P
P
r
r
o
o
d
d
u
u
ç
ç
ã
ã
o
o
d
d
e
e
Q
Q
u
u
i
i
t
t
o
o
s
s
a
a
n
n
a
a
s
s
e
e
p
p
o
o
r
r
A
A
s
s
p
p
e
e
r
r
g
g
i
i
l
l
l
l
u
u
s
s
o
o
c
c
h
h
r
r
a
a
c
c
e
e
u
u
s
s
e
e
m
m
C
C
u
u
l
l
t
t
i
i
v
v
o
o
D
D
e
e
s
s
c
c
o
o
n
n
t
t
í
í
n
n
u
u
o
o
S
S
u
u
b
b
m
m
e
e
r
r
s
s
o
o
Dissertação apresentada ao Programa de
Pós-Graduação em Engenharia Química da
Universidade Federal do Rio Grande do
Norte – UFRN, em cumprimento às
exigências para obtenção do grau de Mestre
em Engenharia Química.
Raimundo Cosme da Silva Filho
N
SILVA FILHO, Raimundo Cosme da – Produção de Quitosanase por Aspergillus ochraceus em Cultivo Descontínuo Submerso. Dissertação de Mestrado, UFRN, Programa de
Pós Graduação em Engenharia Química. Área de Concentração: Engenharia de Processos, Engenharia Bioquímica e Alimentos, Natal/RN, Brasil.
Orientador: Prof. Dr. Everaldo Silvino dos Santos
Co-orientador: Prof. Dra. Gorete Ribeiro de Macedo
RESUMO: No presente trabalho utilizou-se um planejamento fatorial 24 com repetição em triplicata no ponto central, para se investigar a influência dos fatores: concentração de quitosana (substrato) (Cs), temperatura de cultivo (TMC), razão de aeração (RA) e agitação (A) na produção da enzima quitosanase por AAssppeerrggiilllluuss oocchhrraacceeuuss.. Os ensaios foram
realizados aleatoriamente utilizando-se os seguintes níveis para os fatores: (Cs) (-1) 0,1%; (0) 0,15%; (+1) 0,2%; (TMC) (-1) 25 minutos; (0) 30 minutos; (+1) 35 minutos; (RA) (-1) 0,4; (0) 0,6; (+1) 0,8; (A) (-1) 90 rpm, (0) 120rpm, (+1) 150 rpm. Uma unidade de atividade quitosanolítica (U.mL-1) foi definida como a quantidade de enzima necessária para produzir
(1,0 Pmol.min-1) de glicosamina por mL de extrato enzimático. Para o teste de atividade quitosanolítica foram utilizados dois volumes diferentes de caldo enzimático 0,05 mL e 0,1 mL, respectivamente. Os resultados mostraram que foi possível produzir quitosanase em concentração aproximada de 5,9 U.mL-1 utilizando
Aspergillus ochraceus e que a atividade
foi favorecida pelo aumento da agitação (A), da razão de aeração (RA) e da concentração de substrato (Cs), enquanto que o aumento da temperatura de cultivo (TMC) não favoreceu a resposta (atividade quitosanolítica).
BANCA EXAMINADORA: Presidente:
Prof. Dr. Everaldo Silvino dos Santos
Membros:
Profª. Dra. Gorete Ribeiro de Macedo (DEQ/UFRN) Profª. Dra. Telma Teixeira Franco (FEQ/UNICAMP)
Profª. Dra. Roberta Targino Pinto Correia (AGROPECUÁRIA/UFRN)
ABSTRACT
In this work a 24 factorial design with triplicate at central point was used in order to investigate the influence of chitosan concentration (substrate) (Cs), culture media temperature (CMT), aeration ratio (AR) as well as agitation (A) on chitosanase production by
A
Assppeerrggiilllluuss oocchhrraacceeuuss.. Experiments were carried out using the following levels to the
factors: (Cs) (-1) 0.1%; (0) 0.15%; (+1) 0.2%; (TMC) (-1) 25 minutes; (0) 30 minutes; (+1) 35 minutes; (RA) (-1) 0.4; (0) 0.6; (+1) 0.8; (A) (-1) 90 rpm, (0) 120 rpm, (+1) 150 rpm. One chitosanolytic activity (U.mL-1) was defined as the enzyme necessary to produce 1.0
Pmol.min-1 of glicosamine by mL of extract. Chitosanolytic assays were carried out using two extract volumes, 0.05 and 0.1 mL, respectively. Results showed that was possible to produce chitosanase of order aproximatelly 5,9 U.mL-1 by AAssppeerrggiilllluuss oocchhrraacceeuuss and
chitosanolytic activity was increased by increment on substrate concentration, aeration ratio as well as agitation while media culture temperature increment decreased activity.
DEDICATÓRIA
A Deus, por me ceder a oportunidade de iniciar e concluir este trabalho.
À minha mãe e toda minha família pelo apoio e incentivo em todos os momentos da minha vida.
AGRADECIMENTOS
Ao professor Everaldo Silvino dos Santos pela amizade, orientação e dedicação em todas as etapas de desenvolvimento deste trabalho.
A professora Gorete Ribeiro de Macedo pelos conselhos e críticas quando necessário ao desenvolvimento deste trabalho.
Aos amigos do Laboratório de Engenharia Bioquímica, Giovana, Albina, Andréa, Laerte, Franklin, Márcio, Sanderson, Fabiana, Júlio, Ângela e Ana Carmem que me ajudaram de alguma forma nesse trabalho.
Aos funcionários Mazinha e Medeiros pelo apoio.
A Alex e Bruna pela grande colaboração nos experimentos do laboratório.
A Tiago pela grande colaboração e dedicação, o qual não poupou esforços nem tempo em me ajudar na realização dos experimentos em laboratório.
À Dra. Márcia Pedrini pelas sugestões fornecidas, as quais contribuíram para um bom desempenho deste trabalho.
Ao Laboratório de Engenharia Bioquímica da UFRN por ter cedido toda a sua estrutura para realização dos experimentos.
SUMÁRIO
LISTA DE FIGURAS... x
LISTA DE TABELAS...xii
NOMENCLATURA ...xiv
CAPÍTULO I ... 1
INTRODUÇÃO GERAL ... 1
1.1. Introdução...2
1.2. Alguns dados da carcinicultura no Brasil...2
1.3. Obtenção de Produtos de Maior Valor Agregado a partir de Resíduos da Carcinicultura...3
CAPÍTULO II... 5
ASPECTOS TEÓRICOS... 5
2.1. Fungos...6
2.1.1. Características gerais ...6
2.1.2. Reprodução dos Fungos...7
2.1.3. Metabolismo de fungos...8
2.1.4. Nutrição de fungos...9
2.2. Enzimas...9
2.2.1. Classificação e Nomenclatura das Enzimas...11
2.3. Cinética Enzimática...12
2.3.1. Catálise...12
2.3.1.1. Característica do catalisador...12
2.3.1.2. Influência da Concentração de Enzima...13
2.3.1.3. Influência do pH ...13
2.3.1.4. Efeito da Temperatura ...13
2.3.2. Sistema Uni-reacional Simples – Tratamento em Equilíbrio Rápido (Henri, Michaelis e Menten) ...14
2.3.3. Inibição Enzimática ...15
2.3.4. Inibidores Reversíveis...15
2.3.5. Inibição Competitiva...15
2.3.6. Inibição não Competitiva...16
2.3.8.1. Unidade de enzimas e atividades específicas – Quantificação de [E]t...17
2.4. Fermentação...17
2.4.1. Preparo do inóculo ...17
2.4.2. Produção de enzimas em cultivo submerso descontínuo...18
2.5. Quitosana e seus derivados...18
2.5.1. Glicosamina ...20
2.5.2. Sulfato de glicosamina...20
2.6. Quitosanases...21
CAPÍTULO III ... 22
ESTADO DA ARTE... 22
CAPÍTULO IV... 27
MATERIAL E MÉTODOS ... 27
4.1. Material...28
4.1.1. Quitosana...28
4.2. Métodos de análise e preparo do inóculo...28
4.2.1. Seleção da cepa...28
4.2.2. Meios ...29
4.2.2.1 – Manutenção...29
4.2.2.2 – Inóculo ...29
4.2.2.3 – Cultivo ...29
4.2.3. Preparo do inóculo ...29
4.2.4. Determinação da Concentração Celular (Massa Seca) ...29
4.2.5. Determinação da Proteína Total...30
4.3. Padronização ou Estudo da determinação da atividade quitosanolítica...30
4.3.1. Planejamento Experimental para Avaliação da Atividade Quitosanolítica ...31
4.4. Ensaio Cinético...31
4.5. Produção da enzima quitosanase em cultivo descontinuo submerso Incubador Rotativo (Planejamento Experimental)...32
4.6. Planejamento Experimental para Produção da Enzima em Cultivo Submerso...32
CAPÍTULO V ... 34
RESULTADOS E DISCUSSÃO ... 34
5.1. Seleção das cepas produtoras de quitosanase...35
5.2. Avaliação da Atividade Quitosanolítica...36
5.4. Planejamento Experimental para Produção de Quitosanase por Aspergillus
ochraceus em Cultivo Descontínuo Submerso...43
CONCLUSÕES... 58
REFERÊNCIAS BIBLIOGRÁFICAS ... 61
LISTA DE FIGURAS
Figura 1 – Estrutura das Hifas ...7
Figura 2 – Conídios de Aspergillus...8
Figura 3 – Estrutura da quitosana ...19
Figura 4 – Estrutura da glicosamina...20
Figura 5 – Estrutura do sulfato de glicosamina ...20
Figura 6 – Fotografia do Aspergillus ochraceus mantido em meio CZA ...36
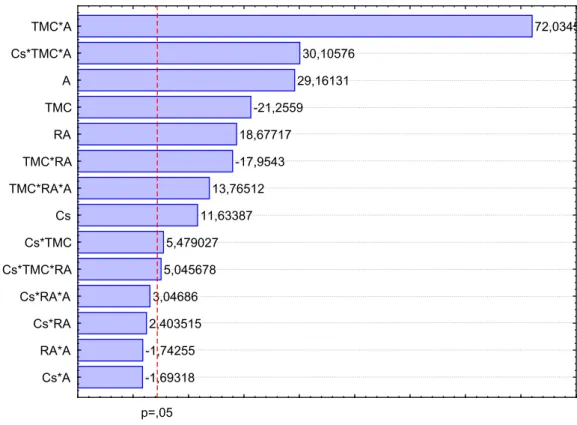
Figura 7 – Gráfico de Pareto do planejamento experimental 23com triplicata no ponto central mostrando a influência dos fatores estudados...37
Figura 8 – Atividade quitosanolítica em função de t e V para C no ponto centrals ...39
Figura 9 – Atividade quitosanolítica em função de t e Cs para V no ponto central ...39
Figura 10 – Atividade em função de C e V para t no ponto centrals ...40
Figura 11 – Perfis cinéticos para o processo de produção de quitosanase por Aspergillus Ochraceusem meio de cultivo contendo 0,2% de quitosana ...41
Figura 12 – Atividade quitosanolítica produzida por Aspergillus Ochraceus durante cultivo descontínuo submerso em meio de cultivo contendo 0,2% de quitosana ...43
Figura 13 – Gráfico de Pareto do planejamento experimental 2 com triplicata no ponto central para tempo de cultivo de 12 horas e volume de caldo enzimático de 0,05 mL. 4 ...45
Figura 14 – Valores preditos em função dos valores observados...49
Figura 15 – Superfície de resposta para atividade enzimática em função de Cs e TMC mantendo-se fixo o valor de RA e A no nível maior (+1) – Planejamento com um volume de caldo de 0,05 mL...50
Figura 16 – Gráfico de Pareto do planejamento experimental 2 com triplicata no ponto central para tempo de cultivo de 12 horas e volume de caldo enzimático de 0,1 mL. 4 ...52
Figura 17 – Valores preditos em função dos valores observados...55
Figura 18 – Superfície de resposta para atividade enzimática em função de Cs e TMC mantendo-se fixo o valor de RA e A no nível maior (+1) – Planejamento com um volume de caldo de 0,1 mL...56
Figura 19 – Curva padrão de glicosamina ...68
Figura 20 – Curva Padrão de BSA ...70
Figura 22 – Superfície de resposta para atividade enzimática em função de Cs e TMC
mantendo-se fixo o valor de RA e A nos níveis (+1) e (-1), respectivamente...73 Figura 23 – Valores preditos em função dos valores observados para o tempo de 72h e volume de caldo enzimático 0,05 mL ...75 Figura 25 – Valores preditos em função dos valores observados para o tempo de 84h e volume de caldo enzimático 0,05 mL ...78 Figura 26 – Superfície de resposta para atividade enzimática em função de Cs e TMC
mantendo-se fixo o valor de RA e A nos níveis (+1) e (-1), respectivamente...79 Figura 27 – Valores preditos em função dos valores observados para o tempo de 60h e volume de caldo enzimático 0,1 mL ...81 Figura 28 – Superfície de resposta para atividade enzimática em função de Cs e TMC
mantendo-se fixo o valor de RA e A nos níveis (+1) e (-1), respectivamente...82 Figura 29 – Valores preditos em função dos valores observados para o tempo de 72h e volume de caldo enzimático 0,1 mL ...84 Figura 30 – Superfície de resposta para atividade enzimática em função de Cs e TMC
mantendo-se fixo o valor de RA e A nos níveis (+1) e (-1), respectivamente...85 Figura 31 – Valores preditos em função dos valores observados para o tempo de 84h e volume de caldo enzimático 0,1 mL ...87 Figura 32 – Superfície de resposta para atividade enzimática em função de Cs e TMC
LISTA DE TABELAS
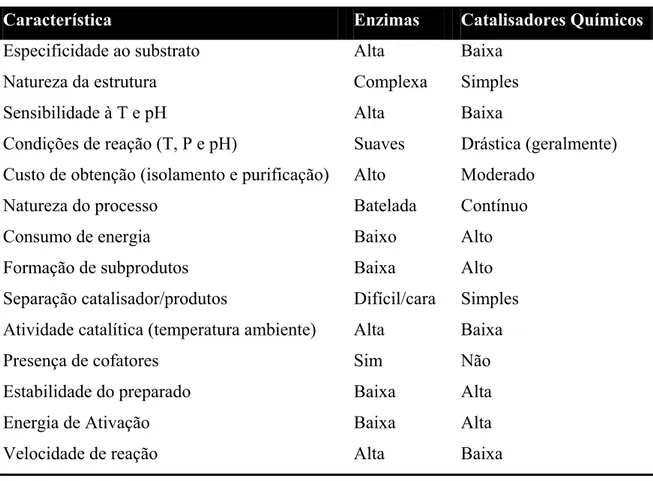
Tabela 1. Comparação das enzimas com os catalisadores químicos...11
Tabela 2. Principais classes de enzimas ...12
Tabela 3. Fontes naturais de quitina e quitosana (Fonte: Polymar, 2003)...19
Tabela 4. Níveis para os fatores e seus valores codificados...31
Tabela 5. Níveis para os fatores e seus valores codificados para o cultivo submerso...33
Tabela 6. Seleção de cepas produtoras capazes de crescer em meio CDA ...35
Tabela 7. Matriz do planejamento experimental 2 com triplicata no ponto central com os respectivos resultados da atividade enzimática 3 ...37
Tabela 8. Efeitos estimados do planejamento experimental 2 com triplicata no ponto central3 ...38
Tabela 9. Avaliação do tempo de reação para a atividade quitosanolítica ...41
Tabela 10. Matriz do planejamento experimental 2 com triplicata no ponto central com os respectivos resultados da atividade enzimática para volume de caldo fermentado de 0,05 mL. 4 ...44
Tabela 11. Efeitos estimados do planejamento experimental 2 com triplicata no ponto central para o volume da caldo enzimático 0,05mL 4 ...46
Tabela 12. Tabela ANOVA gerada pelo STATISTICA...47
Tabela 13. Resumo da ANOVA ...48
Tabela 14. Matriz do planejamento experimental 2 com triplicata no ponto central com os respectivos resultados da atividade enzimática para volume de caldo fermentado de 0,1 mL. 4 ...51
Tabela 15. Efeitos estimados do planejamento experimental 2 com triplicata no ponto central para volume de caldo fermentado de 0,1 mL. 4 ...53
Tabela 16. Tabela ANOVA...53
Tabela 17. Resumo da ANOVA ...54
Tabela 18. Dados para construção da curva de calibração usando o Método DNS ...68
Tabela 19. dados para construção da curva padrão de BSA...70
Tabela 20. Efeitos principais e interações para t = 60h e volume da caldo fermentado 0,05mL ...71
Tabela 21. Tabela ANOVA para t = 60h e volume da caldo fermentado 0,05mL...72
Tabela 23. Tabela ANOVA para t = 72h e volume da caldo fermentado 0,05mL...75 Tabela 24. Efeitos principais e interações para t = 84h e volume da caldo fermentado 0,05mL
...77 Tabela 25. Tabela ANOVA para t = 84h e volume da caldo fermentado 0,05mL...78 Tabela 26. Efeitos principais e interações para t = 60h e volume da caldo fermentado 0,1mL
...80 Tabela 27. Tabela ANOVA para t = 60h e volume da caldo fermentado 0,1mL...81 Tabela 28. Efeitos principais e interações para t = 72h e volume da caldo fermentado 0,1mL
...83 Tabela 29. Tabela ANOVA para t = 72h e volume da caldo fermentado 0,1mL...84 Tabela 30. Efeitos principais e interações para t = 84h e volume da caldo fermentado 0,1mL
NOMENCLATURA
[E]t – Concentração de enzima total [I] – Concentração de inibidor [P] – Concentração de produto P [S] – Concentração de substrato S
A – Agitação (rpm)
A – Atividade quitosanolítica (U.mL-1)
ABCC – Associação Brasileira de Criadores de Camarão AE – Atividade específica (U.mg-1)
ANOVA – Análise de variância (Analysis of Variance)
BSA –
Albumina de soro bovino
(Bovine Sereum Albumin) CDA – Chitosan Dector AgarCs – Concentração de substrato (%) CZA
–
CZAPEK ÁGARDa – Dalton
DEQ – Departamento de Engenharia Química DNS –Ácido Dinitrosalissílico
E – Enzima
Ea – Energia de ativação
EC – Comissão para nomenclatura e classificação de enzimas EP – Complexo enzima-produto
ES – Complexo enzima-substrato GA – Grau de acetilação
GL – Grau de liberdade I – Molécula de inibidor
IUB – União Internacional de Bioquímica (International Union of Biochemistry)
Keq – Constante de equilíbrio ki – Constante de equilíbrio
Km – Constante de Michaelis-Menten kp – Constante de velocidade catalítica
LEB – Laboratório de Engenharia Bioquímica MQ – Média quadrática
P – Molécula de produto pH – Potencial hidrogeniônico R2 – Coeficiente de determinação RA – Razão de aeração
rpm – Rotações por minuto S – Molécula de substrato SQ – Soma quadrática t – Tempo de reação T – Temperatura
TMC – Temperatura de cultivo (ºC) U – Unidade de atividade
Q – Velocidade instantânea
V – Volume de caldo (mL)
vd – Velocidade de dissociação do produto P vf – Velocidade de formação do produto P
1.1. Introdução
No presente, capítulo faz-se uma análise inicial da situação da carcinicultura no Brasil, como mecanismo gerador de uma alta carga de resíduos e como estudos de Engenharia Bioquímica podem utilizar esses resíduos para obtenção de produtos com maior valor agregado, como enzimas e quito-oligossacarídeos, que vem ser a força motriz para o presente trabalho.
1.2. Alguns dados da carcinicultura no Brasil
No item pesca, a carcinicultura representa hoje o ramo mais importante da aquicultura mundial com cerca de 12% do valor gerado anualmente na indústria aquícola. Entre as espécies mais cultivadas no Brasil, destaca-se o Litopenaeus vannamei originário da África.
A carcinicultura brasileira cresceu expressivamente nos últimos anos. Em 1998, o Brasil produziu 7.250 toneladas e, em 2002, ultrapassou essa marca para 60.128 toneladas representando, assim, um acréscimo de 829% em um quinqüênio. Com essa produção o Brasil passou a ser o primeiro da América Latina em carcinicultura. O país se destacou em 2002 produzindo 5,458 kg/ha/ano ultrapassando todos os produtores do mundo e, em 2003, nos períodos de janeiro a julho as exportações aumentarem em cerca de US$ 37,3 milhões (37%), contribuindo neste período de 2003 com um total US$ 138,35 milhões (cerca de 60% do total) (ABCC, 2004). Destaca-se, aqui, o papel da carcinicultura nas exportações brasileiras uma vez que o camarão de cultivo respondeu nesse período de 2003 com exportações de US$ 127 milhões contribuindo com cerca de 91% das exportações de camarão e com cerca de 55% das exportações totais. Em se tratando de carcinicultura o Estado do Rio Grande do Norte apresenta a maior produção de camarão do Brasil com cerca de 280 fazendas de camarão contribuindo com 30,77% da produção nacional seguido pelo Ceará com 27,25% e Bahia com 13,15% da produção (ABCC, 2004). O estado do Rio Grande do Norte é ainda o estado que apresenta a maior taxa de crescimento nas exportações e se forem comparadas às exportações do mês de fevereiro de 2004 com o ano de 2001 pode-se observar que apenas o mês de fevereiro de 2004 representa em torno de 24,6% das exportações do ano de 2001. Em se tratando das atividades produtivas do setor primário da economia do Nordeste a carcinicultura destaca-se na geração de empregos tendo gerado cerca de 70000 empregos, diretos e indiretos, nos seis primeiros meses de 2002.
grande parte do camarão exportado para o mercado internacional não inclui o cefalotórax deixando o mesmo como resíduo sólido que vem sendo descartado no meio ambiente. Dessa forma, o aproveitamento desses resíduos, na obtenção de produtos com maior valor agregado, reduz o impacto ambiental causado por essa atividade bem como possibilita o aumento de sua rentabilidade. Dentre os produtos que podem ser obtidos a partir das carapaças de crustáceos destacam-se a quitina e a quitosana. A quitina é um polissacarídeo abundante na natureza e sua hidrólise, química ou enzimática, produz a quitosana.
1.3. Obtenção de Produtos de Maior Valor Agregado a partir de Resíduos
da Carcinicultura
ainda agrega valor aos resíduos da carcinicultura.
Por outro lado, a produção de enzimas, assim como o seu uso, vem apresentando grande aceitação nos processos industriais uma vez que as mesmas são compostos naturais, biodegradáveis e que realizam reações específicas, ou seja, sem produzir produtos secundários.
Dessa forma, o presente trabalho visa contribuir com o desenvolvimento de um processo fermentativo para a obtenção de uma enzima, quitosanase, capaz de sintetizar oligômeros, com aplicações na indústria farmacêutica e de química fina, partindo de quitosana como única fonte de carbono. Nesse caso, a partir da obtenção de uma cepa de Aspergillus ochraceus, capaz de crescer em meio contendo quitosana como única fonte de carbono e
CAPÍTULO II
2.1. Fungos
2.1.1. Características gerais
Os fungos, por muito tempo, eram considerados como vegetais porém, a partir de 1969, foi criado um reino à parte para classificá-los, o Reino Fungi (TRABULSI e TOLEDO., 1996). Os fungos apresentam uma série de características que os diferenciam das plantas, como por exemplo:
x não são capazes de sintetizar clorofila e não apresentam celulose em sua parede celular, com algumas exceções como fungos aquáticos;
x apresentam algumas características de células animais como a capacidade de depositar glicogênio e a presença de substâncias quitinosas, em sua parede celular;
x os fungos podem ser eucarióticos, como é o caso das leveduras, ou multinucleados como os bolores, apresentando retículo endoplasmático rugoso e mitocôndrias em seu citoplasma;
x são heterotróficos podendo se alimentar de matéria orgânica viva, denominados fungos parasitários, ou morta, os chamados fungos saprofíticos;
Os fungos podem ser encontrados em diversos lugares como na água, no solo, nos animais, nos vegetais, nos seres humanos e em geral nos resíduos orgânicos (TRABULSI e TOLEDO, 1996).
Figura 1 – Estrutura das Hifas
O micélio, formado por um conjunto de hifas, que se desenvolve no interior do substrato e que é responsável pela sustentação e absorção de nutrientes é denominado micélio vegetativo. O micélio que cresce na superfície do meio de cultura é denominado micélio aéreo. Este pode ser denominado também de micélio reprodutivo, quando o mesmo se diferencia para sustentar os corpos de frutificação ou propágulos (PUTZKE e PUTZKE, 1998). Os propágulos classificam-se de acordo com a origem em externos e internos, sexuados e assexuados.
2.1.2. Reprodução dos Fungos
A reprodução dos fungos ocorre em ciclos assexuais, sexuais e parassexuais. A reprodução assexuada é feita através de brotamento, fragmentação e produção de conídios. A reprodução sexuada culmina na produção de basidiósporos, no caso de basidiomicetos. Já a reprodução parassexuada ocorre com a fusão de hifas e formação de um heterocarion no qual contém núcleos haplóides. Apesar da raridade da ocorrência desse, a reprodução parassexual é de grande importância na evolução de alguns fungos (PELCZAR et al., 1996).
A forma mais simples de reprodução assexuada é feita pelos conídios, uma vez que se produzem através de transformações do sistema vegetativo do próprio micélio. As células que originam os conídios são classificadas como células conidiogênicas.
Os conídios apresentam-se como hialinos ou pigmentados, podem ser de formas diferente (esféricos, fusiformes, cilíndricos, piriformes etc;), a parede celular pode ser lisa ou rugosa e podem ser formados por apenas uma célula ou apresentarem septos em mais de um plano; podem estar isolados ou agrupados.
do conidióforo, podendo ser ramificado ou não. Os conídios também podem originar-se em qualquer parte do micélio vegetativo e são denominados conídios sésseis como é o caso do
Trichophyton rubrum.
Alguns fungos patogênicos são identificados a partir de estruturas formadas pela célula conidiogênica e o conidióforo. Essas estruturas são denominadas: aparelho de frutificação ou conidiação. Os conídios podem formar cadeias sobre fiálides em volta de uma vesícula, dilatando a extremidade do conidióforo. Essas estruturas ocorrem em Aspergillus e
apresenta-se em forma de cabeça ao redor de uma vesícula como é ilustrada na Figura 2.
Figura 2 – Conídios de Aspergillus
2.1.3. Metabolismo de fungos
Os fungos são seres aeróbicos e heterotróficos, podendo se desenvolver em ambientes com baixa quantidade de oxigênio, como ocorre no crescimento vegetativo e na reprodução assexuada, como também em ambientes com grande quantidade de oxigênio como é o caso da reprodução sexuada.
Os fungos são capazes de produzir certas enzimas como lípases, invertases, lactases, quitosanases, proteinases, amilases, etc., que fazem a hidrólise do substrato facilitando o mecanismo de transporte ativo e passivo. Esses substratos induzem a formação de enzimas degradativas. Algumas espécies de fungos desenvolvem-se em meios que apresentam amônia ou nitrilos como única fonte de carbono. No entanto as melhores fontes de carbono para o seu desenvolvimento são carboidratos como a D-glicose e alguns sais minerais como sulfatos e fosfatos.
Os fungos apresentam uma grande faixa de temperatura ótima para o seu crescimento apresentando espécies psicrófilas, mesófilas e termófilas. De acordo com as condições nutricionais e temperatura de desenvolvimento podem apresentar morfologia diferente como ocorre na micologia médica com o fenômeno dimorfismo caracterizada com a fase micelial e leveduriforme que crescem em temperaturas variando entre 22 e 28ºC e 35 e 37ºC respectivamente, podendo ser reversíveis. A fase micelial é encontrada no solo, nas plantas e etc., enquanto a fase leveduriforme está presente nos tecidos.
O pH ideal para o desenvolvimento dos fungos varia na faixa entre 5 e 7. Destaca-se, entretanto, que a maioria dos fungos suportam grandes variações de pH como ocorre com os fungos filamentosos que podem crescer em pH variando entre 1,5 e 11, com exceção das leveduras que não suportam pH alcalino.
Os fungos crescem lentamente se comparados com as bactérias, precisando de 7 a 15 dias, ou mais, em meio de incubação para o seu desenvolvimento. Para evitar contaminação por bactérias, que podem se sobrepor ou inibir o seu crescimento, pode-se introduzir no meio de cultura um antibacteriano de largo espectro como o cloranfenicol.
Algumas espécies de fungos se desenvolvem na presença de luz, outras são inibidos e algumas podem crescer tanto na presença quanto na ausência deste agente. No entanto a irradiação solar, em geral, é prejudicial ao seu desenvolvimento, por causa da radiação ultravioleta.
2.1.4. Nutrição de fungos
De acordo com a nutrição, os fungos podem ser saprófitas (ou sapróbios), que se alimentam de matéria orgânica animal ou vegetal morta, e os parasitas que vivem no interior ou sobre organismos vivos (animais ou vegetais), no qual retira-se destes seus alimentos, absorvendo os nutrientes em vez de ingeri-los, secretam enzimas digestivas ao substrato para se desenvolverem. Estas enzimas são capazes de catalisar a quebra de moléculas grandes em moléculas pequenas para em seguida serem absorvidas pelo fungo. É devido a este processo que os fungos podem crescer dentro ou sobre os alimentos. (RAVEM, 2001).
2.2. Enzimas
atividade das células através da quebra de moléculas ou junção das mesmas para formação de novos produtos. Apresentam alto grau de especificidade ao substrato sob os quais atuam.
Certas enzimas são específicas para os tipos de ligações glicosidicas D-1,4 das moléculas de amido, enquanto que outras apresentam especificidade para determinado tipo particular de
isômero óptico como ocorre na oxidação da E-D-glicose pela glicose oxidase.
As enzimas são proteínas que apresentam em sua estrutura um centro ativo (apoenzima) e, em alguns casos, um grupo protéico denominado cofator (coenzima ou íon metálico ativo) e sua atividade depende de alguns fatores como estrutura da proteína, número de cadeias peptídicas, arranjo dessas cadeias na molécula, natureza do substrato e natureza do grupo prostético.
Todos os organismos vivos produzem, em pequena ou grande quantidade, certa variedade de enzimas, sejam elas intra ou extra celulares. As enzimas extracelulares são excretadas para o meio externo e podem decompor compostos insolúveis como celulose, quitina e quitosana.
Algumas destas enzimas podem ser usadas tanto nas indústrias de detergentes, têxteis e farmacêuticas, como também de alimentos, de bebidas, etc., sendo utilizadas em processos biotecnológicos industriais em substituição aos processos químicos que muitas vezes causam grandes prejuízos ao meio ambiente. A produção comercial das enzimas pode ser realizada através do cultivo de mecrorganismos como fungos e bactérias.
Tabela 1. Comparação das enzimas com os catalisadores químicos
Característica Enzimas Catalisadores Químicos
Especificidade ao substrato Alta Baixa
Natureza da estrutura Complexa Simples
Sensibilidade à T e pH Alta Baixa
Condições de reação (T, P e pH) Suaves Drástica (geralmente) Custo de obtenção (isolamento e purificação) Alto Moderado
Natureza do processo Batelada Contínuo
Consumo de energia Baixo Alto
Formação de subprodutos Baixa Alto
Separação catalisador/produtos Difícil/cara Simples Atividade catalítica (temperatura ambiente) Alta Baixa
Presença de cofatores Sim Não
Estabilidade do preparado Baixa Alta
Energia de Ativação Baixa Alta
Velocidade de reação Alta Baixa
2.2.1. Classificação e Nomenclatura das Enzimas
Tabela 2. Principais classes de enzimas
Primeiro EC número Classe da Enzima Tipo de reação catalisada
1. Oxirredutases Catalisam reações de oxirredução.
Transferência de H, O ou elétrons.
2. Transferases Catalisam transferências de grupos entre
moléculas
3. Hidrolases Catalisam reações de hidrolise
4. Liases Catalisam a adição de grupos a ligações
duplas e vice-versa
5. Isomerases Catalisam reações de isomerização
6. Ligases Catalisam a união de duas moléculas,
associadas à ruptura da ligação trifosfato do ATP
2.3. Cinética Enzimática
É a análise quantitativa do efeito de fatores que influenciam a atividade enzimática, analisada com o aumento ou a redução da velocidade catalítica. A cinética enzimática é determinada pelos seguintes fatores:
x Concentração de enzima;
x Concentração de cofatores;
x Concentração de substrato;
x Tipos de inibidores (se houver);
x pH;
x T;
x Força iônica.
2.3.1. Catálise
2.3.1.1. Característica do catalisador
Um catalisador biológico deve apresentar as seguintes características numa determinada reação enzimática:
x Alterar a velocidade de reação sem que haja consumo do mesmo nem apareça como produto da reação;
x Reduzir a energia de ativação
2.3.1.2. Influência da Concentração de Enzima
Em determinadas condições, a velocidade de conversão de substrato em produto pode ser proporcional à quantidade de enzima. No entanto pode-se ocorrer em desvios de linearidade devido a ocorrência de alguns fatores:
x Presença de inibidores;
x Presença de substâncias tóxicas;
x Dissociação da enzima por um ativador;
x Limitações que são impostas pelo próprio método de análise.
Para se evitar esses problemas, deve-se utilizar nos ensaios métodos confiáveis além de enzimas com elevado grau de pureza, substrato livre de contaminantes.
2.3.1.3. Influência do pH
As enzimas geralmente apresentam atividade para uma determinada faixa de pH. No entanto, em alguns casos existe um pH ótimo. Para se eliminar o efeito do pH sobre a afinidade, deve-se utilizar elevadas concentrações de substrato para que ocorra a saturação da enzima nos diferentes valores de pH. Este efeito ocorre devido as variações do estado de ionização dos constituintes do sistema a medida que ocorre a variação do pH.
As enzimas apresentam vários grupos ionizáveis existentes nos diversos estados de ionização, com isso, a atividade catalítica deve-se restringir a uma determinada faixa de pH e esta atividade deve ser medida no pH ótimo. A estabilidade das enzimas depende de alguns fatores tais como:
x Temperatura
x Força iônica
x Natureza química do tampão
x Concentração alguns preservativos
x Concentração de íons metálicos contaminantes
x Concentração de substratos ou cofatores da enzima
x Concentração de enzima
2.3.1.4. Efeito da Temperatura
x Aumento da taxa de reação;
x Decréscimo da estabilidade da proteína com a desativação térmica.
Representa-se a influência da temperatura sobre a atividade enzimática em termos de atividade ou velocidade de reação versus temperatura, isto é, em grande parte das reações a velocidade aumenta com o aumento da temperatura.
A temperatura de uma enzima produz um efeito que depende de certos fatores como pH, força iônica do meio e presença ou ausência de ligantes. Geralmente os substratos impedem a desnaturação da enzima pelo calor. Esta desnaturação térmica implica na perda da atividade.
As enzimas também apresentam uma temperatura ótima, na qual a atividade é máxima, ou seja, a temperatura máxima que a enzima apresenta atividade constante por um determinado período de tempo.
2.3.2. Sistema Uni-reacional Simples – Tratamento em Equilíbrio Rápido (Henri, Michaelis e Menten)
Ocorre quando um único substrato se transforma em um único produto. Admitindo-se que pode ocorrer inicialmente uma reação reversível entre enzima e substrato para a formação de um composto intermediário (complexo enzima-substrato), em seguida se decompõe ou reage com alguma substância formando o produto da reação e ocorre a regeneração da enzima. A seqüência da reação por:
k1 k2
E + S ES E + P k-1
Pode-se obter a equação da velocidade considerando-se as condições de equilíbrio rápido:
x E, S e ES alcançam o equilíbrio muito rápido se comparada com a velocidade de conversão de ES em E + P (etapa lenta);
x A velocidade instantânea em qualquer tempo vai depender da concentração de ES
> @
> @
M M max k S 1 k S V v (1)> @
> @
S k S V v M max(2) Equação de Henri-Michaelis-Menten
A Equação (2) refere-se a velocidade “ instantânea” ou “ inicial” relativa a Vmáx para uma determinada concentração de substrato.
Esta equação só será valida se Q for medido num tempo pequeno o suficiente a fim de que [S] permaneça constante. Por isso não se deve utilizar mais de 5% do substrato durante o o tempo de ensaio.
2.3.3. Inibição Enzimática
Qualquer substância que possa reduzir a velocidade de uma reação enzimática é denominada inibidor.
Os inibidores podem classificar-se como:
Inibidores Re competitivos
« « « ¬ ª ¯ ® eis Irreversív não os competitiv versíveis
2.3.4. Inibidores Reversíveis
Na inibição reversível, a atividade enzimática pode ser recuperada através da remoção do inibidor e caracteriza-se por apresentar um equilíbrio entre o inibidor e a enzima que é definido como constante de equilíbrio ki.
2.3.5. Inibição Competitiva
inibidor quanto o substrato promovem uma verdadeira competição pelo mesmo sítio ativo. O inibidor competitivo pode ser um:
x Análogo não metabolizável;
x Derivado de um substrato;
x Substrato substituto da enzima;
x Produto da reação.
Quando o inibidor combina-se com a enzima, ocorre uma mudança de conformação estrutural da enzima, deformando-se o sítio ativo do substrato e, conseqüentemente impedindo que o substrato se ligue.
A equação de velocidade para um sistema de inibição competitiva pode ser deduzida através das condições de equilíbrio rápido:
> @
> @ > @
S ki I 1 K S V v M max ¸ ¹ · ¨ ©§ (3)
2.3.6. Inibição não Competitiva
Na inibição não competitiva, o inibidor não produz nenhum efeito sobre a ligação com o substrato e vice-versa. Ou seja, S e I se ligam de forma reversível, aleatória e independente em sítios diferentes. O efeito final de um inibidor não competitivo é fazer parecer que a quantidade de enzima presente no meio seja menor.
A equação da velocidade de um sistema que apresente um inibidor não competitivo é dada por:
> @
> @ > @ > @
¸¸ ¹ · ¨ ¨ © § ¸¸ ¹ · ¨¨ © § i i x max k I 1 S k I 1 k S V v (4)2.3.7. Inibição Irreversível
2.3.8. Quantificação de enzimas
2.3.8.1. Unidade de enzimas e atividades específicas – Quantificação de [E]t
Em grande parte das preparações de soluções que contém enzima, a concentração real da enzima é desconhecida. Logo, a quantidade enzima contida numa solução é expressa em termos de atividade enzimátca, e a determinação desta, está diretamente ligada a medida da velocidade da reação. Segundo a União Internacional de Bioquímica, uma unidade (U) de atividade é exatamente a quantidade de enzima capaz de catalisar 1,0 micromol de substrato ou a formação de 1,0 micromol de produto por um tempo de um minuto nas condições de ensaio utilizado (temperatura, concentração de substrato, pH, agitação, etc).
U = micromoles produto/minuto
A concentração da enzima numa solução impura é dada em termos de U.mL-1. Já a atividade específica, é expressa em termos de atividade por miligrama de proteína (U.mg-1):
proteina Unidade
mL
proteina mg mg
mL Unidade
AE (5)
2.4. Fermentação
Os processos fermentativos são caracterizados por processos nos quais microrganismos realizam a conversão catalítica de uma dada substância num determinado produto. Estes processos podem ser classificados como processos descontínuos, contínuos e descontínuos alimentados. A classificação destes processos está diretamente ligada a forma de como o substrato é adicionado e como o produto é retirado. No processo de fermentação descontínuo o substrato é colocado no fermentador, em seguida é inoculado e após o término do processo o produto é retirado. Já no processo contínuo, o substrato é colocado num reator com vazão constante e o meio fermentado é retirado com a mesma vazão de entrada do reator (FACCIOTTI, 2001). Nos processo descontínuos alimentados a adição de substrato e a retirada do mesmo deve ocorrer de forma intermitente (CARVALHO E SATO, 2001a).
2.4.1. Preparo do inóculo
depender tanto do processo de fermentação como da quantidade de meio a ser fermentado (CARVALHO E SATO, 2001b).
A partir de uma cultura pura, inocula-se um volume relativamente pequeno de meio nutriente, que vai depender do tipo de microrganismo cultivado (pois cada espécie microbiana possui velocidades diferentes de crescimento), sendo, em seguida, incubado em condições favoráveis ao desenvolvimento do microrganismo. A suspensão obtida é transferida para um frasco maior em agitador e rotativo ou recíproco (shakers), que por sua vez é adequadamente
incubado, e a seguir, transferido para um frasco contendo um volume ainda maior deste meio, até se conseguir alguns litros de suspensão microbiana. Os cuidados com assepsia, volumes de meio utilizado, numero de transferência bem como as condições de incubação, podem variar de acordo com o tipo de processo de fermentação que se deseja realizar.
2.4.2. Produção de enzimas em cultivo submerso descontínuo
A produção de enzimas, usando processos fermentativos, é constituída basicamente por duas etapas: a primeira, caracteriza-se pela preparação do inóculo e a segunda, pela fermentação do substrato (CARVALHO E SATO, 2001b). A finalidade da primeira etapa é o preparo do microrganismo em condições adequadas para que possa ocorrer o desenvolvimento da segunda etapa. Diferentemente do cultivo em estado sólido, no cultivo submerso os microrganismos encontram-se em um meio com elevada atividade de água.
2.5. Quitosana e seus derivados
A quitosana e seus derivados apresentam grande importância devido ao conhecimento de suas funcionalidades biológicas, médicas, tecnológicas, etc (SHIMOSAKA et al, 1993;
SHIMOSAKA et al, 1995; MITSUTOMI et al., 1995). A quitosana é obtida da quitina,
Figura 3 – Estrutura da quitosana
Quitosana totalmente desacetilada não existe na natureza. Graus de
acetilação (GA) inferior a 50% a torna mais solúvel em soluções ácidas
(MUZZARELLI, 1993; MUZZARELLI
et al
., 1994; DUNG
et al
., 1994;
STOYACHENKO
et al
.,1994). PELLETIER e SYGUSCH (1990) enfatizaram
que grande parte dos resíduos sólidos da indústria pesqueira, principalmente da
carcinicultura, é jogada ao mar ocasionando degradação ambiental. Logo, a
utilização desses resíduos como matéria prima para formação de novos
produtos, não só reduz de forma drástica o impacto ambiental, mas também
daria maior valor agregado à indústria pesqueira.
Tabela 3. Fontes naturais de quitina e quitosana (Fonte: Polymar, 2003)
Animais Marinhos Insetos Microrganismos
Anelídios Escorpiões Leveduras
Moluscos Aranhas Fungos
Celenterados Formigas Esporos
Lagosta Besouros
Camarão Caranguejo
Krill
2.5.1. Glicosamina
A glicosamina, unidade monomérica básica da quitosana, possui atividade antiinflamatória e tem grande importância na construção e manutenção da cartilagem, no tratamento de enfermidades como: febre reumática, artrose e principalmente a artrite e osteoartrite na forma aguda ou crônica (POLYMAR, 2003). A Figura 4 apresenta a estrutura química da glicosamina.
Figura 4 – Estrutura da glicosamina
2.5.2. Sulfato de glicosamina
O sulfato de glicosamina é um derivado da quitosana sendo utilizado no tratamento da osteoartrite sintomática dos joelhos, quadris, coluna, mãos e outras regiões (CRAVEIRO et al., 1998). O sulfato de glicosamina estimula a síntese de proteoglicanos necessários para o
bom funcionamento das articulações, estimula a regeneração das cartilagens e ainda incorpora enxofre ao tecido cartilaginoso. Estudos de longa duração, acima de 3 anos, mostram que o sulfatos de glicosamina evita a progressão de danos estruturais nas articulações e induz melhora significativa nas dores e funções físicas (CRAVEIRO et al., 1998). A Figura 5
apresenta a estrutura química do sulfato de glicosamina.
2.6. Quitosanases
NOGAWA et al. (1998) estudaram a produção, purificação e caracterização total de
uma quitosanase produzida pelo fungo Trichoderma reseei PC-3-7. Estes pesquisadores
inocularam 106 conídios em 100 mL de um meio basal contendo 0.3% de N-acetilglicosamina em incubator rotativo com agitação de 220 rpm a 28oC. Destaca-se que o fungo não produziu quitosanase em meio contendo quitosana ou quitina. Entretanto, o microrganismo produziu quitosanase em meio contendo glicosamina e N-acetilglicosamina, sendo que para este último obteve-se uma atividade específica máxima de 1,5 U/mg após 72 horas de incubação. É importante ressaltar que uma agitação vigorosa favorece à produção da enzima. Esse artigo ilustra a presença de exo-E-D-glicosaminidase e exo-E-D-N-acetilglicosaminidase.
PIZAet al. (1999) estudaram a produção, purificação e caracterização parcial de uma
quitosanase produzida por Bacillus cereus. Nesse caso investigou-se através de um
planejamento fatorial fracionário a influência dos fatores: concentração de sulfato de amônio (0,4; 2,2 e 4,0%), razão de aeração (2; 6 e 7), tempo de fermentação (16; 24 e 32 horas), pH (5; 6 e 6,5) e concentração de quitosana (1,0; 1,5 e 2,0%). Os resultados mostraram que os fatores mais significativos para esse planejamento foram à concentração de sulfato de amônio, a interação entre sulfato de amônio e a aeração, a aeração e o pH, respectivamente.
CHENG e LI (2000) estudaram a preparação de oligossacarídeos utilizando quitosanase produzida por Aspergillus sp e constataram que a enzima foi largamente induzida
em meio contendo quitosana como única fonte de carbono e também na presença de quitina coloidal. A indução da enzima foi realizada em temperaturas variando na faixa de 28ºC a 30ºC, pois essa espécie não cresceu bem em temperaturas superiores a 37ºC.
ZHANG et al. (2000) estudaram a produção, purificação e caracterização de
quitosanase e Exo-E-D-Glucosaminidase por Aspergillus oryzae IAM2660. Os
KUROIWA et al. (2002) estudaram os fatores que afetam a composição de
Oligossacarídeos produzida através da hidrólise de quitosana por quitosanase originária de
Bacillus pumilus BN-262. Neste experimento foi utilizado quitosana 100% desacetilada
dissolvida em ácido acético 1M. O pH do meio foi ajustado em 5,6. Neste estudo a quitosanase foi imobilizada em Agar e Sepharose. Os resultados mostraram que a
concentração de enzima, a temperatura, a velocidade de agitação, e concentração de substrato influenciaram de forma significativa na composição dos oligossacarídeos produzidos.
ICHIKAWA et al. (2002) estudaram a imobilização e estabilização da ligação
multiponto da quitosanase tendo ágar como suporte e concluíram que a imobilização aumentou a termoestabilidade da quitosanase. Os oligossacarídeos de quitosana foram continuamente produzidos usando um reator coluna contendo quitosanase imobilizada. A percentagem de quitosana imobilizada após 28 dias de reação foi de 44%.
ZHU et al. (2003) estudaram as melhores condições fermentativas e propriedades de
uma quitosanase produzida por Acinetobacter sp. C-17. A espécie de bactéria utilizada neste
ensaio foi isolada do solo e identificada como sendo Acinetobacter sp C-17 e capaz de
produzir quitosanse. O microrganismo foi mantido em placas contendo o meio Agar com os seguintes componentes: 0,5 % de quitosana, 0,2 % K2HPO4, 0,1 % KH2PO4, 0,07 % MgSO4, 0,05 % NaCl, 0,05 % KCl, 0,01 % CaCl2, 0,05 % de extrato de levedura e 2 % Agar, o pH do meio de manutenção foi mantido em 7,2 e a temperatura foi mantida em 30ºC durante 3 a 5 dias para identificar a ação da enzima quitosanase. A ação da quitosanase foi identificada através da observação de uma colônia de microrganismo existente na placa. A bactéria foi então extraída e isolada da placa e colocada em fermentador rotativo a 200 rpm durante 72h em meio contendo: 0,07 % K2HPO4, 0,03 % KH2PO4, 0,05 % MgSO4, 003 % peptona,0,03 % de extrato de levedura e 1,0 % de quitosana. O pH foi de 7,0 e a temperatura 30ºC. Como fonte de carbono foram utilizadas além de 1,0 % de quitosana, 1,0 % de quitina e 1,0 % de glicose. Os resultados mostraram que as melhores condições para produção da quitosanase foram alcançadas quando se utilizou 1,0 % de solução de quitosana a 30ºC , pH 7,0 durante 24 horas de incubação.
LIU et al. (2003) estudaram a produção de quitinase por Verticillium lecanii F091
aeração poderiam modificar a concentração de oxigênio dissolvido afetando diretamente no crescimento do Verticillium lecanii e na produção de quitinase.
DONZELLI et al. (2003) estudaram a hidrólise enzimática avançada de quitina de
casca de caranguejo langostino com misturas de enzimas de bactérias e fungos e concluiram que a combinação de enzimas de Trichoderma atroviride e Serratia marcescens foram
capazes de degradar completamente altas concentrações de quitina (100g/mL) a partir de carapaças de caranguejo langostino convertendo a N-Acetilglicosamina (78%), glucosamina (2%) e quitobiose (10%). Enzimas de fonte procariótica apresentaram atividades, para catalisar a reação com quitosana, menores que as enzimas de T. atroviride.
CHEN et al. (2005) estudaram a purificação e a caracterização de dois tipos de
quitosanase produzidas por Aspergillus sp. CJ22-326 em cultivo submerso. Na produção da
enzima foi utilizado um meio de cultivo contendo 1,0% de quitosana, 2,0% de gérmen de trigo, 0,2% de sulfato de amônio, 0,2 % de fosfato de potássio e 0,05% de sulfato de magnésio por litro de solução em pH 5,6. O cultivo foi realizado em frasco de 500 mL contendo 150 mL de meio de cultura a 30ºC por 96 horas com uma agitação de 150 rpm. Os autores apresentam um gel de eletroforese com as duas enzimas purificadas com massa molar de 29 kDa e 109 kDa.
JO et al. (2003) estudaram caracterização e cinética de quitosanase produzida por Bacillus sp. Destaca-se que na produção da enzima utilizada neste ensaio o meio continha
0,5% de concentração de quitosana, 1% de triptona e 1% de NaCl, o pH do meio foi ajustado em 5,5 e temperatura foi mantida em 37ºC com agitação de 180 rpm em incubador rotativo.
FUet al (2003) estudaram a caracterização de três iso-enzimas de quitosanase isolada
de pepsina comercial e denominado como PSC-I, PSC-II, PSC-III, respctivamente, em relação a hidrólise enzimática da quitosana, o meio ótimo para a produção destas iso-enzima continha as seguintes características: pH 5,0; 5,0 e 4,0 e temperaturas de 40ºC, 40ºC e 30ºC, o Km foi de 5,2, 4,0 e 5,6 mg.mL-1 , respectivamente. As massas moleculares das três iso-enzimas foram de 40 kDa. Os resultados mostraram que as três iso-enzimas apresentaram atividade em meio contendo quitosana, produzindo oligômeros da ordem de 68 – 88% desacetilada.
CHOI et al. (2004) estudaram a produção, purificação e caracterização total de uma
quitosanase produzida por Bacillus sp KCTC 0377BP. Nesse caso, com relação à produção da
SHIMOSAKA et al. (2003) estudaram a produção, purificação e caracterização total
de duas quitosanases produzida por Acinetobacter sp CHB101. Nesse caso, com relação à
produção da enzima os pesquisadores usaram dois meios, um contendo glicose e outro contendo quitosana. Com relação à cinética, o meio contendo quitosana fornece um tempo de geração de 280 minutos, enquanto que no meio contendo glicose a taxa de crescimento foi mais elevada e o tempo de geração foi de apenas 110 minutos. Os autores observaram que após os dois primeiros dias de cultivo a atividade quitosanolítica permaneceu baixa (na ordem 0,10 a 0,20 U/mL). Durante a fase de crescimento exponencial o valor da atividade permaneceu com valor inferior a 0,01 U/mL, começando a aumentar ao atingir a fase estacionária, indicando assim que a produção da enzima é não associada ao crescimento.
HUNG et al. (2002) estudaram a purificação, através de troca iônica, e caracterização
da hidrólise sobre ação da quitinase e quitosanase purificadas do meio contendo Bomelina comercial. Destaca-se que a quitinase purificada apresentou pH, temperatura e Km ótimo para ação catalítica em meio contendo quitina de 4,0, 60ºC e 0,2mg.mL-1, respectivamente. Já a quitosanase apresentou o pH, temperatura e Km ótimo de 3,0, 50ºC e 0,88mg.mL-1 , respectivamente.
KIM et al. (2004) estudaram a produção, purificação e caracterização de uma
quitosanase constitutiva produzida pelo Bacillus sp e identificado pelo número 1299.
CAPÍTULO IV
Este capítulo apresenta os materiais usados e a metodologia empregada no estudo, a qual se divide em três seções. Inicialmente são apresentadas a seleção da cepa, meios de cultura empregados, preparo do inoculo e métodos gerais de análise utilizados nas seções subseqüentes. Em seguida, são abordados os testes preliminares do estudo envolvendo a padronização do método de atividade quitosanolítica e ensaio cinético. A metodologia empregada para produção da enzima em cultivo descontinuo submerso finaliza o capítulo.
4.1. Material
4.1.1. Quitosana
No presente trabalho utilizou-se duas quitosanas. A quitosana (Lote 067) obtida junto ao POLYMAR/CE, com no mínimo 80% de desacetilação foi utilizada nos ensaios em placas, em que se avaliou a atividade enzimática bem como no cultivo para a produção de quitosanase pelo Aspergillus ochraceus, por fermentação submersa. A quitosana de baixo
peso molecular (Low Molecular Weight) (Lote 02415AA) da Sigma Aldrich (OHIO/USA) foi
utilizada no cultivo em placas.
4.2. Métodos de análise e preparo do inóculo
4.2.1. Seleção da cepaUtilizou-se neste trabalho um fungo escolhido entre cinco cepas, isolado do solo, pelo pesquisador Álvaro Araújo, e disponível no Laboratório de Engenharia Bioquímica (LEB) do Departamento de Engenharia Química (DEQ) da Universidade Federal do Rio Grande do Norte. Esta linhagem foi escolhida por ser capaz de crescer em meio contendo quitosana como única fonte carbono e energia. Nesses ensaios foram utilizadas placas de Petri contendo, aproximadamente, 40 mL do meio CDA (Chitosan Dector Agar), como meio
4.2.2. Meios
4.2.2.1 – Manutenção
O meio de manutenção das células foi o meio CZAPEK AGAR, cuja composição para 1 L é dada por: 30,0g de Sacarose; 3,0g de NaNO3; 1,0g de K2HPO4; 0,5g de KCl; 0,5g de MgSO47H2O; 0,01g de FeSO4.7H2O; 15,0g de Agar.
4.2.2.2 – Inóculo
O meio de cultura para o preparo do inóculo cuja composição para 1 L é dada por: 30,0g de Sacarose; 3,0g de NaNO3; 1,0g de K2HPO4; 0,5g de KCl; 0,5g de MgSO47H2O; 0,01g de FeSO4.7H2O.
4.2.2.3 – Cultivo
O meio de cultivo, contendo quitosana como fonte de carbono, apresenta composição para 1 L é dada por: 1,0; 1,5; 2,0 g de quitosana (de acordo com a matriz do planejamento); 1,0g de NaCl; 0,5g de (NH4)2SO4; 1,0g de MgSO4; 0,5g de K2HPO4; 0,01g de ZnSO4.7H2O; 0,001g de FeSO4; 0,01g de CaCl2.2H2O; 0,0086g de MnSO4.7H2O.
4.2.3. Preparo do inóculo
No preparo do inóculo utilizou-se 8 placas cultivadas em meio CZA a 30oC durante 5 dias. A biomassa foi transferida para um Erlenmeyer de 1000 mL contendo 500 mL de meio de fermentação CZA. Destaca-se que no preparo do meio para o inóculo foram utilizados duas fontes de carbono, quitosana e sacarose (CZA), a fim de se verificar qual possibilitava um maior crescimento célular. Verificou-se, usando-se câmara de Neubauer, que o número de esporos do fungo, no meio contendo sacarose, foi da ordem de 109 em um período de aproximadamente 5 dias enquanto que no meio contendo quitosana essa concentração foi da ordem de 105 em um período de 10 dias. Esses ensaios foram realizados em incubador rotativo a 120 rpm e 30ºC.
Foi utilizado como inóculo a suspensão de células obtidas no ensaio com sacarose como fonte de carbono, pois este apresentou um maior crescimento célular e um menor tempo para atingir a concentração de 109 nas mesmas condições de ensaio.
4.2.4. Determinação da Concentração Celular (Massa Seca)
15 minutos. Em seguida, retirou-se o sobrenadante e completou-se o volume com água destilada. Repetiu-se esse procedimento por mais duas vezes. Após a terceira retirada do sobrenadante colocou-se o eppendorf na estufa por 24h pesando-se em seguida. A concentração celular em (g/L) foi obtida conforme a Equação 6.
concentração celular (g/L) = (peso do eppendorf seco – peso do eppendorf vazio)*500 (6)
4.2.5. Determinação da Proteína Total
A determinação da proteína total foi efetuada de acordo com o método modificado de SEDMAK e GROSSBERG (1977), em anexo III, que se baseia na diminuição da absorbância do corante azul de Coomassie, devido à ligação proteína-corante, a 595 nm comparado a absorção máxima a 465 nm, conforme SANTOS (2001). Nesse caso, após centrifugação para retirada da biomassa, transferi-se para um eppendorf 1,5 mL de amostra (caldo fermentado) e adicionava-se 1,5 mL de solução azul de coomassie. Deixava-se a solução em repouso por 5 minutos, transferindo-se em seguida para um cubeta de quartzo e efetuando-se as leituras de absorbância nos comprimentos de ondas 465 nm e 595 nm, respectivamente. O espectrofotômetro (Thermo Spectronic modelo Genesys 10UV) foi zerado com água destilada. O conteúdo protéico foi obtido a partir de uma curva padrão de BSA no qual mostrava-se a relação de absorbância A595/A465 para diferentes concentrações de Albumina de Soro Bovino (Fração V – Lote 110881/Sigma Aldrich-Ohio-USA).
4.3. Padronização ou Estudo da determinação da atividade quitosanolítica
banho de gelo. Após essa etapa, o sistema foi centrifugado e com o sobrenadante efetuou-se a leitura no espectrofotômetro a 580 nm. Destaca-se, que antes da leitura da amostra zerava-se o equipamento (branco do espectro) com 1,0 mL de solução tampão fosfato (50 mM, pH 7,0) acrescidos de 1,5 mL de DNS e realizava-se o branco da enzima que consistia da adição de um determinado volume de solução de quitosana, de acordo com a matriz do planejamento experimental, completando-se até um 1,0 mL com tampão fosfato (50 mM, pH 7,0).
4.3.1. Planejamento Experimental para Avaliação da Atividade Quitosanolítica
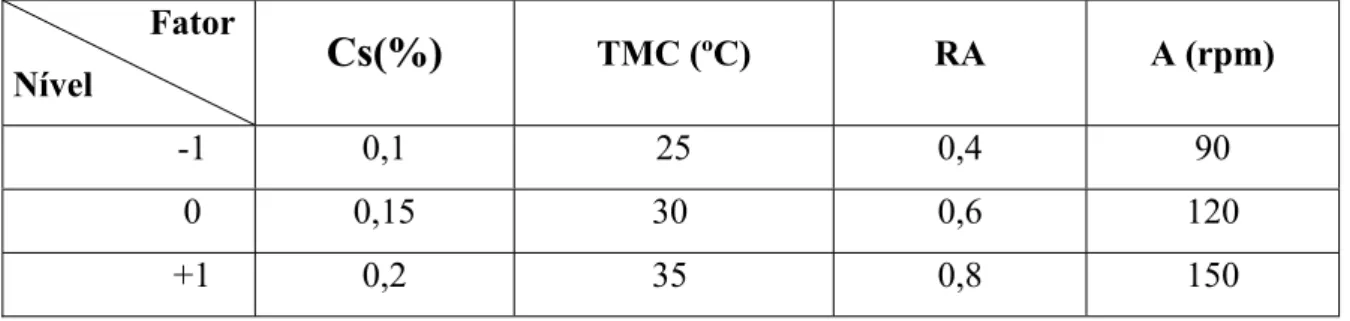
A fim de se investigar às melhores condições para a determinação da atividade enzimática efetuou-se um planejamento fatorial 23 com repetição em triplicata no ponto central para se avaliar a influência dos fatores: volume de caldo (V), concentração de quitosana (substrato) (Cs)e tempo de reação (t) na atividade quitosanolítica (A) (resposta) de caldo enzimático bruto produzido pelo fungo. A Tabela 4 apresenta os níveis para os fatores e seus valores codificados.
Tabela 4. Níveis para os fatores e seus valores codificados
Fator Nível
V (ml) Cs (%) t (min)
-1 0,2 0,2 10
0 0,5 0,6 20
+1 0,8 1,0 30
Na análise do planejamento experimental fatorial foi utilizado um pacote computacional STATISTICA for Windows versão 6.0., conforme SILVA FILHO et al, 2005.
4.4. Ensaio Cinético
cultivadas em incubador rotativo durante 108 horas a 120 rpm e 30ºC. Alíquotas foram retiradas a cada seis horas e analisadas quanto a concentração celular, proteína total no sobredanante e atividade enzimática.
4.5. Produção da enzima quitosanase em cultivo descontinuo submerso
Incubador Rotativo (Planejamento Experimental)
Nos ensaios foram utilizados frascos Erlenmyer de 250 mL com diferentes volumes de meio de cultivo, de forma a se obter diferentes razão de aeração, e concentração de substrato (quitosana), conforme matriz de planejamento (Tabela 5). O meio de cultivo continha os seguintes componentes, em 1 Litro: 1,0g de NaCl; (1,0g; 1,5g; ou 2,0g) de quitosana; 0,5g de (NH4)2SO4; 1,0g de MgSO4; 0,5g de K2HPO4; 0,01g de ZnSO4.7H2O; 0,001g de FeSO4; 0,01g de CaCl2.2H2O; 0,0086 de MnSO4.7H2O, que foram inoculadas com 10% (vol/vol) de inóculo contendo o fungo Aspergillus ochraceus (107/mL) e cultivadas em
incubador rotativo durante 108 horas, com rotações (rpm) e temperaturas (ºC) de acordo com matriz do planejamento experimental (Tabela 5).
4.6. Planejamento Experimental para Produção da Enzima em Cultivo
Submerso
Um dos problemas mais comuns para quem realiza experimentos é determinar a influência de uma ou mais variáveis sobre uma outra variável de interesse (LOBATO, 2003). Este problema pode ser minimizado utilizando-se um planejamento experimental de modo a se obter uma função, ou uma aproximação satisfatória para a mesma, de forma que se operando sobre as variáveis de entrada produza-se como saída a resposta ou as respostas observadas (BARROS NETO, 2001; SILVA, 2004).
Em um planejamento deve-se, inicialmente, definir os fatores e as respostas de interesse. Tendo-se identificado os fatores e respostas define-se o objetivo que se pretende alcançar com os experimentos para que se possa escolher o planejamento mais apropriado. (SILVA, 2004).
No presente trabalho utilizou-se um planejamento fatorial 24 com repetição em triplicata no ponto central, para se investigar a influência dos fatores: concentração de quitosana (substrato) (Cs), temperatura de cultivo(TMC), razão de aeração (RA) e agitação
(A) na atividade (resposta) de caldo enzimático bruto produzido pelo Aspergillus ochraceus
A Tabela 5 apresenta os níveis para os fatores e seus valores codificados.
Tabela 5. Níveis para os fatores e seus valores codificados para o cultivo submerso
Fator
Nível
Cs(%)
TMC (ºC) RA A (rpm)-1 0,1 25 0,4 90
0 0,15 30 0,6 120
+1 0,2 35 0,8 150
CAPÍTULO V
Neste capítulo são apresentados e discutidos os resultados obtidos no presente trabalho. Inicialmente são mostrados, e comentados, os resultados obtidos na seleção dos microrganismos disponíveis no LEB que foram capazes de crescer em placa contendo quitosana como única fonte de carbono e energia. Em seguida, apresenta-se, e discute-se, os resultados obtidos na avaliação para as melhores condições do teste de atividade quitosanolítica. Por último são apresentados e se discutidos os resultados que foram obtidos na produção de quitosanase em cultivo submerso descontínuo usando o Aspergillus ochraceus.
5.1. Seleção das cepas produtoras de quitosanase
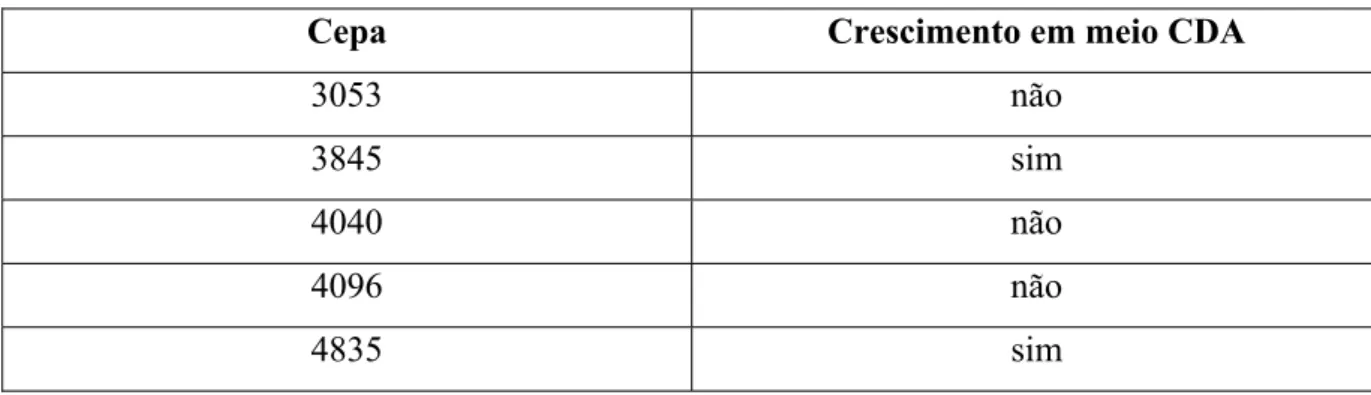
Inicialmente no Laboratório de Engenharia Bioquímica (LEB) existiam algumas cepas, isoladas previamente do solo, que foram testadas com relação a habilidade de crescer em placa contendo quitosana, como única fonte de carbono e energia (meio CDA). Dentre as cinco cepas avaliadas, apenas duas foram capazes de crescer em meio CDA, conforme Tabela 6. Inicialmente as cepas foram identificadas por código e após seleção escolheu-se a cepa que apresentou um melhor crescimento (3845) e esta foi enviada para Fundação André Tosello e identificada como Aspergillus ochraceus. Destaca-se que, pelo menos na literatura que foi
pesquisada, não foi achado registro de Aspergillus ochraceus como produtor de quitosanase,
muito embora seja conhecido que outras espécies de Aspergillus são produtores de
quitosanase como, por exemplo, Aspergillus sp. Y2K, conforme CHENG e LI (2000). A
Figura 6 ilustra uma fotografia do Aspergillus ochraceus mantido em meio CZA.
Tabela 6. Seleção de cepas produtoras capazes de crescer em meio CDA
Cepa Crescimento em meio CDA
3053 não
3845 sim
4040 não
4096 não
Figura 6 – Fotografia do Aspergillus ochraceus mantido em meio CZA
5.2. Avaliação da Atividade Quitosanolítica
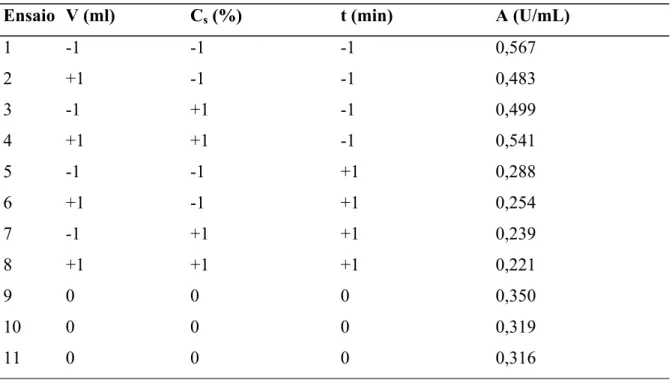
Um planejamento fatorial 23 com repetição em triplicata no ponto central foi utilizado para se avaliar a influência de alguns parâmetros como volume de caldo fermentado V (mL), concentração de substrato (CS) e tempo de fermentação (min), na produção da quitosanase utilizando Aspergillus ochraceus em cultivo descontínuo submerso. Frasco Erlenmeyers de
Tabela 7. Matriz do planejamento experimental 23 com triplicata no ponto central com os respectivos resultados da atividade enzimática
Ensaio V (ml) Cs (%) t (min) A (U/mL)
1 -1 -1 -1 0,567
2 +1 -1 -1 0,483
3 -1 +1 -1 0,499
4 +1 +1 -1 0,541
5 -1 -1 +1 0,288
6 +1 -1 +1 0,254
7 -1 +1 +1 0,239
8 +1 +1 +1 0,221
9 0 0 0 0,350
10 0 0 0 0,319
11 0 0 0 0,316
A Figura 7 mostra o gráfico de Pareto, uma das formas de se avaliar visualmente a influência dos fatores estudados na resposta. A magnitude dos efeitos é representada pelas colunas enquanto que a linha transversal às colunas representa a magnitude dos efeitos com significado estatístico para p=0,05, ou seja, os fatores que são estatisticamente significativos ao nível de 95% de confiança.
-,187823 -1,35233 -1,72797 -1,76554 -2,06605 2,667088 -20,4352 p=,05
Efeitos Estimados (Valor Absoluto) V*t Cs*t Cs V V*Cs*t V*Cs t
Analisando-se o gráfico de Pareto observa-se que o fator tempo (t) foi o que influenciou de forma mais significativa na atividade enzimática atingindo um efeito estimado de aproximadamente -19,67. O sinal negativo indica que o aumento do tempo de ensaio, ou seja, ao se passar de 10 para 30 minutos reduz-se à atividade enzimática. Uma possível explicação para a redução da atividade com o aumento do tempo seria devido à existência de de algum tipo de inibidor, tal vez o próprio substrato. Por outro lado, V e Cs bem como as interações entre esses fatores parecem desprezíveis estatisticamente conforme o gráfico de Pareto. A Tabela 8 apresenta os efeitos estimados, para os fatores principais e suas respectivas interações. Destaca-se que entre todos os efeitos calculados apenas a interação entre V e Cs (V*Cs) positiva, ou seja, embora seus valores não sejam a priori significativos a redução do
volume de caldo enzimático (V) bem como a redução da concentração de quitosana (Cs) favorece ao aumento da atividade enzimática (A).
Tabela 8. Efeitos estimados do planejamento experimental 23 com triplicata no ponto central
Efeitos Estimados; R2=0,95; Ajuste:0,834 MS Erro Puro =0,00035
Desvio Padrão Lim. Conf. Lim. Conf.
Efeito Erro Puro t(2) p -95,% +95
Média/Interação 0,370636 0,005676 65,3038 0,000234 0,346216 0,395056
V -0,023500 0,013310 -1,7655 0,219516 -0,080770 0,033770
CS -0,023000 0,013310 -1,7280 0,226134 -0,080270 0,034270
t -0,272000 0,013310 -20,4352 0,002386 -0,329270 -0,214730
V*CS 0,035500 0,013310 2,6671 0,116517 -0,021770 0,092770
V*t -0,002500 0,013310 -0,1878 0,868345 -0,059770 0,054770
CS*t -0,018000 0,013310 -1,3523 0,308884 -0,075270 0,039270
V*CS*t -0,027500 0,013310 -2,0661 0,174804 -0,084770 0,029770
Observa-se na Tabela 8 que o valor do coeficiente de determinação R2 foi de aproximadamente 95%, indicando que um modelo linear representaria bem a relação entre o fator significativo t e a resposta. Entretanto, para se ter uma resposta exata é necessário fazer uma análise de variância (ANOVA).
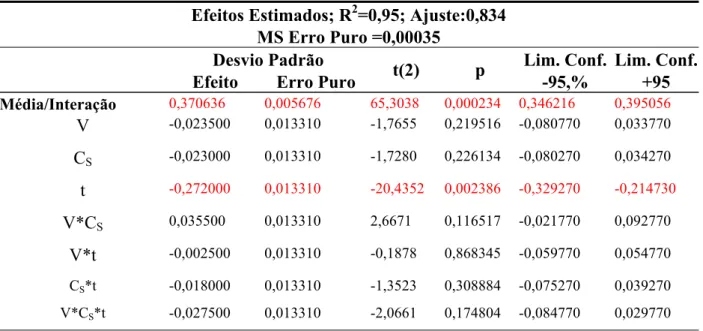
t e V para a concentração de substrato no ponto central, ou seja, Cs = 0,6 %. Observa-se que fator tempo é o que define o valor da atividade (A) obtida.
0,5 0,45 0,4 0,35 0,3 0,25 0,2
Figura 8 – Atividade quitosanolítica em função de t e V para Cs no ponto central
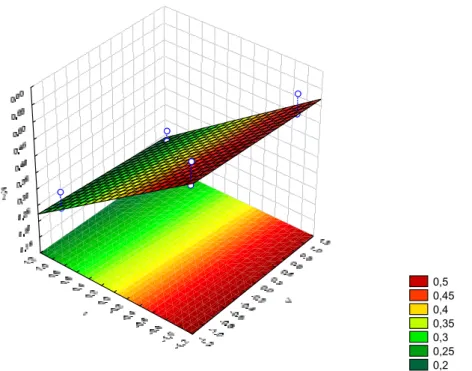
A Figura 9 mostra a atividade quitosanolítica em função de t e Cs para o volume de caldo enzimático V no ponto central, ou seja, V = 0,5 mL, a predominância de t em A é novamente observada.
0,5 0,4 0,3 0,2
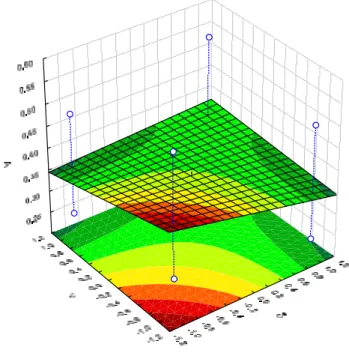
A Figura 10 mostra a atividade quitosanolítica em função de Cs e V para t no ponto central, ou seja, t = 20 minutos, observa-se nessa condição que a superfície é totalmente plana, ou seja, não apresenta inclinação indicando que a atividade quitosanolítica parece não ser influenciada diretamente por esses fatores.
0,4 0,35
Figura 10 – Atividade em função de Cse V para t no ponto central
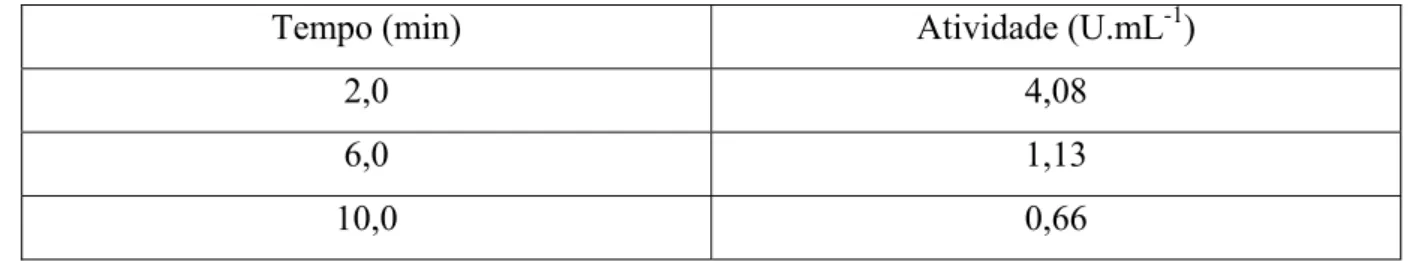
Estes resultados mostraram, a principio, que as melhores condições para se realizar os ensaios para a determinação da atividade quitosanolítica do caldo enzimático produzido pelo Aspergillus ochraceus seriam obtidos usando-se 0,2 mL de caldo bruto, uma concentração de substrato (quitosana) a 0,2% e um tempo de reação de 10 minutos. No entanto, após a realização desse planejamento experimental foram efetuados alguns ensaios de atividade com os tempos de ensaios de 2, 6 e 10 minutos, mantendo-se fixos o volume de caldo (0,2 mL) e a concentração de substrato (0,2%). Os resultados, obtidos em duplicata, mostraram que o tempo de 2 minutos apresentou melhores resultados, conforme Tabela 9.