MINISTÉRIO DA EDUCAÇÃO E CULTURA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
AVALIAÇÃO DA ATIVIDADE BIOLÓGICA DE ÓLEOS
ESSENCIAIS SOBRE
CANDIDA
NÃO
ALBICANS
DEORIGEM
CLÍNICA
MAIZA ROCHA DE ABRANTES
MAIZA ROCHA DE ABRANTES
AVALIAÇÃO DA ATIVIDADE BIOLÓGICA DE ÓLEOS
ESSENCIAIS SOBRE
CANDIDA
NÃO
ALBICANS
DEORIGEM
CLÍNICA
Tese apresentada ao Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte como requisito para a obtenção do título de Doutor em Ciências da Saúde.
Orientador: Profa. Dra. Eveline Pipolo Milan
Colaborador: Profa. Dra. Edeltrudes de Oliveira Lima - UFPB
MAIZA ROCHA DE ABRANTES
AVALIAÇÃO DA ATIVIDADE BIOLÓGICA DE ÓLEOS
ESSENCIAIS SOBRE
CANDIDA
SPP DE
ORIGEM CLÍNICA
Aprovada em: 06 de dezembro de 2013
BANCA EXAMINADORA:
Prfa. Dra. Eveline Pipolo Millan - UFRN (Presidente)
Prfa. Dra. Maria de Fátima Vitória Moura - UFRN (Membro Interno)
Prof. Dr. Cícero Flavio Soares Aragão - UFRN (Membro Interno)
Profa. Dra Raimunda Samia N. Brilhante - UFC - Fortaleza (Membro Externo)
Profa. Dra Hilzeth de Luna Freire Pessôa - UFPB (Membro Externo)
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
AGRADECIMENTOS
Agradeço a Deus pela oportunidade da vida, pelo seu amor, seu sacrifício e sua paixão por todos nós. Sem ele eu não seria nada, mas com ele me sinto forte;
Aos meus pais, Manoel e Marluce por priorizar a educação na vida de seus filhos. Agradeço em particular pelo amor incondicional e pelo incentivo; Aos meus irmãos Sales, Jackeline, Maria do Socorro e Magna que sempre foram parceiros;
A meu esposo, João José, por estar sempre ao meu lado, incentivando, confiando e torcendo pelo sucesso desse trabalho;
Aos meus filhos, Ramon e Luiza, cuja existência é fonte constante de aprendizagem, de inspiração e grande bênção;
Aos meus sobrinhos Samuel e Manuela que são alegrias em minha vida; Às minhas orientadoras Profª. Dra. Eveline Pipolo Milan e Profª. Dra Edeutrudes de Oliveira Lima pelas orientações, aprendizagem, confiança, paciência e companheirismo. Vocês foram fundamentais para o meu crescimento como profissional e como humano nesse processo, pois me fizeram entender que nenhum obstáculo é intransponível quando a necessidade de vencer supera as impossibilidades;
Aos companheiros de laboratório: Felipe Queiroga Sarmento Guerra, Camilla Pinheiro de Menezes, Janiere Pereira, Elizabeth Cristina Gomes dos Santos e Mariana Araújo Paulo de Medeiros por terem me ajudado na execução dos experimentos e terem sido luz nos momentos de dúvidas; À Profa. Dra. Zélia B. V. S. Pontes e à farmacêutica Maria de Fátima F. P.
Carvalho pela ajuda e contribuição;
Aos Professores Ivanaldo Amâncio da Silveira, Guilherme G. Chaves, Geraldo B. Cavalcanti Jr. e Francisco Ricardo Lins Vieira de Melo, pelo apoio e incentivo em prol da conquista dessa meta;
Aos professores, técnicos e funcionários do Programa de Pós-Graduação em Ciências da Saúde, minha gratidão pelas grandiosas informações e experiências adquiridas no decorrer dessa jornada;
Ao Hospital Giselda Trigueiro (HGT) e ao Hospital Pediátrico Maria Alice Fernandes, Natal-RN, pela doação e identificação bioquímica do Banco de Leveduras, em especial às farmacêuticas Ana Cristina Santos Fernandes e Maria Narriman Guimarães Goveia;
“Ao longo da torrente, em cada uma de suas margens, crescerão
árvores frutíferas de toda espécie, e sua folhagem não
murchará, e não cessarão jamais de dar frutos: todos os meses
frutos novos, porque essas águas vêm do santuário. Seus
frutos serão comestíveis e suas folhas servirão de remédio.”
RESUMO
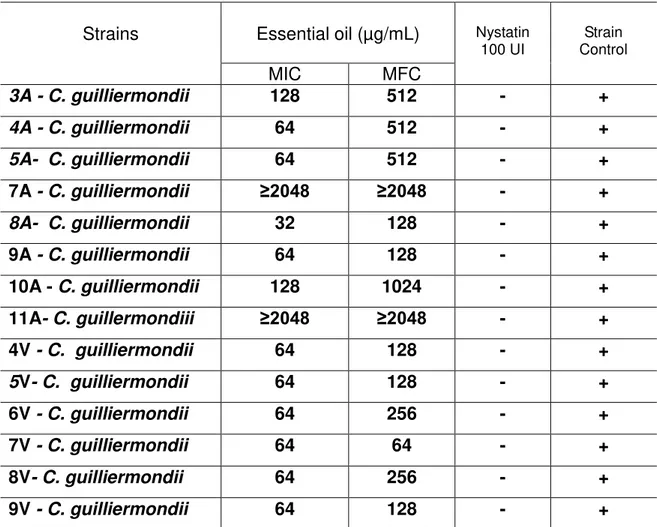
Candidíase é um problema de importância crescente, devido o aumento do número de indivíduos imunocomprometidos e o surgimento de cepas resistentes aos antifúngicos convencionais. É de fundamental importância a busca por novos agentes antifúngicos mais eficazes, menos tóxicos, sendo os óleos essenciais (OEs) excelentes alternativas para esse propósito. Esse estudo investigou a atividade biológica do OE de Mentha spicata L. sobre Candida guilliermondii de origem anal e vaginal. Para tanto foram determinadas a Concentração Inibitória Mínima (CIM), Concentração Fungicida Mínima (CFM), cinética do crescimento das leveduras (Time-Kill), alterações micromorfológicas (técnica do microcultivo em câmara úmida) e investigação do mecanismo de ação antifúngico, utilizando o bioensaio do sorbitol. O OE de M. spicata foi obtido pelo processo de extração por destilação a vapor. Na análise fitoquímica desse óleo foi observada a presença de carvona com 84,32%, seguida pelo limoneno (13,70%) e traços de iso-dihidrocarvona (0,82%). Os resultados da análise da CIM variou entre 32 e 128 μg/mL. A CFM
variou entre 64 e 1024 μg/mL. Na avaliação da ação de OE e da nistatina 100UI/mL, o antifúngico padrão apresentou o efeito fungicida a partir de 4 horas e para OE de M. spicata foi observado efeito fungistático na CIM, CIMX2 e CIMX4 frente às cepas avaliadas. O OE de M. spicata apresentou forte atividade antifúngica contra as cepas de C. guilliermondii, promovendo alterações micromorfológicas visíveis por microscopia óptica, nas concentrações testadas (CIM, CIMx2), resultado semelhante ao que se observou com a nistatina (100UI/mL). Na investigação do mecanismo de ação antifúngico foi constatado que houve alteração da CIM na presença de sorbitol, com elevação dos valores quatro vezes maior que a concentração inicial, o que indica que os componentes desse OE apresentam ação direta sobre a parede celular das leveduras. Conclui-se que o OE de Mentha spicata é um potencial agente terapêutico no tratamento de candidíase.
LISTA DE ABREVIATURAS E SIGLAS
PNPIC Política Nacional de Práticas Integrativas e Complementares 14
SUS Sistema Único de Saúde 14
PNPMF Política Nacional de Plantas Medicinais e Fitoterápicos 14
ANVISA Agência Nacional de Vigilância Sanitária 14
OMS Organização Mundial de Saúde 15
ISO International Standard Organization 15
OEs Óleos Essenciais 15
CG Cromatógrafo Gasoso 19
EM Espectrômetro de Massa 19
CIM Concentração Inibitória Mínima 19
CFM Concentração Fungicida Mínima 19
DCF Departamento de Ciências Farmacêuticas 20
CCS Centro de Ciências da Saúde 20
UFPB Universidade Federal da Paraíba 20
UFRN Universidade Federal do Rio Grande do Norte 20
LUDEM Laboratório Unificado de Desenvolvimento e Ensaios de
Medicamentos 20
CECON Centro de Controle e Produtos para Diagnósticos Ltda 21
ASD Ágar Sabouraud Dextrose 21
DMSO Dimetilsulfóxido 22
CSD Caldo Sabouraud Dextrose 22
HGT Hospital Giselda Trigueiro 23
YPD Extrato de levedura, Peptona, Dextrose 23
CHROMagar Ágar Cromogênico 24
UFC Unidades Formadoras de Colônias 24
A Origem Anal 29
V Origem Vaginal 29
M Molar 30
LISTA DE FIGURAS, QUADROS E TABELAS
Quadro 1. Óleos essenciais utilizados no “screening” para determinação
da atividade antifúngica sobre cepas de Candida spp.
21
Tabela 1. Laudo técnico do óleo essencial de M. spicata (hortelã-peluda)
22
Figura 1. Determinação da concentração inibitória mínima (CIM) - Ellof
(1998) 26
Figura 1. Determinação da concentração fungicida mínima (CFM) -
Ellof (1998) 27
Figura 2. Efeito do óleo essencial sobre o tempo de morte das
leveduras - Klepser et al. (1998) 28
Figura 3. Efeito do óleo essencial de M. spicata L. sobre a morfogênese de cepas de C. guilliermondii - Técnica do microcultivo
30
Figura 4: Investigação do mecanismo de ação antifúngico - método do
Sumário
Páginas
1 Introdução 13
2 Justificativa 18
3 Objetivos 19
3.1 Objetivo Geral 19
3.2 Objetivos Específicos 19
4 Métodos 20
4.1 Desenho do estudo 20
4.2 Local do trabalho 20
4.3 Obtenção do material botânico 20
4.4 Análise dos componentes do óleo essencial de M. spicata L. 22
4.5 Controle de qualidade 23
4.6 Microrganismos 23
4.7 Verificação da viabilidade e pureza das leveduras 24
4.8 Inóculo 24
4.9 Ensaios microbiológicos 24
4.9.1 Determinação da concentração inibitória mínima e concentração fungicida mínima
24
4.9.2 Efeito do óleo essencial de M. spicata sobre o tempo de morte das leveduras
27
4.9.3 Efeito do óleo essencial de M. spicata sobre a morfogênese de cepas de C. guilliermondii
29
4.9.4 Investigação do mecanismo de ação antifúngico - método do sorbitol
30
5 Artigos Produzidos 32
5.1 Artigo 1: Plant essential oils and their antimicrobial activity - review
2010-2013 32
5.2 Artigo 2: Atividade antifúngica de óleos essenciais sobre leveduras
Candida não albicans 52
5.3 Artigo 3: Antifungal activity of the essential oil of M. spicata L. on
5.4 Artigo 4: Antifungal mechanism of essential oil from Mentha spicata L. on clinical strains of Candida guilliermondii
87
6 Comentários, Críticas e Sugestões 107
7 Referências 109
Anexos 115
Anexo 1 Laudo técnico do óleo essencial de Mentha spicata 115
1 INTRODUÇÃO
Candidíase é um problema relevante devido à sua frequência e gravidade das suas complicações. Trata-se de infecção fúngica, predominantemente endógena, de caráter oportunista e que causa significante mortalidade e morbidade em pacientes imunocomprometidos (Rukayadi et al., 2011, Jin et al., 2010; Kothavadeet al., 2010).
A maioria dos casos de candidíase é causada por C. albicans. Entretanto, espécies de C. não albicans têm recentemente contribuído como agentes de infecções, indicando uma tendência de mudança na etiologia desse agravo. As espécies de C. não albicans comumente isoladas de material clínico são C. glabrata, C. tropicalis, C. parapsilosis, C. krusei, C. guilliermondii, C. kefyr, C. lusitaniae, C. viswanathii , C. famata, C. haemulonii e C. norvegensis (Oberoi et al., 2012; Rukayadi et al., 2011; Couto et al., 2011; Santos, 2009).
Os principais agentes antifúngicos utilizados para o tratamento da candidíase são os azóis e polienos. Os azóis, como cetoconazol, miconazol, clotrimazol, fluconazol, itraconazol, voriconazol e, mais recentemente, o posaconazol; atuam através da interação com a citocromo P-450-dependente 14--desmetilase, e, como resultado, inibem a síntese de ergosterol, que é o principal componente da membrana celular fúngica. Já os polienos, nistatina, anfotericina B e as suas formulações lipídicas atuam ligando-se aos esteróis na membrana celular e formam canais, permitindo que os íons de K+ e Mg++ saiam
da célula. Alguns farmácos, como a anfotericina B, são muito tóxicos, e outros, como fluconazol, são limitados por causa da alta taxa de resistência (Oliveira et al., 2011; Lima, 2011; Mendes, 2011).
É importante ressaltar a real existência de resistência in vitro e in vivo em isolados de Candida, pricipalmente em espécies de Candida não-albicans. Espécie como C. krusei apresenta resistência intrínseca ao fluconazol, ao passo que outras, como C. tropicalis e C. glabrata, têm apresentado crescente resistência adquirida (Khan & Malik, 2012; Mendes,2011).
supressiva com antifúngicos por longo período pode ser responsável pela seleção de cepas resistentes (Khan & Malik, 2012).
A crescente resistência aos antifúngicos, o reduzido número de medicamentos disponíveis, limitações terapêuticas, ineficácia, toxicidade, neutropenia grave, interações medicamentosas e a biodisponibilidade insuficiente dos antifúngicos atualmente disponíveis tornam o tratamento das micoses humanas muito difícil e estimulam a busca por novas alternativas terapêuticas entre as plantas aromáticas e seus óleos essenciais, empiricamente usados por apresentar propriedades antifúngicas (Khan & Malik, 2012; Silva, et al., 2009). Dessa forma, destaca-se a importância da busca de novas fontes terapêuticas para o tratamento das infecções fúngicas, que se apresentem mais eficazes e com menos efeitos adversos para o hospedeiro.
Plantas medicinais e aromáticas são amplamente empregadas na medicina popular e têm sido extensivamente estudadas a fim de encontrar compostos mais eficazes e menos tóxicos. Seus produtos e derivados são reconhecidamente importantes na pesquisa farmacológica e no desenvolvimento de novas ferramentas terapêuticas. Assim, constituem uma importante fonte de novos compostos biologicamente ativos e podem ser utilizadas como uma nova possibilidade de intervenção terapêutica. Nesse sentido, o estudo apropriado da química e farmacologia de plantas medicinais se apresenta como um instrumento relevante de investigação de suas propriedades(Saad, 2010).
No Brasil, país com vasta biodiversidade, experiências atreladas ao conhecimento popular aproximam a utilização de produtos naturais aos recursos terapêuticos disponíveis, sendo, inclusive, esta prática recomendada pelo poder público. Em 3 de maio de 2006, o Ministério da Saúde, através da Portaria 971, aprovou a Política Nacional de Práticas Integrativas e Complementares (PNPIC) no âmbito do Sistema Único de Saúde (SUS) (Ministério da Saúde (Brasil), 2006).
distribuídos pela rede pública em quatorze estados (Acre, Amazonas, Bahia, Espírito Santos, Goiás, Pará, Paraíba, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, Sergipe, São Paulo, Tocantins e Distrito Federal). Entre os fitoterápicos distribuídos, estão a Aloe vera (Babosa) para o tratamento de psoríase e queimaduras, o Salix alba (Salgueiro) usado contra dores na região lombar e a Rhamnus purshiana (Cáscara sagrada) para prisão de ventre.
Os benefícios da fitoterapia são reconhecidos pela Organização Mundial de Saúde (OMS). Assim, medicamentos fitoterápicos assumem papel relevante na área farmacêutica, desde que usados de forma adequada e com qualidade assegurada (portalsaude.saude.gov.br, 2012; Ministério da Saúde (Brasil), 2007).
A ISO (International Standard Organization) define óleos essenciais (OEs) como produto obtido de partes de plantas através de destilação por
arraste com vapor d’água, bem como os produtos obtidos por compressão dos
pericarpos de frutos cítricos (Silva, 2011; Mendes, 2011).
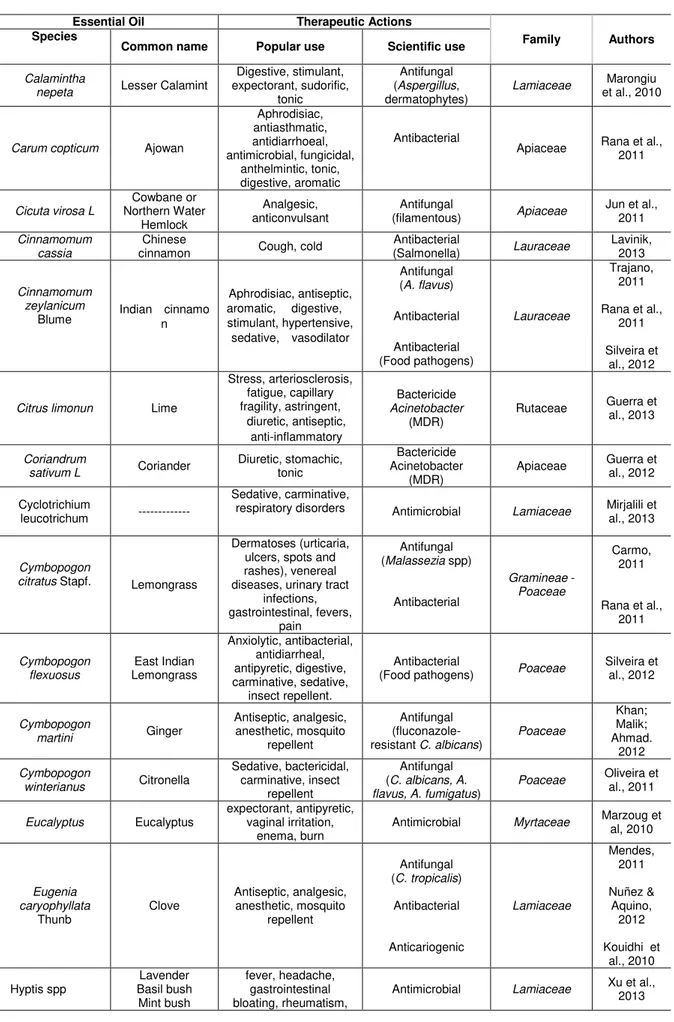
Os óleos essenciais são misturas de compostos voláteis originados do metabolismo secundário das plantas, de composição química complexa, destacando-se a presença de terpenos e fenilpropanóides. São uma rica fonte de compostos biologicamente ativos, conhecidos desde a antiguidade (Silva et al., 2013; Lima et al., 2012; Saad et al., 2010) e que apresentam diversas propriedades farmacológicas, tais como: antioxidante (Maskovic et al., 2013; Xu et al., 2013), antiflamatória (Ramos et al., 2013; Salud et al., 2013; Arumugam et al., 2008), larvicida (Govindarajan et al., 2012; Souza et al., 2012), inseticida (Arango et al., 2013; Salama et al., 2012 ), antibacteriana (Guerra et al., 2013; Castro, et al., 2011) e antifúngica (Tyagi et al., 2013; Khan & Malik, 2012; Oliveira et al., 2011).
O gênero Mentha (família Lamiaceae), de origem europeia, é atualmente cultivado em todo o mundo, devido a sua utilização como flavorizante, aromatizante e pelas aplicações farmacêuticas. A Índia produz cerca de 80% do total mundial de óleo de menta. Embora oito espécies desse gênero sejam cultivadas na Índia, apenas três (Mentha arvensis L., Mentha piperita L e Mentha spicata L.) foram aprovadas pela International Standard Organization (ISO). Esse gênero apresenta dificuldades para sua classificação devido à grande variabilidade em suas características morfológicas e a facilidade de hibridização (Peixoto, 2010; Ferreira, 2008).
Mentha spp. possui um dos óleos essenciais mais consumidos do mundo, com atividade antimicrobiana comprovada e seus derivados são largamente utilizados na produção de alimentos, de produtos de higiene, cosméticos, farmacêuticos, tabaco e bebidas. Os fitoconstituintes do óleo de Mentha spp. variam de acordo com a idade da planta, variedade da espécie, região geográfica, clima e condições do processamento. Os principais constituintes identificados são os monoterpenóides como mentol, mentona, iso mentona, carvona, limoneno, pulegona, iso-dihidrocarvona e s-carvona (Peixoto, 2010; Mkaddem, 2009). Alguns deles possuem alta atividade antioxidante (Abdullah et al., 2010). A planta também é conhecida por sua ação inseticida, propriedades antimicrobianas, antiespasmódica, antiplaquetária, estimulante, antihelmintica e carminativa (Mkaddem, 2009).
bactericida e antiséptica (Ferreira, 2008). O óleo essencial de M. spicata mostrou atividade inseticida e mutagênica forte (Chauhana et al., 2009).
Com base nessas considerações e na alta incidência da candidíase, aumento do número de indivíduos imunocomprometidos, surgimento de cepas resistentes aos antifúngicos comercialmente utilizados, do elevado custo do tratamento, toxicidade dos antifúngicos existentes, é de fundamental importância a busca por novos agentes antifúngicos mais eficazes, menos tóxicos, economicamente viáveis, sendo os produtos derivados de plantas medicinais, excelentes alternativas para esse propósito (Machado et al., 2013; Peixoto, 2010).
O desenvolvimento de estratégias eficazes para o tratamento da candidíase e outras doenças causadas por fungos é um desafio, considerando o aumento em infecções fúngicas oportunistas em pacientes HIV positivos e imunocomprometidos (Khan & Malik, 2012; Zirkel,et al., 2012). O objetivo principal da busca por novos fitoterápicos não é substituir os medicamentos já existentes, mas sim aumentar o arsenal terapêutico disponível, ofertando medicamentos equivalentes, talvez mais baratos, com espectro de ação mais adequado e baixo risco de desenvolvimento de resistência microbiana in vitro (Carmo, 2011).
2 JUSTIFICATIVA
O gênero Candida compreende leveduras oportunistas colonizantes da microbiota humana. Em pacientes imunocomprometidos são a causa mais comum de infecções fúngicas, cujo espectro varia desde patologias mucocutâneas não-fatais, a processos invasivos que podem envolver qualquer órgão (Oliveira et al., 2011, Mendes, 2011).
A elevada incidência de candidíase nos últimos anos se deve à baixa sensibilidade de algumas cepas aos antifúngicos utilizados na prática clínica, necessitando diversificadas estratégias terapêuticas, tais como aumento da dose ou do tempo de uso do antifúngico. (Oliveira et al, 2011).
Outro determinante do agravamento dessa patologia é a grande dificuldade no tratamento, relacionado aos seus efeitos adversos, sendo observada alta taxa de mortalidade em pacientes imunocomprometidos (Peixoto, 2010).
Pesquisas desenvolvidas na expectativa de se obter novos produtos antifúngicos de origem natural tornam-se relevantes, levando-se em consideração a crescente importância clínica e epidemiológica dispensada às infecções micóticas e a necessidade de tratamentos mais eficazes e menos tóxicos para os indivíduos acometidos (Khan & Malik, 2012; Peixoto, 2010).
É dentro desse contexto que pesquisadores de todo o mundo têm se dedicado ao estudo de alternativas viáveis aos tratamentos destas enfermidades. Uma destas alternativas são os estudos com plantas medicinais e seus derivados, considerando os aspectos fitoquímicos e atividades biológicas (Khan & Malik,2012; Oliveira et al., 2011; Mendes, 2011).
Nossa proposta de trabalho foi avaliar a atividade biológica, composição química e mecanismo de ação do óleo essencial de Mentha spicata L. sobre Candida guilliermondii provenientes de vulvovaginites e material anal.
3 OBJETIVOS
3.1 OBJETIVO GERAL
Avaliar a atividade biológica, composição química e mecanismo de ação do óleo essencial de Mentha spicata L. sobre Candida guilliermondii de origem clínica.
3.2 OBJETIVOS ESPECÍFICOS
Realizar um “screening” da atividade antifúngica de óleos essenciais
sobre espécies de Candida não albicans de origem clínica;
Identificar a composição química do óleo essencial de Mentha spicata, utilizando um Cromatógrafo Gasoso (CG) acoplado com Espectrômetro de Massa (EM);
Determinar a Concentração Inibitória Mínima (CIM) e a Concentração Fungicida Mínima (CFM) desse produto sobre as cepas de Candida guilliermondii provenientes de vulvovaginites e material anal;
Avaliar a interferência dos efeitos desse óleo essencial sobre a cinética de crescimento das leveduras;
Analisar o efeito do óleo essencial de Mentha spicata sobre a micromorfologia das cepas de Candida guilliermondii em estudo;
4 MÉTODOS
4.1 Desenho do estudo
Trata-se de um estudo “in vitro”, onde foram coletados dados
micológicos e químicos, com o intuito de observar e estimar a composição química e a ação antifúngica do óleo essencial de M. spicata frente à Candida guilliermondii de origem clínica.
4.2 Local do trabalho
O trabalho foi realizado no Laboratório de Micologia do Departamento de Ciências Farmacêuticas (DCF), do Centro de Ciências da Saúde (CCS), da Universidade Federal da Paraíba (UFPB) e no Laboratório de Microbiologia Clínica do Departamento de Análises Clínicas e Toxicológicas do Centro de Ciências da Saúde (CCS), da Universidade Federal do Rio Grande do Norte (UFRN). Parcerias, para o apoio no desenvolvimento do trabalho, foram também realizadas para análise da composição do óleo essencial de M. spicata (hortelã peluda) ocorrida no Laboratório Unificado de Desenvolvimento e Ensaios de Medicamentos (LUDEM), do Centro de Ciências da Saúde (CCS), da Universidade Federal da Paraíba (UFPB). A concordância dos resultados da identificação bioquímica do Banco de Levedura foi realizada no Laboratório de Microbiologia do Hospital Pediátrico Maria Alice Fernandes, Natal (RN), através do Sistema MicroScan®.
4.3 Obtenção do material botânico:
avaliados onze óleos essenciais extraídos dos espécimes botânicos especificados no quadro 1. Nessa avaliação os óleos foram utilizados “in natura“, ou seja, 100% puros. O método microbiológico utilizado foi o de difusão em meio sólido com discos de papel (Sensiobiodisc do Centro de Controle e Produtos para Diagnósticos Ltda – CECON/SP) impregnados com 10 µL dos óleos essenciais, desenvolvidos em ágar sabouraud dextrose (ASD -
Difco® - France). O sistema foi incubado a 35°C por 48 horas (Koneman et al.,
2008; Yaya, 2008; Ostrosky et al., 2008; Craveiro, 1981). Os ensaios foram realizados em duplicatas e os resultados considerados positivos, quando a média aritmética dos halos de inibição apresentaram valores iguais ou superiores a 15mm de diâmetro, em pelo menos, 50% do total das cepas testadas (Mendes, 2011).
Quadro 1. Óleos essenciais utilizados no “screening” para determinação
da atividade antifúngica sobre cepas de Candida spp.
Fonte:www.plantamed.com.br
O óleo essencial de M. spicata foi escolhido para estudos posteriores, por ter apresentado um dos melhores resultados na triagem microbiológica. Esse produto teve seu parâmetro de qualidade (coloração, pureza, odor,
Espécie Família Nome popular
Cinnamomum zeylanicum Blume Lauraceae canela-da-índia Citrus limonum Burm. F. Rutaceae limão-siciliano Coriandrum sativum L. Krause Apiaceae coentro
Eucalyptus globulus Labill Myrtaceae eucalipto Eugenia coryophyllata Thumb. Lamiaceae cravo-da-índia Mentha arvensis L. Stewart Lamiaceae hortelã comum Mentha piperita L. Briq. Lamiaceae hortelã-pimenta Mentha spicata Schrad. ex Willd Lamiaceae hortelã-peluda Ocimum basilicum Schumach. & Thonn Lamiaceae manjericão Origanum vulgare L. (G. Beck) Klok Lamiaceae orégano
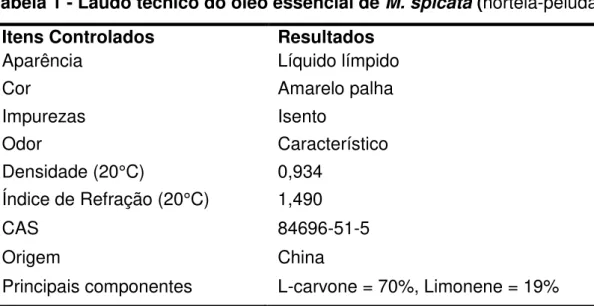
densidade a 20°C e índice de refração a 20°C) descrito em um laudo técnico enviado pela empresa (Tabela 1).
Tabela 1 - Laudo técnico do óleo essencial de M. spicata (hortelã-peluda)
Itens Controlados Resultados
Aparência Líquido límpido
Cor Amarelo palha
Impurezas Isento
Odor Característico
Densidade (20°C) 0,934
Índice de Refração (20°C) 1,490
CAS 84696-51-5
Origem China
Principais componentes L-carvone = 70%, Limonene = 19%
Fonte: Ferquima Ind. E Com. Ltda. Engenheira Química Responsável: Alice Elizabet Lasthaus, CRQ: IV 04330754.
Este óleo foi conservado em um frasco de alumínio e mantido sob refrigeração. No momento da utilização foi preparada uma emulsão do óleo essencial de M. spicata, conforme o protocolo de Allegrini et al (1993). Em um tubo de ensaio esterilizado, foi colocado 16.389μg do óleo essencial, 0,4mL de
dimetilsulfóxido (DMSO - Merck), 0,08mL de Tween 80 (INLAB/Indústria Brasileira) e quantidade suficiente para 8mL de água destilada estéril. Através de diluições em Caldo Sabouraud Dextrose (CSD - Difco® - France)
duplamente concentrado foram obtidas as concentrações desejadas do óleo essencial.
4.4 Análise dos componentes do óleo essencial deM. spicata
Para a análise dos fitoconstituintes foi utilizado um Cromatógrafo Gasoso (CG) da Shimadzu (GC17-A), equipado com um Espectrômetro de Massa (EM). A coleta de dados e integração foi realizada com o software Class5000. A fase móvel foi composta por hélio e bombeada na vazão de 1,6 mL/min comsplit 1:5.
programada para passar de uma temperatura inicial de 60°C a 120°C a 5°C/min e de 120°C a 280°C a 20°C/min. A temperatura do injetor e do detector foram 260 e 280°C respectivamente. O tempo total foi de 20 minutos e o
volume de injeção foi 1,0 μL.
A identificação dos constituintes do OE foi efetuada junto ao sistema de computação e processamento de dados (workstation) interligado ao CG-EM. O sistema é equipado com uma biblioteca Wiley, 6ª Edição da classe-5000 1999, com 229.119 espectros.
4.5 Controle de qualidade
A nistatina (Sigma-Aldrich®) foi selecionada como antifúngico padrão, após realização do antifungigrama pelo método microbiológico de difusão em ASD, o qual apresentou melhor perfil de sensibilidade para esse banco de leveduras. As soluções também foram preparadas no momento de execução dos testes.
4.6 Microrganismos
com glicerol e as miçangas foram colocados na estufa a 35°C. Posteriormente, foram armazenadas sob-refrigeração a 8°C e no freezer a -70°C.
4.7 Verificação da viabilidade e pureza das leveduras
Previamente aos experimentos, as cepas foram submetidas à verificação de sua viabilidade e pureza. Para isso, foram semeadas em meio Ágar Sabouraud Dextrose (Difco® - France), a fim de obter culturas recentes. Para avaliação da pureza, as leveduras foram semeadas com alça descartável pela técnica de esgotamento em meio CHROMagar Candida® (meio cromogênico, que permite a identificação de culturas mistas de leveduras - Difco® - France) e depois incubação a 35C, durante 24-48 horas.
4.8 Inóculo
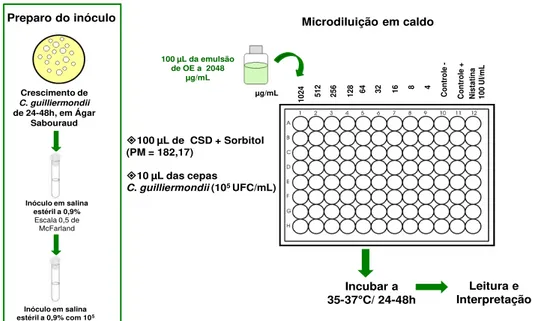
A partir das culturas recentes e mantidas em Ágar Sabouraud Dextrose - ASD (Difco® - France), durante 24-48 horas a 35C, o inóculo foi preparado e padronizado em solução fisiológica a 0,9% estéril (Fresenius Kabi Brasil Ltda). Inicialmente, preparou-se uma suspensão comparativa com o tubo 0,5 da escala de McFarland. A mesma foi ajustada no espectrofotômetro (Leitz-Fhotometer 340-800) para conter aproximadamente 106 UFC/mL. Em seguida, essa suspensão foi diluída com água destilada numa proporção de 1:9, resultando em um inóculo contendo aproximadamente 105 UFC/mL, que foi utilizado nos ensaios (Koneman et al., 2008; Ostrosky et al., 2008).
4.9.Ensaios microbiológicos
4.9.1 Determinação da Concentração Inibitória Mínima – (CIM) e Concentração Fungicida Mínima (CFM)
(Koneman et al., 2008; Ostrosky et al., 2008; Hadacek & Greger, 2000; Ellof, 1998).
A partir das culturas recentes e mantidas em Ágar Sabouraud Dextrose - ASD (Difco® - France), durante 24-48 horas a 35C, o inóculo foi preparado e padronizado em solução fisiológica a 0,9% estéril (Fresenius Kabi Brasil Ltda). Inicialmente, preparou-se uma suspensão comparativa com o tubo 0,5 da escala de McFarland. Em seguida, essa suspensão foi diluída com água destilada numa proporção de 1:9, resultando em um inóculo contendo aproximadamente 105 UFC/mL, que foi utilizado nos ensaios.
Foram utilizadas placas de microtitulação com 96 orifícios estéreis (INLAB). Em cada orifício da placa, foram adicionados 100 µl do meio Caldo Sabouraud Dextrose (CSD - Difco® - USA/France). Em seguida, foi adicionado 100 µl da emulsão do OE na concentração inicial de 1024 µg/mL nas cavidades da primeira linha da placa. Por meio de uma diluição seriada a uma razão de dois, foram obtidas concentrações de 1024 µg/mL até 4 µg/mL. Por fim, foram adicionados 10 µl da suspensão das espécies das leveduras nas cavidades, onde cada coluna da placa refere-se a uma cepa de C. guilliermondii.
Em conjunto com os ensaios microbiológicos, foram realizados os controles de esterilidade (meio líquido CSD sem a suspensão da levedura), de viabilidade/crescimento do microrganismo (no meio líquido isento de produto antifúngico) e com antifúgico padrão (nistatina 100 UI/mL).
Os ensaios microbiológicos foram incubados à temperatura de 35ºC/24-48 horas. Decorrido o tempo de incubação adequado, foi feita a leitura e interpretação dos resultados. A CIM foi definida como a menor concentração capaz de inibir visualmente o crescimento fúngico verificado nas cavidades, quando comparado com o crescimento controle. Os ensaios foram realizados em duplicata e o resultado expresso pela média aritmética dos valores da CIM obtidas nos dois ensaios (Eloff, 1998; Cleeland & Squires, 1991).
A atividade antifúngica dos produtos foi interpretada e considerada ativa ou não, conforme os seguintes parâmetros: CIM até 500 μg/mL= forte
atividade antimicrobiana, CIM entre 600 e 1600 μg/mL= possuem atividade
moderada e CIM acima de 1600 μg/mL= considerado com fraca atividade
Koneman, et al., 2008; Ostrosky et al., 2008; Hadacek & Greger, 2000; Cleeland & Squires, 1991 Crescimento de
C. guilliermondii
de 24-48h, em Ágar Sabouraud
Inóculo em salina estéril a 0,9%
Escala 0,5 de McFarland
Inóculo em salina estéril a 0,9% com 105
UFC/mL (diluição 1:9)
Preparo do inóculo Microdiluição em caldo
µg/mL
1024 512 256 128 64 32 16 8 4 C on tr ol e -C on tr ol e + N is ta tin a 10 0 U I/m L Incubar a 35-37C/ 24-48h
100 µL da emulsão de OE a 2048
µg/mL
Leitura e Interpretação
100 µL de Caldo Sabouraud
10 µL das cepas
C. guilliermondii (105 UFC/mL)
Figura 1: Determinação da concentração inibitória mínima (CIM) - Ellof (1998)
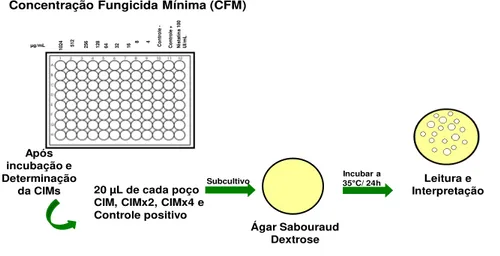
A CFM foi definida após a determinação da CIM, alíquotas de 20 μL
Amato Neto et al., 1994; Zaror & Espenel-Ingroff, 1989
µg/mL
1024 512 256 128 64 32 16 8 4 Con
tr ol e -C on tr ol e + N is ta tin a 10 0 U I/m L Incubar a
35C/ 24h Leitura e
Interpretação Após
incubação e Determinação
da CIMs 20 µL de cada poço CIM, CIMx2, CIMx4 e Controle positivo
Ágar Sabouraud Dextrose
Subcultivo
Considerado crescimento menor que três (03) UFCs
Concentração Fungicida Mínima (CFM)
Figura 2: Determinação da concentração fungicida mínima (CFM) - Ellof (1998)
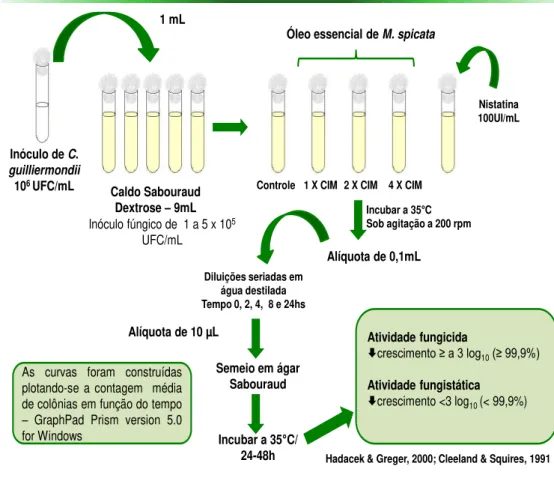
4.9.2 Efeito do óleo essencial de M. spicata sobre o tempo de morte das leveduras
Procedimentos para curva de tempo de morte foram realizados utilizando a metodologia de Klepser et al. (1998). Foram selecionadas duas cepas representativas de C. guilliermondii.Antes do ensaio, as leveduras foram cultivadas em ASD. As suspensões fúngicas foram preparadas de acordo com o padrão 0,5 de McFarland (1-5x106 UFC/mL) (Cleeland & Squires, 1991; Hadacek & Greger, 2000). Um mililitro da suspensão fúngica ajustada foi adicionado a cada tubo que continha 9 mL de CSD, com ou sem drogas. Isto resultou em uma diluição de 1:10 da suspensão fúngica e forneceu um inóculo inicial de cerca de 1-5 x 105 UFC/mL. As concentrações do OE testadas foram de 1, 2 e 4 vezes o valor da CIM. A nistatina foi testada na concentração de 100UI/mL. Em pontos de tempo predeterminados (0, 2, 4, 8 e 24 h após a adição do OE ou nistatina), 0,1 mL da amostra foi removida de cada tubo de cultura e serialmente diluída com água destilada estéril. Uma alíquota de 10 μL
de cada diluição foi semeada uniformemente em placas de ASD. Quando suspeitou-se que o número de colônias fosse menor que 1000 UFC/mL, 10 μL
As placas foram incubadas a 35°C por 24 a 48 h. Após esse período de incubação, o número de unidades formadoras de colônia (UFC) em cada placa foi contado e multiplicado pelo fator da diluição utilizada, para obter, assim, o número de UFC/mL. O limite de detecção mínimo foi de 100 UFC/mL.
As curvas foram construídas plotando-se a contagem média de colônias (log10UFC/mL) em função do tempo (horas) com o GraphPad Prism
version 5.0 for Windows. Foi considerada atividade fungicida da droga quando houve redução no crescimento maior ou igual a 3 log10 (≥ 99,9%) a partir do
inóculo inicial, e atividade fungistática quando houve redução no crescimento menor que 3 log10 (< 99,9%) UFC/mL (Correa-Royero et al., 2010; Ernst et al.,
2002; Keele et al., 2001; Cleeland & Squires, 1991).
Inóculo de C.
guilliermondii
106 UFC/mL
1 mL
Caldo Sabouraud
Dextrose –9mL
Inóculo fúngico de 1 a 5 x 105
UFC/mL
Nistatina 100UI/mL
Controle 1 X CIM 2 X CIM 4 X CIM
Óleo essencial de M. spicata
Incubar a 35C Sob agitação a 200 rpm
Alíquota de 10 µL
Semeio em ágar Sabouraud
Diluições seriadas em água destilada Tempo 0, 2, 4, 8 e 24hs
Incubar a 35C/
24-48h
Atividade fungicida
crescimento ≥ a 3 log10(≥ 99,9%)
Atividade fungistática
crescimento <3 log10 (< 99,9%)
Hadacek & Greger, 2000; Cleeland & Squires, 1991
Alíquota de 0,1mL
As curvas foram construídas plotando-se a contagem média de colônias em função do tempo
– GraphPad Prism version 5.0
for Windows
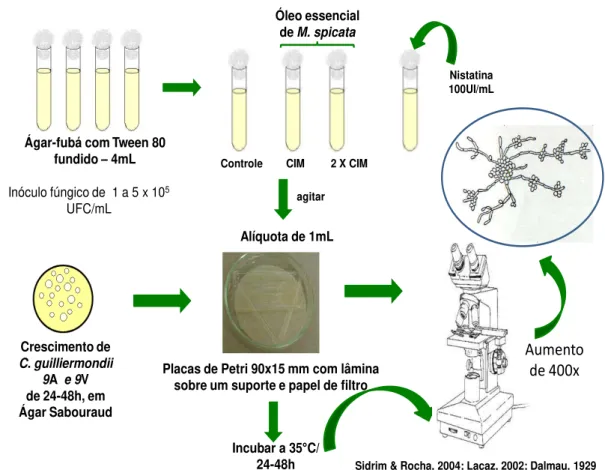
4.9.3 Efeito do óleo essencial de M. spicata sobre a morfogênese de cepas
de C. guilliermondii
Para o estudo de possíveis alterações na micromorfologia de C. guilliermondii, provocadas pela ação dos óleos essenciais, foi empregada à técnica do microcultivo. Com base nos resultados dos valores de CIM encontrados, foram selecionadas duas cepas representativas, uma de origem anal (C. guilliermondii 9A) e outra de origem vaginal (C. guilliermondii 9V) (Sidrim & Rocha, 2004; Lacaz, 2002; Dalmau, 1929). Utilizando o meio sólido ágar-fubá com Tween 80 (Difco® - France) em câmara úmida, o ensaio foi realizado em placas de Petri 90 x 15 mm, contendo uma lâmina sobre um suporte para o microcultivo e papel de filtro (30 x 30 mm), devidamente esterilizados.
O óleo essencial e o antifúngico padrão em quantidade suficiente para obtenção da concentração final desejada foram solubilizados em tubos estéreis. Em seguida, foi adicionado 4 mL de Agar-fubá-Tween 80 fundido em cada um desses tubos: sem óleo nem antifúngico (Controle), com o óleo essencial em concentração correspondente a CIM, CIMx2, e nistatina em concentração correspondente a 100UI/mL.
Ágar-fubá com Tween 80
fundido –4mL
Inóculo fúngico de 1 a 5 x 105
UFC/mL
Nistatina 100UI/mL
Controle CIM 2 X CIM
Óleo essencial de M. spicata
agitar
Placas de Petri 90x15 mm com lâmina sobre um suporte e papel de filtro
Incubar a 35 C/
24-48h Sidrim & Rocha, 2004; Lacaz, 2002; Dalmau, 1929
Alíquota de 1mL
Crescimento de C. guilliermondii
9A e 9V de 24-48h, em Ágar Sabouraud
Aumento de 400x
Figura 4: Efeito do óleo essencial de M. spicata L. sobre a morfogênese de cepas de C.
guilliermondii - Técnica do microcultivo
4.9.4 Investigação do mecanismo de ação antifúngico – método do sorbitol
Este método se baseia na medida dos danos que os produtos com atividade antifúngica produzem aos componentes da parede celular fúngica. Caso o composto atue de alguma forma sob a parede celular do fungo, ele provocará lise de suas células quando na ausência de um estabilizador osmótico, mas permitirá seu crescimento na presença desse suporte osmótico.
Dessa maneira, este ensaio compara as CIM’s dos produtos antifúngicos na
ausência e presença de sorbitol a 0,8 M, um protetor osmótico usado para estabilizar os protoplastos de fungos.
cavidades, com fundo em forma de “U” e em duplicata, semelhante ao item 4.9.1. Em cada orifício da placa, foram adicionados 100 µL do meio líquido CSD previamente adicionado de sorbitol (PM = 182,17) (VETEC Química Fina Ltda – Rio de Janeiro/RJ), ambos duplamente concentrados. Posteriormente, 100 µL da solução dos produtos, também duplamente concentrados, foram dispensados nas cavidades da primeira linha da placa. E por meio de uma diluição seriada a uma razão de dois, foram obtidas concentrações de 1024 µg/mL até 4 µg/mL dos produtos e, no caso do sorbitol, uma concentração final de 0,8 M em cada cavidade. Por fim, foram adicionados 10 µL do inóculo das espécies nas cavidades, onde cada coluna da placa refere-se a uma cepa fúngica, especificamente.
Um controle de microrganismo foi realizado colocando-se nas cavidades 100 µL do mesmo CSD e sorbitol (0,8 M), 100 µL de água destilada estéril e 10 µL do inóculo de cada espécie. Um controle de esterilidade também foi realizado, onde foi colocado 200 µL do CSD em um orifício sem a suspensão dos fungos. Por último, foi realizado o mesmo procedimento com o antifúngico padrão (Nistatina 100 UI/mL). As placas foram seladas e incubadas a 35°C por 48 horas, posteriormente foi realizada a leitura (Zacchino, 2001; Frost et al., 1995).
Zacchino, 2001; Frost et al., 1995; Crescimento de
C. guilliermondii de 24-48h, em Ágar
Sabouraud
Inóculo em salina estéril a 0,9%
Escala 0,5 de McFarland
Inóculo em salina
estéril a 0,9% com 105
UFC/mL (diluição 1:9)
Preparo do inóculo Microdiluição em caldo
µg/mL
1024 512 256 128
64 32 16 8 4 Cont
rol e -C ont rol e + N is ta tina 10 0 U I/m L Incubar a 35-37C/ 24-48h
100 µL da emulsão de OE a 2048
µg/mL
Leitura e Interpretação
100 µL de CSD + Sorbitol (PM = 182,17)
10 µL das cepas
C. guilliermondii (105 UFC/mL)
5 ARTIGOS PRODUZIDOS
5.1 Artigo 1:
Periódico: Pharmaceutical Biology - ISSN: 1388-0209. Status: a ser submetido.
Plant essential oils and their antimicrobial activity – review 2010-2013
Maiza Rocha de Abrantes1*, Edeltrudes de Oliveira Lima2, Mariana Araújo Paulo
de Medeiros1, Felipe Queiroga Sarmento Guerra2, Eveline Pipolo Milan3
1Departamento de Análises Clínicas e Toxicológicas, Centro de Ciências da
Saúde, Universidade Federal do Rio Grande do Norte
2Departamento de Ciências Farmacêuticas, Centro de Ciências da Saúde,
Universidade Federal da Paraíba
3Departamento de Infectologia, Centro de Ciências da Saúde, Universidade
Federal do Rio Grande do Norte
*Corresponding author. Mailing address: Departamento de Análises Clínicas e
Toxicológicas, Centro de Ciências da Saúde, Universidade Federal do Rio
Grande do Norte, R. Gal. Gustavo Cordeiro de Farias, S/N, 1o andar,
Petrópolis, Natal, RN, Brazil. CEP: 59012-570. Phone: +55 (84) 3342-99797,
3342-9801. Mobile: + 55 (84) 9955-1703. E-mail: maizajrl@ufrnet.br.
ABSTRACT
The use of essential oils of vegetable origin is rooted in popular
knowledge and has now been evoked by scientific studies. This study included
an inventory of oils extracted from plants with antimicrobial activity, highlighting
their applications and use. The literature review included any scholarly,
peer-reviewed journal articles published in databases such as Google Scholar,
PubMed (Medical Publications), MEDLINE (International Literature on Health
Sciences), LILACS (Latin American and Caribbean Health Sciences Literature),
SciELO (Scientific Electronic Library Online) as well as a wide range of
academic dissertations and theses from 2010 to 2013. We found 29 essential
oils of vegetable origin with antimicrobial activity, several of which from the
Lamiaceae family. This review suggests that progress has been made in the
study of essential oils.
Introduction
Essential oils (EOs) are complex mixtures of volatile, lipophilic, liquid
and colorless or slightly yellowish compounds with a strong and pleasant
aroma. They originate from the secondary metabolism of plants, and are very
unstable, especially in the presence of air, light, heat, moisture and metals
(Peixoto, 2010; Oliveira, 2011; Ehlert et al., 2013).
These oils can be found in the leaves, flowers, branches, buds, stems,
fruits, seeds, bark and roots of the plants (Lavinik, 2013) and perform various
microorganisms, in attracting pollinators, in protecting the plant from heat,
amongst other functions (Bassolé & Juliani, 2012; Trajano, 2012; Gomes, 2013;
Silva et al., 2013).
Medicinal plants require different techniques for growing, harvesting,
and postharvest processing in order to determine which methods provide higher
biomass accumulation and chemical constituents of interest (Ehlert et al., 2013).
The chemical and biological properties of EOs may vary according to the
environment in which the plant develops, the type of cultivation technique, the
collection of plant material, the season, the climate, the vegetative stage, the
plant organ, age, the time of vegetative phase and the extraction method used
(Zheljazkov et al., 2010; Ehlert et al., 2013; Machado, Ribeiro, Druzian, 2013;
Zhaoa et al., 2013). Plants rich in essential oils should be collected in the
morning or evening since sun exposure may cause loss of a significant amount
of oil. Nevertheless, one can not predict or establish the use of a single
standard technique, since each species reacts differently to environmental
changes (Peixoto, 2010).
There are various methods for extracting essential oils, some of which
include: steam distillation, hydrodistillation (Clevenger method), organic solvent
extraction, microwave-assisted distillation, microwave hydrodiffusion and
gravity, high-pressure solvent extraction, supercritical fluid CO2 extraction,
ultrasonic extraction and solvent-free microwave extraction. However, steam
distillation is the most commonly used method for commercial production scale
(Okoh, Sadimenko, Afolayan, 2010).
Phytochemicals derived from EOs include terpene hydrocarbons,
peroxides, organic acids, lactones, coumarins and sulfur compounds.
Chemically, the vast majority of EOs are derived from phenylpropanoid and
predominantly from terpenoids (Lima, 2011), whereas the majority of their
antimicrobial activity derive from oxygenated terpenes, particularly terpene
phenolics, phenylpropanoids and alcohols (Bassolé & Juliani, 2012).
Essential oils have been widely used by pharmaceutical, sanitary,
cosmetic, agricultural and food industries because of their biologically active
compounds, which present several pharmacological activities: antioxidant
(Maskovic et al., 2013, Xu et al., 2013), anti-inflammatory (Salud et al., 2011;
Ramos et al., 2013), larvicide (Govindarajan et al., 2012; Souza et al., 2012),
insecticide (Salama et al., 2012; Arango et al., 2013), antibacterial (Castro, et
al., 2011; Guerra et al., 2013) and antifungal activities (Oliveira et al., 2011;
Tyagi et al., 2013). Moreover, EOs may be used alone or in combination with
existing methods, which is considered an interesting alternative to reduce or
eliminate resistant pathogens (Khan et al., 2012).
The antifungal properties of EOs of vegetable origin have been
demonstrated through intensive research, driven by the growing trend towards
replacing synthetic agents (Zuzarte et al., 2012). The use of natural antifungal
compounds is important not only for food preservation, but also in the control of
diseases that affect both plants and humans. The search for new antifungal
agents is needed due to the emergence of resistant microorganisms and fatal
opportunistic infections (Carmo, 2011).
The antimicrobial properties of EOs of vegetable origin have been
empirically known for centuries, but only recently has science recognized their
research groups, which study the biological activity of medicinal plants
throughout the world, according to their popular use. In contrast,
microorganisms that cause disease have developed resistance to most of the
available antibiotics, which further fosters the search for natural antibiotics
(Machado, Ribeiro, Druzian, 2013).
The mechanism of action of EOs on microorganisms is complex and not
yet fully elucidated. As is well known, the hydrophobic properties of EOs and
their components cause their binding to lipids in the cell membrane, altering its
structure and increasing its permeability, thus leading to cell leakage and cell
death (Guerra et al., 2012; Gomes, 2013; Lavinik, 2013). This mechanism of
action can not be assigned to a specific target, although there may be many of
them within the cell (Kacániová et al., 2012).
Essential oils of vegetable origin with antifungal action present two
important characteristics: their natural origin (safe for consumers and for the
environment) and lower risk of development of microbial resistance. The latter is
based on the fact that EOs have a complex chemical composition and,
consequently, different mechanisms of activity, making it difficult for
microorganisms to adapt and mutate (Carmo, 2011).
In this retrospective study, we developed an inventory of oils extracted
from plants with antifungal activity, highlighting their applications for humans.
Methods
This is a descriptive study with quantitative and qualitative approaches.
academic dissertations and theses from 2010 to 2013. The following databases
were used: Google Scholar, PubMed (Medical Publications), MEDLINE
(International Literature on Health Sciences), LILACS (Latin American and
Caribbean Health Sciences Literature) and SciELO (Scientific Electronic Library
Online). The keywords used for the search were: essential oils, natural products
and antimicrobials.
Results and Discussion
The sample consisted of 29 EOs with antifungal, antibacterial and
antimicrobial (antifungal + antibacterial) properties. As shown in Table 1,
Lamiaceae has been the most studied family.
Studies have reported the antifungal and antibacterial properties of
some Cymbopogon species. According to Carmo (2011), the EO of
Cymbopogon citratus (Gramineae - Poaceae) is indicated for the treatment of
dermatoses (urticaria, ulcers, spots and rashes), acting against clinical strains
of Malassezia isolated from patients at the Hospital Universitário Lauro
Wanderley (Universidade Federal da Paraíba, Brazil). Moreover, Oliveira (2011)
investigated the activity of the EO of Cymbopogon winterianus (lemongrass) on
Candida albicans, Aspergillus flavus and Aspergillus fumigatus using time-kill
methodology. In this study, is was suggested that this EO had a
concentration-dependent antifungal effect for all strains tested.
In order to develop an alternative therapy for candidiasis - since the one
currently available has become problematic as a result of the toxicity of
Malik and Ahmad (2012) studied the effect of 21 plant EOs against
multidrug-resistant (MDR) strains of C. albicans. According to the study, the oil of
Cymbopogon martini showed a strong inhibitory activity against C. albicans with
Minimal Inhibitory Concentrations ranging from 90 to 100 µg/ml.
While studying the antifungal effect of microcapsules containing EO of
Cinnamomum zeylanicum Blume (Lauraceae) on Aspergillus flavus, Trajano
(2012) noted that in in vitro assays this EO showed fungistatic (650μg/mL) and
fungicide (2600μg/mL) activities. According to the searched literature, C.
zeylanicum have some medicinal properties such as astringent, aphrodisiac,
antiseptic, aromatic, carminative, digestive, stimulant, hypertensive, sedative,
tonic and vasodilator (www.plantamed.com.br).
Antifungal properties have also been found in plant species from genera
Cicuta and Eugenia. An EO extracted from the fruits of Cicuta virosa L. var.
latisecta Celak was used against four food-borne fungi: Aspergillus flavus, A.
oryzae, A. niger and Alternaria alternata. Results showed that this EO had a
strong inhibitory effect on spore production and germination in all tested fungi
(Jun et al., 2011). Furthermore, Mendes (2011) evaluated the activity of the EO
of Eugenia caryophyllata Thunb on strains of C. tropicalis using Minimal
Inhibitory Concentration (MIC) and Minimal Fungicidal Concentration (MFC)
values, and micromorphology, fungal viability (time-kill) and checkerboard
methodologies. Therefore, they observed a concentration-dependent antifungal
activity in the EO, which is potentialized in association with amphotericin B.
An study with Hyptis spp. (Lamiaceae) has shown the antimicrobial
activity of H. suaveolens, H. rhomboidea and H. Brevipes (Xu et al., 2013),
grandiflora presents an antifungal activity against dermatophyte strains.
While investigating the antifungal activity of EOs of Lavandula viridis,
Zuzarte et al. (2011) showed that dermatophyte fungi and Cryptococcus
neoformans were the most sensitive to the EOs (0.32 to 0.64 mL μL⁻¹), followed
by Candida spp. (0.64 to 2.5 ml μL⁻¹). For most of these strains, MIC values
were equal to MLC values, showing the fungicidal effect of the essential oils.
Additionally, it has been observed that the EOs had completely inhibited the
filamentation of C. albicans at concentrations sixteen times below the MIC
value.
Additionally, Zuzarte et al. (2012) studied the activity of the EO of
Lavandula luisieri against dermatophyte fungi and Aspergillus strains as well as
its influence on the dimorphic transition in C. albicans, evaluated through the
inhibition of germ tube formation assay. As previously reported (Zuzarte et al.,
2011), the filamentation in all strains was completely inhibited at concentrations
below sixteen times the MIC. The results support the use of EOs of L. luisieri for
the development of new phytochemicals and food preservatives, emphasizing
their antifungal properties at non-cytotoxic concentrations or at concentrations
with very low negative effects on mammalian cells.
Studies with species of Mentha have made progress in reporting their
antifungal properties on different pathogenic fungi. Peixoto (2010), for instance,
evaluated the anti-Candida action of EOs and fractions of different accessions
of Mentha spp. against C. albicans and C. dubliniensis. Four of the EOs
analyzed showed strong activity with broad spectrum: M. canadensis (MC 05) -
(<0,007 to 0,500 mg/mL); M. spicata (MC 30) (0,062 mg/mL to 0,500 mg/mL);
(MC 52) - (0,062 mg/mL to 0,500 mg/mL). In addition, Abdullah et al. (2010)
have also investigated the antifungal activity of the EO extracted from aerial
parts of Mentha spicata L. (mint) against five pathogenic fungi: Aspergillus
niger, Mucor mucedo, Fusarium solani, Botryodiplodia theobromae, and
Rhizopus solani. In this study, all tested microorganisms were strongly affected
by the EO, indicating an appreciable antimicrobial potential of spearmint oil.
In a study by Castro et al. (2011), it was suggested the use of the EO of
Lippia sidoides Cham. (Verbenaceae) as an antibacterial agent in food. For this
purpose, they studied the antimicrobial activity of the EO against
Staphylococcus aureus and Escherichia coli isolated from artisanal Minas
cheese produced in Brazil and found that both strains were sensitive to its
bactericidal activity.
A multiple-species approach has been used in many researches. In the
in vitro evaluation of the antimicrobial activity of EOs of Cinnamomum cassia
(Chinese cinnamon), Origanum vulgare (oregano), Piper nigrum (black pepper)
and Thymus vulgaris (white thyme), Lavinik (2013) has found that only P.
nigrum showed no inhibitory effect on the growth of enteric Salmonella samples
isolated from poultry. In contrast, T. vulgaris and C. cassia were effective
against 91.3% of the strains, while O. vulgare had an effectiveness of 100%.
The high antimicrobial activity of Thymus and Origanum species has been
associated to their phenolic components such as thymol and carvacrol (Bassolé
& Juliani, 2012). Additionally, similar results were observed by Cleff et al.
(2010). They studied the EO of O. vulgare against strains of Candida spp.
isolated from animals and found that this oil may represent an alternative for the
By investigating the antibacterial activity of EOs from Coriandrum
sativum L. (coriander), Ocimum basilicum L. (sweet basil), Origanum majorana
L. (marjoram) and Rosmarinus officinalis L. (rosemary), Guerra et al. (2012)
found that they presented an effective antibacterial activity against MDR strains
of Acinetobacter spp., except for coriander, which presented lower activity. A
latter study by Guerra et al. (2013) suggested that the EO of Citrus limonun is
also effective against MDR strains of Acinetobacter spp.
Following the multiple-species approach, Silveira et al. (2012) studied
the antimicrobial activity of EOs of herbs grown in the southern Brazil against 12
important bacterial species in food. They noted that the EOs with greater activity
against the bacteria tested were, in descending order, Cymbopogon flexuosus
(lemongrass), Ocimum basilicum L. (sweet basil), Origanum vulgare (oregano),
Cinnamomum zeylanicum (cinnamon) and Laurus nobilis (bay laurel). The
bacterium Yersinia enterocolitica was the most sensitive pathogen to all EOs
tested (MIC 0.62 mg mL-1).
Furthermore, Rana et al. (2011) investigated the antibacterial activity of
19 EOs against four species of bacteria: Pseudomonas aeruginosa,
Staphylococcus aureus, Salmonella typhimurium and Bacillus subtilis. Various
degrees of antibacterial activity were found: Cinnamomum zeylanicum, with the
most prominent antibacterial activity, was followed, respectively, by
Cymbopogon ciatrus and Carum copticum.
Recent researches have aimed to detect in vitro antifungal action of
EOs extracted from plant species native to other biomes. Cyclotrichium
leucotrichum (Lamiaceae), a plant species native to Iran, and Thymus
Candida albicans (Mirjalili et al., 2013; Bellete et al., 2012). The latter was
further suggested to have an antifungal action against Aspergillus fumigatus
and dermatophytes (Bellete et al., 2012).
Calamintha nepeta L (Lamiaceae) Savi subsp. nepeta and Smyrnium
olusatrum L. (Apiaceae), two species native to the Mediterranean coast (Island
of Sardinia, Italy) and to Portugal’s Atlantic coast, were used by Marongiu et al.
(2010, 2012) in order to evaluate the antifungal activity of their EOs against five
species of Candida (C. albicans, C. tropicalis, C. krusei, C. guillermondii, C.
parapsilosis), three species of Aspergillus (A. niger, A. fumigatus, A. flavus), two
species of Microsporum (M. canis, M. gypseum), two species of Trichophyton
(T. rubrum, T. mentagrophytes), Cryptococcus neoformans and
Epidermophyton floccosum. Using MIC and MLC values, it was observed that
C. nepeta L populations rich in pulegone exhibited significant antifungal activity
against Aspergillus and dermatophyte strains (MIC = 0.32 to 1.25 mL mL⁻¹). In
the other hand, S. olusatrum L. oils were particularly active against
dermatophytes strains and C. neoformans (MIC = 0.32 to 0.64 mL mL⁻¹).
Concerning the cell wall structure of bacteria, some studies have
reported that EOs show better activity against Gram-positive bacteria rather
than Gram-negative bacteria. Marzoug et al. (2010), for example, observed this
phenomenon by studying the antimicrobial activity of the EO of Eucalyptus (E.
gracilis, E. oleosa, E. salubris, and E. salmonophloia). Furthermore, Zarai et al.
(2011) reported the same antimicrobial activity while studying the EO of
Marrubium vulgare.
Finally, after analyzing all data collected in this literature review and as
compare results from different studies because of the considerable variation
among the methods used to evaluate the inhibitory effect of EOs on different
microorganisms, such as: exposure of the microorganism to the oil, amount of
emulsifier used, oil solubility and the type of microorganisms used in different
tests.
Conclusion
This review suggests that there has been an improvement in the study
of essential oils of vegetable origin and in the elucidation of their antimicrobial
activity. Undoubtedly, essential oils have proven to be a promising source of
biologically active compounds. Hence, further studies are needed in order to
understand their therapeutic potential and to establish new treatments for
pathogenic diseases.
Declaration of interest
The authors report no declarations of interest
References
Abdullah IH, Farooq A, Muhammad S, Muhammad A, Roman P. (2010).
Chemical Composition, and Antioxidant and Antimicrobial Activities of Essential
Oil of Spearmint (Mentha spicata L.) From Pakistan. Journal of Essential Oil
Arango WM, Marín PA, Murillo BH, Jaramillo CAP. (2013). Actividad insecticida
de una emulsión aceite/agua Del aceite esencial de Eucalyptus. Revista
Cubana de Plantas Medicinales, 18, 109-117.
Bassolé IHN, Juliani HR. (2012). Essential Oils in Combination and Their
Antimicrobial Properties. Molecules, 17, 3989-4006.
Bellete B, Rabérin H, Flori P, El Akssi S, Tran Manh Sung R, Taourirte M, Hafid
J. (2012). Antifungal effect of the essential oil of Thymus broussonetii Boiss
endogenous species of Morocco. Nat Prod Res., 26,1692-1696.
Carmo, ES. (2011). Ensaio clínico com óleo essencial de Cymbopogon citratus
(DC) Stapf. para tratamento de pitiríase versicolor. (Tese) Doutorado em
Produtos Naturais e Sintéticos Bioativos – Concentração: Farmacologia.
Universidade Federal da Paraíba, João Pessoa, PB.
Castro CE, Ribeiro JM, Diniz TT, Almeida AC, Ferreira LC, Martins ER, Duarte
ER. (2011). Antimicrobial activity of Lippia sidoides Cham. (Verbenaceae)
essential oil against Staphylococcus aureus and Escherichia coli. Rev. Bras. Pl.
Med., 13, 293-297.
Cleff MB, Meinerz AR, Xavier M, Schuch LF, Meireles MCA, Rodrigues MRA,
Mello JRB. (2010). In vitro activity of Origanum vulgare essential oil against
Candida species. Brazilian Journal of Microbiology, 41, 116-123.
Ehlert PAD, Ming LC, Marques MOM, Fenandes DM, Rocha WA, Luz JMQ,
Silva RF. (2013). Influência do horário de colheita sobre o rendimento e
composição do óleo essencial de erva-cidreira brasileira [Lippia alba (Mill.) N.
E. Br.]. Rev. Bras. Pl. Med., 15, 72-77.
Gomes dos Santos EC, Donnici CL, Camargos ER, Augusto de Rezende A,