UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTREO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO E PATOLOGIA ORAL
ESTUDO IN VITRO DOS EFEITOS DA BMP-2 E DO SEU
ANTAGONISTA NOGGIN SOBRE A PROLIFERAÇÃO E
MIGRAÇÃO CELULARES EM CARCINOMA EPIDERMÓIDE
DE LÍNGUA
NATAL/RN
2014
2014
ESTUDO IN VITRO DOS EFEITOS DA BMP-2 E DO SEU
ANTAGONISTA NOGGIN SOBRE A PROLIFERAÇÃO E
MIGRAÇÃO CELULARES EM CARCINOMA EPIDERMÓIDE DE
LÍNGUA
Tese apresentada ao Colegiado do Programa de Pós-graduação em Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte, como parte do requisitos para a obtenção de Título do Doutor em Patologia Oral
DOUTORANDA: Cyntia Helena Pereira de Carvalho ORIENTADOR: Prof. Dr. Leão Pereira Pinto
NATAL/RN
2014
Carvalho, Cyntia Helena Pereira de Carvalho.
Estudo in vitro dos efeitos da BMP-2 e do seu antagonista Noggin sobre a proliferação e migração celulares em carcinoma epidermóide de língua/ Cyntia Helena Pereira de Carvalho. – Natal, RN, 2010.
90 f. : il.
Orientador: Prof. Dr. Leão Pereira Pinto.
Tese (Doutorado em Patologia Oral) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Departamento de Odontologia. Programa de Pós-Graduação em Patologia Oral.
1. Carcinoma epidermóide oral – Tese. 2. Proteínas morfogenética óssea -2 – Tese. 3. Proliferação celular – Tese. 4. Metástase – Tese. 5. Noggin – Tese.
I. Pinto, Leão Pereira, II. Título.
RN/UF/BSO Black D65
“Ao Deus Pai, que aos cansados Ele dá novas forças e enche de energia os fracos. No sofrimento eu fui consolada, porque a sua promessa me deu forças. Pois, o Eterno é bom; o seu amor dura para sempre e sua felicidade não tem
fim.” (Is 40.29; Sl 119.50; Sl 100.5)
Dedico com amor aos amado...
Ao meu querido pai, Tarcísio Amorim de Carvalho (in memoriam), que estaria com os olhos brilhando ao ver sua filha se tornar doutora. “-Painho, você não está de corpo presente, mas meu coração sente sua força a cada minuto dedicado nessa carreira e sei que o senhor foi mais um anjo que me protege lá de cima. Essa vitória é fruto da sua dedicação à educação dada a mim e a meus irmãos. Obrigada pelo apoio incondicional a toda a minha formação!”
A minha Mãe amada, Ilma Helena Pereira de Carvalho, mulher forte e de fibra que me dá exemplo de perseverança todos os dias. Sempre me ensinou que devemos batalhar muito para termos sucesso. Obrigada por todo o cuidado que teve e tem comigo. Você foi fundamental nessa minha caminhada.
Aos meus irmãos, Cynara Helena/Geovanni e José Inácio/Jocyelli, pelo amor, proteção e companheirismo. Obrigada por sempre me socorrerem até no mínimos detalhes da minha vida.
Aos meus pequeninos sobrinhos lindos, Clarinha, Geovanninho, Joãozinho, Tarcila e Julinha, que tanto amo e que me dão forças e alegrias. Os dias com vocês são muito mais legais!!!!
“Cada pessoa que passa em nossa vida, passa sozinha, pois cada pessoa é única e nenhuma substitui a outra... Há os que levam muito mas não há os que não levam nada; há os que deixam muito, mas não há os que não deixam nada. Essa é a maior e mais bela responsabilidade de nossa vida e a prova de que duas almas não se encontram por acaso.”
(Charlie Chaplin)
Era início de semestre de 2003.1, quando tive a primeira aula da disciplina de patologia geral no Departamento de Odontologia da UFRN. No primeiro dia de aula, entram na sala seis professores (-Sim, apenas 6 professores, pois as professoras Marcia e Éricka ainda eram alunas), que se apresentaram e explicaram como a disciplina iria funcionar. Foram apenas 10 minutinhos... Dez minutos que entraram para a minha história... Pela primeira vez, depois de um ano de curso, eu via a apresentação da disciplina com todos os professores... Aaah que Professores!!! Via-se nos olhos, o carinho e a dedicação que àqueles professores, até então desconhecidos, tinham com a disciplina e o curso ao qual eu estava inserida. Nunca vou esquecer da aula de Biópsia do professor Leão, da aula de noções neoplasias, a qual o professor Costa, ao falar de oncogenes levou a capa da revista americana Times falando da descoberta da p53. Da aula de neoplasias de glândulas salivares, da professora Lélia, que passava cada slide com entusiasmo. Vi profissionais que hoje são respeitados na nossa classe e experientes ainda alunos de pós-graduação. Lembro-me da aula de cisto dentígero do Professor Gustavo Godoy, da aula de Cárie da Professora Marcia e da Aula de cisto radicular da Professora Éricka (ainda tenho o artigo que foi debatido sobre a origem do
cisto que ela passou). Ao ver esses exemplos decidi: “-Pronto! É isso!... Tô no
lugar certo...” Bastou o convite do Professor Dr. Leão Pereira Pinto para
conhecer o Programa de Iniciação Científica da Base de Pesquisa em Patologia
Oral que não pensei duas vezes: “-Eu vou!” e fui... Confesso que as primeiras
reuniões não entendia muito dos assuntos dos projetos, quando um belo dia o
Professor Leão olha para mim e diz: “- Você será a debatedora do próximo
encontro.” Era uma mistura de felicidade, pelo reconhecimento do professor, com apreensão. “-O que era fibronectina?!!” A partir daí me tornei bolsista
Aqui, sinceramente gostaria de agradecer a todos que direta ou indiretamente puderam contribuir não só com o desenvolvimento deste trabalho, como, principalmente, com o meu amadurecimento pessoal e profissional.
Ao meu orientador Professor Dr.Leão Pereira Pinto, que me possibilitou a honra de ser sua orientanda. Minha gratidão será eterna ao senhor pela imensa dedicação dispensada a minha pessoa. O seu exemplo de vida me faz acreditar no melhor sempre e me dá forças na carreira que pretendi seguir. O conhecimento, o cuidado, o amor e a generosidade que o senhor tem, me faz considerá-lo como um segundo pai. Um pai na minha vida científica e também um pai para vida toda. Professor, tenha aqui uma filha que estará sempre ao seu dispor, aonde eu estiver.
À Professora Dra. Lélia Batista de Souza, que sempre abriu as portas para mim. Sinto orgulho de dizer que a senhora foi também minha orientadora durante essa trajetória e que, me permita dizer, se tenho um pai na ciência, a senhora é a minha mãe científica. Exemplo de mulher e pesquisadora, tem minha admiração e terá sempre minha gratidão por toda atenção dispensada a minha pessoa.
Ao Professor Dr. Antonio de Lisboa Lopes Costa, que me deu a primeira bolsa de iniciação científica e que possibilitou muitos caminhos a serem trilhados durante minha graduação. Meus sinceros agradecimentos e saiba que me identifico bastante com seus ideais.
À Professora Roseana de Aldeida Freitas, por todos os ensinamentos sempre muito embasados em pura ciência. Muito Obrigada pelo carinho e respeito, seu exemplo de harmonia com o trabalho deve ser seguido.
À Professora Hébel Cavalcanti Galvão, por toda simpatia, carinho e gentileza sempre que precisei da senhora. Muito Obrigada!
À Professora Dra. Éricka Janine Dantas da Silveira, por todo conhecimento transmitido e demonstrar todo esforço tem recompensa e que vale a pena acreditar nos sonhos.
À Professora Dra. Lélia Maria Guedes Queiroz, por toda gentileza dedicado a minha pessoa e pelo exemplo de convivência pacífica que transmite.
À Professora Dra. Marcia Cristina da Costa Miguel, por me ensinar a argumentar diante de pesquisas, despertar a curiosidade e a paixão pela imunologia, graças a essa paixão hoje sou professora.
Ao Professor Dr. Carlos Augusto Galvão Barbosa, do Departamento de Morfologia da UFRN, pela disponibilidade dispensada a minha pessoa desde o primeiro contato que fiz para a realização deste projeto, ainda antes da seleção do doutorado. Obrigada pela confiança e pela oportunidade de aprendizado na minha vida profissional.
Ao Professor Dr. Cassiano Francisco Weege Nonaka que sempre me ajudou nos meus trabalhos com muita gentileza, exemplo de um profissional competente.
Ao Professor Dr Adriano da Rocha Germano, por todos os ensinamentos passados durante a vida acadêmica e de pós-graduação. Tenho orgulho de dizer que fui sua aluna. Muito obrigada por tudo!
Ao Professor Dr Hugo Alexandre de Oliveira Rocha e a todos os alunos e técnica do laboratório de Biopolímeros da UFRN, em especial a Ruth, Rafael, Raniere e a Ana Katarina, por terem me recebido de forma tão gentil e por toda ajuda nos conhecimentos em bioquímica e culturas de células cedidos, além de todos os reagentes que eu não possuía e que foram cedidos e feitos para proporcionar os experimentos da presente pesquisa.
À Fernanda Ginani, um anjo, pela ajuda imensurável no desenvolvimento laboratorial desta tese. Fernanda, sem você não teria feito essa caminhada. Você me ensinou e trabalhou junto comigo. Sempre agradecerei a você pela sua disponibilidade e paciência pelas tantas vezes que te “aperriei.” Você é um exemplo de que o conhecimento de verdade deve ser partilhado. Muito Obrigada!
mediram nenhum esforço para me ajudar quando precisei. Terão minha ajuda e meu reconhecimento aonde for! Obrigada por tudo doutores!!! À querida Professora Dra. Águida Cristina Herriques Leitão que tanto me ajudou com sua amizade e sua contribuição no protocolo desta pesquisa foi essencial para o desenvolvimento deste trabalho. Você é uma profissional admirável!
À amiga e agora Professora Dra. Ana Rafaela Luz de Aquino, pela sua cumplicidade desde a graduação, na pós-graduação e agora na docência. Te admiro desde sempre e agradeço a Deus você em minha vida.
Aos amigos e colegas de doutorado, Stefânia Jerônimo, Clarissa Demeda, Denise Hélen de Olibeira, Bárbara Monteiro, Natália Barbosa, Ana Luiza Leite, Roseane Vasconcelos, Edilmar Moura, Conceição Aparecida, Emília Beatriz, Adriana Costa, José Nazareno, Melka Sá, Rodrigo Gadelha e Jamile Moura. Cada um contribuiu de alguma forma com meu aperfeiçoamento no Programa de Pós- graduação. Em especial a Clarissa Demeda pela ajuda junto aos trabalhos do Professor e à Denise Hélen de Oliveira por ajudar com um sorriso no rosto, digna de pessoas gentis e boas.
À querida Idel, que sempre me ajudou com muita disposição e competência. Sua educação e simpatia são admiráveis. Muito obrigada por tudo!
À Graça Galvão, nossa querida Gracinha, por toda dedicação em nos ajudar. Obrigada pela paciência e por sempre resolver meus problemas.
À Sandovânia Oliveira, nossa querida Sandrinha, pela disponibilidade de fazer nossas lâminas sempre com competência. Serei grata por cada trabalho meu a qual você trabalhou com tanta dedicação.
À Hévio Lucena, pela dedicação a nossos trabalhos e pela competência na imunoistoquímica. Obrigada!
À Ricardo Silva pela sua demonstração de responsabilidade no trabalho. Obrigada!
À minha querida e imensa família, avós, tios, tias, primos e agregados, pela força e exemplo de união. O pilar embasado na família nunca cai!
Ao querido Sidharta Augusto, pela amizade abençoada por Deus. Sua ajuda sempre foi presente em minha vida durante toda essa caminhada. Você sabe que o que você precisar não medirei esforços para te ajudar.
Às minhas queridas amigas do Marista, o quinteto fantástico, Débora, Taissa, Isabella e Ana Claúdia, pela amizade duradoura e verdadeira.
Às minhas amigos de Faculdade, Chrystiane Guedes, Alessadra Barreto, Leila Massud, Iane Damasceno, Rosaverena Costa, Patrícia Matsuno e Ana Patrícia Fernandes pelas conversas e amizade que sempre deixam a vida melhor e mais leve de ser vivida.
À Universidade Federal do Rio Grande do Norte, através do Programa de Pós-Graduação em Patologia oral, por ter possibilitado a concretização de um sonho. Hoje sou uma docente e chego ao final do doutorado graças a todo investimento e confiança depositado em meus trabalhos.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo auxílio financeiros que possibilitaram a realização deste trabalho.
Aos meus queridos amigos de profissão da UFCG, Ana Carolinna Albuquerque, George Nascimento, Luciana Gominho, Pedro Paulo dos Santos, Solange Kerpel pela honra de trabalhar ao lados de pessoas tão amigas e éticas. Obrigada por todo aprendizado que vocês me proporcionam.
À Universidade Federal de Campina Grande, a qual sou docente e que me liberou para concluir minhas atividades do doutorado e que tanto me apoia.
RESUMO
O carcinoma epidermóide oral (CEO) representa a neoplasia maligna mais prevalente na cavidade oral e por atingir um grande número de indivíduos, acaba se tornado um relevante problema de saúde pública. Muitos estudos demonstram alterações nos componentes da via BMP em vários tipos de tumores, como os de próstata, cólon, mama, gástricos e CEOs. É do conhecimento atual que essas proteínas podem exercer efeito pró-tumoral em estágios mais avançados do desenvolvimento neoplásico vindo a favorecer a progressão e invasão tumoral. A inibição da via de sinalização da BMP-2, através dos seus antagonistas, tem mostrado resultados positivos de ação antitumoral e que assim, o uso do Noggin pode ser um novo alvo terapêutico contra o câncer. Diante destas evidências e dos escassos trabalhos com BMP-2, Noggin e CEO, o objetivo desta pesquisa foi avaliar o efeito da BMP-2 e seu antagonista Noggin sobre a proliferação e migração celulares em culturas de células de carcinoma epidermóide de língua humana (SCC25). Foi feita a divisão em três grupos de estudo, um grupo controle, onde as células SCC25 não sofriam tratamento com substância alguma, um grupo BMP-2, no qual as células eram tratadas com 100ng/ml de BMP-2 e um grupo de células que eram tratadas com 100ng/ml de Noggin. Para o ensaio de proliferação e ciclo celular foram estabelecidos três intervalos de tempo (24, 48 e 72 horas). A atividade proliferativa foi investigada por azul de tripan e a análise do ciclo celular através da marcação por iodeto de propídio em Citometria de fluxo. O potencial de migração/invasão das células SCC25 foi avaliado através da realização de um ensaio de invasão celular utilizando o matrigel em um intervalo de 48 horas. A curva de proliferação revelou maior crescimento celular nas células tratadas com BMP-2 no intervalo de 72 horas (p<0.05) e menor crecimento e viabilidade celular no grupo Noggin. As proteínas recombinantes favoreceram a maior porcentagem das células na fase do ciclo celular Go/G1 com diferença estatisticamente significativa no intervalo de 24 horas (p<0,05). A BMP-2 promoveu uma maior invasão das células estudadas, assim como o seu antagonista Noggin inibiu a invasão das células estudadas (p<0,05). Dessa forma, os resultados indicam que a BMP-2 favorece o fenótipo maligno, pois estimula a proliferação e invasão das células SCC25 e seu antagonista Noggin pode ser uma alternativa terapêutica pois inibiu essas características pró-tumorais.
ABSTRACT
Oral squamous cell carcinoma (OSCC) is the most prevalent malignancy in the oral cavity and reach a large number of individuals, has become an important public health problem. Studies have demonstrated changes in pathway components BMP in various types of cancers as prostate, colon, breast, gastric and OSCCs. Is the current knowledge that these proteins may exert pro-tumor effect in more advanced stages of neoplastic development coming to favor progression and invasion tumor. The inhibition of the signaling pathway BMP-2 through its antagonists, have shown positive results of antitumor activity and use of Noggin may be a novel therapeutic target for cancer. Given this evidence and the few studies with BMP-2, Noggin and OSCC, the objective of this research was to evaluate the effect of BMP-2 and its antagonist Noggin on proliferation and migration cell in line of cell cultures of human tongue squamous cell carcinoma (SCC25). The study was divided in three groups, a control group, where SCC25 cells suffered no treatment, a 2 group, in which cells were treated with 100ng/ml of BMP-2 and a group of cells that were treated with 100ng/ml of Noggin. For the proliferation assay and cell cycle were established three time intervals (24, 48 and 72 hours). Proliferative activity was investigated by trypan blue and cell cycle analysis by staining with propidium iodide flow cytometry. The potential for migration / invasion of SCC25 cells was performing by a cell invasion assay using Matrigel in a 48-hour interval. The proliferation curve showed a higher proliferation in cells treated with BMP-2 in 72 hours (p < 0.05), and lower overgrowth and cell viability in Noggin group. Recombinant proteins favored a greater percentage of cells in cell cycle phase Go/G1 with a statistically significant difference in the interval of 24 hours (p < 0.05). BMP- 2 produced a greater invasion of cells studied as well as its antagonist Noggin inhibits invasion of cells (p < 0.05). Thus, these results indicate that BMP-2 promotes malignant phenotype, dues stimulates proliferation and invasion of SCC25 cells and, its antagonist Noggin may be an alternative treatment, due to inhibit the tumor progression.
Keywords: Squamous cell carcinoma, cell proliferation, metastasis, bone morphogenic protein
LISTA DE ILUSTRAÇÕES
Página
Figura 1 Sinalização Canônica da via BMP: (1) Fosforilação da R-Smad; (2) Ligação com a Co-Smad transporte do sinal para núcleo; (3) e (4) inibição da via por fatores intracelulares (I-Smads e Smufs) ... 37 Figura 2 Sinalização canônica da BMP através da Smad; B: Oligomerização do
receptor tipo I e posterior ligação com o receptor tipo II induzindo a via p38... 38 Figura 3 Modelo do plaqueamento celular utilizado no estudo para cada ensaio em
placas de 24 poços... 54 Figura 4 Em (A) observa-se a solução do matrigel sobre o filtro na câmara de
invasão (Transwell). (B) Aspecto microscópico dos múltiplos poros da membrana de polietileno. (C) Disposição dos Transwells nos poços da placa para o ensaio de invasão ... 57 Figura 5 Modelo para contagem das células que invadiram a membrana de
polietileno no ensaio de invasão... 59 Figura 6 Aspecto das membranas escaneadas, sob o aumento de 5000µm. É
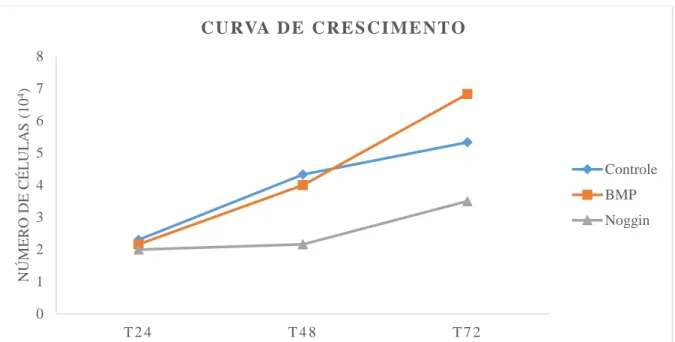
possível ver toda a membrana e evidenciar uma maior área de coloração azul no grupo BMP-2 (B) seguida pelo controle (A) e com menor intensidade a membrana do grupo Noggin(C)... 67 Gráfico 1 Curva de crescimento das células SCC25 durante 72 horas de experimento
para os diferentes grupos estudados. Natal-RN, 2014... 62 Gráfico 2 Quantidade de células SCC25 invasoras expressas em mediana referente
LISTA DE TABELAS
Páginas Tabela 1 - Porcentagem (mediana) das células SCC25 viáveis nos diferentes grupos
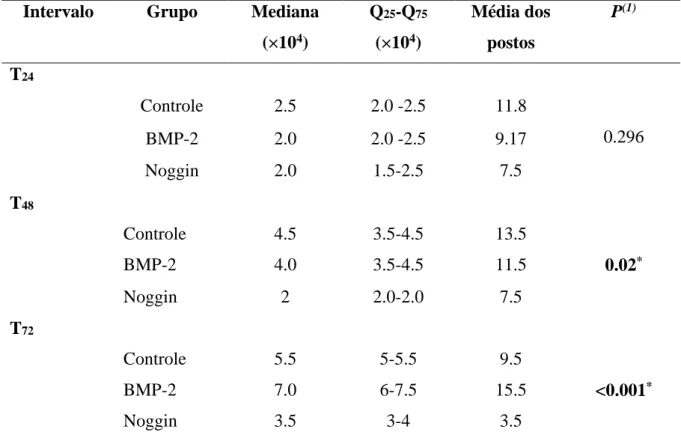
durante 72 horas de experimento. Natal-RN, 2014... 61 Tabela 2 - Mediana, quartis 25 e 75, média dos postos e significância estatística para
o crescimento das células SCC25, em cada intervalo de tempo, nos diferentes grupos estudados. Natal-RN, 2014... 63 Tabela 3 - Análise pareada do crescimentodas células SCC25, em cada intervalo de
tempo, nos diferentes grupos estudados. Natal-RN, 2014... 63 Tabela 4 - Mediana, quartis 25 e 75, média dos postos e significância estatística para
a porcentagem de células SCC25, nas fases do ciclo celular no intervalo de T24, nos diferentes grupos estudados. Natal-RN, 2014... 64 Tabela 5 - Mediana, quartis 25 e 75, média dos postos e significância estatística para
a porcentagem de células SCC25, nas fases do ciclo celular no intervalo de T48, nos diferentes grupos estudados. Natal-RN, 2014... 65 Tabela 6 - Mediana, quartis 25 e 75, média dos postos e significância estatística para
a porcentagem de células SCC25, nas fases do ciclo celular no intervalo de T72, nos diferentes grupos estudados. Natal-RN, 2014... 65 Tabela 7 - Medianas da porcentagem de células SCC25 em cada fase do ciclo
celular, nos diferentes grupos estudados, em cada intervalo de tempo. Natal-RN, 2014... 66 Tabela 8 - Mediana, quartis 25 e 75, média dos postos e significância estatística para
potencial de invasão das células SCC25, durante 48 horas, nos diferentes grupos estudados. Natal-RN, 2014... 68 Tabela 9 - Análise pareada das medianas do potencial de invasão das células
LISTA DE SIGLAS E ABREVIATURAS
AKT – São proteínas membro da família proteína quinase e desempenha importante papel na sinalização celular de mamíferos.
BAMBI – Inibido de membrana ligada a activina da proteína morfognética óssea. BAX - Gene ou proteína pró-apoptótica.
Bcl-2 – Gene ou proteína anti-apoptótica.
BMP – Do inglês, Body Morphogenetic Proteins (Proteína Morfogenética do Osso) BMPR - Do inglês, Body Morphogenetic Proteins Receptor (Receptor de Proteína
Morfogenética do Osso).
CD 31 - Do inglês, Cluster designation ou Cluster of differentiation (Grupo de designação ou Grupo de diferenciação).
CEO - Carcinoma epidermóide oral.
C-fos – Do inglês, Finkel & Osteogenic Sarcoma (Finkel e sarcoma osteogênico), oncogene fos (c-fos) codifica uma proteina nuclear que está envolvida no controle transcricional relacionado com o crescimento.
C-jun – Do Japonês, jun é a sigla de “JU-Nana" para 17 (vírus do sarcoma aviário 17). Oncogene jun (c-jun) codifica uma proteína nuclear que está envolvida no controle transcricional relacionado com o crescimento.
Dan – Do inglês differential screening-selected gene aberrative in neuroblastoma (seleção de genes aberrante do neublastoma).
EGF – Do inglês Epidermal growth factor (Fator de crescimento epidérmico).
ERK – Do inglês Extracellular Signal-Regulated Protein Kinases , Sinal celular regulado por quinase.
FDA – Do inglês Food and Drug Administration é o órgão governamental dos Estados Unidos da América responsável pelo controle dos alimentos (tanto humano como animal), suplementos alimentares, medicamentos (humano e animal), cosméticos, equipamentos médicos, materiais biológicos e produtos derivados do sangue humano. FvW- Fator de von Willebrand.
HPV - Do inglês Human papilomavirus, Papiloma vírus humano. IL-8 – Interleucina 8.
INCA - Instituto Nacional do Câncer.
MMP - Metaloproteinases da matriz extracelular. MTT -
OMS – Organização Mundial da Saúde.
P13K- Do inglês phosphatidylinositol 3-kinase, Fosfatidilinositol 3-quinase. Inibidor com potencial da atividade neoplásica.
P21 – Proteína reguladora da transição da fase G1 para S no ciclo celular. PCR - Do inglês Polimerase chain reaction (Reação em cadeia da polimerase). RAS – Oncogene trandutor de sinal extra celular.
RNAm - Do inglês menseger ribonucleic acid (Ácido ribonucléico mensageiro). RT-PCR - Do inglês Reverse transcription polimerase chain reaction (Reação em
cadeia da polimerase com transcrição reversa).
SMAD - proteínas que modulam a atividade do TGF-β, são homólogas a proteínas drosófilas, mothers against decapentaplegic (MAD) e Caenorhabditis elegans (SMA). O nome é uma combinação dos dois.
SMURF – De inglês Smad ubiquitination regulatory factors (Fator regulatório de ubiquinização de Smad).
TGF - Do inglês Transforming growth factor (Fator transformante de crescimento). Tsg – Do inglês twisted gastrulation (Gastrulação tocida)
VEGF - Do inglês Vascular endothelial growth factor (Fator de crescimento endotelial vascular).
S U M Á R I O
Página
1 INTRODUÇÃO... 27 2 REVISÃO DA LITERATURA... 30 2.1 CARCINOMA EPIDERMÓIDE ORAL... 31 2.2 BMPS: ESTRUTURA, FUNÇÃO E SINALIZAÇÃO... 33 2.3 NOGGIN: CONSIDERAÇÕES GERAIS... 39 2.4 A INFLUÊNCIA DOS COMPONENTES DA SINALIZAÇÃO DAS BMPS NO
INTRODUÇÃO
“Ensina-me o bom senso e o conhecimento, pois confio em Teus mandamentos.”
1 INTRODUÇÃO
O câncer é a principal causa de morbidade em todo o mundo e é uma das principais causas de morte em toda a sociedade (SHENOI et al., 2012). O carcinoma epidermóide (CE) é a neoplasia maligna mais comum da boca, representando cerca de 90% de todas as neoplasias malignas que acometem as estruturas orais. A sua ocorrência corresponde a sexta dentre todas as neoplasias malignas que afetam o ser humano (CHOI et al., 2006; LIANG et al., 2008).
O carcinoma epidermóide oral (CEO), devido ao grande número de indivíduos que acometem, acaba se tornado um relevante problema de saúde pública. Numerosos são os estudos que visam compreender sua etiologia e patogênese, identificando genes e proteínas que estão envolvidos nesses processos (HARDISSON, 2003; NAGPAL; DAS, 2003; THIAGARAJAN et al., 2014; CHENG; REES; WRIGHT, 2014). Acredita-se que esses estudos sejam importantes para o estabelecimento de novas e específicas estratégias de diagnóstico, prognóstico e tratamento dessas neoplasias (BAGAN; SCULLY,2009; SCULLY; BAGAN, 2009).
As proteínas morfogenéticas do osso (BMPs) são citocinas pleiotrópicas pertencentes à superfamília do fator de crescimento transformador-β (TGF-β) (BALEMANS; VAN HUL, 2002). A literatura contemporânea acredita que as BMPs tenham efetiva participação no crescimento de neoplasias malignas. Muitos estudos demonstram alterações nos componentes da via BMP em vários tipos de tumores, como os de próstata, cólon, mama, cérebro, gástricos e epidermóides orais (DERYNCK; AKHURST; BALMAIN, 2001; LEVY; HILL, 2006; BLANCO CALVO et al., 2009; KANG et al., 2010; DE CARVALHO et al., 2011).
A via de sinalização das BMPs é mediada por receptores, co-receptores e antagonistas (BLANCO CALVO et al. 2009). A sinalização intracelular da BMP-2 forma complexos que se translocam para o núcleo e regulam a transcrição de genes alvos, tais como ciclina D1, p21, BAX, Bcl-2, VEGF e MMPs que irão ativar mecanismos relacionados à proliferação, apoptose, angiogênese e remodelação tecidual (VON BUBNOFF; CHO, 2001; HARDWICK et al., 2004; HARDWICK et al., 2008).
2013) e administração da proteína recombinante Noggin em células de carcinoma de próstata diminuiu o potencial de proliferação e invasão dessas células (FEELEY et al. 2006).
REVISÃO DE LITERATURA
“Dedique à disciplina o seu coração, e os seus ouvidos às palavras que dão conhecimento”.
2 REVISÃO DA LITERATURA
2.1 CARCINOMA EPIDERMÓIDE ORAL
O CE, também denominado de carcinoma de células escamosas ou carcinoma espinocelular, define-se como uma neoplasia maligna com origem no epitélio pavimentoso estratificado (KADEMANI, 2007).
Histologicamente, o CE se apresenta como uma proliferação de células da camada espinhosa, que se dispõe em grupos celulares, formando cordões e ninhos ou, isoladamente, invadindo o conjuntivo. As células neoplásicas exibem hipercromatismo nuclear, pleomorfismo celular, mitoses atípicas, dentre outras anormalidades (JOHNSON et al., 2005; NEVILLE et al., 2009; BATISTA et al., 2010).
Conforme definição da Organização Mundial de Saúde (OMS), o CEO se caracteriza por ser uma neoplasia epitelial invasiva com variados graus de diferenciação escamosa e uma propensão à metástases linfonodais precoces (JOHNSON et al., 2005). No Brasil, este câncer é o quinto mais incidente em homens e o décimo primeiro em mulheres. Quanto a estimativa para CEO em 2012/2013 esta é de 9.990 novos casos por 100.000 homens, e de 4.180 por 100.000 mulheres. Para o estado do Rio Grande do Norte, a incidência prevista é de 5 a 7% de todas as neoplasias malignas (INCA, 2014).
Os CEs podem acometer qualquer parte da cavidade oral, desde os lábios até o arco palatoglosso. Os sítios mais comuns variam geograficamente, refletindo diferentes fatores de risco (SHENOI et al., 2012). Este fato pode ser observado no Brasil, uma vez que a incidência de CEO varia nas diferentes regiões, possivelmente, devido às diferenças locais na prevalência dos fatores de risco (COSTA; ARAÚJO; RAMOS, 2005; LOSI-GUEMBAROVSKI et al., 2009; FANG et al., 2013).
Muitos fatores estão envolvidos com a etiologia do CEO. Entre esses se destacam os fatores extrínsecos como o uso de tabaco, álcool, infecção pelo papilomavírus humano (HPV) e a radiação solar ultravioleta que representa o principal fator etiológico dos carcinomas de lábio inferior (LOURENÇO et al., 2007; SOARES et al., 2008; SCULLY; BAGAN, 2009). Já entre os fatores intrínsecos se incluem alterações genéticas, hábitos alimentares, estado imunológico e saúde oral geral (MCDOWELL, 2006; AMTHA et al., 2009; SCULLY; BAGAN, 2009). Contudo, para o seu desenvolvimento, torna-se necessário uma associação destes fatores, tendo em vista ser o CEO uma doença de etiologia multifatorial (CURADO; HASHIBE, 2009).
Pacientes acima de 40 anos são os mais acometidos, apresentando maior incidência com o decorrer da idade, sendo mais no sexo masculino que no feminino (3:1) (NEVILLE et al., 2009). No entanto, a incidência dessa neoplasia em adultos jovens e mulheres vêm crescendo, segundo levantamentos feitos na última década. Isto é atribuído principalmente pela mudança de hábitos das mulheres, como o aumento no consumo de álcool e tabaco, na expectativa de vida e o da infecção pelo HPV (SOARES et al., 2008; CURADO; HASHIBE, 2009; PATEL, 2011; MAJCHRZAK et al., 2014;THIAGARAJAN et al., 2014).
O potencial de agressividade está relacionado com diversos fatores, entre os quais se tem como mais significativos o grau histológico de malignidade, tamanho da lesão, grau de comprometimento dos tecidos vizinhos, presença de metástase no momento do diagnóstico e localização anatômica do tumor (CHOI et al., 2006), muito embora, esses fatores não permitam, realmente, prever o comportamento e o prognóstico dos casos (COSTA et al. 2002). Nesse contexto, marcadores moleculares têm sido extensamente procurados e estudados, porém ainda não foram totalmente esclarecidos.
O caráter genético do CEO é algo já bem estabelecido, onde se observam alterações estruturais envolvendo cromossomos 3, 7, 8, 9 e 11 (BAGAN; SCULLY, 2009), múltiplas alterações envolvendo oncogenes, genes supressores de tumor e os genes que são responsáveis pelo reparo do DNA. Os fatores ambientais, quando associados a esses fatores acarretam um mau funcionamento, com conseqüente perda de controle das funções celulares como divisão, diferenciação, senescência e apoptose, atribuindo à neoplasia suas características (SCULLY; BAGAN, 2009).
perda de coesão, invasão local e metástases. Além desses genes, podemos observar que oncogenes, genes reguladores da apoptose e genes do reparo de DNA também estão envolvidos com a carcinogênese. Os produtos desses genes são utilizados como marcadores em cânceres, sendo os mais observados, o receptor do fator de crescimento epidérmico (EGFR), erbB2, erbB3, genes membros da família ras (H-ras, K-ras, N-ras), c-fos, c-jun, marcadores da apoptose Bax e Bcl-3, genes supressores de tumor p53 e p16 e marcadores de proliferação Ki-67 (HARDISSON, 2003; BAGAN; SCULLY, 2009).
Muitos eventos moleculares cercam o processo de carcinogênese. Baseados nisso pesquisas tentam relacionar os aspectos clínico-patológicos com biomarcadores envolvidos com este complexo processo, para que ao final se possa correlacionar com o prognóstico, bem como encontrar alternativas terapêuticas que proporcionem uma sobrevida maior para os pacientes acometidos pelo câncer. Dentre estes, se destacam as BMPs.
2.2 BMPS: ESTRUTURA, FUNÇÃO E SINALIZAÇÃO
As BMPs são fatores de crescimento multifuncionais pertencentes à superfamília do
fator de crescimento transformador β (TGF- β) e foi primeiramente identificada pelo Dr. Marshal Urist, em 1965. Entretanto, essas proteínas responsáveis pela indução de osso permaneceram desconhecidas até a purificação e a seqüência de BMP bovina-3 (osteogenina) e clonagem das BMP-2 e -4 de humanos, no final de 1980 (CHEN; ZHAO; MUNDY, 2004; XIAO; XIANG; SHAO, 2007). Cerca de vinte membros de BMPs têm sido identificados em uma ampla variedade de organismos, desde insetos a mamíferos (HSU et al., 2005; KIM; KIM, 2006; STEINERT et al., 2008).
A família BMP é composta pelas seguintes moléculas: 2, 3, 4, BMP-5, BMP-6, BMP-7, BMP-8A, BMP-8B, Gdf2 (também chamada de BMP-9), BMP-10, Gdf11 (BMP-11), Gdf7 (BMP-12), Gdf6 (BMP-13), Gdf5 (BMP-14), BMP-15. Apenas a BMP-1, não pertence à família do TGF- β, embora nomeado BMP, não possui a sequência C-terminal que caracteriza a estrutura molecular deste grupo de citocinas, sendo identificada como uma proteinase C pró-colágeno e Chordin, um antagonista da ação das BMPs. (CANALIS; ECONOMIDES; GAZERRO, 2003; GRANJEIRO et al., 2005).
sétima que é usada para a dimerização com um segundo monômero e, essa dimerização é pré-requisito para sua ação biológica (NOHE et al., 2004; WAN; CAO, 2005).
As BMPs são glicoproteínas de peso molecular baixo, de estrutura dímera, composta por duas cadeias polipeptídicas, unidas por pontes de dissufelto, podendo ser homodímeras (duas cadeias idênticas) ou moléculas heterodímeras (duas cadeias diferentes) (GRANJEIRO et al., 2005). Ao sofrerem dimerização, suas moléculas são clivadas proteoliticamente na região carboxi-terminal durante sua secreção. Uma vez secretadas, ligantes diméricos maduros com peso de 21-25 KDa ligam-se a receptores de membrana plasmática em diferentes tipos celulares, com efeitos autócrinos e parácrinos (BALEMANS; VAN HUL, 2002; KIM; KIM, 2006).
Com o avanço das pesquisas, observou-se o relevante potencial biológico da sinalização das BMPs, participando da morfogênese, desenvolvimento e homeostase de diversos órgãos como o coração, rim, cérebro, olhos, pulmão, pele, dente, etc. Diante desses achados, foi proposto que as BMPs não fossem tão somente consideradas proteínas relacionadas com o tecido ósseo e sim denominadas proteínas morfogenéticas do corpo (que no inglês é Body, desta forma, não alterando a sigla), pois se tem demonstrado um amplo espectro de atividades biológicas relativas a essas proteínas sobre diversos tipos celulares, incluindo monócitos, células epiteliais, células mesenquimais e células neurais (BALEMANS; VAN HUL, 2002; REDDI, 2005).
Estudos demonstraram que ratos mutantes para BMP-2 morrem ao apresentarem defeitos no desenvolvimento cardíaco e nos tecidos periembrionários. Mutações na BMP-4 também causam morte por falta de diferenciação mesodérmica. Além disso, ratos com mutações no gene da BMP-7 acarretam a não formação de olhos e falta de desenvolvimento glomerular, o que leva a insuficiência renal e morte logo após o nascimento, bem como, defeitos na BMP-8 provocam infertilidade devido a defeitos na espermatogênese (VARGA; WRANDA, 2005). Xiao, Xiang e Shao (2007) afirmaram que as BMPs são capazes de controlar diferentes medidas de diferenciação e de especificação de vários tipos de células embrionárias para originarem componentes distintos do sistema nervoso dos vertebrados. Da mesma forma, no desenvolvimento embrionário, as BMPs têm um papel fundamental na apoptose, um processo necessário para remover as células que não serão mais úteis no desenvolvimento.
da língua e no epitélio pavimentoso estratificado da boca e esôfago, sugerindo que essa proteína está envolvida na morfogênese dos tecidos maxilofaciais (SUZUKI et al., 2001).
Partindo do princípio de que as células da epiderme sofrem continuadamente um processo de auto-renovação e que suas células têm a capacidade de sair do ciclo celular e sofrer diferenciação terminal através da adição da BMP-6, foi que Gosselet et al. (2007) realizaram estudos utilizando culturas de células com três tipos de ceratinócitos epidérmicos interfolicular primários e BMP-2 e -6. Verificaram os autores, que o tratamento com essas BMPs resultou numa transição de colônias proliferativas para colônias abortivas, sugerindo que essas proteínas inibem a proliferação celular e fazendo com que essas células saiam do ciclo. Concluíram que as BMPs-2 e -6 inibem a proliferação celular dos ceratinócitos, fazendo com que consecutivamente estes sofram diferenciação terminal.
A sinalização das BMPs é mediada por receptores transmembrana do tipo treonina/serina quinase, onde três tipos de receptores I têm mostrado ligarem-se as BMPs: receptor activina tipo IA (ActRIA ou Alk 2), tipo IA (BMPR-IA ou Alk3) e IB (BMPR-IB ou Alk6) e também três tipos de receptores II, consistindo em receptor tipo II BMP (BMPR-II), tipo IIA (ActR-IIA) e o tipo IIB (ActR-IIB). Os domínios quinase treonina/serina dos receptores tipo II são constitutivamente ativos e fosforilam os domínios Gly-Ser (GS) nos receptores tipo I após a interação com a BMP ligante, resultando assim na ativação das quinases dos receptores tipo I (BLANCO CALVO et al., 2009).
A especificidade de sinalização da BMP é largamente mediada por receptores tipo I. Estudos in vitro têm mostrado que todos os membros das BMPs ligam-se a receptores BMPR-II em combinação com BMPR-IA, embora exista uma combinação preferencial entre ligantes e receptores (HSU et al., 2005; KIM; KIM, 2006).
Respostas distintas da via BMP dependem da natureza do complexo ligante – receptor formado. Se o complexo de receptores tipo I e II forem heterodímeros, a via da BMP sinaliza a ativação de mensageiros Smads intracelular (via canônica). Entretanto, se o complexo é homodímero ocorre a ativação mitógena da via de proteínas Quinases (MAPRK) (WAN; CAO, 2005).
que são ativadas pelos receptores tipo I. A Co-Smad é representada apenas pela Smad-4 e as Smads 6 e 7 funcionam como I-Smads. As Smads 2 e 3 somente transmitem sinais para o TGF-
β, Nodal ou ligantes de Activina (smads reguladores de Activina ou RA-Smads). As Smads têm um amplo espectro de atuação e regulam desde a ativação de receptores, bem como a exportação e a importação nuclear de Smads até a atividade transcricional (HARRISSON, 2004; ROSS; HIL, 2008).
A sinalização via BMP é bem específica e controlada pelos receptores tipo I; por exemplo, as BMPs-2 e -4 ligam-se a ambos os receptores Alk3 e Alk6, os quais sinalizam através das três conhecidas R-Smads. A BMP-7 tem elevada afinidade pelo Alk2, mas pode se ligar tanto ao Alk3 como ao Alk6. A BMP-6 liga-se exclusivamente ao Alk-2 e sinaliza através das Smads 1 e 5 (VON BUBNOFF; CHO, 2001).
Fonte: Adaptado de Blanco Calvo et al. (2009)
Figura 1. Sinalização Canônica da via BMP: (1) Fosforilação da R-Smad; (2) Ligação com a Co-Smad transporte do sinal para núcleo; (3) e (4) inibição da via por fatores intracelulares (I-Smads e Smufs).
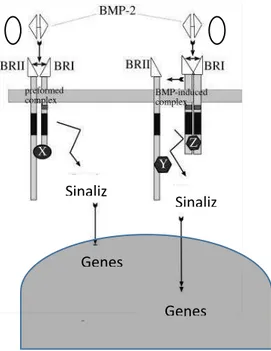
Fonte: Adaptado de Nohe et al. 2001
Figura 2. A: Sinalização canônica da BMP através da Smad; B: Oligomerização do receptor tipo I e posterior ligação com o receptor tipo II induzindo a via p38.
A cascata de sinalização via BMPs é controlada em diversos níveis por fatores intracelulares e extracelulares, incluindo inibição da interação do receptor BMPR-BMP por proteínas extracelulares que se ligam à BMP; presença de pseudorreceptores de membrana; bloqueio da sinalização da BMP pela ligação intracelular das Smads; ubiquitinização e degradação proteossomal das moléculas de sinalização das BMPs (BALEMANS; VAN HUL, 2002; GAZZERRO; CANALIS, 2006).
Na superfície celular existe outro nível de regulação, o pseudorreceptor de BMP (BAMBI - BMP and Activin membrane-bound inhibitor), que é uma glicoproteína transmembrana com domínio extracelular semelhante aos receptores da BMP. Este pseudorreceptor neutraliza os receptores tipos II, sem contato direto com as BMPs (NOHE et al, 2004).
No citoplasma, a I-Smads é responsável pela regulação da via de sinalização da BMP. Estas Smads (6 e 7) se ligam a receptores tipo I, interferindo com a fosforilação da Smad 1/5/8 e heterodimerização com Smad 4. Adicionalmente I-Smad impede a formação do complexo R-Smad/Co-Smad. A expressão das Smads 6 e 7 é induzida por múltiplos estímulos, incluindo BMP-7 e EGF, além de condições patológicas. Pode-se ainda encontrar dois fatores de ubiquinização de Smads, isto é, Smuf 1 e 2, que são mediadores da etapa final de ubiquinização das proteínas alvo. Essas Smufs contem domínio catalítico HECT, que modula a sinalização do
Sinaliz
Sinaliz
Genes
Genes
NÚCL
TGF-β por selecionar, como alvo, o receptor tipo I e as proteínas Smads (BALEMANS; VAN HUL, 2002; GAZERRO; CANLIS, 2006).
Em nível extracelular, o controle é feito por proteínas que se ligam seletivamente às BMPs, impedindo a interação destas com os seus receptores treonina/serina quinase afins. Estes antagonistas possuem em sua estrutura grupamentos cisteína, assim como os membros do
TGF-β, inclusive as BMPs, e são classificados em três subfamílias, baseando-se no tamanho dos grupos cisteína: a família DAN, a Tsg (Twisted gastrulation) e a Chordin e Noggin (HARRISON et al., 2004; YANAGITA, 2005). Esses antagonistas ligam-se às BMPs com a mesma afinidade de seus receptores específicos, bloqueando a transdução de sinal e diminuindo, então, a sua atividade biológica, que pode ser, por exemplo, a da formação óssea. Quando há superexpressão das BMPs em condições patológicas, como a formação excessiva de osso, estes antagonistas podem representar uma proposta terapêutica bastante eficaz (GROPPE et al., 2002).
2.3 NOGGIN: CONSIDERAÇÕES GERAIS
O Noggin foi primeiramente isolado de Xenopus laevis em estudos sobre o desenvolvimento dorsal em embriões por tratamento de Ultravioleta e demonstrou ser expresso em estágios precoces da gastrulação, participando da morfogênese do tecido muscular e nervoso. É secretado como uma proteína glicosilada, sendo um homodímero ligado covalentemente, pesando aproximadamente 64 KDa. Sua estrutura primária consiste de uma região amino-terminal e outra carboxi-terminal contendo um grupamento cisteína. Ao centro segmentos ligantes de heparina básica mantêm o Noggin na superfície celular, o qual se liga com vários graus de afinidade as BMPs, tendo como papel fisiológico, primário, antagonizar a ação direta das BMPs (ZIMMERMAN; DE JESÚS-ESCOBAR; HARLAND, 1996; BALEMANS; VAN HUL, 2002; GROPPE et al., 2002). Em experiências in vitro esta proteína inibe de forma efetiva as BMP-2 , -4 , -5 , -7 , -13 e -14 e de forma menos efetiva BMPs -3 , -6 , -9 , -10 e -15 (GAMER et al, 2005; SEEMANN et al, 2009; SONG et al , 2010).
(ZIMMERMAN; DE JESÚS-ESCOBAR; HARLAND, 1996; GROPPE et al., 2002; KRAUSE; GUZMAN; KNAUS, 2011).
Hsu et al (1998) observaram que o Noggin compete com membros da família do antagonista DAN para ligar-se à BMP-2, sugerindo que a interação entre BMP-2 e estes antagonistas ocorram através do domínio BMP similar.
A presença de Noggin é essencial no desenvolvimento de estruturas derivados do ectoderma, tais como o tubo neural, dentes, folículos pilosos e olhos (MCMAHON et al., 1998). Embora a indução do tubo neural ocorra na ausência de Noggin, foi mostrado ser crucial para a neurogênese (MCMAHON et al., 1998; LIM et al., 2000). Noggin é expresso na notocorda e é aumentada mediante exposição de noradrenalina em tecidos derivados do ectoderma (MCMAHON et al., 1998). A superexpressão de Noggin neutraliza a atividade de BMP-4 em células precursoras neurais causando alta proliferação do tecido neural (BONAGUIDI et al., 2008).
Noggin também é expresso na papila dérmica e no tecido conjuntivo do folículo piloso, onde ele neutraliza a BMP-4 parando a indução folículo piloso em culturas de órgãos embrionários da pele (BOTCHKAREV et al., 1999). Curiosamente, a aplicação ectópica de Noggin e subsequente inibição da BMP-4 conduz alterações no fenótipo do dente, levando a molares e incisivos defeituosos (TUCKER; MATTHEWS; SHARPE, 1998).
No desenvolvimento embrionário da papila gustativa fungiforme, as BMPs -2, -4 e -7 e o Noggin apresentam distribuições distintas e desenvolvem diferentes papéis por vias opostas, seja inibindo ou induzindo a proliferação celular, de acordo com os estágios de formação de tal estrutura (ZHOU; LIU, MISTRETTA, 2006).
Experimentos tem demonstrado que o Noggin em combinação com um fator de crescimento de fibroblastos básico (bFGF) é suficiente para manter o crescimento prolongado de células tronco embrionárias humanas (hES) in vitro (WANG et al., 2005). Além disto, esta protéina também antagoniza a sinalização da BMP para regular o nicho de células-tronco durante a neurogênese (LIM et al., 2000).
Um novo papel de Noggin em células de câncer de próstata osteolítica tem sido indentificado. Verificou-se uma baixa expressão de Noggin em células deste tipo de neoplasia e isto induz metástases ósseas (SCHWANINGER et al.,2007; KRAUSE; GUZMAN; KNAUS, 2011).
As BMPs são proteínas envolvidas na manutenção de um estado de quiescência de células-tronco em seus nichos e, mais tarde, em sua diferenciação em células maduras nos tecidos normais. Deste modo, alteração nos componentes da via de sinalização da BMP pode levar a atividade proliferativa descontrolada das células-tronco normais, quebrando o equilíbrio. Sendo o câncer um processo multifásico, resultante da proliferação clonal de células alteradas que escapam dos mecanismos de controle, é evidente que as alterações na via da BMP podem ser um importante marco na genética e nos eventos moleculares que conduzem ao desenvolvimento do câncer (BLANCO CALVO et al., 2009).
2.4 A INFLUÊNCIA DOS COMPONENTES DA SINALIZAÇÃO DAS BMPS NO DESENVOLVIMENTO DO CÂNCER
Pesquisas nas áreas de embriologia, genética e carcinogênese evidenciam que alterações na via de sinalização das BMPs contribuem para o desenvolvimento de neoplasias, sendo que os primeiros indícios surgiram a partir de estudos genéticos de síndromes de câncer familial, como a polipose juvenil familial, onde mutações do Smad-4 e do BMPR-IA estão implicadas na origem da doença. Mutações no BMPR-IA foram identificadas em portadores da síndrome de Cowden, que é uma síndrome de câncer de mama hereditário. Adicionalmente, a via de sinalização das BMPs encontra-se alterada em cânceres humanos esporádicos (próstata, cólon, mama, cérebro, rim, bexiga, pulmão) e a atuação destas proteínas em carcinogênese é complexa, pois envolve tanto efeitos pró-tumorais, como anti-tumorais (HSU et al, 2005).
expressaram apenas as BMP-1 e BMP-2. O adenocarcinoma expressou fracamente as BMPs (-1, -2, -6, -3 e -7). A marcação imunoistoquímica da BMP-2 no citoplasma das células do carcinoma de língua, confirmou sua presença nessa neoplasia, sugerindo, assim, que as células epiteliais neoplásicas possuem um alto potencial para expressar o RNAm das BMPs.
As BMPs podem atuar como oncogene e como supressor tumoral, a depender do estágio da doença e da sua concentração na matriz tumoral. Além disso, como os efeitos das BMPs são célula-específico e, por isto, podem variar entre os diversos tipos tumorais, inclusive naqueles de mesma origem celular (HSU et al., 2005). Langenfeld et al. (2005) ainda mencionam que as condições de cultura, em estudos in vitro, bem como a concentração de antagonistas intra e extracelular interferem na atividade biológica das BMPs.
Segundo Kim e Kim (2006), o efeito preciso das BMPs em células malignas deve ser interpretado no contexto do tipo celular e condições experimentais, pois realizando uma revisão da atuação dessas proteínas em diversos tipos de câncer, observou-se que dependendo do tipo de câncer estudado elas poderiam estar super ou subexpressas, como por exemplo, no carcinoma de células transicionais da bexiga, verificou-se uma subexpressão, enquanto que no câncer colorretal e de mama uma superexpressão.
Em uma revisão de literatura de Hsu et al. (2005) sobre BMPs e melanomas, esses autores afirmaram que a BMP-7 pode ter uma função antitumoral e pró-tumoral. A superexpressão da BMP-7 ocorre durante a transformação melanocítica, que atua de forma autócrina inibindo o crescimento no estágio inicial de desenvolvimento do melanoma. Como o tumor tende a progredir em direção a um fenótipo mais agressivo, as células do melanoma produzem constantemente altos níveis de BMP-7 e, por conseguinte, duas situações podem ocorrer, uma que se caracteriza pelo desenvolvimento de resistência ao efeito antitumoral da mesma, através da concorrente superexpressão dos inibidores das BMPs, como o Noggin, enquanto que, a outra, mostra que altos níveis de BMP-7, nos estágios mais avançados da doença, promove metástase, estimulando a angiogênese e a remodelação da matriz tumoral (efeito pró-tumoral). Afirmaram, ainda, que este efeito duplo também se aplica às demais BMPs e a toda superfamília TGF-β.
detectada. Estes resultados confirmaram uma expressão forte de BMP-4 e uma expressão moderada de BMP-7 nas linhagens de células de melanoma. Além disto, foi feita a marcação imunoistoquímica dessas lesões, utilizando o nevus como controle negativo. A marcação continuou forte para BMP-4 e BMP-9, tanto em tumor primário como em metástases e negativa para o nevus. Sugeriram assim, que as BMPs têm uma importante participação em melanomas humanos, facilitando a invasão celular e a migração.
Para ocorrer o crescimento tumoral é necessário sustentação e alimentação das células neoplásicas, neste sentido Langenfeld e Langenfeld (2004), estudaram o papel da BMP-2 na angiogênese e, verificaram que a mesma aumenta a neovascularização no desenvolvimento de tumores, fato este confirmado pela utilização de uma BMP-2 recombinante que estimulou a formação de vasos sanguíneos numa linhagem celular (A549) de câncer pulmonar. Sua propriedade em ativar as células endoteliais foi demonstrada pela habilidade de fosforilar a Smad 1/5/8 e ERK-1/2 e, aumentar a expressão do id1, com consequente proliferação e formação do vaso. Concluíram assim que a expressão da BMP-2 em tumores de pulmão tem um importante papel no processo da tumorigênese.
Raida et al. (2005) investigaram o possível papel da BMP-2 sobre células endoteliais da microcirculação da derme humana (CEMDH) e uma possível atividade angiogênica, através da implantação subcutânea de uma esponja estéril no dorso de ratos, sendo inoculada com rhBMP-2 (recombinante) e rhVEGF (recombinante), ou combinação de ambos, diariamente, durante 7 dias (prova da esponja). Além disso, implantaram-se, em ratos, células de câncer de mama da linhagem MCF-7 transfectadas com BMP-2, para avaliar o efeito da superexpressão desta citocina sobre a vascularização tumoral. Após a prova, as esponjas removidas foram imunomarcadas com anticorpos anti-FvW e anti-CD31, revelando aumento da atividade angiogênica com significativo incremento da vascularização no grupo de tratamento combinado. Nos ratos transfectados com MCF-7/BMP-2, observou-se o desenvolvimento de tumores com diâmetro de 1-1,5 cm2, já aqueles transfectados com MCF-7 sem BMP-2 não desenvolveram tumores. Concluiu-se que a BMP-2, em câncer de mama, estimula a angiogênese, sugerindo que a inibição desta via de sinalização pode ter importante valor terapêutico.
do sangue periférico. Além disso, a presença de BMP-2 aumenta a secreção parácrina de fatores de crescimento angiogênico, como o fator de crescimento placentário (PIGF) e o fator de crescimento endotelial vascular (VEGF), em células tronco mesenquimais, no estroma tumoral.
Bieniasz et al. (2009), tentando esclarecer o papel da BMP no desenvolvimento do câncer de pulmão e estabelecer uma provável relação entre essa proteína e fatores de crescimento vasculares na promoção da angiogênese tumoral, estudaram a relação entre a BMP-2 e o VEGF em carcinomas de pulmão. Observaram através da PCR em tempo real uma correlação positiva entre a expressão do RNAm do VEGF e BMP-2 nos tecidos com câncer de pulmão, quando comparados com tecidos de pulmão normal. Concluíram que a BMP-2 pode colaborar com o VEGF na promoção do crescimento do tumor ou invasão, estimulando a angiogênese.
Metástases ósseas são fontes significativas de morbidade e mortalidade entre pacientes com câncer de próstata. Feeley et al. (2005) tentaram determinar o papel das BMPs na formação de lesões metastáticas osteoblásticas no câncer de próstata. Aplicaram BMPs-2, -4 e -7 exógena em linhagem de células de câncer de próstata LAPC-4 e LAPC-9, e utilizaram Western blot e RT-PCR para avaliar os efeitos dessas proteínas na migração, invasão e proliferação celular. Observaram que todas as BMPs foram expressas nas linhagens de células e que as BMP-2 e -7 estimularam a migração celular e invasão de células do câncer de próstata em uma forma dose dependente, mas a BMP-4 não teve efeito. Concluíram, dessa forma, que as BMPs são fundamentais na formação das lesões metastáticas associadas ao câncer de próstata, e estratégias de tratamento futuro, que iniba a atividade das BMPs local pode reduzir a formação e progressão dessas lesões.
Existem poucos estudos que mostram xenoenxerto de rato a um nível funcional, que os antagonistas de BMP podem promover ou inibir propriedades malignas. Em modelos de câncer de pulmão, o Noggin mostrou suprimir o crescimento tumoral, bem como, mestástase óssea (FEELEY et al., 2006 A).
osteólise tumoral in vivo, sugerindo que a inibição local das atividades das BMPs no câncer de próstata pode permitir novas modalidades terapêuticas, diminuindo a morbidade e mortalidade associadas à doença metastática (FEELEY et al., 2006B).
Abordando a importância de se estudar inibidores da via de sinalização das BMPs, Laurila et al. (2013) realizaram uma pesquisa onde avaliaram a expressão de Gremlin e Noggin, através de imunoistoquímica, em vários tecidos normais e amostras de diferentes neoplasias malígnas. Na maioria das amostras normais e tumorais, a expressão dos inibidores foi negativa ou fraca. No painel dos tumores, o padrão de expressão foi mais variável, mas uma elevada expressão dos antagonistas de BMPs foi detectada, pela primeira vez, em alguns casos, tais como para o tumor de células granulares renal e carcinoma papilar da tireóide, para o Noggin. Apesar de Gremlin 1 e Noggin não serem amplamente expressos em tecidos adultos, de um subconjunto de órgãos, o padrão de expressão indicou que estes inibidores podem ter um potencial papel no tecido normal, mantendo a homeostase, bem como, alterados em malignidades.
Partindo do princípio de que a BMP-2 é uma citocina com várias funções que influencia na diferenciação de muitos tipos celulares e, embora seu efeito esteja limitado ao tempo de exposição e à concentração, está claro seu envolvimento em eventos da tumorigênese como angiogênese, apoptose, crescimento e migração. Steinert et al. (2008) investigaram a influência da BMP-2 em linhagens de células de câncer de mama (MCF-7) expostas a uma única aplicação de BMP-2, comparando com contínuas aplicações de altos níveis de BMP-2. Os dados mais relevantes encontrados foram que, em um curto período de exposição verificou-se que 15 genes associados à apoptose estavam alterados, enquanto que, em período mais prolongado, foram detectados mais oito genes. Observou-se também a participação da BMP-2 no processo de migração das células tumorais independente do tempo de exposição através de teste de migração celular com Matrigel.
com um vetor contendo o BMPR-II e a restituição do mesmo não só restaurou a responsividade à BMP-4, como reduziu a tumorigenicidade in vitro. Portanto, os autores concluíram que a superexpressão do BMPR-II conduz a uma restauração da sinalização da BMP por ser um potente supressor de crescimento tumoral, na linhagem celular, TSU-Pr1, de CCI de bexiga humana.
A transição do epitélio/mesenquima é ponto fundamental para a migração de neoplasias originadas de epitélio. Tentando entender esse processo através da via da BMP, Gordon et al. (2009) estudaram a relação da BMP-2 em linhagens de células de carcinoma pancreático (Pan-1). Observaram que a indução da BMP-2 nessas células aumentou a expressão e atividade de MMP-2 e este processo foi mediado pela Smad-1. Sugeriram que a sinalização da BMP, através da ativação da Smad-1 regula a expressão da MMP-2 e esta informação pode auxiliar como alvo terapêutico no tratamento dessa doença.
Rothhammer, Braig e Bosserhoff (2008) analisaram em linhagem de células de melanoma a influência das BMPs com fatores dos processos de migração e invasão celular. Em um grupo de clones das células neoplásicas foi feito a redução da atividade da BMP com um antisenso de BMP-4 e em outro grupo foi feito a inibição com o antagonista chordin. Em ambos observaram a redução da expressão das MMP-1, -2, -3 e -9. Além disso, observaram o efeito das BMPs nos fibroblastos estromais com o tratamento dessas células com BMP-2 e -4, onde tiveram um aumento na expressão das MMPs. Desta forma, concluíram que as BMPs têm um importante papel na disseminação das células tumorais, com a capacidade de degradar a matriz extracelular induzindo à expressão de metaloproteinases tanto em células neoplásicas como em células estromais.
Em culturas de células de condrossarcoma, Hou et al. (2009) estudaram o papel da BMP-2 na motilidade dessas células, pela ativação da MMP-13, através de ensaios de migração com Matrigel, quantificação de proteínas ativas com zimografia, Western blot e PCR em tempo real. Observaram que com a indução de BMP-2 exógena estimulou o processo de migração, aumentando a expressão e ativação de MMP-13, bem como a inibição da BMP-2 diminuía significantemente a migração celular e a expressão da MMP. Concluíram que o mecanismo da BMP-2 de promover a migração de células do condrossarcoma está ligado com a superexpressão da MMP-13.
é incerto, tendo sido implicadas no desencadeamento de alterações fenotípicas em células epiteliais, tornando-as mais semelhantes às células mesenquimais (STRNAD et al., 2010). Durante o desenvolvimento neoplásico, este processo permite às células malignas a migrarem para microambientes diferentes. Este processo, chamado de transição epitélio-mesenquima, é responsável por alterações, tais como, facilitar a migração celular e invasão, ajudando, desta forma, ao desenvolvimento tumoral e aumento do potencial metastático (THAWANI et al., 2010).
Strnad et al. (2010), estudando a influência dos fatores de crescimento produzidos por fibroblastos do estroma de CEs de cabeça e pescoço, afirmam que a BMP-4 é um fator de crescimento que estimula a transformação do epitélio normal. Ao induzirem BMP-4, em ceratinócitos normais, observaram que essas células adquiriram fenótipo diferente, ficando semelhantes aos ceratinócitos do carcinoma. Estes autores concluíram que a secreção parácrina da BMP por fibroblastos estromais pode levar a alterações na interação epitélio-mesênquima e, desta forma, contribuir para o desenvolvimento de neoplasia epitelial.
Yuen e colaboradores (2012) correlacionaram os níveis de expressão de proteína e mRNA de BMP-6 e Noggin, sozinhos ou em combinação com a sobrevida de pacientes em vários tipos de neoplasias malígnas. No CE de esôfago encontraram que a alta expressão de BMP-6 juntamente com a baixa expressão de Noggin foram significativamente associadas com menor sobrevida desses pacientes. Os resultados sugerem fortemente que BMP-6 e o Noggin poderiam ser utilizados em combinação como um pro-indicador diagnóstico na progressão do câncer.
2.4.1 Componentes da sinalização da BMP e o CEO
Gao et al. (2009) realizaram um estudo in vitro com células de carcinoma epidermóide oral (UMSCC-1 e UMSCC-74A) e observaram o efeito da BMP-2 na proliferação e angiogênese desta lesão. Após tratarem as células com BMP-2rh, verificarem a secreção de IL-8 e VEGF, não encontraram diferença significativa entre as células estudadas e o grupo controle. Esses autores, concluíram que a exposição de células de CEO à BMP-2 não estimula a proliferação ou angiogênese nesta lesão.
Analisando a expressão da BMP2/4 e de seu receptor BMPR-IA, em 23 espécimes de carcinoma epidermóide oral e 10 espécimes de hiperplasia fibro-epitelial da mucosa oral, utilizados como grupo controle, Soares et al. (2010) observaram uma fraca expressão de ambos os marcadores em células normais, uma forte marcação da BMP2/4 e fraca marcação da BMPR-IA na maioria dos casos do grupo experimental com metástase, podendo, assim, esses resultados ter implicações prognósticas.
De Carvalho et al. (2011) estudaram a imunoexpressão da BMP-2 e seus receptores (IA e II) em CE de lábio inferior com metástase e sem metástase. Observaram que houve uma superexpressão da BMP-2 em ambos os grupos, com e sem metástase. Apenas a BMPR-IA apresentou diferença significativa quanto à presença de metástase. Concluíram, dessa forma, que distúrbios na via se sinalização da BMP-2 podem estar envolvidos no desenvolvimento do CE de lábio inferior e que a BMPR-IA pode ser indicativo no desenvolvimento de metástase.
Avaliando o efeito do tratamento da BMP-2rh em linhagens de células de CEO, Kokorina et al.(2011) estudaram dois tipos de linhagens de células de carcinoma epidermóide oral diferentes, a UMSCC-74A (expressão positiva para o gene BMP-2) e a UMSCC-1 (expressão negativa para o gene BMP-2). Estes autores verificaram, através de ensaio de invasão por matrigel, que a invasividade das células tratadas com BMP-2rh foi significativamente maior na linhagem UMSCC-74A. Utilizaram ainda um PCR específico (The Human Tumor Metastasis PCR Array) para identificar 84 genes que podem estar envolvidos
no perfil metastático das células tumorais. Este PCR identificou que as células BMP-2 positivas possuíam uma maior expressão de genes caracterizando um genótipo mais agressivo.
resultou na pior sobrevivência dos animais, assim como, os aspectos histológcos, mostraram-se pobremente diferenciados, em comparação com o grupo de controle (xenoenxertos com células não tratadas). Observaram também que mudanças nas proteína-quinases sugere interações da sinalização da BMP-2 com a sinalização de Wnt-β-catenina, Janus quinase / transdutores de sinais e ativadores das vias de transcrições (JAK / STAT).
Sand et al. (2014) correlacionaram a expressão himunoistoquímica de BMP-2 em 149 pacientes portadores de CE de cabeça e pescoço com características clinicopatológicas. Observaram que 146 (98%) dos pacientes apresentava expressão da BMP-2 e que a alta expressão desta proteína estava associado a recorrência local. Afirmaram assim, que estes dados têm implicações importantes para a utilização de BMP-2rh em reconstruções faciais de pacientes afetados com câncer, pois esta proteína pode ser um fator a favorece a recorência local.
O potencial papel das BMPs na transformação maligna e progressão do câncer permanece mal compreendida. Tem sido vista, investigações nesta área variadas, tanto estudos in vitro e in vivo , o que revelam discordância nos resultados, principalmente baseados no tipo
PROPOSIÇÃO
“Aprendi com as primaveras a me deixar cortar para poder voltar inteira.”
3 PROPOSIÇÃO
“As pessoas duvidarão no que dizes, mas acreditarão no que fazes”.
(Lewis Cass)
4 MATERIAL E MÉTODOS
4.1 CARACTERIZAÇÃO DO ESTUDO
Este estudo caracterizou-se por uma investigação experimental in vitro, onde foi observado o efeito da proteína recombinante BMP-2 e seu antagonista Noggin em células SCC25 oriundas de CEO humano.
4.2 CONSIDERAÇÕES ÉTICAS
O presente projeto não necessitou de submissão ao Comitê de Ética em Pesquisa (CEP) ou Comissão de Ética no Uso de Animais (CEUA). Foram utilizados uma linhagem celular imortalizada e produtos comercialmente disponíveis. Todos os procedimentos de biossegurança foram adotados nas diversas etapas experimentais do projeto, garantindo a integridade física dos pesquisadores envolvidos.
Os procedimentos laboratoriais foram realizados no Laboratório de Cultura de Células do Departamento de Bioquímica da UFRN e nos Laboratórios do Programa de Pós-Graduação em Patologia Oral da UFRN. As etapas serão descritas a seguir.
4.3 CULTIVO CELULAR
Utilizou-se neste estudo a linhagem de célula SCC25, derivada do carcinoma epidermóide de língua humano, cedida pelo Programa de Pós-Graduação em Estomatopatologia
– FOP-UNICAMP e cultivadas como recomendado pelo fornecedor “American Type Culture
Collection” (ATCC, Manassas, VA, EUA).
A SCC25 foi estabelecida a partir de um paciente do sexo masculino com 70 anos de idade, o qual não foi submetido a nenhum tratamento prévio à biópsia (RHEINWALD EBECKET, 1981).
As células foram descongeladas e mantidas em frascos de cultivo celular de 75 cm2 (BD Biosciences, San Jose, CA, USA), com meio Eagle modificado por Dulbecco F12 (DMEM/F-12; Invitrogen, Carlsbad, CA, EUA), suplementado com 10% de soro fetal bovino (Cultilab Ltda., Campinas, SP, Brasil), 400ng/ml de hidrocortisona (Sigma-Aldrich Co., St. Louis, MO, USA) e 1% de solução antibiótico-antimicótico (GIBCO, USA). As células foram mantidas em estufa a 37ºC, em atmosfera contendo 5% de CO2.
Laboratório de Cultura Células do Departamento de Bioquímica do Centro de Ciociências da UFRN. O crescimento celular foi monitorado diariamente em microscópio invertido de fase (NIKON – CFI60, Spectrum – Bioengenharia médica hospitalar LTDA, São Paulo, Brasil) e o meio de cultura trocado a cada 48 horas.
Após ocuparem 70% a 90% do frasco, o que se denomina subconfluência, as células foram subcultivadas. O meio de cultura foi removido do frasco e a monocamada celular lavada com solução fosfato-alcalina, sem cálcio e magnésio (PBS), pH 7,2. Em seguida as células foram separadas com 1 ml de solução de tripsina EDTA a 0,25% (1:250) (Invitrogen) durante 5 minutos, a 37ºC.
A tripsina foi inativada pela adição de novo meio de cultura e as células em suspensão foram transferidas para um tubo de fundo cônico de 15 ml e centrifugadas a 1200rpm por 5 minutos, à temperatura ambiente. Em seguida foi aspirado o sobrenadante e o precipitado de células ressuspendido em 1 ml de meio de cultura. Alíquotas desta suspensão foram distribuídas em frascos de cultivo de 75cm2 contendo 8 ml de meio de cultura e novamente levadas de volta à estufa, onde cada procedimento deste deu origem a uma nova passagem de linhagem celular.
Quando se conseguia a quantidade de células esperada para cada ensaio (proliferação, ciclo celular e invasão), o plaqueamento celular foi realizado vinte e quatro horas antes da aplicação das proteínas recombinantes. As células foram divididas em três grupos e submetidas aos diferentes tratamentos descritos a seguir:
1) Grupo Controle – Não houve a aplicação de nenhuma substância nas células deste grupo, não obstante passarem por todos os processos pelos quais os grupos experimentais passaram;
2) Grupo BMP-2 – As células foram tratadas com 100ng/ml de BMP-2 recombinante humano (BMP-2rh) (R&D Systems, Minneapolis, MN, USA) (KANG et al., 2010). 3) Grupo Noggin – As células foram tratadas com 100ng/ml de Noggin recombinante
(Noggin-rh) (R&D Systems. Minneapolis, MN, USA) (KANG et al., 2010).
4.3.1 Plaqueamento celular