Mestrado Integrado em Medicina Veterinária
Escola de Ciências Agrárias e Veterinárias – Departamento de Ciências Veterinárias
Estudo da ocorrência de bacteriemia de Bartonella henselae
em gatos da região Norte de Portugal
Daniela Alexandra Machado Mendes Moreira
Orientador:
Professor Doutor Nuno Francisco Fonte Santa Alegria
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Mestrado Integrado em Medicina Veterinária
Escola de Ciências Agrárias e Veterinárias – Departamento de Ciências Veterinárias
Estudo da ocorrência de bacteriemia de Bartonella henselae
em gatos da região Norte de Portugal
Daniela Alexandra Machado Mendes Moreira
Orientador:
Professor Doutor Nuno Francisco Fonte Santa Alegria
Composição do Júri:
Doutora Felisbina Luísa Pereira Guedes Queiroga Doutor Luís Miguel Martins Lucas Cardoso
Doutora Maria das Neves Mitelo M. de Paiva Cardoso
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
II
O presente documento é da inteira responsabilidade da autora.
III
RESUMO
Bartonella henselae é considerado um agente patogénico emergente, responsável pelo
desenvolvimento da Doença da Arranhadela do Gato, a principal causa de linfadenopatia em crianças e adultos, podendo também cursar com o desenvolvimento de quadros clínicos mais graves nos humanos, particularmente em indivíduos imunodeprimidos.
Os gatos são o principal hospedeiro mamífero reservatório desta bactéria, que é transmitida através das fezes das pulgas da espécie Ctenocephalides felis. A transmissão aos humanos ocorre mediante a contaminação de arranhadelas e/ou mordeduras de gatos com fezes de pulga. Os gatos são, fundamentalmente, portadores assintomáticos da bactéria, que provoca uma bacteriemia intraeritrocitária crónica nestes animais. A maioria das alterações clínicas relatadas advém de ensaios experimentais e incluem febre e anemia transitórias, entre outros sinais clínicos.
Foram recolhidas 30 amostras de sangue de gatos que se apresentaram no HVP, durante os meses de abril e maio de 2012, com o objetivo de determinar a ocorrência do agente, através de PCR.
B. henselae não foi detetada em nenhuma das amostras de sangue avaliadas.
Palavras-chave: Bartonella henselae; Doença da Arranhadela do Gato; PCR;
Bartonelose; Gato.
IV
ABSTRACT
Bartonella henselae is considered an emerging pathogen and it is responsible for the
development of the Cat Scratch Disease, the main cause of lymphadenopathy in children and adults, but may also be associated with the development of more severe clinical pictures in humans, particularly in immunocompromised individuals.
Cats are the main mammalian reservoir hosts of this bacterium, and the transmission between cats occurs via the faeces of Ctenocephalides felis fleas. Transmission to humans occurs through contamination of scratches and/or bites of cats with flea feces. Cats are basically asymptomatic carriers of the bacteria, causing a chronic intraerythrocytic bacteremia in these animals. Most of the clinical changes comes from reported experimental clinical trials, and include transitory fever and anemia, among other clinical signs.
We collected 30 blood samples from cats that performed at HVP, during the months of April and May of 2012, with the objective of determining the occurrence of the agent by PCR.
B. henselae was not identified in any of the blood samples.
V ÍNDICE 1. INTRODUÇÃO GERAL ... 1 1.1. Introdução ... 1 1.2. Etiologia ... 1 1.2.1. Taxonomia ... 1 1.2.2. História ... 2 1.2.3. Caracterização Bacteriológica ... 3 1.2.4. Caracterização Genómica ... 4 1.3. Epidemiologia ... 5
1.3.1. Distribuição Geográfica e Prevalência ... 5
1.3.2. Espécies Suscetíveis ... 6 1.3.3. Fatores de Risco ... 7 1.3.4. Transmissão ... 7 1.3.5. Vetores ... 9 1.4. Patogenia ... 10 1.4.1. Fatores de Virulência ... 13 1.5. Sinais Clínicos ... 14
1.5.1. Relação de Bartonella spp. com outras doenças felinas crónicas ... 16
1.6. Resposta Imunitária ... 17
1.7. Alterações Histopatológicas ... 18
1.8. Potencial Zoonótico ... 18
1.8.1. Doença da Arranhadela do Gato ... 20
1.8.1.1. Forma Típica ... 20
1.8.1.2. Forma Atípica ... 21
1.8.2. Angiomatose Bacilar e Peliose Hepática ... 21
1.8.3. Endocardite ... 22
1.9. Diagnóstico ... 23
VI 1.9.1.1. Isolamento Bacteriano ... 23 1.9.1.2. Diagnóstico Serológico ... 24 1.9.1.3. Identificação Molecular ... 25 1.9.1.3.1. PCR ... 26 1.9.2. Diagnóstico Clínico ... 27 1.10. Tratamento ... 28 1.11. Prevenção/Profilaxia ... 30 1.11.1. Controlo de Vetores ... 30 1.11.2. Vacinação ... 31
1.11.3. Importância em Saúde Pública ... 31
2. ESTUDO DA OCORRÊNCIA DE BACTERIEMIA DE B. HENSELAE EM GATOS DA REGIÃO NORTE DE PORTUGAL ... 33
2.1. Objetivos ... 33 2.2. Material e Métodos ... 33 2.2.1. Animais ... 33 2.2.2. Amostras ... 33 2.2.3. Questionário ... 34 2.2.4. Caracterização da Amostra……….………..35
2.2.5. Técnicas de Análise Molecular ... 38
2.2.5.1. Protocolo Experimental ... 38 2.2.5.2. “Primers” ……….. 38 2.2.5.3. Técnica de PCR.………..38 2.3. Resultados ... 40 2.4. Discussão ... 41 2.5. Considerações Finais ... 46 2.6. Referência Bibliográficas ... 47 2.7. Anexos ... 55
VII
ÍNDICE DE GRÁFICOS
Gráfico 1. Distribuição etária dos animais ... 36
Gráfico 2. Tipo de habitação dos animais……….…….36
Gráfico 3.Convivência com outros gatos ………..………36
Gráfico 4. Presença de desparasitação eterna regular………..……… 37
Gráfico 5. Ocorrência de infestação prévia por pulgas ……….….………37
Gráfico 6. Razões de apresentação dos animais no HVP ……….………..….37
ÍNDICE DE FIGURAS
Figura 1. Morfologia de Ctenocephalides felis ... 9Figura 2. Corpúsculos intraeritrocitários compatíveis com Bartonella spp………..……….11
Figura 3. Pápula pós-inoculação ID de B. henselae num gato ……….……….. 15
Figura 4. Patogenia de B. henselae.……… ……….………..….… 22
VIII
LISTA DE SIGLAS, ABREVIATURAS E ACRÓNIMOS
® -
Marca Registada % - Percentagem º C – Graus Celsius < - Menor Kg – Quilograma mg – Miligrama ml – Mililitro min. – Minuto seg. - Segundo µm – Micrómetro µl - Microlitro q 12h – A cada 12 horas q 48h – A cada 48 horasAAFP – “American Association of Feline Practioners” AB – Angiomatose Bacilar
CO2– Dióxido de Carbono
CSD – Doença da Arranhadela do Gato (do inglês, “Cat-Scratch Disease”) DNA – Ácido Desoxirribonucleico
EDTA - Ácido etilenodiamino tetra-acético (do inglês, “Ethylenediamine tetraacetic acid”) ELISA – Ensaio imunoenzimático (“Enzyme-linked-immunosorbent assay”)
EUA – Estados Unidos da América gltA – Citrato sintase
IX HVP – Hospital Veterinário do Porto
ID - Via Intradérmica
IFA – “Immunofluorescent antibody assay” INF-γ – Interferão γ
IgG – Imunoglobulina G n – Número
pb – Pares de bases
PCR – Reação em Cadeia da Polimerase (“Polimerase Chain Reaction”) PFGE – “Pulse-field-gel electrophoresis”
PH – Peliose Hepática PO – “Per Os” (via oral)
RFLP – “Restriction Fragment Lenght Polymorphism”
ribC - Riboflavina sintetase RNA – Ácido ribonucleico
rRNA – Ácido ribonucleico ribossómico
SIDA – Síndrome da Imunodeficiência Adquirida SPF – “Specific Pathogen Free”
TNF-α – Fator de necrose tumoral α T4SS – Sistema de secreção tipo IV
VPP – Valor preditivo(ou previsível de um resultado) positivo VPN – Valor preditivo negativo
X
AGRADECIMENTOS
A realização deste trabalho não teria sido possível sem a colaboração de diversas pessoas e entidades, que ajudaram ao seu desenvolvimento e concretização, e às quais deixo expresso o meu agradecimento.
Ao Departamento de Ciências Agrárias e Veterinárias da UTAD, pela disponibilização de material e equipamento fundamental para o desenvolvimento da parte laboratorial deste estudo.
Ao Professor Doutor Nuno Alegria, pela pronta aceitação em orientar este trabalho, bem como por toda a ajuda, espírito crítico e disponibilidade prestadas ao longo da sua execução.
Ao Professor Doutor Luís Cardoso, pela disponibilidade e ajuda prestadas na obtenção de material necessário ao desenvolvimento laboratorial deste trabalho.
Ao Professor Shimon Harrus, da Escola de Medicina Veterinária Koret, Universidade Hebraica de
Jerusalém, Israel, pela cedência da cultura bacteriana (origem do DNA).
Ao Hospital Veterinário do Porto e a toda a sua equipa (médicos, enfermeiros, auxiliares), pelo acolhimento e transmissão de conhecimentos. Deixo um agradecimento particular ao Doutor Luís Lima Lobo, pelo apoio prestado e pelo acompanhamento que me facultou relativamente à parte prática deste trabalho.
Aos meus colegas de estágio, pela amizade formada, pelos momentos de alegria partilhados e pelo apoio incondicional que sempre demonstraram: Margarida Costa, Daniela Reis, Carina Costa, Daniela Fernandes e Marta Rebelo.
Pelas sugestões, dicas e incentivo, deixo um agradecimento particular à Joana Rocha. Ao André, pelo voto de confiança e amizade. À Lurdes, pelo exemplo de determinação e força de vontade.
A toda a equipa Breed, pela confiança depositada em mim, pelas facilidades proporcionadas e por me receberem tão bem.
XI
Porque este trabalho é o culminar de uma jornada de vários anos, deixo um agradecimento especial àqueles que sempre me acompanharam neste percurso, desde o início, mostrando-me o enorme valor da Amizade: Ana Cláudia, Filipe, Helder, Isabel, Patrícia e Rita. Porque mesmo que a vida mude, os bons momentos nunca serão esquecidos.
Aos meus pais, essenciais para que tudo na minha vida seja possível e ao meu irmão, companheiro inseparável. Pelos valores transmitidos, pelo amor incondicional e por tudo fazerem para que a construção do meu futuro se torne bem mais fácil. Ao meu afilhado, Tiago, por me fazer sorrir sempre.
À minha avó, pelo orgulho que sempre teve em mim. Ao meu avô que, apesar de não ter assistido a mais esta etapa, sei que continua a olhar por mim.
1
1. INTRODUÇÃO GERAL
1.1. Introdução
O género Bartonella é atualmente constituído por mais de 20 espécies e subespécies de bactérias Gram-negativas de crescimento fastidioso, que invadem os eritrócitos e células endoteliais, causando uma bacteriemia intraeritrocitária prolongada recorrente. Afetam vários hospedeiros mamíferos, aos quais estão altamente adaptadas, e são maioritariamente transmitidas por vetores artrópodes (Guzel et al., 2011; Lamas et al., 2010; Chomel e Kasten, 2010).
Nas duas últimas décadas, tem-se observado um crescente aumento na descoberta e identificação de novas espécies pertencentes a este género, isoladas a partir de uma ampla variedade de hospedeiros mamíferos domésticos e selvagens. Algumas dessas espécies são potencialmente zoonóticas, como é o caso de Bartonella henselae (Guzel et al., 2011; Guptill, L., 2010; Chomel e Kasten, 2010).
Os gatos são o principal reservatório de B. henselae, agente etiológico primordial da Doença da Arranhadela do Gato (Chomel e Kasten, 2010), que é transmitida entre os gatos, sobretudo, através das fezes das pulgas da espécie Ctenocephalides felis
(Boulouis et al., 2005). A transmissão aos seres humanos ocorre através das arranhadelas ou mordeduras de gatos infetados pela bactéria (Edouard e Raoult, 2010).
As espécies do género Bartonella têm vindo a ser reconhecidas como agentes bacterianos patogénicos com uma importância crescente, quer em medicina veterinária quer em medicina humana (Oskouizadeh et al., 2010). A Bartonelose deverá ser encarada como uma das mais importantes infeções emergentes ou re-emergentes para o ser humano (Day, M., 2011).
1.2. Etiologia
1.2.1. Taxonomia
As bactérias do género Bartonella pertencem ao subgrupo alfa-2 da classe das Proteobactérias, e encontram-se filogeneticamente próximas dos géneros Afipia, Brucella,
Agrobacterium e Rhizobium (Edouard e Raoult, 2010; Guptill, L., 2010; Jacomo et al., 2002).
Pertencem à ordem Rhizobiales, e à família Bartonellaceae, que contém unicamente este género. O número de espécies descobertas e descritas neste género tem aumentado consideravelmente desde o início da década de 1990 e, atualmente, estão descritas, pelo menos, 22 espécies diferentes de Bartonella (Guptill, L., 2010; Breitschwerdt, E., 2008). Todas
2
as espécies de Bartonella estão fortemente relacionadas, partilhando mais de 98% de homologia a nível das sequências dos genes 16S rRNA (Jacomo et al., 2002).
1.2.2. História
Desde há mais de 1000 anos que existem relatos de infeções provocadas pelas diferentes espécies de Bartonella (Kaiser et al., 2011). O DNA de B. henselae foi identificado na polpa dental de cadáveres de gatos que viveram entre os séculos XIII e XVI, em distintas regiões de França, demonstrando a ocorrência de bacteriemia devido a este agente há 800 anos (La et al., 2004). Nas duas últimas décadas, observou-se um aumento exponencial no número de espécies e subespécies identificadas dentro deste género, isoladas a partir de um amplo espectro de mamíferos (Chomel e Kasten, 2010). Até 1993, porém, o género Bartonella era constituído unicamente por B. bacilliformis, o agente etiológico da Doença de Carrión (Edouard e Raoult, 2010). Nesse ano, Brenner e colaboradores propuseram a unificação dos géneros Rochalimaea e Bartonella, tendo em conta as similaridades a nível genético (Brenner
et al., 1993). No ano anterior, Regnery e colaboradores isolaram e identificaram Rochalimaea henselae, a partir do sangue de um indivíduo com SIDA que se apresentava febril. Este
microrganismo passou a denominar-se Bartonella henselae e, mais tarde, foi associado à etiologia da Doença da Arranhadela do Gato (CSD). Esta alteração taxonómica conduziu à transferência destas espécies desde a família Rickettsiaceae para a família Bartonellaceae, tendo sido esta, portanto, removida da ordem Rickettsiales (Breitschwerdt e Kordick, 2000). Em 1995, Birtles e colaboradores propuseram a unificação dos géneros Grahamella e Bartonella, com base nas semelhanças das sequências genéticas entre eles, o que conduziu à extinção dos antigos géneros Rochalimaea e Grahamella (Birtles et al., 1995).
Atualmente, o género Bartonella é constituído por mais de 22 espécies e subespécies reconhecidas, incluindo algumas que, originalmente, pertenciam aos géneros Rochalimaea e
Grahamella, e o número de espécies e seus respetivos hospedeiros reservatórios tem vindo
constantemente a crescer (Kaiser et al., 2011; Guptill, L., 2010). Existem 13 espécies ou subespécies consideradas patogénicas para os seres humanos; 4 dessas espécies foram isoladas a partir de gatos (Chomel e Kasten, 2010). Além de B. henselae, os gatos podem ainda ser infetados por B. clarridgeiae, B. koehlerae, B. quintana e B. bovis, de acordo com os resultados de culturas microbiológicas ou técnicas de amplificação do DNA (Stiles, J., 2011; Guptill, L., 2010; Brunt et al., 2006; Boulouis et al., 2005). No entanto, só raramente foram referenciadas infeções por outras espécies além de B. henselae ou B. clarridgeiae (Stiles, J., 2011).
A infeção por B. henselae em felídeos foi descrita pela primeira vez em 1992, por Regnery e colaboradores (Guptill, L., 2010; Boulouis et al., 2005). Seguiram-se muitos outros
3
relatos de infeção por Bartonella spp. em diferentes espécies animais. Desde então, já foram publicados centenas de artigos relacionados com B. henselae ou espécies próximas, e têm sido realizados avanços consideráveis no que concerne ao diagnóstico, tratamento e prevenção da infeção em gatos e em seres humanos (Brunt et al., 2006).
1.2.3. Caracterização Bacteriológica
Todas as espécies de Bartonella spp são pequenos bacilos (ou cocobacilos) Gram-negativos, ligeiramente curvados e aeróbios, pleomórficos, cujas dimensões variam entre 1 a 2 µm. São catalase, oxidase, urease e nitrato-redutase negativos (Edouard e Raoult, 2010; Agan e Dolan, 2002; Breitschwerdt e Kordick, 2000). Os restantes carateres bioquímicos são providos de menor interesse, uma vez que não permitem a diferenciação entre as distintas espécies de Bartonella spp. (Edouard e Raoult, 2010). Considera-se que a maioria das espécies é bioquimicamente inerte, no que diz respeito aos restantes parâmetros bioquímicos, exceto no que diz respeito à produção de peptidases (Boulouis et al., 2005; Breitschwerdt e Kordick, 2000).
Algumas espécies são flageladas ou contêm estruturas que se assemelham a fímbrias, o que facilita a invasão dos eritrócitos, enquanto outras, como B. henselae, parecem carecer de qualquer uma dessas estruturas (Breitschwerdt e Kordick, 2000).
Trata-se de bactérias de crescimento fastidioso, que demoram cerca de 5 a 15 dias até formarem colónias visíveis; contudo, o período de crescimento poderá atingir os 45 dias (Edouard e Raoult, 2010; Boulouis et al., 2005; Agan e Dolan, 2002). Tradicionalmente, crescem em meios de agar semi-sólido, enriquecidos com sangue de coelho (ou de ovelha ou cavalo), a uma temperatura de 35 – 37ºC e numa atmosfera enriquecida com 5% de CO2
(Boulouis et al., 2005; Edouard e Raoult, 2010). Num isolamento primário, algumas espécies (como, por exemplo, B. henselae) apresentam-se sob a forma de colónias de coloração esbranquiçada e de aparência rugosa, seca e com relevo, tendo uma pequena depressão no centro. São colónias difíceis de quebrar e de transferir. Pelo facto de apresentarem um crescimento fastidioso, alguns dos métodos bioquímicos de identificação padronizados poderão não ser aplicáveis no caso destas bactérias (Boulouis et al., 2005). A impregnação de tecidos infetados com prata, pelo método Warthin-Starry, poderá permitir a identificação destes microrganismos, revelando a presença de pequenos bacilos, que tendem a aparecer sob a forma de aglomerados fortemente compactados. Do mesmo modo, também podem ser identificados dentro dos eritrócitos através da coloração de Grünwald Giemsa (Boulouis et al., 2005).
4 1.2.4. Caracterização Genómica
Desde a primeira descrição genómica de B. henselae, nos EUA, foram identificadas diversas estirpes, isoladas a partir de seres humanos e de gatos, em diferentes partes do mundo (América, Europa, África e Austrália) (Ciceroni et al., 2002). B. henselae apresenta uma acentuada diversidade genética, tal como se pode comprovar pelas diferenças observadas nos microrganismos desta espécie isolados a partir de gatos (Brunt et al., 2006). Apresenta uma elevada heterogeneidade genotípica e fenotípica, tal como vários estudos comprovaram, mediante a utilização de diferentes métodos de análise molecular (Ciceroni et al., 2002).
A análise das sequências génicas da região 16S rRNA de B. henselae, revelou a existência de dois genótipos distintos: o genótipo tipo I (Houston) e o genótipo tipo II (Marseille) (Brunt et al., 2006; Chomel et al., 2006; Boulouis et al., 2005). Esta classificação tornou-se amplamente aceite, permitindo uma divisão filogenética consistente e significativa dentro desta espécie, embora sejam descritos vários subgrupos dentro de cada um desses tipos genotípicos inicialmente referidos, com recurso a outros métodos de classificação genética (Guptill, L., 2010; Brunt et al., 2006; Iredell et al., 2003). Alguns autores referem a existência de um terceiro genótipo, denominado Berlin-2 (Edouard e Raoult, 2010; Li et al., 2007).
Apenas o genoma de B. henselae Houston-1 foi totalmente sequenciado, segundo dados recentes (Edouard e Raoult, 2010). O genótipo tipo II aparenta ser ancestral, quando comparado com o genótipo tipo I, tendo este aparecido mais tardiamente (Iredell et al., 2003). Os gatos podem ser co-infetados por ambos os genótipos principais de B. henselae (Boulouis et al., 2005).
Alguns métodos moleculares, nomeadamente a electroforese
(“pulse-field-gel-electrophoresis” – PFGE), comprovam a existência de uma acentuada diversidade entre os
diferentes microrganismos isolados (Arvand et al., 2006; Iredell et al., 2003; Ciceroni et al., 2002). Há também evidências que suportam a existência de variação genómica durante o próprio curso da infeção em gatos, o que confere a este agente a capacidade de permanecer em circulação nos animais infetados durante longos períodos de tempo, escapando à ação do sistema imunitário (Guptill, L., 2010). Em 2003, Iredell e colaboradores referiram a possibilidade de transferência de genes entre as diferentes estirpes de B. henselae, sugerindo que a recombinação génica desempenha um papel importante na variabilidade genética que
B. henselae apresenta (Iredell et al., 2003).
A respetiva prevalência de cada um destes genótipos, quer em gatos quer em seres humanos, varia consideravelmente consoante as diferentes localizações geográficas em que os diferentes estudos se realizaram (Ebani et al., 2011; Chomel e Kasten, 2010; Fabbi et al., 2004; Guptill et al., 2004; Gurfield et al., 2001; Maruyama et al., 2001). B. henselae tipo Marseille é o genótipo dominante nas populações de gatos do Oeste dos EUA, Europa
5
Ocidental (França, Alemanha, Itália, Holanda, Reino Unido) e Austrália, enquanto o tipo Houston-1 é dominante nos países asiáticos (Chomel e Kasten, 2010). Maruyama e colaboradores analisaram, com recurso a PFGE, diversas estirpes de B. henselae, originárias dos EUA, França e Japão, e, tendo em conta os resultados obtidos, propuseram que as populações americana e japonesa de B. henselae tiveram origem a partir de um ancestral europeu, tendo evoluído posteriormente nas respetivas populações felinas (Maruyama et al., 2001). Contudo, estão descritas diferenças na prevalência da infeção pelos dois tipos de
B. henselae, dentro do mesmo país ou região, nas diferentes populações felinas estudadas
(Chomel et al., 2006; Guptill, L., 2010).
Dentro do tipo Houston-1 há ainda diversas estirpes, podendo os gatos ser infetados por mais do que uma dessas estirpes em simultâneo. A grande diversidade dos padrões genómicos obtidos, mediante PFGE, poderá ser o resultado de deriva genética dos microrganismos analisados, o que, por sua vez, poderá ter como principal causa a bacteriemia prolongada que ocorre nos gatos, apesar do desenvolvimento de uma resposta imunitária por parte do hospedeiro infetado (Maruyama et al., 2001).
A maioria dos estudos realizados sugere que as estirpes que infetam os seres humanos apresentam menor diversidade genética do que as que infetam os gatos (Iredell et al., 2003; Dillon et al., 2002). Alguns estudos revelam que a maioria dos casos de Doença da Arranhadela do Gato (CSD) em seres humanos é provocada por B. henselae tipo Houston-1, apesar de o tipo Marseille ser o mais prevalente na população felina, o que sugere que o tipo Houston-1 pode ser a estirpe mais virulenta para os seres humanos; há, portanto, também diferenças entre as estirpes no que concerne à sua virulência (Chomel e Kasten, 2010; Boulouis et al., 2005; Iredell et al., 2003; Dillon et al., 2002; Gurfield et al., 2001).
1.3. Epidemiologia
1.3.1. Distribuição Geográfica e Prevalência
As espécies de Bartonella spp têm uma distribuição mundial, verificando-se uma maior prevalência da infeção por este agente em áreas cujas condições ambientais são mais propícias ao desenvolvimento dos vetores artrópodes, isto é, em regiões com temperaturas e teores de humidade mais elevados (Stiles, J., 2011; Guptill, L., 2010; Breitschwerdt e Kordick, 2000). Os estudos seroepidemiológicos e bacteriológicos efetuados demonstram um aumento da prevalência de bacteriemia desde os países de clima frio (0% na Noruega) até aos países com climas temperados ou quentes e húmidos (68% nas Filipinas) (Boulouis et al., 2005). As seroprevalências são também inferiores, em gatos e em seres humanos, nas latitudes mais a norte, aumentando nos climas mais quentes (Chomel et al., 2006).
6
A infeção de gatos por B. henselae tem sido extensamente documentada na literatura, tendo sido já relatada em vários países da Europa, Ásia, Oceania e América, com base em estudos seroepidemiológicos e bacteriológicos (Boulouis et al., 2005). As taxas de prevalência variam significativamente, consoante a localização geográfica. A prevalência de anticorpos contra B. henselae varia entre 5% a 80%, podendo atingir 93% da população estudada, em gatos de certas colónias (Guptill, L., 2010; Boulouis et al., 2005). Também se verificam diferenças nos níveis de seroprevalências entre indivíduos vivendo na mesma região geográfica (Mansueto et al., 2011). A prevalência de bacteriemia varia entre uma pequena percentagem a mais de metade da população avaliada, alterando também com o ambiente em que o animal vive (animal de interior ou com acesso ao exterior) (Boulouis et al., 2005).
1.3.2. Espécies Suscetíveis
Tratando-se de um agente infecioso que é transmitido através de vetores artrópodes, a preferência destes por certos hospedeiros influencia a transmissão de B. henselae e, portanto, as espécies em que a bactéria é mais frequentemente identificada (Breitschwerdt e Kordick, 2000). Os gatos são o hospedeiro mamífero natural e primário de B. henselae (Guptill, L., 2010; Edouard e Raoult, 2010). Os cães (Canis lupus familiaris) podem também ser infetados por B.
henselae, entre outras espécies de Bartonella, havendo descrições esporádicas das
seroprevalências do microrganismo nesta espécie (Boulouis et al., 2005; Chomel et al., 2006). No entanto, ao contrário do que ocorre nos gatos, os cães não parecem ser um reservatório primário, mas sim hospedeiro acidental, nas regiões não tropicais (Mogollon-Pasapera et al., 2009). No Taiwan, foi reportado um caso de CSD com origem a partir de um cão (Chen et al., 2007).
B. henselae foi também detetada em bovinos (Bos taurus), que não apresentavam
quaisquer sinais de doença, e também em cavalos que apresentavam diferentes sinais clínicos (artropatia crónica, vasculites, aborto). No entanto, não é possível determinar o potencial patogénico que B. henselae desempenha nestas espécies (Guptill, L., 2010).
B. henselae tipo Houston-1 foi isolada a partir de um roedor (Apodemus sylvaticus). Não
está, ainda, também neste caso, determinado o potencial dos roedores funcionarem como reservatório natural da bactéria, sendo necessários estudos adicionais (Boulouis et al., 2005).
Os felídeos selvagens, nomeadamente pumas (Puma concolor), leões africanos (Panthera leo) e chitas (Acinonyx jubatus), em cativeiro ou no seu ambiente natural, são também sensíveis à infeção por B. henselae (Stiles, J., 2011; Boulouis et al., 2005). Tal como ocorre com os felídeos domésticos, os estudos serológicos e bacteriológicos efetuados em felídeos selvagens sugerem que estes podem também ser classificados como reservatórios do agente, mantendo-o no ambiente em que vivem (Molia et al., 2004).
7
A infeção por B. henselae é uma zoonose comum, pelo que os seres humanos são também alvo da infeção por esta bactéria, que pode cursar com diferente sintomatologia, nomeadamente CSD, angiomatose bacilar, peliose bacilar, bacteriemia recidivante com febre, neurorretinite e endocardite (Mansueto et al., 2011; Stiles, J., 2011).
1.3.3. Fatores de Risco
De entre os principais fatores de risco para a infeção de felídeos domésticos por
Bartonella spp., são referidos, embora nem sempre de forma consensual, as condições
climáticas, a idade, o sexo, o acesso à rua e a infestação, atual ou prévia, por pulgas (Guptill, L., et al., 2004; Gurfield et al., 2001).
A prevalência de anticorpos anti–B. henselae varia muito consoante a localização geográfica dos animais avaliados (McElroy et al., 2010). Os animais mais velhos apresentam uma maior prevalência de anticorpos anti-B. henselae do que os animais com idades inferiores a um ano (Guptill, L., 2010). Por outro lado, os gatos jovens têm maior probabilidade de se apresentarem bacteriémicos (McElroy et al., 2010; Chomel e Kasten, 2010; Brunt et al., 2006; Boulouis et al., 2005). Não está estabelecida uma relação entre a presença de bacteriemia e o sexo do animal, havendo resultados muito díspares nos estudos efetuados (Gurfield et al., 2001).
O acesso à rua e o contacto com outros gatos é também um fator de risco para o desenvolvimento de bacteriemia, verificando-se que os gatos oriundos da rua ou adotados de gatis e os que vivem em ambientes com mais do que um gato têm maior probabilidade de serem bacteriémicos ou seropositivos do que os gatos sem acesso à rua e que não têm qualquer contacto com outros gatos (McElroy et al., 2010; Chomel e Kasten, 2010; Brunt et al., 2006; Guptill et al., 2004; Gurfield et al., 2001).
A exposição a artrópodes, que funcionam como vetores da bactéria, é outro fator de risco, verificando-se que a prevalência da bacteriemia é superior em gatos infestados por pulgas (Breitschwerdt et al., 2010; Brunt et al., 2006; Gurfield et al., 2001).
As infeções por retrovírus, a imunodepressão induzida por fármacos ou a senescência imunitária associada ao processo de envelhecimento são outros fatores que poderão contribuir para o aparecimento de alterações clínicas nos animais infetados (Breitschwerdt et al., 2010).
1.3.4. Transmissão
Tal como ocorre com muitos outros agentes infeciosos transmitidos por vetores,
Bartonella spp. têm um ciclo epidemiológico que engloba um hospedeiro reservatório, no qual
provoca uma bacteriemia intraeritrocitária crónica, e um vetor artrópode, responsável pela transmissão da bactéria desde o hospedeiro reservatório até outros hospedeiros sensíveis, que
8
poderão ser hospedeiros naturais ou acidentais (Jacomo et al., 2002). Geralmente, há uma associação específica entre o hospedeiro natural, o vetor e a espécie de Bartonella em causa, o que determina o espectro dos hospedeiros atingidos e a distribuição geográfica dos agentes (Jacomo et al., 2002; Breitschwerdt e Kordick, 2000). A bacteriemia recorrente crónica provocada por B. henselae facilita, provavelmente, a sua transmissão vetorial entre a população felina, tal como sucede com outros agentes transmitidos por vetores hematófagos (Guptill, L., 2010).
B. henselae é naturalmente transmitida entre os gatos através de pulgas, da espécie Ctenocephalides felis (Chomel et al., 1996; Guptill, L., 2010), tal como foi demonstrado, em
1996, por Chomel e colaboradores. Neste estudo, os autores verificaram que pulgas removidas de gatos bacteriémicos transmitiram B. henselae a gatos SPF. Por outro lado, verificaram também que quando gatos SPF coabitaram com gatos bacteriémicos, num ambiente livre de pulgas, não houve transmissão do agente. Concluíram, portanto, que a transmissão da infeção entre os gatos requer a presença de pulgas.
Vários estudos sugerem que a bactéria não se encontra na saliva das pulgas, mas sim nas suas fezes, pelo que a transmissão entre os gatos ocorre a partir das fezes das pulgas e não diretamente através das picadas (Edouard e Raoult, 2010). B. henselae pode sobreviver, permanecendo reprodutivamente viável, nas fezes das pulgas entre 3 a 9 dias, funcionando, deste modo, como uma fonte de contaminação ambiental importante (Stiles, J., 2011).
A transmissão em ambiente natural ocorre quando os gatos possuem uma lesão cutânea (arranhadela, mordedura, abrasão ou picada de artrópode), que é contaminada por fezes de pulgas contendo o agente patogénico (McElroy et al., 2010; Breitschwerdt et al., 2010). Os atos de higiene que os gatos praticam, em si próprios e em outros gatos, também contribuem para a disseminação do agente, uma vez que espalham as fezes de pulga presentes na pelagem (Stiles, J., 2011).
A nível experimental, verificou-se que B. henselae pode ser transmitida por via intravenosa e intramuscular, através da inoculação de sangue proveniente de gatos infetados (Guptill et al., 1997; Kordick et al., 1999). Verificou-se também a infeção experimental mediante a inoculação da bactéria, obtida após crescimento em meio de cultura, através das vias intravenosa, subcutânea, intradérmica e oral (Brunt et al., 2006; Abbott et al., 1996; Greene et
al., 1996). Também se comprovou a ocorrência de infeção após a inoculação intradérmica de
fezes de pulgas infetadas com B. henselae (Brunt et al., 2006). Não se comprovou a transmissão do agente através da saliva das pulgas (Guptill, L., 2010).
Nos diversos estudos experimentais efetuados, que decorreram em ambientes livres de pulgas, não se verificou a transmissão de B. henselae entre gatos infetados e não infetados (Chomel et al., 1996). Este facto permitiu descartar outras hipóteses de transmissão, entre os
9
gatos, tais como mordeduras ou arranhadelas, partilha de recipientes de água ou comida, partilha de caixas de areia ou através dos atos de higiene praticados pelos animais. Não se verificou, portanto, a ocorrência de transmissão horizontal através de contacto próximo, entre gatos bacteriémicos e gatos suscetíveis. Também não se verificou transmissão por via vertical, galactogénica (através do colostro ou do leite) ou durante o acasalamento, também em ambientes livres de pulgas (Guptill et al., 1998; Abbott et al., 1996).
A conjugação destes dados com os resultados de estudos serológicos e epidemiológicos, que correlacionam a infeção por B. henselae em gatos com acesso ao exterior e/ou exposição a pulgas, permite concluir que a principal fonte de infeção são as fezes das pulgas, que contêm o agente, e que a exposição a este artrópode, ou às suas fezes, é o fator mais importante na transmissão de Bartonella entre a população felina (Brunt et al., 2006).
1.3.5. Vetores
A permanência intraeritrocitária de Bartonella aumenta a probabilidade de ingestão deste agente pelos vetores artrópodes, durante o processo de alimentação destes nas diferentes espécies mamíferas hospedeiras (Billeter et al., 2008). É importante diferenciar as espécies de artrópodes que são vetores competentes do agente daquelas que são apenas potenciais vetores, isto é, espécies em que o microrganismo foi identificado, por cultura ou PCR, mas em que a sua presença apenas se deve à ingestão acidental de sangue, a partir de um hospedeiro bacteriémico. Na maioria dos casos, a identificação de B. henselae num determinado artrópode não prova definitivamente a sua competência vetorial, ou seja, a sua capacidade de transmitir a bactéria, de uma forma eficaz, a outro hospedeiro (Billeter et al., 2008).
Com recurso a técnicas de cultura bacteriológica ou de identificação molecular, nomeadamente PCR, o DNA de B. henselae foi detetado em pulgas da espécie C. felis em vários países, incluindo França (Rolain et al., 2003; La Scola et al., 2002), EUA (Kamrani et al., 2008; Chomel et al, 1996), Reino Unido (Shaw et al., 2004), Alemanha (Just et al., 2009), Espanha (Marquéz et al., 2009), Tailândia, Japão, Nova Zelândia e Hungria (Billeter, S., 2008; Brunt et al., 2006). Em Portugal, num estudo realizado em 2009, o DNA de
B. henselae não foi detetado em pulgas de gatos, embora
encontrassem o DNA de B. clarridgeiae (Alves et al., 2009). Koehler e colaboradores identificaram, em 1994, o DNA de
B. henselae em pulgas, através de PCR, e cultivaram a
bactéria a partir de pulgas colhidas de gatos bacteriémicos (Tsai et al, 2011; Billeter et al., 2008). Experimentalmente, comprovou-se que este se trata de um vetor competente de transmissão de B. henselae (Chomel et al., 1996).
Figura 1: Morfologia de
Ctenocephalides felis. Adaptado de Bitam et al., 2010.
10
Além de C. felis, o DNA de B. henselae foi identificado em várias espécies de ixodídeos, que têm sido apontados como um dos potenciais vetores de transmissão da bactéria entre gatos, cães, seres humanos e outros hospedeiros mamíferos (Guptill, L., 2010). A presença de
B. henselae foi constatada em ixodídeos das espécies Ixodes pacificus e I. ricinus, colhidos em
humanos (Chung et al., 2004; Sanogo et al., 2003; Chang et al., 2001), assim como em
I. scapularis, I. persulcatus, Riphicephalus sanguineus e Dermacentor reticulatus, recolhidas do
ambiente ou de hospedeiros de diferentes espécies (Tsai et al, 2011). Cotté e colaboradores demonstraram, após infeção experimental de I. ricinus com B. henselae, que o agente é transmitido ao longo dos diferentes estadios evolutivos do artrópode, e também comprovaram a ocorrência de transmissão da bactéria, viável e com poder infetante, desde as carraças para o sangue, confirmando, assim, que I. ricinus é um vetor competente de B. henselae, infetando as glândulas salivares do artrópode (Cotté et al., 2008). Dietrich e colaboradores recolheram carraças da espécie I. ricinus, a partir de quatro locais europeus distintos, incluindo a Madeira (Portugal), em que detetaram a presença do DNA da bactéria em várias carraças, embora em Portugal não se tenha obtido qualquer resultado positivo (Dietrich et al., 2010).
A deteção de B. henselae em diferentes espécies de ixodídeos levantou a hipótese de estes artrópodes funcionarem como um potencial vetor de transmissão do agente a outros hospedeiros, nomeadamente aos seres humanos (Tsai et al, 2011; Chung et al., 2004). Nos EUA, alguns casos de infeção por B. henselae em humanos foram relacionados com uma exposição prévia a carraças e, atualmente, considera-se que o contacto com estes artrópodes constitui um fator de risco para o desenvolvimento de CSD. São necessários estudos complementares que permitam averiguar o papel exato destes parasitas no ciclo de transmissão da bactéria (Chomel e Kasten, 2010; Brunt et al., 2006; Boulouis et al., 2005).
O DNA de B. henselae tipo Marseille foi também detetado em insetos picadores, nomeadamente da espécie Stomoxys calcitrans (Chung et al., 2004). Deve, por isso, também ser investigado o potencial dos insetos picadores como vetores mecânicos ou biológicos competentes de B. henselae.
1.4. Patogenia
B. henselae apresenta um tropismo particular para os eritrócitos e células endoteliais,
onde pode permanecer durante longos períodos de tempo, induzindo, nos gatos, uma bacteriemia intraeritrocitária persistente (Stiles, J., 2011; Edouard e Raoult, 2010; Breitschwerdt et al., 2010; Mehock et al., 1998). A localização intraeritrocitária foi descrita, pela primeira vez, em 1995, com recurso a microscopia electrónica (Kordick e Breitschwerdt, 1995), tendo-se seguido descrições por outros autores, através de diferentes técnicas de visualização, nomeadamente imunofluorescência (Rolain et al., 2001).
11
Os mecanismos que sustentam esta bacteriemia prolongada não são ainda totalmente reconhecidos e encontram-se sob investigação (Breitschwerdt et al., 2010; Guptill, L., 2010). A maior parte do conhecimento que hoje existe acerca da infeção intraeritrocitária de Bartonella advém de um estudo experimental efetuado por Schülein e colaboradores, com recurso a um modelo de infeção de ratos com B. tribocorum, cujos resultados foram depois extrapolados para outras espécies de Bartonella. De acordo com este modelo, a bactéria é rapidamente eliminada da circulação sanguínea, após a infeção por via intravenosa. No entanto, ela é libertada periodicamente (em intervalos de 5 dias, no caso de B. tribocorum), para a corrente sanguínea, a partir de um nicho primário ainda desconhecido. Esta estratégia é comum a várias espécies de Bartonella e apresenta-se como uma possível adaptação do agente à transmissão vetorial (Kaiser et al., 2011). No caso particular de B. henselae, há evidências que sugerem que a medula óssea é, nos seres humanos, um possível nicho primário da bactéria, uma vez que esta tem a capacidade de invadir, in vitro, células precursoras da medula óssea, o que contribui para a infeção intraeritrocitária prolongada (Breitschwerdt et al., 2010; Mandle et al., 2005).
Alguns autores consideram que B. henselae é primariamente endoteliotrópica, podendo colonizar a vasculatura sanguínea, induzindo, periodicamente, uma bacteriemia recorrente (Chomel et al., 2009; Dehio et al., 2004; Schülein et al., 2001).
A infeção experimental de gatos com B. henselae, através de transfusão sanguínea, permitiu documentar a existência de um padrão de bacteriemia recorrente. No estudo efetuado por Kordick e Breitschwerdt, em 1997, observou-se que há um sequestro periódico do agente, em um ou mais tecidos, ao qual se segue a reentrada do microrganismo em circulação sanguínea. Os padrões de bacteriemia observados variam consideravelmente entre gatos pertencentes ao mesmo grupo experimental (Breitschwerdt et al., 2010).
Figura 2. Corpúsculos intraeritrocitários compatíveis com Bartonella spp.
12
Apesar de a localização intraeritrocitária ser a mais frequente, B. henselae foi detetada também a nível extracelular, no sangue e em outros tecidos de animais infetados, nomeadamente no fígado e baço (Stiles, J., 2011; Guptill et al., 2000; Mehock et al., 1998).
Mehock e colaboradores avaliaram o modo de invasão dos eritrócitos por B. henselae,
in vitro, e verificaram que a bactéria se apresentava a nível intracelular, epicelular e
extracelular. Apenas uma pequena percentagem dos eritrócitos foi invadida. A ausência de flagelos de B. henselae sugere que esta invade os eritrócitos com recurso a movimentos rotatórios, através de fímbrias tipo IV, o que poderá explicar o menor nível de invasão dos eritrócitos que se verifica nesta espécie, em comparação com outras espécies flageladas de
Bartonella (Mehock et al., 1998).
Os gatos experimentalmente infetados com B. henselae mantêm a bacteriemia durante períodos de tempo bastante prolongados, que variam entre 1 mês a 454 dias (Guptill, L., 2010; Breitschwerdt et al., 2010; Kordick et al., 1999; Guptill et al., 1998). No caso dos gatos naturalmente infetados, com exposição continuada a pulgas, a bacteriemia poderá persistir durante anos ou, eventualmente, de forma indefinida (Kordick et al., 1995). A bacteriemia recorrente nos gatos naturalmente infetados poderá não ser devida a uma verdadeira recorrência, mas dever-se a uma reinfeção (recidiva), pelo contato com pulgas, sugerindo a ausência de proteção imunitária prolongada após uma infeção prévia por Bartonella (Arvand et al., 2008).
A bacteriemia persistente é, de facto a característica mais marcante da infeção por
B. henselae em gatos (Chomel e Kasten, 2010). A localização intraeritrocitária parece
constituir-se como uma estratégia adaptativa muito particular, podendo ter desempenhado um papel determinante na história evolutiva natural de B. henselae. A colonização intracelular não hemolítica dos eritrócitos e a permanência no interior das células endoteliais preserva
B. henselae da resposta imunitária do hospedeiro, facilita a sua disseminação a outros tecidos
do organismo, protege a bactéria durante a transmissão vetorial e facilita a evasão à terapia antimicrobiana (Breitschwerdt et al., 2010; Mehock et al., 2008).
Para além da capacidade de provocar esta bacteriemia de longa duração, Bartonella pode, nos seres humanos, induzir a angiogénese, e estes dois aspetos da patogenia têm sido um alvo particular de investigação (Kaiser et al., 2011). B. henselae, entre outras espécies de
Bartonella, pode provocar alterações vasculares proliferativas nos seres humanos, sobretudo
em indivíduos imunodeprimidos (Kaiser et al., 2011; Edouard e Raoult, 2010). O modo como são formadas as lesões neoangiogénicas não é ainda totalmente conhecido, embora se pense que há três mecanismos distintos que actuam sinergicamente: i) estímulo da proliferação das células endoteliais, por parte de B. henselae; ii) inibição da apoptose das células endoteliais; iii)
13
reprogramação angiogénica das células hospedeiras infetadas (Kaiser et al., 2011; Edouard e Raoult, 2010).
Nos indivíduos imunocompetentes, B. henselae cursa, geralmente, com o desenvolvimento de CSD, em que a resposta imunitária do hospedeiro é a responsável pelo surgimento das adenopatias e granulomas. Nestes casos, a bactéria é frequentemente encontrada a nível dos macrófagos, nos gânglios linfáticos (Edouard e Raoult, 2010). A bacteriemia que se verifica nos humanos pode levar ao desenvolvimento de endocardite, em indivíduos com valvulopatias pré-existentes, uma vez que a bactéria se fixa sobre as lesões vegetativas extracelulares (Edouard e Raoult, 2010).
1.4.1. Fatores de Virulência
Os fatores de virulência que, até ao momento, têm sido descritos com maior detalhe são: adesinas (nomeadamente, a adesina A de Bartonella – BadA) e os sistemas de secreção tipo IV (T4SS) VirB/D4 e Trw (Franz e Kempf, 2011).
A adesão à célula hospedeira é um dos passos mais importantes durante o processo de infeção bacteriana e, no caso de B. henselae, é facilitado pela adesina BadA (adesina autotransportadora trimérica), que é também determinante como fator de virulência de outras bactérias Gram-negativas. Foi proposto que a hemaglutinina filamentosa (uma outra adesina) poderá também ter influência como mediador da adesão às células hospedeiras em bactérias Gram-negativas, embora não haja, ainda, dados experimentais que o confirmem. As adesinas de B. henselae poderão interagir com outros fatores de virulência importantes, como os sistemas de secreção tipo IV, responsáveis pelo transporte de proteínas efectoras e de DNA para dentro das células hospedeiras (Franz e Kempf, 2011).
O T4SS VirB/D4 de B. henselae tem efeitos importantes, incluindo a promoção da libertação de citocinas pró-inflamatórias ou pró-angiogénicas, assim como a inibição da apoptose das células endoteliais invadidas (Guptill, L., 2010). Este sistema de secreção está envolvido no estabelecimento de uma infeção crónica e bacteriémica no hospedeiro, tal como demonstrado em modelos experimentais (Franz e Kempf, 2011).
B. henselae apresenta ainda o T4SS Trw, responsável pela colonização intracelular dos
eritrócitos; poderá representar um fator de virulência adicional muito importante, no estabelecimento da bacteriemia crónica que tipicamente ocorre nos hospedeiros felinos e, provavelmente, interage com as adesinas durante o processo de infeção primário (Franz e Kempf, 2011).
Atualmente, é ainda reduzido o conhecimento que existe acerca dos mecanismos que decorrem no curso de uma infeção por B. henselae, sendo necessários mais estudos para
14
clarificar o modo como estes microrganismos persistem nos hospedeiros vertebrados por períodos prolongados.
1.5. Sinais Clínicos
A maioria dos gatos infetados por B. henselae, de modo natural ou experimental, não desenvolve sinais evidentes de doença (Guptill, L., 2010; Brunt et al., 2006). A relação próxima que as espécies de Bartonella sempre tiveram com os gatos domésticos, ao longo da história, permitiu que se estabelecesse uma adaptação evolutiva entre o microrganismo infetante e o hospedeiro, facilitando a coexistência de ambos e minimizando os efeitos patogénicos neste último, o que justifica a ausência de sinais clínicos exuberantes (Guptill, L., 2010). Deste modo, torna-se difícil estabelecer uma relação evidente entre a infeção por B. henselae e o quadro clínico provocado nos gatos, dado o grande número de felinos naturalmente infetados que não exibem quaisquer sinais clínicos (Brunt et al., 2006).
O espectro clínico da infeção nos gatos não está, ainda, totalmente clarificado. Os gatos parecem apresentar-se, sobretudo, como portadores assintomáticos e saudáveis da bactéria (Chomel e Kasten, 2010; Boulouis et al., 2005). A bacteriemia por B. henselae pode ser constatada, mediante cultura de sangue, em 25 a 41% de gatos saudáveis, em diferentes regiões do mundo (Breitschwerdt et al., 2010). Até ao momento, a literatura refere, com relativa escassez, alguns casos em que se associa a infeção por B. henselae ao desenvolvimento de sintomatologia clínica consequente, em gatos naturalmente expostos ao agente (Brunt et al., 2006). A ocorrência e severidade dos sinais clínicos variam com a estirpe presente (O’Reilly et al.,1999).
As alterações clínicas após a infeção natural, quando presentes, são, geralmente, ligeiras, acabando por passar despercebidas à maioria dos proprietários dos animais (Guptill, L., 2010). Alguns animais desenvolvem um período febril de curta duração, após a realização de um procedimento cirúrgico de rotina. O stresse, induzido por cirurgia ou trauma, poderá ser um fator que induz a manifestação da doença nos gatos, traduzindo-se no aparecimento de febre, anemia moderada e disfunções neurológicas, embora esta hipótese careça ainda de confirmação experimental (Breitschwerdt et al., 2008).
B. henselae tem sido sugerida como um potencial agente etiológico de algumas doenças
oculares, nomeadamente, uveítes, em gatos e em seres humanos (Ketring et al., 2004). O primeiro caso suspeito de manifestação ocular da bartonelose felina foi descrito em 1999, por Lappin e Black (citados por: Ketring et al., 2004; Fontenelle et al., 2008; Stiles, J., 2011) tendo ocorrido num gato com uveíte anterior crónica, que apresentava anticorpos anti-B. henselae no soro e intra-oculares e no qual se verificou a resolução da sintomatologia após a administração de doxiciclina e exclusão de outras possíveis etiologias. Em 2008, Fontenelle e colaboradores
15
não encontraram diferenças nos títulos de anticorpos entre dois grupos de gatos, respetivamente com e sem uveíte. Até à data, apenas o caso anteriormente descrito sugere, de forma bastante evidente, que B. henselae pode ser uma causa de uveíte em gatos. No entanto, tendo em consideração a prevalência disseminada da bactéria na população felina, são reduzidas as evidências que a bartonelose seja uma causa evidente de uveítes em gatos, sendo necessários estudos complementares que esclareçam a importância deste agente na etiologia de doença ocular em gatos (Stiles, J., 2011; Ketring et al., 2004).
B. henselae tipo I foi associada a casos de endocardite, a nível da válvula aórtica, em
gatos naturalmente expostos ao agente, e que apresentaram resultados negativos na cultura bacteriológica a partir do sangue. Alguns destes casos tiveram um desfecho fatal (Chomel et
al., 2009; Chomel et al., 2003).
Sendo pouco comum a ocorrência e deteção de sinais clínicos em gatos infetados de modo natural, é através dos ensaios experimentais que se obtém a maioria da informação relativamente às alterações clínicas que B. henselae, potencialmente, provoca nos hospedeiros (Guptill, L., 2010). Os sinais clínicos evidenciados por gatos experimentalmente infetados com
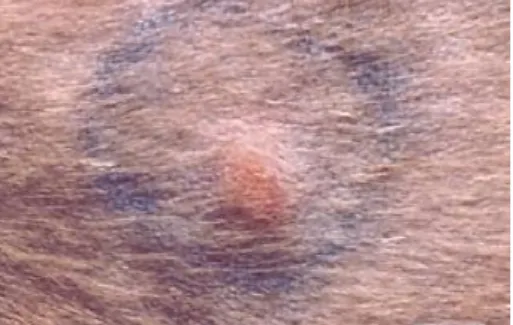
B. henselae são, geralmente, ligeiros, variando com a estirpe utilizada na inoculação. A inoculação por via intradérmica ou subcutânea conduz à inflamação (edema, eritema) desse local, com formação de abcessos e endurecimento, num período de 3 dias e até 3 - 4 semanas após a inoculação (O’Reilly et al., 1999; Guptill et al., 1997; Greene et al., 1996).
A alteração clínica mais frequentemente relatada é a ocorrência de um período febril, tipicamente de curta duração e com temperatura superior a 39.4ºC, durante as primeiras 48-96 horas pós--inoculação e, novamente, 2 semanas depois da inoculação do agente. Outros sinais transitórios incluem o aparecimento de anemia ligeira e linfadenomegalia, localizada ou generalizada. Em alguns casos, foram detetadas disfunções neurológicas transitórias, que se traduziram em nistagmos, convulsões motoras focais, diminuição ou exagero na resposta a estímulos externos, e alterações comportamentais, como agressividade. Alguns animais
16
manifestaram dor muscular epaxial, enquanto outros apresentaram letargia e anorexia (total ou parcial), durante o período febril (O’Reilly et al., 1999; Kordick et al., 1999; Guptill et al., 1997).
Os gatos infetados experimentalmente, através da inoculação intradérmica de
B. henselae, sofreram uma diminuição da sua eficácia reprodutiva, verificada quer em machos
quer em fêmeas. Esse défice reprodutivo traduziu-se na ocorrência de nados-mortos, ausência de gestação e, em alguns casos, gestação obtida apenas após cruzamentos repetidos (Guptill et al., 1998).
Devido à elevada prevalência de gatos bacteriémicos assintomáticos, torna-se difícil estabelecer uma relação de causa-efeito entre as manifestações de doença e a presença de bacteriemia, pelo que são necessários estudos epidemiológicos alargados, envolvendo regiões onde o agente esteja presente de forma endémica e não endémica (Breitschwerdt et al., 2010).
1.5.1. Relação de Bartonella spp. com outras doenças felinas crónicas
Considerando que a bacteriemia provocada por B. henselae ocorre com bastante frequência e é de longa duração, foi sugerido que este agente possa ter influência no surgimento e manutenção de algumas doenças crónicas que afetam os gatos. Um estudo realizado na Suíça demonstrou que os gatos seropositivos apresentavam uma maior probabilidade de desenvolverem estomatite, doenças renais e infeções do tracto urinário (Glaus et al., 1997). Um estudo retrospetivo mais recente encontrou uma associação entre a presença de gengivoestomatite e a infeção por Bartonella spp., verificada em gatos bacteriémicos mas não em gatos seropositivos (Sykes et al., 2010). Estes resultados permitiram colocar a hipótese, ainda que de forma especulativa, que a infeção intravascular duradoura por B. henselae possa trazer consequências negativas, a longo prazo, para os animais (Breitschwerdt et al., 2010).
No entanto, esta associação não foi consistentemente encontrada em estudos posteriores, realizados em gatos provenientes de regiões com forte infestação por pulgas. Alguns estudos seroepidemiológicos avaliaram a existência de uma associação entre a exposição a B. henselae (através de serologia ou deteção da presença do DNA da bactéria) e a ocorrência de várias condições clínicas, como alterações neurológicas (Pearce et al., 2006), gengivite e estomatite (Dowers et al., 2009; Quimby et al., 2008), uveíte (Fontenelle et al., 2008) e febre (Lappin et al., 2008). Os resultados destes estudos, contudo, não confirmaram a existência de uma associação significativa entre uma infeção ativa por
B. henselae e a presença das alterações clínicas referidas.
Os sinais clínicos que têm sido atribuídos a uma infeção por B. henselae são comuns aos provocados por outros agentes e, portanto, torna-se difícil determinar em que animais é que a infeção por esta bactéria é, de facto, a responsável pelos sinais clínicos. São, pois,
17
necessárias investigações epidemiológicas alargadas e rigorosamente controladas, que permitam averiguar até que ponto é que determinadas condições patológicas estão, de facto, associadas a uma infeção por B. henselae (Guptill, L., 2010).
1.6. Resposta Imunitária
Os resultados obtidos após a infeção experimental de gatos indicam que nestes se desenrola, simultaneamente, uma resposta imunitária humoral e celular, que promove a eliminação ou controlo da infeção por B. henselae (Breitschwerdt et al., 2010; Kabeya et al., 2009).
Num estudo experimental, os autores verificaram que a ativação da resposta imunitária celular desempenha um papel determinante na eliminação do agente em gatos bacteriémicos, através da produção de interferão-γ (INF-γ) e fator α de necrose tumoral (TNF-α). Os autores demonstraram a existência de uma associação significativa entre os níveis de INF-γ e o nível de bacteriemia, uma vez que gatos com uma bacteriemia mais acentuada apresentavam uma maior tendência a produzirem níveis superiores de INF-γ, o que permitiu concluir que
B. henselae induz, especificamente, uma resposta imunitária dependente Th1, nos gatos
(Kabeya et al., 2009). Nesse mesmo estudo, Kabeya e colaboradores verificaram que níveis reduzidos de TNF-α, durante o período de bacteriemia, contribuíram para que esta se apresentasse em níveis superiores, sugerindo que o TNF-α desempenha também um papel importante na prevenção da multiplicação da bactéria.
Verificou-se que os gatos experimentalmente infetados tornam-se imunes a uma reinfeção com uma estirpe homóloga de B. henselae (Abbott et al., 1997; Greene et al., 1996). Os gatos infetados com B. henselae tipo II eram resistentes a uma reinfeção com a mesma estirpe da bactéria, não desenvolvendo bacteriemia, mas eram suscetíveis a uma reinfeção com B. henselae tipo I, o que comprova a ausência de proteção cruzada entre estirpes heterólogas da bactéria (Yamamoto et al., 1997). O nível de bacteriemia e a suscetibilidade à reinfeção variam com a estirpe e a espécie de Bartonella spp. infetante (Guptill, L., 2010).
Pelo contrário, Yamamoto e colaboradores evidenciaram a ocorrência de uma proteção cruzada parcial entre ambas as estirpes da bactéria. Estes autores documentaram, tal como esperado, que os gatos infetados inicialmente com B. henselae tipo I e re-infetados com a mesma estirpe estavam protegidos da infeção, mas estavam também parcial ou totalmente protegidos de uma reinfeção por B. henselae tipo II (Yamamoto et al., 2003).
Estes dados são muito importantes para o desenvolvimento de vacinas contra este agente, embora este processo esteja dificultado pelo facto de a proteção cruzada entre as estirpes de B. henselae ser incompleta ou mesmo inexistente, provavelmente devido à variabilidade genética acentuada. Além disso, os gatos naturalmente infetados podem
18
permanecer bacteriémicos durante anos, o que sugere que a resposta imunitária natural poderá ser insuficiente para a completa eliminação do agente (Breitschwerdt et al., 2010; Guptill, L., 2010).
Os dados histopatológicos também permitem suportar a existência de uma resposta imunitária predominantemente mediada por células, que se segue a uma infeção por
B. henselae em gatos. Contudo, esta resposta é parcialmente ineficaz e parece deprimir mas
não eliminar a infeção em muitos gatos naturalmente infetados, resultando numa infeção crónica, acompanhada de um padrão recorrente de bacteriemia (Breitschwerdt et al., 2010).
1.7. Alterações Histopatológicas
Os dados obtidos a partir das necrópsias de animais infetados não são, geralmente, evidentes (Breitschwerdt et al., 2010). Foram detetadas algumas alterações histopatológicas em alguns animais experimentalmente infetados com B. henselae (Kordick et al., 1999; Guptill et al., 1997). Alguns gatos evidenciaram hiperplasia dos nódulos linfáticos periféricos, hiperplasia folicular esplénica, presença de microabcessos esplénicos e hepáticos, colangite ou pericolangite linfocitária, hepatite linfocitária, miocardite linfoplasmocitária e nefrite intersticial linfocitária ou nefrite piogranulomatosa (Kordick et al., 1999; Guptill et al., 1997). Além disso, a bactéria foi detetada em vários tecidos do organismo, nomeadamente, gânglios linfáticos, fígado, coração, rim, pulmão e cérebro (Kordick et al., 1999). Estes dados indicam que a infeção por B. henselae deve ser considerada no diagnóstico diferencial de um grande número de afeções dos gatos, embora seja necessária investigação adicional para estabelecer uma associação causal definitiva entre a infeção e o desenvolvimento das alterações clínicas (Brunt et al., 2006).
1.8. Potencial Zoonótico
A transmissão de B. henselae aos seres humanos ocorre, geralmente, de forma direta, através das arranhadelas dos gatos e/ou através de mordeduras dos animais, caso o sangue do gato ou as fezes das pulgas contaminem o local de lesão cutânea (Kaiser et al., 2011; Edouard e Raoult, 2010; Guptill, L., 2010; Brunt et al., 2006). Apesar de os gatos serem o reservatório principal da bactéria, alguns pacientes humanos negam a possibilidade de existência de mordeduras ou arranhadelas e indicam mesmo a ausência de contacto com estes felinos. Deste modo, considera-se como sendo possível a transmissão direta do agente presente no ambiente, em vetores artrópodes ou outros hospedeiros animais, embora estas hipóteses ocorram com menor frequência e não tenham sido, ainda, reconhecidas como modo de transmissão efetivo (Breitschwerdt et al., 2010; Guptill, L., 2010; Edouard e Raoult, 2010; Brunt et al., 2006).
19
O contacto extensivo com animais e a exposição a artrópodes são fatores de risco para a infeção por B. henselae. Os profissionais de saúde veterinária (médicos, enfermeiros e auxiliares veterinários) têm um risco acrescido de exposição ocupacional, devido à frequência de contacto com sangue e outros fluidos corporais, mordeduras e arranhadelas dos animais, vetores artrópodes e fezes de artrópodes. Esta exposição é mais acentuada quando se lida com animais negligenciados, resgatados da rua ou silváticos (Breitschwerdt et al., 2010). Nos EUA, Noah e colaboradores verificaram, em 1997, que 7,1% dos profissionais de veterinária avaliados eram seropositivos para B. henselae e B. quintana, o que realça o facto de esta profissão estar, geralmente, associada a uma maior probabilidade de infeção, com base no risco de exposição ocupacional (McElroy et al., 2011; Day, M., 2011; Breitschwerdt et al., 2010).
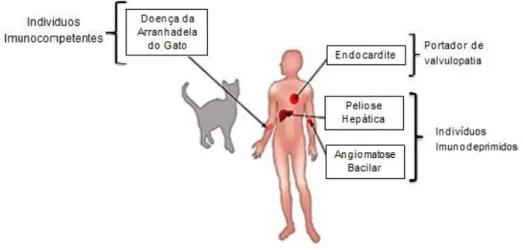
A infeção por B. henselae nem sempre provoca sinais clínicos; numerosos estudos seroepidemiológicos revelaram a presença de anticorpos anti-B. henselae em indivíduos clinicamente saudáveis (McGill et al., 2005; Massei et al., 2003; Sander et al., 2001). O potencial patogénico de B. henselae varia consoante a estirpe infetante e a espécie hospedeira. Nos seres humanos, o curso clínico da doença associada à infeção por este agente varia de acordo com o estatuto imunitário do hospedeiro (Guptill, L., 2010; Brunt et al., 2006; Rolain et al., 2004; Resto-Ruiz et al., 2003). Nos indivíduos imunocompetentes, a infeção por B. henselae está comummente associada ao desenvolvimento da Doença da Arranhadela do Gato, nas formas típica e atípica (incluindo encefalopatias em crianças). Por outro lado, os indivíduos imunodeprimidos desenvolvem, geralmente, afeções mais graves, como a angiomatose bacilar ou a peliose hepática (Edouard e Raoult, 2010; Florin et al., 2008; Brunt et al., 2006; Rolain et al., 2004; Resto-Ruiz et al., 2003). Em 5 a 9% dos casos, observam-se formas atípicas da infeção, que cursam com o desenvolvimento de febre recorrente, endocardite e alterações neurológicas, osteoarticulares, oftalmológicas e pulmonares (Edouard e Raoult, 2010). Uma das características mais marcantes do género
Bartonella é o facto de uma mesma espécie poder causar infeções crónicas ou agudas, e
induzir manifestações vasculares, quer proliferativas quer supurativas (Rolain et al., 2004). De facto, a infeção por B. henselae pode resultar numa reação supurativa focal (CSD em pacientes imunocompetentes), numa resposta angioproliferativa multifocal (angiomatose bacilar em pacientes imunodeprimidos), na multiplicação intravascular da bactéria (endocardite) ou numa resposta inflamatória exagerada, sem evidência da bactéria nos tecidos do paciente (meningoencefalite) (Rolain et al., 2004; Resto-Ruiz et al., 2003).