Mafalda Barroso Capela Dias Pinto
Licenciada em Biologia
Desenvolvimento de bionanoconjugados para a
deteção de anticorpos anti-
Pneumocystis
jirovecii
Dissertação para obtenção do Grau de Mestre em
Genética Molecular e Biomedicina
Orientador: Doutor Ricardo Franco, Professor Auxiliar, FCT/UNL
Coorientadora: Doutora Olga Matos, Professora com agregação, IHMT/UNL
Júri:
Presidente: Prof. Doutora Ilda Maria Barros dos Santos Gomes Sanches Arguente: Inv. Doutora Maria Manuela Jesus Guilherme Gaspar Vogal: Prof. Doutor José Ricardo Ramos Franco Tavares
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-
Pneumocystis jirovecii
Mafalda Barroso Capela Dias Pinto
UNIVERSIDADE NOVA DE LISBOA FACULDADE DE CIÊNCIAS E TECNOLOGIA
DEPARTAMENTO DE CIÊNCIAS DA VIDA
Mafalda Barroso Capela Dias Pinto
Licenciada em BiologiaDesenvolvimento de bionanoconjugados para a deteção de anticorpos
anti-Pneumocystis jirovecii
Dissertação apresentada para a obtenção do Grau de Mestre em Genética Molecular e Biomedicina, pela Universidade
Nova de Lisboa, Faculdade de Ciências e Tecnologia
Orientador:
Doutor Ricardo Franco, Professor Auxiliar, FCT/UNL
Coorientadora:Doutora Olga Matos, Professora com agregação, IHMT/UNL
Júri: Presidente: Prof. Doutora Ilda Maria Barros dos Santos Gomes Sanches
Arguente: Inv. Doutora Maria Manuela Jesus Guilherme Gaspar Vogal: Prof. Doutor José Ricardo Ramos Franco Tavares
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
Copyright Mafalda Barroso Capela Dias Pinto, FCT/UNL, UNL
AGRADECIMENTOS
VII
AGRADECIMENTOS
Ao Professor Doutor Ricardo Franco, agradeço pelo apoio constante e desafios colocados, sem dúvida essenciais para o cumprimento desta tese e para o meu desenvolvimento académico. Agradeço por me ter acolhido no seu laboratório e por toda a orientação.
À Professora Doutora Olga Matos, agradeço por toda a amabilidade e por me ter dado a possibilidade de realização deste projeto, assim como a sua constante preocupação e disponibilidade para o sucesso do mesmo.
À Doutora Inês Gomes, agradeço por todos os ensinamentos, apoio, palavras carinhosas e confiança depositada em mim.
Ao Investigador Fernando Cardoso, agradeço a confiança, a disponibilidade inegável e apoio científico prestados.
Ao pessoal dos laboratórios: “Santa” Maria João Oliveira, Marta “Fixe” Giza, Ana Tomás Chocalheiro, Cátia Mota e Jorge Figueiredo agradeço pela companhia, gargalhadas e suporte dado sempre que necessário. Não serão esquecidos!
À minha família do mundo académico: “Dódio” Pinheiro, “Anicas” Matias, “Sarocas” Correia, “Sónica” Correia, “Aleksa” Azevedo, “Zapiqui” Zapico, “Johnny” Martins e “Prati” Prata agradeço a força, as palhaçadas, o encorajamento, os inúmeros e tão necessários almoços e jantares ao longo desta etapa e dos anos. Parabéns a nós todos!
Aos gordos de longa data: João Vaz, João Rodrigues, Fábio Anastácio e Filipa Valente, não tenho palavras para descrever o que significam há mais de uma década. Aos nossos cafés incontáveis e apoio durante este momento da minha vida.
Aos meus pais e irmão, porque foram vocês que possibilitaram mais uma etapa da minha vida académica, pelo vosso apoio, pela mega paciência para aturar os meus maus humores tardios e por nunca me deixarem desistir dos meus sonhos. Obrigado por tudo!
Ao meu “Mon”. Pelo apoio e amor incondicional ao longo de 7 anos, por me fazeres ver sempre o lado positivo, por nunca me deixares desamparada e me teres ensinado a relaxar. Obrigado Dário!
“Anybody who has been seriously engaged in scientific work of any kind realizes that over the entrance to the gates of the temple of science are written the words: 'Ye must have faith.'”
RESUMO
IX
RESUMO
A Pneumocistose é uma doença infeciosa causada por Pneumocystis jirovecii, um fungo atípico que apresenta tropismo para os pulmões. É uma doença que afeta grande parte da população mundial, surgindo principalmente em doentes imunodeprimidos, sendo o diagnóstico precoce essencial para uma atuação eficaz contra o desenvolvimento da doença. A produção de antigénios sintéticos associados a métodos de deteção robustos, sensíveis e baratos permitem o desenvolvimento de testes de diagnóstico rápido (TDR) que possibilitam a utilização de espécimes biológicos de fácil obtenção.
A presente dissertação teve como objetivo o desenvolvimento de bionanoconjugados robustos, constituídos por nanopartículas de ouro (AuNP) conjugadas com um antigénio sintético recombinante multiepítopo (arsm) específico, que permitirão a criação de um TDR imunocromatográfico em fluxo lateral para a deteção de anticorpos circulantes anti-P. jirovecii no soro de doentes. O antigénio rsm foi obtido através de um sistema de sobreexpressão recombinante em Escherichia coli XJb(DE3) e purificado por cromatografia de afinidade com iões cobre imobilizados.
As AuNP foram sintetizadas seguindo o método de redução de sal de Au(III) com citrato de sódio em meio aquoso, levando à formação de uma solução coloidal de AuNP. Os bionanoconjugados foram caracterizados através de espectroscopia de UV-Vis e eletroforese em gel de agarose a 0,3%, permitindo provar a sua formação e determinar a quantidade de antigénio rsm necessária para revestir a superfície das AuNP. Através destes métodos de caracterização, obtiveram-se bionanoconjugados estáveis compostos por AuNP-MUA-BSA-Antigénio, para uma razão molar [BSA-Antigénio]/[AuNP-MUA] de 300 e de [BSA]/[Antigénio] de 0,75, sendo a BSA o agente estabilizante da ligação AuNP-antigénio rsm. Ainda confirmou-se a ligação dos bionanoconjugados a soro policlonal contendo anticorpos anti-antigénio rsm, observando-se para a razão molar [Soro]/[AuNP-MUA-BSA-Antigénio] de 0,3, a interação específica entre ambos e comprovando-se a possibilidade de utilização dos bionanoconjugados no desenvolvimento do TDR para a pneumonia por Pneumocystis jirovecii (PPc).
ABSTRACT
XI
ABSTRACT
Pneumocystis pneumonia (PcP) is an infectious disease caused by Pneumocystis jirovecii, an atypical fungus that exhibits tropism for the lungs. PcP is a disease that affects much of the world population, mainly affecting immunosuppressed patients, being the early diagnosis essential for effectively fight the development of this disease. The production of synthetic antigens associated with robust, sensitive and cheap detection methods allows the development of rapid diagnostic tests (RDT), which allow the use of biological specimens obtained in a less invasive manner.
The present dissertation was aimed at the development of robust bionanoconjugates composed by gold nanoparticles (AuNP) conjugated with a specific synthetic multiepitope recombinant (smr) antigen, which will allow the creation of an immunochromatographic RDT in lateral flow for the detection of circulating antibodies to P. jirovecii in patients serum. The smr antigen was obtained through overexpression of a recombinant system in Escherichia coli XJb(DE3) and purified with immobilized copper ion-affinity chromatography.
Gold nanoparticles (AuNP) were synthesized following the reduction of Au(III) salt with sodium citrate method in aqueous medium, forming a colloidal solution of AuNP. Bionanoconjugates were characterized through UV-Vis spectroscopy and agarose gel electrophoresis at 0,3%, confirming the formation of bionanoconjugates and allowing the determination of the amount of smr antigen necessary to fully coat the surface of AuNP. Through this characterization methods, it was possible to obtain stable AuNP-MUA-BSA-Antigen bionanoconjugates, for a molar ratio [BSA-Antigen]/[AuNP-MUA] of 300 and [BSA]/[Antigen] of 0,75, being BSA the stabilizing agent between AuNP-smr antigen. The binding between bionanoconjugates and polyclonal serum with antibodies to smr antigen was confirmed for the molar ratio [Serum]/[AuNP-MUA-BSA-Antigen] of 0,3, providing a specific interaction and confirming the possible utilization of these bionanoconjugates in the development of an RDT for Pneumocystis pneumonia (PcP).
ÍNDICE DE CONTEÚDOS
XIII
ÍNDICE DE CONTEÚDOS
AGRADECIMENTOS ... VII RESUMO ... IX ABSTRACT ... XI ÍNDICE DE CONTEÚDOS ... XIII ÍNDICE DE FIGURAS ...XV ÍNDICE DE TABELAS ...XVII LISTA DE ABREVIATURAS...XIX
1 | INTRODUÇÃO ... 1
1.1 | Pneumocistose ... 1
1.1.1 | Pneumocystis jirovecii ... 1
1.1.2 | Morfologia e ciclo de vida ... 2
1.1.3 | Transmissão de Pneumocystis jirovecii... 3
1.1.4 | Diagnóstico da pneumonia por Pneumocystis jirovecii ... 4
1.1.4.1 | Diagnóstico diferencial ... 4
1.1.4.2 | Diagnóstico definitivo ... 5
1.1.4.2.1 | Métodos de coloração histoquímica ... 5
1.1.4.2.2 | Imunofluorescência com anticorpos monoclonais ... 6
1.1.4.2.3 | Deteção molecular por PCR ... 6
1.1.5 | Tratamento de PPc ... 7
1.2 | Glicoproteínas Major de Superfície (Msg) ... 7
1.2.1 | Antigénio recombinante sintético multiepítopo ... 8
1.3 | Proteínas recombinantes His-Tag e purificação por IMAC ... 8
1.4 | Nanopartículas de ouro: Propriedades e aplicações... 10
1.4.1 | Funcionalização de nanopartículas de ouro ... 12
1.4.2 | EDC/NHS e BSA – Reticulação e estabilização ... 13
1.4.3 | Formação de bionanoconjugados ... 14
1.5 | Teste de diagnóstico rápido (TDR) ... 15
1.5.1 | TDR para a deteção de anticorpos anti-Pneumocystis jirovecii ... 15
1.6 | Principais métodos utilizados ... 16
1.6.1 | ELISA (Enzyme-linked immunosorbent assay) ... 17
1.6.2 | Eletroforese em gel de agarose ... 17
1.7 | Objetivos ... 18
2 | MATERIAL E MÉTODOS ... 19
2.1 | Preparação do antigénio rsm ... 19
2.1.1 | Expressão do Antigénio rsm em E. coli XJb(DE3) ... 19
2.1.2 | Purificação do antigénio rsm através de colunas IMAC ... 21
2.1.2.1 | Otimização do procedimento de purificação por IMAC ... 21
2.2 |Análise do antigénio rsm purificado... 22
2.2.1 | ELISA indireta (Enzyme-LInked Immunosorbent Assay) ... 23
2.2.2 | Eletroforese em gel de poliacrilamida a 15% (SDS-PAGE) ... 23
2.2.3 | Western-Blot ... 24
2.2.4 | Método do ácido bicinconínico (BCA) ... 24
2.3 | Nanopartículas de ouro (AuNP) ... 25
2.3.1 | Síntese química de nanopartículas de ouro ... 25
2.3.2 | Caracterização de AuNP através de espectroscopia de UV-Vis ... 25
ÍNDICE DE CONTEÚDOS
XIV
2.3.3.1 | Funcionalização: AuNP-MUA e AuNP-CALNN ... 26
2.3.4 | Conjugação com Antigénio rsm ... 26
2.3.4.1 | Bionanoconjugados: AuNP-MUA-Antigénio e AuNP-CALNN-Antigénio ... 27
2.3.4.2 | Bionanoconjugados: AuNP-MUA-EDC/NHS-Antigénio ... 27
2.3.4.3 | Bionanoconjugados: AuNP-MUA-BSA-Antigénio ... 27
2.4 | Ligação antigénio rsm – soro policlonal anti-arsm ... 28
2.5 | Eletroforese em gel de agarose a 0,3% ... 28
3 | RESULTADOS ... 29
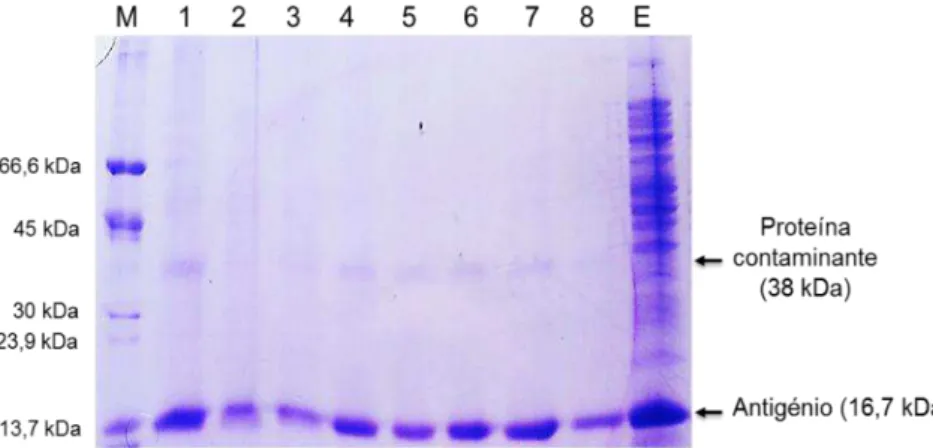
3.1 | Expressão e produção do antigénio rsm em E. coliXJb(DE3) ... 29
3.2 | Purificação do antigénio rsm através de IMAC ... 29
3.3 | Otimização da purificação do antigénio rsm através de IMAC ... 30
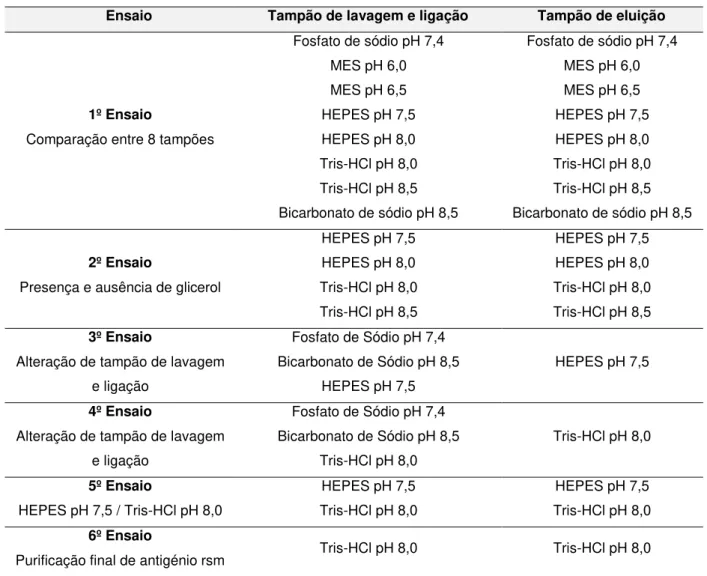
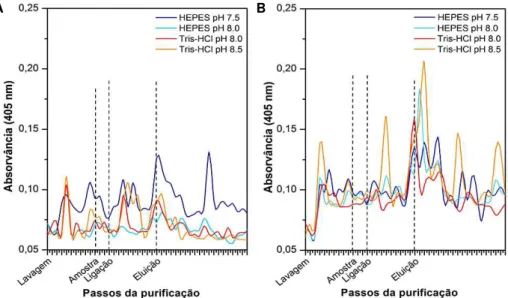
3.3.1 | 1º Ensaio: Comparação entre 8 tampões ... 31
3.3.2 | 2º Ensaio: Presença e ausência de glicerol ... 32
3.3.3 | 3º e 4º Ensaio: Alteração do tampão de lavagem e de ligação ... 33
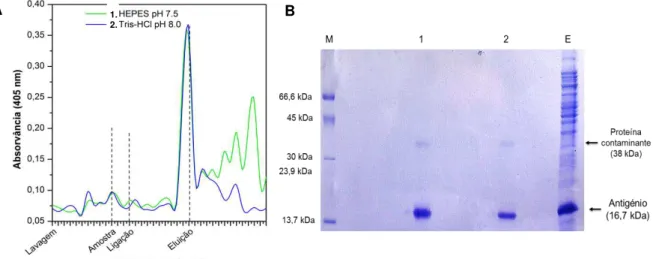
3.3.4 | 5º Ensaio: HEPES pH 7,5 / Tris-HCl pH 8,0 ... 34
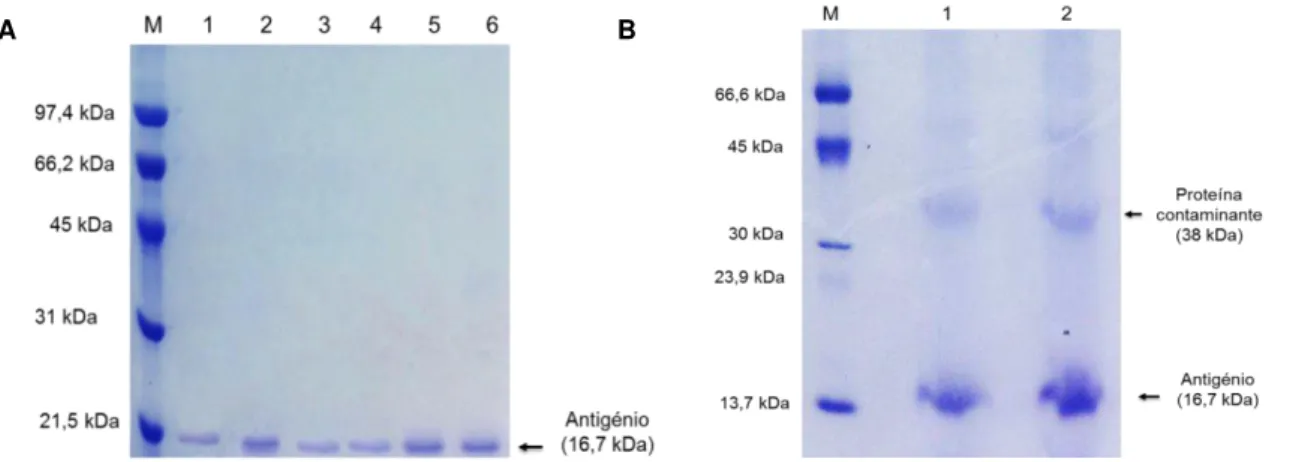
3.3.5 | 6º Ensaio: Antigénio rsm para conjugação com AuNP ... 35
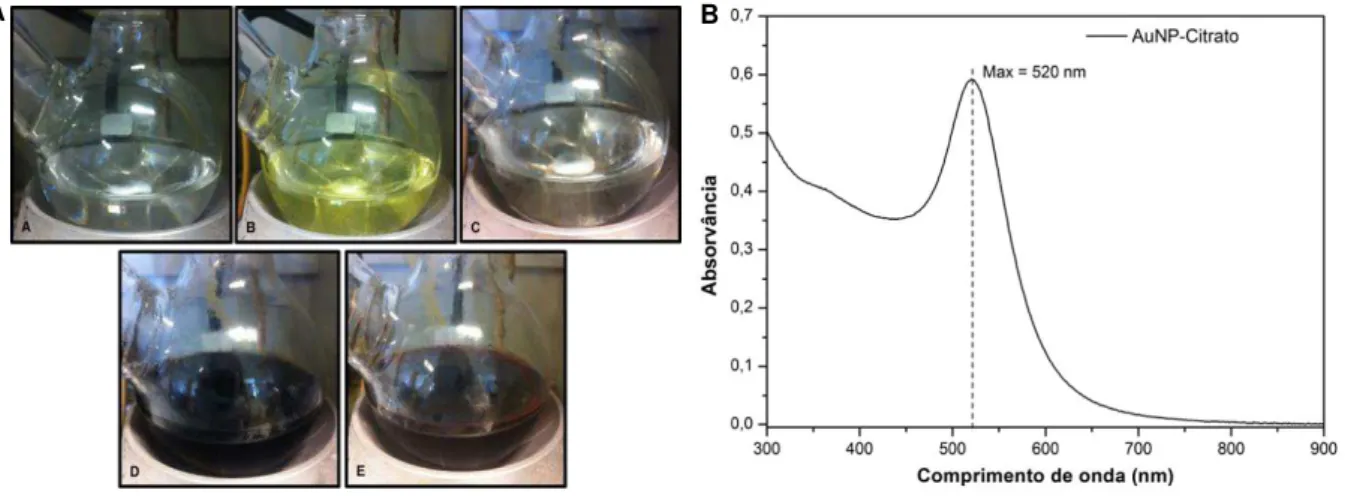
3.4 | Síntese e caracterização de Nanopartículas de ouro ... 36
3.5 | Funcionalização de Nanopartículas de ouro ... 37
3.5.1 | Funcionalização com MUA ou CALNN ... 37
3.6 | Conjugação de AuNP com antigénio rsm ... 38
3.6.1 | Bionanoconjugados: AuNP-MUA-Antigénio / AuNP-CALNN-Antigénio ... 38
3.6.2 | Bionanoconjugados: AuNP-MUA-EDC/NHS-Antigénio ... 40
3.6.3 | Bionanoconjugados: AuNP-MUA-BSA-Antigénio ... 41
3.7 | Ligação antigénio rsm-soro policlonal anti-arsm ... 43
4 | DISCUSSÃO ... 45
4.1 | Expressão e purificação do antigénio rsm em E. coli XJb(DE3) ... 45
4.2 | Bionanoconjugados compostos por antigénio rsm ... 49
4.3 | Estudo da ligação do soro policlonal ao antigénio rsm ... 54
5 | CONCLUSÕES E PERSPETIVAS FUTURAS ... 55
6 | REFERÊNCIAS BIBLIOGRÁFICAS ... 57
7 | ANEXOS ... 61
7.1 Anexo I ... 61
7.2 Anexo II ... 62
7.3 Anexo III ... 65
7.4 Anexo IV ... 66
7.5 Anexo V ... 67
7.6 Anexo VI ... 68
7.7 Anexo VII ... 69
7.8 Anexo VIII ... 69
7.9 Anexo IX ... 70
7.10 Anexo X ... 70
7.11 Anexo XI ... 72
ÍNDICE DE TABELAS
XV
ÍNDICE DE FIGURAS
ÍNDICE DE TABELAS
XVI
ÍNDICE DE TABELAS
XVII
ÍNDICE DE TABELAS
TABELA 1. 1 |Deteção de Pneumocystis jirovecii.Métodos de coloração histoquímica. Adaptado de Bennett, 2015; Thomas
e Limper, 2004 ... 6
TABELA 1. 2|Características do antigénio recombinante sintético multiepítopo. ... 8
__________________________________________________________________________________________ TABELA 2. 1 | Ensaios de purificação por IMAC. Otimização da purificação do antigénio rsm. ... 22
__________________________________________________________________________________________ TABELA I. 1 | Elementos genéticos constituintes do vetor de expressão pLATE31 e funções. ... 61
TABELA I. 2 |Composição do antigénio recombinante sintético multiepítopo. Adaptado de Tomás, 2014. ... 61
TABELA I. 3 |Tampões de ligação e lavagem estudados. ... 62
TABELA I. 4 |Tampões de eluição estudados. ... 62
TABELA I. 5 |Combinação de tampões de lavagem, ligação e eluição utilizada no 2º ensaio. ... 63
TABELA I. 6 |Combinação de tampão estudados no 3º e 4º ensaios. ... 64
TABELA I. 7 |Constituição do marcador de pesos moleculares (made in house). Mw (do inglês, Molecular weight) ... 65
TABELA I. 8 |Composição das soluções de separação e stacking que compõem o gel de SDS-PAGE a 15%. ... 66
TABELA I. 9 |Concentração de proteína em estudo, proveniente do último ensaio de purificação efetuada. ... 67
TABELA I. 10 | Concentração do antigénio rsm, após diálises, e do soro policlonalanti-arsm. ... 67
LISTA DE ABREVIATURAS
XIX
LISTA DE ABREVIATURAS
μ - Mobilidade eletroforética Abs – Absorvância
Antigénio rsm – Antigénio recombinante sintético multiepítopo AuNP – Nanopartículas de ouro
BCA – Método do ácido bicinconínico (do inglês, Bicinconinic Acid Assay) BCIP - (do inglês, 5-bromo-4-chloro-3'-indolyphosphate p-toluidine) BNC - Bionanoconjugados
BSA – Albumina sérica bovina (do inglês, Bovine Serum Albumin)
CDC – Centro de controlo e prevenção de doenças dos Estados Unidos da América (do inglês, Center for Disease Control and Prevention)
CHAPS - 3-[(3-Colamidopropil)dimetilamónia]-1-propanosulfonato DHFR – Diidrofolato reductase (do inglês, Dihydrofolate reductase) DHPS – Diidropteroato sintase (do inglês, Dihydropteroate synthase) DNA – Ácido desoxirribonucleico (do inglês, Deoxyribonucleic Acid) RNA – Ácido ribonucleico (do inglês, Ribonucleic Acid)
E. coli–Escherichia coli
EDC - Cloridrato de 1-etil-3-(3-dimetilaminopropil) carbodiimida
EDTA – Ácido etilenodiamina tetra-acético (do inglês, Ethylenediamine Tetraacetic Acid) EI – Expetoração induzida
ELISA – do inglês, Enzyme-Linked Immunosorbent Assay
FITC – Isotiocianato de fluoresceína (do inglês, Fluorescein isothiocyanate) Fw–Forward
IB – Corpos de inclusão (do inglês, Inclusion Bodies) IFI – Imunofluorescência indireta
IL-6 – Interleucina 6
IMAC – Cromatografia de afinidade com iões metálicos imobilizados (do inglês, Immobilized Metal-ion Affinity Chromatography)
IPTG – do inglês, Isopropyl β-D-1-thiogalactopyranoside LacO – Operão lac
LB – Meio Luria-Bertani LBA – Lavado broncoalveolar
LDH – Lactato desidrogenase (do inglês, Lactate dehydrogenase) LFA – Ensaio de fluxo lateral (do inglês, Lateral Flow Assay) LPS – Lipopolissacarídeos (do inglês, Lipopolysaccharide)
SPR – Ressonância plasmónica de superfície (do inglês, Surface Plasmon Ressonance) Msg – Glicoproteína major de superfície (do inglês, Major surface glycoprotein)
LISTA DE ABREVIATURAS
XX
mtSSU rRNA – Subunidade pequena do RNA ribossómico mitocondrial (do inglês, Mitochondrial Small Subunit ribossomal RNA)
NHS - N-hidroxisuccinimida
NBT - (do inglês, Nitro-blue tetrazolium chloride) o/n –Overnight
PaO2– Pressão parcial de oxigénio arterial
pb– Pares de bases
PB – Tampão Fosfato de sódio
PBS – Tampão fosfato salino (do inglês, Phosphate Buffered Saline) PBS-T – Tampão fosfato salino suplementado com detergente Tween pI– Ponto isoelétrico
P. carinii–Pneumocystis carinii
PMSF – Fluoreto de fenilmetilsulfonilo (do inglês, Phenylmethylsulfonyl fluoride) PPc – Pneumonia por Pneumocystis
rRNA – RNA ribossómico (do inglês, Ribosomal ribonucleic acid)
RT-qPCR – PCR quantitativo em tempo real (do inglês, Real-time quantitative PCR) Rv–Reverse
SDS-PAGE – Eletroforese em gel de dodecil-sulfato de sódio de poliacrilamida (do inglês, Sodium dodecyl sulfate polyacrylamide gel electrophoresis)
SIDA – Síndrome da imunodeficiência humana adquirida
T CD4+ – Linfócitos T com recetores do agrupamento de diferenciação 4 (do inglês, Cluster of differentiation 4)
TARVc – Terapia anti retrovírica de combinação TDR – Teste de diagnóstico rápido
TMP –Trimetoprim
TMP-SMX –Trimetoprim-Sulfametoxazol
TNFα – Fator de necrose tumoral alfa (do inglês, Tumor necrosis factor alfa) UV-Vis – Ultravioleta-visível
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
1
|
INTRODUÇÃO
1
1.1
| PNEUMOCISTOSE
A pneumocistose ou pneumonia por Pneumocystis (PPc) é uma doença infeciosa causada por um fungo oportunista denominado Pneumocystis jirovecii (P. jirovecii). Até 1980, a PPc era uma doença rara e unicamente observada em associação a casos de imunodeficiência intensa, como por exemplo em doentes com cancro ou transplantados. No entanto, com o desenvolvimento da epidemia da Síndrome de imunodeficiência adquirida (sida), a PPc tornou-se uma doença definidora de sida e uma preocupação fundamental, com cerca de 60% dos doentes infetados pelo vírus da imunodeficiência humana (VIH) a apresentarem esta doença, sendo mortal para cerca de 25% destes doentes. (Helweg-Larsen, 2004) Após a introdução da profilaxia anti-PPc ainda nos anos 80 do século passado, e a introdução da terapêutica antirretroviral de combinação (TARVc) em 1996, observou-se uma redução da mortalidade e da incidência de infeções oportunistas. No entanto, a PPc permanece uma doença de extrema importância, ilustrando atualmente, desigualdades no acesso a cuidados médicos entre populações e grupos sociais, e no diagnóstico da infeção por VIH. Deste modo, a PPc destaca-se como uma infeção oportunista com alta morbilidade e mortalidade. P. jirovecii é assim, um agente patogénico de distribuição ubíqua importante em doentes imunodeprimidos seropositivos e seronegativos para VIH. (Aliouat-Denis et al., 2009; Aliouat-Denis et al., 2008; Helweg-Larsen, 2004)
1.1.1 | Pneumocystis jirovecii
O género Pneumocystis foi originalmente descoberto em 1909, no Brasil, pelo Dr. Carlos Chagas. (Chagas, 1909) A descoberta de formas quísticas de Pneumocystis em cortes histológicos foi acidental, quando este médico estudava Trypanosoma cruzi– parasita causador da tripanossomose humana americana ou doença de Chagas -, considerando que seriam parte do ciclo de vida daquele microrganismo. Em 1910, o investigador Antonio Carinii, encontrou formas microscópicas, semelhantes às encontradas por Carlos Chagas, em pulmões de roedores infetados por Trypanosoma lewisi, cuja comparação com amostras de pulmões de ratos não infetados, demonstrou que estas estruturas quísticas seriam representativas de uma nova identidade à qual, o casal Delanoe denominou, em 1912, Pneumocystis carinii, devido ao seu tropismo para os pulmões
(“Pneumo”); pela sua forma quística (“cystis”) e em homenagem ao biólogo italiano Antonio Carinii
(“carinii”).(Redhead et al., 2006; Delanoe e Delanoe, 1912)
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
2
normalmente atuantes na síntese de ergosterol. Além disso, apresenta na sua parede celular β -(1,3)-D-glucano, timidilato sintetase (TS) e dihidrofolato reductase (DHFR), à semelhança de Sacharomyces cerevisiae e contrariamente ao observado em protozoários. A nível filogenético apresenta unicamente um gene nuclear codificante de 16S rRNA ao contrário de outros fungos, que possuem várias cópias deste gene. (Kottom e Limper, 2000; Stringer, 1996; Edman et al., 1988)Em 1994, e através do recurso a análises moleculares, tornou-se evidente que os microrganismos do género Pneumocystis são específicos de hospedeiro, apresentando diferenças genéticas em vários loci de acordo com o hospedeiro (nomeadamente em genes codificantes para as subunidades grande e pequena do rRNA (mtLSU e mtSSU)). (Redhead et al., 2006; Helweg-Larsen, 2004)Em 1999, Pneumocystis humano, anteriormente designado P. carinii f. sp. hominis, passou a ser designado Pneumocystis jirovecii, em homenagem a Otto Jirovec, o primeiro investigador a classificar Pneumocystis como agente patogénico para o Homem, mantendo-se até hoje a seguinte classificação taxonómica: (Hibbett et al., 2007; Redhead et al., 2006; Stringer,1996)
Super Reino: Eukaryota Ordem: Pneumocystidales
Reino: Fungi Classe: Pneumocystidomycetes
Sub-reino: Dikarya Sub-filo: Taphrinomycotina sensu
Filo: Ascomycota Género: Pneumocystis
Família: Pneumocystidaceae Espécie: Pneumocystis jirovecii
1.1.2 | Morfologia e ciclo de vida
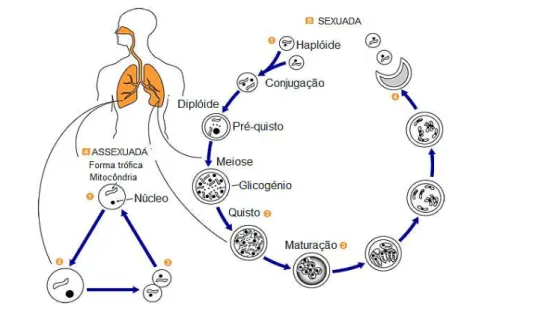
O estudo do ciclo de vida de Pneumocystis é principalmente baseado na observação de tecidos pulmonares infetados através de microscopia eletrónica de transmissão, devido à incapacidade de cultivo destes microrganismos in vitro por longos períodos de tempo e de forma reprodutível. (Aliouat-Denis et al., 2008) Pneumocystis possui tropismo único para o pulmão, penetrando na cavidade pulmonar devido à sua capacidade de aderência às células alveolares não secretoras ou pneumócitos de tipo I, através das glicoproteínas de superfície MSG (do inglês, Major Surface Glycoprotein). A aderência do fungo à parede celular permite o desenvolvimento de um exsudado rico em formas tróficas, ocorrendo um espessamento da membrana alveolar e inflamação dos alvéolos e ductos alveolares. (Helweg-Larsen, 2004; Benfield et al., 1997) No ciclo de vida de Pneumocystis, descrito na FIGURA 1. 1, podem ser identificadas, a forma quística e a forma trófica.
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
3
FIGURA 1. 1 | Ciclo de vida de P. jirovecii. A. Fase de reprodução assexuada; B. Fase de reprodução sexuada. Adaptado de CDC, 2015
O ciclo de vida é composto por duas fases distintas de replicação: uma fase de reprodução sexuada e uma de reprodução assexuada, as quais ocorrem unicamente in vivo. Na fase de reprodução sexuada (fase hipotética, ainda não demonstrada), ocorre a conjugação de duas formas tróficas haplóides originando uma célula diplóide (pré-quísto). Posteriormente, num processo de divisão meiótica seguido de replicação mitótica, forma-se uma forma quística imatura que amadurece, contendo oito corpos intraquísticos haplóides. De seguida, dá-se o desenquistamento, em que são libertados os corpos intraquísticos que se desenvolvem em novas formas tróficas no alvéolo pulmonar. Estas formas tróficas podem reproduzir-se por replicação assexuada (divisão binária). (Helweg-Larsen, 2004)
1.1.3 | Transmissão de Pneumocystis jirovecii
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
4
inflamação pulmonar e a carga parasitária presente no hospedeiro. (Aliouat-Denis et al., 2008) Em imunocompetentes, descobriu-se que P. jirovecii tem a capacidade de se manter no pulmão, durante algum tempo, sem causar qualquer sintomatologia, sendo o processo dependente do sistema imunitário do hospedeiro. (Calderón et al., 2010; Wakefield, 2002) Contudo, estes portadores assintomáticos devido ao facto de apresentarem nos seus pulmões Pneumocystis, são fontes de transmissão de microrganismos para outros indivíduos, comportando-se como “reservatórios”.
(Helweg-Larsen, 2004) Considera-se atualmente que P. jirovecii se transmite por via aérea de indivíduo para indivíduo, permanecendo em dúvida a capacidade de P. jirovecii se propagar unicamente através e no hospedeiro humano ou se é capaz de se desenvolver noutro nicho ecológico fora do hospedeiro; excluindo-se, graças a análises genéticas/filogenéticas, a hipótese de transmissão através de outra espécie hospedeira, devido à sua especificidade intra-espécie. (Aliouat-Denis et al., 2009; Helweg-Larsen, 2004; Wakefield, 1996)
1.1.4 | Diagnóstico da pneumonia por Pneumocystis jirovecii
Apesar dos avanços no estudo de P. jirovecii, o diagnóstico da PPc apresenta obstáculos devido à inespecificidade dos sintomas e dos sinais da infeção e à possível ocorrência de infeções cruzadas com outros microrganismos. Em termos de sintomatologia, os doentes com PPc desenvolvem, normalmente, dispneia, febre, tosse seca não produtora de expetoração e mal-estar, no entanto, o quadro clínico é variável de pessoa para pessoa. Também se verifica em seropositivos para VIH, um início de doença geralmente subtil com sintomas como febre, dores pulmonares ou emagrecimento inexplicável, enquanto em indivíduos imunodeficientes seronegativos para VIH, o quadro clínico tem início súbito podendo progredir para insuficiência respiratória (Calderón et al., 2010; Daly et al., 2002) As manifestações extrapulmonares são extremamente raras, sendo a sua identificação efetuada pela observação de lesões quísticas calcificadas através de tomografia axial computorizada ou ultrassonografia. (Huang et al., 2011; Helweg-Larsen, 2004; Daly et al., 2002)
1.1.4.1 | Diagnóstico diferencial
A avaliação laboratorial de rotina não específica, não fornece, geralmente, grande auxílio no diagnóstico da PPc. No entanto, com base nos sintomas e sinais existentes podem ser efetuados testes de função pulmonar, exames radiológicos, de gasometria arterial e testes laboratoriais, não específicos, como o doseamento da enzima lactato desidrogenase (LDH, do inglês Lactate Dehydrogenase). (Calderón et al., 2010) Nos seropositivos para VIH, a PPc está geralmente relacionada com contagens de linfócitos T CD4+, parâmetro importante para determinar o risco para PPc, inferiores a 200 células/mm3. Quanto aos exames radiológicos, a característica mais comum em
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
5
A gasometria arterial indica hipoxia com diminuição da pressão parcial de oxigénio arterial (PaO2)
e aumento do gradiente de oxigénio alvéolo-arterial, estabelecendo a gravidade da doença e permitindo direcionar o tratamento. A PaO2 quando inferior a 65 mmHg é indicativa da presença de
infeção. Outras estratégias de diagnóstico, como a medição dos níveis séricos de β-(1,3)-D-glucano, de KL-6 (do inglês, Krebs von den Lungen-6) ou de S-adenosilmetionina (SAM), já foram propostas para a distinção entre PPc e outras patologias. (Calderón et al., 2010; Tasaka et al., 2007) Infelizmente, os avanços no estudo da PPc encontram-se atrasados devido à: (1) inexistência de um sistema in vitro que possibilite a cultura de P. jirovecii; (2) às diferenças nos resultados obtidos em cada modelo animal, (devido às diferenças nas espécies infetantes para cada modelo); (3) à incapacidade de identificação do microrganismo fora do hospedeiro e (4) devido às amostras biológicas de obtenção difícil e invasiva. (Helweg-Larsen, 2004)
1.1.4.2 | Diagnóstico definitivo
O diagnóstico clínico não é suficientemente específico para diferenciar a PPc de outras infeções pulmonares oportunistas, com possível ocorrência de reações cruzadas com outros agentes infeciosos, requerendo assim a utilização de técnicas de diagnóstico sensíveis e específicas, que permitam um resultado final fidedigno. Uma vez que não é possível efetuar a cultura in vitro de P. jirovecii, o diagnóstico definitivo consiste na deteção dos microrganismos em espécimes respiratórios. Como o microrganismo afeta os alvéolos pulmonares, espécimes do trato respiratório superior possuem baixa carga fúngica, sendo conveniente recorrer a espécimes do trato respiratório inferior, que são obtidos por métodos mais ou menos invasivos como a biópsia transbrônquica (BTB), lavado broncoalveolar (LBA) ou expetoração induzida (EI). (Huang et al., 2011; Silva et al., 2007; Helweg-Larsen, 2004; Bigby et al., 1986)
Atualmente, o diagnóstico definitivo da PPc baseia-se na identificação de P. jirovecii através de técnicas de coloração histoquímicas em espécimes respiratórios por microscopia. Estas técnicas, contudo, são limitadas devido a apresentarem sensibilidades e especificidades variáveis. Numa tentativa de ultrapassar este problema, outros métodos de diagnóstico laboratorial da PPc têm vindo a ser desenvolvidos como a imunofluorescência direta/indireta com anticorpos monoclonais, e métodos moleculares, como a PCR (do inglês, Polymerase Chain Reaction), começando-se, recentemente, a dar ênfase à investigação de técnicas de diagnóstico da PPc para aplicação em produtos biológicos de fácil obtenção, como o sangue. (Huang et al., 2011; Tasaka et al., 2007; Helweg-Larsen, 2004)
1.1.4.2.1 | Métodos de coloração histoquímica
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
6
TABELA 1. 1 |Deteção de Pneumocystis jirovecii.Métodos de coloração histoquímica. Adaptado de Bennett, 2015; Thomas e Limper, 2004
1.1.4.2.2 | Imunofluorescência com anticorpos monoclonais
Outro método de coloração convencional utilizado no diagnóstico da PPc é a imunofluorescência (IF) direta ou indireta (IFI), que se fundamenta ou na utilização de anticorpos monoclonais específicos marcados com moléculas fluorescentes ou pela utilização de um
conjunto de anticorpos - primário e secundário conjugado com isotiocianato de fluoresceína (FITC) -, respetivamente, os quais reagem a antigénios de superfície de P. jirovecii, emitindo fluorescência de cor verde característica e permitindo a identificação do agente infecioso. (Calderón et al., 2010) A técnica de imunofluorescência é sensível, específica, rápida e fácil de utilizar, detetando tanto trofozoítos como quístos, sendo a técnica mais utilizada atualmente, e considerada de referência, no diagnóstico da PPc. Contudo, apresenta custos elevados relativamente às outras técnicas de coloração, requerendo um microscópio de fluorescência. (Matos et al., 2006; Bava et al., 2002)
1.1.4.2.3 | Deteção molecular por PCR
Para a deteção de P. jirovecii é também possível efetuar métodos baseados em biologia molecular, com maior especificidade e sensibilidade do que os métodos de coloração, e com possibilidade de recurso a espécimes biológicos de obtenção menos invasiva. A técnica de PCR, descrita pela primeira vez em 1983 por Kary Mullis, é uma técnica de análise molecular que possibilita a amplificação de genes específicos em vários tipos de amostras, como soro e sangue. Com a PCR é possível fazer não só a deteção mas, também, a genotipagem de P. jirovecii, incluindo em casos de baixa carga fúngica. (Durand-Joly et al., 2005; Matos et al., 2001; Wakefield et al., 1990) A PCR foi desenvolvida para o estudo de Pneumocystis, em 1990, por Ann Wakefield que descreveu a
FIGURA 1. 2 | Deteção de formas de Pneumocystis por imunofluorescência. 1) Quistos; 2) Trofozoítos. Adaptado de Thomas e Limper, 2004
Metenamina de prata (GMS)
Cora de cinzento-escuro a parede dos quistos, não corando trofozoítos
Wright-Giemsa ou Diff-Quick (Técnica modificada de coloração por Giemsa) Coloração de trofozoítos e corpos intraquísticos com obtenção de núcleos vermelhos e
citoplasma corado de azul
Calcoflúor
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
7
amplificação do gene mitocondrial de RNA ribossomal (mtLSU rRNA) deste microrganismo. (Wakefield et al., 1990) Para aumentar a sensibilidade desta técnica, têm sido desenvolvidos vários protocolos que permitem a escolha de diferentes alvos genéticos, como o gene mtLSU rRNA ou as sequências-alvo MSG, TS e DHFR. Também foram desenvolvidas técnicas como a PCR-nested e PCR quantitativa em tempo real (RT-qPCR) que permitem a obtenção de resultados qualitativos e quantitativos em relação à presença do microrganismo. (Huggett et al., 2008; Helweg-Larsen, 2004) No entanto, mantém-se a dificuldade na distinção de colonização por P. jirovecii e PPc. (Huggett et al., 2008)
1.1.5 | Tratamento de PPc
Ao longo dos anos tem-se observado, principalmente desde a introdução da terapêutica anti retrovírica de combinação (TARVc) em meados dos anos 90 do século passado, progressos no tratamento da PPc. Estes têm permitido o aumento da esperança média de vida dos doentes e um decréscimo na incidência de pneumocistose, em países industrializados. Em 1978, foi desenvolvido um regime terapêutico que envolve a administração da combinação trimetoprim-sulfametoxazol (TMP-SMX) durante um período de três semanas – primeira linha de tratamento. (Calderón et al., 2010)O TMP-SMX é a combinação de fármacos mais eficaz para o tratamento da PPc, pois atua sobre as enzimas DHPS e DHFR. No entanto, os efeitos adversos a esta combinação de fármacos são comuns e doentes com alergias às sulfamidas não podem efetuar esta terapêutica. Este tratamento é utilizado para uma alta gama de infeções o que aumenta a probabilidade de fenómenos de resistência e de infeções oportunistas resistentes, refletindo a necessidade de fármacos alternativos. (Calderón et al., 2010; Helweg-Larsen, 2004; Sepkowitz et al., 1992)
Devido à descoberta de mutações em genes específicos de P. jirovecii em resposta à terapêutica com sulfonamidas, nomeadamente mutações no gene de DHPS em doentes que receberam o tratamento com TMP-SMX, tem sido sugerida a existência de resistência de P. jirovecii a esta combinação. Mutações na DHPS estão associadas a resistência às sulfamidas, em diversos microrganismos, incluindo protozoários como Plasmodium falciparum e bactérias como Streptococcus pneumoniae, agravando os respetivos quadros clínicos, sugerindo a possibilidade da ocorrência de resistências, também, no caso de P. jirovecii. Pode também ser realizada uma terapêutica adjuvante com corticosteroides, benéfica em doentes seropositivos para VIH com PPc e grau moderado ou alto de hipoxia, diminuindo a resposta inflamatória pulmonar. Outras terapêuticas alternativas consideradas de segunda linha, baseiam-se na pentamidina, dapsona-trimetoprim, clindamicina-primaquina ou atovaquona. (Helweg-Larsen, 2004; Safrin et al., 1996) Para além destas terapêuticas alternativas, as equinocandinas (caspofungina, anidulafungina e micafungina) - fármacos antifúngicos
– foram identificadas como inibidores da síntese de β-(1,3)-D-glucano demonstrando uma capacidade para a redução dos quistos sem toxicidade observável. (Lobo et al., 2013; Beck e Cushion, 2009)
1.2
| GLICOPROTEÍNAS MAJOR DE SUPERFÍCIE (MSG)
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
8
As glicoproteínas major de superfície (Msg) representam a maioria dos antigénios de superfície sendo encontradas, quer nas formas tróficas, que nas formas quísticas de Pneumocystis. (Stringer, 2005) São um complexo de proteínas altamente glicosiladas, apresentando hidratos de carbono ricos em manose, e com uma massa molecular de ≈ 100kDa. Estes antigénios de superfície encontram-se envolvidos na interação hospedeiro-agente patogénico, através da ligação a moléculas do hospedeiro como a fibronectina e surfatantes, possibilitando a aderência aos pneumócitos de tipo I. (Stringer, 2005) Na sua totalidade, o genoma de Pneumocystis contém cerca de 100 genes codificantes de várias Msg, no entanto, é expressa uma única isoforma de cada vez durante os vários momentos da infeção, suspeitando-se que estas sejam ativadas através de mecanismos de regulação de transcrição. Particularmente importante tem sido o fragmento conservado que codifica para a região carboxilo-terminal de Msg, denominada fragmento MsgC. (Djawe et al., 2010) A fração MsgC e as suas variantes, MsgC1, MsgC3, MsgC8, MsgC9 são fortemente reconhecidas por anticorpos no soro de doentes seropositivos para VIH com PPc, promovendo títulos altos de anticorpos em doentes seropositivos para VIH com PPc. (Gingo et al., 2011; Daly et al., 2006)
1.2.1 | Antigénio recombinante sintético multiepítopo
Com base nos estudos anteriormente apresentados, o antigénio recombinante sintético multiepítopo (rsm), produzido no Instituto de Higiene e Medicina Tropical, resulta da seleção de três fragmentos hidrofílicos da região C-terminal da proteína Msg de P. jirovecii, ligados entre si por pontes de cinco resíduos de glicina. (Tomás et al., 2016; Tomás, 2014) As pontes de glicina permitem criar duas ligações não reativas, possibilitando a obtenção de uma estrutura tridimensional que permite a interação entre os epítopos dos antigénios e anticorpos, encontrando-se na sua extremidade C-terminal uma cadeia poli-histidina (6xHis) que permite o processo de purificação por cromatografia de afinidade com iões metálicos imobilizados. A TABELA 1. 2 apresenta as características do antigénio rsm, nomeadamente o seu índice de instabilidade e hidropaticidade, que o qualificam como estável. Este antigénio foi sobrexpresso por um sistema recombinante de E. coli, permitindo a sua obtenção nas quantidades necessárias, garantindo a sensibilidade, reprodutibilidade e especificidade dos ensaios. (Tomás, 2014)
TABELA 1. 2| Características do antigénio recombinante sintético multiepítopo.
Parâmetros físico-químicos do antigénio recombinante sintético multiepítopo
Mw (inglês, Molecular weight) 16,7 kDa
Número de aminoácidos 152
Ponto isoelétrico (pI) 8,57
Índice de instabilidade 38,39
Índice de hidropaticidade - 0,702
1.3
| PROTEÍNAS RECOMBINANTES
HIS-TAG
E PURIFICAÇÃO POR IMAC
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
9
caracterizada, permitindo obter a proteína recombinante em altas quantidades e de forma reprodutível. No entanto, existem problemas relacionados com o processo como: baixo crescimento do hospedeiro, formação de corpos de inclusão – que requerem um passo de tratamento – e inatividade da proteína em estudo. Estes são dependentes principalmente do tipo de hospedeiro e vetor de expressão escolhidos. Os sistemas hospedeiros disponíveis incluem bactérias, leveduras, fungos filamentosos e algas unicelulares. E. coli é o hospedeiro mais utilizado por apresentar uma cinética de crescimento rápida que permite uma cultura em fase estacionária em poucas horas e obtenção de culturas de células com alta densidade. No entanto, a sua utilização apresenta algumas desvantagens que incluem a possível instabilidade dos vetores - aquando fermentação em larga escala -, toxicidade de alguns produtos genéticos, e folding proteico incorreto com consequente inatividade dos produtos. (Rosano e Ceccarelli, 2014; Gellissen, 2005) O antigénio em estudo, apresenta uma affinity tag de 6xHis. As tag para além de facilitarem o processo de purificação - que ocorre através do seu bioreconhecimento -, não interferem com a estrutura da proteína, podendo ser utilizadas para a imunodeteção do produto final purificado. (Rosano and Ceccarelli, 2014; Tomás, 2014)
Na presente dissertação, foi utilizada a cromatografia de afinidade com ião metálico imobilizado (IMAC), técnica que permite que iões metálicos imobilizados possam ser utilizados para fracionar e purificar proteínas. Esta é constituída por quatro passos consecutivos: (1) aplicação de tampão de lavagem; (2) amostra contendo a proteína recombinante; (3) seguida de aplicação de tampão de ligação; e por fim, (4) tampão de eluição. (Janson, 2011) Os primeiros dois tampões são tampões de equilíbrio que apresentam uma baixa concentração de imidazole, composto essencial a todo o processo de purificação, enquanto o tampão de eluição apresenta concentrações mais altas de imidazole, que compete com a ligação específica das proteínas His-Tag aos iões metálicos forçando a sua eluição. As proteínas His-tagged apresentam uma alta afinidade para os iões metálicos que são imobilizados nas colunas de cromatografia permitindo uma purificação de forma específica. A força de ligação entre as proteínas His-tagged e os iões metálicos imobilizados é controlada por fatores como a estrutura e características da proteína alvo, a presença e propriedades da tag, propriedades do ião metálico, pH e composição do tampão de ligação, os quais por sua vez influenciam o sucesso da purificação dos produtos proteicos. (GE Healthcare, 2009) A purificação das proteínas é também afetada pela localização do produto dentro do hospedeiro, que pode variar entre secreção proteica no meio de crescimento, no espaço periplasmático ou armazenamento em corpos de inclusão (IB, do inglês, inclusion bodies) insolúveis no citoplasma. Cada processo origina quantidades variáveis de proteínas celulares que precisam de ser removidas para obter uma proteína recombinante pura. Os IB, forma em que se encontra o antigénio rsm, são agregados insolúveis de proteínas que requerem um passo de solubilização – normalmente ureia que funciona como agente desnaturante e caotrópico
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
10
1.4
| NANOPARTÍCULAS DE OURO: PROPRIEDADES E APLICAÇÕES
O avanço de áreas como a nanotecnologia e bionanotecnologia no contexto da saúde humana tem permitido ao longo dos anos o desenvolvimento de novos métodos que possibilitam a deteção de microrganismos e o diagnóstico de doenças com elevada sensibilidade e especificidade assim como o estudo e controlo da entrega de fármacos e de novas terapias. (Omidfar et al., 2013) Os nanomateriais metálicos, como as nanopartículas de ouro (AuNP), são entidades com um diâmetro entre 1 e 100nm rodeados por um agente de revestimento e que apresentam propriedades óticas e eletrónicas - dependentes da sua composição, forma e tamanho - diferentes das que apresentariam à macro escala como: alta estabilidade, solubilidade em água, tamanho, dispersão e morfologia controláveis, assim como uma superfície de funcionalização simples e elevada área superficial. Todas estas propriedades estão diretamente relacionadas com o seu método de preparação, que permite o controlo da sua composição, forma e tamanho. (Sperling e Parak, 2010) Acima de todas as propriedades apresentadas pelas AuNP, as propriedades óticas como o alto coeficiente de extinção e a ressonância plasmónica de superfície (SPR, do inglês, Surface Plasmon Ressonance) são especialmente importantes no desenvolvimento de biossensores colorimétricos. (Almeida et al., 2014)
A SPR é um fenómeno originado pela interação da radiação eletromagnética (campo oscilante) com uma superfície metálica, neste caso a solução coloidal de AuNP, ou seja, quando a frequência da onda eletromagnética é coincidente com a oscilação natural da nuvem de eletrões condutores presentes na superfície da AuNP, resulta numa ressonância plasmónica de superfície caracterizada por uma amplitude máxima de oscilação (FIGURA 1. 3). (Almeida et al., 2014; Yasun et al., 2013; Uechi e Yamada, 2008) Através da variação das características físico-químicas das AuNP - como a morfologia e função dielétrica do meio - e por meio da agregação das AuNP, é possível alterar o comprimento de onda da banda de amplitude máxima de SPR no espectro. (Huang e El-Sayed, 2010; Uechi e Yamada, 2008)
FIGURA 1. 3 | Efeito de SPR. Ressonância plasmónica de superfície. Adaptado de Yasun et al., 2013
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
11
Esta mudança de comprimento de onda das AuNP é a característica que permite a sua utilização como sondas óticas em diversas aplicações de deteção e diagnóstico, sendo dependente da variação de características físico-químicas das AuNP e da agregação. (Almeida et al., 2014; Uechi e Yamada, 2008) O estado de agregação é potenciado por fatores como: (1) ausência de uma molécula de revestimento forte para estabilizar as nanopartículas; (2) presença de soluções com altas concentrações de sal e desestabilização da camada de hidratação, que levam à aproximação das nanopartículas através de forças atrativas, como forças de dipolo induzido (Van der Waals, pontes de hidrogénio); (3) ponto isoelétrico (pI) das moléculas à superfície da nanopartícula e pH da solução – permitem alteração ou cancelamento das cargas superficiais das AuNP. (Sperling e Parak, 2010)
FIGURA 1. 4 | Banda SPR de AuNP. A distância entre AuNP afeta o pico de SPR, originando um desvio de vermelho para azul, quando a distância interpartícula diminui. Adaptado de Almeida et al., 2014
As AuNP podem ser sintetizadas pela redução química ou eletroquímica de Au(III) na presença de um agente redutor, sendo o tamanho e a forma final das AuNP controlados pelas condições experimentais da síntese, nomeadamente, tipo de agente redutor utilizado, tempo de reação, temperatura reacional e agente de revestimento. Na presente dissertação, a síntese de AuNP esféricas com cerca de 15nm de diâmetro, baseou-se no método de Turkevich, proposto em 1951, e melhorado por Kimling. (Kimling et al., 2006; Turkevich et al., 1951) Neste método, o agente redutor é o citrato de sódio, que além de funcionar como redutor do sal de Au(III), reveste as AuNP obtidas, prevenindo a sua agregação. O agente redutor também possibilita o controlo sobre o tamanho e forma geométrica das AuNP, obtendo-se no final da síntese uma solução de AuNP com o tamanho numa gama entre os 10 e 20nm, e valor médio de 15nm. (Sperling e Parak, 2010) A preparação das AuNP é feita através da redução aquosa de um sal de Au(III) [HAuCl4 (Au3+ Au0)] por uma solução
de citrato de sódio, segundo a EQUAÇÃO 1. 1
EQUAÇÃO 1. 1 | Esquema de reações da síntese de nanopartículas pelo método de Turkevich.
Oxidação de citrato C6H6O7 C5H4O5 + CO2 + 2 H+ + 2 e
-Redução do sal a citrato AuCl3 + 2 e- AuCl + 2 Cl
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
12
O citrato de sódio (agente de revestimento), representado na FIGURA 1. 5, irá ligar-se à superfície das AuNP, estabilizando os núcleos, conferindo uma camada de iões carregados negativamente à sua superfície, impedindo a sua agregação através de forças repulsivas e, consequentemente, estabilizando as AuNP em solução coloidal. (Sperling e Parak, 2010)
FIGURA 1. 5 | AuNP-Citrato. Redução aquosa de um sal de ouro por uma solução de citrato de sódio, originando nanopartículas de ouro estabilizadas. Adaptado de Szunerits et al., 2014
1.4.1 | Funcionalização de nanopartículas de ouro
De modo a aumentar a estabilidade das AuNP, estas podem ser funcionalizadas. A funcionalização refere-se à modificação de uma superfície atribuindo-lhe características físico-químicas diferentes das originais, podendo os iões de citrato ser substituídos por um ligando bifuncional. Este ligando bifuncional apresenta numa extremidade a capacidade de estabelecer ligações fortes com a superfície da AuNP e, na extremidade oposta, uma funcionalidade química capaz de interação preferencial com a (bio)molécula com a qual se pretende conjugar. Os alcanotióis, moléculas utilizadas para a conjugação de nanopartículas com proteínas, possuem, numa das extremidades, um grupo tiol (-SH) que se liga covalentemente às nanopartículas e, na extremidade oposta, um grupo carboxílico (-COOH) que confere a carga negativa uniforme à superfície das AuNP e a possibilidade de formação de interações electroestáticas com biomoléculas. Na presente dissertação, foram estudados o alcanotiól ácido 11-mercaptoundecanóico (MUA), bem como o pentapéptido CALNN (Cisteína, Alanina, Leucina, Asparagina, Asparagina). (Franco e Pereira, 2012; Sperling e Parak, 2010)
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
13
carregados apresentam grupos amida nas suas cadeias laterias hidrofílicas e um grupo carboxílico na extremidade C-terminal que confere estabilidade e solubilidade em soluções aquosas. (Lévy et al., 2004)
FIGURA 1. 6 | Representação esquemática da estrutura molecular dos componentes utilizados na funcionalização de AuNP.A. ácido 11-mercaptoundecanóico (MUA); e B. pentapéptido CALNN. Adaptado de Sperling e Parak, 2010
1.4.2 | EDC/NHS e BSA – Reticulação e estabilização
No âmbito deste trabalho, para além do estudo da funcionalização de AuNP, foram também estudados dois compostos e a sua influência nas ligações formadas entre a AuNP e o antigénio rsm, com o qual se pretende formar bionanoconjugados: EDC/NHS – par de compostos utilizados na reticulação de proteínas - e BSA (do inglês, Bovine serum albumine) – para a estabilização de ligações entre AuNP e antigénio. A formação de uma ligação covalente do tipo ligação peptídica entre o grupo funcional das AuNP e a biomolécula a conjugar é uma ligação estável entre as biomoléculas e as AuNP, isto porque, a maior parte das proteínas contém grupos amina superficiais (provenientes, por exemplo, das cadeias laterais de resíduos de lisina), possibilitando a conjugação direta com as AuNP.
O EDC [Cloridrato de 1-etil-3-(3-dimetilaminopropil) carbodiimida] é uma das carbodiimidas mais utilizadas, catalisando a formação de ligações amida entre os grupos carboxi e amina. A adição do composto NHS [N-hidroxisuccinimida] estabiliza o intermediário formado pela reação com EDC, O-acilisoureia, através da formação de grupos funcionais éster. Apesar de serem compostos com vantagens como a sua elevada solubilidade em água e facilidade de remoção dos produtos secundários, são extremamente dependentes de componentes como pH, e da razão EDC/NHS aplicada – pode ocorrer a perda de forças electroestáticas repulsivas resultando em agregação. (Conde et al., 2014; Guirgis et al., 2012; Bartczak e Kanaras, 2011) A BSA (66,6 kDa) é uma proteína monomérica solúvel em água, que efetua o transporte de vários compostos exógenos e endógenos incluindo hidratos de carbono, aminoácidos, esteroides e fármacos. É normalmente utilizada em bionanotecnologia como uma macromolécula inerte estabilizadora dos conjugados de ouro coloidal após a adsorção de anticorpos às AuNP, funcionando como um bloqueante e preenchendo as ligações vazias existentes, estando descrita a sua preferência por superfícies carregadas negativamente. Apesar, do ponto isoelétrico da BSA ser 4,6 – encontrando-se carregada
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
14
negativamente a pH 7, pH a que a maior parte das experiências nesta dissertação é realizada -, a BSA contém na sua superfície 60 grupos lisina que estão carregados positivamente e que estabelecem interações electroestáticas com componentes carregados negativamente, como as AuNP. Quanto à sua estrutura, a BSA é composta por 3 domínios e em cada um desses domínios existem 3 bolsos hidrofóbicos – os bolsos IIA e IIIA têm sido particularmente estudados pela sua capacidade de docking molecular. (Tsai et al., 2011; Thobhani et al., 2010)
1.4.3 | Formação de bionanoconjugados
As AuNP apresentam elevada biocompatibilidade e por isso, nos últimos anos têm sido alvo de elevado interesse em aplicações biológicas, nomeadamente em aplicações de biodiagnóstico. (Almeida et al., 2014) Na natureza existe uma grande variedade de moléculas orgânicas disponíveis e passíveis de utilização para conjugação de AuNP, podendo adotar diferentes composições, tamanhos e complexidades, incluindo péptidos, açúcares, enzimas, DNA ou RNA. (Sperling e Parak, 2010)
A conjugação de biomoléculas às AuNP gera complexos denominados de bionanoconjugados (BNC) que permitem a formação de interações de forma específica com vários sistemas biológicos. Os bionanoconjugados compostos por AuNP-anticorpo ou antigénio apresentam funcionalidades únicas provenientes de ambos os materiais, como o tamanho e características óticas e magnéticas das AuNP juntamente com a elevada capacidade de reconhecimento de analitos específicos. (Quesada-González e Merkoçi, 2015; Arruebo et al., 2009) Para a formação destes bionanoconjugados existem 4 tipos de estratégias adotadas relativamente à conjugação das biomoléculas às nanopartículas de ouro: Ligação à superfície da nanopartículas de ouro através de adsorção aos grupos tiol (-SH); adsorção electroestática das biomoléculas carregadas positivamente às AuNP funcionalizadas e carregadas negativamente; ligações por afinidade (não covalentes), como o sistema avidina-biotina; e por fim, ligação covalente através de conjugação química, explorando as possíveis ligações entre os grupos funcionais da nanopartícula e da biomolécula, por exemplo utilizando EDC/NHS. (Sperling e Parak, 2010) A ligação direta das biomoléculas às AuNP é também dependente da carga superficial, hidrofobicidade, tamanho e morfologia das mesmas, podendo originar alterações na conformação das biomoléculas em ligação à AuNP – observado por Tsai (2011) na ligação direta de BSA às AuNP. (Tsai, 2011) No presente trabalho, pretende-se desenvolver um bionanoconjugado inovador, composto pelo antigénio recombinante sintético multiepítopo (rsm), descrito anteriormente, ligado às AuNP - ao contrário dos bionanoconjugados observados regularmente na literatura e compostos por ligação AuNP-anticorpo. (Arruebo et al., 2009; Byrne et al., 2009)
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
15
presença/ausência de infeção através do TDR a desenvolver. A utilização de bionanoconjugados compostos por AuNP em testes de diagnóstico beneficia das propriedades únicas que estas apresentam, descritas anteriormente, e que possibilitam não só uma deteção do analito alvo, como o desenvolvimento de um diagnóstico de rápido e de fácil utilização.
1.5
| TESTE DE DIAGNÓSTICO RÁPIDO (TDR)
Os bionanoconjugados têm duas grandes aplicações médicas: terapia e deteção, sendo esta última o foco da presente dissertação. O diagnóstico precoce possibilita uma ação rápida na prescrição de tratamento adequado permitindo a redução do número de pessoas infetadas, do número de mortes e um maior controlo da taxa de transmissão da doença. (Wild et al., 2013; Wickramasinghe et al., 2007) Os métodos mais comuns para o diagnóstico da PPc (secção 1.1.4.2), possibilitam um diagnóstico com especificidade e sensibilidade variáveis, necessitando de técnicos e equipamento especializado - raramente disponível em países subdesenvolvidos, impossibilitando o diagnóstico precoce necessário para o controlo da PPc - e baseiam-se em amostras obtidas de forma extremamente invasiva e dolorosa para o doente. De modo a obviar estes problemas, surgem os testes imunocromatográficos ou testes de diagnóstico rápido (TDR), que têm como objetivo principal tornar o diagnóstico um processo rápido, sensível, específico e barato, permitindo a obtenção de um resultado de fácil interpretação uma vez que não é necessário o recurso a técnicos especializados. (Wild et al., 2013)
1.5.1 | TDR para a deteção de anticorpos anti-Pneumocystis jirovecii
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
16
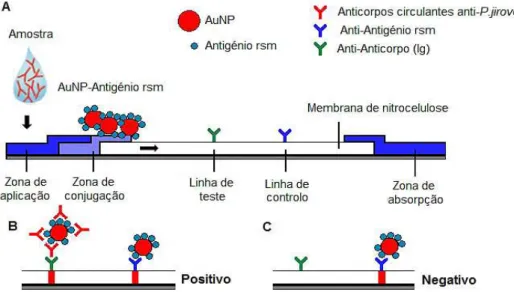
FIGURA 1. 7 | Representação esquemática do TDR para a deteção de anticorpos anti-P. jirovecii. A. TDR e respetivos componentes do teste; B. Teste positivo; C. Teste negativo.
O teste funcionará, como esquematizado na FIGURA 1. 7. Uma extremidade da tira de nitrocelulose/papel de filtro é imersa na amostra biológica líquida que contém os anticorpos circulantes específicos anti-P. jirovecii a detetar. A amostra percorre a superfície por capilaridade, arrastando os anticorpos circulantes nela contidos até à zona de conjugação. Posteriormente, vão-se ligar à zona de deteção, que contém a linha de teste - região com anti-Ig anti-P. jirovecii direcionado para os anticorpos circulantes contra os patogénios em estudo – e a linha de controlo - região com anticorpos específicos anti-antigénio rsm (anti-arsm). Ao percorrer a fita, o anticorpo circulante liga-se ao antigénio conjugado às nanopartículas de ouro (BNC) e o complexo recém-formado é deslocado no sentido do fluxo da amostra, ao longo da tira. O anticorpo anti-anticorpo Ig imobilizado, especifico para os anticorpos circulantes, reconhece o anticorpo ligado aos bionanoconjugados, ocorrendo a acumulação do complexo na região da tira de nitrocelulose. A acumulação nesta região gera um sinal colorido vermelho.
O bionanoconjugado que não se ligou a anticorpos circulantes irá continuar a difundir ao longo da tira, sendo capturado por anticorpos específicos contra o antigénio rsm. À semelhança do sinal gerado para o complexo com anticorpos circulantes, a acumulação do antigénio rsm conjugado a AuNP gera um sinal colorido vermelho, que serve de controlo no teste LFIA. Sendo assim, para a obtenção de um teste positivo, é necessária existência de duas tiras vermelhas, tanto na linha de teste, como na de controlo, e para um teste negativo, a existência de unicamente uma tira vermelha, representativa da linha de controlo.
1.6
| PRINCIPAIS MÉTODOS UTILIZADOS
1.6.1 | ELISA (Enzyme-linked immunosorbent assay)
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
17
complexa. (Engvall e Perlmann, 1971) Este método permite a deteção de determinada substância, usualmente um antigénio, numa amostra líquida, através de reações com anticorpos marcados com enzimas, baseando-se o resultado final na alteração de cor relacionada com a interação entre ambos. A fosfatase alcalina ou a peroxidase são exemplos de enzimas frequentemente utilizadas. Os ensaios de ELISA são compostos por um sistema de captura, um analito e o sistema de deteção (espectrofotómetro). Os testes ELISA são regularmente utilizados para o diagnóstico de agentes infeciosos como parasitas, bactérias, vírus, proteínas, anticorpos ou hormonas, tendo-se em conta o tipo de ligação e tamanho do antigénio, a sensibilidade e precisão desejadas para a escolha da configuração mais adequada ao estudo, existindo quatro categorias de ensaios ELISA - imunométricos (direto, indireto e sandwich) e competitivos. (Gan e Patel, 2013; Jia et al., 2009)
Na presente dissertação utilizou-se o formato de ELISA indireta, que envolve a imobilização do antigénio rsm na microplaca, o qual é posteriormente detetado por um anticorpo primário. Por último, um anticorpo secundário conjugado com fosfatase alcalina ligar-se-á ao anticorpo primário, originando na presença de substrato uma cor amarela, cuja intensidade é medida a 405nm, possibilitando a confirmação da presença do antigénio após a sua purificação através de IMAC.
1.6.2 | Eletroforese em gel de agarose
A técnica de eletroforese em gel de agarose é utilizada para separar sistemas biológicos como ADN e proteínas com alta resolução, no entanto, também permite a separação de nanomateriais, sendo utilizada em bionanotecnologia. (Xu et al., 2007) A porosidade do gel de agarose é controlada pelo aumento ou diminuição da concentração de agarose utilizada na preparação do mesmo. Assim, uma alta concentração de agarose permite a obtenção de um gel com poros de tamanho pequeno e vice-versa, originando diferenças no gradiente de separação, e onde o processo de solidificação do gel resulta da formação de pontes de hidrogénio intra e intermoleculares entre cadeias de agarose. (Wilson e Walker, 2010) A mobilidade eletroforética das nanopartículas depende do tamanho e carga das nanopartículas, que se reflete na sua velocidade de migração e na força do campo elétrico aplicado. (Zheng et al., 2015) A Equação 1. 2 permite calcular a mobilidade eletroforética (μ em cm2/V.s), onde ν representa a velocidade de migração (cm/s) e E, o campo elétrico (V/cm).
Na presente dissertação, a eletroforese em gel de agarose é utilizada para observação das diferenças na migração entre bionanoconjugados aquando alteração da concentração de antigénio presente ou da ligação de anticorpo aos bionanoconjugados AuNP-antigénio rsm. Assim sendo, a formação de bionanoconjugados AuNP-Antigénio rsm foi avaliada em eletroforese em gel de agarose. Às AuNP previamente funcionalizadas com MUA, CALNN, MUA-EDC/NHS, foram adicionadas diferentes razões molares de antigénio rsm e de antigénio rsm acoplado a BSA, sendo possível observar qual dos componentes presente em solução favorece a conjugação das AuNP ao antigénio rsm e determinar a razão molar de antigénio necessária para a obtenção de AuNP completamente revestidas com uma coroa de proteína.
Desenvolvimento de bionanoconjugados para a deteção de anticorpos anti-Pneumocystis jirovecii
18
1.7
| OBJETIVOS
As infeções fúngicas invasivas são uma causa importante de mortalidade e morbilidade, especialmente em doentes imunodeprimidos ou hospitalizados com doenças severas. A PPc é uma doença presente em hospedeiros com o sistema imunitário debilitado, como doentes seropositivos para VIH e doentes recentemente transplantados ou com cancro sob o efeito de tratamentos imunossupressores. (Lobo et al., 2013) Como referido, a falta de sistema in vitro de cultivo de P. jirovecii aliado à especificidade de espécie; a ausência de deteção de P. jirovecii fora dos seus hospedeiros; e, por fim, o facto dos espécimes biológicos necessários para a deteção e diagnóstico de P. jirovecii e PPc, respetivamente, serem de obtenção invasiva, provocando desconforto ao doente, dificultam a obtenção de um diagnóstico definitivo. (Helweg-Larsen, 2004)
Pneumocystis jirovecii é um fungo atípico com um ciclo de vida bifásico e presente nos pulmões do hospedeiro ligado ao epitélio dos alvéolos pulmonares através dos pneumócitos de tipo I. Esta aderência é inicialmente mediada pelas glicoproteínas major de superfície (MSG) com cerca de 95-140kDa, antigénios mais abundantes na superfície de Pneumocystis com um papel crucial na interação com o hospedeiro e ativação de resposta imunitária, representando uma família de genes polimórfica com altos níveis de variação antigénica, que permitem o mecanismo de evasão ao sistema imunológico do hospedeiro. (Helweg-Larsen, 2004) Estudos sobre a MSG recaem num fragmento recombinante relativamente conservado que codifica a região C-terminal, denominada fragmento MsgC e que demonstra resultados promissores para imunodiagnóstico da PPc (Djawe et al., 2010; Daly et al., 2004) A disponibilidade de um teste fiável e sensível para deteção de P. jirovecii proporcionaria um grau de especificidade superior e substituiria os métodos de amostragem invasiva utilizados.