UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS MÉDICAS
RAMILA DE BRITO MACÊDO
EFEITO DA INIBIÇÃO DA CALCINEURINA PELA CICLOSPORINA A
EM CÉLULAS PLANCTÔNICAS E BIOFILMES DO COMPLEXO
Candida parapsilosis
RAMILA DE BRITO MACÊDO
EFEITO DA INIBIÇÃO DA CALCINEURINA PELA CICLOSPORINA A
EM CÉLULAS PLANCTÔNICAS E BIOFILMES DO COMPLEXO
Candida parapsilosis
Dissertação submetida ao Curso de Pós-Graduação em Ciências Médicas, do Centro de Ciências da Saúde, da Faculdade de Medicina, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre.
Orientador: Profa. Dra. Rossana de Aguiar Cordeiro Co-Orientador: Prof. Dr. José Júlio Costa Sidrim
RAMILA DE BRITO MACÊDO
EFEITO DA INIBIÇÃO DA CALCINEURINA PELA CICLOSPORINA A
EM CÉLULAS PLANCTÔNICAS E BIOFILMES DO COMPLEXO
Candida parapsilosis
Dissertação submetida ao Curso de Pós-Graduação em Ciências Médicas, do Centro de Ciências da Saúde, da Faculdade de Medicina, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre.
Aprovada em: ___/___/______
BANCA EXAMINADORA
________________________________________ Prof.ª Dr.ª Rossana de Aguiar Cordeiro (Orientador)
Universidade Federal do Ceará (UFC) _______________________________________
Prof. Dr. Marcos Fábio Gadelha Rocha Universidade Estadual do Ceará (UECE) _________________________________________
AGRADECIMENTOS
À instituição UFC, Universidade Federal do Ceará, pelo apoio estrutural, humano e material.
Ao Programa de Pós-graduação em Ciências Médicas pelo ótimo acolhimento.
Ao CEMM, Centro Especializado em Micologia Médica, pelo aprendizado diário e ter possibilitado a execução desse trabalho.
Aos professores do CEMM: José Júlio Costa Sidrim, Raimunda Sâmia Nogueira Brilhante, Tereza de Jesus Pinheiro Gomes Bandeira pelos ensinamentos, direcionamentos e pelo engrandecimento intelectual não só meu como de todos os alunos que fazem ou fizeram parte da “Família CEMM”.
A minha orientadora Rossana de Aguiar Cordeiro, pelo conhecimento repassado, pela paciência, interesse e disponibilidade com que me acompanhou durante esses anos. Aprendi lições valiosas tanto profissionalmente quanto pessoalmente que levarei para vida.
Aos professor Marcos Fábio Rocha Gadelha pelo acompanhamento, principalmente, nos últimos meses e pela sua gentileza e educação.
Ao Dr. Renato Everardo pela disponibilidade em participar da banca da defesa.
A Ana Karoline da Costa Ribeiro e a Camila Gomes Virgínio Coelho em participar da banca de qualificação e por suas considerações pertinentes.
Ao Doutorando Carlos Eduardo Cordeiro Teixeira pela imprescindível ajuda na realização desse trabalho, além do grande carinho.
Aos funcionários da instituição, tanto do programa das Ciências Médicas quanto da Microbiologia, desde recepção, passando pelas secretarias e chegando aos técnicos do laboratório, que sempre me receberam com carinho, amizade, respeito e cumplicidade.
Aos meus pais, pois sem eles nada disto seria possível. Mesmo nas situações mais complicadas o apoio deles foi muito importante para que eu conseguisse concluir o objetivo a que me propus.
RESUMO
O Complexo Candida parapsilosis compreende três espécies, C. parapsilosis stricto sensu, C. metapsilosis e C. orthopsilosis, que possuem características fenotípicas iguais, podendo ser diferenciadas apenas pelo genótipo utilizando a técnica de PCR com enzima de restrição. O Complexo C. parapsilosis vem ganhando destaque na epidemiologia mundial da candidíase por ser a 2a ou 3a espécies mais isolada, além disso, relatos de resistência a alguns antifúngicos são preocupantes. A calcineurina molécula responsável, também, pela resistência aos antifúngicos e pensando em novos alvos moleculares para as drogas que o objetivo desse trabalho foi, avaliar o potencial sinérgico de antifúngicos e do inibidor de calcineurina, ciclosporina A, contra formas planctônicas e biofilmes de cepas do Complexo C. parapsilosis de origens clínicas. Os ensaios de sensibilidade com anfotericina B, fluconazol, voriconazol, caspofungina e ciclosporina A foram realizadas pela técnica de microdiluição, em conformidade com as orientações do Clinical Laboratory Standards Institute. Os testes de sinergismo contra células planctônicas de cepas do Complexo C. parapsilosis foram realizados pelo método de Checkerboard, em ensaio de microdiluição. Combinações formadas por antifúngicos com ciclosporina A foram avaliados contra biofilmes em formação e maduros, em placas de poliestireno, onde diferenças no padrão de sensibilidade aos antifúngicos entre as espécies não foram observadas, porém cepas de C. parapsilosis stricto sensu foram mais sensíveis à ciclosporina A que C. orthopsilosis e C. metapsilosis. O sinergismo entre os antifúngicos e ciclosporina A foi observado em cepas do Complexo C. parapsilosis. As combinações formadas por antifúngicos e ciclosporina A foram capazes de impedir o crescimento das espécies do Complexo na fase planctônica, bem como, na formação de biofilme nas CIM10X e CIM50X e mostrou efeito inibitório contra biofilmes maduros de C. parapsilosis stricto sensu, C. metapsilosis e C. orthopsilosis nas CIM50X. Os resultados obtidos reforçam o potencial de inibição da calcineurina fúngica como uma abordagem promissora para aumentar a eficiência de drogas antifúngicas.
ABSTRACT
Candida parapsilosis Complex comprises three species, C. parapsilosis sensu stricto, C. metapsilosis and C. orthopsilosis, which have the same phenotypic characteristics, can be differentiated only by the genotype using PCR with restriction enzyme. The C. parapsilosis Complex is gaining prominence in the global epidemiology of candidiasis to be the second or third most isolated species, moreover, reports of resistance to some antifungal agents are worrying. Calcineurin molecule also responsible for resistance to antifungal drugs and thinking of new molecular targets with the objective of this study was to evaluate the potential synergistic antifungal and calcineurin inhibitor, cyclosporin A, against planktonic and biofilm forms of strains C. parapsilosis Complex from clinical sources. The susceptility assays with amphotericin B, fluconazole, voriconazole, caspofungin and cyclosporin A were performed by microdilution in accordance with the guidelines of the Clinical Laboratory Standards Institute. The method board in microdilution assay performed tests for synergism against planktonic cells of strains of C. parapsilosis Complex. Antifungal combinations formed by cyclosporin A were evaluated against biofilms forming and mature in polystyrene plates, where differences in the pattern of antifungal susceptibility among species were observed, but strains of C. parapsilosis sensu stricto were more sensitive to cyclosporin A to C. orthopsilosis and C. metapsilosis. Synergism between the antifungal and cyclosporin A was observed in strains of C. parapsilosis Complex. The combinations formed by antifungal and cyclosporin A were able to prevent the growth of the species in the planktonic phase of the complex, as well as in biofilm formation in CIM10X and CIM50X and showed inhibitory effect against mature biofilms of C. parapsilosis sensu stricto, C. metapsilosis and C. orthopsilosis in CIM50X. These results support the potential of inhibiting fungal calcineurin as a promising approach for increasing the efficiency of antifungal drugs.
LISTA DE ILUSTRAÇÕES
Figura 1- (a) Formação de pseudo-hifas: anel do septo entre a célula mãe e a célula-filha, iniciando o fuso mitótico; (b) Formação de hifas verdadeiras: projeção do tubo germinativo...22 Figura 2- Aspectos macromorfológicos (a) e micromorfológico (b) do Complexo Candida parapsilosis...23
Figura 3- a) Colônias do Complexo C. parapsilosis em meio cromogênico apresentando coloração de branca a lilás; b) Prova de assimilação de carbono... ..24 Figura 4- Gel de agarose a 1%, mostrando fragmentos de bandas de aproximadamente 716 pb, concluindo que as cepas de 1-8 são pertencentes ao Complexo C. parapsilosis, C - controle negativo da reação e M - marcador molecular de 1000 pb... 45 Figura 5- Gel de agarose a 2% mostrando digestão do produto do PCR-SADH com enzima de restrição BanI. C. parapsilosis stricto sensu (poço 6), C. metapsilosis (poços 1, 2, 3, 7 e 8) e C. orthopsilosis (poços 4 e 5). C – controle negativo e M – marcador molecular... ...46
LISTA DE TABELAS
LISTA DE QUADROS
LISTA DE ABREVIATURAS E SIGLAS
ATCC American Type Culture Collection
CLSI Clinical and Laboratory Standards Institute CHEF Contour-Clamped Homogeneous Electric Fields EUA Estados Unidos da América
g Grama (s)
HIV Vírus da Imunodeficiência Humana IgG Imunoglobulina G
IL Interleucina
ITS Espaçadores Internos Transcritos MIC Concentração Inibitória Mínima pb Pares de base
PCR Reação em Cadeia da Polimerase PBS Tampão fosfato-salino
RAPD Random Amplified Polymorphic DNA PCR-REA PCR com enzima de Restrição
SADH Secondary Alcohol Dehydrogenase Sap Proteinase Aspártica
SUMÁRIO
1 INTRODUÇÃO 15
1.1O GÊNERO CANDIDA: ASPECTOS GERAIS 15
1.2ASPECTOS HISTÓRICOS 16
1.3O COMPLEXO Candida parapsilosis 17
1.4ASPECTOS EPIDEMIOLÓGICOS 19
1.5 ASPECTOS MORFOFISIOLÓGICOS 21
1.6IDENTIFICAÇÃO DO COMPLEXO Candida parapsilosis 23
1.7PATOGENIA E FATORES DE VIRULÊNCIA 24
1.7.1Fosfolipases 26
1.7.2 Proteases 27
1.7.3 Biofilme 28
1.8 SENSIBILIDADE A DROGAS ANTIFÚNGICAS 29
1.9 CALCINEURINA 31
1.9.1 Ciclosporina A 33
2 PERGUNTAS DE PARTIDAS 34
3 HIPOTÉSES CIENTÍFICAS 35
4 OBJETIVOS 35
4.1 OBJETIVO GERAL 35
4.2 OBJETIVOS ESPECÍFICOS 35
5 MATERIAL E MÉTODOS 36
5.1 RECUPERAÇÃO E IDENTIFICAÇÃO DAS CEPAS DO COMPLEXO C.
parapsilosis 36
5.2 IDENTIFICAÇÃO MOLECULAR DAS CEPAS DO COMPLEXO C.
parapsilosis 38
5.3 DROGAS ANTIFÚNGICAS E CICLOSPORINA A 39
5.4 TESTES DE SENSIBILIDADE IN VITRO 39
5.4.1 Preparo do inóculo 40
5.4.2 Microdiluição 40
5.4.3 Avaliação do sinergismo pelo método Checkerboard 40 5.5 INIBIÇÃO DE BIOFILMES DO COMPLEXO C. parapsilosis 41
5.5.1 Formação de biofilme 41
5.5.3 Efeito da CsA e drogas antifúngicas sobre biofilme formado no Complexo C.
parapsilosis 43
6 ANÁLISE ESTATÍSTICA 44
7 RESULTADOS 44
7.1 IDENTIFICAÇÃO E CONFIRMAÇÃO DAS CEPAS 44
7.2 SENSIBILIDADE IN VITRO DO COMPLEXO C. parapsilosis FRENTE À
CsA E DROGAS ANTIFÚNGICAS 46
7.3 EFEITO DA COMBINAÇÃO DA CsA E ANTIFÚNGICOS EM CEPAS DO
COMPLEXO C. parapsilosis 47
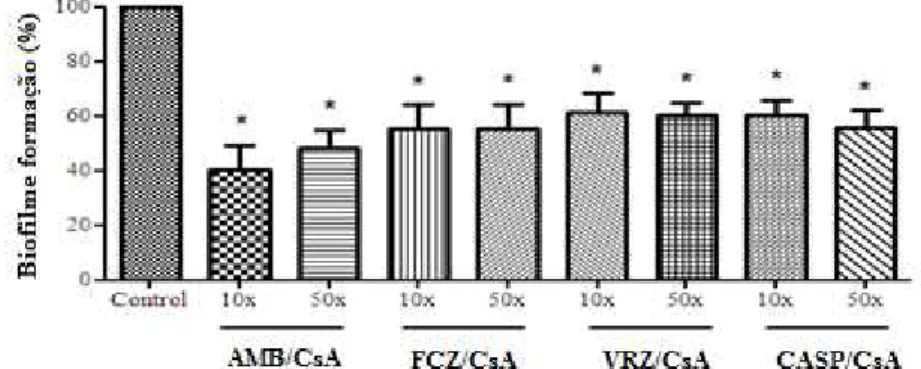
7.4 EFEITO DA CsA E DROGAS ANTIFÚNGICAS ISOLADAS E EM COMBINAÇÃO NA FORMAÇÃO DE BIOFILMES DE C. parapsilosis 52 7.5 EFEITO DA CsA E DROGAS ANTIFÚNGICAS ISOLADAS SOBRE
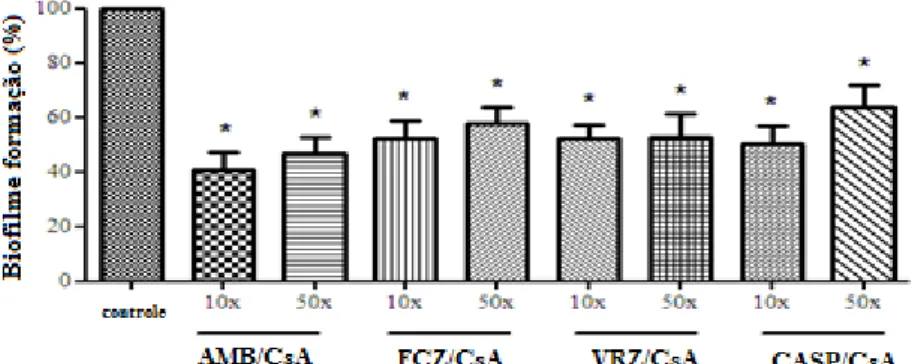
BIOFILME MADURO DE C. parapsilosis 53
8 DISCUSSÃO 55
9 CONCLUSÃO 58
10 ARTIGO CIENTÍFICO 59
1 INTRODUÇÃO
1.1 O GÊNERO CANDIDA: ASPECTOS GERAIS
São microrganismos eucariontes, heterotróficos, anamórficos (DE HOOG et al., 2000), possuem ampla distribuição e são encontrados nos mais diversos habitats; (PFALLER; DIEKEMA, 2007).
Taxonomicamente, as leveduras desse gênero pertencem ao Reino Fungi, filo Ascomycota; subfilo Saccharomycotina, classe Saccharomycetes, ordem Saccharomycetales e família Saccharomycetaceae (NCBI, 2013).
Espécies de Candida residem como comensais, fazendo parte da microbiota humana e animal (BARBEDO; SGARBI, 2010), estando presente na mucosa oral do trato gastrointestinal e geniturinário dos seres humanos (MICELI et al., 2011). Todavia, quando ocorre um desequilíbrio no sistema imunológico do hospedeiro, esses microrganismos podem passar de agentes da microbiota para agentes patogênicos, causando infecção e quadros de fungemias (BARBEDO; SGARBI, 2010; MICELI et al., 2011).
Aproximadamente 65% das espécies de Candida são incapazes de crescer a uma temperatura acima de 37 °C, o que impede estas espécies de serem agentes patogênicos bem sucedidos (SILVA et al., 2012). Atualmente, mais de 300 espécies heterogêneas já foram descritas (NCBI, 2013), porém mais de 17 delas são conhecidas por serem agentes etiológicos de infecções humanas (PFALLER; DIEKEMA, 2007; SARDI et al., 2013), dado considerável se compararmos que, em 1963, eram conhecidas apenas cinco espécies de Candida como causadoras de doenças em humanos, incluindo C. albicans, C. parapsilosis, C. tropicalis, C. stellatoidea (C. albicans var stellatoidea) e C. guilliermondii (NCBI, 2013).
modernas instalações de unidade de terapia intensiva (HORN et al., 2009; LIONAKIS; NETEA, 2013).
As infecções fúngicas invasivas, especialmente aquelas causadas por Candida spp., continuam a ser uma importante causa de mortalidade em pacientes imunocomprometidos e aqueles submetidos a procedimentos invasivos (BORMAN et al., 2009). Embora a espécie Candida albicans seja a mais comum encontrada em infecções humanas (PFALLER et al., 1999; SANDVEN, 2000; BORMAN et al., 2009), todavia nos últimos anos, vem sendo descrito um aumento no número de infecções invasivas causadas por espécies de Candida não-albicans e, dentre estas, Candida parapsilosis é freqüentemente isolado de mucosas e infecções sistêmicas em todo o mundo (NCBI, 2013).
1.2 ASPECTOS HISTÓRICOS
Os primeiros relatos escritos de lesões compatíveis com candidíase datam da época de Hipócrates (460 a 337 a.C.), que constatou e descreveu a candidose oral, ao observar a presença de placas esbranquiçadas na cavidade oral de uma criança recém-nascida. Anos mais tarde, Galeno (200 a 130 a.C.) relatou achados semelhantes àqueles descritos por Hipócrates. Todavia, o gênero só foi descrito pela primeira vez em 1839 por Langenbeck, que observou o microrganismo em lesões orais de pacientes com tifo e, erroneamente, o descreveu como agente etiológico daquela doença (ODDS, 1988).
Em 1842, David Gruby definiu a patogenia da candidíase oral e classificou o seu agente etiológico como pertencente ao gênero Sporotrichum, mas, somente em 1846, Berg estabeleceu definitivamente a relação do microrganismo com a ocorrência de candidíase oral. Posteriormente, em 1853, Charles Robin denominou esse microrganismo como Oidium albicans e, em 1861, Zenker descreveu o primeiro caso de infecção cerebral por disseminação hematogênica associado ao gênero Candida. Em 1862, Mayer descreveu seis casos de candidíase vaginal e foi capaz de reproduzir experimentalmente a infecção em coelhos (ODDS, 1988).
microrganismo como pertencente ao gênero Candida e à espécie Candida albicans (SIDRIM; ROCHA, 2004).
Posteriormente, Virchow demonstrou a capacidade de invasão nos tecidos pelo microrganismo. Em 1940, foi descrito o primeiro caso de isolamento da levedura em corrente sanguínea (HURLEY, 1964; HURLEY; WINNER, 1964; SIDRIM, 1999).
Até as décadas de 1960 e 1980, a candidiase disseminada era considerada uma doença rara, ocorrendo predominantemente em pacientes submetidos a cirurgias com queimaduras graves ou vítimas de traumas, bem como em pacientes gravemente neutropênicos, com leucemia ou linfoma. Em 1981, foi descrito o primeiro caso de infecção invasiva por Candida, todavia o marco da historia das infecções por Candida ocorreu, a partir da década de 1980, com a epidemia do vírus HIV e, consequentemente, com a introdução do uso indiscriminado de antifúngicos e antibióticos (JARVIS, 1995).
A partir da década de 90, com o advento das técnicas de identificação molecular, microrganismos puderam ser revalidados (SULLIVAN et al., 1995), como por exemplo a espécie C. parapsilosis, que foi reclassificada em três espécies distintas assim designadas: como C. parapsilosis stricto sensu, C. orthopsilosis e C. Metapsilosis, constituindo assim um Complexo (TAVANTI et al., 2005).
1.3 O COMPLEXO CANDIDA PARAPSILOSIS
A levedura C. parapsilosis foi, originalmente, descrita por Ashford como uma espécie de Monilia não fermentadora de maltose isolada de amostras de fezes de um paciente com diarréia na cidade de Porto Rico, em 1928. A espécie foi nomeada Monilia parapsilosis para distinguí-la da espécie mais comum, Monilia psilosis, conhecida, hoje, como Candida albicans (TROFA et al., 2008). Em 1932, a espécie foi reclassificada como Candida parapsilosis por Langeron e Talice (NOSEK et al., 2009).
isolados e sugeriram a existência de grupos geneticamente distintos entre eles. Resultados semelhantes também foram encontrados por Carruba e colaboradores (1991) após análise de 16 isolados clínicos e ambientais de C. parapsilosis por meio de técnicas de cariotipagem eletroforética.
Em 1992, Lehmann e colaboradores realizaram um estudo pioneiro almejando a distinção de C. albicans, C. lusitaniae, C. tropicalis, C. glabrata e C. parapsilosis por meio da técnica de RAPD (Random Amplified Polymorphic DNA). Os pesquisadores incluíram oito isolados de C. parapsilosis dos grupos previamente identificados por Piper et al. (1988) e verificaram que os oligonucleotídeos RP2 e RP4-2 eram capazes de diferenciar um painel de cepas de C. parapsilosis fisiologicamente homogêneas em três grupos geneticamente distintos. A heterogeneidade genética em isolados da mesma espécie também foi confirmada por Lott e colaboradores (1993), por meio da combinação de resultados obtidos com as técnicas de CHEF (Contour-Clamped Homogeneous Electric Fields) e RAPD.
Em 1995, Lin e colaboradores avaliaram características fenotípicas e moleculares de 45 isolados de C. parapsilosis, incluindo 31 cepas oriundas dos casos reportados em um hospital no Texas. Os autores analisaram o padrão eletroforético de diversas enzimas (malato desidrogenase, manitol desidrogenase, glicose 6-fosfato desidrogenase, sorbitol desidrogenase, α-glicosidase, β-glicosidase, superóxido-dismutase, α-esterase, α-manosidase, catalase, fosfatase alcalina e fosfatase ácida), além do sequenciamento das regiões ITS1, ITS2 e 5.8S do rDNA e testes de sensibilidade antifúngica. Os resultados mostraram que os isolados poderiam ser classificados em três grupos distintos, baseados no padrão eletroforético das enzimas α-esterase, superóxido-dismutase e glicose 6-fosfato desidrogenase, denominados Candida parapsilosis grupo I, II e III (LIN et al., 1995). A partir de então, diversos estudos, baseados em outras técnicas moleculares, comprovaram os achados de Lin e colaboradores (ROY; MEYER, 1998; KATO et al., 2001; NOSEK et al., 2002). Segundo alguns autores (CASSONE et al., 1995; LIN et al., 1995; ROY; MEYER, 1998; KATO et al., 2001), essas diferenças seriam suficientes para que os três grupos genéticos de C. parapsilosis fossem reconhecidos como espécies distintas.
alanil-TRNA sintetase, topoisomerase tipo II, orotidina 5’-fosfato descarboxilase. Os autores investigaram 32 isolados de C. parapsilosis, assim distribuídos: 21 isolados do Grupo I, nove isolados do Grupo II e dois isolados do Grupo III, definidos com base na reação de RAPD com o oligonucleotídeo RPO2 (RYCOVSKA et al., 2002) e sequenciamento da região ITS1 (LIN et al., 1995). Apesar de não ter sido possível detectar polimorfismos nem mesmo de base única com os marcadores genéticos escolhidos entre os 21 isolados do Grupo I, Tavanti e colaboradores detectaram diferenças entre os isolados de cada um dos grupos, após amplificação do gene do SADH, (Secondary Alcohol Dehydrogenase). Baseados nos resultados obtidos, bem como na extensa descrição das diferenças existentes entre os três grupos por outros autores, Tavanti e colaboradores propuseram a seguinte denominação taxonômica para esses organismos: C. parapsilosis stricto sensu, C. orthopsilosis e C. metapsilosis para os isolados originalmente reunidos nos grupo I, II e III, respectivamente (TAVANTI et al., 2005).
1.4 ASPECTOS EPIDEMIOLÓGICOS
A incidência de candidíase invasiva vem aumentando em todo o mundo, nos últimos 10 anos, (BASSETTI et al., 2011) e está associada a uma alta taxa de mortalidade (PFALLER; DIEKEMAN, 2010; CANTÓN et al., 2011).
Atualmente, uma grande proporção de infecções da corrente sanguínea é causada devido às espécies de Candida não-albicans, em destaque para o Complexo Candida parapsilosis que é o segundo agente do gênero Candida mais isolado de hemoculturas na Ásia, América Latina e alguns países europeus (ALMIRANTE et al., 2005; PFALLER; DIEKEMAN, 2007; COSTA DE OLIVEIRA et al., 2008; PEMÁN et al., 2011).
Na Europa, o Complexo C. parapsilosis é o segundo ou terceiro agente mais comum, estando responsável por 15-23% de todos os episódios de candidemia (ALMIRANTE et al., 2005; TORTORANO et al., 2006). Em pesquisa realizada na Espanha (CANTÓN et al., 2011) e Itália (BASSETI et al., 2011), Complexo C. parapsilosis superou as outras não-albicans tornando-a a segunda espécie mais isolada de hemoculturas depois de C. albicans.
O Complexo Candida parapsilosis é mais frequentemente isolado em pacientes hospitalizados (ALMIRANTE et al., 2005). Além disso, é o segundo causador mais comum de candidemia em crianças (BLITH et al., 2009; ARENDRUP et al., 2011), principalmente em prematuros internados em unidades de terapia intensiva (PASQUALOTTO, et al., 2005; FRANÇA et al., 2008; HINRICHSEN et al., 2008), tornando a espécie predominante em alguns hospitais pediátricos (NEU et al., 2009; CANTÓN et al., 2011).
No Brasil, o Complexo é relatado como espécie mais isolada de Candida não-albicans (AQUINO et al., 2005; GONÇALVES et al., 2009; MOTTA et al., 2011). Na região do Nordeste, foram descritos dois estudos em hospitais de referência de Recife (HINRICHSEN et al., 2008) e de Fortaleza (MEDRANO et al., 2006), que também confirmam essa prevalência.
Estudo multicêntrico aponta que o Complexo C. parapsilosis foi mais frequentemente isolado no Kuwait (30,6%), América do Sul (20,5-21,3%), Espanha (23%) e Austrália (19,9%); já em isolados hospitalar a maior frequência foi na Arábia Saudita (44%), seguida por Itália (35,5%) e Portugal (32%). Nas unidades de tratamento intensivo, as percentagens mais elevadas para o Complexo C. parapsilosis foi na Espanha (67%), seguido pela Eslováquia (48%) e nos EUA (33,7%) (FALAGAS et al., 2010).
Distinguir a prevalência das espécies do Complexo C. parapsilosis está sendo uma ferramenta para melhor entendimento das suas peculiaridades. Duas pesquisas envolvendo cepas de candidemia sistêmica originárias de várias partes do mundo mostraram que mais 90% dos isolados, eram de C. parapsilosis stricto sensu, ≥ 5% eram isolados de C. orthopsilosis, ≥ 1,5% de C. metapsilosis (LOCHART et al., 2008; DIEKEMA et al., 2009).
Na Oceania, especificamente na Austrália, a espécie mais isolada, com 94%, foi C. parapsilosis stricto sensu, em seguida, com 3,7%, C. orthopsilosis e, com 2,1%, C. metapsilosis. Na América Central, notadamente no México, foram isoladas 90,4% de C. parapsilosis stricto sensu, 29% de C. orthopsilosis e 4% de C. metapsilosis. Cepas de C. parapsilosis stricto sensu foram recuperadas a partir de todos os tipos de amostras biológicas, particularmente associada a hemocultura. Cepas de C. orthopsilosis e C. metapsilosis foram primeiramente isoladas a partir de sangue e de pele, respectivamente (TREVIÑO-RANGEL et al., 2012).
stricto sensu, seguido por C. orthopsilosis e C. metapsilosis (SILVA et al., 2009; GARCÍA-EFFRON et al., 2011; CANTÓN et al., 2011; MIRANDA-ZAPICO et al., 2011). No estudo realizado por de Toro et al. (2011), não foram isoladas nenhuma cepa de C. metapsilosis (DE TORO et al., 2011). Já em estudos em Portugal e outro na Hungria, as proporções de C. metapsilosis foram superiores ao de C. orthopsilosis (KOCSUSÉ et al., 2007; GÓMEZ-LÓPEZ et al., 2008), fato também confirmado por Chen e colaboradores em cepas isoladas na região de Taiwan (CHEN et al., 2010).
No Brasil, entre 2003 e 2004, uma pesquisa laboratorial prospectiva de candidemia, realizada em 11 hospitais gerais situados em nove cidades brasileiras, durante um período de 24 meses, 141 isolados, dos quais 88% foram identificados como C. parapsilosis stricto sensu, 9% de C. orthopsilosis e 3 % de C. metapsilosis. Os dados não são necessariamente representativos de toda a região. Portanto, mais estudos com maior número de isolados são necessários (GONÇALVES et al., 2009).
1.5 ASPECTOS MORFOFISIOLÓGICOS
As leveduras do gênero Candida fazem parte de um grupo heterogêneo de organismos. Macroscopicamente, as colônias, semeadas em ágar Sabouraud dextrose (SDA), dependendo da espécie, podem apresentar coloração de branca a creme, a textura pode ser lisa, brilhante, enrugada, seca, esférica ou de forma oval, bem como podem medir aproximadamente 2-5 x 3-7 mm de tamanho (LARONE et al., 2002; SILVA et al., 2012).
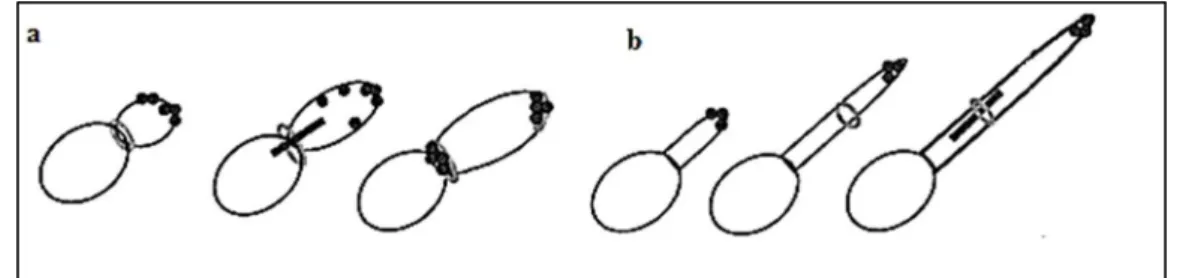
A maior diferença entre a hifa verdadeira e a pseudo-hifa está na organização de seus ciclos celulares. A hifa que se projeta no primeiro ciclo celular, antes da formação do septo, é chamada de tubo germinativo, termo que deveria ser usado para descrever o alongamento que desenvolve a hifa. O termo hifa refere-se a toda estrutura ramificada e aos filamentos que contêm mais de um septo e ausência de constrições (BARBEDO; SGARBI, 2010). Porém, no primeiro ciclo celular da pseudo-hifa, o anel do septo aparece entre a célula mãe e a célula-filha antes do surgimento do broto. O processo de mitose é iniciado e, quando se completa, as células separam-se, com a formação de um septo composto principalmente de quitina, ver figura 1. Já se tratando de ciclo celular de pseudo-hifas e blastoconídeos, não existem muitas diferenças, com exceção do alongamento e da separação da célula por completo, permitindo a formação do septo, sendo que na pseudo-hifa as formações do septo e da constrição coincidem no mesmo ponto (BARBEDO; SGARBI, 2010).
Fatores adicionais, tais como a biossíntese de esfingolípideos e calmodulina, são conhecidos por controlar a progressão do ciclo celular das hifas. As hifas são também conhecidas por possuírem várias estruturas que estão ausentes nas pseudo-hifas (SUDBERY et al., 2004; THOMPSON et al., 2011). A orientação do tubo germinativo, no estado leveduriforme nas pseudo-hifas, é determinada pelo polarissoma (complexo de proteínas envolvidas na orientação do crescimento do tubo germinativo), enquanto na formação do tubo germinativo de hifas verdadeiras a orientação é determinada tanto pelo polarissoma como pelo spitzenkörper (estrutura responsável pelo crescimento e desenvolvimento polarizado encontrada apenas em hifas verdadeiras) (CAMPRIM et al., 2005; WHITEWAY et al., 2007). É importante ter em mente que, enquanto pseudo-hifas parecem fisicamente mais com as hifas, elas realmente compartilham muito mais propriedades com os blastoconídeos (THOMPSON et al., 2011).
Figura 1. (a) Formação de pseudo-hifas: anel do septo entre a célula mãe e a célula-filha, iniciando o fuso mitótico; (b) Formação de hifas verdadeiras: projeção do tubo germinativo.
formam nas extremidades dos filamentos das hifas (THOMPSON et al., 2011). Estas estruturas são geralmente formadas em resposta a condições nutricionais pobres. (BARBEDO; SGARBI, 2010; THOMPSON et al., 2011). Ver figura 2.
1.6 IDENTIFICAÇÃO DO COMPLEXO Candida parapsilosis
Diferentes técnicas para identificação de leveduras do gênero Candida são utilizadas, atualmente, desde diagnóstico baseado em morfologia, limitações nutricionais e características bioquímicas à utilização de técnicas mais modernas, como kits comerciais, testes imunológicos e técnicas moleculares (DE HOOG et al., 2010).
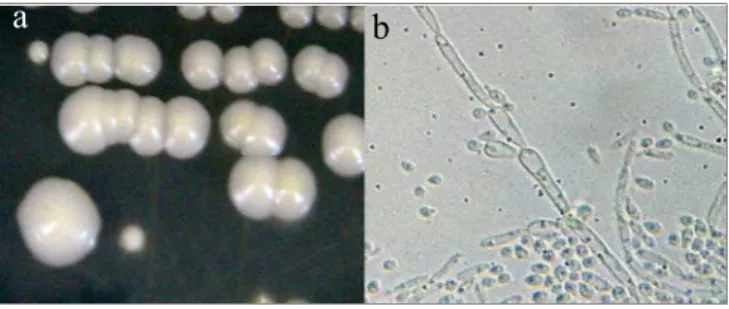
O diagnóstico micológico para o gênero Candida inicia-se, na confecção de lâminas contendo amostras do espécime clínico, clarificadas com KOH (aquoso a 20%) e visualizadas em microscópio óptico, com a finalidade de observar blastoconídios e pseudo-hifas. Posteriormente, as amostras clínicas são repicadas em meios de cultura clássicos, como ágar Sabouraud, ágar Sabouraud acrescido de cloranfenicol e ágar Sabouraud acrescido de cloranfenicol e de cicloheximida (SIDRIM; ROCHA, 2004). Após 24 horas, entre as temperaturas de 25 a 35 ºC, as colônias são avaliadas morfologicamente, as quais são, normalmente, de coloração branca a creme, glabrosa e convexa (DE HOOG et al., 2000; TORTORA et al., 2005). Em seguida, é realizada a avaliação micromorfológica, por meio do repique em ágar Cornmeal-Tween 80 (DE HOOG et al., 2000) que se baseia no princípio de que a incubação neste meio estimula a produção de conídios e filamentação, sendo possível sugerir à espécie, através do estudo da presença e da disposição dos blastoconídios e pseudo-hifas (SIDRIM; ROCHA, 2004; MILAN; ZAROR, 2004). Figura 2.
Fonte: CEMM, 2012
Figura 2. Aspectos macromorfológicos (a) e micromorfológico (b) do Complexo Candida parapsilosis.
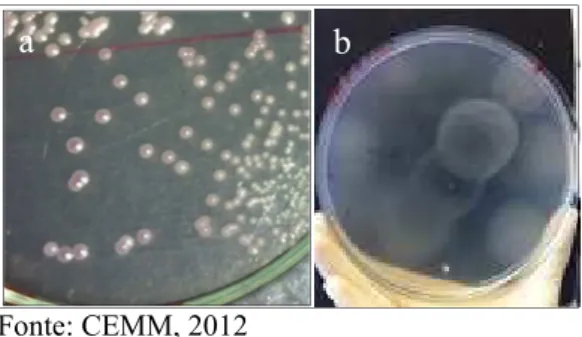
Vale destacar que a identificação pode não ser determinada através apenas de características macro e micromorfológicas, sendo necessária a realização de testes bioquímicos, como a assimilação e a fermentação de carboidratos, assim como a assimilação de nitrogênio e a prova da enzima urease. Adicionalmente, faz-se o uso de meio cromogênico específico para o gênero, o qual diferencia as espécies com base na coloração apresentada por elas quando crescidas nesse meio (MURRAY et al., 2006). Ver figura 3.
Mesmo com todos os testes citados acima, as espécies do Complexo não se diferenciam. A atual diferenciação das espécies do Complexo acontece por identificação molecular, utilizando a técnica de PCR com restrição de enzima (TAVANTI et al., 2005).
Fonte: CEMM, 2012
Figura 3. a) Colônias do Complexo C. parapsilosis em meio cromogênico apresentando coloração de branca a lilás; b) Prova de assimilação de carbono.
1.7 PATOGENIA E FATORES DE VIRULÊNCIA
A capacidade da levedura em aderir, infectar e causar doença é definida como potencial de virulência ou patogenicidade (TAMURA et al., 2007). Para estabelecer a doença, o microrganismo pode expressar uma variedade de fatores inerentes que contribuem para estabelecer a doença (LIONAKIS; NETEA, 2013).
Espécies do gênero Candida são encontradas como parte da microbiota de diferentes sítios anatômicos no hospedeiro imunocompetente (DE LUCA et al., 2012), como por exemplo: pele, trato gastrintestinal, trato geniturinário e trato respiratório superior, permanecendo sem causar danos (DESTIN et al., 2010), bem como do ambiente, em cateteres e dispositivos médicos (SILVA et al., 2005). Entretanto, se o hospedeiro entra em um estado de comprometimento imunológico, o microrganismo pode dar início a uma infecção oportunista (SMEEKENS et al., 2013).
Candida spp. são importantes patógenos de humanos, porém 10% das espécies causam infecções podendo ser do tipo aguda ou crônica, superficial ou profunda, localizada ou disseminada (SILVA et al., 2005), as quais podem causar mortalidade com taxas entre 20-60% (SMEEKENS et al., 2013).
Nas últimas décadas, observou-se um aumento significativo na incidência de infecções fúngicas oportunistas por Candida spp., aumento esse atribuído ao crescente número de pacientes portadores de neoplasias ou doenças degenerativas, indivíduos transplantados e portadores do vírus HIV (CONDE-ROSA et al., 2010).
Mudanças fisiológicas no hospedeiro são os principais fatores que levam a um quadro de infecção por Candida spp, porém, fatores inerentes ao patógeno, (LINDE et al., 2010) também chamados de fatores de virulência, podem contribuir para a instalação da doença (BLANCO et al., 2010; LIU et al., 2010), a saber: o aumento do potencial patogênico do microrganismo, o aumento da habilidade do mesmo em colonizar e invadir tecidos do hospedeiro, de escapar do sistema imune e, por fim, aumentar a morbidade e a mortalidade (CHOW et al., 2012).
Entre os fatores de virulência apresentados por Candida spp. pode-se citar a capacidade de crescer a 37 ºC, a produção de metabólitos capazes de causar manifestações alérgicas do tipo tardia e imediata, a produção de enzimas hidrolíticas, a variabilidade fenotípica (LINDE et al., 2010), a aderência às células do hospedeiro mediada por adesinas, morfogênese, hidrofobicidade da superfície celular e a formação de biofilme (DE LUCA et al., 2012; HORVÁTH et al., 2012; COSTA et al., 2013).
Candida parapsilosis é considerado agente de infecções exógenas por ser capaz de colonizar a pele, principalmente as mãos de profissionais da saúde, assim como as soluções glicosiladas de uso hospitalar e cateter venoso central. (CISTERNA et al., 2010).
Sua detecção é particularmente associada à nutrição parenteral total. A ocorrência de Candida parapsilosis é maior em crianças (HINRICHSEN et al., 2008; CISTERNA et al., 2010).
A expansão da população de pacientes imunocomprometidos, que utilizam cateteres intravenosos, nutrição parenteral total, procedimentos invasivos e, ainda, fazem uso crescente de antibióticos de amplo espectro, quimioterapias citotóxicas e transplante, são fatores que contribuem para o aumento destas infecções (ORTEGA et al., 2011; SARDI et al., 2013).
capacidade de aderir a superfícies plásticas e, consequentemente, desenvolver candidemia relacionadas com cateteres (BERNARDIS et al.; 1999). Recentemente, Tavanti e colaboradores (TAVANTI et al., 2005) descreveram duas novas espécies pertencentes ao Complexo C. parapsilosis, C. metapsilosis e C. orthopsilosis. C. metapsilosis, sendo menos virulento in vitro em comparação com C. orthopsilosis e C. parapsilosis stricto sensu (GÁCSER et al., 2007; ORSI et al., 2010). Estas duas novas espécies podem habitar nichos importantes em certas populações de pacientes, enfatizando, assim, a necessidade de vigilância contínua em cada país para monitorizar a prevalência e distribuição dos membros do Complexo. Definir os determinantes de virulência ajudará a entender as características patogênicas das novas espécies (SILVA et al., 2009; TOSUN, et al., 2013).
Fatores de virulência associados ao Complexo C. parapsilosis incluem a capacidade de aderir a uma grande variedade de superfícies biológicas e protéticas, formação de biofilme em dispositivos médicos e secreção de enzimas hidrolíticas (TAVANTI et al., 2010; CHOW et al, 2012; SILVA et al., 2012).
O primeiro estudo disponível, que compara a interação do Complexo C. parapsilosis com a superfície do hospedeiro, foi efetuado por Gácser et al. (2007). As três espécies foram comparadas quanto à sua capacidade de invadir e alterar a estrutura de um tecido epitelial reconstituído, demonstrando que C. metapsilosis era menos virulenta, em comparação com as outras duas espécies do grupo (GÁCSER et al., 2007; BERTINI et al., 2013).
O potencial de virulência de cada uma das espécies do Complexo foi avaliado em um modelo murino para candidíase vaginal. Este estudo compara a capacidade in vivo das espécies
C. parapsilosis stricto sensu, C. orthopsilosis, C.metapsilosis em colonizar e causar uma infecção. Os resultados obtidos indicaram que C. orthopsilosis e C. metapsilosis são capazes de induzir a vaginite de uma maneira semelhante a C. parapsilosis stricto sensu e confirmam o potencial menos virulento da C. metapsilosis (GÁCSER et al., 2007; ORSI et al, 2010).
1.7.1 Fosfolipases
A atividade das fosfolipases está provavelmente envolvida no processo de ruptura da membrana celular e invasão das células do hospedeiro, contribuindo para a penetração destes microrganismos no tecido do hospedeiro (GHANNOUM, 2000; PARK et al., 2013). Espécies de Candida não-albicans são capazes de produzir fosfolipases extracelulares, mas essa produção é relativamente inferior quando comparada a C. albicans (SILVA et al., 2012).
No estudo realizado por Dagdeviren et al. (2005), a atividade de fosfolipase foi detectada em 15,15% de todas as 33 estirpes analisadas. Ghannoum et al. (2000) detectaram atividade fosfolipase em C. não-albicans, incluindo 51,0% das cepas de C. parapsilosiss. Shmizu et al. (1996) e Kartarcioglu (2002) afirmaram que não foi encontrada atividade da enzima fosfolipase em cepas de C. parapsilosis. Apesar de a utilização de gema de ovo como fonte de fosfolipídios nos estudos acima, as divergências entre os resultados podem ter origem a partir das diferenças entre as formulações dos meios de comunicação e / ou as propriedades biológicas das estirpes.
1.7.2 Proteases
As proteases são todas as enzimas que catalisam a clivagem das ligações peptídicas (CO-NH) das proteínas. Muitas espécies fúngicas secretam proteases quando crescidas em meio contendo proteína como fonte de nitrogênio (MONOD et al., 2002). As proteases estão divididas em dois grandes grupos, dependendo do seu sítio de ação, sendo elas: exopeptidases e endopeptidases. Exopeptidases clivam a ligação peptídica no grupo amina (NH2) ou carboxila (COOH) terminal da proteína, enquanto endopeptidases clivam ligações peptídicas dentro de uma cadeia polipeptídica (DOS SANTOS et al., 2011).
Baseado na natureza do grupo funcional do sítio ativo e do tipo de mecanismo enzimático, as proteases são divididas em oito tipos: asparagina, aspática, cisteína, glutâmica, metalo, serina, treonina e desconhecido, porém, podem também serem classificadas em ácidas, alcalinas (básicas) e neutras, de acordo com o pH no qual são ativadas (YIKE et al., 2011).
incluindo proteínas relacionadas às defesas imunológicas e estruturais, tais como IgG de cadeias longas, α2-macroglobulina, proteína C3, β-lactoglobulina, lactoperoxidase, colágeno e fibronectina (PICHAVÁ et al., 2001).
1.7.3 Biofilme
Biofilmes são comunidades microbianas que crescem aderidas a alguma superfície sólida, envolvidos por uma matriz exopolimérica secretada pelos microrganismos em associação. Alguns fatores contribuem para a formação de biofilme, dentre os quais, a quantidade de nutrientes e de moléculas de quorum-sensing (FANNING; MITCHELL et al., 2012).
Os biofilmes são compostos por aproximadamente 97% de água, variando conforme as características do ambiente onde se encontram. A matriz é composta por um complexo de polímeros, nutrientes, produtos de lise celular e partículas de materiais do meio (SUTHERLAND et al., 1997). Muitas leveduras de importância médica apresentam a capacidade de formação de biofilme, como as do gênero Candida, Cryptococcus e Trichosporon.
A formação de biofilme oferece ao microrganismo proteção contra adversidades do ambiente, resistência a estresses físicos e químicos, cooperação metabólica e regulação da expressão gênica baseada na comunidade (RAMAGE et al., 2012). O material extracelular, que compõe a matriz do biofilme, tem papel fundamental na defesa contra células fagocitárias e no suporte da manutenção da integridade do biofilme, bem como na limitação da difusão das substâncias tóxicas (NEGRI et al., 2012).
O estudo de modelos de biofilme tem sido essencial na investigação deste modo de crescimento para a caracterização de propriedades fenotípicas associadas a padrões de expressão de genes (NETT et al., 2012).
Os estudos in vitro em placas tornaram-se uma ferramenta fundamental para a investigação da formação de biofilme de Candida spp., fornecendo informações importantes sobre a sua composição e propriedade. (RAMAGE et al., 2006; RUSICKA et al., 2010).
realidade, a formação de biofilme está diretamente ligada à expressão gênica, pois comprovam relativa mudança na expressão gênica tanto em biofilme formado, quanto na fase planctônica (GARCÍA-SÁNCHEZ et al., 2004; GIBBONS et al., 2011).
Já foram relatadas formações de biofilme em cateteres venosos centrais, cateteres urinários, dispositivos de diálise, aparelhos cardiovasculares, próteses de voz, implantes penianos, próteses orais e implantes oculares (RAMAGE et al., 2006; ESTIVILL et al., 2012). Essas infecções associadas a implantes são inerentemente difíceis de tratar e podem requerer terapia antifúngica a longo prazo e a remoção física do implante para controle da infecção (RAMAGE et al., 2012).
Os biofilmes são formados facilmente por células do Complexo C. parapsilosis, em meio contendo concentração elevada de glicose e de lipídios, e podem estar associados com o aumento da prevalência deste organismo em infecções na corrente sanguínea de pacientes que recebem nutrição parentérica (NOSEK et al., 2009). A preferência seletiva da espécie para dispositivos médicos plásticos é de particular interesse, como a formação de biofilme aumentando a capacidade do organismo para colonizar cateteres intravasculares (WEEMS, 1992; TROFA et al., 2008). A formação de biofilmes por C. parapsilosis, têm sido associado com maior morbidade e mortalidade em comparação com isolados incapazes de formar biofilmes (KUMAMOTO et al., 2002; SILVA et al., 2012). Em contraste com C. albicans, C. parapsilosis produz biofilmes mais finos e menos estruturados (KUHN et al., 2002). Estas características do biofilme estão de acordo com os reportados recentemente por Silva et al. (2009). Lattif et al. (2009) demonstraram que, tal como C. parapsilosis stricto sensu, as espécies C. orthopsilosis e C. metapsilosis eram também capazes de formar biofilmes.
1.8 SENSIBILIDADE A DROGAS ANTIFÚNGICAS
Atualmente, as drogas antifúngicas disponíveis para o tratamento podem ser divididas em quatro diferentes classes, de acordo com o seu mecanismo de ação: inibição da síntese do ergosterol (derivados azólicos); alteração na permeabilidade da membrana celular (poliênicos); inibição da síntese de ácidos nucléicos (fluocitosina e griseofulvina) e inibição da síntese de glucanos da parede celular (equinocandinas) (CHAPMAN; SULLIVAN; CLEARY, 2008). Quando comparadas aos antibióticos, o desenvolvimento de agentes antifúngicos é relativamente limitado (SILVA et al., 2012), sendo restrito o número de drogas disponíveis para o tratamento de infecções fúngicas invasivas (VANDEPUTTE et al., 2012).
A resistência aos antifúngicos pode ser dividida em resistência clínica e resistência in vitro. A resistência clínica é relacionada à falha na resposta ao tratamento, que, por sua vez, pode estar associada a uma baixa concentração do fármaco no sangue e tecidos do paciente, além de um sistema imunológico deficiente, bem como a presença de focos permanentes de infecção, como cateteres e abscessos (REX et al., 1995; SANGLARD; ODDS, 2002; RAMAGE; LOPEZ-RIBOT, 2005).
A resistência in vivo pode ser divida em primária e secundária. Na primária, também chamada de intrínseca ou inata, o microrganismo apresenta naturalmente resistência a antifúngicos (ATIQUE et al., 2006). Na resistência secundária ou adquirida, há seleção das cepas resistentes por meio do uso indiscriminado de drogas antifúngicas, tanto na terapia humana, quanto na agricultura (PFALLER; DIEKEMA, 2007; ROMEO; CRISEO, 2009; COLOMBO et al., 2009).
Entre os mecanismos que contribuem para o fenômeno de resistência aos derivados azólicos, destacam-se a superexpressão ou mutação do gene ERG11, responsável por codificar a enzima lanosterol 14-α-demetilase, molécula alvo dos azólicos; superexpressão dos genes que codificam bombas de efluxo, CDR1 e MDR1; e alterações no gene ERG3, indispensável para a biossíntese do ergosterol. Outros mecanismos não elucidados totalmente podem ocorrer simultaneamente (USER et al., 2007; FERRARI et al., 2009).
Inicialmente, os estudos de sensibilidade foram voltados apenas a estudos de antibacterianos e, por outro lado, nenhuma atenção era voltada para a resistência a antifúngicos. Nos últimos anos, infecções causadas por fungos e, em particular, por leveduras do gênero Candida, têm aumentado significantemente principalmente em pacientes infectados com o vírus da imunodeficiência humana, pacientes com câncer (JOHNSON, 2008).
Há uma crescente preocupação relacionada com a resistência ou tolerância antifúngica do Complexo C. parapsilosis. O Complexo C. parapsilosis foi considerado como baixa resistência ao fluconazol (HAJJEH et al., 2004; NGUYEN et al., 1996; PFALLER et al., 2007), no entanto, a resistência clínica a azóis tem sido cada vez mais relatada (BRITO et al., 2006; MOUDGAL et al., 2005; SARVIKIVI et al., 2005). De acordo com o estudo realizado por Chen e colaboradores (2010), todos isolados de C. parapsilosis stricto sensu e C. orthopsilosis foram considerados sensíveis ao fluconazol e as cepas de C. metapsilosis foram consideradas resistentes. Isto está em contraste com relatórios anteriores que descrevem uma ou nenhuma resistência de sensibilidade diminuída ao fluconazol em cepas de C. metapsilosis (LOCKHART et al., 2008; SILVA et al., 2009; CHEN et al., 2010). Cepas de C. parapsilosis stricto sensu e C. orthopsilosis que foram isoladas mostraram CIMs elevados de caspofungina em comparação com isolados de C. metapsilosis. Os isolados de C. parapsilosis stricto sensu apresentaram valores de CIM significativamente mais elevados de micafungina que as de C. orthopsilosis e C. metapsilosis (FORREST et al., 2008; CHEN et al., 2010).
Em um estudo realizado por Ruiz et al. (2013), observou-se que os valores MIC50 e CIM90 para C. parapsilosis stricto sensu foram maiores que as outras duas espécies do Complexo, encontrando resistência a anfotericina B e a itraconazol, situação também observada no estudo realizado por Cantón et al. (2011), em que C. parapsilosis stricto sensu foi a única espécie que mostrou resistência envolvendo os mesmos antifúngicos. Candida metapsilosis também demonstrou CIM50 e CIM90 com valores mais elevados para o itraconazol. Apesar do fato de que Gonçaves et al. (2010) não tinham chegado a qualquer cepa de C. metapsilosis dose dependente, C. orthopsilosis e C. metapsilosis foram mais sensíveis às drogas testadas em contraste com um estudo realizado por Diekema et al. (2009).
A calcineurina é uma proteína altamente conservada em organismos eucariontes, é importante para mediar as respostas de estresse em plantas e fungos, constitui em uma fosfatase ativada por Ca²+ / calmodulina (ARAMBURU et al., 2004; CHEN et al., 2011) e é responsável pela transmissão de informações da membrana celular para o núcleo (STEINBACH et al., 2007; STIE et al., 2008). Ela é composta por duas subunidades distintas: “A”, que é a catalíca, e “B”, que é a reguladora. Em resposta ao influxo de cálcio, a calmodulina liga-se à calcineurina subunidade A e bloqueia a ação do domínio C-terminal da calcineurina ação autoinibitória, resultando na formação do complexo ativo de calcineurina. A calcineurina é importante para as respostas ao estresse térmico, incluindo baixas e altas temperaturas, também funciona em resposta ao estresse por cátions em C. neoformans e Saccharomyces cerevisiae. Além disso, também é importante para a resposta e crescimento em meio de pH alcalino, nos dois casos. A calcineurina funciona em C. albicans para detectar sinais de invasão do tecido do hospedeiro e de infecção disseminada (BLANKENSHIP et al., 2003; CHEN et al., 2010).
A calcineurina está ligada a vários agentes infecciosos, incluindo fungos patogênicos oportunistas humanos, tais como cepas de Cryptococcus neoformans e Candida albicans. A molécula é utilizada de forma diferente entre os principais fungos patogênicos, como demonstrou o estudo realizado por Steinbach e colaboradores, em 2006, em que Cryptococcus neoformans mutantes, que possuíam a calcineurina, foram severamente prejudicados em seu crescimento a 37 °C apresentando defeitos, tornando-os avirulenttornando-os. Com Candida albicans, a calcineurina não foi necessária para a sobrevivência in vitro a temperatura de 37 °C, mas sim para a sobrevivência no soro e virulência (STEINBACH et al., 2007).
Tanto as subunidades A e B são necessárias para a atividade da calcineurina. Todos os organismos eucarióticos possuem ao menos um gene codificando cada subunidade (ZANG et al., 2012). A calcineurina é o alvo dos fármacos imunossupressores como a ciclosporina A (CsA) e FK 506, que suprimem o sistema imunitário por inibição da calcineurina (LIU et al., 1991). O mecanismo de ação da CsA tem sido extensivamente estudado no ascomiceto S. cerevisiae, bem como em células T (HEITMAN et al., 1992; CARDENAS et al., 1999).
Homólogos da calcineurina têm sido identificados e caracterizados em vários fungos. A calcineurina é essencial e regula a progressão do ciclo celular em Aspergillus nidulans (RASMUSSEN et al., 1994) e elongação de hifas e crescimento vegetativo em Neurospora crassa (PROKISCH et al., 1997). Na levedura Schizosaccharomyces pombe, mutantes da calcineurina são estéreis, têm defeitos na citocinese, polaridade da célula e posicionamento do corpo do fuso (YOSHIDA et al., 1994). Em S. cerevisiae, a calcineurina regula a homeostase iônica e a síntese da parede celular, ativando fatores de transcrição Tcn1/Crz1, que regulam os genes que codificam as bombas iônicas e as enzimas biossintéticas da parede celular (incluindo Fks2, Pmr2, PMC1 e PMR1) (HUYNH et al., 2012).
1.9.1 Ciclosporina A: inibidor da calcineurina
A CsA liga-se à proteína intracelular ciclofilina-1, formando um complexo que inibe a calcineurina. Portanto, a CsA é classificada como um inibidor de calcineurina. Estes complexos de CsA-ciclofilina, os quais se ligam à calcineurina, inibem a transdução de sinais para o núcleo resultando na interrupção ou diminuição da síntese de muitas citocinas, principalmente a Interleucina-2 (IL-2). As diminuições da transcrição de IL-2 e da resposta dos linfócitos-T a isso resultam na inibição da proliferação de linfócitos-T helper e linfócitos-T citotóxicos. A CsA não causa alteração com relação à imunidade humoral, portanto, as vacinas que estimulam a resposta protetora humoral não são afetadas negativamente por este fármaco (LIU et al., 2007).
diversas dermatoses inflamatórias, como dermatite atópica e psoríase (CARDENAS et al., 1999).
Devido às suas propriedades lipofílicas, a CsA é amplamente distribuída na maioria dos tecidos com exceção da barreira hematoencefálica. Este fármaco é metabolizado principalmente pelo sistema de enzimas citocromo P450, especificamente pelo CYP3A4, no fígado e no intestino. Fármacos que inibam o CYP3A4 ou haja competição com a glicoproteína-P podem alterar o metabolismo da CsA substancialmente (CRUZ et al., 2002).
As drogas imunossupressoras ciclosporina A, FK-506 (tacrolimus) e rapamicina (sirolimus) são usadas para tratar e prevenir a rejeição de órgãos transplantados, porém exercem efeitos antifúngicos potentes contra uma variedade de fungos patogênicos (BADER et al., 2003; UPPULURI et al., 2008). Os estudos revelam sinergismo entre os azólicos e inibidores da calcineurina CsA e FK-506 e os estudos in vivo demonstraram que a combinação sinérgica CsA/fluconazol tem efeito terapêutico benéfico. Em resumo, estes agentes farmacêuticos altamente bem-sucedidos podem encontrar uma aplicação clínica ainda maior no combate a doenças infecciosas (BLANKENSHIP et al., 2003; BADER et al., 2003; ONYEWU et al., 2006).
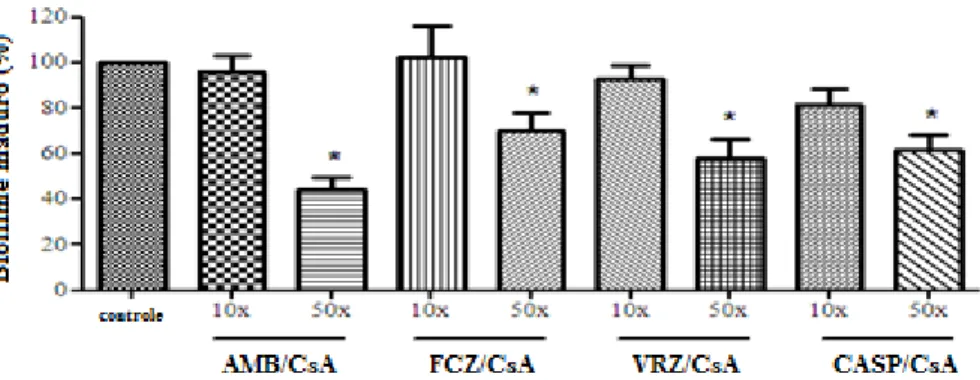
Em estudo realizado por Shinde e colaboradores (2012), foram demonstrados pela primeira vez os resultados sobre atividade sinérgica da CsA com drogas antifúngicas (VRZ, FCZ, AMB e CASP) contra o crescimento planctônico e a formação de biofilme, bem como em biofilmes maduros de C. albicans. Os resultados obtidos neste estudo sugerem que a inibição da CsA é mediada por mecanismos específicos do biofilme e potencializa a ação de antifúngicos contra biofilmes resistentes aos medicamentos. O aumento da sensibilidade de células planctônicas e a reversão da resistência a drogas na forma de biofilme em formação após a adição do CsA indicam que a calcineurina pode estar fazendo um papel importante na resistência à FCZ, VRZ e CASP. No entanto, o mecanismo exato por trás do sinergismo da CsA com drogas antifúngicas ainda não está claro (MACHETTI et al., 2003; UPPULURI et al., 2008).
2 PERGUNTAS DE PARTIDA
2. Qual o efeito da CsA no desenvolvimento de biofilmes das cepas do Complexo Candida parapsilosis?
3 HIPÓTESES CIENTÍFICAS
1. Uma vez que a CsA inibe de forma seletiva a calcineurina – molécula essencial a homeostase celular – é possível que a droga torne os organismos do Complexo C. parapsilosis mais sensíveis à ação de antifúngicos em formas plantônicas e em biofilme.
2. A CsA é capaz de reduzir o biofilme em formação e o biofilme maduro por cepas do Complexo C. parapsilosis.
4 OBJETIVOS
4.1 OBJETIVO GERAL
Investigar os efeitos da CsA isoladamente e em associação com antifúngicos sobre leveduras do Complexo Candida parapsilosis em formas planctônica e em biofilme.
4.2 OBJETIVOS ESPECÍFICOS
1. Realizar a identificação fenotípica dos isolados do Complexo C. parapsilosis utilizados no trabalho;
2. Realizar e confirmar a identificação molecular dos isolados do Complexo C. parapsilosis por meio da enzima de restrição BanI.
4. Avaliar o efeito sinérgico, in vitro, da CsA em combinação com drogas antifúngicas frente a cepas do Complexo de C. parapsilosis em forma planctônica e biofilme;
5. Avaliar o efeito da CsA em combinação com drogas antifúngicas sobre o biofilme em formação e o biofilme formado das cepas do Complexo de C. parapsilosis.
5 MATERIAL E MÉTODOS
5.1 RECUPERAÇÃO E IDENTIFICAÇÃO DAS CEPAS DO COMPLEXO C. parapsilosis
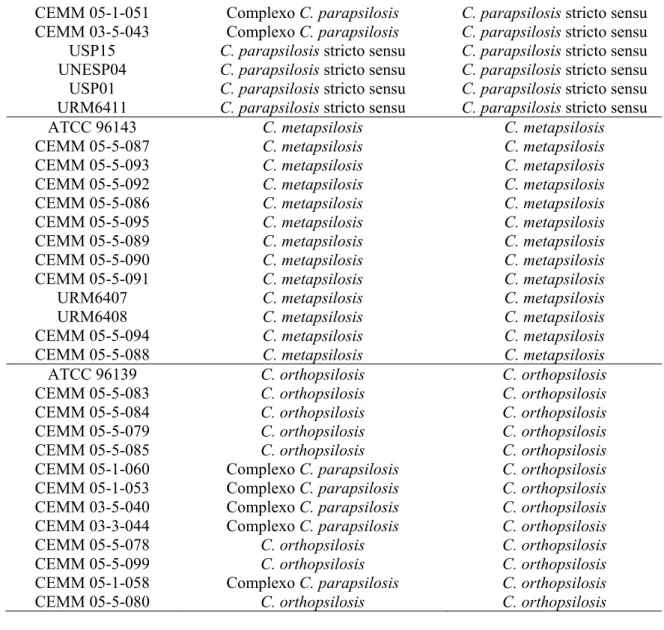
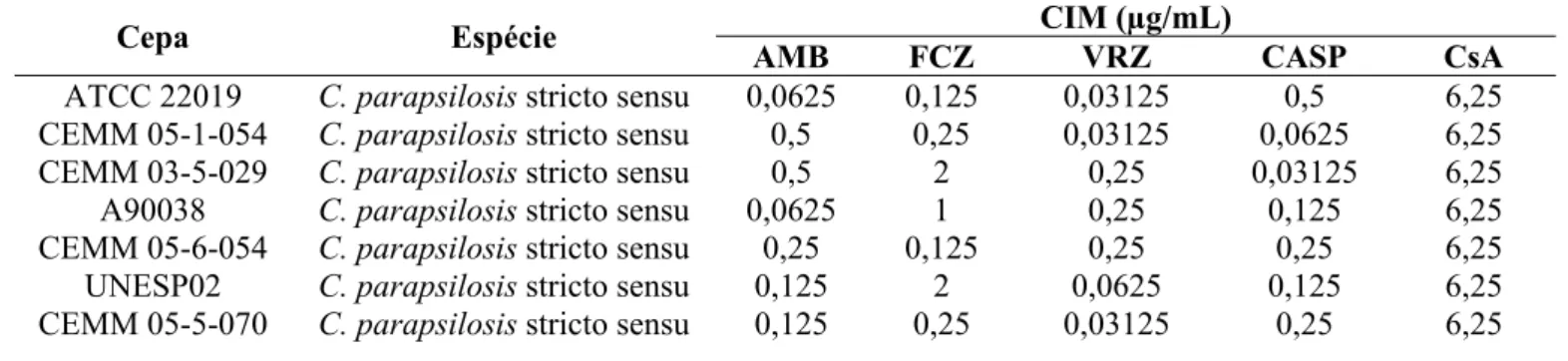
Neste estudo, foram incluídas 39 cepas do Complexo Candida parapsilosis; destas, 36 cepas de origem clínica e 3 ATCC´s, as quais foram obtidas, na Micoteca do Centro Especializado em Micologia Médica (CEMM), bem como cedidas gentilmente pelos pesquisadores: Dra. Arianna Tavanti (UNIPI, Università degli Studi di Pisa, Itália); Prof.a Lourimar Vianna (UNIVALE, Universidade do Vale do Rio Doce, Minas Gerais); Prof.a Dr.a Cristiane Yumi Koga Ito (UNESP, Universidade Estadual Paulista, São Paulo) e Prof.a Dr.a Rejane Pereira Neves (UFPE, Universidade Federal de Pernambuco). Cepas de referência provenientes do banco de culturas American Type Culture Collection (ATCC) foram gentilmente cedidas pela Prof.a Dr.a Elisa Borghi (UNIMIT, Università degli Studi di Milano, Itália), que são ATCC 22019 (C. parasilosis stricto sensu– número de coleção CEMM 03-1-019), ATCC 96139 (C. metapsilosis – número de coleção CEMM 097) e ATCC 96143 (C. orthopsilosis – número de coleção CEMM 05-4-098). Ver quadro 1.
procedimento foi realizado sob normas de biossegurança nível 2. Para controle do experimento foi utilizado uma cepa C. parapsilosis (ATCC 22019).
Adicionalmente, foi analisado o crescimento de cada isolado em meio cromogênico (HiCrome Candida Differential Agar, HiMedia, Mumbai, Índia) para constatar a pureza das colônias (ALFONSO et al., 2010; SIDRIM et al., 2010). Por fim, a ausência de contaminação bacteriana foi confirmada por meio de coloração de Gram.
Quadro 1. Origem das cepas do Complexo C. parapsilosis.
Código Espécie Sitio de coleta Micoteca de origem
ATCC 22019
C. parapsilosis stricto sensu
Fezes UNIMIT
CEMM 05-1-054
C. parapsilosis stricto sensu
Hemocultura CEMM
CEMM 03-5-029
C. parapsilosis stricto sensu
Hemocultura CEMM
A90038
C. parapsilosis stricto sensu
Cavidade oral UNESP
CEMM 05-6-054
C. parapsilosis stricto sensu
Cavidade oral UNESP
UNESP02
C. parapsilosis stricto sensu
Cavidade oral UNESP
CEMM 05-5-070
C. parapsilosis stricto sensu
Cavidade oral UNIVALE
CEMM 05-1-051
C. parapsilosis stricto sensu
Hemocultura CEMM
CEMM 03-5-043
C. parapsilosis stricto sensu
Hemocultura CEMM
USP15
C. parapsilosis stricto sensu
Cavidade oral UNESP
UNESP04
C. parapsilosis stricto sensu
Cavidade oral UNESP
USP01
C. parapsilosis stricto sensu
Cavidade oral UNESP
URM6411
C. parapsilosis stricto sensu
Hemocultura UFPE
ATCC 96143 C. metapsilosis Cateter UNIMIT CEMM 05-5-087 C. metapsilosis Unha UNIPI CEMM 05-5-093 C. metapsilosis Tecido biopsia UNIPI
CEMM 05-5-092 C. metapsilosis Hemocultura UNIPI CEMM 05-5-086 C. metapsilosis Aspirado brônquico UNIPI
CEMM 05-5-095 C. metapsilosis Ouvido UNIPI CEMM 05-5-089 C. metapsilosis Faringe UNIPI CEMM 05-5-090 C. metapsilosis Fezes UNIPI CEMM 05-5-091 C. metapsilosis Urina UNIPI
URM6407 C. metapsilosis Hemocultura UFPE URM6408 C. metapsilosis Hemocultura UFPE CEMM 05-5-094 C. metapsilosis Urina UNIPI CEMM 05-5-088 C. metapsilosis Vagina UNIPI
CEMM 05-5-084 C. orthopsilosis Swab urogenital UNIPI CEMM 05-5-079 C. orthopsilosis Aspirado brônquico UNIPI CEMM 05-5-085 C. orthopsilosis Aspirado brônquico UNIPI
CEMM 05-1-060 C. orthopsilosis Hemocultura CEMM CEMM 05-1-053 C. orthopsilosis Hemocultura CEMM CEMM 03-5-040 C. orthopsilosis Hemocultura CEMM CEMM 03-3-044 C. orthopsilosis Hemocultura CEMM CEMM 05-5-078 C. orthopsilosis Cateter UNIPI
CEMM 05-5-099 C. orthopsilosis Pele UNIPI CEMM 05-1-058 C. orthopsilosis Hemocultura CEMM CEMM 05-5-080 C. orthopsilosis Unha UNIPI UNIMIT: Università degli Studi di Milano, Itália; UNIPI: Università degli Studi di Pisa, Itália; UNIVALE:
Universidade do Vale do Rio Doce, Minas Gerais; UNESP: Universidade Estadual Paulista, São Paulo; UFPE: Universidade Federal de Pernambuco; ATCC: American Type Culture Collection.
5.2 IDENTIFICAÇÃO MOLECULAR DAS CEPAS DO COMPLEXO C. parapsilosis
Para confirmação da identidade das cepas, foi feita a análise molecular segundo descrito por Tavanti et al. (2005) baseado em PCR-REA. Para a extração de DNA, as leveduras foram cultivadas em ágar Batata e incubadas por 48 horas a 35 °C. Inicialmente, uma única e pequena colônia foi transferida para microtubo contendo 6µL de NaOH 0,02 M e, posteriormente, os tubos foram levados ao termociclador por 10 minutos a 99,9 °C. A reação de PCR foi conduzida em volume total de 25 µL, dos quais encerravam 2,95 µL de H2O mili-Q estéril; 5,0 µL de tampão 5X (Promega, USA); 5,0 µL de MgCl2;
2,5 µL do oligonucleotídeo S1F (GTT GAT GCT GTT GGA TTG T) e 2,5 µL de oligonucleotídeo S1R (CAA TGC CAA ATC TCC CAA); 5,0 µL de dNTp; 0,05 µL de Taq (Go Taq Hot Start - Promega, USA) 2 µL de suspensão obtida por lise celular. As condições de amplificação foram realizadas em um termociclador (Multigene Gradiente- Labnet, USA) nas seguintes condições: desnaturação durante 7 minutos a 94 °C, seguido por 30 ciclos de desnaturação a 94 °C durante 1 minuto, hibridação a 50 °C durante 1 minuto e alongamento a 74 °C durante 1 minuto, com uma extensão final de 10 minutos a 74 °C (TAVANTI et al., 2005).
uma solução com brometo de etídio na concentração de 0,5mg/mL. As bandas de DNA foram, então, visualizadas por transiluminador de UV.
A digestão com a enzima de restrição BanI (BshNI – Fermentas Life Sciences, Lituânia) foi realizada de acordo com o protocolo de Tavanti et al. (2005) com modificações. A reação utilizou 10 µL dos amplicons utilizados no PCR, 18 µL de H2O
mili-Q estéril, 2 µL de tampão 10X (adquirido junto com a enzima) e 2 µL da enzima BanI; todo o material foi incubado em banho-maria por 16 horas a 37 °C. Os produtos da digestão foram separados por eletroforese em gel de agarose a 2%; os géis foram incubados em solução de brometo de etídio por 30 minutos e visualizados em transiluminador de UV. O peso molecular das bandas obtidas foi estimado com auxílio do marcador da New England, Biolabs® de 100 pb. A diferenciação das espécies do Complexo C. parapsilosis se dá com bandas de diferentes pesos moleculares. Para C. parapsilosis stricto sensu duas bandas com aproximadamente 550 e 200 pb cada, pra C. metapsilosis duas bandas de 400 e 200 pb cada e para C. orthopsilosis uma banda de aproximadamente 700 pb.
5.3 DROGAS ANTIFÚNGICAS E CICLOSPORINA A
Soluções de anfotericina B (AMB; Sigma Chemical Corporation, EUA), fluconazol (FCZ; Pfizer, Brasil) e caspofungina (CASP; Merck Sharp & Dohme, Brasil) foram diluídas em água destilada estéril; voriconazol (VRZ; Pfizer, Alemanha) foi preparado em dimetilsulfóxido (CLSI, 2008). Solução estoque de ciclosporina A (CsA; Merck, EUA), na concentração de 5 mg/mL, foi preparada em água destilada estéril. Todas as drogas foram estocadas a - 20 ºC e diluídas no momento de uso em meio RPMI 1640 com L-glutamina e sem bicarbonato de sódio (Sigma Chemical Co., St. Louis, MO, EUA), tamponado a pH 7,0 com 0,165 M de ácido morpholinepropanesulfonic (MOPS, Sigma Chemical Co.).
As concentrações das drogas testadas variaram de 0,03125 a 16µg/ml para AMB, FCZ, VRZ e CASP (PFALLER et al., 2006; CLSI, 2008), de 0,125 a 64 µg/mL para FCZ (CLSI, 2008) e de 6,25 a 100 µg/mL para CsA (SHINDE et al., 2012).
5.4.1 Preparo do inóculo
O preparo do inóculo para o teste de sensibilidade foi feito a partir de colônias crescidas em ágar Batata dextrose por 24 h a 35 ºC. Resumidamente, colônias foram resuspensas em 5 mL de solução salina estéril a 0,85 % e a suspensão obtida foi ajustada a turbidez a 0,5 na escala de Mc Farland. Em seguida, a suspensão foi diluída na proporção 1:100 e, em seguida, 1:20 em meio RPMI, para obtenção de um inóculo com concentração final de variando de 0,5 a 2,5 x 103 células / ml (CLSI, 2008).
5.4.2 Microdiluição
O teste de sensibilidade foi realizado por meio da técnica de microdiluição em caldo de acordo com documento M27 -A3 (CLSI, 2008). Para realização do teste foram utilizadas 39 cepas do Complexo C. parapsilosis identificadas e confirmadas anteriormente. Foram usadas placas de poliestireno de 96 poços com fundo em U com capacidade de 200 μL, em que primeiramente foi adicionado 100 µL do meio RPMI em cada poço, em seguida acrescentou-se 100 µL da droga na primeira coluna, em uma concentração quatro vezes maior que a concentração esperada no primeiro poço e, posteriormente, a droga foi diluída até a décima coluna. A coluna 11 de cada placa foi destinada ao controle negativo do experimento, ou seja, o inóculo e o meio sem a droga; a coluna 12 foi dividida em duas partes com quatro poços cada uma, onde em uma metade era feito o controle de esterilidade da droga em teste e, na outra, era usada para controle de esterilidade do meio RPMI 1640. As placas foram incubadas a 35 ºC e lidas após 24 h para FCZ, VRZ e CASP e 48 h para AMB e CsA.
A concentração inibitória mínima (CIM) foi definida como a menor concentração do fármaco que causou a inibição completa para AMB e uma diminuição significativa de crescimento de 50% de inibição para VRZ, FCZ, CASP, quando comparados ao controle (CLSI, 2008). Para CsA, a CIM foi definida como 50% de inibição, de acordo com o protocolo de Shinde e colaboradores de 2012.
A avaliação do efeito sinérgico entre CsA e as drogas antifúngicas foi realizada em um ensaio conhecido como modelo de Checkerboard (ODDS, 2003). Foram utilizadas 39 cepas do Complexo C. parapsilosis. Em suma, este teste permite avaliar o efeito inibitório de soluções contendo diferentes concentrações de cada droga em combinação. As concentrações das drogas combinadas variaram de acordo com as concentrações contidas na quadro 2.
Quadro 2. Concentrações de cada droga testada isoladamente ou em combinações.
Drogas Concentração inicial (µg/mL)
Concentração final (µg/mL)
Fluconazol (FCZ) 0,03125 16
Voriconazol (VRZ) 0,03125 16
Caspofungina (CASP) 0,03125 16
Anfotericina B (AMB) 0,125 64
Ciclosporina A (CsA) 6,25 100
FCZ/ CsA 0,0156/ 0,312 1/ 2,5 VRZ/ CsA 0,0039/ 0,3125 0,0625/ 20 CASP/ CsA 0,0039/ 0,625 0,0625/ 2,5 AMB/ CsA 0,0156/ 0,156 1/ 2,5
A concentração inibitória mínima de cada fármaco em combinação (CIMsin) foi definida como a menor concentração que causou 50% de inibição do crescimento para a combinação de CsA com FCZ, VRZ e CASP e de 100% quando combinada com AMB. As interações foram classificadas como sinérgicas, indiferentes ou antagônicas, de acordo com o Índice de Concentração Inibitória Fracionada (FICI). Desta forma, foram considerados os seguintes parâmetros: FICI ≤ 0,5: sinergismo, FICI > 4,0: antagonismo e 0,5 < FICI > 4,0: sem interação (ODDS, 2003).
5.5 INIBIÇÃO DE BIOFILMES DO COMPLEXO C. parapsilosis
O protocolo foi realizado, de acordo com o estabelecido por Ruiz e colaboradores (2013), com adaptações. Foram utilizadas 7 cepas de cada espécie do Complexo, escolhidas aleatoriamente mais as cepas ATTC´s das respectivas espécies, totalizando um de n = 24 cepas, ver quadro 3. As leveduras foram cultivadas em ágar Sabouraud dextrose por 24 h a 35 °C. Para preparo do inóculo, uma colônia foi transferida para tubos contendo 3 mL de solução salina estéril a 0,85%, sendo a turvação ajustada ao padrão 4,0 da escala de Mc Farland. Para a formação do biofilme, foram utilizadas placas de poliestireno de 96 poços com fundo chato com capacidade para 200 μL; em cada poço, foram adicionados 180 µL de caldo Sabouraud suplementado com glicose a 8% e 20 µL do inóculo em salina. As placas foram incubadas a 35 ºC por 24 h. Após esse período, todo o líquido foi aspirado e os poços lavados duas vezes com 200 µL de PBS. As placas foram mantidas em repouso por 20 minutos em cabine de fluxo laminar e, decorrido esse tempo, adicionou-se a cada poço 110 µL de cristal violeta a 0,4% por 45 minutos. Em seguida, as placas foram lavadas três vezes com 200 µL de água destilada estéril e adicionado 200 µL de etanol (99,5%) em cada poço por mais 45 minutos; 100 µL de cada poço foram transferidos para uma nova placa para leitura em espectrofotômetro (leitor automático de microplacas) a 595 nm. Os valores de absorbância do controle negativo (poços com apenas as culturas) foram subtraídos a partir dos valores das cepas testadas para minimizar potenciais interferências; todo o experimento foi realizado em triplicata e com controle de crescimento e reagentes utilizados.
Quadro 3. Relação de cepas utilizadas para os testes com biofilme.
Candida parapsilosis
strcito sensu n = 8
Candida metapsilosis
n = 8
Candida orthopsilosis
n = 8
ATCC 22019 ATCC 96143 ATCC 96139
CEMM 05-1-054 CEMM 05-5-087 CEMM 05-5-083 CEMM 03-5-029 CEMM 05-5-092 CEMM 05-5-084 CEMM 05-6-054 CEMM 05-5-095 CEMM 03-5-040
CEMM 05-5-070 URM6407 CEMM 05-5-078
CEMM 05-1-051 URM6408 CEMM 05-1-053
CEMM 03-5-043 CEMM 05-5-094 CEMM 05-5-099
USP01 CEMM 05-5-088 CEMM 05-1-058
A capacidade da CsA e drogas antifúngicas na inibição da formação de biofilmes de C. parapsilosis stricto sensu, C. orthopsilosis e C. metapsilosis foi avaliada, de acordo com o protocolo usado por Ruiz et al. (2013), com adaptações. Foram utilizadas as mesmas 24 cepas do experimento anterior.
A formação de biofilme foi realizada conforme descrito acima, exceto pela a adição das drogas em teste, ao caldo Sabouraud suplementado com glicose a 8%. Para o teste, foram escolhidas três concentrações (CIM, CIM10X e CIM50X) da CsA baseado em dados do efeito da mesma sobre a célula no estado planctônico. Posteriormente, foi realizado o estudo da ação da combinação de CsA e drogas antifúngicas nas mesmas concentrações sobre a formação de biofilme. Os experimentos foram realizados em triplicata e repetidos de forma independentes.
5.5.3 Efeito da CsA e drogas antifúngicas sobre biofilme formado no Complexo C. parapsilosis
Posteriormente, foi realizado o estudo da ação da combinação da CsA e drogas antifúngicas nas mesmas concentrações sobre a formação de biofilme. Os experimentos foram realizados em triplicata e independentes.
6 ANÁLISE ESTATÍSTICA
As sensibilidades antimicrobianas foram comparadas por meio de análise unidirecional de variância (ANOVA) e comparações múltiplas do pós-teste de Tukey. Diferenças entre os tratamentos foram avaliadas para significância, utilizando o teste de Wilcoxon. Um valor de p < 0,05 foi considerado significativo. As análises estatísticas foram realizadas com o GraphPad Prism 5.0 (GraphPad Software, San Diego, CA, EUA).
7 RESULTADOS
7.1 IDENTIFICAÇÃO E CONFIRMAÇÃO DAS CEPAS
Todas as 39 cepas utilizadas nesse trabalho foram testadas para as características fenotípicas e moleculares.
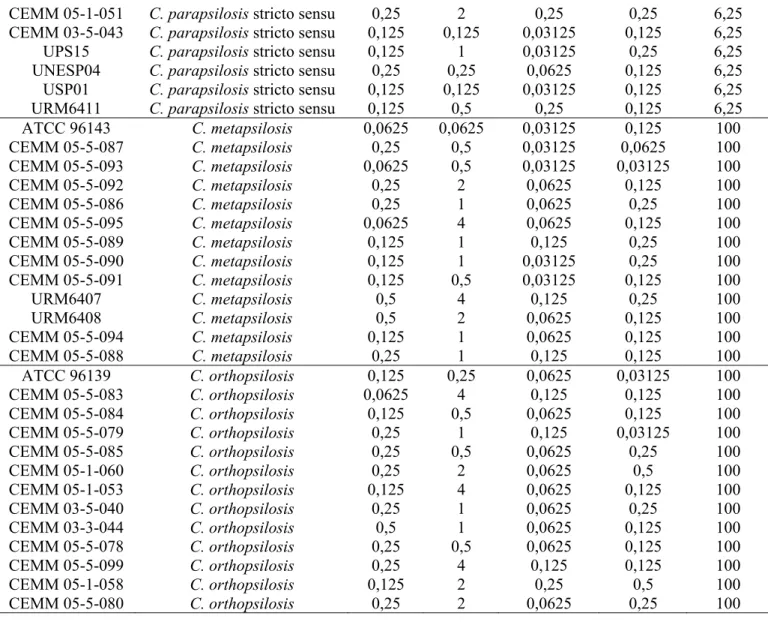
As cepas oriundas da micoteca do CEMM, que não possuíam classificação a nível de espécie, foram identificadas molecularmente, além terem confirmadas suas características macro e micromorfológicas. As cepas doadas pelos pesquisadores possuíam a identificação a nível de espécie, porém foram testadas para a confirmação tanto molecular como fenotipicamente. Logo, como resultado, todas as cepas confirmaram a identificação de origem. Ver tabela 1.
Tabela 1. Resultado da identificação molecular das 39 cepas.