UNIVERSIDADE CATÓLICA DE BRASÍLIA - UCB
Pró
–
Reitoria de Pós - Graduação e Pesquisa
Programa de Pós-Graduação
Stricto Sensu
em Educação
Física
Trabalho de defesa do mestrado
ESTUDO MORFOQUANTITATIVO DA PAREDE DA
PARTE ASCENDENTE DA AORTA DE RATOS
WISTAR IDOSOS TREINADOS EM NATAÇÃO NA
INTENSIDADE DO LIMIAR DE LACTATO
Autora: Maritza Alves de Sousa Coura
Orientadora: Prof
a. Dr
a. Carmen Silvia Grubert Campbell
MARITZA ALVES DE SOUSA COURA
ESTUDO MORFOQUANTITATIVO DA PAREDE DA PARTE AORTA ASCENDENTE DE RATOS WISTAR IDOSOS TREINADOS EM NATAÇÃO NA
INTENSIDADE DO LIMIAR DE LACTATO
Dissertação apresentada ao programa de Pós - graduação Stricto Sensu em Educação Física e Lazer da Universidade Católica de Brasília, como requisito parcial para obtenção de Título de Mestre em Educação Física.
Orientadora: Dra. Carmen Silva Grubert Campbell – Universidade Católica de Brasília. Co – orientador: Dr. Edson Aparecido Liberti
– Universidade de São Paulo
FOLHA DE APROVAÇÃO
Defesa de autoria de Maritza Alves de Sousa Coura, intitulada “Estudo
morfoquantitativo da parede da aorta ascendente de ratos Wistar idosos treinados em natação
na intensidade do limiar de lactato’’, apresentada como requisito parcial para obtenção do grau de Mestre em Educação Física e Saúde da Universidade Católica de Brasília em 05/12/2011, defendida e aprovada pela banca examinadora abaixo:
Prof. Doutora Carmen Silvia Grubert Campbell Orientadora
Mestrado e Doutorado em Educação Física- (UCB)
Prof.Titular Edson Aparecido Liberti Co - orientador
Anatomia Humana- ICB/USP.
Prof. Doutor Herbert Gustavo Simões Examinador interno
Mestrado e Doutorado em Educação Física-(UCB)
Prof. Doutora Juliana Hott de Fúcio Lizardo Examinadora externa
Universidade Federal do Espírito Santo - (UFES)
Prof. Doutor Ricardo Moreno Lima Suplente
Universidade de Brasília – (UNB)
AGRADECIMENTOS
Aos meus orientadores, os professores Carmen da Silvia Grubert Campbell, Edson Aparecido Liberti e o Herbert Gustavo Simões por terem me orientado com sabedoria e dedicação, mostrando-me o caminho da ciência, por fazerem parte de minha vida nos momentos bons e ruins e por serem exemplos tanto no campo profissional como pessoal.
A Sra. Rosana Duarte Prisco pela prestabilidade na realização da análise estatística dos dados. A Sra. Marta Righetti, técnica do laboratório de Anatomia, que prepara as lâminas de histologia, por ter sido uma pessoa essencial na realização do meu trabalho.
Aos meus colegas do Laboratório de Anatomia Funcional Aplicada à Clínica e a Cirurgia do ICB-USP em especial a Karina do Valle, o Josenberg Batista, William Mayer, Paulo Henrique e sua esposa, Flávia Oliveira, Linda Tamayo, em memória à professora Sílvia Boldrini, o Ricardo, a Sabrina e a sua irmã, a Bruna e o Teves. Ao meu amigo Leonardo Liberti, por ter me ajudado durante o tempo que morei em São Paulo.
À minha família pelo amor, carinho, paciência, apoio e incentivo, cuja participação foi fundamental para a realização deste trabalho.
Aos meus amigos Ana Paula Lamounier, Danielle, Mércia, Suliane, Darlan, Alessandra, Daniel Tavares, Rafael Sotero, Ana, Bibiano Madrid e a todos os meus colegas de estudos da Universidade Católica de Brasília.
“O bem que praticares, em algum lugar, é teu advogado em toda parte.”
RESUMO
Coura, Maritza Alves de Sousa. Estudo morfoquantitativo da parede da aorta. 2011. Mestrado em Educação Física e Lazer, Universidade Católica de Brasília, 2011.
O envelhecimento está associado à elevação da pressão arterial sistólica, ao aumento da parede do ventrículo esquerdo e também, a uma maior rigidez na túnica íntima e média das artérias devido a diferentes fatores, como a destruição das fibras elásticas. Como forma de prevenir doenças cárdio - vasculares, promover mudanças na estrutura das artérias e, consequentemente, a moderação da pressão arterial, o exercício físico vem sendo utilizado como um tratamento não farmacológico. Objetivo: Avaliar sob os aspectos morfológicos e quantitativos, as alterações da parte ascendente da aorta de ratos Wistar idosos (16 meses) treinados em natação na intensidade do limiar de lactato. Dez animais machos foram divididos em dois grupos experimentais, sendo um grupo controle (n=5) e um grupo treinado em natação (n=5), mantidos em gaiolas coletivas, sem restrições de ração e água, treinados cinco vezes/semana, 30 minutos/dia, durante oito semanas. Para a avaliação aeróbia foram determinados o Limiar de Lactato na primeira, quarta e oitava semanas de treinamento. Após o período experimental, foi realizada a eutanásia e a retirada do coração e da aorta, que foi devidamente fixada e preparada de acordo com os procedimentos de histologia para colorações com Hematoxilina-Eosina, Weigert e Verhoeff para avaliação das fibras elásticas. No material obtido foram realizadas avaliações qualitativas e quantitativas utilizando-se métodos morfométricos e estereológicos. Resultados: O exercício físico promoveu um aumento (p<0,05) na espessura, área de secção transversa, fibras elásticas e na distância entre os feixes do núcleo de músculo liso sem alterar o diâmetro. Conclusão: A aorta dos animais treinados apresentou alterações morfológicas compatíveis com o aumento da elasticidade, demonstrando que o exercício físico foi um fator determinante na mudança estrutural da aorta ascendente destes animais, resultando em uma artéria mais elástica e com possível redução do estresse tangencial na parede arterial durante o exercício físico e o repouso.
ABSTRACT
LISTA DE ILUSTRAÇÕES
Figura 1:Processos da hipótese oxidativa de resposta à lesão. ... 24
Figura 2: A classificação da American Heart Association para as lesões ateroscleróticas humanas. ... 25
Figura 3: História natural e principais consequências da aterosclerose ... 26
Figura 4: Disfunção endotelial na aterosclerose. ... 28
Figura 5: Início da lesão. ... 29
Figura 6: Inflamação. ... 31
Figura 7: Formação de células espumosas. ... 32
Figura 8: Fotomicrografias da artéria carótida comum de um suíno demonstrando hiperplasia de célula muscular lisa. ... 33
Figura 9: Representação esquemática na apoptose em diferentes estágios da aterosclerose. .. 35
Figura 10: A estrutura de uma artéria normal... 42
Figura 11.A: Anatomia da aorta ascendente (face esternocostal). ... 44
Figura 11. B: Anatomia da aorta ascendente (face diafragmática)... 45
Figura 12: Fotos do biotério e equipamento para dosagem da concentração de lactato. ... 55
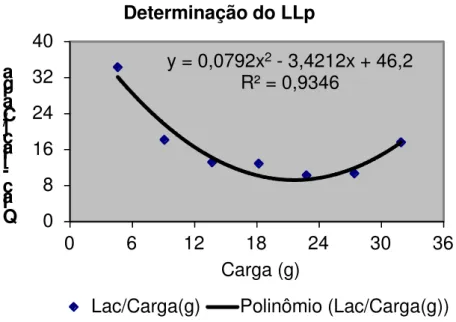
Figura 13: Método polinomial. ... 57
Figura 14: Fotomicrografia corada com Verhoeff, Hematoxilina – Eosina e Weigert. ... 59
Figura 15. Fotomicrografia da mensuração da área externa, interna, diâmetro interno e externo. ... 60
Figura 16: Foto do microscópio trinocular. ... 61
Figura17: Técnica utilizada com a coloração Hematoxilina - Eosina. ... 62
Figura 18: Foto da técnica utilizada para a coloração de Verhoeff. ... 62
LISTA DE TABELAS
Tabela 1– Média e Desvio Padrão da porcentagem do peso corporal equivalente ao Limiar de Lactato Polinomial e Peso Corporal pré e pós experimento e peso da aorta. ... 64
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
Ae - área externa;
AGES – produtos finais da glicolisação avançada; Ai - área interna;
Apo B – apoliproteína B do LDL; Apo E - apoliproteína E;
AST - área da secção transversa; AVC – acidente vascular cerebral; DCV – doenças cardiovasculares; De - diâmetro externo;
Di - diâmetro interno; EC – célula endotelial; FC – frequência cardíaca;
FGF – fator de crescimento de fibroblastos; GC – grupo dos animais controle;
GT – grupo dos animais treinados com natação; HA – hipertensão arterial;
Highly ox-LDL – LDL altamente oxicidada;
IBGE - Instituto Brasileiro de Geografia e Estatística; IL – interleucina;
INF- α - interferon alfa; INF- – interferon gama; LA - limiar anaeróbio;
LDL – lipoproteína de baixa densidade; LL- limiar de lactato;
LLp - limiar de lactato polinomial; MEC – matriz extracelular;
MFEL- máxima fase estável de lactato; n. – número;
NO – Óxido Nítrico; Oxlp – lipídios oxicidados; PA – pressão arterial; PC – peso corporal;
QA[nu] - densidade numérica de núcleos;
ROS – espécie reativa de oxigênio; RVP – resistência vascular periférica; SHR- ratos espontaneamente hipertensos;
SHR- EX- ratos espontaneamente hipertensos exercitados; SHR-SED- ratos espontaneamente hipertensos sedentários; SMC – célula muscular lisa;
sPLA2– fosfolipase 2 secretada;
SV - densidade de área;
TGF –α – fator de crescimento tumoral alfa; TNF- tratamento não farmacológico;
TNF-α – fator de necrose tumoral alfa; VV[lam] - densidade de volume de lamela;
[lac] - concentração de lactato sanguíneo;
(LEEFS)- UCB - Laboratório de Estudos em Educação Física e Saúde da Universidade Católica de Brasília;
µm - micrômetros;
δ – espessura;
SUMÁRIO
1 INTRODUÇÃO ... 18
2 REVISÃO DA LITERATURA ... 21
2.1 ENVELHECIMENTO E ARTERIOSCLEROSE ... 21
2.1.1 Aterosclerose ... 22
2.2 EVENTO INICIAL DA ATEROSCLEROSE ... 27
2.3 INFLAMAÇÃO ... 30
2.4 CÉLULAS MUSCULARES LISAS ... 32
2.5 APOPTOSE ... 33
2.6 FATORES DE RISCO PARA ATEROSCLEROSE ... 35
2.7ASPECTOS MORFOLÓGICOS DOS VASOS SANGUÍNEOS ... 40
2.8 AORTA ... 43
2.9 DISTRIBUIÇÃO DAS FIBRAS ELÁSTICAS ... 45
2.10 DISTRIBUIÇÃO DE COLÁGENO ... 46
2.11 INTERAÇÃO ENTRE EXERCÍCIO FÍSICO, ARTÉRIAS, ATEROSCLEROSE E ENVELHECIMENTO ... 48
3 METODOLOGIA ... 54
3.1 AMOSTRA ... 54
3.2 GRUPOS EXPERIMENTAIS ... 55
3.3 ADAPTAÇÃO AO MEIO LÍQUIDO ... 55
3.4 AVALIAÇÃO AERÓBIA PRÉ E PÓS-TREINAMENTO ... 55
3.5 COLETA, ARMAZENAGEM E DOSAGENS SANGUÍNEAS ... 56
3.6 DETERMINAÇÃO DO LIMIAR DE LACTATO ... 56
3.7 PROTOCOLO DE TREINAMENTO AERÓBIO NA NATAÇÃO ... 57
3.8 PREPARAÇÃO DAS AMOSTRAS ... 57
3.9 QUANTIFICAÇÃO ... 59
3.11 ESTUDO ESTEREOLÓGICO DA PARTE ASCENDENTE DA AORTA ... 61
4 ANÁLISE ESTATÍSTICA ... 63
5 RESULTADO ... 64
6 DISCUSSÃO E CONCLUSÃO ... 66
REFERÊNCIAS ... 70
1 INTRODUÇÃO
O envelhecimento é um dos fatores de risco para o desenvolvimento de doenças vasculares como, por exemplo, aterosclerose, doenças coronarianas (YILDIZ, 2007) e também, de outras doenças que estão associadas às alterações estruturais do envelhecimento das artérias (GIRERD et al, 2007). Essas alterações também induzem a uma elevação da pressão arterial (PA) sistólica, com conseqüente aumento da espessura da parede do ventrículo esquerdo, sendo que, esta última freqüentemente está relacionada com uma maior rigidez da parede da aorta (GIRERD et al, 2007). Ainda segundo Yildiz (2007), essas alterações estão também relacionadas a uma das principais causas de ataques cardíacos e derrames cerebrais (COSTOPOULOS et al., 2007).
A incidência da aterosclerose aumenta a cada década vivida (COSTOPOULOS et al., 2007). Segundo Mallika et al., (2007), a aterosclerose é considerada uma das principais causas de morte no século 21. No Brasil, dados do instituto Brasileiro de Geografia e Estatística (IBGE, 2002), as doenças cardiovasculares (DCV) se destacam como a principal causa de morte no país (28% para homens e 36,9% para mulheres), em todas as regiões e estados. A região Sul e o estado do Rio Grande do Sul, em particular, registram as maiores proporções, sendo responsáveis por 40% das mortes de mulheres. O fumo, a obesidade, o diabetes mellitus, a hipertensão arterial (HA), a hipercolesterolemia, o histórico familiar de doenças cardiovasculares (DCV) e a falta de exercícios aumentam o risco das doenças (PINHO et al, 2010).
Os mecanismos envolvidos nesse processo são múltiplos e complexos, existem diferentes teorias para sua explicação, que envolvem, por exemplo, o papel e as alterações endoteliais promovidas pelas dislipidemias, pela hipercoagulação, oferta insuficiente da biodisponibilidade de óxido nítrico (NO), estresse oxidativo, inflamação constituída de macrófagos, monócitos derivados e linfócitos – T, infecção por certos agentes patogênicos, e também pela disfunção endotelial. Estas alterações no tecido arterial podem ser morfologicamente caracterizadas pelo aumento da espessura da túnica íntima e média, devido à destruição gradual das fibras elásticas e pelo aumento do depósito de substâncias como o cálcio na MEC (KOCKX, 1998; NIEDERHOFFER et al, 1997; PINHO et al, 2010; TATCHUM-TALOM et al, 1995).
Sofrem também alterações as proteínas fibrosas, elastina e colágeno, que estão associadas tanto com o envelhecimento como a Hipertensão Arterial (HA) (BLUMENTHAL et al., 1950; ITO, 1982). As proteínas fibrosas são os componentes de maior elasticidade da parede arterial. A modificação patológica dessas proteínas pode contribuir também para o endurecimento da parede da aorta e consequentemente para um transtorno na função cardíaca e vascular, sendo o exercício uma forma de tratamento não farmacológico (TNF) (KRAMSCH et al., 1981; WONG et al, 1975).
melhora nas fibras eulanínicas e oxitalânicas por uma parcial interrupção dos processos de elastogênese.
Embora os efeitos do treinamento físico sejam bem descritos, ao prescrever exercício físico como TNF para diferentes doenças, tanto em estudos envolvendo experimentação com humanos ou animais, é importante considerar quais métodos serão utilizados para avaliação e prescrição do treinamento. Diferentes métodos de avaliação aeróbia vêm sendo utilizados, como a avaliação do consumo de oxigênio durante a corrida (WISLOFF et al, 2001), análise da resposta lactatêmica durante o exercício com cargas progressivas ou retangulares, em corrida (PILIS et al, 1993) ou na natação (GOBATTO et al, 2001), e ainda, por meio da utilização de variáveis matemáticas referenciadas no desempenho dos animais (BILLAT et al, 2005). Embora existam diferentes métodos, como os citados anteriormente, sabe-se que a análise da lactatemia e o uso de modelos matemáticos baseados no desempenho são os mais utilizados devido ao menor custo quando comparados aos que fazem uso de análise gasosa.
O limiar anaeróbio (LA), variável importante na análise dos efeitos do treinamento e da condição aeróbia, pode ser identificado através da análise da concentração de lactato e determinação do limiar de lactato – LL, sendo considerado um modelo eficiente para avaliar a capacidade aeróbia de grupos com indivíduos saudáveis (JONES & CARTER, 2000) ou não (OMIYA et al, 2004) e também em experimentos com animais (VOLTARELLI et al, 2002). As formas para identificar o LL geralmente usam testes de cargas progressivas, em que, ao iniciar um teste, o metabolismo muscular é mantido principalmente pelas vias aeróbias. Conforme é aumentada a intensidade do exercício, a atividade das fibras musculares glicolíticas também aumenta, até um momento que a participação destas fibras (Glicolíticas) torna-se desproporcionalmente aumentada em relação à utilização das fibras musculares oxidativas, levando a um aumento da concentração de lactato sanguíneo de modo desproporcional ao aumento da intensidade do exercício, verificando-se assim uma maior participação das vias anaeróbias a partir deste momento (SIMÕES et al, 1999). Desta forma estima-se uma intensidade de exercício relacionada a mais alta concentração de lactato sanguíneo que possa ser mantida em equilíbrio, tanto no que se refere à produção, como também da remoção do lactato sanguíneo (POOLE et al, 1988), ou seja, sem a participação predominante do metabolismo anaeróbio (BENEKE, 1995).
máximo de oxigênio (ACSM, 2002), diminuindo-se assim os riscos cardiovasculares (Wasserman, 2002). A resposta do lactato sanguíneo ao exercício tem sido considerada válida para diagnóstico da aptidão aeróbia, prescrição e acompanhamento do treinamento em humanos (Svedahl & MacIntosh, 2003) e ratos (Cunha et al, 2008; Cunha V. et al, 2008, Cunha et al, 2009; Gobatto 2001).
Gobatto et al. e Voltareli et al.foram os primeiros a publicarem estudos com aplicação de protocolos para determinação do máximo estado estável de lactato (MEEL) e LL em ratos na natação. Sabendo que os princípios gerais que regulam o fluxo de lactato são válidos para ambas as espécies e que é possível identificar o LL em ratos, (Cunha et al, 2008; Cunha V. et al, 2008, Cunha et al, 2009; Gobatto 2001) assim como também é possível identificar a MEEL, que acontece por volta de 5,5 mmol.L-1 de lactato nos ratos (Cunha et al, 2009; Gobatto 2001) e nos humanos ocorre por volta
de 4 mmol.L-1. Pode-se sugerir que a cinética de lactato seja semelhante entre humanos e ratos, e a
utilização destes métodos para avaliação e prescrição de treinamento torna-se uma importante ferramenta na pesquisa. Sendo assim, o objetivo do presente estudo foi avaliar os efeitos do treinamento de natação realizado na intensidade do limiar anaeróbio sobre os componentes da parede aorta ascendente.
2 REVISÃO DA LITERATURA
2.1 ENVELHECIMENTO E ARTERIOSCLEROSE
2.1.1 Aterosclerose
A palavra aterosclerose deriva da palavra grega “atero” que significa mingual ou papa, correspondendo à área central necrótica na base da placa aterosclerótica e “esclerose”. Já esclerose significa rígido e corresponde a capa fibrótica na borda luminal da placa. As lesões ateroscleróticas contêm colesterol na forma de ésteres, SMCs, macrófagos e tecido conectivo composto por colágeno, elastina e glicosaminoglicanos. (GOTTLIEB et al, 2005; MALLIKA & RAJAPPA, 2007; TEGOS et al, 2001). É uma doença multifatorial, lenta e progressiva, resultante de uma série de respostas celulares e moleculares altamente específicas (ROSS, 1999). O acúmulo de lipídios, células inflamatórias e elementos fibrosos, que se depositam na
parede arterial, desenvolvendo lesões na túnica íntima e média, são os responsáveis pela formação e adesão de placas ou estrias de gorduras, que progridem para obstrução da luz do vaso (GOTTLIEB et al , 2005; LIBBY et al, 2000; LUSIS, 2000).
A aterosclerose é a principal representante dos processos patológicos cardiovasculares relacionados ao envelhecimento, uma vez que se manifesta em adultos, cuja incidência aumenta exponencialmente a partir dos 45 anos de idade. No entanto, algumas pesquisas observaram a prevalência de placas de gordura superior a 40% nas autópsias de jovens, sugerindo que o processo dessa patologia ocorra precocemente, podendo iniciar-se no feto, sendo desenvolvida por hipercolesterolemia materna, progredindo silenciosamente na adolescência e apresentando manifestações clínicas na fase adulta (GOTTLIEB et al, 2005; NAPOLI et al, 1997).
Existem duas hipóteses propostas ao longo dos anos para a aterosclerose: uma é caracterizada pela proliferação celular da íntima, enquanto a outra é caracterizada pela organização e o crescimento repetitivo de trombos. De acordo com a visão atual, que adere elementos de ambas as teorias e inclui os fatores de riscos, onde se fundamenta na idéia de que as lesões ateroscleróticas representam uma resposta inflamatória crônica da parede arterial às agressões variadas envolvendo linfócitos, macrófagos, SMCs e células endoteliais (EC) (MALLIKA et al, 2007; ROBBINS & CONTRAN, 2005), tendo como eventos fundamentais nessa hipótese:
Acúmulo de lipoproteínas nas paredes dos vasos [lipoproteína de baixa densidade (LDL), lipoproteína de muito baixa densidade (VLDL)] (ROBBINS & CONTRAN, 2005);
Modificação de lipoproteínas por oxidação (MALLIKA et al, 2007);
Adesão de monócitos circulante e outros leucócitos ao endotélio, seguida por sua migração para a íntima e transformação em macrófagos e células espumosas ou xantomizadas (MALLIKA et al, 2007);
Adesão de plaquetas ou a leucócitos aderentes (ROBBINS & CONTRAN, 2005);
Liberação de fatores de plaquetas ativadas, macrófagos ou células vasculares que provocam a migração das SMCs da túnica média para a íntima (MALLIKA et al, 2007);
Proliferação das SMCs na íntima e elaboração da MEC, resultando em acúmulo de colágeno e proteoglicanos (ROBBINS & CONTRAN, 2005);
Figura 1:Processos da hipótese oxidativa de resposta à lesão da parede vascular na aterosclerose (Modificado de SCHOEN & COTRAN, 2000).
A American Heart association (ROBBIS & CONTRAN, 2005) a classifica as lesões ateroscleróticas em seis tipos, iniciando com células espumosas isoladas ou xantomizadas, estágios de estrias gordurosas, ateromas e fibroateromas, até as lesões mais avançadas como trombos, onde são exemplificados na figura (Figura 2).
Estudos têm sugerido duas fases interdependentes na evolução da doença aterosclerótica, a fase “aterosclerótica” ou das estrias gordurosas, na qual ocorrem as lesões
predomina a formação anatômica da lesão aterosclerótica sob a influência dos “fatores de risco aterogênicos” clássicos e que silenciosamente demora décadas para evoluir (Figura 3 da fase pré-clínica) (ROBBIS & CONTRAN, 2005).
Figura: 2: A classificação da American Heart Association para as lesões ateroscleróticas humanas, desde o tipo pontos gordurosos (Tipo I) até a lesão avançada do tipo VI. O diagrama também inclui os mecanismos de crescimento e correlações clínicas. (Modificada de Stary HC, et al: A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis. Circulation 92:1355, 1995).
A outra fase são as placas ateroscleróticas ou a fase trombótica (Figura 3, fase clínica), que sofre influência dos “fatores de risco trombogênicos”, determinando a formação aguda de trombo sobre a placa aterosclerótica. Essas lesões avançadas possuem uma capa fibrosa, que podem ser classificadas de dois tipos: estáveis e instáveis e vão determinar a estabilidade ou a ruptura da placa. As placas mais instáveis são as que possuem maior probabilidade de ruptura e maior conteúdo lipídico intracelular e a sua ruptura ou fissura resulta em formação de trombos (ROBBINS E COTRAN, 2005).
As capas fibrosas são constituídas de SMC e MEC que envolve o núcleo com material amorfo rico em lipídios. Estas placas podem se tornar muito complexas, com aumento significativo da deposição de cálcio, ulceração na superfície luminal e hemorragias dos pequenos vasos (vasa vasorum), que nascem e crescem em direção à lesão, na túnica média da parede arterial. Embora as lesões avançadas possam se tornar muito grandes, complicando o fluxo sanguíneo, a pior complicação clínica é quando se forma a oclusão aguda devido à formação de trombos ou coágulos, resultando em infarto do miocárdio ou acidente vascular encefálico (AVC) (GOTTLIEB et al, 2005; DUARTE et al, 2008). Os dados epidemiológicos da aterosclerose são demonstrados em relação à incidência ou de óbitos ocasionados por cardiopatia isquêmica. A aterosclerose também é responsável por outras conseqüências da redução aguda ou crônica da perfusão arterial, como gangrena das pernas, oclusão mesentérica, cardiopatia isquêmica crônica e encefalopatia isquêmica (SCHOEN & COTRAN, 2000).
2.2 EVENTO INICIAL DA ATEROSCLEROSE
Sabe-se bem que as características funcionais das artérias coronárias são determinadas pelo o funcionamento da célula endotelial (EC), célula muscular lisa (SMC) e de elementos do tecido conectivo nas paredes arteriais como o colágeno. O endotélio tem a função de barreira seletiva, que controla a difusão de macromoléculas no lúmen, regulação do tônus vagal, modulação da inflamação, síntese e inibição do crescimento vascular e também sintetiza fatores vasoconstritores e vasodilatadores como NO. A morfologia das ECs é influenciada por uma força física muito importante que atua na parede vascular chamada de estresse de cisalhamento (LUSIS, 2000; MALLIKA, et al, 2007).
As ECs que se localizam em regiões tubulares do vaso, onde o fluxo é uniforme e laminar, tem característica elipsóide e são organizadas em direção ao fluxo. As ECs que se localizam em regiões de ramificação, bifurcações ou curvatura têm característica poligonal e não possuem uma organização, demonstram intensa permeabilidade para macromoléculas como o LDL e são locais de predisposição para a formação da lesão (LUSIS, 2000; MALLIKA, et al, 2007), além disso, causam alterações características no fluxo sanguíneo como aumento da turbulência.
Nesses locais de predisposição da lesão, são sintetizadas moléculas específicas que são responsáveis pela agregação, migração e acúmulo de monócitos e células T; de modo que estas moléculas de aderência se ligam aos receptores para glicoproteínas e integrinas presentes nos monócitos e células T, incluindo várias selectinas, moléculas de adesão intercelular (ICAM) e moléculas de aderência às células vasculares (VCAM) (LUSIS, 2000; MALLIKA, et al, 2007).
Figura: 4: Disfunção endotelial na aterosclerose. As primeiras mudanças no endotélio antes da formação de lesões ateroscleróticas. Estas mudanças iniciais incluem o aumento da permeabilidade endotelial para lipoproteínas e outros constituintes do plasma, que é mediado pelo óxido nítrico (NO), prostaciclinas, fatores de crescimento derivados das plaquetas, angiotensina II e endotelinas; moléculas que controlam a adesão de leucócitos, incluindo L-selectina, integrinas, molécula de adesão de plaqueta do endotélio-1 (PCAM-1) e moléculas de aderência endoteliais, que incluem a E-selectina, P-selectina, moléculas de adesão
intercelular (ICAM-1) e moléculas de adesão vascular (VCAM-1). Migração de leucócitos para a parede arterial, que é mediada por OX-LDL (Lipoproteína de baixa densidade oxidada), proteína-1 quimiotáxica dos monócitos (MCP-1), interleucina-8 (IL-8), fatores de crescimento derivados de plaquetas, fator estimulador de colônia de macrófago e osteopontina (ROSS, 1999).
O evento inicial da aterosclerose se caracteriza pelo acúmulo e difusão do LDL circulante pelas junções das ECs e o seu aprisionamento na parede vascular, interagindo com a apoliproteína B da LDL (apo B), outras lipoproteínas contendo apo B, chamadas de lipoproteína Lp(a) e proteoglicanos da matriz, contribuindo para o crescimento das SMCs e fibrinólise (ROSS, 1999).
Desta maneira, modificações iniciais aumentam uma espécie de LDL pouco oxidada ou minimamente oxidada sem que ocorra grandes modificações na apo B, esse tipo de LDL possuem atividade pró-inflamatória, podendo recrutar mais monócitos juntamente com glicoproteínas de adesão de moléculas da superfície celular e penetrando as ECs e se transformando em macrófagos (ROSS, 1999).
O LDL minimamente oxidado não possue modificações suficientes para serem reconhecidas pelos receptores removedores dos macrófagos. Ratos com deficiência da enzima 12/15 Lipoxigenase têm uma redução da aterosclerose, sugerindo que esta proteína seja uma fonte importante de espécies reativas de oxigênio (ROS) para a oxidação da LDL.
As lipoxigenases inserem o oxigênio em ácidos graxos polienóicos produzindo moléculas como o ácido hidroperoxieicosatetraenoico (HPETE), que são responsáveis para serem transferidos através da membrana celular para espalhar o LDL extracelular. Uma forte proteção contra a aterosclerose é a lipoproteína de alta densidade denominada HDL, que funciona removendo o colesterol de tecidos periféricos e protegendo com a inibição da oxidação das lipoproteínas (LUSIS, 2000) (figura 5):
2.3 INFLAMAÇÃO
O acúmulo do LDL minimamente oxidado estimula as ECs a produzirem moléculas pró-inflamatórias como citado anteriormente, fatores de crescimento e adesão de moléculas como fator estimulador da colônia de macrófagos (M-CSF) e podem inibir a produção de NO. O NO possue propriedades anti-aterogênicas, provocando a vasodilatação vascular. Outros fatores além da oxidação do LDL influenciam na inflamação como: forças hemodinâmicas, hereditariedade, níveis de atividade física, alterações da coagulação sanguínea, hiperuricemia, etnia, hipercolesterolemia, obesidade, alta concentração sérica de homocisteína, hormônios sexuais, infecção, tabagismo, ferro, álcool, dieta pobre em antioxidantes, HA e diabetes melitos (ALENCAR et al, 2000; LUSIS, 2010; MALLIKA et al, 2007; PINHO et al, 2010; ROBBINS & COTRAN, 2005).
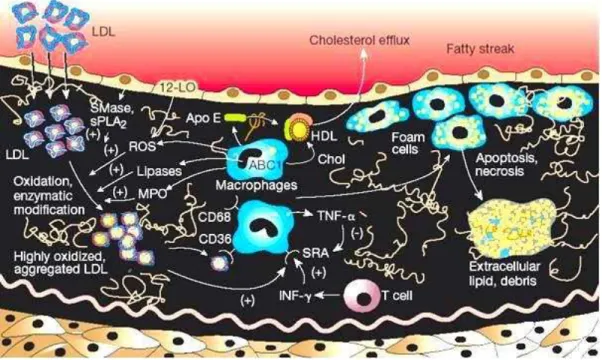
Quando a LDL oxidada ativa as ECs das artérias, ocorre a hiperexpressão de moléculas de adesão como: molécula de adesão vascular-VCAM, ICAM-1 e selectinas P e E. As moléculas de adesão provocam o “rolamento” dos leucócitos na superfície endotelial e penetram na parede vascular atraídos por quimiocinas produzida por macrófagos (proteína quimiotática de monócitos-MCP-1, IL-8 e fatores de crescimento como fator de estimulação de macrófagos- M-CSF). Ao mesmo tempo, há também a liberação de citocinas (Gama interferon-IFNy, Fator de necrose tumoral beta-TNF ) e angiotensina II (que estimula o crescimento de SMCs e a síntese da MEC).
Figura 6: Inflamação. O LDL minimamente oxidado (minimally oxidized LDL) estimula as células endoteliais (EC) a produzirem moléculas de adesão, proteínas quimiotáticas como a proteína quimiotática de monócitos-1 (MCP-1) e fatores de crescimento como o fator de estimulação de colônia de macrófagos (M-CSF), resultando no recrutamento de monócitos à parede do vaso e formando macrófagos. O LDL oxidado também inibe a produção de óxido nítrico (NO) e a expressão de moléculas de adesão leucocitária endotelial (ELAMs). As moléculas de adesão das ECs são importantes no recrutamento de leucócitos [moléculas de adesão vascular (VCAM-1), molécula de adesão de plaqueta do endotélio 1 (PCAM-1), Selectinas- P e E, molécula de adesão intercelular (ICAM-1)]. Existem importantes moléculas de adesão em monócitos como β integrina ( β
integrin), a integrina VLA-4 e PCAM-1. Produtos finais da glicolisação avançada (AGES) são formados nos diabéticos e promovem inflamação por meio de receptores específicos das ECs (LUSIS, 2000).
A ingurgitação de LDL altamente oxidada pelos macrófagos é mediada por um grupo de receptores removedores que reconhecem vários ligantes, como o SR-A e CD-36. A expressão desses receptores removedores é regulada por um fator de transcrição, cujos ligantes incluem ácidos graxos oxidados, e por citocinas como fator de necrose tumoral alfa (TNF-α) e interferon alfa (INF –α) (LUSIS, 2000).
Figura 7: Formação de células espumosas. LDL intensamente oxidada (highly oxidized aggregated LDL) e a formação de células xantomizadas (Foam cells). Agregados de lipoproteínas de baixa densidade (LDL) altamente oxidadas são formados no vaso como resultado da ação de espécies reativas de oxigênio (ROS) e de enzimas como a esfingomielinase (SMase), fosfolipase 2 secretada (sPLA-2), outras lipases e mieloperoxidase (MPO). O agregado de OX-LDL é reconhecido pelos receptores removedores dos macrófagos como o SR-A, CD-36 e CD-38. A expressão dos receptores removedores é mediada por citocinas como TNF-α (Fator de necrose tumoral alfa) e INF- (Gama Interferon). As células xantomizadas secretam apoliproteína E (apo E), que facilitam a remoção do excesso de colesterol. A apoptose das células xantomizadas resulta em uma massa extracelular necrótica e repleta de lipídios (extracellular lipid. depris) (LUSIS, 2000).
2.4 CÉLULAS MUSCULARES LISAS
Caracteriza-se pelo aspecto poliédrico, com grandes núcleos, abundante citoplasma e pela capacidade de migração, proliferação e síntese protéica aumentada. São associados à perda da contratilidade. A SMC sintética é muito difícil de ser diferenciada de fibroblastos, sendo também chamada de miofibroblasto. Como o processo da aterosclerose representa um estímulo para a ativação da SMC sintética vascular, é possível que a dilatação das lesões que possuam células musculares ativadas possa facilitar o desenvolvimento da hiperplasia da íntima e resultando no espessamento da artéria (CARAMORI et al, 1997).
As SMCs sintéticas migram da média para a íntima, onde proliferam e depositam componentes da MEC, transformando estrias gordurosas em ateromas fibrogordurosos e contribuindo para o crescimento progressivo das lesões ateroscleróticas. Diversos fatores de crescimento estão relacionados com essa proliferação como: fator de crescimento derivados de plaquetas- PDGF (liberado por plaquetas aderidas a um foco de lesão endotelial, por macrófagos, ECs e SMCs), fator de crescimento de fibroblastos (FGF) e fator de crescimento tumoral alfa (TGF-α). As SMCs formam células espumosas e moléculas da MEC, como o colágeno, que atua também na estabilização da placa. Contudo, as células imunes e inflamatórias ativadas nas placas ateroscleróticas podem provocar a apoptose das SMCs na íntima (BARNES E FARNDALE, 1999; ROBBINS E CONTRAN, 2005).
A. .B
Figura 8: Fotomicrografias da artéria carótida comum de um suíno, obtidas após angioplastia experimental. Observa-se hiperplasia da íntima por células de núcleo poliédrico (A), que à imuno histoquímica (B) demonstra ser célula muscular lisa. Coloração: Tricrômico de Masson em A e imunoperoxidase para a e g-actina em B. Magnificação original 400x (CARAMORI, et al, 1997).
Dentre a ampla gama de mecanismos envolvidos na formação da placa aterosclerótica, a apoptose tem se destacado, sendo proposto que a associação desse fenômeno com a ativação de processos inflamatórios contribui tanto para o remodelamento vascular como para instabilidade da placa, para ruptura e para a formação de trombos (MARTINET & KOCKX, 2001). A apoptose é um processo de morte celular programada, geneticamente controlada, que ocorre em várias condições fisiológicas e patológicas dos seres humanos. Morfologicamente, nas células apoptóticas ocorrem mudanças estruturais na membrana plasmática, fragmentação do DNA, condensação da cromatina e formação dos corpos apoptóticos, que são fagocitados rapidamente pelas células adjacentes (KOCKX, 1998).
A apoptose funciona como mecanismo de regulação do excesso de proliferação celular durante o desenvolvimento orgânico (SAUNDERS et al, 1966), em macrófagos pode ser benéfica para a estabilidade da placa se os corpos apoptóticos forem removidos. Isso diminuiria a destruição das fibras colágenas. Células apoptóticas não removidas podem ativar a trombina e induzir a trombose, ocasionando a morte do indivíduo. Por outro lado, as lesões constituídas somente por SMCs, apresentam pouca apoptose (< 0,1%). Quando a apoptose ocorre nas SMCs, podem ser prejudiciais por enfraquecer a cápsula fibrosa pela diminuição da síntese de fibras colágenas, contribuindo para instabilidade da placa (LIBBY et al, 1996; MARTINET & KOCKX, 2001). Em termos qualitativos, ainda não se pode determinar com precisão qual o tipo celular que predomina na apoptose (KOCKX, 1998).
Figura 9: Representação esquemática na apoptose em diferentes estágios da aterosclerose. Células musculares lisas (SMCs); Mφ= macrófagos; LP=lipídios; oxlp=lipídios oxidados; proteínas pró-apoptóticas: Bax, Caspases 2,3 e Fas.
A formação de LDL oxidada na parede vascular está associada com a apoptose e com a expressão de proteínas relacionadas à apoptose, tanto em lesões ateroscleróticas iniciais como avançadas. (OORNI et al, 2000). O avanço no conhecimento da fisiopatologia da aterosclerose permitiu identificar a apoptose como uma característica muito importante na formação, progressão e na instabilidade da placa aterosclerótica, mediada por um complexo sistema envolvendo mediadores inflamatórios. A despeito desse conhecimento molecular, as aplicações terapêuticas para modular a apoptose em favor da estabilização ou da regressão da placa ainda não estão bem definidas e a cargo de futuras pesquisas. Por outro lado, as dietas pobres em lipídios reduzem a apoptose e parecem ocasionar benefícios ao alterar a morfologia da placa aterosclerótica. Portanto os dois principais componentes da placa (lipídios e células inflamatórias) medeiam a apoptose e podem acelerar a doença vascular por mecanismo de
“feedback’’ positivo (KOCKX, 1998).
2.6 FATORES DE RISCO PARA ATEROSCLEROSE
1. Idade: Com a idade aumenta o índice de óbitos por cardiopatia isquêmica a cada década, mesmo na idade avançada. A aterosclerose pode ser silenciosa até a meia idade ou posteriormente, quando as lesões arteriais precipitam lesões nos órgãos. Entre as idades de 40 e 60 anos, a incidência de infarto do miocárdio pode aumentar até em cinco vezes (ROBBINS & CONTRAN, 2005).
2. Sexo: Mulheres na idade fértil têm menos chances do que os homens a desenvolver aterosclerose por causa dos estrógenos. Após a menopausa, o risco para as mulheres aumentam, se igualando com os dos homens. Os efeitos protetores dos estrógenos são: aumento da lipoproteína de alta densidade (HDL) e redução do LDL; diminuição da resistência à insulina; redução do fibrinogênio, fator VII e inibidor 1 do ativador do plasminogênio; menor expressão de moléculas de adesão no endotélio; redução da proliferação de SMCs; ação antioxidante. O papel da substituição hormonal da menopausa é controverso, enquanto estudos sugerem ação protetora contra a aterosclerose, estudos randomizados recentes não confirmam tal efeito, até desaconselham essa terapia em idosas ou com DCVs ( ROBBINS & CONTRAN, 2005).
3. Hiperlipidemia: É o fator de risco mais importante para aterosclerose, concentrações elevadas de colesterol no plasma são suficientes para estimular o desenvolvimento de lesões e a progressão das mesmas, mesmo que outros fatores de risco estejam ausentes (ROBBINS & CONTRAN, 2005).
4. Genética: A propensão genética está relacionada com multifatores de risco relacionados, como HA ou diabetes. Com uma pequena percentage de envolvimento de distúrbios genéticos hereditários como a hipercolesterolemia familiar (ROBBINS & CONTRAN, 2005).
5. HA: Homens com idades entre 45 e 62 anos cujas pressões arteriais estão acima de 169/95mmHg possuem cinco vezes mais risco de ter cardiopatia isquêmica do que aqueles com PA de 140/90mmHg ou inferiores. Tanto os níveis sistólicos quanto os diastólicos são importantes para elevar os riscos. Terapias protetoras como o exercício reduz a incidência de doenças relacionadas à aterosclerose, principalmente acidentes vasculares cerebrais e cardiopatia isquêmica.
quais, aliás, melhoram quando o paciente emagrece (DANDONA & ALJADA, 2002; LIBBY et al, 2002 ).
7. Diabete melito: O diabete melito atua nas lesões por diversos mecanismos:
No diabético encontra-se disfunção endotelial com diminuição da síntese de substâncias dilatadoras como NO e prostaglandinas, talvez mediada por radicais livres;
Alterações da MEC; ácidos graxos livres, não-esterificados, alteram a membrana basal dos vasos;
Em diabéticos com hiperinsulinemia, parece que a insulina atua estimulando o crescimento de SMCs;
Aumento da adesividade de plaquetas pela elevação na síntese de tromboxano A2 e redução da prostaciclina;
A hipoglicemia causa ativação de monócitos por meio da estimulação da proteína cinase C;
Muitas vezes os diabéticos também apresentam hiperlipidemia, hipercolesterolemia e/ou HA;
Em diabéticos, os sistemas antioxidantes (incluindo a captação de radicais livres) são menos eficientes, o que significa maior dano causado por radicais livres na parede vascular;
Nos diabéticos, em geral existe predominância de fatores pró-coagulantes que obstruem os vasos;
Resistência à insulina está relacionada a uma elevada fagocitose de LDL oxidada por macrófagos, formando mais células espumosas na lesão endotelial;
Hiperglicemia aumenta a expressão de metaloproteinases em fibroblastos;
Receptores para produtos finais da glicosilação são expressos em placas ateroscleróticas de diabéticos, provocando uma necrose aumentada, maior número de macrófagos, linfócitos T e expressão aumentada de antígenos leucocitário humano (HLA-DR). Esses receptores aceleram ainda mais o processo inflamatório nas placas e aumentam a apoptose de SMCs e endoteliais, sua ativação contribui também p/ ruptura da placa (DANDONA & ALJADA, 2002; LIBBY et al, 2002).
Muitas investigações têm estabelecido que o tabagismo é um fator de risco independente para aterosclerose. Isto tem sido demonstrado em populações distintas. O tabagismo promove o desenvolvimento da aterosclerose por várias vias. Leva a um aumento da oxidação de LDL, aumenta a viscosidade sangüínea, aumenta as concentrações de fibrinogênio e lesa o endotélio. O fumo também está associado com muitas respostas agudas, como o aumento da freqüência cardíaca e a demanda do miocárdio, vasoespasmo coronariano e adesão plaquetária. O risco cardiovascular de fumantes é freqüentemente aumentado devido ao efeito sinérgico entre o fumo e outros fatores de risco como as dislipidemias e HA (FROHLICH et al, 2001).
10.Hiperuricemia: É fator agravante do desenvolvimento de lesões vasculares em hipertensos. Suspeita-se que as moléculas de O2 ativado, que surgem durante a
formação do ácido úrico, possam lesar os vasos (ROBBINS & CONTRAN, 2005).
11. Alterações da coagulação sanguínea: Indivíduos com aumento dos marcadores de fibrinólise e de proteínas de fase aguda como proteína C reativa e IL-6, têm risco aumentado de complicações ateroscleróticas nas coronárias, especialmente ruptura e fissura de placas e trombose (ROBBINS & CONTRAN, 2005).
12. Estresse psicossocial: Multifatores psicossociais têm sido associados a aterosclerose, que atualmente é considerada como o resultado de um processo inflamatório crônico. Há evidências que repetidos estados de estresse psicológico ou estresse psicológico crônico pode induzir a um processo inflamatório crônico que culmina em aterosclerose. Estes eventos inflamatórios, causados pelo estresse, podem ser responsáveis por até 40% de casos de aterosclerose em paciente sem outros fatores de risco já conhecidos (BLACK & GARBUTT, 2002). O estresse psicológico ativa o sistema nervoso simpático, o eixo hipotalâmico-pituitário e o sistema renina-angiotensina e causa a liberação de muitos hormônios como as catecolaminas, corticosteróides, glucagon, hormônio de crescimento, renina e concentrações altas de homocisteína, que induz um aumento da atividade cardiovascular, lesão endotelial e indução das células de adesão de moléculas que recrutam células inflamatórias para a parede das artérias. Uma fase aguda de resposta, similar a aquela associada com inflamação, é produzida também e é caracterizada pela ativação de macrófagos, produção de citocinas e outros mediadores inflamatórios e proteínas de fase aguda, tudo que promove o processo inflamatório (BLACK & GARBUTT, 2002). O estresse também induz a um perfil lipídico aterosclerótico com a oxidação de lipídio e se crônico, um estado de hipercoagulação que pode resultar em trombose arterial e levar a morte. A detecção de células de adesão de moléculas, citocinas e proteínas da fase aguda no sangue são indicadores de uma resposta de fase aguda induzida por estresse e podem ser encontrada no sangue de pessoas assintomáticas indicando uma possível DCV futura (BLACK & GARBUTT, 2002).
aterosclerose nesses indivíduos seja pelo aumento dos radicais livres. Em relação a isso é possível que a menor frequência de DCV em mulheres na idade fértil seja devida à perda periódica de ferro pela menstruação, além do efeito protetor dos estrógenos (ROBBINS & CONTRAN, 2005).
14. Infecção: A infecção pode desencadear a aterosclerose, particularmente a
Chlamydia pneumoniae e o citomegalovírus, ambos possuem ampla distribuição,
podem infectar células da parede dos vasos sanguíneos e demonstram persistência, latência e recorrência de infecção. Podem potencializar os efeitos dos fatores de risco como hipercolesterolemia, por acelerar as vias de inflamação crônica associadas às lesões ateroscleróticas ou por influenciar a resposta das células da parede vascular à lesão. Além disso, infecções extra vasculares podem influenciar o desenvolvimento de lesões ateromatosas e de suas complicações, alterando o metabolismo lipídico sistêmico, ou através da circulação de mediadores inflamatórios. Por exemplo, citocinas pró-inflamatórias como a IL-6, produzidas em resposta a uma infecção remota poderiam promover a ativação de células da parede vascular e leucócitos em lesões preexistentes (ROBBINS & CONTRAN, 2005).
2.7 ASPECTOS MORFOLÓGICOS DOS VASOS SANGUÍNEOS
A arquitetura e a composição celular geral dos vasos sanguíneos são as mesmas em todo sistema cardiovascular. Alguns aspectos da vasculatura mudam de acordo com as necessidades funcionais distintas de cada região, refletindo suas diferentes necessidades. Para suportar o fluxo sanguíneo e o fluxo pulsátil e a pressão sanguínea mais elevada nas artérias, suas paredes são mais espessas do que das veias. A espessura da parede arterial diminui conforme os vasos se tornam menores, mas a proporção entre a espessura da parede e o lúmen aumenta.
fina e tem um papel insignificante nas propriedades mecânicas da aorta (SILVER et al, 2001; ROBBINS & COTRAN, 2005).
Nas artérias de grande calibre ou elásticas são freqüentes a quantidade de lâminas elásticas na média. A túnica média é a camada mais espessa da aorta e é formada por camadas de SMCs organizadas helicoidalmente (JUNQUEIRA & CARNEIRO, 2008). Essas células são encontradas em situações que necessitam de contrações lentas sustentadas ou rítmicas, isentas de controle voluntário. São fusiformes, apresentam um único núcleo com forma alongada ou elíptica de posição central. Os pequenos grupos de células são organizados em feixes por tecido colágeno fino contendo vasos sanguíneos e nervos (STEVENS & LOWE, 1995). Estende-se da parte interna da lâmina elástica interna até a parte externa da lâmina elástica externa. As camadas de SMCs da média, próximas ao lúmen recebem oxigênio e nutrientes por difusão direta a partir do lúmen do vaso, facilitada por orifícios na membrana elástica interna.
Contudo, em vasos médios e grandes, a difusão a partir do lúmen não é adequada para as porções mais externas da média, e, portanto, essas áreas são supridas por pequenas
arteríolas provenientes de fora do vaso (chamadas vaso vasorum, literalmente “vasos dos
vasos”), atravessando-os na metade ou nos dois terços mais externos da média. Essa túnica tem a função de regularizar o fluxo sanguíneo, sendo que os componentes elásticos da aorta permitem que ela se expanda durante a sístole, desta forma armazenando parte da energia de cada batimento cardíaco. No intervalo entre as contrações cardíacas, durante a fase diastólica do ciclo cardíaco, a retração elástica da parede vascular impele o sangue através do sistema vascular periférico. Com o envelhecimento, a aorta perde elasticidade e os grandes vasos não mais se expandem tão prontamente, principalmente quando a PA é elevada. Desta forma, as artérias de indivíduos mais idosos se tornam tortuosas e dilatadas (JUNQUEIRA & CARNEIRO, 1999; ROBBINS & COTRAN, 2005).
até três túnicas. Esses nervos recebem informações do sistema nervoso autônomo simpático para os vasos contraírem-se, modulando o diâmetro da mesma (WILLIAMS et al, 1995; GUYTON & HALL, 1996).
As proteínas fibrosas, elastina e colágeno, são os componentes estruturais-chaves da MEC dos vasos sanguíneos, fornecendo força e elasticidade à aorta, bem como permitindo variações de pressão durante cada batimento (MATSUDA et al, 1989; MATSUDA et al, 1993; JACOB, 2003). As propriedades funcionais dos vasos, particularmente das grandes artérias e veias, são muito dependentes da quantidade absoluta e relativa desses constituintes, e da configuração e quantidade relativa desses constituintes básicos supracitados, que variam no sistema arterial, em motivo das adaptações locais às necessidades mecânicas ou metabólicas.
Estas variações estruturais de um local para o outro ocorrem principalmente na média e na MEC (JACOB, 2003), onde a elastina confere elasticidade e o colágeno atua proporcionando rigidez para a parede das artérias, limitando a extensibilidade. O grau de relação entre as fibras colágenas e elásticas é importante para proporcionar as propriedades mecânicas que o tecido necessita, uma vez que 46% do peso da aorta correspondem a colágeno e 30% a elastina. Alterações na quantidade e qualidade de qualquer um dos constituintes da matriz podem ser determinantes para o desenvolvimento de doenças que afetam diretamente a aorta (CATTELl et al, 1996; SILVER et al, 2001). Diante do exposto, a figura 10, a seguir, ilustra um esquema representativo da parede vascular:
2.8 AORTA
A aorta é a principal artéria sistêmica do corpo na qual o sangue circula centrifugamente em relação ao coração, conduzindo sangue oxigenado para o organismo (WILLIAMS et al, 1995). Possue valiosa função como bomba auxiliar e é o maior vaso elástico distribuidor de sangue oxigenado para os diversos tecidos e órgãos do corpo humano (CATTEL et al, 1996; SILVER et al, 2001).
Divide-se em aorta ascendente, arco da aorta e aorta descendente. A porção da aorta descendente no tórax é denominada de aorta torácica. Em cada parte da aorta surgem vários ramos. A aorta é classificada como uma artéria elástica, de túnica média espessa e constituída, em grande parte, por lâminas do tecido elástico. Esse vaso suporta à pressão sistólica e presidir a retração elástica. Sua elasticidade diminui com o envelhecimento. As paredes da aorta são nutridas por “vasa-vasorum”.
As paredes da parte ascendente da aorta e do arco da aorta possuem presso-receptores, cujas fibras de origem sobem com os nervos vagos até os centros vasomotores do tronco encefálico. Quando são estimulados esses receptores por um aumento da pressão, produzem uma reação reflexa, de queda da PA e da frequência cardíaca (GARDNER et al, 1988).
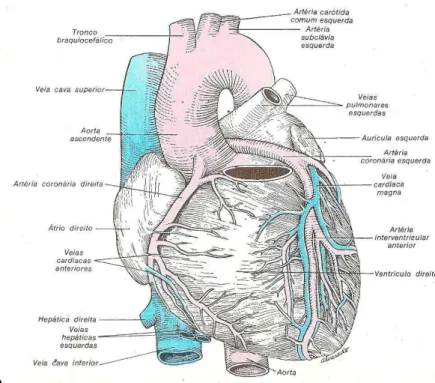
A aorta é classificada como de grande calibre, no adulto a sua parte ascendente tem aproximadamente 3 cm de diâmetro e cerca de 5 cm de comprimento (DANGELO & FATTINI, 1995; WILLIAMS et al, 1995). As artérias, entre as quais, a aorta, possui propriedades morfológicas e mecânicas específicas que contribuem na fisiologia hemodinâmica do sistema arterial. Elas conduzem o sangue sob alta pressão para os tecidos e por isso que são resistentes e flexíveis (GUYTON & HALL, 1996). Elasticidade é a propriedade que apresentam certos corpos de retornar à sua forma primitiva ao cessar a ação que neles produziu uma deformação (FERREIRA, 2005). Essa importante característica das grandes artérias modula a PA (STEVENS & LOWE, 1995). Na aorta essa pressão é pulsátil e está em torno de 100 mmHg (GUYTON & HALL, 1996). Segue abaixo a ilustração da anatomia da aorta ascendente:
A
B
Figura 11. B: Anatomia da aorta ascendente da face diafragmática do coração (HENRY GRAY, 1977).
2.9 DISTRIBUIÇÕES DAS FIBRAS ELÁSTICAS
O principal componente das fibras elásticas é a elastina que é uma glicoproteína estrutural que compõe o sistema elástico da aorta. Diferentes proporções de elastina e microfibrilas promovem características funcionais variáveis de acordo com as necessidades locais dos tecidos (KIELTY et al, 2002). O desenvolvimento da elastogênese ocorre em três estágios hierarquicamente graduais e sucessivos, que possuem funções biomecânicas únicas, essas fibras estão em processo de evolução contínua, partindo da forma da fibra oxitalânica (formada exclusivamente por miofibrilas e sem elastina), para a fibra elaunínica (formada por grande parte de miofibrilas e pouca elastina) e por último a fibra elástica ou elástica madura (formada por grande quantidade de elastina e poucas miofibrilas) (GAWLIK, 1965; COTTA-PEREIRA & IRUELA-ARISPE, 1989).
& BORNSTEIN, 1969; ROSS, 1973). O método de coloração chamado Verhoeff permite o estudo das fibras elásticas maduras. Essas fibras têm função de distensão intensificada, é o elemento responsável pela distensibilidade reversível do tecido conectivo, proporcionando um aumento de até uma vez e meia o seu cumprimento e de retornarem ao seu cumprimento original. São as fibras mais espessas, na microscopia eletrônica possuem diâmetros de 200 a 1000 nm (GAWLIK, 1965; COTTA-PEREIRA & IRUELA-ARISPE, 1989; PANIAGUA et al, 1983).
Os métodos de coloração chamados resorcina de Weigert com prévia e sem prévia oxidação permitem a coloração das fibras eulanínicas. As fibras eulanínicas são menos espessas que as elásticas e mais espessas que as oxitalânicas e têm função de distensão, possuem uma forma tortuosa ou em espiral (GAWLIK, 1965; COTTA-PEREIRA & IRUELA-ARISPE, 1989). As fibras oxitalânicas coram-se pelo método de coloração chamado de Resorcina de Weigert com prévia oxidação por oxona.
Essas fibras possuem função de resistência, estão distribuídas entre as fibras de colágeno e possuem trajeto ondulado. Sua distribuição ocorre em locais ocorre estresse mecânico e servem como uma proteína elástica acessória. Sua ampla distribuição indica que sua função estende além da elastogênese. Apresentam resistência à hidrólise àcida, por isso são denominadas oxitalânicas. Possuem a espessura de 15 a 16 nm e é o primeiro estágio da elastogênese (FULLMER, 1958; GAWLIK, 1965; GOLDEFISHER et al, 1983; COTTA-PEREIRA & IRUELA-ARISPE, 1989).
2.10 DISTRIBUIÇÃO DE COLÁGENO
colágenas são delgadas, desarranjadas e muito espaçadas, e denso quando as fibras colágenas estão compactadas (STEVENS & LOWE, 1995; CATTELL et al, 1996).
Muitas células podem sintetizar o colágeno, como os osteoblastos, EC e SMCs, mas a grande maioria é sintetizada de fibroblastos (JENSEN E HOST, 1997). Existem ao menos 28 tipos de colágeno, que constituem diversos tecidos, sendo a mais abundante proteína do corpo humano. Cerca de 80 a 90% do colágeno que existe na aorta são do tipo I e III, juntamente com pequenas quantidades dos tipos IV, V, VI e VIII. Tipos I, III e VI estão presente nas túnicas intima, média e adventícia e realizam a função mecânica conferindo resistência à tração (BARNES, 1988; CATTELL, 1996).
O colágeno tipo III está associado em particular com a extensibilidade da parede vascular e o colágeno tipo I fornece rigidez arterial. Além do papel mecânico importante para manutenção do tecido, o colágeno proporciona uma ancoragem para as células e exerce uma importante influência na função celular por meio do seu contado com os receptores (BARNES & FARNDALE, 1999).
O colágeno tipo IV ocorre na membrana basal endotelial e circunda a lâmina basal da SMC, o colágeno V está localizado no subendotélio e associado também com a superfície da SMC, o colágeno VI é encontrado entre as fibras colágenas na túnica média e no subendotélio, onde possue importante função como placas de adesão (BARNES, 1988) e o colágeno tipo VIII, que é sintetizado por ECs e por SMCs após a lesão das artérias (BENDECK et al, 1996; MACBEATH et al, 1996; SIBINGA et al,1997).
As SMCs nas placas ateroscleróticas produzem nova matriz constituída de colágeno tipo I, III e V (BARNES, 1988). Essa nova matriz, junto com os constituintes, é responsável pela oclusão do lúmen vascular ocasionado pela placa aterosclerótica. (KOYAMA & REIDY, 1998).
2.11 INTERAÇÃO ENTRE EXERCÍCIO FÍSICO, ARTÉRIA, ATEROSCLEROSE E ENVELHECIMENTO
Muitas pesquisas indicam que os exercícios moderados a intensos estão associados com reduções importantes na incidência de doenças cardiovasculares (DCVs), sugerindo o exercício físico como um importante tratamento não farmacológico na prevenção e prognóstico destas doenças (HAMBRECHT et al, 2000; MANSON et al, 2002). Estudos em seres humanos e em animais de laboratório demonstram que o estresse de cisalhamento (força que o sangue exerce sobre a parede das artérias), induzido pelo exercício físico, é um poderoso estímulo para a liberação de fatores vasorelaxantes produzidos pelo endotélio vascular, como o ON (GOTO et al, 2003). Os efeitos benéficos do exercício regular sobre as DCVs são associados, principalmente, à maior produção de agentes vasodilatadores derivados do endotélio, com conseqüente redução da resistência vascular periférica (RVP), diminuição dos níveis de LDL, e inibição plaquetária. Entre os componentes envolvidos, podemos citar também:
Regressão de lesões na aterosclerose - Estudos demonstraram que o exercício aliado ao controle do colesterol e a dieta de baixa gordura, diminui a progressão ou pode conduzir a regressão das lesões coronarianas em longo prazo (de 4 a 6 anos de exercício) (PINHO et al 2010);
Formação de novos vasos colaterais – Várias pesquisas realizadas em animais demonstram que a diminuição do calibre das artérias coronárias estimula o aparecimento de circulação colateral e que este aumento é intensificado quando os animais são submetidos ao exercício físico (PINHO et al 2010).
Redução da viscosidade do sangue - o exercício regular causa aumento do volume do plasma, além da diminuição de algumas proteínas plasmáticas como o fibrinogênio e globulinas ocasionando a redução da viscosidade sanguínea. (PINHO et al 2010).
Alguns autores demonstram que nunca é tarde para reduzir o risco da aterosclerose e outras DCVs, que mesmo a prática das atividades diárias como: transporte, trabalho, casa, fazer compras e lazer colaboram para reduzir o risco (SILVA et al, 2006; MANSON et al, 1999; DUVERNOY et al, 2006) e diminui o índice de morte em idosas (VAN DAN et al, 2008). Outros estudos como o de Currie et al (2009) demonstram que apenas 6 dias de treinamento de endurance de bicicleta, a 65% do VO2 máx, 6 vezes por semana, durante 2
horas por dia em jovens saudáveis, foi capaz de alterar a rigidez arterial. Em pesquisas também com idosos, mas que praticaram exercícios aeróbios por 33 anos, de 3 a 4 vezes por semana, cada sessão de treinamento consistiu de 61-70 minutos de duração na intensidade de 77 a 84% da frequência cardíaca (FC) de reserva, resultando em baixa perda do Vo2máx, sem
elevação da PA ou da composição corporal (KASCH et al, 1999).
Em homens sedentários jovens, a prática de exercícios físicos aeróbio de baixa intensidade durante 8 semanas, em bicicleta ergométrica a 70% do VO2 máx, de 3 a 4 vezes
por semana, com sessões de 60 minutos cada, pode melhorar a distensibilidade da aorta, mas os efeitos só podem ser mantidos com a prática contínua do exercício (KAKIYAMA et al, 2005). Por outro lado, o sedentarismo causa disfunção endotelial em ratos jovens e saudáveis, pelo qual pode ser completamente reversível por exercícios físicos moderados em um curto período de tempo (SUVORAVA et al, 2004).
A prática regular de exercício físico produz efeitos benéficos agudos e crônicos sobre os fatores de risco de diversas patologias, como a aterosclerose, melhorando o controle glicêmico, a resistência a insulina, dislipidemia, HA e reduzindo o índice de morbidade e mortalidade da população em geral (OKADA et al, 2010).
Em repouso, cerca de 4 a 7 ml de sangue são fornecidos a cada 100g de músculo do corpo. Durante o exercício os músculos necessitam de um fluxo sanguíneo aumentado para atender a demanda de oxigênio, ocorrendo uma vasodilatação local devido à elevação do metabolismo das células musculares, podendo alcançar de 50 a 75 ml por 100g de tecido (MCARDLE et al, 1996). Por outro lado, a ativação do bulbo e as respostas do sistema nervoso simpático elevam o débito cardíaco e a PA, podendo em casos de exercícios intensos, aumentarem o fluxo sanguíneo de 30 a 40%, elevando o dobro e distendendo ainda mais os vasos sanguíneos. O vaso sofre uma alta pressão, mas a sua complacência permite que as fibras musculares se alonguem e a resistência do vaso diminua (BRUM et al, 2004; SILVERTHORN, 2003). Durante o exercício físico ocorre então um aumento do volume sistólico e consequentemente a quantidade de sangue a ser acomodada na árvore arterial a cada batimento cardíaco deverá ser maior.
A contração do músculo esquelético durante o exercício físico comprime os vasos sanguíneos em todo o corpo, conduzindo altas quantidades de sangue dos vasos periféricos para o coração e pulmões, aumentando o débito cardíaco de 5 a 6 vezes. Por sua vez, o aumento do débito cardíaco eleva a PA sistólica e mantém ou reduz a pressão diastólica (FORJAZ et al, 1998), o que aumenta a força que empurra o sangue pelo leito vascular distendendo os vasos. Consequentemente ocorre uma redução da RVP, mas o débito cardíaco aumentado mantém a PA alta.
hipotensão. Sendo que para se obter uma maior hipotensão pós-exercício tem sido sugerindo a prática de exercício aeróbio cíclico, na intensidade leve a moderada e de longa duração. (BRUM et al, 2004).
Ainda que, o exercício físico possa induzir em vasos de grande calibre um aumento da expressão gênica da tropoelastina, um precursor da elastina, que pode influenciar a um remodelamento vascular independe do aumento da PA ocorrido na HA, ajudando positivamente na elasticidade vascular (ALDEN et al, 1991).
O exercício físico influência a homeostase de todo o organismo, não somente dos vasos, pois aumenta a demanda de energia dos músculos exercitados. Como o corpo tem que atender toda essa nova demanda metabólica, além das adaptações vasculares supracitadas o organismo necessita de adaptações fisiológicas que vão também influenciar a função cardiovascular. Essas adaptações cardiovasculares dependem das características do exercício praticado (tipo, a intensidade, a duração e a massa muscular envolvida). Em relação ao tipo de exercício, podemos caracterizar dois tipos principais: dinâmicos e estáticos, sendo que cada um desses tipos vão ocasionar diferentes respostas cardiovasculares (FORJAZ & TINUCCI, 2000).
Nos exercícios estáticos, há uma elevação da freqüência cardíaca (FC), com manutenção ou diminuição do volume sistólico e com um pequeno aumento do débito cardíaco. Entretanto, observa-se uma RVP aumentada, que resultará em alta elevação da PA. Essas alterações acontecem porque a contração realizada na isométrica ocasiona obstrução mecânica do fluxo sangüíneo muscular, o que consequentemente faz com que os metabólitos produzidos se acumulem, acionando quimiorreceptores na atividade nervosa simpática (BRUM et al, 2004).
importante no exercício dinâmico é que quanto maior a massa muscular exercitada, maior será o aumento da FC e menor é a elevação da PA (FORJAZ & TINUCCI, 2000).
Sabendo que as respostas cardiovasculares aos exercícios dinâmicos e estáticos são distintas, na prática, apresentam componentes dinâmicos e estáticos, sendo que essas respostas vão depender da contribuição desses dois componentes. A musculação em intensidade alta, apesar de ser feita de forma dinâmica, apresenta componente isométrico elevado (FORJAZ et al, 2003), apresentando uma resposta cardiovascular parecida com os exercícios estáticos (como o aumento da FC e altíssima elevação da PA), que progride à medida que ocorre as repetições (FORJAZ et al., 2003).
Diversas pesquisas têm sugerido que não exclusivamente o exercício aeróbio proporciona uma melhora no risco de DCVs, mas outros tipos de exercício em geral, como o treinamento resistido. Os exercícios com peso podem apresentar efeitos benéficos como: força muscular, capacidade funcional, bem-estar psicossocial (aumento da auto - estima), além de atenuar os fatores de risco cardiovasculares. Dentre as várias adaptações promovidas pelo treinamento resistido podemos dar ênfase ao aumento na capacidade de realizar atividades do dia-a-dia, o incremento na tolerância ao treinamento aeróbico, a supressão da queda de força associada à idade avançada e a atenuação das respostas cardiovasculares ao esforço.
Porém, alguns estudos com sedentários idosos, observaram um aumento da rigidez das artérias, onde também está igualmente elevada em outras condições patológicas além da aterosclerose, como: resistência a insulina, obesidade, envelhecimento, sedentarismo e diabetes mellitus. Sabendo que, a rigidez vascular proporciona um elevado índice de mortalidade cardiovascular no mundo, algumas pesquisas têm avaliado a complacência e rigidez das artérias com a intervenção do exercício físico, pelo seu forte impacto na saúde (UMPIERRE & STEIN, 2007).