UNIVERSIDADE DE SÃO PAULO
MARIA LEONORA DE CASTRO
COPOLÍMEROS ESTATÍSTICOS BIODEGRADÁVEIS DE
-CAPROLACTONA E L,L-DILACTÍDEO – SÍNTESE,
CARACTERIZAÇÃO E PROPRIEDADES
Tese de Doutorado apresentada ao Departamento de Engenharia Metalúrgica e de Materiais da Escola Politécnica da Universidade de São Paulo para a obtenção do título de Doutor em Engenharia.
São Paulo
MARIA LEONORA DE CASTRO
COPOLÍMEROS ESTATÍSTICOS BIODEGRADÁVEIS DE
-CAPROLACTONA E L,L-DILACTÍDEO – SÍNTESE,
CARACTERIZAÇÃO E PROPRIEDADES
Tese de Doutorado apresentada ao Departamento de Engenharia Metalúrgica e de Materiais da Escola Politécnica da Universidade de São Paulo para a obtenção do título de Doutor em Engenharia.
Área de concentração: Engenharia de Materiais Orientadora: Profa Dra. Wang Shu Hui.
Este exemplar foi revisado e alterado em relação à versão original, sob responsabilidade única do autor e com anuência de seu orientador.
São Paulo, 08 de maio de 2006 Assinatura do autor
Assinatura do orientador
Castro, Maria Leonora de
Copolímeros Estatísticos Biodegradáveis de ε-Caprolactona e L,L-Dilactídeo – Síntese, Caracterização e Propriedades. São Paulo, 2006. 134 p.
Tese (Doutorado) – Escola Politécnica da Universidade de São Paulo. Departamento de Engenharia Metalúrgica e de Materiais.
1. Copolímeros de ε-Caprolactona e L,L-Dilactídeo. 2.
AGRADECIMENTOS
O autor expressa a sua gratidão à Profa Dra Wang Shu Hui pela orientação, paciência e dedicação.
À minha grande família que está sempre presente em todas as minhas realizações e aflições, em especial à minha irmã Rosa e aos meus adorados sobrinhos.
Às amigas e colaboradoras na revisão desta tese Ana Magda e Ângela, pelo carinho e dedicação.
Aos amigos e companheiros de jornada Flávia, Telma, Walker, Shirley, José Carlos, Lili, Isabel, Márcia, Márcio, Tunísia.
Aos amigos Marta, Moacir, Maria Helena e Kazu, pelo carinho e apoio, tão importantes nestes momentos finais.
Aos professores e amigos Jefferson e Paulo do Departamento de Engenharia de Materiais da Faculdade de Engenharia Química de Lorena – FAENQUIL, pela realização das análises de difração de raios-X.
Ao Flávio, do Instituto de Geociências da Universidade de São Paulo, pela realização de algumas análises de difração de raios-X.
À Profa Débora, do Laboratório de Polímeros “Prof. Bernhard Gross” do Instituto de Física da USP de São Carlos, pela realização das análises de cromatografia de permeação em gel.
Ao Prof. Pedro, do Departamento de Engenharia Química da FAENQUIL, pela realização de algumas cromatografias de permeação em gel.
À Profa Luiziana e ao Prof. Gregório, do Instituto de Pesquisas Tecnológicas (IPT), pela orientação e permissão para a realização dos estudos de degradação dos materiais objetos de estudo desta tese; e ao estagiário Jonas pela realização dos ensaios de degradação dos polímeros.
Aos funcionários e amigos Lívio, Danilo, Clélia e aos demais funcionários do Departamento de Metalurgia e de Materiais da USP, que direta ou indiretamente contribuíram para a realização deste trabalho.
O estudo desenvolvido gerou as seguintes publicações:
PUBLICAÇÃO EM REVISTA
CASTRO, M, L.; WANG, S., H. Statistical copolymers of 1,1-lactide and ε-caprolactone. Polymer Bulletin, Berlin, v.51, n.2, p. 151-158, 2003.
PUBLICAÇÕES EM EVENTOS INTERNACIONAIS
CASTRO, M. L.; WANG, S. H. Statistical Copolymers of L,L-Lactide and εεεε
-Caprolactone: Morphology and DynamicMechanical Behavior. In: 40th International symposium on macromolecules, 2004, Paris. Proceedings of 40th International symposium on macromolecules. Paris : IUPAC, 2004. v. 1551. p. 1-2.
ZHAO, L.; CASTRO, M. L.; YUNG, D.; WANG, S. H. Synthesis and characterization of biodegradable triblock copolymers of Poly(lactide-co-caprolactone)-PEG-
Poly(lactide-co-caprolactone). in: pps 2004 Americas Regional Meeting, 2004,
Florianópolis. pps 2004 Americas Regional Meeting Proceedings. São Carlos : ABPOL, 2004. v. 1, p. 533-534.
CASTRO, M. L.; WANG, S. H. Synthesis of copolymers of l,l-lactide and e-caprolactone. In: BIOMAT'03 - 3rd International Congress on Biomaterials, 2003,
CASTRO, M.L.; WANG, S. H. Synthesis of biodegradable polymers and copolymers
of l-lactide and εεεε-caprolactone. In: I SBPMAT - 1st Brazil-MRS Meeting, 2002, Rio de
Janeiro. 1st Brazil-MRS Meeting. Rio de Janeiro : SBPMAT, 2002. v. 1. p. 114.
DRUMOND, W. S.; BRAGATO, M. ; CASTRO, M. L.; WANG, S. H. Synthesis of poly(L-lactic acid) (PLLA) from L-lactide. In: ISNAPOL - International symposium on natural polymers and composites, 2002, São Pedro. 4th ISNAPOL - International symposium on natural polymers and composites, 2002. v. 1. p. 289-294.
PUBLICAÇÕES EM EVENTOS NACIONAIS
SILVA, L.F. ; CASTRO, M. L.; GOMEZ, J. G., C.; ALENCAR, J. N.; WANG, S. H.. Avaliação da biodegradabilidade de copolímeros estatísticos de l,l-lactideo e
e-caprolactona pelo teste de Sturm. In: 8o Congresso Brasileiro de Polímeros, 2005,
Águas de Lindoia. Anais do 8o Congresso Brasileiro de Polímeros. São Carlos : ABPOL, 2005. v. 1. p. 1-2.
CASTRO, M. L.; WANG, S. H.. Synthesis and microstructure characterization of copolymers of l,l-lactide and e-caprolactone. In: 7º Congresso Brasileiro de
RESUMO
ABSTRACT
SUMÁRIO
AGRADECIMENTOS ...i
PUBLICAÇÃO EM REVISTA ...iii
PUBLICAÇÕES EM EVENTOS INTERNACIONAIS ...iii
PUBLICAÇÕES EM EVENTOS NACIONAIS ...iv
RESUMO...v
ABSTRACT ...vi
LISTA DE FIGURAS ...x
LISTA DE TABELAS ...xiv
LISTA DE ABREVIATURAS ...xv
1 INTRODUÇÃO...1
OBJETIVOS ... 3
2 REVISÃO BIBLIOGRÁFICA...4
2.1 Métodos e mecanismos de polimerização e copolimerização...5
2.2 Polimerização do l,l-dilactídeo...6
2.3 Polimerização da ε-caprolactona...9
2.4 Características da copolimerização...11
2.5 Propriedades de biomateriais para a aplicação médica...14
2.6 Degradação dos poliésteres poli(l,l-dilactídeo), poli(ε-caprolactona) e copolímeros...17
2.8 Aplicações dos poliésteres poli(l,l-dilactídeo), poli(ε-caprolactona) e
copolímeros...27
3 MATERIAIS, EQUIPAMENTOS E MÉTODOS...32
3.1 Materiais...32
3.2 Equipamentos...33
3.3 Métodos e Procedimentos...34
3.3.1 Procedimentos experimentais para a síntese dos homopolímeros e copolímeros de ε-caprolactona (CL) e l,l-dilactídeo (LL)...34
3.3.1.1 Polimerização do ε-caprolactona (CL)...35
3.3.1.2 Polimerização do l,l-dilactídeo (LL)...36
3.3.1.3 Síntese dos copolímeros poli(l,l-dilactídeo-co-ε-caprolactona)...37
3.3.1.4 Cálculo dos rendimentos das reações de polimerização...37
3.3.2 Métodos para a caracterização dos homopolímeros e copolímeros sintetizados...38
3.3.2.1 Determinação da massa molar pelo método de viscosidade capilar...38
3.3.2.2 Cromatografia de permeação em gel (GPC)...44
3.3.2.3 Ressonância magnética nuclear de 13C (RMN de 13C)...44
3.3.2.4 Difração de raios-X em altos ângulos (WAXS)...45
3.3.2.5 Análise térmica dinâmico-mecânica (DMTA)...46
3.3.2.6 Calorimetria exploratória diferencial (DSC)...47
3.3.2.7 Avaliação da biodegradação dos copolímeros Co10, Co20, Co40, Co50, Co60 e Co90, segundo teste de Sturm...48
4 RESULTADOS E DISCUSSÃO...50
4.1.1 Efeito da variação da concentração do iniciador (SnOct2) no rendimento das
reações de polimerização do ε-caprolactona e do l,l-dilactídeo...50
4.1.2 Valores das viscosidades intrínsecas e massas molares dos poli(ε -caprolactona) (PCL) e dos poli(l,l-dilactídeo) (PLL) obtidos pelo método de viscosimetria...53
4.1.3 Influência do tempo de reação na polimerização por ciclo adição do l,l-dilactídeo (LL) e da ε-caprolactona (CL)...54
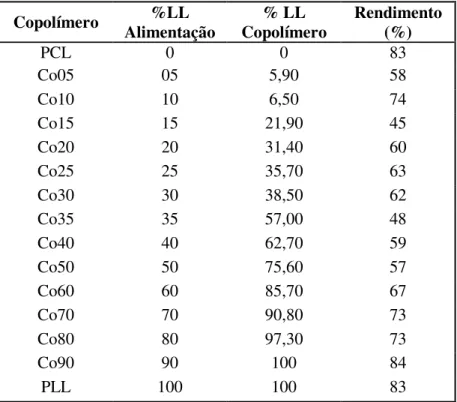
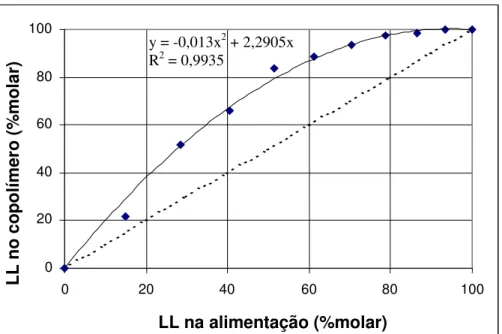
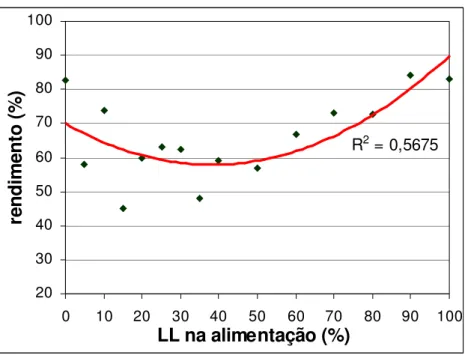
4.2 Efeito da composição na reação de copolimerização...58
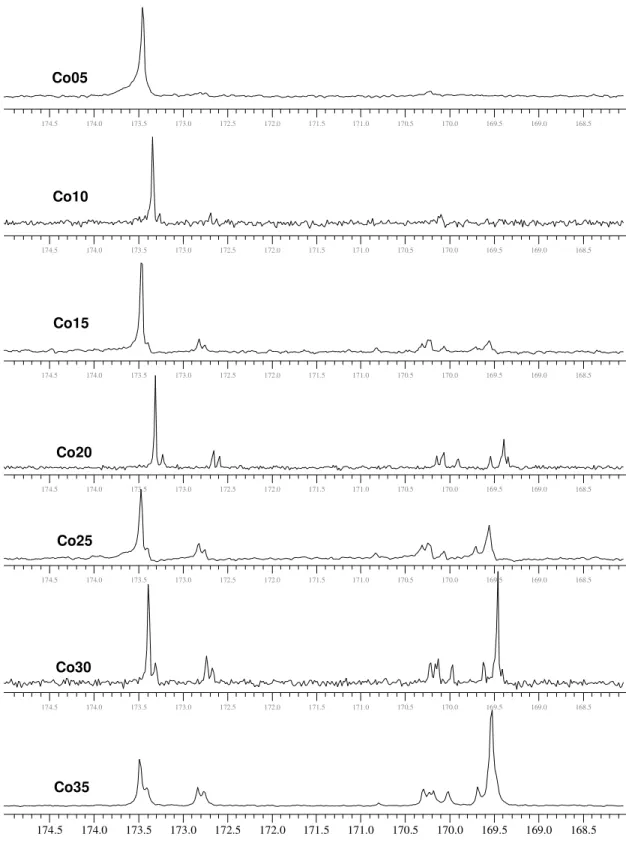
4.3 Análise da microestrutura dos copolímeros de LL e CL...60
4.3.1 Espectroscopia de ressonância magnética nuclear de 13C (RMN de 13C)...60
4.3.2 Análise das massas molares dos copolímeros obtidos por cromatografia de permeação em gel (GPC) e viscosidade de soluções diluídas...83
4.3.3 Resultados das análises por difratometria de raios-X (WAXS)...84
4.3.4 Resultados das análises térmicas dinâmico-mecânicas (DMTA)...91
4.3.5 Resultados das análises por calorimetria exploratória diferencial (DSC)...103
4.3.6 Avaliação da biodegradabilidade dos copolímeros Co10, Co20, Co40, Co50, Co60 e Co90...107
5 CONCLUSÕES...112
LISTA DE FIGURAS
Figura 1.1 Fórmula geral do poli(l,l-dilactídeo-co-ε-caprolactona)... 2
Figura 2.1 Polimerização catiônica do l,l-dilactídeo... 7
Figura 2.2 Polimerização aniônica do l,l-dilactídeo... 8
Figura 2.3 Desprotonação do l,l lactídeo formando íon planar... 9
Figura 2.4 Polimerização catiônica da ε-caprolactona... 10
Figura 2.5 Polimerização aniônica da ε-caprolactona... 10
Figura 2.6 Polimerização por inserção por coordenação da ε-caprolactona... 10
Figura 2.7 Micrografias da degradação do copolímero contendo 50% de dilactídeo (85% L-dilactídeo e 15% D-dilactídeo) e 50% de ε-caprolactona, in vivo, após 3 meses (A) e 4 meses (C).
ϕ
representa o biomaterial e FB representa fragmentos do biomaterial... 16Figura 2.8 Variação do volume (µL) de um copolímero (PLL85CL50) com o tempo e variação da massa molar com o tempo (in vivo)... 23
Figura 2.9 Variação da massa molar (Mw) durante a degradação do copolímero (PLL85CL50) na forma de barras em vivo e na forma de guias de nervos in vitro... ... 23
Figura 2.10 Ilustração esquemática do dispositivo para teste de fadiga do fio de blenda PLL-PCL e do fio de aço inox, simulando a fixação de ossos... 25
Figura 3.1 Esquema do viscosímetro capilar tipo Ubbelohde 108... ... 42
Figura 3.2 Viscosidade inerente e viscosidade específica reduzida em função da concentração da solução de PCL em acetato de etila, para o PCL sintetizado com 0,70%m de SnOct2... 43 Figura 3.3 Sistema para os ensaios de biodegradabilidade pela medida do dióxido de carbono desprendido em sistema aberto... 49
Figura 4.1 Rendimento da polimerização do CL x % mássica do SnOct2... 52
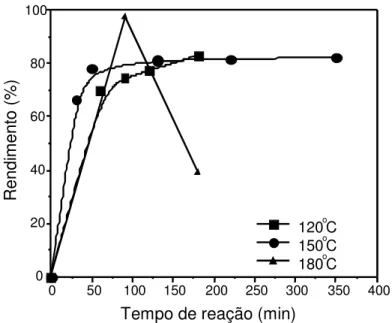
Figura 4.2 Rendimento da polimerização do LL x % mássica do SnOct2... 52 Figura 4.3 Efeito da temperatura e tempo de reação no rendimento da polimerização
do l,l-dilactídeo... ...
Figura 4.4 Massa molar em função do tempo de reação de polimerização do
l,l-dilactídeo... 56
Figura 4.5 Composição do copolímero obtido em função da composição da mistura de mistura de monômeros na alimentação... 59
Figura 4.6 Influência da composição na alimentação dos monômeros no rendimento do copolímero... 60
Figura 4.7 Espectro de RMN de 13C do homopolímero PCL... 61
Figura 4.8 Espectro de RMN de 13C do copolímero Co05... 62
Figura 4.9 Espectro de RMN de 13C do copolímero Co10... 63
Figura 4.10 Espectro de RMN de 13C do copolímero Co15... 64
Figura 4.11 Espectro de RMN de 13C do copolímero Co20... 65
Figura 4.12 Espectro de RMN de 13C do copolímero Co25... 66
Figura 4.13 Espectro de RMN de 13C do copolímero Co30... 67
Figura 4.14 Espectro de RMN de 13C do copolímero Co35... 68
Figura 4.15 Espectro de RMN de 13C do copolímero Co40... 69
Figura 4.16 Espectro de RMN de 13C do copolímero Co50... 70
Figura 4.17 Espectro de RMN de 13C do copolímero Co60... 71
Figura 4.18 Espectro de RMN de 13C do copolímero Co70... 72
Figura 4.19 Espectro de RMN de 13C do copolímero Co80... 73
Figura 4.20 Espectro de RMN de 13C do copolímero Co90... 74
Figura 4.21 Espectro de RMN de 13C do copolímero Co30... 76
Figura 4.22 Espectro de RMN de 13C do copolímero Co60... 76
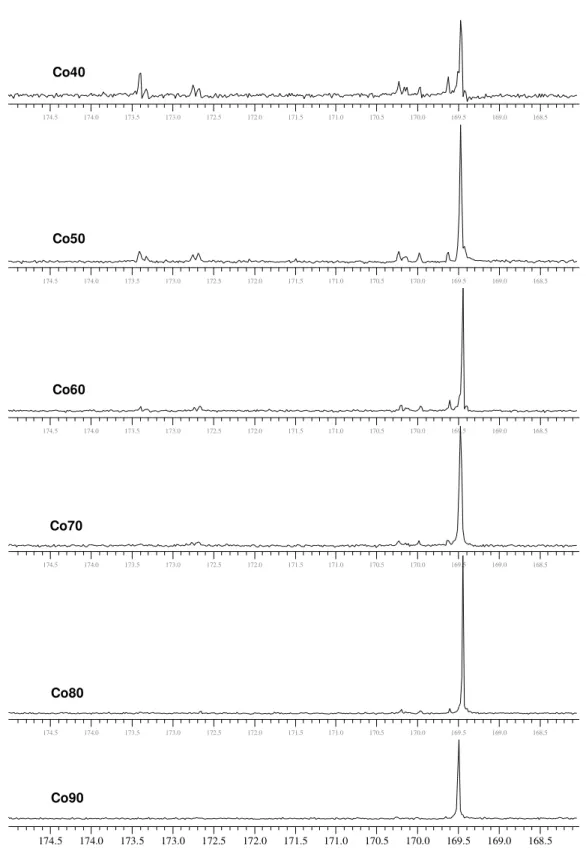
Figura 4.23 Espectros de RMN de 13C do copolímero Co05, Co10, Co15, Co20, Co25, Co30, Co35, na região da carbonila (169-174 ppm)... 78
Figura 4.24 Espectros de RMN de 13C dos copolímeros Co40 Co50, Co60, Co70, Co80 e Co90, na região da carbonila (169-174 ppm)... 79
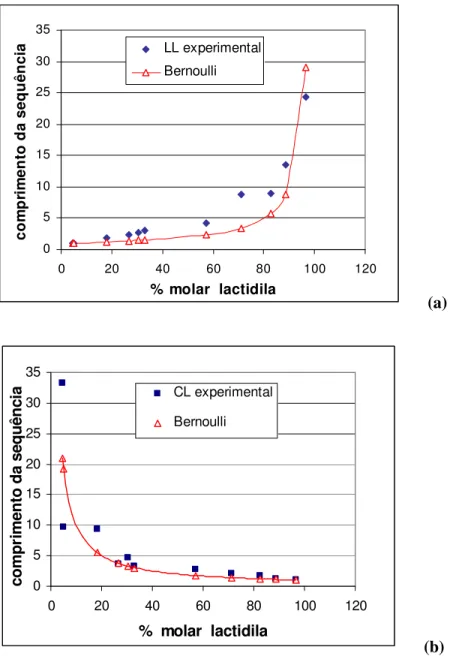
Figura 4.25 Influência da composição do copolímero no comprimento de segmento das unidades de lactidila (♦) (a) e caproíla ( ) (b), e distribuição de Bernoulli ( )... 82
Figura 4.26 Curvas de difração de raios X dos homopolímeros e copolímeros Co 10 ao Co40... 85
Figura 4.27 Curvas de difração de raios X dos homopolímeros e copolímeros Co 50 ao Co90... 86
Figura 4.29 Curvas de difração de raios X dos copolímeros Co30 e Co40... 90 Figura 4.30 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co05... 92 Figura 4.31 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co10... 92 Figura 4.32 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co15... 93 Figura 4.33 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co20... 93 Figura 4.34 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co25... 94 Figura 4.35 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co30... 94 Figura 4.36 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co35... 95 Figura 4.37 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co40... 95 Figura 4.38 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co50... 96 Figura 4.39 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co60... 96 Figura 4.40 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co70... 97 Figura 4.41 Módulo de armazenamento (E’), módulo de perda (E”) e tangente de δ em
função da temperatura do copolímero Co80... 97 Figura 4.42 Tangente δ em função da temperatura dos copolímeros Co05 ao Co25... 99
Figura 4.43 Tangente δ em função da temperatura dos copolímeros Co30 ao Co70... 99
Figura 4.44 Módulo de armazenamento (E’) em função da temperatura do copolímero Co05 ao Co25... 100 Figura 4.45 Módulo de armazenamento (E’) em função da temperatura do copolímero
Co30 ao Co70... 100 Figura 4.46 Módulo de perda (E”) em função da temperatura do copolímero Co05 ao
Co25...
... 101
Figura 4.47 Módulo de perda (E”) em função da temperatura do copolímero Co30 ao Co70...
... 101
Figura 4.48 Curvas DSC do homopolímero PCL e dos copolímeros Co05 ao Co35... 103 Figura 4.49 Curvas DSC dos homopolímeros PCL, PLL e dos copolímeros Co40 ao
LISTA DE TABELAS
Tabela 4.1 Rendimentos dos poli(ε-caprolactona) (PCL) e poli(l,l-dilactídeo) (PLL) sintetizados com o iniciador SnOct2 nas concentrações: 1,30%; 1,00%; 0,70%;0,50% e 0,30%, temperatura de reação de 120 ± 2oC, tempo de
reação de 2 horas e 45 minutos... 51
Tabela 4.2 Valores das viscosidades intrínsecas e das massas molares dos PCL e PLL sintetizados com o iniciador SnOct2 nas concentrações: 1,30%; 1,00%; 0,70%; 0,50% e 0,30%, temperatura de reação de 120 ± 2oC, tempo de reação de 2 horas e 45 minutos... 53
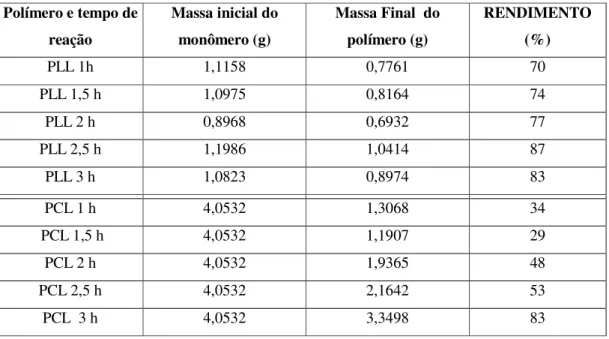
Tabela 4.3 Massas e rendimentos obtidos nas reações de polimerização dos monômeros LL e CL em função do tempo de reação... 55
Tabela 4.4 Composições mássicas na alimentação e nos copolímeros e rendimentos das reações ... 58
Tabela 4.5 Sinais de ressonância da carbonila por RMN de 13C- em ppm... 77
Tabela 4.6 Ressonância da carbonila nos diferentes tríades do copolímero... 80
Tabela 4.7 Massas molares GPC (g/mol) e índice de polidispersidade... 84
Tabela 4.8 Valores de cristalinidade dos homopolímeros e copolímeros sintetizados... 89
Tabela 4.9 Temperaturas dos picos tangente das análises de DMTA... 98
Tabela 4.10 Valores de Tg Tm, ∆Hm, Tc e cristalinidade dos homopolímeros PCL e PLL e dos seus copolímeros... 105
LISTA DE ABREVIATURAS
a Constante de Mark-Houwink para um determinado sistema polímero / solvente / temperatura
CDCl3 Clorofórmio deuterado
CL ε-caprolactona
-CL Caproíla
[CL] Concentração da unidade caproíla
Co Copolímero
Co05 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 5% em massa de
l,l-dilactídeo na alimentação
Co10 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 10% em massa de
l,l-dilactídeo na alimentação
Co15 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 15% em massa de
l,l-dilactídeo na alimentação
Co20 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 20% em massa de
l,l-dilactídeo na alimentação
Co25 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 25% em massa de
l,l-dilactídeo na alimentação
Co30 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 30% em massa de
l,l-dilactídeo na alimentação
Co35 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 35% em massa de
Co40 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 40% em massa de
l,l-dilactídeo na alimentação
Co50 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 50% em massa de
l,l-dilactídeo na alimentação
Co60 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 60% em massa de
l,l-dilactídeo na alimentação
Co70 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 70% em massa de
l,l-dilactídeo na alimentação
Co80 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 80% em massa de
l,l-dilactídeo na alimentação
Co90 Copolímero de l,l-dilactídeo e ε-caprolactona contendo 90% em massa de
l,l-dilactídeo na alimentação
-CO- Carbonila
c Concentração da solução do polímero para o ensaio de viscosimetria
concm PCL Concentração mássica do PCL no copolímero em porcentagem
concm PLL Concentração mássica do PLL no copolímero em porcentagem
DMTA Análise térmica dinâmico-mecânica
DSC Calorimetria exploratória diferencial
E’ Módulo de armazenamento
E” Módulo de perda
GPC Cromatografia de permeação em gel
h Hora
LL l,l-dilactídeo
-LL Lactidila
[LL] Concentração da unidade lactidila
LCL Comprimento médio da seqüência CL LLL Comprimento médio da seqüência LL
LCLB Comprimento médio da seqüência CL calculado por distribuição estatística de
Bernoulli
LLLB Comprimento médio da seqüência LL calculado por distribuição estatística de
Bernoulli
M v Massa viscosimétrica média
min Minuto
M n Massa molar média numérica
M w Massa molar média ponderal
MWD Distribuição de massa molar ou polidispersidade
PLL Poli(l,l-dilactídeo)
PCL Poli(ε-caprolactona)
PET Poli(tereftalato de etileno)
RMN de 13C Espectroscopia de ressonância magnética nuclear de Carbono 13
SEC Cromatografia de exclusão por tamanho
SnOct2 Octanoato de estanho II
t Tempo de escoamento da solução no viscosímetro
to Tempo de escoamento do solvente no viscosímetro
Tc Temperatura de cristalização
Tg Temperatura de transição vítrea
THF Tetra-hidrofurano
TMS Tetrametilsilano
tan_delta = tan tangente de delta, amortecimento, tan_delta = E” / E’
WAXS Difração de raios-X de alto ângulo
∆ ∆ ∆
∆Hm Entalpia de fusão
%CO2 Quantidade mássica de dióxido de carbono desprendido
%LL Quantidade em massa do l-l-dilactídeo
%mol Composição do copolímero em porcentagem molar
oC Graus Celsius
[ηηηη] Viscosidade intrínseca
η η η
ηiner Viscosidade inerente
η η η
ηesp red Viscosidade específica reduzida
θ θ θ
1 INTRODUÇÃO
Os poliésteres degradáveis em processos hidrolíticos e/ou enzimáticos a hidroxiácidos não tóxicos, são usados em medicina como reposição temporária de ossos e/ou elementos de fixação, como fios de suturas e matrizes de encapsulação de drogas de liberação controlada. Os homopolímeros e copolímeros de lactídeos e de ε-caprolactona pertencem a este grupo. As principais vantagens desses poliésteres alifáticos são biocompatibilidade e biodegradabilidade. Os copolímeros de l,l-dilactídeo (LL) e ε-caprolactona (CL) têm sido pesquisados com a finalidade de desenvolver valiosos materiais biodegradáveis para aplicações médicas. Existe também um interesse em poliésteres que possam ser usados em embalagens propensas à desintegração em curto espaço de tempo, após serem depositadas em aterros apropriados.
O poli(ε-caprolactona) (PCL) e o poli(l,l dilactídeo) (PLL) são usualmente sintetizados por polimerização de abertura de anel em massa ou em solução. A síntese de poliésteres por condensação a partir dos correspondentes hidroxiácidos também é possível, mas é muito difícil obter polímeros com alta massa molar e livre de mistura de cíclicos. 1, 2
No presente trabalho de doutorado foram preparados copolímeros estatísticos (Figura 1.1) usando uma extensa faixa de composição na alimentação (5% a 90% de LL), utilizando o octanoato de estanho II (SnOct2) como iniciador, polimerização em massa à temperatura moderada (120 oC) e tempo de reação também moderado (3 horas), a fim de evitar reações de transesterificação.
Figura 1.1 Fórmula geral do poli(l,l-dilactídeo-co- - caprolactona)
Os homopolímeros e os copolímeros estudados neste trabalho foram sintetizados após a definição das melhores condições de reação de polimerização da ε-caprolactona (CL) e do
l,l-dilactídeo (LL), e caracterizados por meio das seguintes técnicas: viscosimetria capilar, cromatografia de permeação em gel (GPC), espectroscopia de ressonância magnética nuclear de Carbono 13 (RMN de 13C), difração de raios X em altos ângulos (WAXS), análise térmica dinâmico-mecânica (DMTA) e calorimetria exploratória diferencial (DSC).
m
)
C
O
O
O
C
O
(
)
(
C
O
OBJETIVOS
Tem sido cada vez mais crescente o interesse e a busca por materiais biodegradáveis, biocompatíveis e que ofereçam propriedades mecânicas e térmicas apropriadas para diversas aplicações, seja como embalagem biodegradável ou nos vastos usos para medicina e engenharia de tecidos. Os copolímeros de ε-caprolactona (CL) e l,l-dilactídeo (LL) têm sido pesquisados para essas finalidades. Porém, não existem na literatura estudos com extensa faixa de composições dos copolímeros de CL e LL (5,90% a 97,30% de LL), correlacionando as propriedades mecânicas, térmicas e a degradação em função da cristalinidade, os quais podem determinar as possibilidades de aplicação desses biomateriais.
Em função da necessidade desse tipo de material, os objetivos do presente trabalho são:
(1) preparar copolímeros de ε-caprolactona (CL) e l,l-dilactídeo (LL) com extensa faixa de propriedades mecânicas,
(2) estudar as suas microestruturas e suas propriedades térmicas e mecânicas, e
2 REVISÃO BIBLIOGRÁFICA
Os poliésteres biodegradáveis sintéticos, como poli (ácido láctico), poli (ácido glicólico), poli(ε-caprolactona) e os seus copolímeros, têm sido sintetizados devido a sua biodegradabilidade desde a década de 70. Os biomateriais derivados do poli (ácido láctico) têm conquistado atenção clínica nos últimos anos devido à sua aceitação em organismos vivos e têm sido usados como elementos de fixação, em materiais para reposição de ossos, como fios de suturas e matrizes de encapsulação de drogas em sistemas de liberação controlada.1,3,4,5, 6, 7, 8
Um exemplo de aplicabilidade consagrada destes poliésteres derivados do poli (ácido láctico) é o poli(dilactídeo), que é um material para fios de sutura utilizado há três décadas, tanto por sua biocompatibilidade como pelas propriedades não imunogênica e não tóxica. A utilização do monômero l,l-dilactídeo tem despertado o interesse da comunidade médica, não só por razões técnicas mas também pela comercial: o monômero tem grande disponibilidade comercial e de fácil síntese em homopolímeros e copolímeros derivados biodegradáveis que, ao se decomporem, geram o ácido láctico presente em todos os animais e microorganismos.3, 9
que a produção de polímeros biodegradáveis será de 10% do total de plásticos a partir de 2010, comparado ao 0,01% produzido em 1996.11
O poli(l,l-dilactídeo) sofre rápida hidrólise mas tem baixa permeabilidade, por outro lado o poli(ε-caprolactona) mostra boa permeabilidade, mas degrada muito lentamente.
As técnicas de copolimerização e blendas têm sido utilizadas com o intuito de combinar a boa permeabilidade do poli(ε-caprolactona) com a rápida biodegradação do poli(l,l-dilactídeo),
para o controle da taxa de degradação e conseqüente liberação da droga, em sistemas de liberação controlada.13, 14, 15, 16
2.1 Métodos e mecanismos de polimerização e copolimerização
Os polímeros poli(ε-caprolactona) (PCL) e poli(l,l-dilactídeo) (PLL) têm sido
usualmente sintetizados por polimerização em massa, solução ou suspensão 17. Em qualquer destas técnicas é utilizado um iniciador organometálico na presença ou ausência de um co-iniciador contendo hidrogênio ativo.
Os compostos orgânicos de metais como estanho18, 19,20,21, alumínio17,18, 22, 23, 24, 25,26, ítrio 27,28, zinco18, 19, 25, 29, 30, 31 , lítio 32 e ferro 33 são catalisadores de metal ativo de baixa toxicidade. Esses catalisadores têm sido incluídos na polimerização e copolimerização do l,l-dilactídeo (LL) e ε-caprolactona (CL) com a finalidade de controlar a microestrutura do
o 2-etil-hexanoato de estanho, conhecido como octanoato de estanho, SnOct2 9, 34, 35, que, além de ser aceito pelo FDA para fins alimentícios e médicos, apresenta solubilidade em solventes orgânicos e monômeros de ésteres cíclicos, facilitando a reação de síntese. 36
Os mecanismos envolvidos na iniciação da reação têm sido sistematicamente estudados e revisados por Kowalski et al. (2000).37 A etapa de propagação de polimerização
dos sistemas lactídeo/lactona-octanoato de estanho II tem sido atribuída ao mecanismo de inserção por coordenação com abertura de anel. 38, 39, 9, 36
Também é possível a realização de sínteses por condensação dos hidroxiácidos correspondentes. No entanto, é muito difícil obter polímeros com alta massa molar e livre de misturas de cíclicos. 1,2
Uma comparação entre as polimerizações em solução e por suspensão foi realizada por Slomkowski et al. (1998)1. Os autores encontraram muitas vantagens na polimerização por
suspensão aniônica em relação a em solução. Dentre estas: as taxas de conversão dos monômeros CL e LL na polimerização em suspensão são de 10 a 20 vezes maior do que para polimerização em solução; a viscosidade é menor e obtêm-se produtos na forma de partículas de tamanhos micrométricos; a distribuição estatística das massas molares é mais estreita e os polímeros obtidos são livres de oligômeros cíclicos.
2.2 Polimerização do l,l-dilactídeo
alternativos, sendo a inserção por coordenação o método industrial usado para a obtenção do poli(l,l-dilactídeo).
A polimerização catiônica é menos atrativa, do ponto de vista industrial ou acadêmico, pois somente ácidos extremamente fortes são capazes de iniciar a polimerização catiônica do l,l-dilactídeo.9 A reação envolve a substituição nucleofílica em carbono quiral com alto risco de racemização do produto. A obtenção de polímeros de alta massa molar é difícil e a polimerização é facilmente terminada por água. 40
O mecanismo de polimerização catiônica, representado na Figura 2.1 9, consiste numa primeira etapa na protonação do oxigênio exocíclico (-C=O). Como conseqüência, a ligação Me-C-O-CH adjacente se torna ativada eletrofílicamente. Em uma segunda etapa (propagação) esta ligação é rompida pelo ataque nucleofílico de um outro monômero l,l-dilactídeo. Este processo se repete durante toda a etapa de propagação até que um nucleófilo monofuncional, por exemplo a água, provoque a terminação da cadeia em crescimento.9, 37, 40
A polimerização aniônica, representada na Figura 2.2 9, é iniciada por alcóxidos de metais alcalinos (metóxido de potássio).9, 40 Ambas as etapas de iniciação e propagação consistem em um ataque nucleofílico de um ânion ao carbono da carbonila (C=O) do l,l-dilactídeo, seguido pela clivagem da ligação CO-O do anel. 41 A polimerização aniônica não apresenta uma etapa inerente de término; em condições ideais chega-se a polímeros vivos e à formação de copolímeros em bloco.
CH3
CH3 O
O
O O + O R O CH O
O C
CH3 CH3
C O CH
O R
Figura 2.2 Polimerização aniônica do l,l- lactídeo 9
Uma das desvantagens da técnica é a possibilidade de ocorrência da desprotonação do monômero l,l-dilactídeo, gerando um ânion lactídeo planar (Figura 2.3). Devido à planaridade do ânion, as reações de protonação/desprotonação podem levar também a produto racêmico. O ânion lactídeo pode também iniciar uma nova cadeia (transferência) gerando como conseqüência massas molares moderadas ou baixas no produto.
CH3 H3C O
O
O O
H
R O
+ HO R +
CH3 H3C O
O
O O
A polimerização por inserção por coordenação, utilizando como catalisador o 2-etil-hexanoato de estanho (Sn(Oct)2), é considerada de particular importância por diversos motivos: (a) permite a união do bloco poli(l,l-dilactídeo) a estruturas pré formadas como, por exemplo, drogas, sorbitol e manitol, formando copolímeros com diferentes estruturas, (b) apresenta alta eficiência: quase total conversão do monômero l,l-dilactídeo é alcançada até mesmo quando a razão monômero/catalisador é alta 104:1, (c) o catalisador Sn(Oct)2 é aceito pela FDA para fins alimentícios e médicos em muitos países, 35, 36, 42 sendo usado em escala industrial (ex. Cargill/ DOW e Purac) para a síntese do poli(l,l-dilactídeo) usado para fabricação de fios de suturas. Além disso, o Sn(Oct)2 apresenta solubilidade em solventes orgânicos e monômeros de ésteres cíclicos, facilitando a reação36, e apresenta baixo custo relativo se comparado com outros catalisadores. 35, 37
2.3 Polimerização da εεεε-caprolactona
Os estudos sobre a polimerização por abertura de anel (ciclo-adição) da ε-caprolactona
(CL) foram concentrados principalmente na determinação de estruturas de centros ativos e nas relações entre as cinéticas de propagação e reações secundárias (como transesterificação inter ou intramolecular). 1
Assim como o l,l-dilactídeo, a ε-caprolactona pode ser polimerizada por processo
-OCCH2CH2CH2CH2CH2-O
O
+
OO II
II
O
Figura 2.4 Polimerização catiônica da εεεε-caprolactona 1
O O II
O
--CCH2CH2CH2CH2CH2-O
II
Figura 2.5 Polimerização aniônica εεεε-caprolactona 1
O
O Sn
Oct Oct
-CCH2CH2CH2CH2CH2-O O
II
_
II
Figura 2.6 Polimerização por inserção por coordenação da εεεε-caprolactona 1
A etapa inicial da polimerização do ε-caprolactona ocorre mais comumente por
2.4 Características da copolimerização
A síntese de copolímeros é mais favorável do que as misturas mecânicas conhecidas como blendas, pois além de combinar as propriedades individuais dos polímeros constituintes, propicia propriedades adicionais ao material por efeito sinergético. A copolimerização gera macromoléculas capazes de se auto-organizar em geometrias periódicas de longa ordem. A ligação covalente entre os blocos pode promover a miscibilidade entre as partes não similares, limitando a separação de fase a dimensões da ordem de 100-400 Angstrons. Essa característica é muito importante para os materiais usados em engenharia de tecidos chamados
de “scaffolds” (tablados ou suportes). 44
A copolimerização representa uma valiosa estratégia para preparar materiais poliméricos com propriedades mecânicas e biodegradabilidades finamente ajustadas com a composição química e cristalinidade. A habilidade de cristalizar dos copolímeros resulta da preservação da simetria, da tacticidade e do comprimento dos segmentos homogêneos formados pelas unidades constituintes.
A microestrutura e arquitetura dos copolímeros sintetizados por polimerização por abertura de anel de ésteres cíclicos resultam de cinéticas e termodinâmica dos sistemas de polimerização, e estão relacionadas com o meio de reação, catalisador, natureza do co-iniciador e temperatura, entre os parâmetros mais importantes da polimerização.8, 19, 22, 23, 29, 45, 46, 47, 48, 49, 50
microestrutura e a influência dos constituintes tornarão possíveis o planejamento de materiais com combinações de propriedades, especificamente materiais biodegradáveis elastoméricos ou materiais termoplásticos flexíveis com alta rigidez e resistência à ruptura.
Kloss et al. (2002)51 e Wang et al. (2003) 52 mostraram a correlação entre composição,
microestrutura e biodegradabilidade para uma série de poli(éster-uretano) contendo diferentes segmentos de poli(ε-caprolactona). Em relação ao comportamento térmico, foi observado que o aumento na proporção do segmento rígido (poliuretano) acarretou o aumento nos valores da temperatura de transição vítrea (Tg) dos polímeros devido ao aumento nas interações hidrogênio. Esse efeito foi mais pronunciado na série de poli(éster-uretano) linear, sendo esse fato atribuído ao maior empacotamento das cadeias lineares em relação às reticuladas, com extensores de cadeia cíclicos, os quais introduzem maior volume livre.
A diversidade de monômeros ésteres cíclicos existentes, (d,l e l,l-dilactídeo,
glicolídeo, tetra metil glicolídeo, ε-caprolactona, δ-valerolactona, γ- valerolactona,
γ-butirolactona, etc), permite a obtenção de uma grande diversidade de homopolímeros e
copolímeros de poliésteres com propriedades versáteis. 3, 53,54
Os monômeros ésteres cíclicos podem ser combinados entre si formando uma grande diversidade de poliésteres com as mais variadas estruturas (bloco, alternado, estatístico) e propriedades, de acordo com as condições reacionais utilizadas (temperatura, tipo de catalisador etc) e/ou com a proporção entre estes monômeros. Duda et al. 50 prepararam
copolímeros em bloco usando os monômeros lactídeo e ε-caprolactona através da polimerização aniônica, utilizando o catalisador Al(oiPr)
mesmos monômeros e o iniciador SnOct2, sintetizaram copolímeros através da polimerização por inserção por coordenação.
Monômeros com grande diferença de reatividade entre si tendem a resultar em estruturas em bloco e, monômeros com reatividades próximas tendem a resultar em estruturas estatísticas. É importante destacar que a reatividade relativa entre os monômeros é diferente da velocidade de homopolimerização. 3
Bero et al. 18 (1993) estudaram a copolimerização do l,l-dilactídeo e ε-caprolactona na presença de iniciadores contendo zinco e alumínio (dietil zinco, trietil alumínio, isopropóxido de alumínio, acetil acetato de alumínio), em solução de clorobenzeno e temperaturas entre 50 a 150oC. Os copolímeros obtidos foram precipitados em hexano e secos a vácuo a 50 oC. As probabilidades de adição do monômero na cadeia polimérica são muito similares utilizando como iniciador o isopropanoato de alumínio (temperatura de reação=150 oC) ou o octanoato de estanho (temperaturas de reação=110 oC e 130 oC). Porém, experimentalmente foi observado que a probabilidade de adição do ε-caprolactona no final da cadeia lactidila (-LL) é
mais baixa do que a probabilidade de adição do dilactídeo ao final da cadeia caproíla (-Cap). Se o final da cadeia polimérica for –LL, a probabilidade de adição do ε-caprolactona é de 2% e a probabilidade de adição do dilactídeo é de 98%. Se o final da cadeia polimérica for –Cap, a probabilidade de adição do ε-caprolactona é de 26% e a probabilidade de adição do
Essa preferência de inserção do –LL na cadeia do copolímero de l,l-dilactídeo e ε
-caprolactona foi observada também por Choi et al. 46
2.5 Propriedades de biomateriais para aplicação médica
As propriedades requeridas aos biomateriais poliméricos para aplicações médicas são similares àquelas requeridas aos outros tipos de biomateriais, ou seja, biocompatibilidade, esterilizabilidade, propriedades físicas e mecânicas adequadas e manufaturabilidade.56
A biocompatibilidade é a aceitação de um implante pelos tecidos vizinhos e pelo organismo de modo geral. O implante deve ser compatível com o tecido em relação à mecânica, química, superfície e propriedades farmacológicas. Os fluídos do corpo podem atuar como solvente para as impurezas da matriz de polímero. Os compostos envolvidos na polimerização e nos estágios de processamento, chamados de monômeros, oligômeros, iniciadores e solventes, podem gerar características morfológicas particulares como cristalinidade ou porosidade, causando toxicidade indesejável devido à baixa liberação ou baixa captação de compostos de baixa massa molar pelo organismo.57
De acordo com Vert et al.58 as reações ao corpo estranho são brandas para os
biomateriais que degradam lentamente, e severas para os biomateriais que degradam mais rapidamente. Den Dunnen et al. 59,60,61,62 estudaram o comportamento de três tipos de
biomateriais in vivo (ratos): um copolímero semicristalino de l,l-dilactídeo e -caprolactona
Após 18 meses de implantação o copolímero semicristalino estava totalmente fragmentado, e após esse período foram observadas muitas células de reações ao corpo estranho (fagócitos) e grande número de nucleação ao redor dos fragmentos do biomaterial. Os fragmentos eram angulares e poligonais, com bordas pontiagudas. Após 24 meses os fragmentos se tornaram menores e arredondados, e as reações ao corpo estranho se tornaram mais brandas. O copolímero amorfo já se encontrava totalmente fragmentado após 4 meses de implantação (Figura 2.7). Durante a degradação a maior parte da massa do biomaterial diminuiu e os fragmentos se tornaram menores. Após 6 meses de implantação foram observados pequenos fragmentos do biomaterial rodeados por células multinucleadas de reações ao corpo estranho. Após 7 meses, os fragmentos e as células multinucleadas desapareceram. No biomaterial não degradável, até 5 meses de implantação as reações ao corpo estranho foram brandas. Após esse período o número de fibroblastos e a quantidade de colágeno na cápsula fibrosa (formada ao redor do biomaterial) aumentaram. Após todos os períodos de implantação (até 8 meses) foram observadas células multinucleadas de reações aos corpos estranhos na interface. Foram observadas células de reações aos corpos estranhos nos copolímeros de degradação rápida e lenta em diferentes períodos de implantação, respectivamente 6 e 18 meses. Segundo os pesquisadores, este fato foi causado não somente pelas propriedades químicas dos biomateriais, mas também pelas propriedades físicas dos fragmentos, como tamanho e formato.
causa alterações nas estruturas moleculares dos polímeros, as quais aparecem como alterações nas propriedades físicas e químicas.63
Figura 2.7 Micrografias da degradação do copolímero contendo 50% de dilactídeo (85%
L-dilactídeo e 15% D-dilactídeo) e 50% de εεεε-caprolactona, in vivo, após 3 meses (A)
e 4 meses (C). ϕϕϕϕ representa o biomaterial e FB representa fragmentos do
biomaterial.64
170 µµµµm
170 µµµµm
17 µµµµm
A maioria dos tecidos vivos estruturais, como ossos, ligamentos, tecidos de ligação, são compósitos macromoleculares. Por isso os compósitos poliméricos sintéticos são atrativos materiais para o desenvolvimento de novos e apropriados biomateriais para reposição, suporte e crescimento ou fixação de tecidos vivos.
2.6 Degradação dos poliésteres poli(l,l-dilactídeo),poli(εεεε-caprolactona) e copolímeros
A condição mais importante para a biodegradação dos sistemas poliméricos é a presença de ligações hidrolisáveis e/ou oxidáveis ao longo da cadeia principal.65 Alguns poliésteres são degradáveis em processos hidrolíticos e/ou enzimáticos a hidroxiácidos não tóxicos. 1 As taxas de hidrólise e biodegradação são dependentes da composição e comprimento de seqüência. Uma complexa combinação desses fatores estruturais determina a morfologia dos compostos poliméricos, com cristalinidade e orientação geralmente retardando a taxa de degradação.65 Marten et al. 66 demonstraram que
o efeito dominante controlador da biodegradabilidade de poliésteres alifáticos é a mobilidade das cadeias do polímero, que está correlacionada com a diferença de temperatura de fusão da fração cristalina do poliéster e a temperatura na qual a degradação ocorre.
Os tipos de microorganismos que degradam o poli(l,l-dilactídeo) (PLL) é limitada no ambiente natural, quando comparado com os microorganismos capazes de degradar outros poliésteres como o poli(ε-caprolactona) (PCL) e o poli(β-hidroxibutirato) (PHB). Dos microorganismos capazes de degradar o PLL foram isolados quatro acnomicetes e quatro bactérias, um dos acnomicetes foi identificado como sendo o Amicolatopsis sp (classe 41). 11
67 Entre essas enzimas a Proteinase-K é mais efetiva e, por isso, é freqüentemente utilizada nos estudos de degradabilidade do PLL e copolímeros.67,68
Segundo Karjomaa et al. 69, os oligômeros de poli(l-ácido láctico) solúveis em água,
com massas molares entre 220 e 550 g.mol-1, biodegradaram numa mistura microbiológica preparada do húmus, a 25 oC e 58 oC, pH 7,5. Enquanto que, os oligômeros cristalinos e hidrofóbicos, com massas molares entre 550 e 2880 g.mol-1, biodegradaram somente a 58 oC. As massas molares médias dos oligômeros decresceram durante a degradação biótica e abiótica, sendo que esse decréscimo de massa molar foi ligeiramente maior na degradação biótica.
Hakkarainem et al. 70 também observou que a presença de microorganismos acelera a
taxa de degradação do poli (l,l-dilactídeo), e que o efeito sinergético de uma mistura de várias culturas de microorganismos aumenta a taxa de degradação, comparado à degradação em culturas puras.
Para Lunt 38 a degradação do poli(ácido láctico) é primeiramente hidrolítica e dependente da temperatura e umidade. Quando a massa molar média do poliéster atinge aproximadamente 10.000 g/mol os microorganismos do solo começam a digerir os oligômeros de ácido láctico, produzindo dióxido de carbono e água. Mas os microorganismos não são eficientes na assimilação do lactídeo cíclico70.
Kasuya et al. 12 estudaram a biodegradabilidade de vários poliésteres alifáticos, dentre
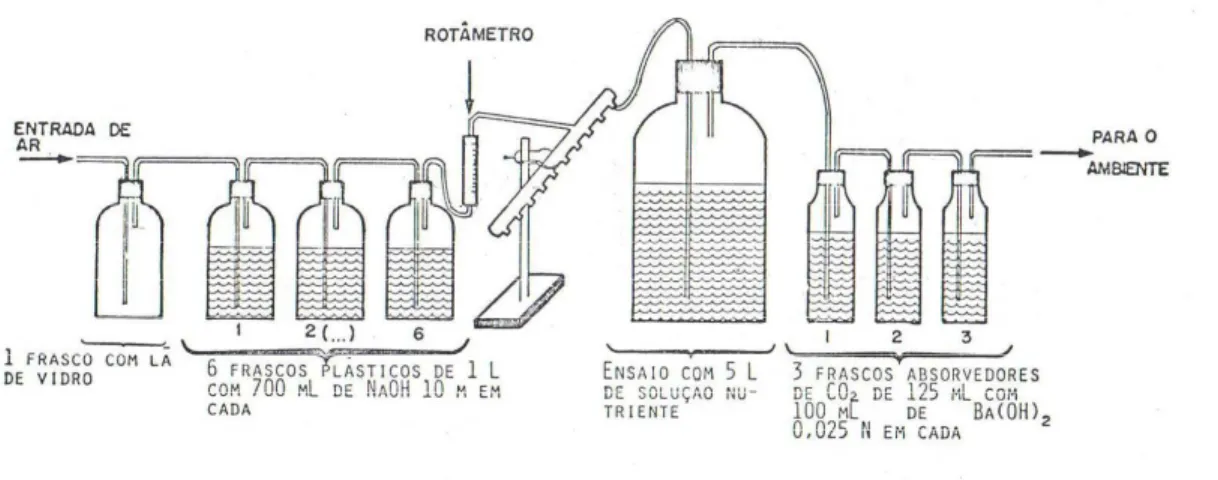
eles o poli(ε-caprolactona), em água natural. Neste estudo foram utilizadas quatro diferentes
(Ibaragi, Japão), e duas de água doce, do rio Arakawa (Saitama, Japão) e do lago Kasumigaura (Ibaragi, Japão). A biodegradabilidade foi avaliada pela alteração da Demanda Bioquímica de Oxigênio (BDO) no decorrer do tempo de exposição, e por perda de massa. As amostras dos poliésteres foram imersas em 200 mL de água natural acrescido de 0,2 mL de uma solução de sais minerais, a 25 oC, por 28 dias. O grau de biodegradação BDO dos filmes de PCL aumentou com o tempo, até cerca de 80 %, com 28 dias de exposição nas amostras de água doce e na água da Baía de Tókio; e a biodegradabilidade por perda de massa nessas águas foi de 100%. Nas águas do oceano Pacífico a biodegradação BDO foi cerca de 60 % e a perda de massa foi de 67 % em 28 dias. Com isso, os autores concluem que os microorganismos capazes de degradar o PCL estão largamente distribuídos em águas doces e águas marinhas.
Alguns tipos de fungos possuem diferentes efeitos na degradação de polímeros, entretanto, existe pouca informação sobre quais tipos de fungos podem acelerar significativamente a degradação de poliésteres alifáticos. Cai et al. 71 estudaram a influência
de dez tipos de fungos na degradação in vitro do PLL e PCL, avaliados pela variação da
viscosidade inerente desses polímeros, antes e após a degradação por 30 dias, na temperatura de 26 ± 1 oC. O Fusarium L023 foi o mais efetivo na degradação do PLL, dentre os fungos
avaliados (Fusarium L023, Geastrum Triples 2167, Polyporous, Fusarium 2138, Stereum 2039 Fusarium L017, Fusarium L037, Fusarium L025, Fusarium L021, Frameters hirsuta
2108). Os fungos não apresentaram o mesmo efeito na degradação do PCL. O Fusarium 2138
mostrou maior atividade na degradação do PCL.
Lostocco et al. 65 estudaram a degradação hidrolítica e a biodegradação de
moniliforme, cujas culturas foram mantidas em dextrose de batata ou em suco de 8 vegetais
-V8 juice agar- (suco V8, CaCO3 e agar). O copoliéster em bloco de poli(ε-caprolactona)
(M w = 43000 g/mol) e l,l-dilactídeo, contendo 65% em peso de PCL, apresentou perda de massa de 13%, após 35 dias de exposição hidrolítica, em solução de 0,1 N NaOH, 37oC. Os autores observaram que a degradação hidrolítica do copoliéster em bloco PLL/PCL foi controlada pela cristalinidade inicial do CL e a composição total, após 5 semanas; e a fase PLL é mais susceptível à cisão da cadeia de forma aleatória. Com relação à biodegradação, o
Fusarium solani (77-2-3) e o Fusarium moniliforme degradaram os copoliésteres com grandes
comprimentos de seqüência de CL (43000), enquanto que com o Fusarium solani (77-102)
não ocorreu degradação. A degradação foi atribuída à atividade cutinase, presente no
Fusarium solani (77-2-3). Entretanto, o Fusarium solani (77-2-3) e o Fusarium moniliforme
não foram capazes de degradar o copoliéster de menor comprimento de seqüência de CL (2000). Os sistemas com tamanhos limitados de domínios de PCL parecem inibir a atividade de degradação do Fusarium.
Alguns pesquisadores observaram que a hidrólise do copolímero em bloco de
ε-caprolactona e d,l,dilactídeo, a 50 oC durante 70 dias, é mais rápida do que a do PCL. O aumento da lactidila acelera a hidrólise. 14, 72 Enquanto que, a perda de massa do copolímero estatístico de ε-caprolactona e l,l,dilactídeo (CL/L=8/92), em solução tampão de fosfato a
37oC, foi mais rápida quando comparada ao PLL, apesar de nenhuma alteração da resistência a tração ter sido observada antes e após a hidrólise. 73
Durante o metabolismo in vivo, o poli-dilactídeo é degradado por hidrólise em ácido
Os poli(lactídeo) industriais são encontrados em duas formas: o poli(l,l-dilactídeo) (PLL) semicristalino e o poli(d,l-dilactídeo) (PDL) amorfo. Recentemente, alguns estudos têm demonstrado que materiais desenvolvidos a partir de polímeros biodegradáveis semicristalino, tais como poli(l,l-dilactídeo) e poli( -caprolactona), são vagarosamente absorvidos e podem levar muitos anos para serem completamente absorvidos pelos tecidos, e por isso podem conferir potencial de carcinogenicidade em longo prazo, devido à exposição do entorno do tecido a uma combinação de efeitos químicos dos produtos primários de hidrólise, de efeitos mecânicos e da reação de imunização devido aos fragmentos poliméricos sólidos. 64, 77,78 Em contrapartida o poli(l,d-dilactídeo) (PDL) amorfo é prontamente degradado em curto tempo e seus produtos desaparecem em duas semanas.78 Porém, algumas complicações, como inchamento e inflamação no tecido, podem ser prevenidos pela incorporação de um
anti-inflamatório como o salicilato nas cadeias poli(l-dilactídeo). É possível polimerizar o l-dilactídeo com o di e tri-salicídeo e usar o ácido salicílico como iniciador da polimerização
do l-dilactídeo ou da copolimerização do l-dilactídeo e -caprolactona. 79
Den Dunnen et al.80 investigaram a degradação em longo prazo de implantes
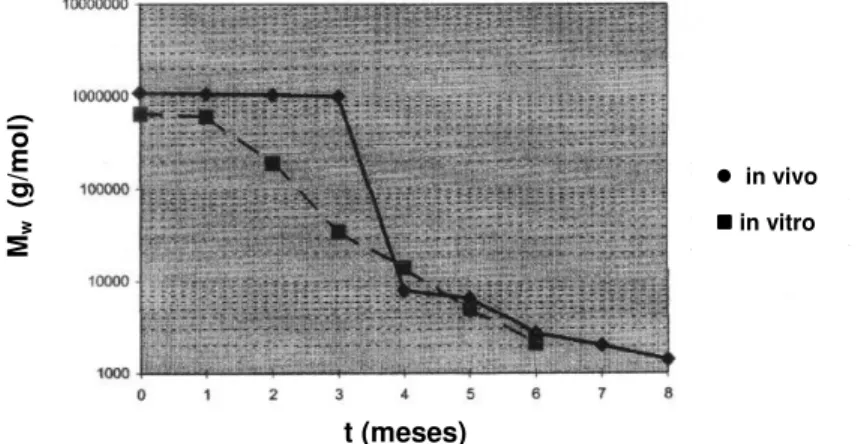
subcutâneos em ratos, de um copolímero contendo 50% de dilactídeo (85% L-dilactídeo e 15% D-dilactídeo) e 50% de ε-caprolactona (PLL85CL50), e as decorrentes reações estranhas ao corpo. Não foram observados fragmentos de biomaterial remanescentes após 12 meses de implantação do biomaterial. Os pesquisadores observaram que a degradação do PLL85CL50 é caracterizada pelo inchamento do polímero em degradação até 3 meses; após esse período ocorreu um decréscimo de volume desse polímero. O inchaço é causado pela absorção de água pelo polímero em degradação, se tornando opaco. O polímero se torna novamente transparente depois de seco. In vitro, após 60 dias, foi observada a perda de 7% da massa
relativamente lenta, embora o volume do biomaterial aumente para um máximo depois do tempo de implantação de 3 meses. Após esse período o biomaterial permanece inchado e opaco (ainda contém água), mas o volume decresce rapidamente. Numa segunda fase (6 meses) a degradação é relativamente rápida e caracterizada por fagocitose e/ou reabsorção do copolímero degradado pelas cápsulas fibrosas (formadas ao redor do implante). A massa molar (Mw) permanece igual à massa inicial, 1.106 g/mol, até o período de 3 meses de implantação. Após esse período a degradação aumenta (segunda fase) e, após 4 meses de implantação a Mw decresce para 8000 g/mol. Esse rápido decréscimo na Mw corresponde ao rápido decréscimo de volume após 3 meses de implantação. Em todo o período de investigação (12 meses) não foram observados fragmentos do biomaterial. O procedimento de degradação do copolímero PLL85CL50, observado por den Dunnen et al. 80 e descrito acima, está representado na Figura 2.8. Nesse estudo foi observado que a maior parte do biomaterial degradou após 6 meses de implantação; menos de 5% do volume do biomaterial implantado não degradou após esse período. Não foi observada cristalização dos copolímeros amorfos durante a degradação. Após 8 meses foram observados os primeiros monômeros e dímeros do processo de degradação.
V
o
lu
m
e
(µµµµ
L
)
M
as
sa
m
o
la
r
(g
/m
o
l)
Fase 1 Fase 2 Fase 3
tempo (meses)
Figura 2.8 Variação do volume (µµµµL) de um copolímero (PLA85CL50) com o tempo, e
variação da massa molar com o tempo (in vivo). 80
Ao contrário do que acontece com o material in vivo, a perda de massa e o decréscimo
da massa molar (Mw) ocorreram de modo constante durante a degradação do material in
vitro, como mostrado na Figura 2.9.
Mw
(
g
/m
o
l)
t (meses)
in vivo in vitro
Figura 2.9 Variação da massa molar (M w) durante a degradação do copolímero
(PLL85CL50) na forma de barras in vivo e na forma de guias de nervos in
Jeong et al. 81 também compararam a degradação in vitro e in vivo do copoliester poli
(l,l-dilactídeo-co-ε-caprolactona), na proporção molar 50:50. As amostras tubulares e porosas
(90% de porosidade) impregnadas com células de músculo liso foram implantadas sub-cutâneamente em ratos por 15 dias, para o monitoramento da degradação in vivo. O mesmo
copoliéster foi degradado in vitro em solução de fosfato. Todas as amostras tubulares
(scaffolds) degradaram lentamente in vivo e in vitro, mesmo em membranas finas e altamente
porosas. Porém, a degradação in vivo foi mais rápida do que a degradação invitro, fato este
atribuído à atuação das enzimas.
Vandamme et al. 82 demonstraram que a degradação do poli(ε-caprolactona) in vivo foi
mais rápida do que a degradação in vitro, em animais ruminantes. A rápida degradação foi
atribuída à presença de ácidos e bactérias nos estômagos desses tipos de animais.
2.7 Propriedades dos poliésteres poli(l,l-dilactídeo), poli(εεεε-caprolactona) e copolímeros
Em muitos aspectos as propriedades básicas do poli-dilactídeo (PLL) encontram-se entre as do poliestireno (PS) e as do poli(tereftalato de etileno) (PET). O PLL apresenta as seguintes propriedades: módulo de flexão maior que o do PS; resistência a alimentos gordurosos e produtos de lacticínios equivalente ao do PET; é excelente barreira de aroma e sabor; pode ser facilmente lacrado por aquecimento; para filmes amorfos a claridade e o brilho excedem o PET, OPP e OPET; a alta energia de superfície permite facilidade de impressão. 38
Viljanmaa et al.83 observaram boas propriedades adesivas em baixa temperatura
molar 81/19, comparado ao convencional não biodegradável poli(etileno-co-vinilacetato) (EVA). A adesão inicial com os materiais testados foi excelente e devido à baixa temperatura vítrea (Tg), o comportamento em baixa temperatura, especialmente com materiais de embalagem não porosos, é melhor do que com o EVA. A baixa temperatura retarda a indesejável degradação durante o tempo de estocagem de embalagens de alimentos congelados. Entretanto, a estabilidade pode ser aumentada por tratamento com peróxido ou anidrido acético. 84
Hattori et al. 85 observaram que a resistência à fadiga de fios de blenda de poli(l-ácido
láctico) e poli(ε-caprolactona), usados para fixação de fraturas ósseas, foram maiores do que a de fio de aço inoxidável. O teste de resistência à fadiga consistiu em amarrar as amostras num dispositivo e aplicar sucessivamente uma carga de 200 g na ponta das amostras amarradas com o fio de blenda PLL e PCL e com o fio de aço inoxidável, como mostra a Figura 2.10. O fio de PLL também foi testado.
Figura 2.10 Ilustração esquemática do dispositivo para teste de fadiga do fio de blenda
PLL-PCL e do fio de aço inox, simulando a fixação de ossos. 85
BLENDA PLL-PCL
FIO AÇO INOX AMOSTRA
As pontas do fio de aço inox foram torcidas para a fixação da amostra no dispositivo e o fio da blenda de PLL e PCL foi amarrado e o nó foi fundido, para evitar que o nó se desfizesse. O fio de PLL foi somente amarrado sem a fusão do nó, devido à alta temperatura de fusão do poli (ácido láctico). O fio de aço inox rompeu antes de 25.000 ciclos de ensaio, enquanto que o fio da blenda de PLL e PCL não rompeu e mostrou ligeira perda do nó mesmo depois de 50.000 ciclos. O fio de PLL desamarrou imediatamente após iniciar o teste. 85
A resistência à tração de um copolímero contendo 50% de dilactídeo (85% l,l-dilactídeo e 15% D-dilactídeo) e 50% de ε-caprolactona foi avaliada após diferentes períodos de degradação, após implante subcutâneo em ratos. A resistência à tração decresceu de 2,5 MPa (tempo 0) para 0 MPa após o período de degradação de 2 meses. 80
Rich 86 observou que a adição de compostos com pequena massa molar não afeta a cristalinidade do copolímero, exceto no copolímero P(CL95/LA5), onde a entalpia de fusão aumentou em 9%. Alguns compostos como lidocaina adicionada ao copolímero P(CL10/LA90) abaixa significantemente a temperatura de transição vítrea do copolímero (Tg), atuando como um plastificante da matriz. Enquanto outros compostos, como hidrocloreto de propanolol e teofilina, não alteram a Tg do copolímero. 86,87
Tylor et al. 88 estudaram a toxicidade dos produtos acumulados de degradação de
alguns polímeros bioabsorvíveis in vitro, como o PLL, o PCL, o poli (ácido glicólico), dentre
2.8 Aplicações dos poliésteres poli(l,l-dilactídeo), poli(εεεε-caprolactona) e copolímeros
Os materiais biodegradáveis têm vastas aplicações em embalagens, adesivos a quente, em sistemas de liberação controlada de drogas, na regeneração e/ou substituição de tecidos (na chamada engenharia de tecidos), na fixação óssea em fraturas e até mesmo no tratamento de lipodistrofia facial associado ao HIV e preenchimento de rugas e cicatrizes.
Segundo Lunt 38, em breve, produtos de poli(l,l-dilactídeo), tais como filmes flexíveis para usos em cozinha e biosacolas de lixo, revestimentos de latas e aplicações em gramado, estarão disponíveis no mercado. Muitos outros produtos estão em desenvolvimento, incluindo recipientes termicamente conformados, papéis recobertos e artigos moldados por injeção.
Tártaro et al. 89 investigaram o uso de placas e parafusos de poli (ácido láctico) na
fixação óssea em fraturas de mandíbulas, não sendo observado nenhuma complicação nos pacientes.
significativo na espessura da pele (até 10 mm). Este produto foi aprovado inicialmente na Europa com o nome de New-FillR e tem sido utilizado na correção de rugas e cicatrizes. 90
Darney et al.91 investigaram o uso de cápsulas de caprolactona contendo
levonorgestrel em implantes contraceptivo subcutâneo.
seleção desses biomateriais, o tempo de degradação é fundamental para o sucesso do implante.
Den Dunnen et al. 80 investigaram o uso de copolímero de L-dilactídeo, D-dilactídeo e ε-caprolactona (50% de dilactídeo e 50% de ε-caprolactona - 85% L-dilactídeo e 15%
d-dilactídeo) como biomaterial para reconstituição de nervos periféricos. A reconstrução de nervos periféricos pode ser conseguida com o uso de um guia para a regeneração de nervos. Os biomateriais utilizados para guia de nervos, além de biocompatíveis, devem ser flexíveis, semi-permeáveis, e de fácil aplicação em microcirurgia. Um guia de nervos deve também ser transparente, para permitir a observação precisa do local do nervo em regeneração, por meio de telescopia. A semi-permeabilidade das paredes do guia de nervos tem efeito positivo na regeneração do nervo. Após cumprir as suas funções, os guias de nervo devem degradar. O copolímero [50/50 (85/15 L/D)LA/ε-CL] degradou completamente em 1 ano sem a formação de fração cristalina de baixa degradação. O copolímero [50/50 (85/15 L/D)LA/ε-CL]
entumece durante a degradação, aumentando de volume, especialmente durante os primeiros 3 meses. Isto pode ter uma influência negativa na regeneração do nervo, fazendo com que o copolímero [50/50 (85/15 L/D)LA/ε-CL] possa ser usado somente em situações clínicas para regeneração de pequenas fissuras (alguns mm) em nervos pequenos, como, por exemplo nervos digitais.
Kellomaki et al. 100 estudaram o uso de membranas de compósitos bioabsorvíveis do
copolímero de ε-caprolactona e l-ácido láctico (50/50) e malhas de poli (96% l-, 4% d-dilactídeo), com esferas cerâmicas bioativas (osteocondutividade), como materiais
Hattori et al. 85 desenvolveram uma nova técnica para fixação de ossos, utilizando fios
de blenda de poli (l-ácido láctico) e poli (ε-caprolactona) com as pontas fixadas por
fusão do nó.
Outro tipo de aplicação do copolímero poli(l-dilactídeo-co-ε-caprolactona) foi observada quando o copolímero, na razão molar de 50/50, foi utilizado para aumentar a compatibilidade de blendas de poli(l-dilactídeo) (PLL) e poli(-ε-caprolactona) (PCL), aumentando assim a compatibilidade entre esses dois polímeros semi-cristalinos. A adição do copolímero poli(l-dilactídeo-co-ε-caprolactona) suprimiu a cristalização do PLL na sua
temperatura de cristalização (Tc) e induziu a cristalização concorrente entre o PLL e o PCL.101
Lemmouchi et al. 102 investigaram o uso de copolímeros de ε-caprolactona e d,l-dilactídeo nas proporções molares CL/DLLL 80/20, 85/15 e 90/10, em liberação
controlada de medicamentos para tripanosomíase, uma doença que acomete freqüentemente animais domésticos africanos. Em prévios experimentos in vivo (coelhos e gado), usando
bastões de copolímero com a droga, foi observada reação inflamatória no local do implante devido à rápida liberação da droga na primeira semana após a implantação. Para evitar essa explosão inicial de liberação da droga os bastões com a droga foram recobertos com copolímero e as reações do tecido foram significantemente reduzidas após a implantação. Foram investigados os efeitos da composição do copolímero, massa molar, polímero de recobrimento dos bastões dos copolímeros e da espessura do recobrimento dos bastões na liberação das drogas: brometo de etídio (EtBr) e cloreto de isometamídio (IMM). A liberação do IMM in vitro dos copolímeros biodegradáveis poli(ε-caprolactona-co-d,l-dilactídeo) é
liberado em 10 dias. A taxa de liberação do IMM depende da espessura de recobrimento dos bastões, da concentração da solução tampão utilizada e da força iônica dessa solução. Em todas as situações a liberação do IMM foi mais rápida do que a liberação do EtBr. No caso do EtBr a taxa e duração de liberação da droga podem ser ajustadas pela composição do copolímero, do polímero de recobrimento, a massa molar do copolímero, a espessura de recobrimento e a geometria. A liberação do EtBr é mais rápida em copolímero de menor massa molar: a permeabilidade da droga é maior e a degradação da matriz polimérica é mais rápida, resultando em rápida liberação da droga. A liberação do EtBr é governada por difusão, nos primeiros estágios, e por perda de massa da matriz nos últimos estágios do processo de liberação.
Pignatello et al. 103 investigaram o uso de nanosuspensão de um polímero
3 MATERIAIS, EQUIPAMENTOS E MÉTODOS
A seguir são descritos os materiais e equipamentos empregados, o procedimento experimental das reações de polimerização e os métodos para a caracterização dos homopolímeros e copolímeros sintetizados.
3.1 Materiais
Os materiais utilizados no presente trabalho não sofreram nenhum tipo de tratamento ou purificação prévia. Os reagentes e solventes utilizados eram de grau puramente analítico (PA). A parte experimental desta tese foi realizada com a utilização dos seguintes reagentes e solventes:
- Acetato de etila; grau analítico; Procedência: Synth - Acetona (propanona); grau analítico; Procedência: Synth
- ε-caprolactona (oxi-1oxo-hexametileno); Procedência: Aldrich; grau de pureza 99%;
densidade = 1,030 g/cm3.
- Clorofórmio (triclorometano); grau analítico; Procedência: Synth - Hexano; grau analítico; Procedência: Synth
- l,l-Dilactídeo (3,6 dimetil-1,4 dioxano- 2,5 diona); Procedência: Aldrich; ponto de fusão 116-119 °C; grau de pureza 98%, densidade = 1,251 g/cm3.
- Metanol; grau analítico; Procedência: Synth
3.2 Equipamentos
Além dos equipamentos comuns usados nos laboratórios de pesquisa, foram utilizados os seguintes equipamentos:
- Câmara “glove-box” (uma câmara de acrílico com luvas de borracha totalmente
vedada à entrada de ar externo, com entrada para gases inertes), projetada e fabricada para a execução deste trabalho.
- Calorímetro exploratório diferencial - DSC 50 da Shimadzu, pertencente ao Instituto de Pesquisas Energéticas e Nucleares – IPEN – CNEN/SP.
- Cromatógrafo Líquido Agilient 1100, pertencente ao Instituto de Física da USP de São Carlos.
- Difratômetro de Raios X ISO-DEBYEFLEX 1001 da Seifert & Co (40 kV, 30 mA), pertencente ao Departamento de Engenharia de Materiais da Faculdade de Engenharia Química de Lorena – FAENQUIL.
- Difratômetro de Raios X da SIEMENS D 5000 (20 kV, 5 mA), pertencente ao Instituto de Geociências da Universidade de São Paulo.
- Analisador térmico dinâmico-mecânica - DMTA-VI da Rheometrics Scientific - Espectrômetro de Ressonância Magnética Nuclear Bruker de 200 MHz, pertencente à