ESTUDO DA EXPRESSÃO IMUNOISTOQUÍMICA DA PROTEÍNA
GALECTINA-3 ASSOCIADA À
β
-CATENINA E CICLINA D1 EM
CARCINOMA ADENÓIDE CÍSTICO E ADENOCARCINOMA
POLIMORFO DE BAIXO GRAU DE MALIGNIDADE DE GLÂNDULAS
SALIVARES
Estudo da expressão imunoistoquímica da proteína galectina-3
associada à
β
-catenina e ciclina D1 em carcinoma adenóide cístico
e adenocarcinoma polimorfo de baixo grau de malignidade de
glândulas salivares
Tese apresentada à Faculdade de Odontologia da Universidade de São Paulo, para obter o título de Doutor, pelo Programa de Pós-Graduação em Odontologia.
Área de Concentração: Patologia Bucal
Orientadora: Profª. Drª. Suzana Cantanhede Orsini Machado de Sousa
Catalogação-na-Publicação Serviço de Documentação Odontológica
Faculdade de Odontologia da Universidade de São Paulo
Ferrazzo, Kívia Linhares
Estudo da expressão imunoistoquímica da proteína galectina-3 associada à ß-catenina e ciclina D1 em carcinoma adenóide cístico e adenocarcinoma polimorfo de baixo grau de malignidade de glândulas salivares / Kívia Linhares Ferrazzo; orientador Suzana Cantanhede Orsini Machado de Souza. -- São Paulo, 2008.
86p. : fig., tab., graf.; 30 cm.
Tese (Doutorado - Programa de Pós-Graduação em Odontologia. Área de Concentração: Patologia Bucal) -- Faculdade de Odontologia da Universidade de São Paulo.
1. Adenocarcinoma – Marcação imunoistoquímica nuclear 2. Patologia Bucal
CDD 617.63 BLACK D61
AUTORIZO A REPRODUÇÃO E DIVULGAÇÃO TOTAL OU PARCIAL DESTE TRABALHO, POR QUALQUER MEIO CONVENCIONAL OU ELETRÔNICO, PARA FINS DE ESTUDO E PESQUISA, DESDE QUE CITADA A FONTE E COMUNICADA AO AUTOR A REFERÊNCIA DA CITAÇÃO.
São Paulo, ____/____/____
Ferrazzo KL. Estudo da expressão imunoistoquímica da proteína galectina-3 associada à -catenina e ciclina D1 em carcinoma adenóide cístico e
adenocarcinoma polimorfo de baixo grau de malignidade de glândulas salivares [Tese de Doutorado]. São Paulo: Faculdade de Odontologia da USP; 2008.
São Paulo, ____ / ____ / 2008
Banca Examinadora
1) Prof(a). Dr(a).
Titulação:____________________________________________________________ Julgamento:______________________ Assinatura:__________________________ 2) Prof(a). Dr(a).
Titulação:____________________________________________________________ Julgamento:______________________ Assinatura:__________________________ 3) Prof(a). Dr(a).
Titulação:____________________________________________________________ Julgamento:______________________ Assinatura:__________________________ 4) Prof(a). Dr(a).
Titulação:____________________________________________________________ Julgamento:______________________ Assinatura:__________________________ 5) Prof(a). Dr(a).
Ao meu marido Vilmar,
Essa conquista é fruto do seu apoio e incentivo constantes. Obrigada pelo amor e pela amizade.
À minha filha Bruna,
Sei que muitas vezes estive ausente e sinto muito por isso... Por não ter tido mais tempo para brincar com você, assistir a seus filmes prediletos, jogar conversa fora, enfim, ser uma mãe mais presente. Agradeço a você pela compreensão e, apesar de tão jovem, pela sua grande responsabilidade.
Ao meu pai Linhares e irmãos Morgana, Ronaldo e Ricardo, aos meus primos Daisy, Joaquim e Fernando e aos meus Amigos...
Ao Senhor Deus por estar sempre comigo em todos os momentos e por ter me ajudado a chegar até aqui.
À Professora Dra. Suzana Cantanhede Orsini Machado de Sousa, Professora Titular da Disciplina de Patologia Bucal da FOUSP e minha orientadora, agradeço pelos conhecimentos transmitidos desde o mestrado, pela disponibilidade para orientação e pela oportunidade de desenvolver este e outros trabalhos que me permitiram crescer profissionalmente e ingressar na carreira acadêmica.
Ao Professor Dr. Décio dos Santos Pinto Jr., Professor da Disciplina de Patologia Bucal da FOUSP, pela ajuda e sugestões na elaboração do projeto de pesquisa que deu origem a este trabalho, pela disponibilidade e por todos os ensinamentos transmitidos.
À Professora Titular Dra. Marina Helena Cury Gallottini de Magalhães e aos demais Professores da Disciplina de Patologia Bucal da FOUSP, Dra. Andrea Mantesso, Dr. Fábio Daumas Nunes, Dra. Karem Ortega e Dra. Marilia Trierveiler Martins pelo alegre e agradável convívio, pela disponibilidade e ensinamentos transmitidos a todos nós alunos da pós-graduação.
Ao Professor Dr. Marcos Martins Neto, chefe do Departamento de Patologia da Universidade Federal de Santa Maria, pela compreensão e apoio para que eu pudesse concluir o Doutorado.
Às amigas Marina de Deus Moura e Yonara Freire pela amizade e pela confiança que pude depositar em vocês desde o mestrado.
A todos os colegas do curso de Pós-Graduação em Patologia Bucal com quem tive o prazer de conviver Flávia Caló, Serginho, Paulo Braz, Renata Acay, Fernanda Yamamoto, Brunno, Aluana, Thaís, Fábio Coracin, Camila, Helder, Sérgio Cury,
Flávia Pontes, Patrícia Adachi, Tessa, Roberto, Alexandra, Alexandre, Juliana,
Paulo Sérgio, Luciana Marocchio e Vanessa Remualdo. A amizade, troca de experiências e informações foram de grande importância durante todo o curso.
À Elisa Santos não só pelo imprescindível auxílio técnico no Laboratório de Imunoistoquímica e de Patologia Cirúrgica, mas também pela amizade e pelos bons momentos.
Às funcionárias da Disciplina de Patologia Bucal Bia, Nair, Néia e Zilda pela atenção, gentileza e colaboração sempre presentes.
[Tese de Doutorado]. São Paulo: Faculdade de Odontologia da USP; 2008.
RESUMO
marcação predominantemente citoplasmática para essa proteína. Ambos os tumores exibiram intensa marcação citoplasmática e/ou nuclear para a -catenina na maioria dos casos. Não houve imunorreatividade para a ciclina D1 em 14/15 casos de adenocarcinoma polimorfo de baixo grau. Em contraste, os carcinomas adenóides císticos revelaram marcação nuclear específica para a ciclina D1 em 10 de 15 casos estudados em mais de 5% das células neoplásicas e essa marcação estava associada à marcação citoplasmática e nuclear da galectina-3 (p<0,05). Esses resultados sugerem que nos carcinomas adenóides císticos a expressão da galectina-3 pode exercer uma função de proliferação celular e parece estar relacionada à diferenciação celular no adenocarcinoma polimorfo de baixo grau. Além disso, a perda de expressão da galectina-3 no carcinoma adenóide cístico pode estar associada a um comportamento clínico mais agressivo dessa lesão. Embora a -catenina pareça exercer algum papel no mecanismo de carcinogênese dessas duas lesões, ela não parece se ligar à galectina-3 para ativar a ciclina D1.
ABSTRACT
carcinomas (p<0,05). These results suggest that in adenoid cystic carcinoma galectin-3 may play a role in cellular proliferation through cyclin D1 activation. In polymorphous low-grade adenocarcinoma gal-3 expression seems to be associated with cellular differentiation. In addition, loss of cytoplasmic expression of galectin-3 in adenoid cystic carcinomas may be related to a more aggressive behavior of these lesions. Although -catenin seems to play a role in carcinogenesis, in both lesions, it seems that it does not bind to galectin-3 for cyclin D1 stimulation.
Figura 5.1- Carcinoma adenóide cístico, subtipo sólido...52
Figura 5.2- Adenocarcinoma polimorfo de baixo grau de malignidade...53
Figura 5.3- Comparação dos aspectos histopatológicos e imunoistoquí-
Tabela 5.1 - Dados referentes à marcação imunoistoquímica da proteína galectina-3 nos carcinomas adenóides císticos e nos adenocarcinomas polimorfos de baixo grau de
malignidade...50 Tabela 5.2 - Dados referentes à marcação imunoistoquímica das
proteínas -catenina e ciclina D1 nos carcinomas adenóides císticos e nos adenocarcinomas polimorfos de baixo grau de
malignidade...51 Tabela 5.3 - Análise estatística da expressão da galectina-3 no carcinoma
adenóide cístico e no adenocarcinoma polimorfo de baixo grau
de malignidade...56 Tabela 5.4 - Marcação imunoistoquímica da galectina-3 entre os subtipos
do carcinoma adenóide cístico...58 Tabela 5.5 - Análise estatística da -catenina e ciclina D1 no carcinoma
adenóide cístico e adenocarcinoma polimorfo de baixo grau de
malignidade...59 Tabela 5.6 - Relação da galectina-3 e da -catenina em membrana no
carcinoma adenóide cístico...62 Tabela 5.7 - Relação da galectina-3 e da -catenina em membrana no
adenocarcinoma polimorfo de baixo grau de
malignidade...62 Tabela 5.8 - Relação da galectina-3 e da -catenina em núcleo e/ou
citoplasma no adenocarcinoma polimorfo de baixo grau de
malignidade...63 Tabela 5.9 - Relação da galectina-3 e da ciclina D1 no carcinoma
Adenóide cístico...64 Tabela 5.10 - Relação da galectina-3 e da ciclina D1 no adenocarcinoma
polimorfo de baixo grau de
malignidade...64 Tabela 5.11 - Associação da -catenina em membrana e da Ciclina D1 no
Tabela 5.13 - Associação da -catenina na membrana e da Ciclina D1 no adenocarcinoma polimorfo de baixo grau de
malignidade...66 Tabela 5.14 - Teste de associação da perda de expressão em membrana
da -catenina e da marcação imunoistoquímica da ciclina D1
Gráfico 5.1 - Análise estatística da expressão da galectina-3 no carcinoma adenóide cístico e no adenocarcinoma
polimorfo de baixo grau de malignidade...57 Gráfico 5.2 - Marcação da -catenina em núcleo/citoplasma no
carcinoma adenóide cístico e adenocarcinoma polimorfo
de baixo grau de malignidade...60 Gráfico 5.3 - Marcação da -catenina em membrana no carcinoma
adenóide cístico e adenocarcinoma polimorfo de baixo grau
de malignidade...60 Gráfico 5.4 - Marcação da ciclina D1 no carcinoma adenóide cístico
e adenocarcinoma polimorfo de baixo grau de malignidade...61 Gráfico 5.5 - Comparação da marcação nuclear e citoplasmática da
galectina-3 com a marcação da ciclina D1 no carcinoma
9C4 clone do anticorpo contra a galectina-3
APBG adenocarcinoma polimorfo de baixo grau de malignidade Bcl-2 proteína supressora da apoptose
CA Califórnia
CAC carcinoma adenóide cístico C-kit protooncogene
Co “company”
DAB diaminobenzidina
EDTA “Etylenediamine-Tetraacetic Acid” Et al e colaboradores
FOUSP Faculdade de Odontologia da Universidade de São Paulo kDa “kilodaltons”
mM milimolar MO “Missouri” NJ “New Jersey”
PCR do inglês “Polymerase Chain Reaction” pH potencial hidrogeniônico
RDI “Research Diagnostics Inc” Ser-6 aminoácido serina resíduo 6
SP São Paulo
% por cento ºC graus Celsius
beta – segunda letra do alfabeto grego gama – terceira letra do alfabeto grego
μm micrômetro
p.
1 INTRODUÇÃO...18
2REVISÃO DA LITERATURA...20
2.1 Carcinoma adenóide cístico...20
2.2 Adenocarcinoma polimorfo de baixo grau de malignidade...24
2.3 Galectina3...27
2.4 β-Catenina...32
2.5 Ciclo celular e Ciclina D1...35
3 PROPOSICÃO...39
4 MATERIAL E MÉTODOS...40
4.1 Casuística e análise morfológica...40
4.2 Técnica imunoistoquímica...41
4.3 Análise dos resultados...43
4.4 Análise estatística...45
5 RESULTADOS...46
5.1 Aspectos histológicos do carcinoma adenóide cístico e do adenocarcinoma polimorfo de baixo grau de malignidade...46
5.2 Expressão imunoistoquímica da proteína galectina-3...47
5.3 Expressão imunoistoquímica da proteína β-catenina...48
5.4 Expressão imunoistoquímica da proteína ciclina D1...49
5.5 Análise estatística...55
6 DISCUSSÃO...68
7 CONCLUSÕES...76
REFERÊNCIAS...77
1 INTRODUÇÃO
As neoplasias malignas das glândulas salivares são lesões raras e os
mecanismos de progressão tumoral nessas lesões ainda não estão bem definidos na
literatura.
Dentre todas as neoplasias malignas que afetam as glândulas salivares, o
carcinoma adenóide cístico está entre as duas mais freqüentes e merece atenção
distinta em função de seu aspecto microscópico, curso clínico e prognóstico. Na
maioria das vezes a lesão se origina a partir das glândulas salivares menores. Os
pacientes mais acometidos pela doença encontram-se entre a quinta e a sétima
décadas da vida e não há uma predileção significativa por sexo. Essa lesão é
caracterizada por um crescimento lento, porém, apresenta grande potencial de
invasão dos tecidos adjacentes, além de uma grande propensão a recidivar e fazer
metástases.
Outro tumor maligno que está entre os que mais freqüentemente acometem
as glândulas salivares é o adenocarcinoma polimorfo de baixo grau. Essa neoplasia
ocorre quase que exclusivamente em glândulas salivares menores, é caracterizada
por um crescimento lento e raramente está associada a metástases. O
adenocarcinoma polimorfo de baixo grau apresenta aspectos histológicos
semelhantes ao carcinoma adenóide cístico e isso muitas vezes pode dificultar o
diagnóstico. Embora essas duas neoplasias apresentem semelhanças nos padrões
histológicos, é imprescindível que se faça um correto diagnóstico, pois o
Recentemente Ferrazzo et al. (2007) demonstraram que essas duas
neoplasias expressam a proteína galectina-3 de formas distintas. A galectina-3, um
dos membros mais estudados da família das galectinas, apesar de ser expressa em
uma variedade de células normais, tem sido associada à progressão tumoral,
resistência à apoptose e metástase em várias neoplasias. Entretanto, os
mecanismos moleculares que regulam estas funções ainda não estão bem
esclarecidos na literatura.
Lin et al. (2002) demonstraram que a superexpressão da galectina-3 controla
alterações nos níveis de expressão de alguns reguladores do ciclo celular, dentre
eles a ciclina D1. Além disso, Shimura et al. (2004) relataram que a ciclina D1 é
ativada pela -catenina de uma maneira dependente da galectina-3.
Neste trabalho nos propusemos a comparar a marcação imunoistoquímica
nuclear e / ou citoplasmática da proteína galectina-3 no carcinoma adenóide cístico
com seus subtipos histológicos e no adenocarcinoma polimorfo de baixo grau de
malignidade, tentando relacionála à marcação imunoistoquímica das proteínas
2 REVISÃO DA LITERATURA
2.1 Carcinoma adenóide cístico
O carcinoma adenóide cístico é considerado uma das neoplasias mais
freqüentes dentre todas as neoplasias malignas que acometem as glândulas
salivares (BOKO et al., 2004; COPELLI et al., 2008; HYAM; VENESS; MORGAN,
2004; PIRES et al., 2007). Este tumor pode ocorrer em qualquer glândula salivar,
não havendo muita concordância na literatura quanto à sua localização preferencial.
Alguns estudos têm demonstrado que o carcinoma adenóide cístico tem uma
predileção pelas glândulas salivares menores e pela glândula submandibular, sendo
raramente encontrado na glândula parótida (KOLUDE; LAWOYIN; AKANG, 2001;
QURESHI et al., 2005). Outros autores apontam as glândulas salivares maiores
como sendo a localização mais freqüente para essa neoplasia (HADDAD et al.,
1995; KHAN et al., 2001). Entretanto, quando esses tumores acometem as glândulas
salivares menores não há dúvida na literatura de que o local de maior ocorrência é o
palato, embora esse tumor possa ser encontrado também na mucosa bucal, lábio e
assoalho bucal (BUCHNER; MERRELL; CARPENTER, 2007; PIRES et al., 2007).
A faixa etária mais comumente atingida por essa neoplasia maligna está entre
a quinta e sexta décadas da vida (BUCHNER; MERRELL; CARPENTER, 2007;
GARDEN et al., 1995; HADDAD et al., 1995; KHAN et al., 2001; PIRES et al., 2007)
CARPENTER, 2007; CHUMMUN et al., 2001; RAUX-RAKOTOMALALA et al., 2003;
PIRES et al., 2007).
Clinicamente o carcinoma adenóide cístico geralmente se apresenta como
uma massa de crescimento lento e persistente, cujos sinais e sintomas clínicos
dependem, dentre outros fatores, da sua extensão e localização anatômica. Na
região das glândulas salivares maiores, essa lesão se apresenta clinicamente como
um aumento de volume nas regiões pré-auricular ou submandibular. O modo de
expansão do carcinoma adenóide cístico é característico. Esse tumor apresenta uma
propensão à invasão perineural que é responsável pela queixa de dor e desconforto
em aproximadamente 50% dos pacientes (ELLIS; AUCLAIR, 1996).
Há uma tendência do carcinoma adenóide cístico de invadir o osso adjacente
e se espalhar pela base do crânio, e isso é considerado a maior causa de morte
nesses tumores. Metástases tardias e recorrências locais também são freqüentes
(GARDEN et al., 1995; SPIERS et al., 1996), embora alguns estudos demonstrem
que essa lesão tem um potencial para desenvolver metástases à distância em fases
bem precoces do desenvolvimento do tumor, independente de recorrências locais
(RAPIDIS et al., 2005; YASUMATSU et al., 2004).
Morfologicamente, o carcinoma adenóide cístico exibe três subtipos
histológicos: cribriforme, tubular e sólido (YAMAMOTO et al., 1998). Entretanto, as
células tumorais que compõem essa neoplasia são principalmente de dois tipos:
células luminais e células mioepiteliais (BARNES et al., 2005; FURUSE et al., 2005).
O padrão cribriforme exibe ninhos de células epiteliais dispostas
concentricamente formando diversos espaços cilíndricos dando um aspecto de
“queijo suíço” à lesão. Estes espaços são na maioria pseudocistos que apresentam
que envolvem esses pseudocistos são células mioepiteliais de núcleo basofílico
ovóide e citoplasma escasso. Os espaços ductais são preenchidos por material
mucinoso eosinofílico e cercados por células cuboidais apresentando citoplasma
mais volumoso e eosinofílico. Dificilmente são encontradas figuras de mitose
(BARNES et al., 2005; FIGUEIREDO; SOUSA; ARAÚJO, 1997).
O subtipo histológico tubular apresenta células cuboidais de citoplasma
eosinofílico e escasso, arranjadas em estruturas ductiformes de duas camadas de
células envoltas por um estroma hialino. As células que circundam internamente
esses espaços tubulares são do tipo epitelial luminal, que por sua vez são cercadas
por uma camada periférica de células mioepiteliais (BARNES et al., 2005;
FIGUEIREDO; SOUSA; ARAÚJO, 1997).
No padrão sólido as células tumorais formam lençóis ou ninhos de tamanhos
ou formatos variados, onde se abrem às vezes estruturas ductiformes. As células
neoplásicas apresentam geralmente morfologia cuboidal, núcleos ovais e
hipercromáticos, com citoplasma claro e escasso (BARNES et al., 2005;
FIGUEIREDO; SOUSA; ARAÚJO, 1997). Um pior prognóstico tem sido associado a
esse subtipo histológico (KHAN et al., 2001).
Muitas vezes observa-se a presença simultânea de mais de um subtipo
histológico em um único tumor. Nesses casos a classificação deve ser feita
levando-se em consideração o padrão predominante (ELLIS; AUCLAIR, 1996; TOMICH,
1991).
Com relação ao prognóstico da doença, alguns autores relatam que os
tumores localizados em glândulas salivares menores da cavidade bucal, nasal e
seios paranasais têm uma evolução pior quando comparados àqueles das glândulas
determinar o prognóstico do carcinoma adenóide cístico é o padrão morfológico,
onde se acredita que o subtipo sólido é o mais agressivo e está relacionado a um
pior prognóstico da doença, seguido pelos padrões cribriforme e tubular
(YAMAMOTO et al., 1998). Ainda com base no aspecto morfológico, a presença de
invasão perineural tem sido considerada como um possível fator de prognóstico
desfavorável para essa doença (GARDEN et al., 1995).
Copelli et al. (2008) avaliaram e trataram 43 pacientes com neoplasias
malignas de glândulas salivares menores. Desses, 26 eram casos de carcinoma
adenóide cístico que se dividiam em 13 do tipo sólido (50%), 7 do tipo cribriforme
(26,9%) e 6 carcinomas adenóides císticos tubulares (23,1%). Segundo os autores,
dentre todos os 43 pacientes que foram tratados, 11 pacientes apresentaram
metástases à distância e dentre esses, 10 pacientes, 90,9% haviam sido tratados
para o carcinoma adenóide cístico, sendo que a maioria deles (70%) apresentava
carcinoma adenóide cístico do subtipo sólido. Os autores relataram ainda que a
invasão perineural foi um achado freqüente nos carcinomas adenóides císticos
(65,4% dos casos) e associaram a invasão perineural a uma pior sobrevida dos
pacientes e pior controle da doença.
Muitos estudos têm sido feitos no sentido de se tentar identificar proteínas
que possam ser utilizadas como marcadores imunoistoquímicos e assim tentar
2.2 Adenocarcinoma polimorfo de baixo grau de malignidade
O adenocarcinoma polimorfo de baixo grau de malignidade ocorre quase que
exclusivamente nas glândulas salivares menores, sendo descrito por alguns autores
como o segundo tipo mais comum de tumor que acomete as glândulas salivares
(BUCHNER; MERRELL; CARPENTER, 2007; FREEDMAN; LUMERMAN, 1983).
Aproximadamente 60% dos casos de adenocarcinoma polimorfo de baixo grau
envolvem o palato duro, mas a lesão pode ocorrer também em outras localizações,
como região retromolar, lábio superior, base da língua, glândulas salivares maiores,
nasofaringe e cavidade nasal, embora com uma menor freqüência (BUCHNER;
MERRELL; CARPENTER, 2007; GNEPP; CHEN; WARREN, 1988; PIRES et al.,
2007; WALDRON; EL-MOFTY; GNEPP, 1988). Há uma maior prevalência desse
tumor em pacientes do sexo feminino em uma proporção de 2:1, na faixa etária que
oscila entre a quinta e a sétima décadas da vida (BUCHNER; MERRELL;
CARPENTER, 2007; EVANS; LUNA, 2000; PIRES et al., 2007).
Essa neoplasia apresenta crescimento lento e indolente além de uma
variação morfológica observada histologicamente. O nome descritivo dessa
patologia reflete essas características. As células que constituem o adenocarcinoma
polimorfo de baixo grau de malignidade são de um único tipo, mas se apresentam
dispostas em diversos arranjos histológicos, conferindo a esse tumor a variedade de
configurações morfológicas que pode haver de um tumor para outro, ou mesmo
dentro de um mesmo tumor. Os principais padrões histológicos que podem ser
encontrados são: lobular ou sólido, papilar, cribriforme (lembrando o carcinoma
circundadas por uma única camada de células. Essas células tumorais são
palidamente coradas, apresentam núcleos ovóides e às vezes nucléolos, e o
tamanho varia de pequenas a médias. A presença de mitoses é incomum e necrose
não é um achado típico. A invasão perineural também é um achado freqüente
nessas lesões (BARNES et al., 2005).
Em 1999 Araújo et al. realizaram um estudo morfológico e imunoistoquímico
de 30 casos de adenocarcinoma polimorfo de baixo grau de malignidade de
glândulas salivares com o objetivo de caracterizar o componente celular dessa
lesão. Foram utilizadas as citoqueratinas 7, 8, 10, 13, 14, 18 e 19, vimentina e actina
músculo-específica. A maioria das células tumorais foi positiva para vimentina e para
as citoqueratinas 8, 14 e 18, mas foi negativa para a actina músculo-específica.
Dessa forma os autores concluíram que o adenocarcinoma polimorfo de baixo grau
deriva das células da junção ácino - ducto intercalar e não das células mioepiteliais.
O adenocarcinoma polimorfo de baixo grau apresenta algumas similaridades
com o carcinoma adenóide cístico no aspecto histológico. Porém, apesar dessas
duas lesões apresentarem aspectos histológicos semelhantes em algumas ocasiões,
em contraste ao adenocarcinoma polimorfo de baixo grau, o carcinoma adenóide
cístico apresenta uma alta taxa de recorrência não só localmente como tem
capacidade de fazer metástases à distância, e isso está associado ao pior
prognóstico dessa lesão (GARDEN et al., 1995; RAPIDIS et al., 2005; SPIERS et al.,
1996; YASUMATSU et al., 2004).
A distinção histológica entre o adenocarcinoma polimorfo de baixo grau e o
carcinoma adenóide cístico se faz baseada principalmente nos aspectos citológicos.
As células no adenocarcinoma polimorfo de baixo grau são cuboidais ou colunares,
característico do carcinoma adenóide cístico. Entretanto muitas vezes esta distinção
se torna difícil, principalmente quando o padrão arquitetural dessas lesões é muito
similar. Quando o adenocarcinoma polimorfo de baixo grau apresenta padrão de
crescimento sólido ou cribriforme, ele pode ser confundido com o carcinoma
adenóide cístico. Histologicamente, as áreas sólidas do adenocarcinoma polimorfo
de baixo grau apresentam menos pleomorfismo celular, menos figuras de mitoses e
quase nunca apresentam áreas de necrose quando comparados ao carcinoma
adenóide cístico (BARNES et al., 2005). Por outro lado, quando há áreas
cribriformes semelhantes, a distinção pode ser feita por painéis imunoistoquímicos
que incluem especialmente citoqueratinas de vários pesos moleculares, vimentina e
actina de músculo liso (ARAÚJO et al., 2000, 2001).
Apesar de diversos estudos imunoistoquímicos já terem sido realizados na
tentativa de se descobrir marcadores imunoistoquímicos eficientes para diferenciar o
adenocarcinoma polimorfo de baixo grau do carcinoma adenóide cístico (LODUCCA
et al., 2000, 2003), o único marcador que apresentou uma clara diferença no padrão
de marcação entre esses dois tumores foi a vimentina que é negativa nas células
luminais do carcinoma adenóide cístico e positiva em praticamente todas as células
neoplásicas do adenocarcinoma polimorfo de baixo grau (DARLING; SCHNEIDER;
PHILLIPS, 2002). Segundo Araújo et al. (2000), a vimentina está sempre presente
nas células neoplásicas mioepiteliais mas não é exclusiva dessas células e pode ser
expressa por outras células originárias do ducto intercalar, o que justificaria a
positividade dessa proteína nas células do adenocarcinoma polimorfo de baixo grau
de malignidade, que se origina das células da junção ácino – ducto intercalar, como
Beltran et al. (2006) sugeriram dois marcadores a serem utilizados como um
painel para distinguir essas duas neoplasias: um anticorpo indicador de proliferação
celular, o protooncogene C-kit que é um receptor transmembrana de tirosinoquinase,
e o marcador do componente mioepitelial dos tumores de glândulas salivares -
actina de músculo liso. Segundo os autores essas proteínas apresentaram forte
marcação nos carcinomas adenóides císticos estudados em contraste aos
adenocarcinomas polimorfos de baixo grau.
2.3 Galectina-3
As galectinas constituem uma família de lectinas animais com afinidade por
-galactosídeos presentes na superfície de células normais e tumorais. Essas
proteínas estão envolvidas em diversos eventos biológicos, tais como controle do
ciclo celular, resposta imune, adesão celular, apoptose e metástase (BARONDES et
al., 1994). Dentre os 14 tipos de galectinas identificados em mamíferos, a
galectina-3, uma proteína monomérica de 31kDa, destaca-se pela intensa participação em
processos inflamatórios, sendo produzida por macrófagos ativados, neutrófilos,
mastócitos, eosinófilos, células dendríticas e algumas subpopulações de linfócitos. A
galectina-3 também tem sido detectada no epitélio do trato gastrointestinal e
respiratório, nos rins e em alguns neurônios sensitivos (HUGHES, 1999; KASAI;
HIRABAYASHI, 1996).
Após sua síntese, a galectina-3 se localiza predominantemente no citoplasma
alternando entre o núcleo e o citoplasma (DAVIDSON et al., 2002). A localização
intracelular da galectina-3 no núcleo e/ou no citoplasma depende de vários fatores
como o tipo celular, o nível de proliferação celular e a progressão neoplásica
(MOUTSATSOS et al., 1987; OPENO et al., 2000).
Os mecanismos de transporte da galectina-3 entre o núcleo e o citoplasma,
bem como as proteínas que podem participar desse processo são motivos de muitos
estudos (DAVIDSON et al., 2006; LI et al., 2006; NAKAHARA et al., 2006).
Estudos têm demonstrado que a galectina-3 pode exibir marcação
citoplasmática ou nuclear com diferentes funções (CALIFICE et al., 2004;
DAVIDSON et al., 2002; HONJO et al., 2000; LIU; PATERSON; WANG, 2002; LOTZ
et al., 1993; TAKENAKA et al., 2004; VAN DEN BRÜLE et al., 2000). A localização
intracelular da galectina-3 desempenha papel importante na sua função
anti-apoptótica e a fosforilação da galectina-3 no resíduo serina (Ser-6) parece ter um
papel fundamental nesse processo. Takenaka et al. (2004) demonstraram que a
substituição do resíduo Ser-6 por um aminoácido não fosforilado (alanina) impediu a
translocação núcleo-citoplasma da proteína galectina-3, inibindo assim a sua
atividade anti-apoptótica.
Califice et al. (2004) e Van den Brüle et al. (2000) demonstraram que há uma
visível mudança de localização da galectina-3 intracelular nas células do carcinoma
de próstata quando comparado com células não tumorais. Segundo os autores, a
galectina-3 está expressa tanto no núcleo quanto no citoplasma das células normais
da próstata, enquanto que nas células do tecido tumoral a galectina-3 manteve-se
expressa no citoplasma, mas não no núcleo dessas células.
Em carcinomas de língua, os níveis da expressão nuclear da galectina-3
normal, enquanto que a expressão citoplasmática da galectina-3 aumentou. Os
autores sugerem que a translocação da galectina-3 do núcleo para o citoplasma
durante a progressão neoplásica pode servir como fator prognóstico em pacientes
com carcinoma de língua (HONJO et al., 2000). Esses resultados juntos sugerem
que a galectina-3 parece ter uma atividade anti-tumoral quando presente no núcleo e
favorecer a progressão do tumor quando expressa no citoplasma.
Alguns trabalhos sugerem que a galectina-3, quando localizada no
compartimento extracelular, exerce uma função anti-apoptótica. A galectina-3
extracelular pode não ser uma molécula anti-apoptótica por si só, mas há a
possibilidade de que a sua interação com alguma proteína na superfície celular
possa exercer essa atividade anti-apoptótica em algumas células, contribuindo
dessa forma para a sobrevivência celular (NAKAHARA; OKA; RAZ, 2005). Outros
estudos também demonstraram o envolvimento da galectina-3 na inibição da
apoptose. Células que apresentaram uma superexpressão da galectina-3 mostraram
também um aumento da resistência à estimulação apoptótica quando induzidas por
radiação e óxido nítrico (MOON et al., 2001; YANG; HSU; LIU, 1996).
Por outro lado, também foi descrita uma função pró-apoptótica para a
galectina-3. Fukumori et al. (2003) relataram que a galectina-3 extracelular secretada
pelas células tumorais pode exercer uma função pró-apoptótica nos linfócitos T
humanos, contribuindo no mecanismo de “escape imunológico” das células tumorais,
e indiretamente favorecendo a progressão tumoral.
O mecanismo molecular pelo qual a galectina-3 regula a apoptose não está
bem esclarecido, contudo, é possível que ela possa mimetizar a Bcl-2, uma proteína
mitocondrial bem conhecida como supressora da apoptose (MOON et al., 2001;
Apesar de existirem vários trabalhos na literatura relacionando a expressão
da proteína galectina-3 à invasão tumoral e metástases em diversas neoplasias
como neoplasias da tireóide, gástricas e da região da cabeça e pescoço, alguns
dados são conflitantes e inconsistentes e não há um consenso geral na literatura a
respeito do papel dessa proteína na progressão tumoral (DUMIC; DABELIC;
FLÖGEL, 2006).
Os estudos da galectina-3 em tecidos tireoideanos normais e neoplásicos
demonstraram que a galectina-3 tem se mostrado ausente ou com uma fraca
expressão em tecidos normais e neoplasias benignas da tireóide, e superexpressa
em carcinomas tireoideanos, principalmente nos carcinomas papilíferos
(FERNANDEZ et al., 1997; ROSA; KANAMURA; CARVALHO, 2005; WILSON et al.,
1986).
Por outro lado, em algumas lesões como tumores de mama, próstata e ovário,
a expressão da galectina-3 é inversamente proporcional ao potencial metastático da
lesão (CASTRONOVO et al., 1996; KRZESLAK; LIPINSKA, 2004; PACIS et al.,
2000).
Em tumores malignos epiteliais da região da cabeça e do pescoço alguns
trabalhos verificaram que a galectina-3 está localizada na superfície celular, onde
pode estar associada às interações celulares. Seu padrão de expressão parece
estar associado à diminuição do padrão de diferenciação do tumor, sugerindo que a
galectina-3 pode ser utilizada como um marcador biológico e de diferenciação nesse
tipo de lesão (GILLENWATER et al., 1996; PLZAK et al., 2004).
A expressão da galectina-3 em neoplasias de glândulas salivares foi estudada
pela primeira vez por Xu et al. (2000). Os autores verificaram que houve marcação
dos 9 casos de adenocarcinomas polimorfos de baixo grau e em 8 dos 9 casos de
carcinomas ex-adenomas pleomórficos. Diante desse resultado os autores
concluíram que a expressão da galectina-3 pode estar associada à diferenciação
celular.
Mais tarde, Penner, Folpe e Budnick (2002) também compararam a
expressão da galectina-3 em carcinoma adenóide cístico e adenocarcinoma
polimorfo de baixo grau e concluíram que a galectina-3 não exerce nenhuma função
na diferenciação celular dessas duas lesões.
Teymoortash et al. (2006) estudaram 35 casos de carcinoma adenóide cístico
de cabeça e pescoço e observaram que todos os casos que apresentaram
metástases à distância eram positivos para a galectina-3 e todos os casos onde não
ocorreram metástases à distância eram negativos para a galectina-3. Da mesma
forma, todos os pacientes que apresentaram metástases regionais também eram
positivos para a galectina-3, com uma marcação predominantemente citoplasmática.
Diante disso concluíram que a expressão da galectina-3 está associada ao aumento
da incidência de metástases regionais e à distância nos carcinomas adenóides
císticos de cabeça e pescoço.
Recentemente foi estudada a expressão imunoistoquímica da proteína
galectina-3 em carcinomas adenóides císticos e adenocarcinomas polimorfos de
baixo grau de malignidade. Nesse trabalho observou-se que a marcação da
galectina-3 foi predominantemente nuclear nos carcinomas adenóides císticos
estudados e citoplasmática nos adenocarcinomas polimorfos de baixo grau de
malignidade. Além disso, de uma forma geral, a marcação imunoistoquímica da
proteína galectina-3 nessas lesões manteve o mesmo padrão de marcação das
padrões de expressão distintos, sugerindo a participação dessa proteína na
diferenciação celular (FERRAZZO et al., 2007).
Os resultados de vários estudos mostram que, embora a galectina-3 esteja
localizada com mais freqüência no citoplasma, ela também pode ser detectada no
núcleo, na superfície celular ou no meio extracelular, o que indica uma
multifuncionalidade dessa molécula (HUGHES, 1999). Os níveis de expressão da
galectina-3 dependem do organismo ou do tecido avaliado, sugerindo que fatores
específicos do tumor ou do tecido podem modular a expressividade da galectina-3
(TAKENAKA et al., 2004).
Weinberger et al. (2007) estudaram a marcação nuclear e citoplasmática da
galectina-3, associando-a à expressão da -catenina e da ciclina D1 em carcinomas
de tireóide. Os autores sugerem que a expressão da galectina-3 parece estar
fortemente associada ao aumento da expressividade da -catenina e da ciclina D1
nos carcinomas bem diferenciados de tireóide, estando, portanto a galectina-3
envolvida no desenvolvimento dessas lesões através da ativação da via de
sinalização do Wnt.
2.4 β-Catenina
As cateninas são uma família de moléculas representadas pela α - (102 kda),
- (88 kDa) e - (82 kDa) catenina. Dentre o grupo das cateninas, a -catenina
possui destaque por se ligar diretamente à porção citoplasmática da E-caderina,
denominado complexo caderina-catenina, que participa da adesão célula-célula
dependente do cálcio nas junções celulares (OZAWA; BARIBAULT; KEMLER,
1989).
Além da função na adesão celular junto com a E-caderina, a -catenina,
quando na sua forma monomérica ou livre, possui uma função sinalizadora, ativando
genes alvo responsáveis pela divisão celular, como o c-myc e a ciclina D1
(SHTUTMAN et al., 1999; TETSU; McCORMICK, 1999). Essa função sinalizadora da
-catenina está associada à sua participação na via de sinalização do Wnt
(SHIMURA et al., 2004). Os genes Wnt pertencem a uma família em expansão de
moléculas de sinalização e proto-oncogenes em potencial que estão envolvidos não
apenas na carcinogênese, mas também na regulação da embriogênese, proliferação
e diferenciação de linhagens celulares. Dezenove genes Wnt existem no genoma de
mamíferos e têm demonstrado funcionar como marcadores moleculares associados
com a progressão tumoral (KATOH, 2005). Os membros da família Wnt têm sido
divididos em duas classes funcionais com base em suas atividades biológicas.
Alguns membros dessa família (Wnt-1, Wnt-3A, and Wnt-8) sinalizam pela via do
Wnt-1/wingless, dita via clássica ou canônica, que estabiliza a -catenina
citoplasmática, induzindo a translocação desta para o núcleo onde se ligará a fatores
de transcrição (KATOH, 2005; SHIMURA et al., 2005).
A -catenina citoplasmática normalmente tem vida curta porque ela é
rapidamente fosforilada e degradada, mantendo-se assim níveis normais dessa
proteína no citoplasma. A superexpressão dessa proteína livre no citoplasma por
falha nos mecanismos de fosforilação e degradação, é suficiente para que ela seja
translocada para o núcleo, ativando sua atividade transcricional podendo estar
-catenina na carcinogênese tem sido extensivamente estudado nos adenocarcinomas
colorretais (BIENZ; CLEVERS, 2000; POLAKIS; HART; RUBINFELD, 1999; TETSU;
MCCORMICK, 1999).
Daa et al. (2005) avaliaram a expressão da -catenina, E-caderina e ciclina
D1 em 23 casos de carcinoma adenóide cístico de glândulas salivares. Segundo os
autores, todos os casos de carcinoma adenóide cístico apresentaram marcação
junto à membrana celular para a -catenina e para a E-caderina, porém com uma
distribuição irregular. Somente 3/23 casos apresentaram marcação nuclear para a
-catenina e 11/23 casos exibiram marcação nuclear para a ciclina D1. Os autores
pesquisaram ainda através de PCR se havia mutação no gene da -catenina e
verificaram que em um caso, onde havia acúmulo da -catenina no núcleo, havia
também mutação no gene e sugeriram que a mutação no gene da -catenina foi
responsável pelo acúmulo dessa proteína no núcleo, mas isso não estava associado
à estimulação da ciclina D1.
Furuse et al. (2006) estudaram a expressão da -catenina e da E-caderina em
algumas neoplasias de glândulas salivares. Os autores observaram um aumento da
marcação nuclear da -catenina nas células mioepiteliais do carcinoma
epitelial-mioepitelial. Outras neoplasias estudadas como o adenoma pleomórfico, o
carcinoma adenóide cístico e o adenocarcinoma polimorfo de baixo grau não
apresentaram diferenças no padrão de marcação dessas proteínas. Segundo os
autores, esses resultados refletem os diferentes mecanismos de carcinogênese
encontrados nas diferentes neoplasias das glândulas salivares.
Zhou e Gao (2006) estudaram a expressão da -catenina, Pin1 e ciclina D1
em carcinomas adenóides císticos de glândulas salivares e verificaram que o
células tumorais, associado à diminuição da expressão dessa proteína na membrana
celular, estava associado à maioria dos carcinomas adenóides císticos metastáticos,
sugerindo que nos carcinomas adenóides císticos a via de sinalização do Wnt está
ativada e isso pode estar associado à carcinogênese e metástases nessas lesões.
2.5 Ciclo Celular e Ciclina D1
O organismo humano consiste num grande número de células cujos núcleos
contêm todo o nosso material genético (DNA), localizado em 46 cromossomos (em
23 pares). A divisão celular é fundamental para a manutenção do estado de
equilíbrio do indivíduo. O processo de divisão celular é constituído basicamente por
dois períodos que se repetem constantemente: a intérfase e a mitose. Este processo
inclui a replicação cromossomal e a segregação em duas células filhas (KOSHLAND
Jr, 1989; LINDEN et al., 1992). Estes eventos são coordenados através do ciclo
celular.
O ciclo celular consiste em diversas fases; a replicação do DNA ocorre
durante a fase S (síntese de DNA) e a segregação cromossomal durante a fase M
(mitótica). Nas células somáticas as fases S e M são separadas pelas chamadas
fases “gap” ou intervalo: G1 (pré-sintética) e G2 (pré-mitótica). Na primeira (G1), que
ocorre antes da replicação do DNA, há uma série de eventos biológicos
responsáveis pelo crescimento celular. Quando atinge um determinado tamanho a
célula entra na fase seguinte (S), na qual acontece a síntese do DNA. A célula
cada cromossomo. Finalmente na fase seguinte (G2), que corresponde ao intervalo
entre o final da síntese de DNA e o início da mitose, a célula verifica se a duplicação
do DNA está completa e se prepara para a divisão celular. A fase M é o período
mais curto do ciclo celular. Aqui ocorre a condensação dos cromossomos e o seu
alinhamento no fuso mitótico, culminando com a separação das cromátides irmãs
(NURSE, 1990, 1994, 2000).
Depois da divisão as células voltam a G1 e o ciclo celular fica completo.
Durante a sua vida a célula pode se proliferar continuamente, pode entrar em
apoptose ou pode permanecer quiescente, saindo do ciclo celular e entrando em
uma fase fisiológica de repouso (G0).
As transições que ocorrem durante a progressão do ciclo celular estão sendo
constantemente controladas. A divisão celular é controlada pelo ambiente
extracelular como reflexo da ação de fatores de crescimento, fatores de adesão
celular e hormônios, e por um sistema de controle intrínseco da célula. Este sistema
interno de controle do ciclo celular é regulado por interrupções que podem parar o
ciclo em pontos de checagem (ou “checkpoints”) em resposta a qualquer
irregularidade, como por exemplo, alteração da replicação ou DNA danificado,
assegurando que os estágios do ciclo celular tenham sido corretamente completados
antes do próximo estágio de divisão começar (COLLINS; JACKS; PAVLETICH,
1997; HARTWELL; WEINERT, 1989). Existem dois principais pontos de checagem:
o G1/S, também chamado de ponto de restrição, e o G2/M, que ocorre antes da
mitose.
A regulação do ciclo celular é realizada por ciclinas e por proteínas quinases
dependentes de ciclinas (Cdks). As ciclinas são proteínas do ciclo celular das células
cíclicas durante o ciclo celular. Essas proteínas são sintetizadas imediatamente
antes de serem utilizadas e seus níveis caem abruptamente depois da sua ação no
ciclo celular devido à sua degradação (HUNTER; PINES, 1994).
São conhecidos oito tipos diferentes de ciclinas humanas: A, B, C, D, E, F, G
e H. Existem três subtipos da ciclina D (D1, D2 e D3) que se distribuem de acordo
com o tipo celular. A ciclina D1 encontra-se amplamente presente em células
epiteliais e fibroblastos, e é uma proteína chave na regulação do ciclo celular,
particularmente no ponto de controle G1/S - ponto de restrição - do ciclo celular
(SHERR; ROBERTS, 1995). Esta proteína forma complexos com a Cdk4 e Cdk6. A
função principal desses complexos é fosforilar a proteína do retinoblastoma. A
fosforilação da proteína do retinoblastoma libera um fator de transcrição (E2F), que
leva a célula à progressão da fase G1 para fase S do ciclo celular (COQUERET,
2002). Este último autor relatou que, além dessa função da ciclina D1 como
ativadora das proteínas quinases dependentes de ciclina, existe outra função
descrita para essa proteína. Estudos experimentais demonstraram que a ciclina D1
funciona como reguladora da transcrição, modulando a atividade de fatores de
transcrição. Segundo Ewen e Lamb (2004), ambas as atividades da ciclina D1
podem contribuir no processo da carcinogênese.
O gene da ciclina D1 tem sido freqüentemente amplificado ou superexpresso
em vários tipos de carcinomas em humanos, incluindo os carcinomas de cabeça e
pescoço (CALLENDER et al., 1994; EL-NAGGAR; STECK; BATSAKIS, 1995;
MOTOKURA; ARNOLD, 1993).
Lin et al. (2002) investigaram a participação da galectina-3 sobre a expressão
da ciclina D1 em culturas celulares de carcinoma de mama. Segundo os autores, a
superexpressão da galectina-3. Dessa forma, sugeriram que a galectina-3 regula a
transcrição gênica através da estimulação da ciclina D1.
Segundo Neves et al. (2004), a forte expressão da proteína ciclina D1 em
carcinomas epidermóides bucais de alto grau sugerem que esta proteína está
associada à proliferação celular nessas lesões.
Angadi e Krishnapillai (2007) concluíram que o aumento da expressão da
proteína ciclina D1 está associado à perda da diferenciação em carcinomas
epidermóides bucais e carcinomas verrucosos.
A participação da ciclina D1 na proliferação celular e progressão tumoral nos
carcinomas adenóides císticos tem sido estudada, entretanto existe muita
controvérsia na literatura. Yasumatsu et al. (2004) estudaram a expressão da ciclina
D1 em carcinomas adenóides císticos de glândulas salivares. Neste trabalho os
autores concluíram que a expressão da ciclina D1 não está associada à proliferação
das células neoplásicas, não tendo, portanto, nenhum valor prognóstico nessas
lesões. Recentemente, Greer Jr et al. (2007) avaliaram a expressão
imunoistoquímica da ciclina D1 em 39 casos de carcinomas adenóides císticos de
glândulas salivares que foram divididos de acordo com os subtipos histológicos
tubular, cribriforme e sólido. Os autores não conseguiram estabelecer uma
associação entre o subtipo histológico do tumor e a expressão da ciclina D1, porém
observaram uma superexpressão dessa proteína (mais de 5% de núcleos de células
marcadas) em 90% dos casos (35/39). Os autores sugeriram que a superexpressão
da ciclina D1 pode contribuir para o crescimento tumoral e está associada ao
3 PROPOSIÇÃO
A proposta deste trabalho é avaliar a expressão imunoistoquímica nuclear e
citoplasmática da proteína galectina-3, relacionando-a à marcação imunoistoquímica
da -catenina e da ciclina D1 em carcinomas adenóides císticos e adenocarcinomas
4 MATERIAL E MÉTODOS
4.1 Casuística e análise morfológica
Esta pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Faculdade
de Odontologia da Universidade de São Paulo, através do Parecer de Aprovação
número 150/07 (Anexo A).
Para este estudo foram utilizados materiais selecionados dos Arquivos do
Serviço de Anatomia Patológica da Faculdade de Odontologia da Universidade de
São Paulo – SP obtidos de biópsias de lesões bucais, sendo 15 casos de
adenocarcinoma polimorfo de baixo grau de malignidade e 15 casos de carcinoma
adenóide cístico de glândulas salivares. As lâminas referentes aos casos e coradas
pela técnica da hematoxilina e eosina foram submetidas a um estudo morfológico em
microscopia de luz para confirmação do diagnóstico. Os casos de carcinoma
adenóide cístico foram classificados e separados histologicamente de acordo com os
subtipos: tubular, cribriforme e sólido.
Os tumores foram submetidos ao estudo imunoistoquímico, utilizando-se o
método do polímero marcado com peroxidase e os cortes submetidos aos anticorpos
4.2 Técnica imunoistoquímica
Para realização da técnica de imunoistoquímica foram utilizados cortes de 3
μm de espessura a partir do material previamente fixado em formol a 10% e
emblocado em parafina. Os cortes foram estendidos em lâminas de vidro
previamente lavadas em álcool absoluto, secas e mergulhadas por um minuto em
solução de 3-aminopropytriethoxy-silane (Sigma Chemical CO., St Louis, MO / USA)
a 10% em álcool absoluto. A desparafinação foi realizada em dois banhos de xilol,
um a 60ºC por 30 minutos, e outro em temperatura ambiente por 20 minutos. Em
seguida os cortes foram hidratados em uma série descendente de etanol, a partir de
três passagens em etanol absoluto, seguido por etanol 95% e 85% durante 5
minutos cada. Em seguida, os cortes foram imersos em hidróxido de amônia a 10%
em solução alcoólica a 95% durante 10 minutos com a finalidade de se remover o
pigmento formólico. Posteriormente, foram lavados em água corrente por 10 minutos
e passados por dois banhos de água destilada de 5 minutos cada.
Para todos os anticorpos estudados foi realizada a mesma recuperação
antigênica. Os cortes receberam tratamento para recuperação antigênica com
tampão TRIS / EDTA a 10mM, pH 9.0 por 10 minutos em microondas. Após
resfriamento em temperatura ambiente, os cortes foram lavados em água corrente
por 10 minutos, passados em dois banhos de água destilada de 5 minutos cada, e
então submetidos ao bloqueio da peroxidase endógena que foi feito com dois
banhos de quinze minutos cada um em solução de peróxido de hidrogênio a 6% e
metanol (1:1). Os cortes foram incubados “overnight” por 18 horas com o anticorpo
C, na diluição de 1:200. Os anticorpos anti- -catenina (clone 14/Beta-Catenin, BD
Biosciences, USA) e anti-ciclina D1 (clone DCS-6, Dako Corporation, Glostrup,
Denmark) foram incubados à temperatura ambiente durante 40 minutos na diluição
de 1:200 e 1:55, respectivamente. Todas as secções foram incubadas em um ciclo
de kit EnVision Mouse (Dako Corporation, Carpinteria, CA, USA) por 30 minutos e
lavadas com TBST pH 6.0.
Para revelação foi utilizado o cromógeno diaminobenzidina 0,025% (DAB,
3,3-diaminobenzidina, Sigma Chemical Co., St Louis MO / USA). Após a lavagem, os
cortes foram contra-corados com hematoxilina de Mayer previamente filtrada. Os
passos seguintes foram desidratação em uma cadeia ascendente de etanol
seguindo a seqüência de 70%, 90% e 100% durante 2 minutos cada banho,
diafanização em xilol (2 banhos de 5 minutos cada), e montagem com lamínula.
Nos cortes utilizados como controle negativo a incubação com o anticorpo
primário não foi realizada. O controle positivo utilizado para o anticorpo da proteína
galectina-3 foi um bloco parafinado de carcinoma papilífero de tireóide previamente
testado e positivo. Para a -catenina foi utilizado um bloco parafinado de arquivo que
continha fragmento de mucosa normal, cujo epitélio apresentava marcação positiva
para o referido anticorpo; para a ciclina D1 o controle positivo foi um caso de
carcinoma epidermóide bucal sabidamente positivo para este anticorpo. Como
controles positivos internos foram avaliados, quando presentes, epitélio estratificado
da mucosa de revestimento e vasos sangüíneos. Tecidos de glândula salivar normal
4.3 Análise dos resultados
A análise dos resultados foi feita mediante uma avaliação quantitativa das
proteínas galectina3 e ciclina D1 associada à análise qualitativa da proteína
-catenina nos dois tumores estudados: adenocarcinoma polimorfo de baixo grau e
carcinoma adenóide cístico, sendo que nesse último as lesões foram ainda
separadas por subtipos histológicos. Foram consideradas positivas as células com
marcação imunoistoquímica de coloração acastanhada, não sendo levada em
consideração a intensidade da coloração. A avaliação qualitativa da -catenina foi
realizada por três observadores diferentes e a avaliação quantitativa das proteínas
galectina-3 e ciclina D1 foi executada por um único observador.
Para a galectina-3 foram consideradas positivas marcações citoplasmáticas e
nucleares, sendo que todos os casos que apresentaram células neoplásicas
marcadas foram considerados positivos, independente da quantidade de células
marcadas. A expressão imunoistoquímica dessa proteína no núcleo e no citoplasma
foi avaliada separadamente. Com a finalidade de se fazer a análise estatística, foi
considerada a quantidade percentual absoluta e relativa de núcleos e citoplasmas de
células neoplásicas marcadas em um total de 1000 células neoplásicas.
A -catenina foi avaliada qualitativamente levando-se em consideração a
marcação dessa proteína junto à membrana e a marcação em núcleo e/ou
citoplasma. Para isso foi atribuído o escore “0” (zero) àqueles casos que não
apresentaram marcação dessa proteína em núcleo e/ou citoplasma e escore “1”
(um) aos casos que apresentaram marcação de núcleo e/ou citoplasma. Além disso,
-catenina na membrana celular. Para analisar esse dado, atribuiu-se escore “0” (zero)
aos casos onde havia marcação da -catenina junto à membrana celular e escore
“1” (um) aos casos que apresentaram perda de expressão da proteína na
membrana.
Na avaliação da ciclina D1, foram consideradas positivas somente células
apresentando marcação nuclear de coloração acastanhada. De acordo com estudos
prévios (GREER Jr. et al., 2007; SHIRATSUCHI et al., 2007; WEINBERGER et al.,
2007; YASUMATSU et al., 2004), foram considerados positivos para a ciclina D1 e
com uma superexpressão dessa proteína os casos que exibiram mais de 5% de
núcleos de células neoplásicas marcadas para a proteína, e negativos os casos que
apresentaram menos de 5% de núcleos marcados. Com a finalidade de se realizar a
análise estatística, foi atribuído o escore “0” (zero) aos casos negativos para a ciclina
D1 e escore “1” (um) aos casos positivos para essa proteína.
As células positivas para a galectina-3 e para a ciclina D1 foram contadas
manualmente - 1000 células por campo escolhido aleatoriamente em cada caso
estudado. As imagens dos campos foram obtidas em microscópio de luz Carl Zeiss
Axio Imager A1 com aumento final de 400x e câmera Axio Cam HR3 acoplados a um
sistema computadorizado utilizando o software Axio Vision Release 4.6.3 SP1, 2007,
que permitiu a contagem manual das células positivas dentro dos parâmetros
4.4 Análise estatística
Para responder ao objetivo do estudo foram utilizados os testes
Mann-Whitney (CONOVER, 1980) para comparar a galectina-3 entre os dois tipos de
tumores (adenocarcinoma polimorfo de baixo grau e carcinoma adenóide cístico) e
os testes de Kruskal-Wallis (NETER et al., 1996) para comparar a mesma proteína
entre os subtipos do carcinoma adenóide cístico. Para verificar a existência de
associação entre as proteínas -catenina e ciclina D1 nos dois tumores foram
realizados testes qui-quadrado ou testes exatos de Fischer (AGRESTI, 1990)
quando a amostra não foi suficiente para a realização do teste qui-quadrado. O
mesmo foi feito para associar as proteínas aos subtipos histológicos do carcinoma
adenóide cístico. Por último, para verificar a existência de associação entre a
expressão imunoistoquímica das diferentes proteínas, foram realizados testes
Mann-Whitney para comparar a expressão da galectina-3 com a expressão da -catenina e
da ciclina D1 e os testes qui-quadrado ou exato de Fisher para comparar a
expressão da -catenina e ciclina D1 nos dois tumores estudados.
Os dados foram ilustrados através de gráficos de Barras (BUSSAB;
MORETTIN, 1987) e em todas as análises utilizou-se o nível de significância de 5%
(p<0,05).
O software utilizado nas análises estatísticas foi o SPSS - Statistical Package
for the Social Sciences (SPSS Inc., Chicago, USA) na versão 13.0 e os gráficos
5 RESULTADOS
5.1 Aspectos histológicos do carcinoma adenóide cístico e do adenocarcinoma polimorfo de baixo grau de malignidade
Os carcinomas adenóides císticos estudados incluíram dois casos do subtipo
tubular, sete casos do subtipo cribriforme e seis casos do subtipo sólido, totalizando
15 casos.
As lâminas coradas pela hematoxilina e eosina e observadas sob microscópio
de luz revelaram o parênquima da lesão constituído por dois tipos de células: células
luminais, com formato cuboidal e citoplasma eosinofílico, e células mioepiteliais, com
núcleo hipercromático basofílico e citoplasma claro e escasso.
No subtipo tubular observavam-se estruturas tubulares ductiformes
compostas por duas camadas de células. O subtipo cribriforme era caracterizado
pela formação de ilhas de células mioepiteliais contendo múltiplos espaços
pseudocísticos, onde por vezes também eram observados pequenos espaços
ductiformes delimitados por células mais cuboidais. Células neoplásicas formando
ninhos sólidos e algumas vezes lençóis, onde se observavam poucos espaços
ductiformes se abrindo circundados por células luminais, caracterizavam o subtipo
sólido do carcinoma adenóide cístico (Figuras 5.1 A e B).
Os 15 casos de adenocarcinomas polimorfos de baixo grau de malignidade
estudados eram compostos histologicamente por células cuboidais ou colunares que
apresentavam núcleo vazado e citoplasma claro, sem a presença de atipias
formando quatro padrões histológicos distintos: o padrão lobular que era formado
por lóbulos de células neoplásicas arranjadas em ilhas sólidas; áreas exibindo
estruturas tubulares ductiformes com uma única camada de células; ilhas de células
neoplásicas com múltiplos espaços pseudocísticos, configurando o aspecto
cribriforme e também áreas formando cordões e trabéculas. O aspecto
histopatológico de um dos casos de adenocarcinoma polimorfo de baixo grau de
malignidade pode ser observado na figura 5.2 A.
5.2 Expressão imunoistoquímica da proteína galectina-3
Todos os casos de carcinomas adenóides císticos apresentaram marcação
imunoistoquímica para a proteína galectina-3. Essa marcação foi
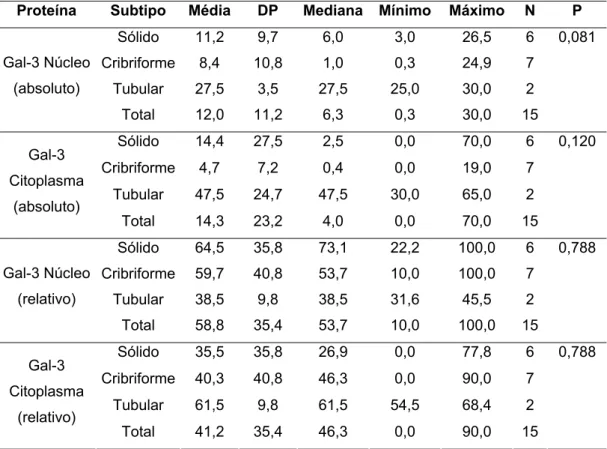
predominantemente nuclear, sendo que em 4 dos 15 casos estudados (26,66%) a
marcação foi exclusivamente nuclear.
No subtipo tubular do carcinoma adenóide cístico, as células internas das
estruturas ductiformes tubulares expressaram a proteína tanto no núcleo quanto no
citoplasma. Os casos do subtipo cribriforme do carcinoma adenóide cístico
apresentaram poucas células positivas para a galectina-3. A marcação nesse
subtipo histológico estava localizada restritamente nas células luminais que
formavam os pequenos ductos no interior das ilhas neoplásicas cribriformes. Essa
marcação foi predominantemente nuclear em 4/7 casos de carcinomas adenóides
císticos cribriformes estudados. No subtipo sólido observou-se marcação
ductiformes que eventualmente se formavam e essa marcação era
predominantemente nuclear em 4/6 casos (Figura 5.1 C).
No adenocarcinoma polimorfo de baixo grau, independente do padrão
histológico observado, a marcação imunoistoquímica da galectina-3 foi intensa,
marcando sem distinção praticamente todas as células neoplásicas,
predominantemente no citoplasma (Figura 5.2 B).
Os dados referentes à marcação imunoistoquímica da proteína galectina-3
nos dois tipos de tumores e subtipos histológicos do carcinoma adenóide cístico
estão resumidos na tabela 5.1.
5.3 Expressão imunoistoquímica da proteína β-catenina
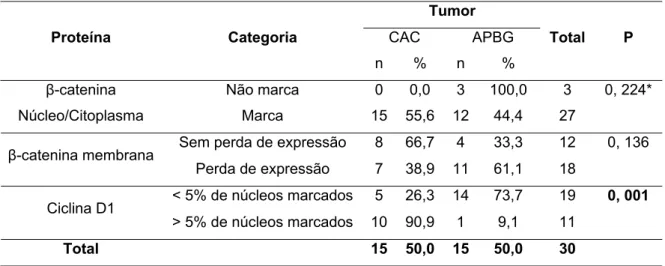
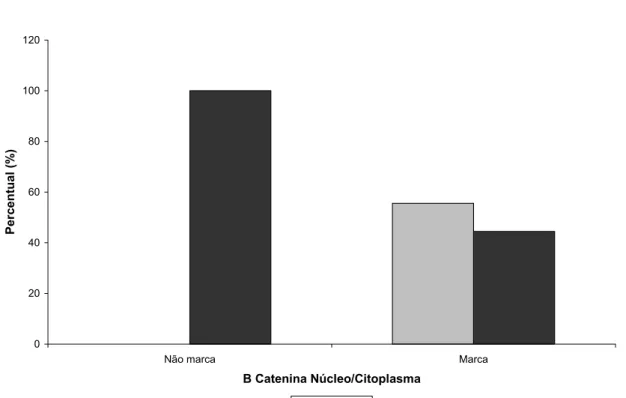
Todos os 15 casos de carcinomas adenóides císticos apresentaram marcação
imunoistoquímica da -catenina no núcleo e/ou no citoplasma. Em sete dos 15
casos estudados (46,66%) houve perda de expressão da -catenina junto à
membrana celular das células neoplásicas em algumas áreas do tumor. Dentre os
subtipos histológicos do carcinoma adenóide cístico, houve perda de expressão da
proteína na região da membrana celular em quatro dos seis casos do subtipo sólido
(66,66%) e em três dos sete casos (42,85%) do subtipo cribriforme. Nos dois casos
do subtipo tubular estudados não houve perda de expressão da -catenina em
nenhuma região da lesão (Figuras 5.1 D e E).
Dentre os adenocarcinomas polimorfos de baixo grau, 12 dos 15 casos (80%)
Houve perda de expressão da -catenina junto à membrana celular em 11 casos
(73,33%) em algumas regiões do tumor (Figura 5.2 C e Tabela 5.2).
5.4 Expressão imunoistoquímica da proteína ciclina D1
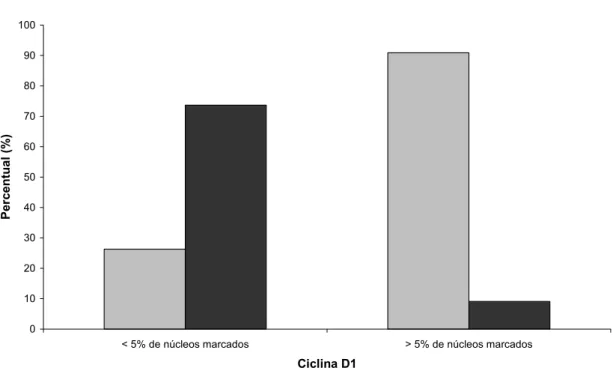
Dos 15 casos de carcinomas adenóides císticos avaliados pela técnica
imunoistoquímica para a proteína ciclina D1, 10 casos (66,66%) foram positivos para
essa proteína, exibindo mais de 5% de núcleos de células neoplásicas marcadas, e
cinco casos foram considerados negativos, apresentando menos de 5% de núcleos
marcados para a proteína (Figura 5.1 F).
Verificou-se a positividade da proteína ciclina D1 em apenas um caso dos 15
adenocarcinomas polimorfos de baixo grau de malignidade estudados,
correspondendo a 6,66% dos casos (Figura 5.2 D e Tabela 5.2).
A comparação dos aspectos histopatológicos e imunoistoquímicos das
proteínas galectina-3, -catenina e ciclina D1 entre as duas neoplasias estudadas
Tabela 5.1 – Dados referentes à marcação imunoistoquímica da proteína galectina-3 nos carcinomas adenóides císticos e nos adenocarcinomas polimorfos de baixo grau de malignidade
Caso Tipo de Tumor Gal-3/1000 Gal-3 Na % Gal-3 Nr % Gal-3 Ca % Gal-3 Cr % 01 CAC sólido 97 5,70 58,76 4,00 41,24 02 CAC sólido 72 6,30 87,50 0,90 12,50 03 CAC sólido 275 26,50 96,36 1,00 3,64 04 CAC sólido 900 20,00 22,22 70,00 77,78 05 CAC sólido 134 3,00 22,39 10,40 77,61 06 CAC sólido 54 5,40 100,00 0,00 0,00 07 CAC cribriforme 249 24,90 100,00 0,00 0,00 08 CAC cribriforme 410 22,00 53,66 19,00 46,34 09 CAC cribriforme 94 9,40 100,00 0,00 0,00 10 CAC cribriforme 7 0,30 42,85 0,40 57,14 11 CAC cribriforme 5 0,50 100,00 0,00 0,00 12 CAC cribriforme 100 1,00 10,00 9,00 90,00 13 CAC cribriforme 52 0,60 11,53 4,60 88,46 14 CAC tubular 950 30,00 31,58 65,00 68,42 15 CAC tubular 550 25,00 45,45 30,00 54,54 16 APBG 950 5,00 5,26 90,00 94,73 17 APBG 885 1,50 1,69 87,00 98,30 18 APBG 1000 15,00 15,00 85,00 85,00 19 APBG 950 15,00 15,78 80,00 84,21 20 APBG 970 21,00 21,64 76,00 78,35 21 APBG 900 3,00 3,33 87,00 96,66 22 APBG 956 7,60 7,95 88,00 92,05 23 APBG 960 30,00 31,25 66,00 68,75 24 APBG 920 2,60 2,82 89,40 97,17 25 APBG 930 3,00 3,22 90,00 96,77 26 APBG 1000 13,00 13,00 87,00 87,00 27 APBG 1000 8,00 8,00 92,00 92,00 28 APBG 900 28,00 31,11 62,00 68,88 29 APBG 960 5,00 5,20 91,00 94,79 30 APBG 600 2,00 3,33 58,00 96,66
Tabela 5.2 – Dados referentes à marcação imunoistoquímica das proteínas β-catenina e ciclina D1 nos carcinomas adenóides císticos e nos adenocarcinomas polimorfos de baixo grau de malignidade
Caso Tipo de Tumor β-Cat N/C β-Cat M Cicl D1 +/- Cicl D1 %
01 CAC sólido 1 0 1 5,4
02 CAC sólido 1 1 1 20,1
03 CAC sólido 1 1 1 19,3
04 CAC sólido 1 1 1 10,0
05 CAC sólido 1 0 1 14,8
06 CAC sólido 1 1 0 0,4
07 CAC cribriforme 1 0 1 19,8
08 CAC cribriforme 1 0 1 14,9
09 CAC cribriforme 1 1 0 2,7
10 CAC cribriforme 1 0 0 0,8
11 CAC cribriforme 1 0 0 0,3
12 CAC cribriforme 1 1 0 0,8
13 CAC cribriforme 1 1 1 11,9
14 CAC tubular 1 0 1 5,2
15 CAC tubular 1 0 1 10,8
16 APBG 1 0 0 0,3
17 APBG 1 1 0 1,2
18 APBG 1 0 0 0,8
19 APBG 0 1 0 1,0
20 APBG 0 1 0 2,2
21 APBG 0 1 1 7,0
22 APBG 1 1 0 0,0
23 APBG 1 0 0 2,7
24 APBG 1 1 0 0,0
25 APBG 1 1 0 0,0
26 APBG 1 1 0 1,0
27 APBG 1 1 0 0,0
28 APBG 1 1 0 0,8
29 APBG 1 0 0 0,2
30 APBG 1 1 0 0,5
5.5 Análise estatística
Foram realizados testes Mann-Whitney para comparar a marcação
imunoistoquímica nuclear e citoplasmática da galectina-3 entre os dois tipos de
tumores estudados.
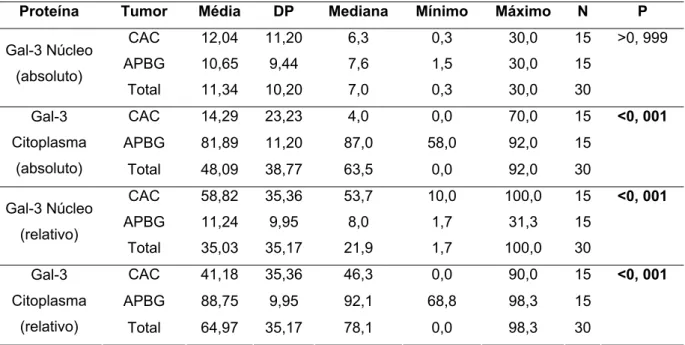
A contagem média absoluta de núcleos marcados da proteína galectina-3 foi
12,04% no carcinoma adenóide cístico e 10,65% no adenocarcinoma polimorfo de
baixo grau. O teste de Mann-Whitney revelou que essa diferença não foi
estatisticamente significante. Quando comparada a quantidade relativa de núcleos
de células marcadas para essa proteína nos dois tumores, observou-se que a
expressão da galectina-3 foi maior no carcinoma adenóide cístico e essa diferença
foi estatisticamente significante (p < 0, 001). A marcação citoplasmática da proteína
galectina-3 foi maior no adenocarcinoma polimorfo de baixo grau tanto em valores
absolutos quanto em valores relativos (p < 0, 001). Esses resultados estão ilustrados
Tabela 5.3 – Análise estatística da expressão da galectina-3 no carcinoma adenóide cístico e no adenocarcinoma polimorfo de baixo grau de malignidade
Proteína Tumor Média DP Mediana Mínimo Máximo N P
CAC 12,04 11,20 6,3 0,3 30,0 15 >0, 999
APBG 10,65 9,44 7,6 1,5 30,0 15 Gal-3 Núcleo
(absoluto)
Total 11,34 10,20 7,0 0,3 30,0 30
CAC 14,29 23,23 4,0 0,0 70,0 15 <0, 001
APBG 81,89 11,20 87,0 58,0 92,0 15 Gal-3
Citoplasma
(absoluto) Total 48,09 38,77 63,5 0,0 92,0 30
CAC 58,82 35,36 53,7 10,0 100,0 15 <0, 001
APBG 11,24 9,95 8,0 1,7 31,3 15 Gal-3 Núcleo
(relativo)
Total 35,03 35,17 21,9 1,7 100,0 30
CAC 41,18 35,36 46,3 0,0 90,0 15 <0, 001
APBG 88,75 9,95 92,1 68,8 98,3 15 Gal-3
Citoplasma
(relativo) Total 64,97 35,17 78,1 0,0 98,3 30