FACULDADE DE MEDICINA
PERFIL EPIDEMIOLÓGICO DA MALÁRIA E ADESÃO AO TRATAMENTO EM MENORES DE CINCO ANOS, MALANJE-ANGOLA, FEVEREIRO-MARÇO DE
2019.
(ESTUDO TRANSVERSAL)
MATEUS FERREIRA ALFREDO GONÇALVES
Orientadora: Profª. Doutora Inês Sófia Morales Salcedo
Coorientadora: Profª Doutora Cristina Maria Moreira Campos Furtado Figueiredo
Dissertação especialmente elaborada para obtenção do grau de Mestre em Epidemiologia da Faculdade de Medicina da Universidade de Lisboa.
FACULDADE DE MEDICINA
PERFIL EPIDEMIOLÓGICO DA MALÁRIA E ADESÃO AO TRATAMENTO EM MENORES DE CINCO ANOS, MALANJE-ANGOLA, FEVEREIRO-MARÇO DE
2019.
(ESTUDO TRANSVERSAL)
MATEUS FERREIRA ALFREDO GONÇALVES
Orientadora: Profª. Doutora Inês Sófia Morales Salcedo
Coorientadora: Profª Doutora Cristina Maria Moreira Campos Furtado Figueiredo
Dissertação especialmente elaborada para obtenção do grau de Mestre em Epidemiologia da Faculdade de Medicina da Universidade de Lisboa.
2019
“A impressão desta dissertação foi aprovada pelo Conselho Científico da
Faculdade de Medicina de Lisboa em reunião de 19 de Novembro de 2019.
“Nascemos sem conhecimento e nenhuma habilidade, por fim somos seres humanos sem conhecimento, mas também com muita oportunidade de conhecimento.
Por isso, é importante salientar que o conhecimento é necessário na vida de um indivíduo. Ter conhecimento resume-se em ter foco, ter disciplina, metas e muita fé.
Escolher profissão que irá ser e se esforçar para retirar o máximo de aprendizado. Contudo, temos oportunidades de tornar-nos inteligentes a cada dia.
O conhecimento é adquirido com esforço, força e fé. Enfim nunca deixe de buscar conhecimento, conhecimento gera frutos para um futuro melhor”.
(Djalma Baptista)
A realização desta caminhada formativa não seria concretizada sem o apoio de todos que direta ou indiretamente participaram do mesmo e de forma incondicional prestaram o seu contributo.
Profundo agradecimento ao altíssimo DEUS Pai todo poderoso, a Ele toda honra e toda glória é dada porque até aqui tem sido o meu refúgio e fortaleza socorro bem presente na angústia. Um grande reconhecimento e agradecimento a minha esposa Maria António Carlos (in memoria) que a sua alma descanse em paz, que muito fez a quando da primeira etapa formativa (parte curricular), pelo carinho, amor, coragem, dedicação, humildade, as constantes ausências e muitas orações para que DEUS protegesse a família e infelizmente nesta última etapa ela partiu para eternidade, a Ela peço que tenha um descanso eterno e que esteja na destra de DEUS e que dê muita saúde a sua família, saudades de seu esposo e filhos, descanse em paz mamã.
Aos meus filhos Marcelo Carlos Gonçalves e Mauro Carlos Gonçalves, que sempre suportaram as constantes ausências do pai, tenho consciência que nunca conseguirei retribuir este tempo passado.
Efusivamente endereço um grande reconhecimento a minha orientadora, Professora Doutora Inês Sófia Morales Salcedo e a minha coorientadora Professora Doutora Cristina Furtado que se têm tornado numa mola impulsionadora para o sucesso e conclusão desta dissertação e que tanto contribuíram para a minha formação. O meu muito obrigado.
Ao Professor Doutor Eduardo Ekundi Valentim que tem participado de forma direta no sucesso da minha formação, colocando-me perante desafios importantes para o meu desenvolvimento pessoal e profissional.
A Professora Doutora Ivett Mullens Ramos pelo apoio e o impulso que tem dado para a elaboração desta dissertação.
Ao Msc. José Luís Bencomo Atanay, pelo incentivo e as constantes ajuda.
A Direção do Hospital Materno Infantil de Malanje, pela colaboração e autorização da recolha de dados.
A comissão Científica do Mestrado em Epidemiologia da Faculdade de Medicina da Universidade de Lisboa, que nunca mediram esforços na transmissão dos seus conhecimentos
Agradeço aos meus pais, Ferreira Alberto Gonçalves (in memoria) Lectícia Alfredo Gonçalves pelos ensinamentos e princípios de dignidade, de honestidade e de persistência na concretização dos nossos objetivos pessoais.
A todos meus colegas o meu agradecimento sincero por tudo que têm feito, pelo cruzar neste caminho, como amigos e companheiros de uma jornada bem-sucedida.
Ao Instituto Superior Politécnico de Malanje (ISPM), um grande reconhecimento pela confiança e por terem acreditado em mim neste percurso.
A todos DEUS abençoe.
O MEU MUITO OBRIGADO
A malária é uma doença que ameaça 3,4 mil milhões de pessoas a nível mundial, que vivem em zonas endémicas, como África, Ásia e América. No que se refere a malária causada por Plasmodium falciparum em Angola a malária encontra-se espalhada por todo o país sendo endémica nas 18 províncias, com maior incidência as províncias do norte, cujo tratamento é baseado em combinações de Artemisinina, é um problema de saúde pública que atrapalha o desenvolvimento dessa região e que a adesão à terapêutica medicamentosa é um dos principais fatores que influencia na eficácia do tratamento. O principal objetivo da presente investigação é descrever o perfil epidemiológico e a adesão ao tratamento dos menores de cinco anos de idade com diagnóstico clínico de malária em Malanje- Angola no período de Fevereiro-Março de 2019. Aplicou-se a abordagem quantitativa do método científico de corte transversal e correlacional em uma amostra não probabilística por conveniência em 150 pacientes com diagnostico de malária e com tratamento antimalárico. Este estudo utiliza métodos indiretos (autorrelato) para avaliar a adesão ao tratamento com perguntas baseadas no teste de Morisky-Green-Levine ao final do tratamento. Foi possível observar que 100% dos pacientes foram infetados pelo Plasmodium falciparum com uma média de idade de 26.56 meses e com um desvio padrão de 10.82, sendo 95 (63,3%) dos pacientes do sexo feminino e maioritariamente da etnia kimbundo 42.7%. O teste de Morisky-Green-Levine indicou uma adesão de 41.3%, comparativamente com outros estudos consideramos ser uma adesão negativa. Os resultados mostraram que não houve diferenças estatísticas significativas o que requer um estudo mais aprofundado, com uma dimensão amostral maior, necessário à confirmação da nossa observação. Esperamos que o presente trabalho contribua para estimular aqueles que iniciam a carreira científica e queiram abraçar o desafio de dedicar seu trabalho em prol do desenvolvimento de conhecimentos que potencializem o entendimento apropriado para as inúmeras doenças atualmente negligenciada como a malária.
Malaria is a disease that threatens 3.4 thousand million people worldwide, living in endemic areas such as Africa, Asia and America. With regard to malaria caused by Plasmodium falciparum in Angola, malaria is widespread throughout the country and is endemic in the 18 provinces, with higher incidence in the northern provinces, where treatment is based on combinations of Artemisinin, It is a health problem which hinders the development of this region and that adherence to drug therapy is one of the main factors influencing treatment efficacy. The main objective of the present investigation is to describe the epidemiological profile and adherence to the treatment of children under five years of age with clinical diagnosis of malaria in Malanje-Angola from February to March 2019. The quantitative approach of the scientific method cross-sectional and correlational study in a non-probabilistic sample for convenience in 150 patients diagnosed with malaria and with antimalarial treatment. This study uses indirect methods to assess adherence to treatment with questions based on the Morisky-Green-Levine test at the end of treatment. It was possible to observe that 100% of the patients were infected by Plasmodium falciparum with a mean age of 26.56 months and a standard deviation of 10 82, of which 95 (63.3%) were female and 42.7% were kimbundo. The Morisky-Green-Levine test indicated a 41.3% adhesion 62 of a total of 150 patients, compared with other studies we considered this to be a negative adhesion. The results did not show statistically significant differences, which requires a more detailed study, with a larger sample size, necessary to confirm our observation.
We hope that the present work will help to stimulate those who start their scientific careers and want to embrace the challenge of devoting their work to the development of knowledge that enhances the proper understanding of the many diseases currently neglected such as malaria.
INTRODUÇÃO...14
HIPÓTESES DE TRABALHO...20
OBJECTIVOS: ... 21
JUSTICATIVA ... 22
CAPITULO I. FUNDAMENTOS TEÓRICOS RELACIONADOS AO PERFIL EPIDEMIOLÓGICO DA MALARIA E ADESÃO AO TRATAMENTO EM MENORES DE CINCO ANOS. ... 23
1.1 – Antecedentes históricos da malária. ... 23
1.1.2 - Histórico da Malária em Angola. ... 25
1.2–Epidemiologia da malária, elementos teóricos a considerar. ... 27
1.3 – Morbilidade e mortalidade associada a malária em idade pediátrica... 31
1.4 -Fatores associados a morbi-mortalidade por malária. ... 32
1.5 -Tratamento medicamentoso, adesão ao tratamento. ... 33
1.6- Especificidade de tratamento ao paciente pediátrico com malária...36
CAPITULO II. METODOLOGIA ... 42
2.1 – Área de estudo. ... 42
2.2 Desenho do Estudo. ... 43
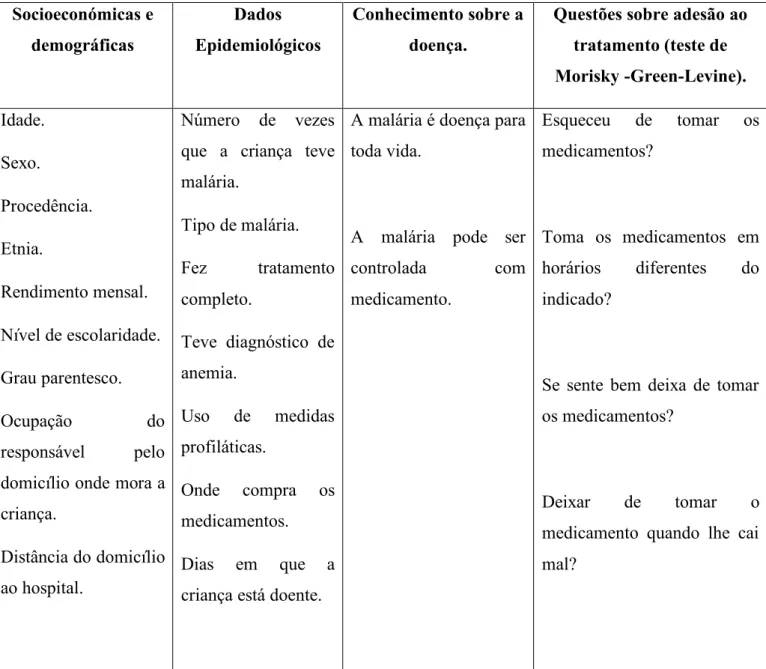
2.2.1 Variáveis em estudo ... 44
2.2.2 População e Amostra ... 45
2.2.3 Critérios de Inclusão e Exclusão ... 45
2.2.4 Métodos de recolha de dados ... 45
2.2.5 Métodos Estatísticos ... 46
2.2.6 Processamento, Análises da informação e técnicas a empregar ... 46
2.3. Aspetos Éticos...47
CAPITULO III: RESULTADOS. ... 48
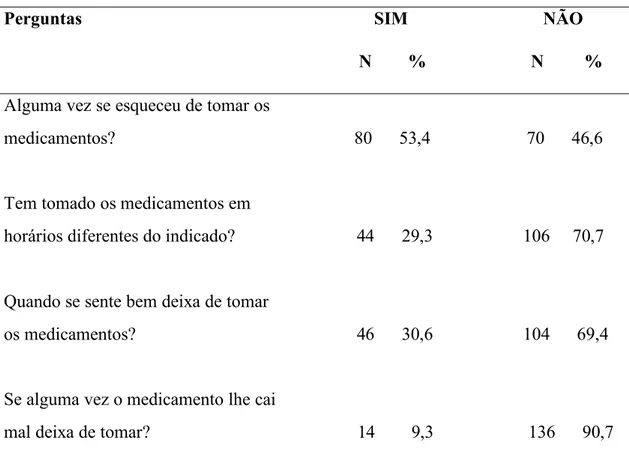
3.1 Respostas obtidas no Teste de Morisky-Green-Levine...48
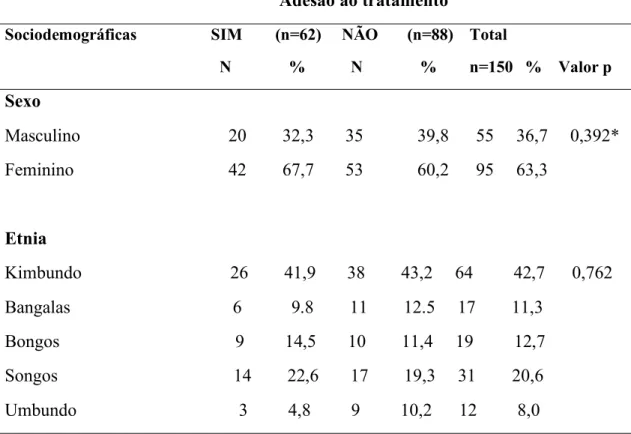
3.2 Caraterização sociodemográficas dos pacientes estudados...49
3.3 Caraterísticas epidemiológicas dos pacientes estudados...51
CAPITULO IV: DISCUSSÂO ... 54
CONCLUSÕES ... 56
RECOMENDAÇÕES ... 58
APÊNDICES ... 67
APÊNDICE 1: Distribuição dos pacientes de acordo o sexo ... 67
APÊNDICE 2: Distribuição dos pacientes de acordo o nível de escolaridade ... 67
APÊNDICE 3: Distribuição dos pacientes de acordo a ocupação do cuidador ... 68
APÊNDICE 4: Distribuição dos pacientes de acordo a distância do domicílio até ao hospital. ... 68
APÊNDICE 5: Distribuição dos pacientes de acordo a etnia ... 69
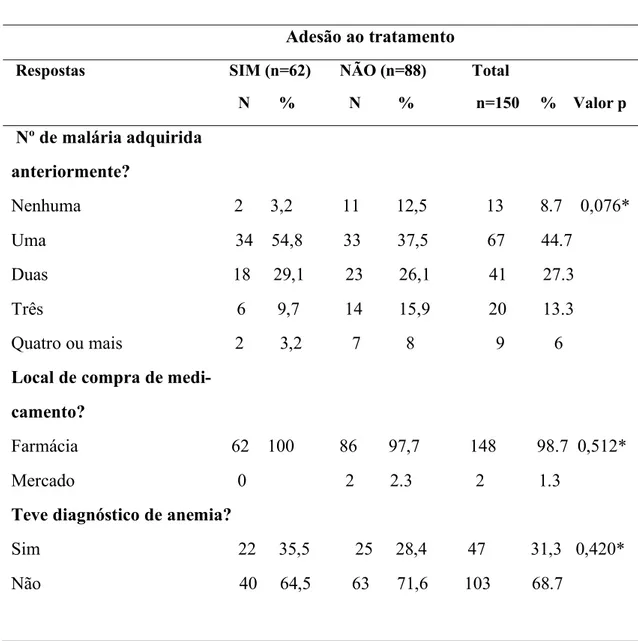
APÊNDICE 6: Distribuição dos pacientes de acordo número de malaria adquirida anteriormente. ... 69
APÊNDICE 7: Distribuição dos pacientes de acordo ao cumprimento do tratamento. ... 70
APÊNDICE A: Solicitação de autorização para recolha de dados...71
APÊNDICE B: Formulário de Consentimento Informado...72
APÊNDICE C: Questionário...73
ANEXO A: Autorização do Hospital Materno Infantil de Malanje...77
Tabela 1. Protocolo Nacional de tratamento da Malária em crianças com Artemeter em Ampolas de 80mg e 20mg/ml... 36 Tabela 2. Protocolo Nacional de tratamento da Malária simples com Artemeter +
Lumefantrine... 37 Tabela 3. Protocolo Nacional de tratamento da Malária simples com Artesunate +
Amodiaquina... 38 Tabela 4. Variáveis consideradas no estudo... 44 Tabela 5. Distribuição dos pacientes de acordo com o resultado do Teste de Morisky-Green-Levine... 48 Tabela 6. Distribuição dos pacientes de acordo as caraterísticas sociodemográficas, segundo o resultado do Teste de Morisky-Green-Levine... 49 Tabela 7. Distribuição dos pacientes de acordo as respostas sobre as variáveis epidemiológicas, segundo o resultado do Teste de Morisky-Green- Levine... .51 Tabela 8. Distribuição dos pacientes de acordo com as respostas sobre os fatores relacionados ao conhecimento sobre a doença, segundo o resultado do Teste de Morisky-Green-Levine...52
Gráfico 1. Distribuição de frequência quanto ao tipo de medidas profiláticas utilizadas pela criança... 53
INDICE DE FIGURAS
Figura 1. Províncias de Angola... 42 Figura 2. Municípios de Malanje... 43
ACT ...Artemisinina
ADPP…Ajuda de Desenvolvimento de Povo para Povo AL... Artemeter + Lumefantrina
AQ... Amodiaquina AS... Artesunato
CDC... Centers for Disease Control and Prevention DHA…. Dihidroartemisina
DDT…. Diclorodifeniltricloroetano INE…… Instituto Nacional de Estatística MAS…. Ministério da Saúde de Angola
PNCM... Programa Nacional de Controlo da Malária PPQ…. Piperaquina
RBM.... Roll Back Malaria
USAID. U.S Agency for International Development UTIS…. Unidades de Tratamento com Inseticida
VIH/SIDA...Vírus de Imunodeficiência Humana/ Síndrome de Imunodeficiência Adquirida
INTRODUÇÃO
A malária é um problema de saúde de elevada importância, devido a sua alta incidência mundial e às consequências que traz às pessoas acometidas pela doença, influenciando significativamente o potencial de desenvolvimento de países, regiões e estados pelos múltiplos custos que acarreta. Estudos realizados em áreas endémicas estabeleceram que a malária causa perdas consideráveis para as famílias sob forma de rendimento, os custos com o tratamento, perda de escolaridade e diminuição de produção agrícola (Sequeira, 2016; Flessa, 2013).
O relatório da World Health Organization (WHO, 2018) indica a endemicidade da malária em 90 países de diferentes regiões continentais, nomeadamente África, Ásia do Pacífico, América e Sudeste Asiático, sendo que 3,4 mil milhões de pessoas apresentam riscos de contrair a malária por residir em zonas endémicas totalizando 40% da população mundial, dos 90 países endémicos, 17 pertencem ao Continente Africano, significando que 92% dos casos de malária ocorreram no continente Africano, 5% no Sudeste Asiático e 2% nas regiões do Mediterrâneo Oriental (WHO, 2018).
Segundo dados de 2017 verificaram-se 219 milhões de casos de malária e 435 000 mortes por malária em todo o mundo (WHO, 2018).
Dados do relatório da WHO (2018), mostram uma diminuição dos casos de malária a nível mundial entre 2010 e 2017, um decréscimo na ordem de 18%. A região Sudeste Asiática continua a ver sua taxa de incidência diminuir de 17 casos da doença por 1000 habitantes em risco em 2010, para 7 em 2017 (uma diminuição de 59%). Todas as outras regiões não registaram variações de incidência, exceto a região das Américas que registou um aumento em grande parte devido ao alastramento de transmissão da infeção no Brasil, Nicarágua e Venezuela.
Em África a taxa de incidência da malária permaneceu em 219 casos por 1000 habitantes em risco pelo segundo ano consecutivo. O maior número dos casos de malária em 2017, ocorreram na região Africana (92%), seguida da região do Sudeste Asiático (5%), e nas regiões do Mediterrâneo oriental (2%). Dados estatísticos reportam que 93% das mortes por malária, ocorreram em África (WHO, 2018).
As estratégias de combate à doença que se tem implementado, com objectivo de identificar populações de risco, reduzindo os níveis de transmissão da doença e tornar o sistema de saúde de vários países mais eficientes, tem contribuído significativamente na
redução dos casos de malária bem como a taxa de mortalidade observada entre 2010 e 2017 (WHO, 2018).
Sendo uma doença de grande preocupação para a população, a WHO (2018), define a existência de grupos vulneráveis onde a doença apresenta-se com maior prevalência: Crianças menores de cinco anos de idade, mulheres grávidas, lactentes, pacientes com Vírus de Imunodeficiência Humana/ Síndrome de Imunodeficiência Adquirida (VIH/SIDA), migrantes não imunes bem como populações móveis e viajantes.
Em Angola, a malária está distribuída por todo o país, sendo endémica nas 18 Províncias. Considera-se que as províncias do Norte são as mais afetadas (Cabinda, Uíge, Zaire, Cuanza Norte, Cuanza Sul Malanje, Lundas Norte e Sul), devido às suas características geográficas e climáticas, tornando-se na principal causa de morte por doença em Angola, igualmente de internamentos hospitalares e ausência escolar ou do trabalho, provocando um impacto negativo na saúde das populações na educação e economia do País, Plano Nacional de Controlo da Malária (ADPP, 2006; MINSA, 2017).
Em 2017, registaram em Angola 4.500.221 casos de doença e um total de 13.967 mortes por malária. Ao considerar as estatísticas de mortalidade, o Ministério da Saúde em Angola, para o ano 2018 reportou dados de 3.007.111 casos e 7.356 mortes. Uma quebra quase a metade face ao ano anterior (MINSA, 2017).
As crianças menores de cinco anos de idade são as mais vulneráveis, tendo a OMS estimado que em 2017, representaram cerca de 61% (266.000) óbitos por malária em todo mundo (WHO, 2018). Ao considerar que a malária aumenta o risco de anemia ferropénica (52%), síndromes febris, convulsões, hemo-transfusões e mortes nesta idade, considera-se uma população muito vulnerável de adoecer e morrer por esta causa. Em Malanje foram notificados em 2018, cerca de 301. 371 casos de malária dos quais 273 863, foram crianças menores de cinco anos de idade e destes casos 391 resultaram em óbitos ocorridos no mesmo período, neste grupo etário (DPSM, 2018).
Em Angola os dados de morbilidade e mortalidade por malária são recolhidos pelas unidades de saúde, que igualmente registam a dispensa e consumo de anti-maláricos. Para monitorizações e avaliações de todos os casos de malária, o Programa Nacional de Luta Contra a Malária (PNCM), criou um ponto focal nacional, existindo em cada província um supervisor de controlo da doença (médico ou outro especialista). Em
Malanje o ponto focal da malária é responsável pelo apoio institucional em planear, implementar e desenvolver atividades de prevenção a malária. Os dados devem ser recolhidos com regularidade a partir dos pontos focais, e depois transmitidos ao nível nacional por intermédio das províncias (Governo de Angola, 2015).
Dados da Agência dos Estados Unidos para o Desenvolvimento Internacional, (USAID, 2016) revelaram o esforço de Angola no combate à malária, evidenciado pelo aumento dos serviços de saúde, pela reabilitação e reconstrução de infraestruturas sanitárias, assim como pelo uso de combinações terapêuticas eficazes. Estas estratégias têm fornecido informação útil e com impacto positivo na população angolana. Neste sentido, considera-se que há necessidades de enfocar a atenção a este problema de saúde, por forma a melhor caraterizar o perfil epidemiológico da doença nesta população e sua repercussão na qualidade de vida e no estado de saúde dos angolanos (USAID, 2016). Segundo (Brawley e Culos-Reed, 2000), os termos adherence e compliance têm significados diferentes: Compliance, pode ser traduzido como obediência, cumprimento de regras, pressupondo papel passivo do paciente. Adherence, traduzido como aderência ou adesão, caracteriza a escolha livre das pessoas em adotar ou não certa recomendação, isto é, concordância autônoma. Ambas terminologias são muito comuns em estudos observacionais desta natureza, considerando a adesão como uma situação na qual o paciente compreende a sua condição, os aspetos básicos da doença e a importância da adesão para melhoria do quadro clínico.
O tratamento é um dos pilares fundamentais para que o controlo da malária seja bem-sucedido, no entanto em todo mundo um número significativo de doentes abandona ou não cumpre com as prescrições médicas. Em alguns países de África, bem como no Equador e Peru, a baixa adesão ao tratamento é uma das principais barreiras encontradas no combate à malária (Farmer, 1999).
É consensual que a não adesão à terapia medicamentosa da malária é uma das principais causas de insucesso no tratamento e pode contribuir para a manutenção da cadeia de transmissão do protozoário, gerando danos para o paciente, família, serviço de saúde, comunidade específica e até população em geral. Por outro lado, acrescenta-se que a resistência aos medicamentos e o subsequente aumento dos custos com o tratamento não pode ser também menosprezados (Farmer, 1999).
Outros fatores descritos que influenciam a adesão à terapêutica são a percepção do paciente e família da gravidade da patologia, o conhecimento sobre o tratamento, a confiança na prescrição e na equipa de saúde (Leite e Vasconcellos, 2003).
Em Angola, os anti-maláricos autorizados pelo Ministério da Saúde são distribuídos em todo país de forma gratuita e incluem diversos medicamentos em que os mais utilizados são as combinações de Coartem, Coarsucam, Quinino e Primaquina. Estes medicamentos são prescritos de acordo com o tipo de malária diagnosticada e a espécie de Plasmodium (malária por P. falciparum, P. ovale, P. malariae e P. vivax), em Angola o P. falciparum é o parasita mais predominante com 99,7% (MINSA, 2005-2009).
A infeção por P. falciparum é clinicamente silenciosa, refletindo a capacidade adaptativa dos mecanismos imunológicos em prevenir a doença (Schofield & Grau, 2005). No entanto, em indivíduos não imunes (viajantes e crianças menores de cinco anos) as infeções são clinicamente mais evidentes e uma minoria destas aproximadamente 1% podem tornar-se graves ou potencialmente fatais (Mackintosh, Beeson e Marsh, 2004). A doença pode manifestar-se como síndrome discreto ou como uma sobreposição de síndromes aparentando múltiplas etiologias. Em caso de morte pode ocorrer o envolvimento de um simples órgão ou, pelo contrário, este ser multiorgânico (Weatherall e Cobb, 2001; Schofield e Grau, 2005; Tampuz, Jereb, Muzlovic e Prablu., 2003).
Os padrões gerais da doença dependem marcadamente da idade e da prévia experiência imunológica do hospedeiro. Em áreas de alta transmissão da malária o fardo é suportado sobretudo por latentes e crianças pequenas, com risco de vida, sendo o cenário de doença fatal dominado clinicamente por quadros de disfunção respiratória (distress respiratório), malária cerebral (MC) e anemia severa da malária (Weatherall e Cobb, 2001; Tampuz et al, 2003; Rogerson, Grau e Hunt, 2004; Schofield e Grau, 2005; Crawley, Chuc, Mtove e Nosten, 2010).
No entanto, em áreas de menor transmissão a infeção primária pode ocorrer tardiamente, na idade adulta. Nestas situações a doença grave traduz-se, com frequência, por distúrbios adicionais tais como insuficiência renal, edema pulmonar, choque e icterícia. Alguns estudos reportam como fatores determinantes e principais na
doença a dinâmica da transmissão, a idade e as respostas imunológica e genética do hospedeiro (Weatherall e Cobb, 2001; Schofield e Grau, 2005).
De acordo com OMS, define-se a malária não complicada (não grave), como: malária sintomática, sem sinais de gravidade ou evidências clínicas ou laboratorial de disfunção de um ou mais órgãos vitais. Geralmente os sintomas e sinais (febre, astenia, edema) referido pelo paciente, não permite a tomada de decisões assertivas e ajustadas às necessidades específicas do paciente durante o atendimento clínico. A doença é suspeitada clinicamente, principalmente na base da febre ou de história de febre (WHO, 2010a). A malária é uma doença curável se diagnosticada e tratada precoce e corretamente. No entanto é considerada muitas vezes como uma emergência médica, sobretudo pela rápida progressão para complicações e morte (Weatherall, 2002; Tampuz et al., 2003; White, 2003; WHO, 2010a; Crawley et al., 2010). O período de incubação (tempo que decorre desde a inoculação dos esporozoítos até ao desenvolvimento dos sintomas) pode ser significativamente prolongado quer, pelo nível de imunidade adquirida por meio de exposição prévias (White, 2003; Tampuz et al, 2003), como pela quimioprofilaxia antimalárica ou pela terapêutica supressiva que pode atenuar, mas não prevenir a doença (Taylor e Strickland, 2000). Dependendo da espécie, pode variar entre sete a trinta dias (períodos mais curtos são atribuídos a infeções por P. falciparum e mais longos para P. malariae). Têm sido reportadas algumas exceções (White, 2003), por exemplo em relação à malária não P. falciparum, período de incubação é habitualmente mais longo (média 15-16 dias). Nas infeções por P. vivax, o período mais longo de incubação descrito, foi de 4 a 13 meses (White, 2003; Tampuz et al., 2003). Nos indivíduos não imunes com infeção por P. falciparum, o período pré-patente (tempo que decorre entre a inoculação dos esporozoítos e a deteção da parasitemia) é em média de 10 dias (variando entre 5-10 dias), enquanto o período de inoculação é em média de 11 dias (6-14 dias) (Tampuz et al., 2003).
A crise febril clássica da malária geralmente associada a infeção por Plasmodium falciparum raramente se observa, tendo uma duração muito variável de seis a dez horas. Clínica e tradicionalmente distinguem-se três fases: Fase fria – de início brusco, caraterizada por calafrios e tremor, Fase quente – correspondente ao início da febre, acompanhada por cefaleias, vómitos e convulsões, principalmente em crianças, com uma duração de três a oito horas; finalmente a Fase húmida – caraterizada por sudação abundante, com temperatura normal ou hipotermia e fadiga. Classicamente refere-se que
a periodicidade da febre varia em função da espécie. Assim a febre “terçã” ocorre sobretudo nas infeções por P. falciparum, P. vivax e P. ovale e a febre “quartã” é comummente atribuível às infeções por P. malariae. Constituem exceções as infeções por P. falciparum que podem apresentar febre continua ou muito irregular e sem periodicidade. A febre é um sintoma muito comum, mais de 92% dos doentes referem sobretudo os não-imunes (Tampuz et al., 2003).
A OMS, recomenda a avaliação e monitorização da parasitemia dos casos tratados (WHO, 2010a; WHO, 2010b; White, 2011).
Com a propagação da farmacoresistência, a OMS tem preconizado a utilização das combinações baseadas na artemisinina como a terapia de primeira linha quer em situações de malária não complicada/não grave, como em situações de doença grave. Estas combinações de artemisinina (ACTs), apresentam uma vantagem de 98% da redução rápida e significativa da biomassa parasitária, a rápida resolução dos sintomas clínicos, atividades efetivas contra Plasmodium falciparum multirresistente, a diminuição dos portadores de gametocitos e consequente redução da transmissão. Apesar de controversa, têm sido relatadas poucas reações adversas e fraca resistência do parasita com o uso da artemisinina e seus derivados.
Price (1996), referiu como desvantagem da utilização dos ACTs a ausência do efeito hipnozoiticida quando utilizado em monoterapia (Price, 1996).
É neste sentido que surge o presente trabalho, que procurou responder o seguinte problema científico:
Qual é o perfil epidemiológico da malária e a adesão ao tratamento em menores de cinco anos na província de Malanje-Angola no período Fevereiro-Março de 2019?
HIPÓTESES DE TRABALHO
Dada a escassez de estudos em Angola, sobre o perfil epidemiológico da malária e a adesão ao tratamento em menores de cinco anos de idade, realizou-se este estudo observacional, transversal com uma componente analítica.
A. Pretendemos com este estudo, identificar se existia associação entre adesão ao tratamento e as variáveis sociodemográficas, epidemiológicas e fatores relacionados ao conhecimento da doença.
H0 [hipótese nula]: Não existe associação entre adesão ao tratamento e as diferentes variáveis de estudo.
H1 [hipótese alternativa]: Existe associação entre adesão ao tratamento e as diferentes variáveis de estudo.
OBJECTIVOS:
Objetivo geral
Descrever o perfil epidemiológico e a adesão ao tratamento dos menores de cinco anos de idade com diagnóstico clínico de malária em Malanje-Angola no período de Fevereiro-Março de 2019.
Objetivos específicos
Ø Caracterizar os casos incidentes de malária em menores de cinco anos que se dirigem aos serviços de saúde na Província de Malanje-Angola durante o período em estudo.
Ø Estimar a frequência de adesão ao tratamento da malária na Província de Malanje-Angola durante o período em estudo.
Ø Identificar as causas associadas ao abandono do tratamento na província de Malanje-Angola durante o período em estudo.
JUSTICATIVA
A malária atinge de forma endémica 90 países em todo o mundo. Estes países estão localizados na faixa intertropical e reúnem, além de condições favoráveis para o crescimento do vetor, condições precárias de moradias. Milhões de pessoas no mundo apresentam risco de contrair a doença, a maior parte encontra-se no continente africano (Brilhante, 2013).
A malária é um grande problema de saúde pública no mundo, pois apresenta alta incidência e tem influenciado negativamente o desenvolvimento de países, estados e cidades, pelos altos custos que acarreta (Velasco et al. , 2017).
O estudo da malária tem uma grande importância em países do terceiro mundo, como países africanos, do Sudeste da Ásia e na Região Amazónica da América do Sul.
No continente africano, ocorre em grandes proporções nas cidades da África Austral (Angola, Botsuana, Suazilândia, Moçambique, Namíbia, África do Sul, Zâmbia e Zimbabué) onde o P. falciparum é o mais prevalente (99.7%). A doença ocorre em regiões cuja as condições ambientais são insatisfatórias. O crescente aumento dos casos e o aumento das taxas de mortalidade, impulsiona os órgãos de saúde a trabalharem nas questões de promoção de saúde para prevenção da malária (Reiners, Azevedo, Ricci e Sousa, 2010).
Após pesquisas bibliográficas realizadas sobre o tema, verificou-se a falta de estudos referentes a malária em Malanje, tornando como um dos fatores da baixa quantidade de produção científica nessa área.
Neste sentido, espera-se que este trabalho possa contribuir para o melhor entendimento do perfil epidemiológico da malária, auxiliando estudos futuros e que possa ser uma mais valia ímpar no sentido de se promoverem ações de sensibilização no seio dos responsáveis de saúde pública, e com isto dar um valor acrescido na implementação de medidas preventivas e profiláticas que incentivem para a continuação ao combate da malária na população geral e em crianças menores de cinco anos em particular, pois segundo a OMS estas integram um grupo de risco no que diz respeito à doença, pela sua vulnerabilidade.
CAPITULO I. FUNDAMENTOS TEÓRICOS RELACIONADOS AO PERFIL EPIDEMIOLÓGICO DA MALARIA E ADESÃO AO TRATAMENTO EM MENORES DE CINCO ANOS.
O capítulo I, apresenta os fundamentos teóricos relacionados a antecedentes históricos da entidade. A epidemiologia da Malaria. Ao considerar os, elementos conceptuais sobre adesão ao tratamento e estatísticas em termos de morbilidade e mortalidade por malária a nível mundial, em África, em específico em Angola e especificamente em idade pediátrica. O autor estabelece pontos de contactos dos referentes teóricos que abordam o objeto de estudo e oferece as considerações a respeito, assim como a definição de adesão ao tratamento da malária em menores de cinco anos.
1.1 – Antecedentes históricos da malária.
A malária sempre foi desde a antiguidade, um dos principais flagelos da humanidade. Vários registos sobre prováveis infeções humanas de malária, foram encontrados ao longo dos tempos em documentos chineses que remontam a 3000 anos a.C. (Biggs e Brown., 2001; Carter e Mendis, 2002). Textos antigos provenientes do Egipto, da Índia e da Grécia fazem referência a sintomas como febres intermitentes e até febres epidémicas mortais (Carter e Mendis, 2002). A doença chegou a ser relacionada com a punição de deuses e presença de maus espíritos presentes nos pântanos, foi justamente essa ligação da febre com áreas alagadas que, séculos mais tarde, exatamente no século XIV, os italianos passaram chamá-la de mal aria (mau ar), pois se acreditava que era transmitida pelo odores fétidos que emanavam dos pântanos (França, Santos e Figueroa-villar, 2008; CDC, 2015). Hipócrates foi o primeiro a descartar as superstições e descreveu detalhadamente os sintomas da malária, distinguindo a febre malárica intermitente da febre contínua provocada por outras doenças infeciosas e mencionou as alterações no baço provocadas pela doença. Também relacionou a doença com a época do ano e os locais que os pacientes frequentavam e onde viviam (CDC, 2015).
No século XVII missionários Jesuítas descobriram que tribos indígenas sul americanas usavam a casca de uma árvore, Cinchona spp, para o tratamento de febres, o princípio ativo dessa árvore, a quinina foi isolada em 1820 por Pelletier e Caventou, e manteve-se a droga de eleição para o tratamento e prevenção da malária durante muito tempo (Biggs e Brown, 2001).
Em 1880 Charles Louis Alphonse Laveran, ao examinar sangue de um paciente que apresentava febre há 15 dias, verificou a existência de parasitas dentro dos eritrócitos. Laveran acreditava que só havia uma espécie, oscillariamalariae (CDC, 2016). Esta descoberta foi, no início alvo de algum ceticismo porque a comunidade científica acreditava que a malária era causada por uma bactéria, Bacillus malariae, pela sua descoberta foi-lhe atribuído o prémio Nobel em 1907 (Biggs e Brown, 2001).
Camillo Golgi estabeleceu, em 1886, que havia pelo menos duas formas de doença uma terçã e outra quartã. Golgi observou que estas produziam diferentes quantidades de novos parasitas e que a febre coincidia com a rotura dos eritrócitos e libertação dos parasitas para a corrente sanguínea (CDC, 2016). Em 1890, Giovanni Grassi e Raimundo Filetti deram o nome P. vivax e P. malariae as duas espécies de parasitas identificadas. Em 1897, William H. Welch atribuiu o nome Plasmodium falciparum a espécie responsável pela malária terçã. No mesmo ano Ronaldo Ross demonstrou que os parasitas podiam ser transmitidos a pacientes infetados por mosquitos. Mais tarde mostrou que os mosquitos podiam transmitir parasitas da malária entre pássaros. Pela sua descoberta, Ross, recebeu um Prémio Nobel em 1902. Entre 1898 e 1899, Giovanni Batista Grassi, Amico Bignami e Giuseppe Bastianelli descreveram o ciclo completo de desenvolvimento do parasita no Homem e no mosquito. Foi em 1922 que John William Watson Stephens descreveu a quarta espécie do parasita, Plasmodium ovale (CDC, 2015).
O tratamento alternativo com a quinina surgiu em 1934 quando Hans Andersag descobriu a cloroquina, mas esta só foi reconhecida como sendo eficaz e segura em 1946 (Biggs e Brown, 2001; CDC, 2015). Paul Muller, em 1939, descobriu as propriedades inseticidas do Diclorodifeniltricloroetano (DDT), composto este que tinha sido sintetizado por um estudante de química Othmer Zeidler em 1874 (CDC, 2015). Após a descoberta da cloroquina foram desenvolvidos o proguanil e a pirimetamina, tendo sido largamente usados, mas a sua eficácia começou a diminuir durante os anos 50. Em 1960 começaram a ser observadas na Tailândia e Colômbia, resistências a cloroquina por parte de Plasmodium falciparum, tendo-se gradualmente espalhado para a maior parte das zonas endémicas (Biggs e Brown, 2001).
O parasita knowlesi teria sido identificado em 1931 em macacos por Robert Knowles e Biraj Mohan Das Gupta (CDC, 2015; Cox-Singh, 2008). Só em 1965 foi documentada
pela primeira vez a infeção por P. knowlesi num homem que se encontrava a viajar pela Malásia (CDC, 2015). Até há relativamente pouco tempo, pensava-se que a infeção provocada por este parasita em humanos era rara. No entanto, entre Novembro de 2004 até Março de 2005 foram relatadas 4 mortes na Malásia (Cox-Singh, 2008).
Atualmente, há 90 países que estão em risco para malária, a maioria deles localizados no continente africano. Estima-se que há nessas regiões aproximadamente 3,4 mil milhões de pessoas localizadas apenas em 27% da superfície terrestre (Guerra, Snow e Hay, 2006).
A Organização Mundial da Saúde (OMS), a partir de 1992, foi desenvolvendo estratégias que culminou em Abril de 2000, com assinatura da Declaração de Chefes de Estado em Abuja, que orienta para o desenvolvimento de uma iniciativa de fazer recuar o paludismo no Continente Africano até ao ano 2030. A estratégia teve por meta fazer com que a malária nos próximos 25 anos deixe de ser um problema de saúde pública para a África (WHO, 2001-2010).
1.1.2 - Histórico da Malária em Angola.
(Fortes, 2011) no âmbito da sua dissertação de doutoramento, efetuou e apresentou um levantamento histórico da malária em Angola [pp 33-37] do qual se destacam aqui, apenas os marcos que consideramos relevantes: A malária é conhecida em Angola desde a antiguidade, contudo os primeiros registos datam de 1923, altura da realização do 1º Congresso de Medicina Tropical da África Ocidental, realizado em Luanda, onde a malária em Angola ocupa um lugar de destaque (Cambournac, Gâmdara, Pena e Teixeira, 1955a).
1942-1952 – É proposta a estratificação de Angola em três zonas:
• Zona equatorial, englobando a região de Cabinda e dos Bakongos com alta transmissão durante todo ano;
• Zona Tropical, estendendo-se da bacia do Congo até a província de Benguela; • Zona Subtropical, correspondente à região sul do país (tendo em conta a
influência climática da Namíbia e do Kalahari) (Cambournac e José, 1955b; Cambournac, Gâmdara e Pena, 1955c).
1955 – 1958 – Cambournac e José (1955b), aproveitou a presença da Missão de Prospeção de Endemias em Angola que deveria fazer o estudo da incidência e da distribuição da febre-amarela, para ao mesmo tempo fazer o primeiro inquérito sobre malária em Angola, realizado em todo o território com exceção de Capelongo, Mulondo e Vila Salazar. Diversos estudos reportavam a existência, na época de diferenças de prevalência entre as localidades – na província do Bié a prevalência entre as localidades variava de 5% a 80%. Inquéritos efetuados revelaram na época uma situação de transmissão esporádica para a localidade do Lobito e de hipoendemia para a cidade de Luanda. O parasita dominante era Plasmódium falciparum e a população vetorial tinha a
seguinte distribuição:
a) Complexo Anopheles gambiae com predomínio da espécie An. gambiae em toda a parte setentrional, An. Melas no Lobito e An. Arabiensis no sul. An. melas na época terá sido igualmente dominante em Luanda;
b) An. Funestos encontra-se igualmente descrito nos documentos da época juntamente com o An. nili como vetores dominantes, com referências a An. pharoensis como vetor secundário.
Os portugueses ensaiavam pela primeira vez a aplicação de inseticidas residuais numa região bastante limitada no Sul de Angola (Cambournac et al, 1956b-1955c).
1960 – 1970 – Foi elaborado um projeto com o objetivo de organizar equipas de luta contra a malária nas principais cidades e implementando um projeto-piloto de erradicação da malária na província de Benguela (centro-sul) com a duração de três anos.
1975 – 1985 – É proposta a criação do serviço de luta contra a malária a nível nacional. Ação que deveria contar com o apoio da OMS. Esta situação não foi concretizada, devido à ascensão de Angola à Independência. Somente em 1984, com o apoio da OMS, inicia-se a implementação do PNCM e realiza-se o primeiro estudo in vivo e in vitro de resistência de P. falciparum à cloroquina (Dias, 1985).
1992 – 1999 – Angola subscreve a declaração de Amesterdão que orienta a nova estratégia mundial. Em 1997 realiza-se a Cimeira dos Chefes de Estado da Organização de Unidade Africana (OUA). Angola subscreve a iniciativa Africana de Aceleração da luta contra o paludismo e associa-se a iniciativa Africana contra o paludismo no século
XXI. Com o apoio da UNICEF, foi realizado o primeiro estudo específico sobre conhecimentos, atitudes e práticas (CAP) em relação à malária, na comuna da Funda, província do Bengo. Este estudo serviu de base à introdução do uso de redes mosquiteiras tratadas com inseticida, numa iniciativa piloto que se foi generalizando nos anos seguintes a todas as províncias do país através da criação de Unidades de Tratamento com Inseticida (UTIS).
1999 – 2002 – Angola subscreveu em Moçambique, a Iniciativa Mundial RBM, tendo em 2000, no encontro dos Chefes de Estado dos Governos africanos, realizado na República Federal da Nigéria, subscrito a Declaração de Abuja que resume a iniciativa RBM. Em 2001 o Governo angolano disponibilizou o primeiro orçamento específico para um Programa nacional Integrado de Combate as Grandes Endemias, sendo a malária uma das prioridades, criando em 2002 uma Comissão Nacional de Combate ao VIH/SIDA, Malária e Tuberculose.
2003 – 2006 – Angola beneficia de financiamento do Fundo Global criado para o Combate à Malária, VIH/SIDA e Tuberculose, tendo sido reforçado, em 2005, por um financiamento complementar atribuído pelo Presidente dos E.U.A. George W. Bush e pelo Banco Mundial.
Em 2006, foi definida nova política de tratamento dos casos não graves de malária, com a introdução das combinações terapêuticas à base de artemisinina (ACTs) (Fundo Global de Luta Contra AIDS, 2009).
Em Angola o desenvolvimento dessa estratégia consiste na informação, educação comunicação, combate as águas estagnadas e luta anti larva, uso de mosquiteiros impregnados por todas as famílias e principalmente para as crianças e mulheres grávidas, uso de inseticida em residências, saneamento básico, água potável na comunidade, recolha do lixo e enterrar e identificação de áreas de risco (Fortes et al, 2006).
1.2–Epidemiologia da malária, elementos teóricos a considerar.
A epidemiologia da malária é muito complexa e pode apresentar variações consideráveis, mesmo nas áreas geográficas relativamente pequenas. O grau de
parasitemia e o índice esplénico, o índice esplénico que corresponde ao percentual de esplenomegalias em relação ao total de baços palpados (WHO, 2009); Greenwood, 1997; Mouchet, 2004). De acordo com a OMS (1964), citado por Mouchet (2004), as zonas endémicas têm a seguinte classificação: zonas hipo endémicas, aquelas cujo índice esplénico é inferior a 10%; meso-endémicas, zonas em que o índice varia entre 11% e 50%; híper endémicas, zonas com índice entre 51% a 75% e holo endémicas, aquelas em que os índices são superiores a 75% (Mouchet, 2004; Snow, 2005; Snow, 1997; White, 2003).
A malária, conhecida também como paludismo, impaludismo e maleita, é uma doença infeciosa causada por parasita da classe de Sporozoe da ordem Eucoccidiida, da família de plasmodidae, pertencendo ao género Plasmodium e do filo apcomplexa, intracelular obrigatório (Kasper, 2015).
Assim sendo, a malária é uma protozoose dos eritrócitos causada nos humanos por cinco espécies do género Plasmodium. Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae e Plasmodium Knowlesi transmitida pela picada do mosquito fêmea do género Anopheles (Camargo, 2008; Cox-Singh, 2008). O género Plasmodium, o qual pertence a família plasmodidae é caracterizado por apresentar dois tipos de multiplicação no seu ciclo de vida; uma assexuada e outra sexuada (Dronamraju e Paolo Arese, 2006). São conhecidas cerca de 156 espécies de Plasmodium, sendo que 350 espécies de mosquitos do género Anopheles foram estudadas. Dentre estes, 50 são considerados transmissores da malária com a nomenclatura de Anopheles gambiae (Camargo, 2008).
O Plasmodium falciparum, é responsável pela febre terçã benigna ou subterçã maligna, que geralmente está associada a formas severas e fatais da doença com períodos de incubação de 12 dias aproximadamente (Schofield e Grau, 2005). Este mesmo Plasmodium é unicamente responsável pela malária cerebral, porque os eritrócitos ficam aderidos à microvasculatura cerebral dificultando o fluxo sanguíneo normal, provocando a congestão, o edema, a anoxia até mesmo a morte.
Outros sintomas podem estar presentes, provocados por esta espécie como: falência renal, disfunção do miocárdio e arritmias, hipoglicemia, disfunção hepática, distúrbio
metabólico e icterícia. Quando não há evidências de disfunção de órgãos vitais, a letalidade é baixa sempre que se prove o tratamento rápido e efetivo.
Nessa linha de pensamento, quando são usados medicamentos inefetivos ou se verifica atrasos no tratamento principalmente em malária por P. falciparum, a carga de parasitas continua aumentando e pode desencadear uma malária complicada. O doente pode em poucas horas progredir a uma doença grave com uma ou mais das seguintes manifestações: coma, acidoses metabólicas, anemia severa, hipoglicemia, edema agudo do pulmão (Collins, 2005; Singh, 2004; Kasper, 2015).
O P. vivax, habitualmente não provoca mortalidade e é maioritariamente encontrado nos países tropicais e de clima temperado, tendo como período de incubação entre 10 a 20 dias. O P. malariae caracteriza-se pela ocorrência de acesso febril a cada 72 horas, sendo o seu período de incubação entre 12 a 18 dias (Mouchet, 2004).
Os sintomas de infeção por P. vivax, P. ovale e P. malariae são difíceis de serem distinguidos dos provocados por P. falciparum. Todavia, neste último, os pacientes podem evoluir rapidamente para malária mais grave, se não forem diagnosticados e tratados atempadamente. As outras espécies apesar de produzirem uma infeção mais simples possuem a capacidade de permanecerem latentes e provocarem recaídas anos mais tarde (Kasper, 2015).
As recaídas de P. vivax e P. ovale podem ocorrer dois a cinco anos após a exposição, mas normalmente, ocorrem nos primeiros seis meses. Na infeção por P. malariae, foram descritas recaídas 40 anos após a primoinfeção (Biggs e Brown, 2001).
O P. ovale, apresenta a mesma característica que o P. vivax, é prevalente na maioria dos países da África Subsariana e endémico nas Filipinas (WHO, 2009). O P. Knowlesi, é um parasita que se encontra nos macacos e porcos e habitam nas florestas do sudoeste Asiático (Cox-Singh, 2008).
Os Plasmodium são transmitidos ao homem pela picada do mosquito fêmea do género Anopheles, que estando infetados ao picar inoculam os esporozoítos, forma infetante do parasita. A transmissão também pode ocorrer ocasionalmente por inoculação direta de glóbulos vermelhos infetados por via transfusional, como transmissão vertical de uma
contaminadas, bem como acidentes de trabalho em pessoal de laboratório ou hospital. Três dos parasitas causadores da malária, são encontrados exclusivamente em humanos, P. falciparum, P. vivax e P. ovale. Após a picada, os parasitas chegam ao fígado onde multiplicam de forma intensa e rápida, entrando na corrente sanguínea e invadindo os glóbulos vermelhos, começando a destrui-los. A partir desse momento, aparecem os primeiros sintomas da doença (Kasper, 2015).
No processo de transmissão da malária, é importante atender-se ao período de incubação, que é o espaço de tempo que decorre entre a picada do mosquito infetado ao aparecimento dos primeiros sintomas, tendo este período uma duração mínima de 15 dias, na maioria dos casos (Camargo, 2008).
Neste sentido, todo o ser humano é suscetível a malária, mesmo aquelas pessoas que já a contraíram várias vezes, uma vez que a imunidade induzida pela presença do parasita nunca confere uma proteção total (CDC, 2010a). Outros relatos indicam que em situações em que o individuo já apresentou vários episódios da doença, pode ser verificado um abrandamento dos sintomas (Collins e Jeffery, 2005). Segundo Milner (2010), afirma que as crianças com idades inferiores aos cinco anos, mulheres grávidas e adultos sem imunidade, representam os grupos de maior risco em contrair a doença. As características clínicas da malária dependem da espécie de Plasmodium, do número de parasitas e do estado imunitário do hospedeiro humano. Geralmente o seu quadro clínico é caracterizado pelo calafrio, febre e sudoração, cefaleia e complicações respiratórias (Collins e Jeffery, 2005).
Caso a doença não seja diagnosticada atempadamente e tratada, podem surgir complicações tais como, desenvolvimento de anemia devido a elevada destruição dos eritrócitos pelo parasita (Ajuda de Desenvolvimento de Povo para Povo) (ADPP, 2006). Outros autores realçam que uma vez a infeção progride, pode-se verificar uma esplenomegalia devido à função de remoção dos eritrócitos parasitados da corrente sanguínea, bem como pode-se verificar a hepatomegalia em uma menor extensão (Biggs e Brown, 2001).
Em Angola, a malária constitui um grave problema de saúde pública, atualmente representando a primeira causa de morbi-mortalidade, absentismo laboral e escolar, no país mais de três milhões de habitantes estão sob risco de contrair a doença a qual lidera
a lista de doenças endémicas nas 18 províncias com possibilidades de surtos epidémicos em algumas delas, observando-se um aumento da transmissão durante a estação de chuva com picos entre os meses de Janeiro e Maio. Em Angola as espécies identificadas são P. falciparum, P. vivax, e P. malariae, sendo o P. falciparum o parasita predominante, responsável por cerca de 99.7% de todos os casos da malária no país (Rowe, 2009).
1.3 – Morbilidade e mortalidade associada a malária em idade pediátrica.
A morbi-mortalidade em idade pediátrica relacionada a malária continua preocupar todos os envolventes nesta luta, uma vez que se verifica que a taxa de morbilidade se mantém elevada, apesar de registrar uma redução na mortalidade pela doença nesta idade em 2017 em comparação ao ano 2010. Este grupo é considerado como vulnerável ao considerar o maior nível de infeção pela malária. Em 2017 representou 61% das mortes (266.000) em todo mundo. O Relatório da OMS (2018), indica que há poucos avanços na luta contra malária o que compromete a estratégia de erradicação da doença em muitos países (WHO, 2018).
Na literatura científica especializada, reporta-se que houve uma diminuição de mortalidade por esta causa desde o ano 2010 e 2017, influenciado pelo impacto das ações de controlo da malária, uma melhoria da situação nutricional da população e na confirmação laboratorial dos diagnósticos. Apesar disto, ainda subsiste a necessidade de se prestar atenção ao tratamento de casos de malária, seu diagnóstico e mortalidade intra-hospitalar devido à falta de técnicas suficientes por parte de alguns técnicos na realização de diagnósticos diferenciais, tornando-se este aspeto um fator de potenciação da mortalidade intra-hospitalar supostamente por malária (WHO, 2017).
De acordo com a Agency for International Development (USAID, 2016), esforço no combate à malária foi notável, uma vez que foram aumentados os serviços de saúde, a reabilitação e reconstrução de infraestruturas sanitárias. Por outra parte o uso de combinações terapêuticas eficazes que oferecem, cada vez mais garantias e confiança nos serviços de saúde.
Segundo a Organização Mundial da Saúde (2018), estimou que o impacto da malária na saúde e no desenvolvimento económico das populações humanas é maior nas regiões tropicais e subtropicais. No ano 2017, reportou-se 219 milhões de casos e 435 000
cinco anos de idade que tiveram a malária como causa. Do total de casos registrados a nível mundial, 200 milhões (92%) e 403 000 (93%) mortes ocorreram em África onde 99,7% dos casos são devidos ao P. falciparum. Em específico, Angola registou 4.500.221 casos e 13 967 mortes. Entretanto, reduções importantes da taxa de mortalidade infantil devido à malária vêm acontecendo em vários países, como por exemplo, no Quénia (O´meara e Lang, 2009; WHO, 2018).
Incrivelmente, 80% das mortes concentraram-se em apenas 17 países de África e Índia, sete destes países são responsáveis por 53% das mortes por malária em todo mundo, a saber: Nigéria (19%), República Democrática do Congo (11%), Burkina Faso (6%), República da Tanzânia (5%), Serra Leoa (4%), Níger (4%) e a Índia com (4%) (OMS, 2008; WHO , 2018).
1.4 -Fatores associados a morbi-mortalidade por malária.
Até ao final do século XIX, as doenças infeciosas parasitárias entre os principais problemas de saúde pública, sendo responsável por elevadas taxas de mortalidade e baixa expectativa de vida das populações humanas. Prevalece desta forma diversas condições que favorecem o processo de transmissão da doença, dentre estes destaca-se: a fonte de alimentação (humana ou outra), o local de habitação (dentro ou fora das casas) a altura em que se alimenta e o tempo de vida do mosquito (Capinha, 2009). Coexistem outros fatores dos quais: condições ambientais que assumem uma grande importância na transmissão da doença, dentro destes a temperatura. Apesar de uma elevada resistência a temperaturas elevadas, o comportamento do mosquito é muito sensível a este fator podendo afetar aspetos como a duração do período de hibernação e o estímulo a alimentação. Para além de afetar o comportamento do mosquito a temperatura também condiciona o desenvolvimento do parasita no interior do mosquito (Weber, 2004; Capinha, 2009). Com o aumento da temperatura, o período de incubação do parasita diminui tornando-se infecioso mais rapidamente. Por tanto as temperaturas mais baixas o parasita demora mais tempo a tornar-se infecioso o que pode impedir para a transmissão já que o tempo de vida do mosquito pode não permitir o desenvolvimento completo do parasita.
Como exemplo a uma temperatura ambiente de 19ºC, o P. falciparum demora 30 dias para se desenvolver, fato este que é impeditivo para transmissão pois o mosquito tem
um tempo médio de vida inferior, já que o P. vivax a essa temperatura, consegue completar o seu desenvolvimento em menos de 20 dias, ou seja, em clímas mais temperados à malária só se vai transmitir em curtos períodos de tempo, quando a temperatura assim o permitir (Weber, 2004).
A altitude é considerada como um fator dentro das condições ambientais, que influência a distribuição, ao considerar que a altitude elevada a temperatura é mais baixa, limitando a transmissão da doença. Por outra parte, a água também é um aspeto essencial para o desenvolvimento do mosquito. Três das quatro fases do ciclo de vida do mosquito são exclusivamente aquáticas e têm lugar geralmente em águas paradas (Gomes, 2011). Vários são os autores que referem que as chuvas aumentam reprodução dos mosquitos, mas, no entanto, se a precipitação for muito elevada, esses locais são destruídos resultando numa diminuição do número de mosquito (Weber, 2004; Capinha, 2009; Gomes, 2010; Parente, Sousa e Ribeiro, 2012; Rey, 2001).
Na mesma linha de pensamento, o vento também condiciona a transmissão da malária. Em noites ventosas as picadas de insetos diminuem consideravelmente devido a dificuldade de voo do mosquito nestas condições (Webber, 2004). Outros fatores estão relacionados em boa parte com a falta de saneamento básico, baixo nível de escolaridade, fatores económicos, adoção de atitudes e comportamentos individuais e coletivos que propiciam o contacto humano com o vetor (WHO, 2010b).
Na mesma senda, vão existindo outros fatores como o pluviométrico e hidrológico. Porque a existência de padrões favoráveis de precipitação e a hidrologia do local, permitem o aumento de habitats de reprodução do mosquito. Há também uma forte dependência das condições de temperaturas para o desenvolvimento do parasita (Bomblies, 2012). A relação pode variar de espécie para espécie do vetor. Em situações de chuvas intensas, a água pode arrastá-los para lugares inadequados, dificultando o seu crescimento. Mas de forma geral, as chuvas favorecem a multiplicação dos insetos principalmente quando as precipitações são moderadas, intermitentes e alternadas com períodos de sol quente (Parente, Sousa e Ribeiro, 2012; Rey, 2001).
1.5 -Tratamento medicamentoso, adesão ao tratamento.
Para que seja garantida a melhoria do paciente infetado, é necessário a administração de um ou mais fármacos. Os medicamentos são escolhidos pelo médico de acordo com algumas informações sobre os seguintes aspetos: tipo de Plasmodium infetante, idade do paciente, histórico de exposição anteriores, gravidez e outros problemas de saúde, verificados caso a caso. De seguida apresentamos sumarizadamente os principais medicamentos segundo o nível de utilização, respetivamente as mais utilizadas atualmente e as de pouca utilização (Freitas, 2017).
Artemeter +Lumefantrina
Artesunate+Cloroquina (AS+CQ) Artesunate+Amodiaquina (AS+AQ)
Artesunate+Sulfadoxina+Pirimetamina (AS+SP) Artesunate+Mefloquina (AS+MQ)
Medicamentos de pouca utilização Piperaquina+Dihydroartemisinina
Piperaquina+Dihydroartemisinina+Trimetoprim Dihydroartemisinina+Piperaquina
Dihydroartemisinina+Naftoquina; Artesunate+pironaridina Artesunate+Chlorproguanil+Dapsone
Fonte: Retirado e adaptado de WHO (2010a) e WHO (2010b).
Com a ausência de uma vacina, a quimioterapia continua a ser uma das armas usadas para reduzir a morbi-mortalidade associada a malária. O tratamento tem como objetivo atingir o parasita em pontos-chave do seu ciclo evolutivo ou então interromper a esquizogonia sanguínea que é responsável pelas manifestações clínicas da infeção, interromper a transmissão do parasita através do impedimento do desenvolvimento das formas sexuadas (Gomes, 2010).
Segundo (Teixeira, 2001), referiu que o tratamento da malária em Angola foi padronizado após a criação do protocolo de tratamento da malária, produzido pelo Ministério da saúde.\
Os principais medicamentos são:
Primaquina: Em comprimidos de 5 e 15 mg de base. Usada para gametocitos de P. falciparum e hipnozoitos de P. vivax e P. ovale. É contra-indicado para gestantes e crianças menores de 6 meses, pelo risco de hemólise e em qualquer afeção que predisponha à granulocitopenia, incluindo artrite reumatoide e lúpus. Pode provocar
anorexia, náuseas e vómitos, dores abdominais, fraqueza e mal-estar. As reações mais graves são para o sistema hematopoiético.
Quinino: Em geral as apresentações orais e injetável contém 500 mg do sal que correspondem a 325mg da base. Pode ser usado isolado (em locais onde o P. falciparum ainda não desenvolveu resistência) ou com antibióticos (doxiciclina ou vibramicina). Pode ser usado em gestantes e crianças pequenas, sempre associada à clindamicina. Contra-indicações: hipersensibilidade ao tratamento recente com mefloquina. Uma única dose de mais de 3g pode causar intoxicação grave e potencialmente fatal precedida por depressão do SNC e convulsões. Tem também cardiotoxicidade.
Mefloquina: Comprimidos de 274mg de sal, correspondendo a 250 mg de base. Pode ser administrada a gestantes, porém não no primeiro trimestre da gravidez, os efeitos colaterais mais frequentes são tontura, náuseas, vómitos, diarreia e dor abdominal. O principal temor é com manifestações psiquiátricas graves. Contra-indicações: antecedentes de convulsão, história de alergia a mefloquina, antecedentes de doenças neurológicas ou psiquiátricas, ter recebido tratamento com mefloquina nos últimos 21 dias e arritmias cardíacas.
Artemisinina e seus derivados: só devem ser usados para P. falciparum e nunca em monoterapia, na tentativa de não promover mais resistências. Devem ser associados com clindamicina ou mefloquina. Na maioria dos casos aparecem mais artesunate (comprimidos de 50mg, cápsulas retais de 50 e 200 mg e frascos com pó para injeção intravenosa de 60mg) e artemeter (comprimidos de 50 mg e ampolas de 1ml para injeção intramuscular com 80mg). Nos últimos anos o Ministério da saúde, divulgou a orientação para o uso de coartem (artemeter associado ao lumefantrine) como primeira escolha para o P. falciparum não grave.
Principais esquemas de tratamento utilizado na malária
a) Tratamento das infeções pelo P. vivax ou P. ovale, são feitos com cloroquina em 7 dias.
b) Tratamento das infeções pelo P. vivax ou pelo P. ovale são feitos com cloroquina em 3 dias e específico em 14 dias (esquema longo).
c) Tratamento das infeções pelo P. malariae para todas as idades e das infeções por P.vivax ou P. ovale em gestantes e crianças com menos de 6 meses, são feitos com cloroquina em 3 dias.
d) Tratamento das infeções por P. falciparum com a combinação fixa de artesunate+mefloquina em 3 dias e específico em dose única.
e) Tratamento das infeções por P. falciparum com a combinação fixa de artemeter+lumefantrina são feitos em 3 dias.
f) Esquema de segunda escolha, recomendado para o tratamento das infeções por P. falciparum com quinino em 3 dias, doxiciclina em 5 dias e específico no 6º dia.
1.6 Especificidade de tratamento ao paciente pediátrico com malária:
O tratamento da malária em criança menor de cinco anos compreende o seguinte protocolo:
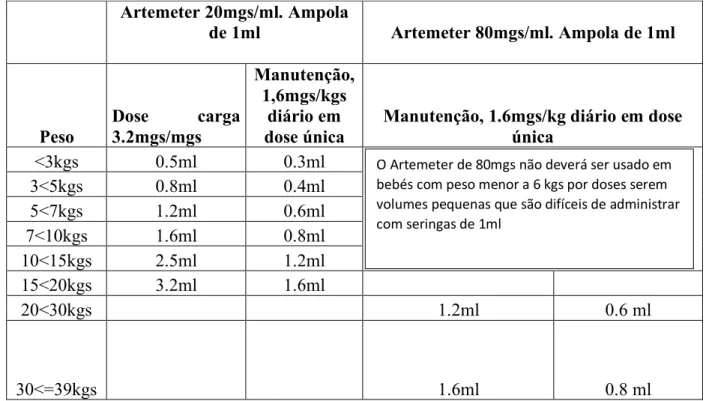
Tabela 1: Protocolo Nacional de: Tratamento de Malária em crianças com Artemeter em Ampolas de 80mgs/ml e 20mgs/ml. Artemeter 20mgs/ml. Ampola de 1ml Artemeter 80mgs/ml. Ampola de 1ml Peso Dose carga 3.2mgs/mgs Manutenção, 1,6mgs/kgs diário em dose única
Manutenção, 1.6mgs/kg diário em dose única <3kgs 0.5ml 0.3ml 3<5kgs 0.8ml 0.4ml 5<7kgs 1.2ml 0.6ml 7<10kgs 1.6ml 0.8ml 10<15kgs 2.5ml 1.2ml 15<20kgs 3.2ml 1.6ml 20<30kgs 1.2ml 0.6 ml 30<=39kgs 1.6ml 0.8 ml
O Artemeter de 80mgs não deverá ser usado em bebés com peso menor a 6 kgs por doses serem volumes pequenas que são difíceis de administrar com seringas de 1ml
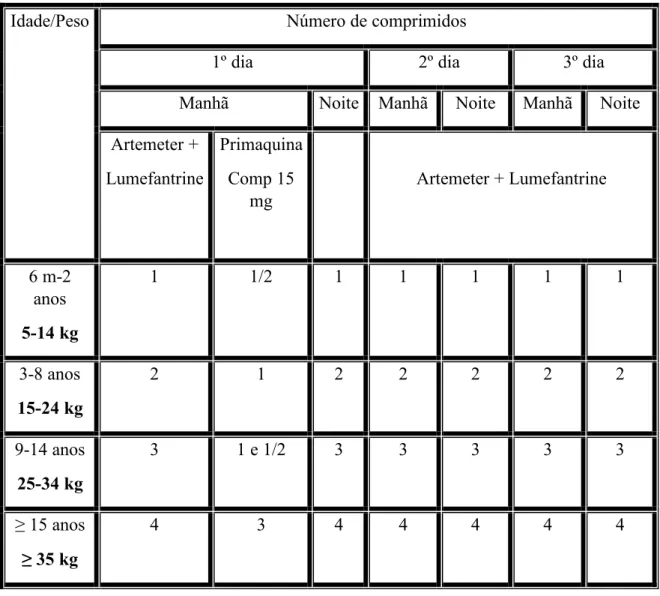
Tabela 2: Protocolo Nacional de: Tratamento da Malária simples (Malária não complicada) com Artemeter + Lumefantrine 20mg/120 mg (2 doses por dia durante 3 dias).
Idade/Peso Número de comprimidos
1º dia 2º dia 3º dia
Manhã Noite Manhã Noite Manhã Noite Artemeter + Lumefantrine Primaquina Comp 15 mg Artemeter + Lumefantrine 6 m-2 anos 5-14 kg 1 1/2 1 1 1 1 1 3-8 anos 15-24 kg 2 1 2 2 2 2 2 9-14 anos 25-34 kg 3 1 e 1/2 3 3 3 3 3 ≥ 15 anos ≥ 35 kg 4 3 4 4 4 4 4
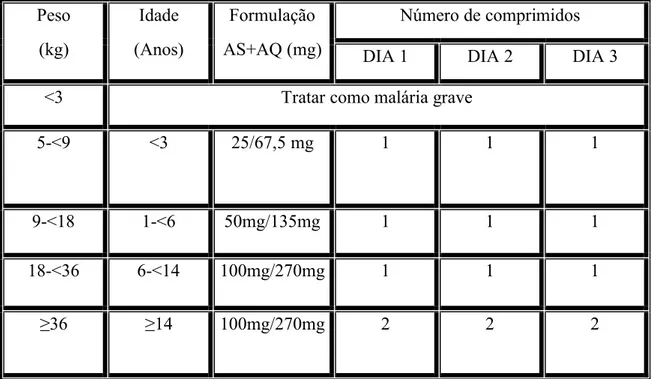
Tabela 3: Protocolo Nacional de: Tratamento da Malária simples (Malária não complicada) com Artesunato+Amodiaquina (ASAQ).
Peso (kg) Idade (Anos) Formulação AS+AQ (mg) Número de comprimidos
DIA 1 DIA 2 DIA 3
<3 Tratar como malária grave
5-<9 <3 25/67,5 mg 1 1 1
9-<18 1-<6 50mg/135mg 1 1 1
18-<36 6-<14 100mg/270mg 1 1 1
≥36 ≥14 100mg/270mg 2 2 2
O autor concorda com tais elementos e reforça que deve-se reavaliar o protocolo de tratamento da malária pelo fato de muitos medicamentos estarem a criar resistências aos Plasmodium.
O tratamento é um dos pilares fundamentais para que o controle da doença seja bem-sucedido. No entanto, em todo mundo um número significativo de pacientes abandona ou não cumpre com as prescrições dos anti maláricos (Leite e Vasconcelos, 2003). A sistematização das obras de autores que abordaram o fenómeno do estudo, permitiu o autor considerar as definições sobre adesão e adesão ao tratamento. O autor teve em conta os autores como: Brawley e Cullos-Reed, 2000, que definiu a “adesão como adoção de certa recomendação”.
Rocha, 2008, considera adesão “como obediência, cumprimento de regras/ grau de concordância entre as recomendações do prestador de cuidados de saúde e o comportamento do paciente em relação ao regime terapêutico proposto”;
Pereira E. Edna Ishikawa e Cor Fontes, 2011, definem “adesão como escolha livre” o que indica um posicionamento mais ativo por parte do paciente, ou seja, ele assume sua
posição frente ao tratamento sugerido, influenciando dessa forma na eficácia do tratamento.
Já o autor do estudo, define a “adesão como o cumprimento estrito de todas as medidas que lhe forem impostas. Sendo este o principal determinante para a efetividade do tratamento”.
Estabelecimentos de pontos de contacto/regularidades que se põe em manifesto. - Cumprimento de determinadas regras/medidas.
- Adoção de certas recomendações; - Escolha livre;
A adesão ao tratamento baseia-se em que pacientes devem receber medicamentos em doses corretas, por tempo necessário e instruções para sua correta administração. A adesão contribui a recuperação da saúde do doente e evita o surgimento de resistências (Pereira et al, 2011).
A Real Academia da Língua Espanhola, define como “união física, pegadura das coisas” “qualidade de adesão” (Real Academia, 2010). A literatura Inglesa faz menção aos termos de cumprimentos (compliances) e adesão (adherence) que são de maior uso, outrossim são utilizados também outros sinónimos tais como: cooperação, colaboração, aliança terapêutica, seguimento, obediência, observância, adesão e concordância (Libertad, 2013). Por sua vez, Noguês e colaboradores afirmaram que adesão compreende dois aspetos: O cumprimento na toma dos medicamentos (quanto a doses e a forma) e persistência durante o tempo da prescrição (Noguês, Sorli e villar, 2007). Apesar dos múltiplos conceitos de adesão ao tratamento, uma definição que tem sido notável a sua aceitação é a proposta por Haynes, que define como “o grau em que a conduta de um paciente em relação com a toma de medicamentos, o seguimento de uma dieta ou a modificação de hábitos de vida, coincide com as instruções proporcionadas pelo médico ou pessoal sanitário (Haynes, 1979).
Outra definição aceite é a de Gil e colaboradores que definem a adesão como o grau de coincidência entre as orientações médico-sanitárias, não limitando-se as indicações terapêuticas, de tal forma que inclui assistência a áreas programadas, participação em