1.
INTRODUÇÃO
A estimulação cardíaca artificial permanente desenvolveu-se a partir de
1958, quando ELMQUIST; SENNING
36descreveram o uso do primeiro marcapasso
permanente totalmente implantável, e rapidamente incorporou novos recursos
18, 42.
Desde então, este recurso tecnológico tem sido de enorme valia para o tratamento
de pacientes com bradiarritmias persistentes: elimina sintomas causados pelo baixo
fluxo cerebral decorrente da freqüência cardíaca lenta; diminui o risco da morte
súbita por assistolia ou fibrilação ventricular e auxilia no tratamento da insuficiência
cardíaca.
marcapassos atuais: os microprocessadores e as baterias de lítio, que são
herméticas e de longa duração. Estruturalmente, entretanto, estes aparelhos
apresentam a mesma configuração da época de sua invenção: compõem-se de um
gerador de pulsos e um ou mais cabos-eletrodos, que conduzem os estímulos
elétricos gerados até o coração.
As técnicas de implante convencionalmente utilizadas também quase
não sofreram modificação com o passar dos anos: a via de acesso preferencial
para os cabos-eletrodos atingirem o coração tem sido a transvenosa, em geral pela
veia subclávia, e o local de implante do gerador de pulsos, a região infraclavicular,
em loja subcutânea. A técnica epimiocárdica, utilizada no primeiro implante de
marcapasso permanente, foi rápida e progressivamente sendo preterida, e, hoje em
dia, passou a ser de utilidade quase que exclusiva para os pacientes em que a via
transvenosa não pode ser usada.
Nesse cenário, fortemente solidificado para pacientes adultos, a
estimulação cardíaca artificial pediátrica apresenta-se como um desafio para os
especialistas. O índice de utilização é muito menor que em adultos. Em 1999, os
dados do Registro Brasileiro de Marcapassos mostram que há 0,7 novos implantes
por milhão de habitantes, quando considerados apenas os pacientes com menos de
20 anos de idade
23. No mesmo ano, o Registro Dinamarquês refere 1,4 implantes
por milhão, quando consideradas apenas as crianças com menos do que 10 anos
de idade
84. A principal indicação para o implante pediátrico é a bradicardia
pós-cirúrgica, respondendo por mais da metade dos implantes, seguida do bloqueio
atrioventricular congênito
34, 37, 41, 58, 69, 93, 98, 118. A via de acesso preferencial tem sido
a epimiocárdica. O modo de estimulação mais utilizado é o unicameral ventricular.
Os principais fatores que tornam a estimulação cardíaca um desafio em
crianças, entretanto, não são sua baixa utilização, e sim a pequena superfície
corpórea das crianças e o fenômeno do crescimento. A pequena dimensão das
superfícies torácica e abdominal de neonatos e lactentes, torna difícil o alojamento
dos menores geradores de pulsos atualmente produzidos. O reduzido calibre de
suas veias dificulta o acesso dos cabos transvenosos. A pouca elasticidade dos
cabos-eletrodos não se adapta à velocidade do crescimento da criança, fazendo
com que, em pouco tempo, se tornem curtos em relação ao tamanho corporal,
ficando sujeitos a trações, que causam complicações, como o aumento do limiar de
estimulação ou o rompimento do seu revestimento ou de seu condutor elétrico.
aumento do limiar e perda do comando do marcapasso, tem sido menos utilizada
em crianças pequenas, devido ao calibre das veias. Quando utilizada da maneira
clássica, pela veia sub-clávia ou jugular, fica difícil o alojamento do gerador de
pulsos na parede abdominal, o local menos sujeito à erosão da pele.
1.1.
OBJETIVOSO presente estudo foi desenvolvido com a finalidade de analisar,
retrospectivamente, a evolução dos pacientes pediátricos submetidos a implante de
marcapasso cardíaco artificial permanente pela via transfemoral.
Os objetivos específicos da investigação foram:
1. avaliar a sobrevida total dos pacientes, analisando a influência de
parâmetros pré-operatórios sobre os resultados tardios;
2. verificar a duração do sistema transfemoral, analisando as causas de
descontinuidade do uso do eletrodo e a necessidade de reoperações
para a sua manutenção;
3. estudar as complicações relacionadas à técnica, verificando o
número de reoperações necessárias no transcorrer da evolução do
paciente;
2.
ASPECTOS
RELEVANTES
DA
LITERATURA
2.1.
I
NDICAÇÕES DA ESTIMULAÇÃO CARDÍACA ARTIFICIAL PEDIÁTRICAO uso da estimulação cardíaca artificial permanente em crianças é mais
freqüente nos bloqueios atrioventriculares congênitos e nos processos
bradicárdicos irreversíveis após cirurgias cardíacas. Outras condições patológicas
podem exigir o implante de marcapasso permanente, como: a doença do nó
sinusal, a síndrome do QT longo congênito, e os bloqueios atrioventriculares
adquiridos não cirúrgicos. A incidência dessas entidades, contudo, é menos
expressiva.
2.1.1.
B
LOQUEIOA
TRIOVENTRICULARC
ONGÊNITOcerebral e de insuficiência cardíaca eram consideradas baixas na evolução dos
pacientes. Acreditava-se que, pela freqüente localização intranodal da lesão do
sistema de condução que provoca o bloqueio congênito, esta anomalia somente
mereceria o cuidado do implante de marcapasso em situações especiais. Por ser
dotado de cronotropismo, o nó atrioventricular geralmente confere à criança boa
adaptação de freqüência cardíaca aos esforços físicos e estados hiperdinâmicos
28, 64, 71, 89, 95. A despeito da existência do bloqueio da condução do estímulo cardíaco,
a incidência de períodos de assistolia ventricular é considerada baixa. Mães
portadoras de lúpus eritematoso sistêmico ou que tenham sido acometidas por
rubéola durante a gestação, apresentam maior risco de terem filhos com bloqueio
congênito
100.
A indicação da estimulação cardíaca artificial permanente em crianças
com bloqueio atrioventricular congênito, tem sido estabelecida nos pacientes que se
apresentem com sintomas: de baixo fluxo cerebral, como síncopes, pré-sincopes ou
tonturas; de insuficiência cardíaca; de intolerância aos esforços físicos ou com
baixo desenvolvimento estatural. Nos pacientes assintomáticos, o implante de
marcapasso tem sido indicado apenas quando outras condições patológicas estão
associadas ao bloqueio, como: outras malformações cardíacas; arritmias
ventriculares espontâneas ou provocadas pelo esforço; presença de complexo QRS
maior que 0,12 s; intervalo QT longo; ausência de resposta cronotrópica aos
esforços; freqüência cardíaca considerada inadequada para a idade e má
adaptação do miocárdio à freqüência cardíaca lenta, verificada pelo aumento da
área cardíaca ao estudo radiológico ou ecocardiográfico
2, 10, 28, 54, 64, 71, 89, 95.
que essa enfermidade representa nesse período da vida. Dos 55 fetos
acompanhados, com bloqueio atrioventricular total, apenas 26 sobreviveram à
gestação ou ao período neonatal. Dentre os fatores de risco para o óbito,
observaram que a freqüência ventricular menor que 55 bpm estava relacionada a
alta mortalidade (p<0,001).
MICHAËLSSON et al.
80(1995), estudaram a evolução natural do
bloqueio atrioventricular total congênito isolado assintomático. O seguimento clínico
de 102 pacientes maiores de 15 anos de idade, não submetidos a implante de
marcapasso, mostrou, ao final de até 30 anos de acompanhamento: alta incidência
de síncope e de morte súbita, necessidade de implante de marcapasso em 88%
dos pacientes que atingiram 45 anos de idade, e desenvolvimento de insuficiência
mitral secundária à bradicardia em 16% dos pacientes.
2.1.2.
B
RADICARDIAP
ÓS-
OPERATÓRIAA bradicardia persistente pós-operatória tem sido a principal indicação
para o implante de marcapasso permanente em crianças. ECTOR et al.
34(1985),
ENNKER et al.
37(1985), FLEMING et al.
41(1981), HAMILTON et al.
58(1997),
KERSTJENS-FREDERIKSE et al.
69(1991), RAO et al.
93(1995), SACHWEH et al.
98(2000) e WARD et al.
118(1987) apresentam incidência de bradicardia
pós-operatória que varia de 54 a 86% dentre todas as indicações de marcapasso.
independentes para risco de lesão irreversível do sistema de condução. Estudando
apenas a correção de cardiopatias congênitas, WEINDLING et al.
120(1998),
referem incidência desse tipo de complicação em 3% das operações realizadas sob
circulação extracorpórea. Nos pacientes submetidos a reoperação, entretanto, a
necessidade de implante de marcapasso pode ser maior
52, 75. LEWIS et al.
75(1998), estudando 558 pacientes submetidos a reoperações encontraram incidência
da doença do nó sinusal em 3,8%, de bloqueio atrioventricular persistente em 5,2%
e de implante de marcapasso definitivo em 9,7% dos pacientes.
A persistência do bloqueio atrioventricular peroperatório difere nas
diferentes experiências. SQUARCIA et al.
105(1971), acompanhando a evolução de
911 pacientes submetidos a correções que envolviam o manuseio do septo
interventricular, relatam que 71 pacientes apresentaram bloqueio atrioventricular, de
segundo ou terceiro graus, ou dissociação atrioventricular. Desses, apenas sete
mantiveram-se em bloqueio atrioventricular e necessitaram de marcapasso
definitivo. WEINDLING et al.
120(1998), acompanhando 54 pacientes que
desenvolveram bloqueio atrioventricular pós-operatório e sobreviveram ao período
intra-operatório, verificaram que apenas 20 pacientes (37%) persistiram em
bloqueio atrioventricular após o nono dia de pós-operatório. Destes, entretanto, 19
persistiram com o bloqueio após 30 dias.
num total de 650 pacientes avaliados. A incidência da doença do nó sinusal variou
de 2,6 a 27,7%, a do bloqueio atrioventricular persistente, de 0 a 7,8% e a
necessidade de implante de marcapasso definitivo variou de 3,8 a 24,6% dos
pacientes.
BLANCH et al.
12(1995), DRAGO et al.
31(1992), DUSTER et al.
33(1985); GILLJAM et al.
51(1996), HELBING et al.
60(1994), PULEY et al.
91(1999) e
TURLEY et al.
113(1988) estudaram séries de pacientes submetidos às operações
de Mustard e de Senning para o tratamento da transposição das grandes artérias,
num total de 684 pacientes. A incidência de doença do nó sinusal variou de 25 a
87%, a do bloqueio atrioventricular persistente, de 0 a 16% e a necessidade de
implante de marcapasso definitivo variou de 3,1 a 22,0%.
CHINNOCK et al.
19(1996) e RAZZOUK
94(1993) estudaram a evolução
de 246 e 168 crianças, respectivamente, submetidas a transplante cardíaco. A
incidência de doença do nó sinusal foi de 2,0 e 1,8%; a de bloqueio atrioventricular
persistente, de 0,8 e 0,6% e a necessidade de implante de marcapasso definitivo,
de 2,8 e 2,4%, respectivamente, para as duas séries.
atrioventricular persistente, de 0,9 a 9,0%, e a necessidade de implante de
marcapasso definitivo variou de 1,5 a 9,0 %.
As correções de processos obstrutivos da via de saída do ventrículo
esquerdo também podem apresentar como complicação o bloqueio atrioventricular.
BOCKOVEN et al.
13(1998), GALLOTTI; ROSS
43(1981), PENKOSKE et al.
90(1989), STARNES et al.
106(1996) e THEODORO et al.
109(1996) estudaram a
evolução de pacientes submetidos a miectomia septal, ressecção de estenose
subaórtica associada ou não a outros defeitos e operação de Ross, totalizando 172
pacientes. Bloqueio atrioventricular persistente esteve presente de 0 a 4,7% dos
pacientes, implicando em implante de marcapasso permanente em todos eles. Não
foram relatados casos de doença do nó sinusal.
NG et al.
85(1979) e SPEVAK et al.
104(1986) analisaram a evolução de
crianças submetidas a troca valvar, encontrando incidência de bloqueio
atrioventricular persistente e implante de marcapasso de 20 e 14,4%,
respectivamente, para as duas séries. Não foram relatados casos de doença do nó
sinusal.
atrioventricular total em 22% dos pacientes. Em apenas quatro pacientes, o
bloqueio era congênito. Nas demais crianças, o distúrbio da condução foi
considerado decorrência da evolução natural dos pacientes.
2.1.3.
D
OENÇA DON
ÓS
INUSAL NÃOC
IRÚRGICAA doença do nó sinusal, primária, ou secundária ao uso de
medicamentos é menos freqüente na população pediátrica do que a pós-operatória.
Apresenta-se como bradicardia sinusal sintomática, pausas sinusais prolongadas
ou síndrome de braditaquicardia. FLEMING et al.
41(1981), estudando 50 crianças
submetidas a implante de marcapasso referem 22% de doença do nó sinusal não
cirúrgica. GILLETTE et al.
49(1983), estudando 51 pacientes com idade média de
10,5 anos, portadores de doença do nó sinusal, referem etiologia pós-operatória em
59%, secundária ao uso de medicamentos em 10%, associada a malformações não
corrigidas em 8%, associada a cardiomiopatia congestiva em 4% e primária em
20% dos pacientes.
2.1.4.
B
LOQUEIOA
TRIOVENTRICULARA
DQUIRIDON
ÃOC
IRÚRGICOCom o advento das técnicas de intervenção por cateter, novas formas
de bloqueio atrioventricular induzido têm sido relatadas. A aplicação de
radiofreqüência ou choques de baixa energia pode provocar lesão permanente do
tecido de condução, intencional ou inadvertida
40, 99, 114. SCHAFFER et al.
99(1996)
relatando os resultados do Registro Pediátrico de Ablação por Radiofreqüência,
referem bloqueio atrioventricular inadvertido em 1,2% dos pacientes. Esta
complicação esteve relacionada, principalmente, ao tratamento da taquicardia por
reentrada nodal e da taquicardia atrioventricular por vias acessórias anteriores e
médio-septais. Sessenta e cinco por cento dos bloqueios foram permanentes.
VILLAIN et al.
114(1990) relatam o tratamento de 26 crianças portadoras de
taquicardia ectópica juncional congênita. Dessas, seis foram submetidas a ablação
do tronco do feixe de His, por cateter ou cirurgia, quatro delas evoluindo bem, sem
necessidade de medicamentos, após o implante de marcapasso permanente.
FARIN; MOSKOWITZ
38(1996) e HAREL et al.
59(1995) relatam casos
de crianças que desenvolveram bloqueio atrioventricular secundário a traumatismo
torácico.
2.1.5.
O
UTRAS INDICAÇÕESGARSON Jr. et al.
44(1993), em estudo internacional, analisaram a evolução de
287 crianças portadoras da síndrome do QT longo. Referem que o implante de
marcapasso, em 16% dos pacientes, foi o tratamento não farmacológico mais
utilizado, seguido da ressecção do gânglio estrelado em 3,0% e implante de
desfibrilador automático em 1,5% dos pacientes.
A estimulação artificial da ponta do ventrículo direito tem sido proposta
como alternativa não farmacológica para o tratamento da cardiomiopatia hipertrófica
obstrutiva. A melhora dos sintomas de insuficiência cardíaca, a diminuição do
número de episódios sincopais e a diminuição do gradiente intraventricular têm
sido relatadas pelos autores, existindo, entretanto, grande controvérsia quanto a
esses resultados
77, 96. RISHI et al.
96(1997) estudaram a evolução de 10 crianças,
portadoras de gradiente intraventricular maior ou igual a 40 mmHg. Os autores
referem que a estimulação atrioventricular levou à melhora subjetiva dos sintomas
em seis pacientes e à diminuição, estatisticamente significativa, do gradiente e das
pressões intra-ventricular e capilar pulmonar, em sete pacientes.
2.2.
M
ODOSD
EE
STIMULAÇÃOC
ARDÍACAE
MP
EDIATRIAA desproporção entre o tamanho do sistema de estimulação e a
superfície corporal das crianças não é o único motivo para a preferência de
sistemas unicamerais. Os poucos trabalhos da literatura que analisaram as
contribuições da sístole atrial e da variação da freqüência cardíaca para a melhora
do débito cardíaco não mostraram resultados concordantes.
KARPAWICH et al.
68(1987) estudaram o comportamento
hemodinâmico de 14 crianças e adultos jovens, portadores de bloqueio
atrioventricular não cirúrgico, comparando as condições: estimulação ventricular
sincronizada às ondas “P” e ventricular com freqüência não variável. Concluíram
que estes pacientes conseguem compensar a perda do sincronismo atrioventricular
ao repouso. Os autores não observaram, também, diferença na duração do
exercício, quando da mudança do modo. Referem, entretanto, que o débito
cardíaco foi significativamente maior durante a estimulação atrioventricular.
Também não foram observadas diferenças na preferência por modo de estimulação
pelos pacientes.
compararam o desempenho hemodinâmico das estimulações atrial direita,
ventricular direita septal e ventricular direita apical, em 22 crianças. Concluíram
que, durante estimulação a 150 ppm, não há diferença hemodinâmica significativa
entre as estimulações atrial direita e ventricular septal.
O uso de sensores não atriais para a regulação da freqüência cardíaca
na população pediátrica, tem sido considerada na literatura uma boa opção.
Embora MILLER et al.
81(1989), estudando cinco pacientes pediátricos portadores
de bloqueio atrioventricular, não tenham observado melhora da capacidade física,
ou da função hemodinâmica, com a mudança de modo ventricular de freqüência
fixa para estimulação com resposta de freqüência cardíaca por sensor de atividade,
outros trabalhos demonstraram a utilidade dos sensores. ZEIGLER et al.
126(1990)
e RAGONESE et al.
92(1994) estudaram o desempenho da estimulação ventricular
com resposta de freqüência, por sensor de atividade do tipo “piezo-elétrico”, em
crianças. Concluíram que esse modo de estimulação é seguro e eficiente,
independentemente do tipo de implante. CELIKER et al.
17(1997) estudaram
estimulação ventricular com duplo sensor, de atividade e de intervalo QT, em 10
pacientes com idade variando de seis a 16 anos. Concluíram que,
independentemente da forma de combinação dos sensores, este tipo de
estimulação permitiu correção eficiente da freqüência cardíaca das crianças.
2.3.
T
ÉCNICAS DEI
MPLANTE DEM
ARCAPASSO EMC
RIANÇASutilizada para a estimulação cardíaca artificial permanente pediátrica,
particularmente nos primeiros anos de vida ou em crianças de baixo peso
9, 50.
A necessidade obrigatória de anestesia geral para a realização do
implante de marcapasso pediátrico e a facilidade de se alojar o gerador de pulsos
no abdome, têm sido os principais motivos para a opção pela via epimiocárdica em
crianças. Além disso, a dificuldade de obtenção de acessos venosos compatíveis
com o calibre dos cabos-eletrodos, bem como o maior crescimento da criança no
eixo crâneo caudal, fazendo com que, num pequeno período de tempo, o
cabo-eletrodo transvenoso se torne curto para o tamanho do paciente, também têm sido
argumentos favoráveis às técnicas epimiocárdicas.
2.3.1.
T
ÉCNICAS EPIMIOCÁRDICASO desenvolvimento de novos eletrodos, não penetrantes e com
liberação de esteróides
8, 9, 25, 57, 65, 66, tem sido o recurso utilizado para minimizar o
maior problema da estimulação epimiocárdica pediátrica: a perda de comando por
aumento crônico do limiar. Eletrodos de concepção mais antiga, penetrantes no
miocárdio, mostraram elevada incidência de perda de comando, fratura de
cabo-eletrodo e necessidade de reoperações freqüentes
26, 58, 69, 93, 98, 124.
diafragmática do ventrículo direito. A realização de implantes atriais por essa via,
entretanto, não é igualmente simples.
A toracotomia anterior esquerda é o acesso mais utilizado em crianças
para atingir o ventrículo esquerdo. A fácil abordagem da aurícula esquerda por essa
via de acesso, torna-a muito interessante para a realização de implantes atriais ou
atrioventriculares.
A toracotomia anterior direita é o acesso preferencial quando há
dextrocardia. Nos corações normoposicionados, permite o implante de eletrodos no
átrio direito com grande facilidade. O implante do eletrodo ventricular, entretanto,
não é igualmente simples, embora factível.
2.3.2.
T
ÉCNICAS ENDOCÁRDICASVários autores têm preconizado o uso da via transvenosa para o
implante dos eletrodos, com dois objetivos básicos: diminuir o porte cirúrgico do
procedimento e a incidência do aumento crônico do limiar. Em crianças de baixo
peso, o uso das veias jugulares, pouco freqüente em adultos, tem sido preconizado
47, 82, 83, 110, 118.
FISHBERGER et al.
39(1996) utilizaram a via trans-hepática, com sucesso, em uma
criança submetida previamente à operação de Senning.
O uso da veia femoral para o implante de marcapasso permanente foi
proposto por ELLESTAD et al.
35(1980) como alternativa para o melhor alojamento
do gerador de pulsos em pacientes com tecido celular subcutâneo muito delgado ou
que exigissem melhor resultado estético. Apresentaram a evolução de 23 pacientes
adultos, relatando as seguintes complicações: extrusão de cabo-eletrodo em um
paciente, tromboflebite tardia em um, perfuração miocárdica atrial em um,
perfuração de ventrículo direito em um e desposicionamento em quatro pacientes.
Posteriormente, LAUB et al
74(1991), ANTONELLI et al.
3(1993), WEST
et al.
122(1993), VILLALBA et al.
115(1994), TRIGANO et al.
111(1997), GOTO et al.
53(1998) e BARAKAT
6(2000) também utilizaram essa via de acesso em adultos,
devido a deformidade do sistema venoso da veia cava superior ou por
deformidades da parede torácica.
2.3.3.
A
LOJAMENTO DO GERADOR DE PULSOSVárias formas de alojar o gerador de pulsos têm sido descritas. A mais
corrente é a confecção da loja nos hipocôndrios, em posição subcutânea ou
submuscular, que permitem boa acomodação do gerador de pulsos
27.
A acomodação do gerador de pulsos na parede torácica é difícil em
crianças de baixo peso, mesmo em posição subpeitoral, considerada por GILLETTE
et al.
48(1991) como o local preferido para o implante pediátrico de marcapassos.
Esta localização causa grande deformidade estética e incidência elevada de erosão
de pele e extrusão da prótese. Outras alternativas têm sido propostas para a
confecção da loja do gerador de pulsos em crianças: a cavidade pleural; a fossa
ilíaca; a região lombar peri-renal e o espaço supra-hepático
21, 22, 55, 56, 61, 76, 87, 125.
2.4.
A
SPECTOSP
SICOSSOCIAIS DASC
RIANÇASP
ORTADORAS DEM
ARCAPASSOCrianças portadoras de marcapasso cardíaco artificial são alvos de
freqüente discriminação. Pais e professores tendem a considerá-las portadoras de
cardiopatia grave, limitando sua atividade física, mesmo quando apresentam
desempenho físico e hemodinâmico normais. A deformidade estética, causada
pelas incisões cirúrgicas e pela presença do gerador de pulsos, faz com que essas
crianças sejam alvo de comentários e brincadeiras dirigidos pelos colegas de
escola.
grupos de crianças de idade semelhante: 30 crianças portadoras de cardiopatia
congênita sem marcapasso e 30 crianças saudáveis. Os autores concluíram que
crianças portadoras de marcapasso, na totalidade, adaptam-se à sua prótese e ao
impacto desta em suas vidas, de maneira saudável e resignada. Observaram,
contudo, “um senso de controle pessoal diminuído, que dificulta o desenvolvimento
da competência e da autonomia necessárias para que esses indivíduos, ao passar
da adolescência para a fase adulta, atinjam sua independência". Referiram, ainda,
“a potencial rejeição dessas crianças pelos seus pares da mesma idade".
3.
CASUÍSTICA
E
MÉTODOS
3.1.
C
ASUÍSTICAForam estudadas 99 crianças submetidas a implante de marcapasso
cardíaco artificial permanente pela via transfemoral, no período de 12 de novembro
de 1981 a 7 de novembro de 2000, no Instituto do Coração do Hospital das Clínicas
da Faculdade de Medicina da Universidade de São Paulo (Incor).
3.1.1.
C
RITÉRIOS DEI
NCLUSÃOForam excluídos os pacientes que apresentavam implante de
marcapasso prévio por qualquer via de acesso e os que não tivessem pelo menos
uma das veias femorais livre de manipulação prévia.
3.1.2.
C
ARACTERÍSTICASP
RÉ-
OPERATÓRIAS DAP
OPULAÇÃOE
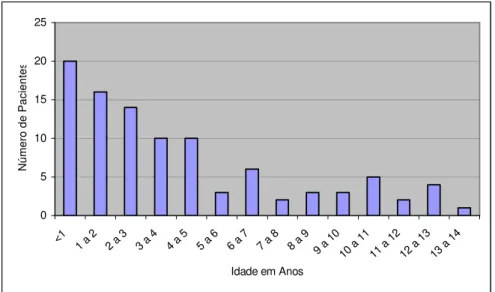
STUDADAA idade das crianças variou de um dia a 13 anos de vida (média = 4,1
±
3,6 anos). A figura 1 mostra a distribuição das crianças por faixa etária.
0 5 10 15 20 25 <1
1 a 2 2 a 3 3 a 4 4 a 5 5 a 6 6 a 7 7 a 8 8 a 9 9 a 10
10 a
11
11 a
12
12 a
13
13 a
14
Idade em Anos
N úm er o de P ac ie nt es
Figura 1. Distribuição das faixas de idade dos pacientes
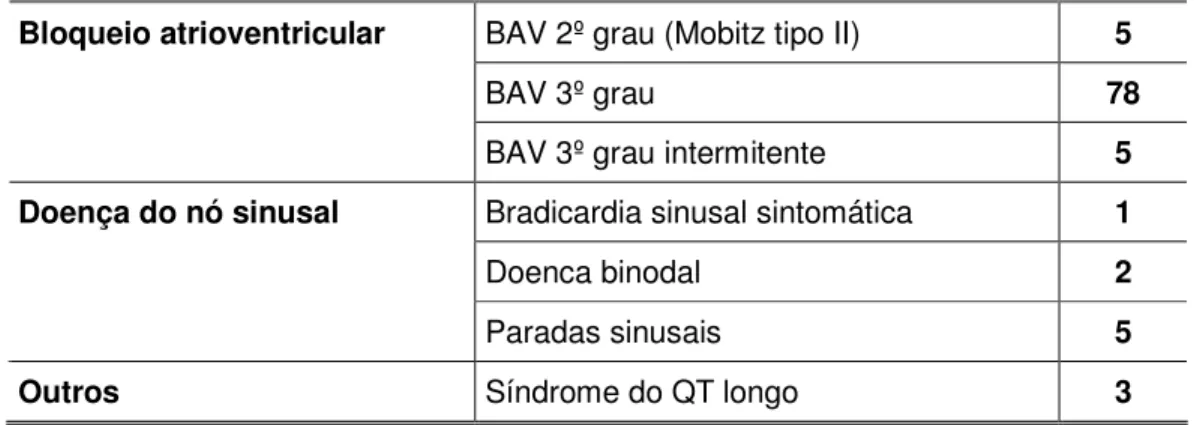
A indicação para implante de marcapasso permanente foi: bloqueio
atrioventricular avançado em 88 pacientes, doença do nó sinusal em oito, e
síndrome do QT longo congênito em três (Tabela I). Os dados clínicos dos
pacientes estão dispostos no Anexo B e os exames complementares no Anexo C.
BAV 2º grau (Mobitz tipo II)
5
BAV 3º grau
78
Bloqueio atrioventricular
BAV 3º grau intermitente
5
Bradicardia sinusal sintomática
1
Doenca binodal
2
Doença do nó sinusal
Paradas sinusais
5
Outros
Síndrome do QT longo
3
Tabela I. Distúrbio do ritmo cardíaco no pré-operatório (BAV 2º grau = bloqueio atrioventricular do segundo grau; BAV 3º grau = bloqueio atrioventricular do terceiro grau;
EPV = estenose pulmonar valvar)
3.1.3.
E
TIOLOGIA DOD
ISTÚRBIO DAC
ONDUÇÃOAs causas mais freqüentes para o distúrbio da condução elétrica foram:
traumatismo cirúrgico em 54 crianças; anomalia congênita, associada ou não a
outros defeitos congênitos, detectada em 39 e causas adquiridas não cirúrgicas em
seis pacientes.
Bloqueio atrioventricular congênito já existia previamente à correção cirúrgica em
cinco pacientes, enquanto que 54 crianças apresentaram a bradicardia após o
tratamento cirúrgico. Os resultados das correções realizadas estão listados na
Tabela II e os defeitos não corrigidos ou residuais, na Tabela III.
Morfologia cardíaca normal
33
Não operados
Defeito não operado
7
Correção completa da anatomia
44
Discordância atrioventricular
4
Prótese valvar
2
Transplante cardíaco
1
Correções totais
Tubo extra-anatômico
3
Correções incompletas
Defeito residual
5
Tabela II. Resultado das correções realizadas para os defeitos intracardíacos
Comunicação interatrial
4
Comunicação interventricular
1
EPV + forame oval patente
1
Não operados
Transposição corrigida das grandes artérias (GA)
1
Comunicação interventricular
1
Estenose pulmonar severa
1
Isomerismo atrial esquerdo
2
Residuais
Feixe de Kent
1
Prótese Valvares
Transposição corrigida GA + doença de Ebstein
2
TOTAL
14
Nos casos de bradicardia pós-operatória, o implante do marcapasso
permanente foi realizado em um período que variou de quatro dias a 10 anos
(média = 343
±
815 dias) após a cirurgia cardíaca. O implante de marcapasso foi
indicado antes do 14º dia de pós-operatório em 10 crianças, do 14º ao 30º dia em
24, do segundo mês ao final do primeiro ano em 11 e, após o primeiro ano, em
nove crianças.
A correção envolveu a manipulação do septo interatrial em duas
crianças, do septo interventricular em 22, do septo atrioventricular em 12, da região
subaórtica em três e associações em nove. Em uma criança foi realizado
transplante cardíaco. Em decorrência dessa manipulação, desenvolveu-se bloqueio
atrioventricular em 50 pacientes e doença do nó sinusal em quatro. (Anexo D).
Outras malformações associadas estão listadas no Anexo E.
3.1.4.
M
ANIFESTAÇÕESC
LÍNICASArritmia secundária à bradicardia
1
Arritmia
Suporte para medicação
1
Síncope
11
Baixo fluxo cerebral
Baixo fluxo cerebral
10
Insuficiência cardíaca
Insuficiência cardíaca
23
Presença da bradicardia
50
Profilática
Presença de intervalo QT longo
3
Tabela IV. Indicação para o implante de marcapasso
No momento da internação hospitalar na qual o marcapasso artificial
permanente foi implantado, 31 pacientes não apresentavam sintomas ou sinais
clínicos de insuficiência cardíaca, 36 estavam em classe funcional II, 27 em classe
III e cinco em classe IV, segundo os critérios da New York Heart Association.
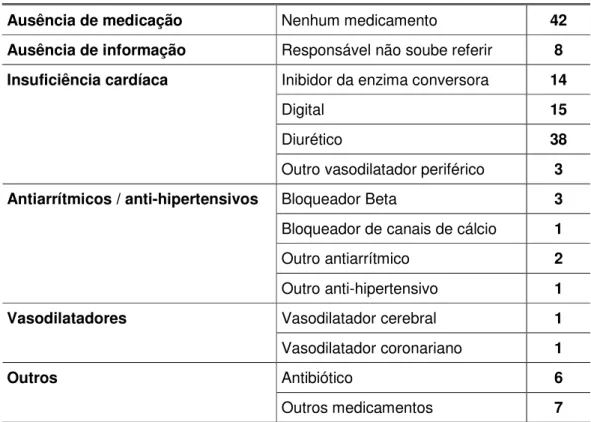
Outros antecedentes de importância detectados foram: Síndrome de
Down em cinco, acidente vascular cerebral prévio em duas, pneumonia em
evolução no momento do implante em duas e rabdomiossarcoma em uma criança.
Ausência de medicação
Nenhum medicamento
42
Ausência de informação
Responsável não soube referir
8
Inibidor da enzima conversora
14
Digital
15
Diurético
38
Insuficiência cardíaca
Outro vasodilatador periférico
3
Bloqueador Beta
3
Bloqueador de canais de cálcio
1
Outro antiarrítmico
2
Antiarrítmicos / anti-hipertensivos
Outro anti-hipertensivo
1
Vasodilatador cerebral
1
Vasodilatadores
Vasodilatador coronariano
1
Antibiótico
6
Outros
Outros medicamentos
7
Tabela V. Prescrição dos pacientes no momento da indicação do marcapasso.
Nada digno de nota
74
Extra-sístoles isoladas
4
Extra-sístoles pareadas
2
Extra-sístoles polimórficas
3
Ritmo idioventricular acelerado
2
Taquicardia não sustentada
4
Arritmias ventriculares
Taquicardia sustentada
1
Intervalo QT longo
8
Outros Achados
Onda delta
1
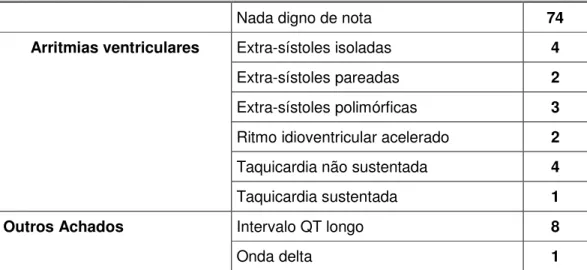
Tabela VI. Arritmias ventriculares e alterações eletrocardiográficas encontradas no pré-operatório.
Ao estudo radiológico simples do tórax, o tamanho da silhueta cardíaca
foi considerado normal em 11 crianças, aumentado + / 4+ em 24, ++ / 4+ em 43, e
+++ / 4+ em 21.
3.2.
T
ÉCNICA DOI
MPLANTET
RANSFEMORALTodos os procedimentos cirúrgicos foram realizados sob anestesia geral
e ventilação endotraqueal.
3.2.1.
I
MPLANTE DOC
ABO-
ELETRODOO procedimento, realizado preferencialmente no lado esquerdo,
inicia-se com uma incisão transversa de aproximadamente 1 cm na prega inguinal,
acompanhando as linhas de força. Por essa via de acesso é dissecada
preferencialmente a croça da veia safena interna, ou a veia femoral, no caso de a
primeira não apresentar calibre suficiente para a passagem do(s)
cabo(s)-eletrodo(s). Se for utilizada a veia safena, esta é ligada. No caso da utilização da
veia femoral, é realizada oclusão temporária, com reconstituição do fluxo ao final do
implante do cabo-eletrodo.
Após a introdução de um ou dois cabos-eletrodos na veia, sua
progressão, passando pelas veias ilíaca e cava inferior até o interior do átrio direito,
é acompanhada por fluoroscopia.
Nos implantes ventriculares, o cabo-eletrodo, de fixação ativa ou
passiva, é implantado preferencialmente na ponta ou na parede diafragmática do
ventrículo direito.
Para a estimulação atrial, são utilizados eletrodos de fixação ativa,
posicionados, sempre que possível, na aurícula direita ou na porção mais alta do
átrio direito.
Nos pacientes portadores de transposição dos vasos da base,
submetidos a correção atrial, os eletrodos são posicionados nas câmaras
esquerdas.
intracavitário espontâneo atrial e/ou ventricular. Após obtenção de parâmetros
adequados para estimulação e sensibilidade, parte do excesso de eletrodo é
introduzido, com o objetivo de formar a maior alça possível no átrio direito, para
adequar o tamanho do cabo-eletrodo ao crescimento da criança.
O implante do cabo-eletrodo é finalizado com sua fixação à veia,
através de ligadura com fio absorvível.
3.2.2.
I
MPLANTE DOG
ERADOR DEP
ULSOSO gerador de pulsos é alojado na fossa ilíaca, por meio nova incisão
cirúrgica. Essa segunda incisão, também transversa, é realizada sobre a prega
abdominal inferior, na direção das linhas de força da pele, no mesmo lado do
implante do cabo-eletrodo e de extensão igual ao menor diâmetro do gerador de
pulsos a ser implantado. A partir dessa incisão, que abrange pele e tecido celular
subcutâneo, a loja do gerador de pulsos é feita com o descolamento do tecido
celular subcutâneo, a partir da aponeurose dos músculos abdominais em direção
cranial.
A figura 2 mostra uma representação esquemática do procedimento.
3.2.3.
R
EOPERAÇÃO PARAR
EINTRODUÇÃO DEC
ABO-
ELETRODO NOS
ISTEMAV
ENOSO COMF
ORMAÇÃO DEN
OVAA
LÇAA
TRIALQuando, com o passar do tempo e o crescimento da criança, se nota,
pela radiografia simples do tórax, que a alça de eletrodo no átrio direito está
desfeita, é indicado um segundo tempo cirúrgico. O objetivo deste é liberar o
cabo-eletrodo que está em excesso na loja do gerador de pulsos, e introduzi-lo no interior
do sistema venoso, refazendo-se a alça no átrio direito.
É realizada uma incisão transversa abdominal sobre a cicatriz anterior,
através da qual é retirado o gerador de pulsos. Após verificação dos valores do
limiar de estimulação, da impedância do sistema cabo-eletrodo-miocárdio e do
potencial intracavitário, e da constatação das boas condições do cabo-eletrodo,
este é cuidadosamente liberado da loja do gerador de pulsos.
Uma segunda incisão cirúrgica é então realizada na região inguinal,
sobre a incisão anterior, através da qual o cabo-eletrodo é liberado até sua
entrada na veia. Sob fluoroscopia, o excesso de cabo-eletrodo é introduzido no
sistema venoso, até a formação de nova alça no átrio direito.
3.2.4.
M
EDIDA DOSP
ARÂMETROSI
NTRA-
OPERATÓRIOS DEE
STIMULAÇÃO E DES
ENSIBILIDADEOs valores das medidas intra-operatórias de estimulação e de
sensibilidade foram obtidos com analisadores específicos (Biotronik Era 20 e Era
300). Foram verificados: o limiar de estimulação, a impedância do sistema
cabo-eletrodo-miocárdio e a captação do potencial intrínseco da câmara cardíaca onde o
eletrodo foi implantado (“onda P” ou “onda R”).
3.3.
P
ADRONIZAÇÃO DOSS
ISTEMASI
MPLANTADOSA escolha do modo de estimulação implantado segue os critérios
estabelecidos pelo Incor, que indica, para crianças portadoras de bloqueios
atrioventriculares, preferencialmente, marcapassos ventriculares, e, nas disfunções
sinusais com condução atrioventricular normal, implantes atriais. Implantes
atrioventriculares foram reservados a crianças com problemas hemodinâmicos que
tornem crítica a falta de sincronismo atrioventricular.
Para o implante em cavidades atriais são empregados
preferencialmente os cabos-eletrodos de fixação ativa, enquanto que, para o
ventrículo direito, são utilizados indistintamente cabos de fixação ativa ou passiva.
comprimento, e, a partir dessa data, cabos de 80 cm, sempre que disponíveis e
independentemente da idade do paciente.
Pela entrada de pacientes na experiência em momentos diferentes do
desenvolvimento dos marcapassos, vários tipos de geradores de pulso, de câmara
única ou de dupla-câmara, foram utilizados: programáveis em freqüência;
multiprogramáveis com telemetria unidirecional; multiprogramáveis com telemetria
bidirecional e os dotados de sensores de movimento, para modulação da
freqüência cardíaca.
3.4.
P
ADRONIZAÇÃO DOS
EGUIMENTOP
ÓS-O
PERATÓRIOOs pacientes foram seguidos pela mesma equipe médica, com retorno
semestral para os residentes na região metropolitana de São Paulo, e anual para os
residentes em localidades distantes.
3.4.1.
P
ÓS-
OPERATÓRIOI
MEDIATOeletrodo(s) à radiografia simples do tórax, e da verificação das boas condições de
estimulação pelo eletrocardiograma.
3.4.2.
P
ÓS-
OPERATÓRIOT
ARDIOO acompanhamento clínico dos pacientes era realizado no ambulatório
de cardiopatias congênitas ou com o médico particular, enquanto a avaliação
específica do funcionamento do sistema de estimulação era realizada na clínica de
marcapasso do Incor.
Nas visitas à clinica de marcapasso eram analisados:
•
o aspecto da loja do gerador de pulsos;
•
as funções de estimulação e de sensibilidade do marcapasso,
com o uso de programadores específicos para os geradores de
pulso e monitoração eletrocardiográfica;
•
os parâmetros de fim de vida de bateria, pela medida com
intervalômetro durante reversão magnética do marcapasso e
•
o tamanho da alça de eletrodo no átrio direito, pela radiografia
3.4.3.
I
NDICAÇÃO DAR
EOPERAÇÃO PARAR
EINTRODUÇÃO DOC
ABO-
ELETRODO.
Uma vez verificado que a alça do cabo-eletrodo no átrio direito estava
desfeita, a equipe cirúrgica era contatada para definir o momento de indicar a
reintrodução.
3.5.
A
VALIAÇÃO DOSP
ARÂMETROSR
ELACIONADOS AOSE
VENTOSP
ÓS-O
PERATÓRIOSCom o objetivo de avaliar a influência das condições pré-operatórias
sobre os eventos pós-operatórios, foram analisados parâmetros demográficos (sexo
e idade); clínicos (sintomas e sinais; etiologia e classe funcional),
eletrocardiográficos (bloqueio atrioventricular avançado e arritmia ventricular / QT
longo) e radiológicos (área cardíaca e defeito intracardíaco).
3.5.1.
P
ADRONIZAÇÃO DASV
ARIÁVEISP
RÉ-
OPERATÓRIASIdade: foi considerada a idade do paciente no momento do implante do
marcapasso;
Sintomas e sinais: foram considerados somente os sintomas e sinais
atribuídos à bradicardia;
Etiologia: a etiologia do distúrbio da condução foi subdividida em
pós-cirúrgica e não-pós-cirúrgica. Os pacientes submetidos a tratamento cirúrgico, que já
apresentavam a bradicardia que indicou previamente o implante de marcapasso,
foram classificados como de etiologia não-cirúrgica;
Classe funcional: foram considerados portadores de insuficiência
cardíaca grave os pacientes com classes funcionais III e IV, segundo os critérios da
New York Heart Association;
Bloqueio atrioventricular avançado: foram classificados como
portadores de bloqueio atrioventricular avançado os pacientes com achado
eletrocardiográfico de bloqueio atrioventricular do 2º grau tipo II ou 2:1 ou total;
Arritmia ventricular ou QT longo: foram considerados os achados de
extra-sístoles ventriculares isoladas ou repetitivas e as alterações morfológicas
associadas a arritmias graves, como intervalo QT longo ou pré-excitação
ventricular;
Área cardíaca: foram classificados como portadores de área cardíaca
Defeito ou prótese intracardíacos: foram considerados como sem
defeito os pacientes sem malformação ou os submetidos a correção total, incluídos
os portadores de discordância atrioventricular ou tubos extra-anatômicos. Foram
considerados portadores de defeito ou prótese intracardíaca os pacientes com
malformações congênitas não corrigidas cirurgicamente; os com defeito residual
após correção completa; os submetidos a correções paliativas e os portadores de
próteses valvares.
3.5.2.
P
ADRONIZAÇÃO DOSE
VENTOSP
ÓS-
OPERATÓRIOSÓbito do paciente: foi avaliada a sobrevida total dos pacientes,
considerando-se o momento do óbito, tanto dos pacientes que estavam em uso do
marcapasso transfemoral, quanto dos que já tinham seu marcapasso transfemoral
removido, estando em uso de outro tipo de marcapasso ou sem estimulação
cardíaca artificial.
Final da duração do sistema transfemoral: foi considerado o
momento da perda da função do sistema transfemoral, qualquer que fosse o
motivo. No caso de óbito do paciente, foram considerados apenas os casos que
poderiam ser relacionados a falha do sistema de estimulação, ou seja, morte súbita
ou morte de causa não esclarecida enquanto o marcapasso transfemoral ainda
estivesse em uso.
Reoperação para reintrodução de cabo-eletrodo: foi estudada a
transfemoral, para compatibilizar o tamanho do cabo-eletrodo ao tamanho do
paciente. Para a construção das curvas de expectativa de duração do sistema ou
mesmo da influência das variáveis pré-operatórias, não foram considerados o
sucesso ou a falha desse procedimento. Também não foi considerada a indicação
cirúrgica: primária ou associada à troca de gerador de pulsos por exaustão de
bateria.
Reoperações “sensu lato”: foi estudada a necessidade de
reoperações, seja para manutenção eletiva do sistema (troca de gerador ou
reintrodução de cabo-eletrodo), seja para o tratamento de complicações, ou por
outras indicações eletivas. Nas oportunidades em que mais de um tempo cirúrgico
foi utilizado para tratar a mesma intercorrência, um único evento foi considerado.
3.6.
A
NÁLISEE
STATÍSTICAOs índices de mortalidade e de eventos ocorridos durante o seguimento
pós-operatório dos pacientes foram determinados pelo método de Kaplan-Meier.
a partir das variáveis consideradas fatores independentes de prognóstico, foram
comparadas através do teste de log-rank.
Para as comparações das variáveis quantitativas estudadas no período
intra-operatório do implante inicial com as da primeira reoperação realizada, foi
utilizado o teste “t” de Student para amostras pareadas. Nessa análise foram
incluídas apenas as variáveis dos pacientes que apresentavam dados completos
em relação aos períodos estudados.
A existência de correlação entre os eventos tempo de sobrevida,
duração do sistema transfemoral e reintrodução do cabo-eletrodo com a idade do
paciente, foi analisada por método de regressão linear.
4.
RESULTADOS
O implante de marcapasso foi possível em todos os procedimentos, não
tendo ocorrido óbito intra-operatório.
Foram implantados 88 sistemas ventriculares, sete atrioventriculares e
quatro atriais.
A principal via de acesso utilizada para a introdução dos
cabos-eletrodos foi a veia safena interna esquerda, por onde foram introduzidos 63
eletrodos, seguida da veia femoral esquerda, utilizada para o implante de 31 cabos.
Pelas veias femoral e safena interna direitas, foram implantados apenas 12
sistemas. Em todos os implantes atrioventriculares, ambos os cabos foram
implantados pela mesma via de acesso. (Tabela VII).
Veia Utilizada
Atrial
Ventricular
Safena interna esquerda
7
56
Femural esquerda
3
28
Femural direita
1
7
Safena interna direita
0
4
Todos os 11 eletrodos atriais utilizados foram de fixação ativa,
implantados na porção mais alta do átrio direito em oito pacientes, na aurícula
direita em um, no átrio esquerdo em um paciente submetido a operação de
Senning, e na parede lateral do átrio direito em um. Dos 95 cabos ventriculares
implantados, apenas onze eram de fixação passiva. A ponta do ventrículo direito foi
a região do implante em 40 pacientes, a parede diafragmática, em 31, a parede
septal do ventrículo direito, em 15, o ventrículo esquerdo, em seis pacientes
portadores de tranposição dos vasos da base, e outras regiões, em três pacientes.
Os modelos dos cabos-eletrodos utilizados estão apresentados no Anexo F.
Os geradores de pulso foram implantados na fossa ilíaca esquerda em
91 crianças, e na fossa ilíaca direita em oito. Os modelos de geradores de pulsos
implantados estão listados no Anexo G.
4.1.
S
EGUIMENTO DOSP
ACIENTESOs pacientes foram acompanhados por um período que variou de sete
dias a 18,2 anos (média = 5,3
±
5,0 anos). Houve um óbito hospitalar devido a
4.2.
S
OBREVIDA DOSP
ACIENTESAté o momento da última avaliação, 83 pacientes permaneciam vivos. O
óbito mais precoce ocorreu sete dias após o implante de marcapasso e o mais
tardio, 103,5 meses (média = 24,4
±
31,6 meses). Os óbitos foram de causa
cardíaca em cinco pacientes, infecciosa em quatro, súbita em dois, desconhecida
em três e por outras causas em dois. (Tabela VIII e Anexo I).
Causa desconhecida
3
Desconhecida
Morte súbita
2
Cardíaca
Insuficiência cardíaca terminal
5
Infecção no sistema
1
Infecciosa
Infecção não relacionada ao marcapasso
3
Hemorragia pulmonar
1
Outras causas
Complicação anestésica
1
Tabela VIII. Causas de óbito
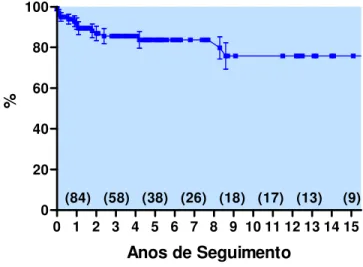
A curva de sobrevida calculada pelo método de Kaplan-Meier (Figura
3), mostra índices de sobrevida de 83,7% aos cinco anos de seguimento e de
Figura 3. Sobrevida dos pacientes.
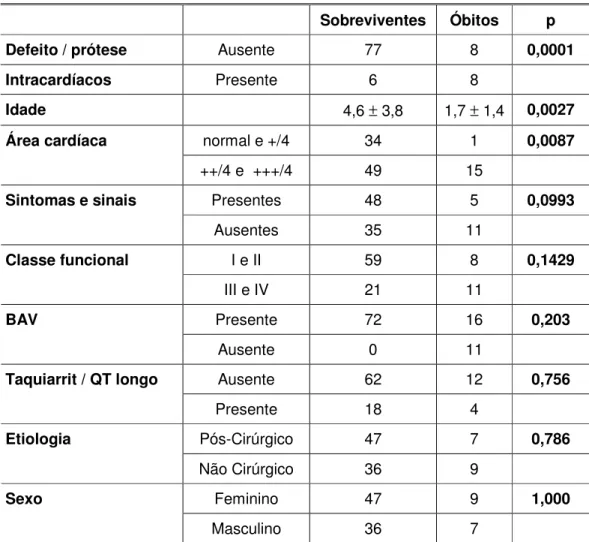
A análise isolada das variáveis pré-implante estudadas identificou a
existência de relação significativa para os parâmetros idade do paciente, presença
de defeito ou prótese intracardíacos e tamanho da silhueta cardíaca com a
sobrevida do paciente, enquanto, para a variável presença de sintomas e sinais, foi
detectado nível de significância 0,0993 (Tabela IX).
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
(84) (58) (38) (26) (18) (17) (13) (9)
Anos de Seguimento
Sobreviventes
Óbitos
p
Defeito / prótese
Ausente
77
8
0,0001
Intracardíacos
Presente
6
8
Idade
4,6
±
3,8
1,7
±
1,4
0,0027
normal e +/4
34
1
0,0087
Área cardíaca
++/4 e +++/4
49
15
Presentes
48
5
0,0993
Sintomas e sinais
Ausentes
35
11
I e II
59
8
0,1429
Classe funcional
III e IV
21
11
Presente
72
16
0,203
BAV
Ausente
0
11
Ausente
62
12
0,756
Taquiarrit / QT longo
Presente
18
4
Pós-Cirúrgico
47
7
0,786
Etiologia
Não Cirúrgico
36
9
Feminino
47
9
1,000
Sexo
Masculino
36
7
Tabela IX. Análise isolada das variáveis relacionadas com a sobrevida. (BAV = bloqueio atrioventricular; Taquiarrit / QT longo = arritmia ventricular ou intervalo QT longo)
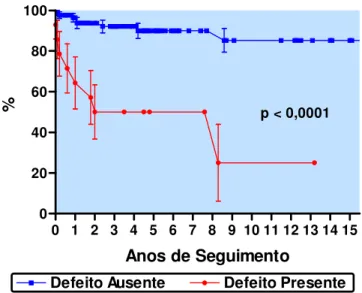
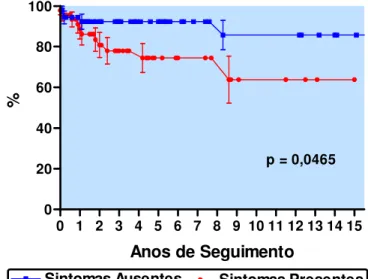
As curvas de sobrevida, obtidas a partir dos três fatores de prognóstico
identificados pelos modelos de risco proporcional de Cox, são apresentadas nas
Figuras 4, 5 e 6, e mostram a menor sobrevida dos pacientes com idade inferior a
três anos à época do implante, dos que apresentavam defeito ou prótese
intracardíaca, e dos que apresentavam sintomatologia decorrente da bradicardia.
Figura 4. Sobrevida dos pacientes a partir da existência de defeitos ou próteses
intracardíacos.
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
Defeito Ausente
Defeito Presente
p < 0,0001Anos de Seguimento
Figura 5. Sobrevida dos pacientes segundo a idade no momento do implante incial.
Figura 6. Sobrevida dos pacientes a partir da existência de sintomas
pré-operatórios.
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
Sintomas Ausentes
Sintomas Presentes
p = 0,0465Anos de Seguimento
%
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
Idade > 3 anos
Idade
≤
≤
≤
≤
3 anos
p = 0,0017
Anos de Seguimento
4.3.
D
URAÇÃO DOS
ISTEMAT
RANSFEMORALAté a data da última avaliação, os sistemas de estimulação
transfemorais haviam sido utilizados de sete dias a 202 meses (média = 48,9
±
44,0
meses). A interrupção do funcionamento do primeiro eletrodo transfemoral ocorreu
em 37 dos 99 pacientes, devido à retirada do sistema em 22 e pelo óbito em 15.
A retirada do sistema foi motivada por falha da função de estimulação
em cinco casos, pela incompatibilidade entre o comprimento do cabo-eletrodo com
o tamanho do paciente em dois, por problemas infecciosos em oito, e causas
eletivas em sete pacientes (Anexo J).
Figura 7. Expectativa de duração dos cabos-eletrodos transfemorais.
A análise isolada das variáveis pré-implante estudadas identificou
tendência de relação apenas para o parâmetro presença de defeito ou prótese
intracardíacos. (Tabela X). A análise de risco proporcional de Cox, entretanto, não
confirmou essa tendência.
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
(80) (54) (31) (17) (7) (6) (5) (3)
Anos de Seguimento
Em uso
Retirado P
Defeito / prótese
Ausente
64
22
0,05595
Intracardíacos
Presente
10
4
Taquiarrit / QT longo
Ausente
51
23
0,106
Presente
63
25
0,1698
BAV
Ausente
10
1
Feminino
43
13
0,4315
Sexo
Masculino
30
12
I e II
51
16
0,4358
Classe funcional
III e IV
22
10
Normal e +/4
27
8
0,5691
Área cardíaca
++/4 e +++/4
46
18
Presentes
38
15
0,6207
Sintomas e sinais
Ausentes
35
11
Idade
4,2
±
3,7
4,0
±
3,6
0,8575
Pós-Cirúrgico
40
14
0,9335
Etiologia
Não Cirúrgico
33
12
Tabela X. Análise isolada das variáveis pré-operatórias relacionadas com a duração do cabo-eletrodo transfemoral. (BAV = bloqueio atrioventricular; Taquiarrit / QT longo = arritmia ventricular ou intervalo QT longo)
Figura 8. Correlação entre idade do paciente no momento do implante e tempo de
duração do eletrodo transfemoral.
4.4.
R
EOPERAÇÃO PARAR
EINTRODUÇÃO DEC
ABO-E
LETRODOO procedimento para liberação de cabo-eletrodo da loja do gerador de
pulsos e sua introdução no sistema venoso, com formatação de nova alça em átrio
direito, foi realizado em 30 crianças. Apenas uma criança foi submetida a dois
procedimentos, com intervalo de seis anos.
O menor tempo transcorrido entre o primeiro implante e a reintrodução
de cabo-eletrodo foi de 2,3 meses, e o maior, de 100,0 meses (média = 46,8
±
24,2).
0 1 2 3 4 5 6 7 8 9 10
0 5 10 15
Tempo (anos)
Id
ad
e
(a
n
o
Em seis oportunidades, o procedimento de reintrodução de
cabo-eletrodo foi realizado isoladamente e, em 25, associado à troca do gerador de
pulsos. A indicação primária do procedimento foi a necessidade de compatibilizar o
comprimento do cabo-eletrodo com o crescimento do paciente, em 20
oportunidades, e a exaustão da bateria do gerador de pulsos, em 11.
A expectativa de permanência do sistema transfemoral livre de
reintrodução de cabo-eletrodo, calculada pelo método de Kaplan-Meier (Figura 9),
mostra índices de 64,2% aos cinco anos de seguimento, de 20,0%, aos oito e de
10,0%, aos nove anos. O tempo médio necessário para a reintrodução de
cabo-eletrodo foi de 66 meses.
Figura 9. Curva atuarial dos pacientes livres da primeira reintrodução de
cabo-eletrodo.
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 0
20 40 60 80 100
Anos de Seguimento
A análise isolada das variáveis pré-implante estudadas identificou a
existência de relação significativa apenas para o parâmetro presença de defeito ou
prótese intracardíacos, enquanto a variável idade do paciente no momento do
implante apresentou nível de significância de 0,0964. (Tabela XI). A análise de risco
proporcional de Cox não confirmou essas tendências.
Não Realizada
Realizada P
Defeito / prótese
Ausente
55
30
0,0078
Intracardíacos
Presente
14
0
Idade
4,6
±
3,9
3,2
±
2,8
0,0964
I ou II
50
17
0,2150
Classe funcional
III ou IV
20
12
< ++
22
13
0,2735
Área cardíaca
> ou = ++
47
17
Presente
60
28
0,3535
Bloqueio
Atrioventricular
Ausente
9
2
Presentes
35
18
0,3951
Sintomas e sinais
Ausentes
34
12
Ausente
50
24
0,6467
Taquiarrit / QT longo
Presente
16
6
Feminino
38
18
0,6494
Sexo
Masculino
31
12
Etiologia
Pós-Cirúrgico
37
17
0,7799
Não Cirúrgico
32
13
Pela regressão linear, não foi encontrada correlação entre a idade do
paciente no momento do implante e o tempo para reintrodução de cabo-eletrodo.
(Figura 10).
Figura 10. Correlação entre idade do paciente no momento do implante inicial e
tempo para a primeira reintrodução de cabo-eletrodo.
Dos trinta procedimentos realizados, foi possível a introdução do
excesso de eletrodo liberado da loja do gerador, produzindo nova alça, em 23. Em
sete deles o procedimento falhou devido à aderência do cabo-eletrodo ao endotélio
da veia cava inferior ou ao endocárdio do átrio direito.
Para os casos de sucesso no procedimento de reintrodução, o tempo
transcorrido entre o primeiro implante e a reoperação variou de 2,3 a 75,8 meses,
com média de 40,8
±
4,7. Nos casos em que a reintrodução falhou, o tempo
transcorrido entre o primeiro implante e a reoperação variou de 29,6 a 99,9 meses,
com média de 66,3
±
8,2. Essa diferença, avaliada pelo teste “t” de Student para
amostras não pareadas, mostrou diferença significativa com valor de p = 0,0135.
0 1 2 3 4 5 6 7 8 9 10
0 5 10 15