Telma Marisa Rebelo Silva
Fevereiro de 2013
Caracterização do proteoma mitocondrial
do cancro de cabeça e pescoço:
análise de um caso clínico
UMinho|20
12
Telma Marisa R
ebelo Silva
Caracterização do pro
Trabalho realizado sob a orientação da
Doutora Rita Ferreira
e da
Doutora Sandra Paiva
Telma Marisa Rebelo Silva
Dissertação de Mestrado
Mestrado em Genética Molecular
Caracterização do proteoma mitocondrial
do cancro de cabeça e pescoço:
Nome: Telma Marisa Rebelo Silva
Endereço electrónico: telma.mrs@gmail.com Telefone: 912414721 Número do Cartão de Cidadão: 11268574 9ZZ1
Título da dissertação:
Caracterização do proteoma mitocondrial do cancro de cabeça e pescoço: análise de um caso clínico
Orientadores: Doutora Rita Ferreira Doutora Sandra Paiva Ano de conclusão: 2013 Designação do Mestrado: Mestrado em Genética Molecular
É AUTORIZADA A REPRODUÇÃO INTEGRAL DESTA TESE APENAS PARA EFEITOS DE INVESTIGAÇÃO, MEDIANTE DECLARAÇÃO ESCRITA DO INTERESSADO, QUE A TAL SE COMPROMETE;
Universidade do Minho, ___/___/______
“ A person who never made a mistake never tried anything new.”
Albert Einstein
À Doutora Rita Ferreira, um sincero obrigado por me ter acolhido e proporcionado a realização deste trabalho. Agradeço a oportunidade, todos os conhecimentos que me transmitiu, toda a confiança que depositou nas minhas capacidades, a autonomia que me deu e a disponibilidade prestada.
À Doutora Sandra Paiva, pela disponibilidade em ajudar, apoio e amizade demonstrada.
A todas as pessoas do Departamento de Biologia, incluindo técnicos, professores e colegas, pelo bom ambiente de trabalho e amizade.
A todos os meus amigos que me apoiaram, compreenderam e incentivaram durante este período.
Um agradecimento muito especial para toda a minha família por serem o meu suporte em todas as etapas da minha vida. Aos meus pais e irmãos por me apoiarem sempre que precisei. E especialmente à minha querida Bruna pelo carinho e compreensão que ajudou ao longo deste percurso.
E por fim, agradeço ao Luís que com grande amizade sempre me apoiou nos momentos que mais necessitei.
A todos, um franco e sentido,
Resumo
O cancro de cabeça e pescoço encontra-se entre as neoplasias com maior incidência, cuja taxa de mortalidade não mudou significativamente apesar dos avanços tecnológicos e novas terapêuticas propostas nos últimos anos. Entre as alterações que caracterizam as células tumorais neste tipo de cancro encontra-se o aumento da captação de glucose acompanhado de elevadas taxas de glicólise com redução da fosforilação oxidativa, fenómeno conhecido como “efeito de Warburg”. No sentido de contribuir para uma melhor compreensão das alterações do proteoma mitocondrial subjacentes ao cancro de cabeça e pescoço, neste estudo identificaram-se as proteínas mitocondriais diferentemente expressas entre o tecido tumoral e não tumoral e entre o gânglio metastizado e normal num paciente com um tumor T3N3 no bordo da língua. A análise proteómica foi realizada por LC-MS/MS, com quantificação por iTRAQs. Foram identificadas 158 proteínas diferentes com predominância de proteínas envolvidas no metabolismo e fosforilação oxidativa. A análise das proteínas diferentemente expressas entre as diferentes amostras sugere a prevalência de proteínas apoptóticas nos tecidos neoplásicos e uma diminuição da atividade mitocondrial. As alterações do proteoma mitocondrial associadas ao cancro da cabeça e pescoço sugerem uma adaptação metabólica das células tumorais. Estudos adicionais devem ser efetuados no sentido de corroborar os resultados obtidos com o intuito de melhor compreender o impacto das alterações mitocondriais no fenótipo das células tumorais.
Abstract
Head and neck cancer is among the neoplasms with higher incidence despite the technological advances and new therapeutic proposed in the last years. Among the changes that characterize the tumor cells from this type of cancer is the increasing glucose uptake that occurs to fulfill the high rates of glycolysis with the concomitant decrease of oxidative phosphorylation, a phenomenon known as "Warburg effect". To better understand the changes in mitochondrial proteome underlying head and neck cancer, in this study were performed mitochondrial protein profiling in order to identify the proteins differentially expressed between tumor and non-tumor tissues in a patient with a tumor T3N3 located in the edge of the tongue. The proteomic analysis was performed by LC-MS/MS, with iTRAQs quantification. Most of the 158 different proteins identified belong to metabolism and oxidative phosphorylation (according to GOA). The analysis of differentially expressed proteins among the different samples, based on iTRAQ data, suggests the prevalence of apoptosis and a decrease in mitochondrial activity in tumor cells. Overall, data indicate that the mitochondrial proteome alterations associated with head and neck cancer appear are related with the metabolic adaptation that characterize tumor cells. Additional studies must be performed in order to validate data obtained aiming to add new insights on the impact of mitochondrial alterations in the phenotype of tumor cells.
Agradecimentos...iii
Resumo...v
Asbtract... vii
Glossário ... xi
Lista de Figuras ...xiii
Lista de Tabelas ... xv
1.Introdução ... 3
2. Cancro de cabeça e pescoço ... 3
2.1.Epidemiologia e fatores etiológicos ... 3
2.2. Alterações metabólicas associadas ao cancro: Efeito de Warburg ... 5
2.3. Proliferação celular e “preferências “ metabólicas ... 7
3. Mitocôndria e o cancro... 8
3.1.Supressão da atividade mitocondrial mediada pelo HIF... 10
3.2. “Assinatura” bioenergética e marcadores tumorais... 12
4. Objetivos do trabalho ... 15
5. Materiais e métodos... 19
5.1. Desenho experimental... 19
5.2. Isolamento de mitocôndrias ... 20
5.3. Quantificação da proteína total e do mtDNA... 20
5.4. Western bloting ... 20
5.5. Análise do proteoma mitocondrial por LC-MS/MS com quantificação por iTRQAs .. 21
5.6. Análise estatística... 22
6. Resultados ... 25
6.1. Análise do teor relativo de mitocôndrias nos tecidos... 25
6.2. Caraterização das alterações do perfil proteico mitocondrial associadas ao cancro da cabeça-pescoço ... 25
6.2.1. Análise global da fração mitocondrial por LC-MS/MS ... 25
Bibliografia... 47 Anexos ... 59
2DE Eletroforese em gel a 2 dimensões
2D-DIGE Two-dimensional Difference gel electrophoresis
AKT Proteína cinase B
ANOVA Análise de variância
ATP Adenosina Trifosfato
β-F1-ATPase ATP sintase- subunidadeβ
CI (NDUFV2) NADH desidrogenase [ubiquinona] flavoproteína 2, mitocondrial
COX Citocromo c oxidase
CoA Coenzima A
DNA Ácido desoxirribonucleico
DO Densidade ótica
EGF Fator de crescimento epidérmico
FH Fumarato hidratase
GAPDH Gliceraldeído 3-fosfato desidrogenase Hela Linha celular de cancro do colo do útero
HIF Fator indutor de hipoxia
HK Hexocinase
HL60 Human promyelocytic leukemia cells
HPLC High-Performance liquid chromatography
Hsp60 Proteína de choque térmico com 60 kDa
iTRAQs isobaric tag for relative and absolute quantitation
LC Cromatografia liquida
LDH Lactato desidrogenase
LNCaP Linha celular de adenocarcinoma da próstata
MALDI-TOF/TOF Espectrómetro de massa tipo duplo TOF com fonte de MALDI
MS Espectrometria de massa
MS/MS Espectrometria de massa tandem mtDNA Ácido desoxiribonucleico mitocondrial mTOR Mammalian target of rapamycin
NADH Nicotinamide adenine dinucleotide PDK1 Cinase 1 dependente de fosfoinositídeo
PDH Piruvato desidrogenase
pI Ponto isoelétrico
PK Piruvato cinase
PI3K Fosfatidilinositol 3-cinase
TCTP Translationally controlled tumor protein
TOF/TOF Tempo-de-vootandem
TSC Tuberous sclerosis complex
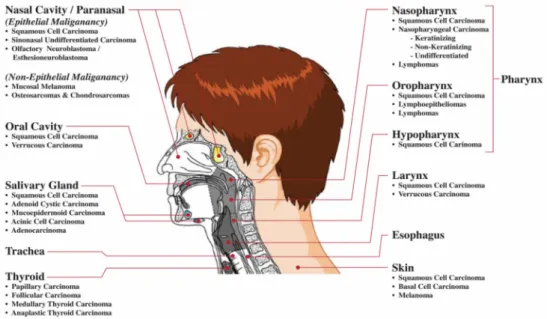
Figura 1: Cancro da Cabeça e Pescoço: histopatologia vs. localização anatómica (Stadler et al.
2008)... 4 Figura 2: Representação esquemática das vias metabólicas utilizadas pelos tecidos diferenciados, proliferativos e pelos tumores para a obtenção de energia. Warburg observou que as células tumorais têm tendência para converter a maior parte da glucose em lactato independentemente da presença de oxigénio (glicólise aeróbica) em oposição à fosforilação oxidativa (na presença de oxigénio) ou à glicólise anaeróbica (na ausência de oxigénio) (Vander-Heidenet al.2009). ... 6 Figura 3: Mecanismos propostos para o aumento da permeabilidade mitocondrial. (a) Modelo clássico de permeabilização. Formação de canais pro—apoptóticos ou abertura do poro de transição de permeabilização (PTP) com libertação dos fatores opoptóticos do espaço intermembranar (IMS) e das cristas mitocondriais para o citosol onde vão desencadear a ativação das caspases e morte celular. (b) Modelo de permeabilização alternativo. Durante a apoptose um agente perturbador da membrana transloca-se para a mitocôndria e destabiliza a camada lipídica com formação de um poro lipídico e posterior remodelação intra-mitocondrial desencadeando a libertação de fatores apoptogénicos. c) Modelo proposto para a divisão mitocondrial e fissão induzida (MMP) onde a membrana mitocondrial interna (IMM) e membrana mitocondrial externa (OMM) são conduzidas em justaposição para formar uma haste intermédia, onde posteriormente se forma um anel que contrai as mitocôndrias, até que estas se dividem (Alirol e Martinou 2006)... 9 Figure 4: Vias de sinalização que regulam o metabolismo nas células em proliferação. A ligação do fator de crescimento (GF) ao seu recetor activa o PI3K e as serina/treonina cinases Akt e mTOR (superior esquerdo). A ativação constitutiva da via do mTOR pode ocorrer em tumores devido a mutações nos genes supressores de tumor PTEN, TSC1e TCS2 (de Berardinis et al.
2008)... 11 Figura 5: Esquema do trabalho experimental realizado na análise de um caso clínico... 19 Figura 6: Distribuição por classes funcionais das proteínas identificadas nos tecidos do Paciente analisado neste estudo, segundo a base de dadosGene Ontology Annotation(GOA). . 26 Figura 7: Análise da expressão de ATP sintase- subunidade β (azul), ETFDH (vermelho) e subunidade NDUFV2 do Complexo I (verde), GAPDH (Azul Claro) e α-B-Cristalina (Laranja) na fração mitocondrial do tecido tumoral (T), normal (TN), gânglio normal (G) e metastizado (GM). Os resultados são expressos como média ± desvio padrão da densidade ótica (DO) expressa em unidades arbitrárias (análises efetuadas em triplicado). Acima dos gráficos são apresentadas imagens representativas de Western blotting para cada proteína analisada.
*p<0,5; **p<0,01 e ***p<0,005 vs TN; *p<0,5; **p<0,01 e ***p<0,005 G vs GM. ... 29 Figura 8: Análise da expressão de GAPDH na fração citoplasmática obtido do tecido tumoral (T), tecido normal (TN), gânglio (G) e gânglio metastizado (GM) comparativamente com o
***p˂0,05 TN vs T, G, GM; **p˂0,05 T vs GM e G vs GM... 30 Figura 9: Esquema representativo das proteínas cujos níveis se encontraram alterados no tecido tumoral e/ou gânglio mestastizado, comparativamente aos tecidos normais adjacentes, de um doente com cancro da cabeça-pescoço... 31
Tabela 1: Avaliação do teor mitocondrial nos diferentes tecidos a partir da concentração de proteína mitocondrial, de mtDNA e da massa de tecido obtidos (análises efetuadas em triplicado). ... 25 Tabela 2: Análise comparativa das proteínas mitocondriais diferentemente expressas entre tecido não tumoral (TN), tumoral (T), gânglio normal (G) e gânglio metastizado (GM), utilizando iTRAQS (análises efetuadas em duplicado) ...
... 27 Tabela A1: Proteínas identificadas na fração mitocondrial no tecido não tumoral (NT), tumoral (T), gânglio normal (G) ou gânglio metastizado (GM) por LC-MS/MS. ... 59
1. Introdução
Segundo a Organização Mundial de Saúde, em 2008 ocorreram 7,9 milhões de mortes por cancro, e estima-se que em 2030 este número aumente para 13,1 milhões (WHO 2011). O cancro da cabeça e pescoço encontra-se entre os tumores mais agressivos e embora não seja dos mais prevalentes, prevê-se que a sua incidência aumente devido a fatores relacionados com o estilo de vida, tais como o consumo de tabaco e álcool (Anandet al. 2008; Han et al.2009; Zygogianniet al. 2011).
De entre os mecanismos celulares subjacentes ao desenvolvimento tumoral, as alterações do metabolismo no sentido de uma maior predominância de glicólise aeróbica parecem assumir particular importância. Esta maior dependência pela glicólise para obtenção de energia parece resultar da inibição da fosforilação oxidativa (OXPHOS) e é mais elevada em tecidos sob hipóxia (Gatenby e Gillies 2008; Gillieset al.2008; Hsu e Sabatini 2008; Vazquezet al. 2010). Neste contexto, as mitocôndrias têm sido alvo de vários estudos que visam uma melhor compreensão das alterações do metabolismo energético e moleculares que ocorrem nas células tumorais (Cuezva et al. 2002; Cuezva et al. 2004; Gogvadze et al. 2008; Acebo et al.
2009). Com o desenvolvimento de novas estratégias experimentais na área da proteómica envolvendo técnicas de quantificação como os iTRAQs para análise do proteoma por LC-MS/MS, é possível uma melhor compreensão das vias moleculares utilizadas pelas células tumorais para se adaptarem a diversos microambientes (Berridgeet al.2010).
2. Cancro da cabeça e pescoço
2.1. Epidemiologia e fatores etiológicos
O cancro de cabeça e pescoço encontra-se entre as neoplasias mais frequentes, com 780.000 novos casos registados anualmente em todo mundo (WHO 2008). O principal tipo histológico é o carcinoma epidermoide da cabeça e pescoço e corresponde a cerca de 90% dos casos. Em termos de localização anatómica fazem parte deste grupo de neoplasias a cavidade oral, que compreende a mucosa bucal, gengivas, palato duro, língua, a faringe, que inclui a orofaringe, nasofaringe, hipofaringe; a laringe, as glândulas salivares, a cavidade nasal e os seios
paranasais. Os níveis de incidência são cerca de 40% na cavidade oral, 25% na laringe, 15% na faringe, sendo o restante nos locais remanescentes (Sturgiset al.2004; Lothaireet al.2006).
O principal fator etiológico associado ao cancro da cabeça e pescoço é o consumo de tabaco e álcool, cujo efeito sinérgico tem sido amplamente estudado nos últimos anos (Hashibe
et al. 2007; Boffetta et al. 2008; Gandini et al.2008; Zygogianni et al. 2011). Outros fatores podem contribuir para a carginogénese nomeadamente uma má nutrição, má dentição, poluição ambiental e certas condições de trabalho associadas à indústria como a metalurgia e a petroquímica, assim como a predisposição e suscetibilidade genética (Döbrossy 2005; Choi e Myers 2008). No entanto, uma percentagem significativa de casos pode estar relacionada com a infeção pelo vírus do papiloma humano (HPV) (Sturgis e Cinciripini 2007).
As neoplasias da cabeça e pescoço são geralmente diagnosticadas tardiamente com consequências fatais em muitos casos (Wadsworth et al. 2004). O prognóstico e a abordagem terapêutica escolhida baseiam-se essencialmente em parâmetros clínicos, histológicos e radiológicos, com definição da localização do tumor primário e do estadio do mesmo. No entanto, apesar de muitos tumores apresentarem um mesmo estadio clínico, os padrões de evolução e crescimento tumoral podem ser bastante variáveis (Thomaset al.2005; Stadleret al.
2008). Deste modo existe uma grande diversidade em termos morfológicos e anatómicos, o que torna difícil definir com precisão a extensão da doença para um determinado paciente (figura 1) (Stadleret al.2008).
Muitos dos tumores da cabeça e pescoço metastizam, mas a sua disseminação ocorre geralmente de forma ordenada e permanece restrita a uma dada zona por longos períodos de tempo (Leibelet al.1991). A invasão local dos tecidos é seguida por metástases para linfonodos regionais (Leemanset al. 1993, 1994; Pignonet al. 2007). As metástases linfáticas à distância tendem a ocorrer tardiamente (Leibelet al.1991).
Do ponto de vista metabólico, os tumores da cabeça e pescoço evidenciam um fenótipo glicolítico (Halfpenny et al. 2002; Fliedner et al. 2012). Este fenótipo observado em diversos tipos de cancro coloca a glicólise no centro da atividade maligna, dando substrato à teoria avançada por Warburg há mais de cinquenta anos (Efeito de Warburg) (Warburg 1956). Uma vez mais demonstrando a importância que as mitocôndrias têm nos processos carcinogénicos incluindo de cabeça e pescoço.
Contudo apesar dos numerosos estudos sobre os mecanismos de carcinogénese, o desenvolvimento do tumor, progressão e agressividade permanecem desconhecidas. Assim, o desenvolvimento de novas abordagens terapêuticas é fundamental e para o efeito é necessário identificar alvos moleculares, tendo por base os mecanismos celulares ativados ou comprometidos nos tumores da cabeça e pescoço (Hanet al.2009).
2.2. Alterações metabólicas associadas ao cancro: Efeito de Warburg
No início dos seus estudos Warburg verificou que as células tumorais produzem a maior parte do seu ATP através da via glicolítica, ainda que em condições aeróbicas (Warburg 1930). Este investigador sugeriu também que a elevada taxa glicolítica das células tumorais deveria resultar de uma disfunção bioenergética ao nível das mitocôndrias (Warburg 1930, 1956). A produção de ATP pela via da glicólise sob condições aeróbicas, conhecida como “Efeito de
Warburg” (figura 2), tem sido verificada por vários investigadores e pareceser uma característica
da maior parte das células tumorais (Semenzaet al.2001; de Berardiniset al. 2008;Gogvadze
et al. 2010). Mais ainda, parece haver uma associação entre células tumorais com um metabolismo essencialmente glicolítico e a agressividade do tumor (Simonnetet al.2002).
Figura 2: Representação esquemática das vias metabólicas utilizadas pelos tecidos diferenciados, proliferativos e
pelos tumores para a obtenção de energia. Warburg observou que as células tumorais têm tendência para converter a maior parte da glucose em lactato independentemente da presença de oxigénio (glicólise aeróbica) em oposição à fosforilação oxidativa (na presença de oxigénio) ou à glicólise anaeróbica (na ausência de oxigénio) (Vander-Heiden
et al.2009).
No sentido de melhor compreender a “preferência” metabólica das células tumorais, têm sido estudados os componentes da fosforilação oxidativa do ponto de vista estrutural, tendo-se detetado, por exemplo, uma diminuição da expressão da subunidade beta da ATP sintatendo-se (Isidoro et al. 2005). Inclusivamente foi verificado por alguns autores uma correlação inversa entre os níveis de expressão desta proteína e a taxa de glicólise aeróbica (Cuezva et al. 2002, 2004; Lin et al.2008; Acebo et al. 2009). A associação entre as disfunções mitocondriais e o aumento da taxa de glicólise tem sido constatada in vitro, nomeadamente em células de carcinoma de pulmão que na presença de oligomicina, um inibidor da atividade do complexo V da fosforilação oxidativa, passam a realizar a glicólise aeróbica para obtenção de ATP. Estes resultados sugerem que as células se tornam glicolíticas como resultado da supressão da via energética mitocondrial (Lopez-Rioset al.2007).
Contudo outros estudos têm demonstrado que as mitocôndrias de alguns tumores são bastante funcionais no que diz respeito à capacidade de síntese de ATP pela cadeia respiratória (Eakin et al. 1972; Vincent et al. 2008; Pavlides et al. 2009). De facto em alguns tumores verificou-se que o consumo de oxigénio é até maior do que em tecidos normais. Assim, alguns autores defendem que não há evidências concretas para a existência de défices da capacidade respiratória, tanto ao nível da cadeia transportadora de eletrões, como dos cofatores ou na
presença ou ausência de enzimas mitocondriais (Weinhouse 1976). No sentido de explicar a alteração da via de produção de ATP, alguns autores atribuem ao efeito de Pasteur o silenciamento mitocondrial e não ao efeito de Warburg (Zu e Guppy 2004). Mais recentemente tem sido sugerido que o efeito de Warburg deve-se a alterações nas vias de sinalização que regulam a glicólise e que também estão envolvidas na regulação da bioenergética mitocondrial, não envolvendo necessariamente défices de sistemas enzimáticos mitocôndriais (Gogvadzeet al.
2008; Gogvadzeet al.2010).
A constatação de que a maioria dos tumores apresenta elevadas taxas glicolíticas teve grande impacto no contexto clínico, com aplicação na deteção de tumores pela técnica de tomografia por emissão de positrões (PET) (Rohren 2004; Lee et al. 2005; Lopez-Rios et al.
2007; Cuezva et al. 2007, 2009). A utilização de um análogo de glucose (2-fluoro-2-deoxi-D-glucose; FDG) permite detetar células que por serem altamente glicolíticas requerem quantidades elevadas de substrato energético. O FDG é fosforilado pelas hexocinase a FDG-6-fosfato, que não é metabolizado interrompendo a via glicolítica. A acumulação deste metabolito nas células pode posteriormente ser detetada, após o decaimento radioativo do isótopo fluor-18. O FDG-PET é usado no diagnóstico, estadiamento e monitorização de vários tipos de cancro nomeadamente do cólon, mama, pulmão, linfomas, melanomas (Cuezva et al. 2002, 2004; Isidoroet al.2004, 2005) e cancro da cabeça e pescoço (Regeet al.1994; Braamset al.1995). As células tumorais com maior consumo de glucose estão associadas a um mau prognóstico (Minn et al. 1997; Lopez-Rios et al. 2007). Torna-se então evidente que a glicólise aeróbica predispõe as células tumorais a um fenótipo que culmina na sua transformação e proliferação, incluindo a sobrevivência em condições de hipoxia, metastização e evasão da apoptose (Semenzaet al.1996; Semenza 2004; Gottlieb e Tomlinson 2005).
2.3. Proliferação celular e “preferências” metabólicas
Estudos recentes analisaram as propriedades metabólicas das células em proliferação e das células diferenciadas, sendo que as primeiras são caracterizadas por realizarem a glicólise aeróbica enquanto as segundas recorrem primordialmente à fosforilação oxidativa mitocondrial para obtenção de energia (Vander-Heiden et al. 2009). A elevada taxa glicolítica aeróbica das
um processo mediado pelo fator induzido pela hipoxia (HIF) (Denko 2008; Marin-Hernandez et al. 2009) e pelo fator von Hippel-Lindau (VHL). Este fator promove uma redução da ubiquitinação e estabilidade do HIF-α com consequente reprogramação do metabolismo energético no sentido de um metabolismo glicolítico (Godinot et al.2007; Semenza 2007). Neste contexto, verificou-se ainda um aumento dos transportadores de glucose (GLUTs) e enzimas glicolíticas (Kimet al.2006; Papandreouet al.2006).
Apesar dos diversos trabalhos efetuados no sentido de elucidar o metabolismo das células tumorais, não existe nenhuma evidência de que estas sejam inerentemente glicolíticas. Contudo algumas células tumorais exibem um grau moderado de glicólise aeróbica enquanto outras o fazem quando em hipoxia (Zu e Guppy 2004). As linhas celulares HL60 e HeLa sob hipoxia não expressavam um fenótipo puramente glicolítico (Herst e Berridge 2007). Estes resultados sugerem a existência de uma flexibilidade metabólica por parte das células tumorais, indicando que a glicólise aeróbica por si só não é suficiente para caracterizar as células em proliferação (Berridgeet al.2010).
As células tumorais que são desprovidas de mtDNA e por isso deficientes na fosforilação oxidativa servem de modelo glicolítico no cancro (King e Attardi 1989; Herst et al. 2004, 2005; Herst e Berridge 2007; Kulawiec et al. 2008). Experiências conduzidas a partir destes modelos celulares, mostram que a taxa de crescimento destas células em cultura é bastante reduzida (Berridge et al. 2010). Contudo ao aumentar os níveis intracelulares de NADH foi possível melhorar a sobrevivência destas células em condições de hipóxia e reduzir a produção de espécies reativas de oxigénio (ROS). Estas propriedades sugerem que as células tumorais conseguem diminuir os danos macromoleculares, assegurando a sua sobrevivência e crescimento em condições de escassez de nutrientes e o oxigénio (Berridgeet al.2010).
3. Mitocôndria e o Cancro
As mitocôndrias são organelos de elevada importância na homeostasia celular, estando envolvidos na produção de ATP através da fosforilação oxidativa (OXPHOS), e na regulação da morte celular programada (apoptose) (Wallace 1999, 2005). No entanto, as mitocôndrias de células tumorais apresentam diferenças bioquímicas e estruturais relativamente às das células normais (Muller-Hocker 1992, 2000; Maximo e Sobrinho 2000). Os tumores mais agressivos apresentam, geralmente, um maior número de mitocôndrias, com mais cristas e de menor
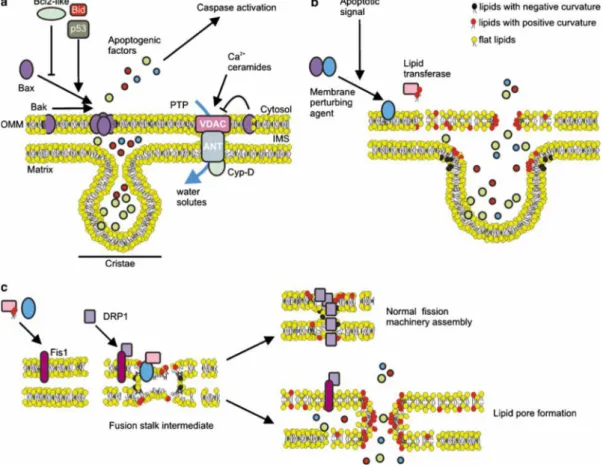
diâmetro em comparação com tumores menos agressivos (Pederson 1978; Cuezvaet al.2002). Mutações no DNA mitocondrial (mtDNA) e alterações da composição molecular das membranas também têm sido descritas em células tumorais (Carew e Huang 2002), com consequente comprometimento da respiração e síntese de ATP (Brandon et al.2006; Chatterjeeet al.2006). No caso das alterações membranares, os mecanismos que levam à permeabilização mitocondrial continuam por esclarecer, embora tenham sido propostos diversos modelos (figura 3) (Martinou e Green, 2001; Crompton et al. 2002; Waterhouse et al. 2002). No entanto, pode afirmar-se que as alterações morfológicas originam um fenótipo estrutural típico de neoplasias, sendo um fator relevante no estudo do cancro (Alirol e Martinou 2006).
Figura 3: Mecanismos propostos para o aumento da permeabilidade mitocondrial. (a) Modelo clássico de
permeabilização. Formação de canais pro—apoptóticos ou abertura do poro de transição de permeabilização (PTP) com libertação dos fatores opoptóticos do espaço intermembranar (IMS) e das cristas mitocondriais para o citosol onde vão desencadear a ativação das caspases e morte celular. (b) Modelo de permeabilização alternativo. Durante a apoptose um agente perturbador da membrana transloca-se para a mitocôndria e destabiliza a camada lipídica com formação de um poro lipídico e posterior remodelação intra-mitocondrial desencadeando a libertação de fatores apoptogénicos. c) Modelo proposto para a divisão mitocondrial e fissão induzida (MMP) onde a membrana
uma haste intermédia, onde posteriormente se forma um anel que contrai as mitocôndrias, até que estas se dividem (Alirol e Martinou 2006).
Mutações em alguns genes (SDHB,SDHC,SDHDeFH) que codificam para o Complexo II/Ciclo de Krebs também promovem o desenvolvimento de neoplasias (Baysalet al. 2000;Eng
et al. 2003), onde foi verificada uma associação entre mutações em genes nucleares que codificam subunidades da succinato desidrogenase e a predisposição para feocromocitomas
(SDHB) e paragangliomas (SDHB e SDHC) (Eng et al. 2003). A acumulação de fumarato e
sucinato parece favorecer a transcrição do HIF-1α originando um estado denominado de pseudo-hipóxia. Após uma adaptação à hipoxia, as células adquirem um metabolismo energético assente na glicólise (Gimenez-Roqueploet al.2001; Selaket al.2005; Kinget al.2006; Robey e Hay 2006).
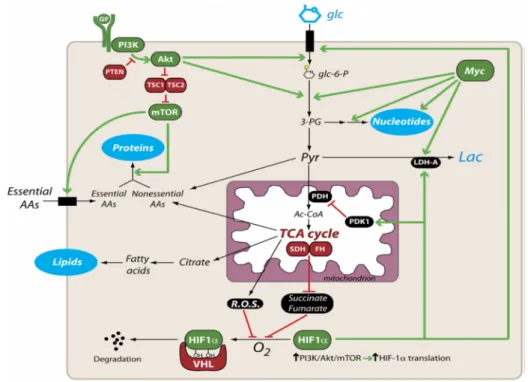
3.1. Supressão da atividade mitocondrial mediada pelo HIF
As células tumorais têm a capacidade de se adaptarem a condições de hipóxia até que a concentração de oxigénio seja normalizada via angiogénese (Gogvadzeet al. 2008; Gogvadze et al. 2010). Enquanto situações de isquémia são geralmente letais para as células normais, as células tumorais têm a capacidade de sobreviver nestas condições (Moll e Schramm 1998). As células tumorais passam a utilizar a via glicolítica para obterem a energia que necessitam, por um processo mediado pelo HIF-1 (Wang e Semenza 1993). O HIF-1 tem uma estrutura de heterodímero e possui duas subunidades, HIF-1a e HIF-1b, que são expressas constitutivamente. A síntese da primeira subunidade verifica-se mesmo na ausência de oxigénio, enquanto a segunda ocorre por uma via dependente de oxigénio (Semenza 2003). Na presença de oxigénio a cadeia HIF-1a é polihidroxilada nos resíduos prolil e arginil através de hidroxilases dependentes de oxigénio. Nesta conformação o HIF-1a liga-se à proteína supressora tumoral VHL, componente de reconhecimento da proteína ubiquitina ligase E3 (figura 3). O HIF-1a uma vez ubiquitinado é reconhecido pelo proteassoma e rapidamente degradado. Em condições de hipoxia, a hidroxilação é suprimida e o HIF-1a torna-se mais estável e consequentemente acumula-se no núcleo, onde forma um complexo com o HIF-1b (Semenza 2004). Este complexo induz a expressão de genes que controlam aspetos cruciais do desenvolvimento tumoral, incluíndo a proliferação celular, angiogénese e capacidade de metastização. O HIF-1 estimula ainda a expressão de proteínas chave da via glicolítica, tais como transportadores de glucose e
hexocinases. Contudo, níveis elevados de HIF-1 foram observados em tumores com oxigenação normal, sugerindo que outros fatores podem estabilizar o HIF-1 (Hagg e Wennstrom 2005).
No entanto, a maioria dos estudos sugerem que o HIF-1 estimula a glicólise em células tumorais e suprime a atividade da OXPHOS da mitocôndria. Assim, o HIF-1 pode funcionar como um interruptor entre a glicólise e a fosforilação oxidativa (Kim et al. 2006; Papandreou et al.
2006).
Figure 4: Vias de sinalização que regulam o metabolismo nas células em proliferação. A ligação do fator de
crescimento (GF) ao seu recetor activa o PI3K e as serina/treonina cinases Akt e mTOR (superior esquerdo). A ativação constitutiva da via do mTOR pode ocorrer em tumores devido a mutações nos genes supressores de tumor
PTEN,TSC1eTCS2(de Berardiniset al.2008).
Vários mecanismos têm sido sugeridos como sendo regulados pelo HIF-1. Foi demonstrado que este fator induz a expressão de PDK1 que por sua vez inativa a PDH, com consequente comprometimento do ciclo de Krebs e da respiração mitocondrial (Kimet al.2006; Papandreou et al. 2006). O HIF-1 estimula a expressão do geneLDH-A, cujo produto catalisa a conversão de piruvato em lactato (Semenzaet al.1996). A LDH é composta por duas isoformas LDH-A e LDH-B. A primeira converte o piruvato em lactato em condições anaeróbicas em células normais. A segunda favorece a conversão do lactato em piruvato e é expressa em níveis elevados em tecidos aeróbicos tais como o coração. A ação das duas isoformas leva à supressão da respiração mitocondrial em tumores por falta de fornecimento de acetil-CoA no ciclo de
pode servir como mecanismo de proteção das células das espécies reativas de oxigénio(Luet al.
2002; Semenza 2007).
Os resultados obtidos por alguns autores indicam claramente que a estimulação da produção de energia pela via mitocondrial pode no futuro constituir uma abordagem terapêutica com vista a induzir a morte das células tumorais (Semenza 2007; Jiang e Wang 2012).
O HIF-1 também regula a função mitocondrial em células tumorais via citocromo c oxidase (COX). Em condições aeróbicas ou de hipóxia os níveis de expressão das diferentes subunidades da COX são distintos, em particular da COX4. Aparentemente, essa alternância entre as subunidades da COX constitui um mecanismo para manter a respiração em condições de escassez de oxigénio e pode estar envolvido numa resposta adaptativa à hipóxia (Fukuda et al.2007; Gogvadzeet al.2008; Gogvadzeet al.2010).
3.2. “Assinatura” bioenergética e marcadores tumorais
A bioenergética das células tumorais tornou-se um importante foco de investigação na área do cancro, tendo como objetivo a compreensão das suas alterações no âmbito da hipótese de Warburg (Cuezva et al. 2002, 2004; Isidoro et al. 2004, 2005). Recentemente foi demonstrado que a atividade metabólica das células tumorais se correlaciona com o perfil proteico que permite inferir sobre a atividade mitocondrial da célula. Neste contexto, tem-se avaliado a expressão de proteínas mitocondriais, como por exemplo a subunidade beta da ATP sintase (bioenergética) e Hsp60 (estrutural) e em simultâneo, a expressão de marcadores glicolíticos, tais como, GAPDH, PK, LDH, HK, nas células tumorais (Leeet al.2005; Cuevzaet al.
2002, 2007). A aplicação desta metodologia permite obter uma “assinatura” proteómica que avalia as exigências energéticas dos tecidos (obtida através do rácio βF1/Hsp60) bem como o potencial energético da mitocôndria (obtido através do rácio βF1/Hsp60/GAPDH) (Lopez-Rioset al.2007; Cuezva et al. 2009). Contrariamente ao esperado, alguns resultados revelaram que os tumores provenientes de diferentes tecidos ou com distintos tipos histológicos têm a mesma assinatura proteómica referente ao metabolismo energético (Acebo et al. 2009), o que parece sugerir que o fenótipo bioenergético da mitocôndria não é específico de células tumorais nem do tipo de tecido (Aceboet al. 2009; Cuezvaet al.2004; Isidoroet al.2005). Estes dados suportam a noção de que o metabolismo energético pode ser um alvo promissor para novas abordagens
terapêuticas para diversas neoplasias (Shinet al.2005; Santamariaet al.2006; Tomiyamaet al.
2006).
Embora as proteínas mitocondriais e respetivas funções tenham sido amplamente estudadas, pouco se sabe acerca de como o proteoma é modulado no cancro (Rorbach et al. 2007; de Cavanagh et al. 2007). O proteoma mitocôndrial de mamíferos é constituído por aproximadamente 2000-2500 proteínas diferentes (Goffartet al. 2007). A utilização de técnicas no âmbito da proteómica (tais como 2DE, 2D-LC acopladas à espectrometria de massa) tornou possível a análise do proteoma mitocondrial em larga escala de forma a obter uma visão global sobre a abundância relativa das proteínas expressas numa dada condição e das interações que estabelecem (Jiang e Wang 2012). Kulawiec et al. (2006) utilizando 2D-DIGE analisaram a expressão do gene UQCRC1 (que codifica ubiquinol cytochrome-c reductase core protein I) e verificaram maior expressão em tumores de mama (74%) e ovário (34%). Para além disso correlacionaram positivamente este dado com a expressão do citocromo c-oxidase (COXII) codificado pelo mtDNA. No cancro da mama foram identificadas proteínas com alteração da expressão de preoteinas da fosforilação oxidativa, síntese do grupo heme, apoptose e oxidação dos ácidos gordos (Strong et al. 2006). A comparação do proteoma de células de carcinoma renal (RCCs) sem VHL (gene supressor de tumor) permitiu também verificar que a proteína 2 do core do complexo ubiquinol citocromo c reductase se encontrava sobre-expressa e uma forma de septina 2 sub-expressa após transfeção com VHL. O aumento da expressão de septina 2 parece ser comum em células RCCs (Cravenet al.2006).
Em células LNCaP verificou-se um aumento da expressão de proteínas VDAC1 e VDAC2 e uma diminuição PRDX2, TCTP afetando a atividade catalítica de proteínas mitocondriais com papel na apoptose (Liuet al.2007).
A análise do proteoma mitocondrial pode permitir uma melhor compreensão dos mecanismos moleculares subjacentes ao fenótipo tumoral, ajudando a determinar a “assinatura” bioenergética de um tumor.
4- Objetivos da tese
Dada a importância da mitocôndria nos processos energéticos celulares e de nas células tumorais ocorrerem alterações metabólicas, o presente projeto de mestrado teve como objetivo geral a avaliação do proteoma mitocondrial de tecido tumoral e gânglio metastizado de um paciente com cancro da cabeça e pescoço. Nesse sentido procedeu-se à:
(i) caracterização do perfil proteico de mitocôndrias isoladas de tecido tumoral (bordo da língua), tecido não tumoral adjacente, gânglio metastizado e gânglio normal, por LC-MS/MS;.
(ii) análise das proteínas identificadas em termos de processos biológicos utilizando ferramentas bioinformáticas;
(iii) análise comparativa da expressão de proteínas mitocôndriais entre amostras diferentes por LC-MS/MS com iTRAQs;
(iv) validação dos resultados obtidos por análise de proteínas alvo por Western blotting. Pela análise integrada dos resultados obtidos, pretendeu-se aumentar o conhecimento dos mecanismos moleculares subjacentes ao cancro da cabeça e pescoço.
5. Materiais e Métodos
5.1.Desenho experimental
No presente estudo analisou-se um paciente do sexo masculino com diagnóstico confirmado de presença de um tumor T3N3 no bordo da língua.
As amostras de tumor, tecido não tumoral adjacente, gânglios metastizados e não metastizados foram imediatamente processadas para posterior avaliação bioquímica do proteoma mitocondrial. Na figura 5 é apresentada de forma esquemática a abordagem experimental utilizada.
Homogeneização mecânica e digestão enzimática
Determinação do teor de mtDNA LC-MS/MS com quantificação com
iTRAQs Western Blotting
ETFDH ATPβ
alpha beta Cristalina (α-B-Cristalina) CI (NDUFV2) GAPDH Western Blotting GAPDH Fração mitocondrial Fração citoplasmática Mitocôndrias isoladas
5.2. Isolamento de mitocôndrias.
Imediatamente após a coleta, os tecidos foram incubados com colagenase I (2mg/mL) durante 10 minutos a 37ºC. Após lavagem com DMEM, incubou-se o pellet celular com tripsina 0,25mg/mL no gelo durante 20 minutos. Após homogeneização dos extratos celulares com um Potterhomogeneizere um pistão de Teflon, procedeu-se a uma centrifugação a 14500g durante 10 minutos a 4ºC tendo-se descartado o sobrenadante. Os pellets obtidos foram ressuspendidos em tampão de isolamento (250mM sacarose, 0,5mM EGTA, 10mM HEPES, pH 7,4) com BSA
fat free e posteriormente centrifugados a 750g durante 10 minutos a 4ºC. Os sobrenadantes obtidos foram centrifugados a 14000g durante 10 minutos a 4ºC e os pellets obtidos (fração mitocondrial de cada uma das amostras) assim como os sobrenadantes (fração citoplasmática) foram separados e guardados a -70ºC para posteriores análises bioquímicas (de acordo com o descrito na figura 6).
5.3. Quantificação da proteína total e do mtDNA
A determinação da concentração de proteína total presente nas frações citoplasmática e mitocondrial foi efetuada através do método colorimétrico “RC DC protein assay” da BioRad. Este ensaio baseia-se numa modificação do protocolo de Lowry et al. (1951), permitindo a quantificação de proteína na presença de agentes redutores e detergentes. Os valores de densidade ótica foram determinados a 750nm num espectrofotómetro (Genesys 6, Thermo, USA). Simultaneamente, foi efetuada uma curva de calibração utilizando-se para o efeito padrões de albumina sérica bovina (BSA) com diferentes concentrações.
Para determinar o teor de DNA presente na fração mitocondrial utilizou-se o Qubit™ fluorometerda Invitrogen®.
5.4. Western blotting
De modo a avaliar a expressão de proteínas específicas, a um dado volume de cada uma das amostras adicionou-se tampão de redução (10% de SDS, 0,5M de Tris, pH de 6,8, 15% de glicerol, 20% de mercaptoetanol e azul bromofenol) e ferveram-se as amostras de forma a garantir a desnaturação total das proteínas. As amostras reduzidas foram depois aplicadas num
gel SDS-PAGE 12,5% preparado de acordo com o descrito por Laemmli et al. (1970). As proteínas depois de separadas foram transferidas para uma membrana de nitrocelulose (Whatman®, Protan®) por electrotransferência num tampão de 25mM de Tris, 192mM de Glicina, pH de 8,3 e 20% de metanol, durante 2,30 horas a 200mA. De forma a evitar ligações não específicas, incubou-se a membrana com uma solução de 5% de leite magro em pó em TBS-T (100mM de TBS-Tris, pH de 8,0, com 150mM de NaCl e 0,05% de TBS-Tween 20) durante 3 horas à temperatura ambiente. A membrana foi então incubada com anticorpo primário diluído 1:1000 em solução de bloqueamento (ETFDH, ab91508; ealpha beta Cristalina, ab13497; anti-ATPB, ab14730; anti-NDUFV2 do Complexo I, ab87980 ou anti-GAPDH, ab9485 da Abcam) durante 2 horas à temperatura ambiente. Após 3 lavagens de 10 minutos com TBS-T, a membrana foi incubada com anticorpo secundário anti-rabbit ou anti-mouseacoplado com HRP (horseradish peroxidase) (Amersham Pharmacia Biotech) diluído 1:1000 numa solução de 5% leite magro e pó em TBS-T, durante 1 hora à temperatura ambiente. Após novas lavagens com TBS-T, 3 vezes 10 minutos, as membranas foram tratadas com reagentes de quimioluminescência (reagentes ECL), de acordo com as instruções do fabricante, e expostas a um filme de Raio X (Kodak Biomax Light Film, Sigma). Depois de revelado, o filme foi digitalizado no Molecular Imager Gel Doc XR+ System (BioRad) e analisado com o software QuantityOne versão 4.6.3 (BioRad). A quantidade de proteína aplicada nas membranas foi controlada por marcação da membrana com Ponceau S.
5.5. Análise do proteoma mitocondrial por LC-MS/MS com quantificação por iTRAQs.
A um dado volume de amostra contendo 100g de proteína adicionou-se um dado volume de RapidGest para uma concentração final de 0,1%. Após sonicação das amostras durante 30 segundos, adicionou-se TCEP para uma concentração final de 5mM e incubou-se durante 60 minutos a 60ºC com agitação. De seguida, adicionou-se um dado volume de MMTS em 2-propanil para uma concentração final de 10mM de e incubou-se à temperatura ambiente durante 10 minutos com agitação. Por último, incubou-se com tripsina (10mg/µl) durante 20h a 37 ºC com agitação (300rpm). As amostras foram secas na SpeedVac Plus SC 210 A (Thermo Savant, USA) e foram posteriormente marcadas com iTRAQ (8-plex), segundo as indicações do
em 50µl de etanol 70%/TEAB 0,5M. De seguida, adicionaram-se os marcadores com a seguinte associação às amostras analisadas: 121 (T), 117 (TN), 119 (G), 118 (GM), e incubou-se durante 2h à temperatura ambiente. A reação foi interrompida por adição de água e as amostras já marcadas foram misturadas e secas na SpeedVac Plus SC 210 A (Thermo Savant, USA).
Os digestos das amostras foram separados por HPLC (Alliance Waters 2690, Waters, Milford, MA, USA) de acordo com o método descrito por Vitorino et al. (2009). Para tal, foi injetado um volume de digesto equivalente a 20 g de proteína no HPLC, numa coluna C18 (5 mm de diâmetro interno e 5 µm de tamanho de partícula, da Dionex) ligada a uma coluna RP PepMap100 C18 (150 mm x 0.075 µm I.D., 3 µm de tamanho de partícula). Os solventes utilizados na separação dos péptidos foram A (2% ACN 0.1% TFA) e B (água e 95% ACN, 0.045% TFA). O gradiente foi realizado de A para B em 50 minutos. Foram coletadas frações de péptidos eluídos da coluna com um coletor automático Probot (LcPackings), em frações de 12 segundos, com adição de 270nL de matriz do ácido-ciano-4-hidroxicinâmico (6mg/mL de matriz-ciano-4-hidroxicinâmico preparada em 70% ACN e 0.3% de TFA suplementada, com 0.4L de uma solução (15fmol) glu-fib).
Os espectros foram adquiridos num MALDI-TOF/TOF (4800 Applied Biosystems) sendo selecionados os 10 picos mais abundantes de cada fracção para MS/MS. Os espectros obtidos foram processados e analisados utilizando o software ProteinPilot (v4.0 AB Sciex, EUA), que utiliza o algoritmo paragon para a identificação da proteína na base de dados da SwissProt. O valor de cut-off para a aceitação da identificação de proteínas no ProteinPilot ® foi um
ProteoScorede 1,3 (95% de confiança).
5.6. Análise estatística
A média e o desvio padrão foram calculados para todas as variáveis de cada um dos parâmetros em análise. Para testar as diferenças de expressão de proteínas (western blotting) entre os diferentes tecidos efetuou-se uma análise de variância multifatorial one-way ANOVA seguida da aplicação do teste Dunnett´s de comparação com um controlo (TN) e ainda múltipla comparação através do teste de Tukey´s. O cálculo dos dados foi efetuado com o software GraphPad Prism versão 5.0. O nível de significância estabelecido foi de 5%.
6. Resultados
6.1. Análise do teor relativo de mitocôndrias nos tecidos
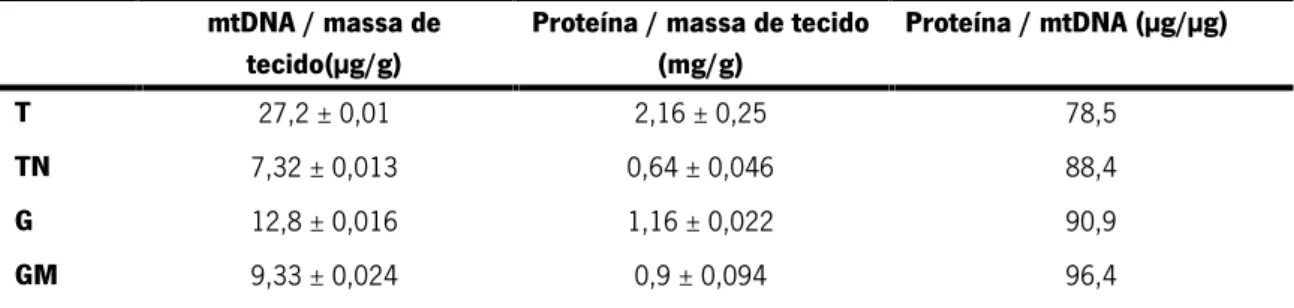
No sentido de avaliar as alterações do proteoma mitocondrial associadas ao cancro da cabeça-pescoço procedeu-se ao estudo de um paciente com um tumor T3N3 na língua. Primeiro procedeu-se à análise do teor mitocondrial e para o efeito determinou-se a concentração de proteína total e de DNA nas frações mitocondriais e relacionou-se estes parâmetros entre si e com a massa total de tecido tumoral (T), não tumoral (TN), gânglios (G) e gânglios metastizados (GM) (tabela 1).
Tabela 1: Avaliação do teor mitocondrial nos diferentes tecidos a partir da concentração de proteína mitocondrial,
de mtDNA e da massa de tecido obtidos (análises efetuadas em triplicado).
mtDNA / massa de tecido(µg/g)
Proteína / massa de tecido (mg/g) Proteína / mtDNA (µg/µg) T TN G GM 27,2 ± 0,01 7,32 ± 0,013 12,8 ± 0,016 9,33 ± 0,024 2,16 ± 0,25 0,64 ± 0,046 1,16 ± 0,022 0,9 ± 0,094 78,5 88,4 90,9 96,4
A razão mtDNA/massa de tecido constitui um indicador grosseiro do número de mitocôndrias no tecido. Pela análise da tabela 1 verifica-se que o tecido tumoral (T) possui um número maior de mitocôndrias relativamente ao tecido normal (TN). Contrariamente, o teor mitocondrial dos gânglios metastizados é menor do que o dos gânglios (G). Relativamente ao rácio quantidade de proteína mitocondrial/massa de tecido, observa-se uma tendência semelhante o que corrobora os dados anteriores. O teor de proteína mitocondrial por mitocôndria sugere uma alteração da densidade proteica mitocondrial, maior em GM.
6.2. Caracterização das alterações do perfil proteico mitocondrial associadas ao cancro da cabeça-pescoço
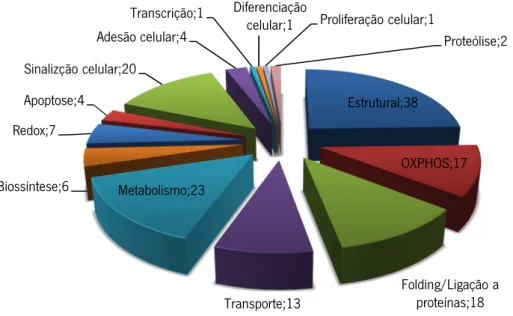
Estrutural;38 OXPHOS;17 Folding/Ligação a proteínas;18 Transporte;13 Metabolismo;23 Biossíntese;6 Redox;7 Apoptose;4 Sinalizção celular;20 Adesão celular;4 Transcrição;1 Diferenciação
celular;1 Proliferação celular;1
Proteólise;2
funcionais de acordo com o GOA (Gene Ontology Annotation): estrutural (38 proteínas), transporte (13 proteínas), redox (7 proteínas), adesão celular (4 proteínas), proliferação celular (1 proteína), fosforilação oxidativa (OXPHOS; 17 proteínas), metabolismo (23 proteínas), apoptose (4 proteínas), transcrição (1 proteína), proteólise (2 proteínas), folding/ligação a proteínas (18 proteínas), biossíntese (6 proteínas), sinalização celular (20 proteínas) e diferenciação (1 proteína) (figura 6).
Figura 6: Distribuição por classes funcionais das proteínas identificadas nos tecidos do Paciente analisado neste
estudo, segundo a base de dadosGene Ontology Annotation(GOA).
Como se pode constatar da análise da figura 6 a maior parte das proteínas identificadas são estruturais (24%), seguidas das proteínas associadas ao metabolismo (15%), sinalização celular (13%), e folding/ligação a proteínas (12%), sendo evidente um elevado número de proteínas relacionadas com a OXPHOS (11%), associadas à produção de ATP. Relativamente às proteínas metabólicas verifica-se uma prevalência de proteínas envolvidas na glicólise. É de salientar a identificação de algumas proteínas anteriormente associadas a tumores de cabeça e pescoço (tabela A1 em anexo), tais como endoplasmina, anexina A1, piruvate cinase isozymes M1/M2,Heat shock protein beta-1e proteínaWilms tumor protein 1-interacting protein.
6.2.2. Análise da fração mitocondrial com quantificação por iTRAQs As frações mitocondriais dos diferentes tecidos recolhidos do Paciente em análise foram posteriormente sujeitas a um estudo comparativo por LC-MS/MS com quantificação por iTRAQs.
Esta análise permitiu a identificação de 12 proteínas diferentemente expressas entre pelo menos dois dos tecidos em estudo e com diferenças superiores a 1,3 ou inferiores a -1,3 entre si. Como se pode constatar pela análise da tabela 2, estas proteínas pertencem às classes funcionais metabolismo, OXPHOS, transporte ou folding/ligação a proteínas. No entanto, mais de 50% são proteínas metabólicas, e cerca de 29% pertencentes ao sistema OXPHOS, sugerindo alterações da funcionalidade mitocondrial.
Tabela 2: Análise comparativa das proteínas mitocondriais diferentemente expressas entre tecido não tumoral
(TN), tumoral (T), gânglio normal (G) e gânglio metastizado (GM), utilizando iTRAQS (análises efetuadas em duplicado).
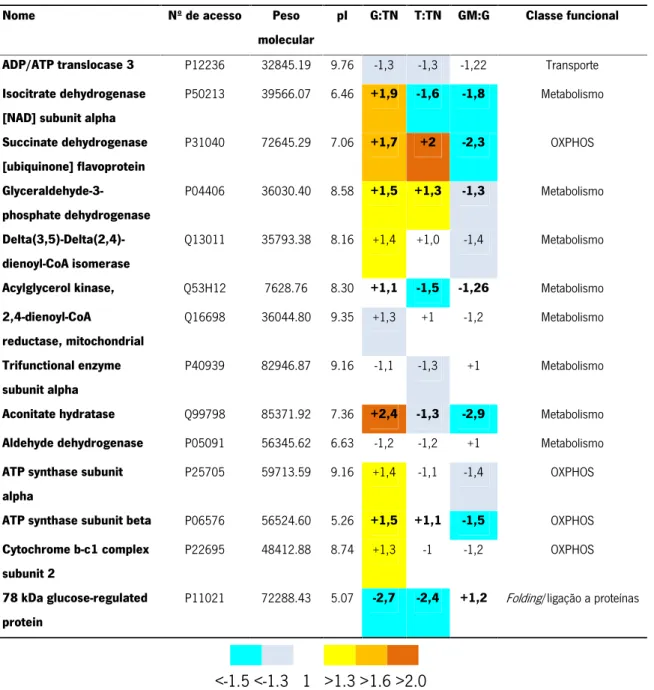
Nome Nº de acesso Peso
molecular
pI G:TN T:TN GM:G Classe funcional
ADP/ATP translocase 3 P12236 32845.19 9.76 -1,3 -1,3 -1,22 Transporte
Isocitrate dehydrogenase [NAD] subunit alpha
P50213 39566.07 6.46 +1,9 -1,6 -1,8 Metabolismo Succinate dehydrogenase [ubiquinone] flavoprotein P31040 72645.29 7.06 +1,7 +2 -2,3 OXPHOS Glyceraldehyde-3-phosphate dehydrogenase P04406 36030.40 8.58 +1,5 +1,3 -1,3 Metabolismo Delta(3,5)-Delta(2,4)-dienoyl-CoA isomerase Q13011 35793.38 8.16 +1,4 +1,0 -1,4 Metabolismo
Acylglycerol kinase, Q53H12 7628.76 8.30 +1,1 -1,5 -1,26 Metabolismo
2,4-dienoyl-CoA reductase, mitochondrial Q16698 36044.80 9.35 +1,3 +1 -1,2 Metabolismo Trifunctional enzyme subunit alpha P40939 82946.87 9.16 -1,1 -1,3 +1 Metabolismo
Aconitate hydratase Q99798 85371.92 7.36 +2,4 -1,3 -2,9 Metabolismo
Aldehyde dehydrogenase P05091 56345.62 6.63 -1,2 -1,2 +1 Metabolismo
ATP synthase subunit alpha
P25705 59713.59 9.16 +1,4 -1,1 -1,4 OXPHOS
ATP synthase subunit beta P06576 56524.60 5.26 +1,5 +1,1 -1,5 OXPHOS
Cytochrome b-c1 complex subunit 2
P22695 48412.88 8.74 +1,3 -1 -1,2 OXPHOS
78 kDa glucose-regulated protein
P11021 72288.43 5.07 -2,7 -2,4 +1,2 Folding/ligação a proteínas
Relativamente às proteínas metabólicas, verificou-se que existem diferenças de expressão no tecido tumoral (T) e no gânglio metastizado (GM) quando comparados com tecido não tumoral e gânglio não metastizado, respetivamente. Contudo é possível inferir que ambos apresentam a mesma tendência. Os resultados mostram que as proteínas do ciclo de Krebs isocitrato desidrogenase subunidade alfa e aconitase se encontram sub-expressas no tumor e no gânglio mestastizado relativamente ao tecido não tumoral adjacente. A GAPDH evidência tendências opostas nestes 2 tecidos embora a presença desta enzima na mitocôndria esteja associada à indução de apoptose (Tarze et al. 2007). Quanto às proteínas da fosforilação oxidativa destaca-se a sucinato desidrogenase que se encontra aumentada no tecido tumoral comparativamente ao tecido não tumoral adjacente mas que no gânglio metastizado se encontra em níveis aproximadamente 2 vezes menores relativamente ao gânglio adjacente normal. Relativamente às duas subunidades da ATP sintase, não se observaram diferenças entre o tecido tumoral e o tecido não tumoral mas verificaram-se níveis mais baixos destas proteínas no gânglio metastizado relativamente ao gânglio normal. Uma tendência semelhante foi observada para a subunidade 2 no complexo III da OXPHOS. No global, os resultados parecem apontar para uma diminuição do sistema OXPHOS mais acentuada no gânglio metastizado relativamente ao tecido adjacente normal do que no tecido tumoral.
Relativamente à 78 kDa glucose-regulated protein, uma proteína envolvida no
folding/ligação a proteínas, os resultados evidenciaram uma diminuição acentuada dos níveis desta proteína no tecido tumoral relativamente ao tecido não tumoral adjacente.
Com exceção das subunidades identificadas da sucinato desidrogenase e da isocitrato desidrogenase, não se observaram diferenças de expressão das proteínas identificadas entre GM e T, o que sugere uma adaptação do perfil proteico das mitocôndrias destes tecidos no mesmo sentido.
6.3. Análise por Western blotting de proteínas mitocondriais
No sentido de confirmar as diferenças de expressão observadas anteriormente e de complementar os resultados obtidos por LC-MS/MS determinou-se o teor de proteínas específicas na fração mitocondrial (figura 7) e fração citoplasmática (figura 8) dos vários tecidos do Paciente em análise por Western blotting.
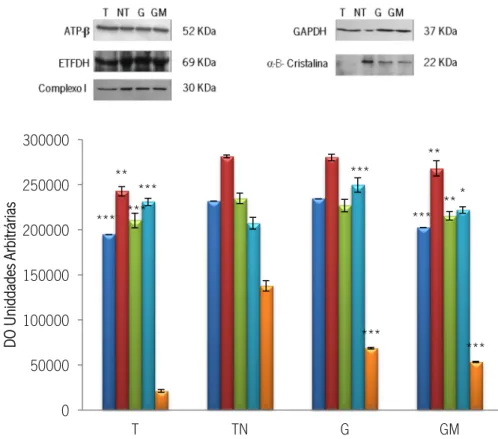
0 50000 100000 150000 200000 250000 300000 T TN G GM DO U nid da de s Ar bit rá ria s
Figura 7: Análise da expressão de ATP sintase- subunidadeβ (azul), ETFDH (vermelho) e subunidade NDUFV2 do Complexo I (verde), GAPDH (Azul Claro) e α-B-Cristalina (Laranja) na fração mitocondrial do tecido tumoral (T), normal (TN), gânglio normal (G) e metastizado (GM). Os resultados são expressos como média ± desvio padrão da densidade ótica (DO) expressa em unidades arbitrárias (análises efetuadas em triplicado). Acima dos gráficos são apresentadas imagens representativas de Western blotting para cada proteína analisada.
*p<0,5; **p<0,01 e ***p<0,005 vs TN; *p<0,5; **p<0,01 e ***p<0,005 G vs GM.
Verificou-se assim que a expressão da subunidade β da ATP sintase no tecido tumoral (T) e gânglio metastizado (GM) se encontra substancialmente diminuída comparativamente com o tecido não tumoral (TN) e gânglio normal (G). As diferenças são significativas em particular para o tecido tumoral vs. não tumoral. Estes dados enfatizam o défice do sistema OXPHOS nos tecidos neoplásicos, à semelhança do verificado na quantificação com iTRAQs para o tecido ganglionar metastizado (GM:G).
Relativamente à expressão das proteínas ETFDH e subunidade NDUFV2 do Complexo I verificou-se uma diminuição significativa no tecido tumoral e gânglio metastizado.
Pela análise da figura 7 é ainda possível verificar a presença da GAPDH na fracção mitocondrial, onde é geralmente associada à apoptose, como referido anteriormente (Tarze et
*** *** ******* *** *** * *** *** *** ** ** ** *** *** ***
relativamente ao não tumoral. Contudo quando comparamos o gânglio metastizado com o gânglio não metastizado verifica-se uma diminuição significativa da GAPDH no primeiro tecido.
Pode ainda constatar-se que a expressão de α-B-Cristalina é muito reduzida no tecido tumoral e bastante diminuídos no gânglio metastizado.
A expressão de GAPDH foi ainda avaliada na fração citoplasmática (Figura 8) tendo-se verificado, à semelhança do constatado na fracção mitocondrial, um aumento significativo da expressão desta proteína no tecido tumoral. Em relação ao gânglio metastizado observaram-se valores inferiores quando comparado com o gânglio não mestastizado.
Figura 8: Análise da expressão de GAPDH na fração citoplasmática obtido do tecido tumoral (T), tecido normal
(TN), gânglio (G) e gânglio metastizado (GM) comparativamente com o controlo (TN). Os resultados são apresentados como média ± desvio padrão de densidade óptica (DO) expressa em unidades arbitrárias (análises efetuadas em triplicado). Ao lado do gráfico encontra-se a imagem representativa do Western blotting para a proteína analisada. ***p˂0,05 TN vs T, G, GM; **p˂0,05 T vs GM e G vs GM. *** *** *** *** ***
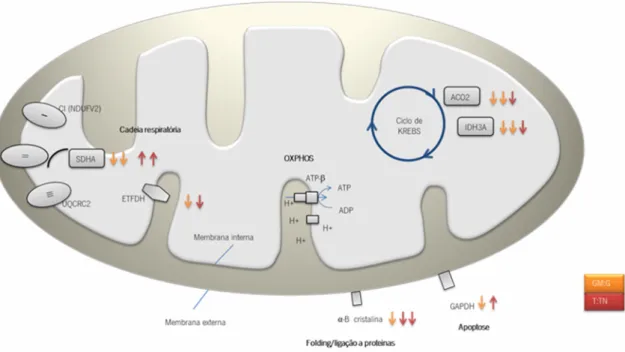
De forma a contextualizar as proteínas identificadas/avaliadas no presente estudo, a seguir é apresentado uma figura onde essas proteínas são localizadas na mitocôndria, de modo a facilitar a compreensão dos resultados obtidos.
Figura 9: Esquema representativo das proteínas cujos níveis se encontraram alterados no tecido tumoral e/ou
gânglio mestastizado, comparativamente aos tecidos normais adjacentes, de um doente com cancro da cabeça-pescoço.
7. Discussão
Em Portugal, as neoplasias constituem o segundo grupo de doenças com maior incidência, tendo sido responsável por cerca 30000 óbitos em 2010, apenas superado pelas doenças cardiovasculares (WHOGIB 2010). De entre todas as localizações, os tumores de cabeça e pescoço são o sexto tipo de neoplasias mais comum, com cerca de 6% de novos casos por ano (WHO 2011; IPO 2010). Apesar dos avanços verificados nos últimos anos ao nível do diagnóstico e tratamento do cancro de cabeça pescoço, este continua a ter uma taxa de mortalidade bastante elevada. Estima-se que cerca de 6 em cada 10 destes doentes morram nos 5 anos após a data do seu diagnóstico (Bettendorf et al. 2004; Neville e Day 2002). Esta elevada mortalidade parece estar relacionada com o facto de grande parte dos casos não serem diagnosticados atempadamente (Bànkfalvi e Piffkò 2000) e ocorrer metastização do tumor primário (Leemans et al. 1993, 1994). Atendendo à elevada mortalidade e morbilidade associada aos tumores da cabeça e pescoço e aos elevados custos inerentes aos tratamentos, torna-se fundamental a prevenção de comportamentos de risco e a deteção dos tumores em fases iniciais. É assim necessária uma melhor compreensão das vias celulares e moleculares que estão subjacentes a tipo de neoplasias com vista ao desenvolvimento de terapias e meios de diagnósticos mais eficazes.
Nos últimos anos, as alterações do metabolismo observadas nas células tumorais têm constituído o foco de vários trabalhos de investigação (de Berardiniset al.2008; Semenza et al.
2001). Neste contexto, a mitocôndria parece assumir um papel fundamental (Gogvadze et al.
2008). Embora esteja estabelecido que existem diferenças funcionais ao nível das mitocôndrias dos tecidos tumorais, o conhecimento da plasticidade do proteoma mitocondrial é bastante limitado. Na maioria dos estudos que visam a caracterização proteómica da mitocôndria são utilizadas abordagens baseadas na espectrometria de massa, como o LC-MS/MS. A aplicação de iTRAQs para a identificação de proteínas diferentemente expressas em tecidos tumorais é relativamente recente tendo já sido descritos resultados promissores da sua utilização para a identificação de potenciais biomarcadores (Ralhanet al.2008). No nosso estudo utilizou-se LC-MS/MS com iTRAQs para a identificação das proteínas diferentemente expressas em mitocôndrias isoladas de diferentes tecidos de um Paciente com um tumor T3N3 do bordo da
No presente estudo começou-se por avaliar o teor de mitocôndrias nos diferentes tecidos analisados. De acordo com a literatura, as mitocôndrias possuem em média 2-10 cópias de mtDNA (Wiesneret al. 1992; Hazkani-Covoet al. 2010), que é constantemente renovado de uma forma independente do ciclo celular. Assim, assumindo que o número de cópias de mtDNA/mitocôndria se mantém aproximadamente constante, o teor de mtDNA normalizado à massa de tecido poderá dar uma indicação, embora que grosseira, do número de mitocôndrias no tecido. Os resultados obtidos sugerem um aumento significativo do número de mitocôndrias no tecido tumoral (cerca de 4 vezes) e no gânglio metastizado (Tabela 1). Em estudos anteriores foi observado um aumento da síntese de proteínas mitocondriais associada a tumores (Macheda
et al. 2005; Chatterjee et al. 2006; Wang et al. 2011) bem como alterações morfológicas tais como um aumento do tamanho do organelo, alterações ao nível da membrana, das cristas e da densidade mitocondrial (Loet al. 1968; Pederson 1978; Kiebischet al. 2008).
Para além do aumento da densidade mitocondrial no tecido tumoral e gânglio metastizado, a análise do proteoma mitocondrial efetuada por LC-MS/MS evidenciou alterações da expressão de proteínas mitocondriais, particularmente de vias como OXPHOS, estruturais, metabólicas, sinalização celular e folding/ligação. Dentro destas classes salientam-se as proteínas Grp78,Heat shock protein beta-1,endoplasmina, anexinaA1,piruvato cinaseisozymes M1/M2, proteínaWilms tumor protein 1-interacting proteine calreticulina, descritas na literatura como estando envolvidas nos mecanismos de carcinogénese de alguns tipos cancros, nomeadamente da cabeça e pescoço (Pedrero et al. 2004; Ciocca e Calderwood 2005; Nakatsukaet al. 2006; Roesch-Elyet al. 2007, Christofket al. 2008; Zhuet al. 2010; Chiuet al. 2011; Szantoet al. 2012).
Mais de 50% das proteínas identificadas como diferentemente expressas são proteínas metabólicas, e cerca de 29% pertencentes ao sistema OXPHOS. De entre as proteínas metabólicas é de salientar as proteínas do ciclo de Krebs aconitase e isocitrato desidrogenase, que se encontram sub-expressas no tumor e no gânglio mestastizado relativamente ao tecido não tumoral adjacente. Estes dados parecem estar de acordo com o aumento da expressão de proteínas relacionadas com a hipoxia característica de neoplasias (McCammonet al.2003; Xuet al. 2005; Frezza et al. 2011). A par da diminuição da expressão destas enzimas do ciclo de Krebs, neste estudo observou-se um aumento da expressão de GAPDH citoplasmática no tecido tumoral (figura 8), enfatizando o papel da glicólise no metabolismo das células tumorais. No entanto, o aumento da atividade glicolítica em células cancerosas pode não estar associado ao
comprometimento das mitocôndrias mas pode dever-se a alterações do microambiente do tumor que induz a adaptação dos processos metabólicos, incluindo um aumento da expressão de enzimas glicolíticas (Mathupalaet al. 2001; Locasale e Cantley 2010). De facto, vários autores defendem não só uma adaptação das células aos microambientes mas também uma mudança no próprio ambiente por parte dessas mesmas células (Berridgeet al. 2010). Sabe-se no entanto que a glicólise, o ciclo de Krebs e cadeia respiratória funcionam como um sistema acoplado. O ciclo Krebs é essencialmente regulado pela disponibilidade de substratos, e inibido pela acumulação de outros intermediários do ciclo. Uma alteração na cadeia respiratória pode levar à acumulação de NADH e outros reguladores críticos do ciclo de Krebs, como o oxaloacetato, succinil CoA e citrato (Frezzaet al.2010). Os danos causados na cadeia respiratória vão reduzir a conversão do piruvato a acetil CoA levando também à redução da atividade do ciclo de Krebs (McCammon et al.2003; Gogvadze et al. 2008; Frezza e Gottlieb 2009; Kaelin 2011). Mesmo na presença de oxigénio a glicólise torna-se a via preferencial para as células cancerosas de forma a obterem energia suficiente para funções celulares. Neste estudo também se observou o aumento da expressão de sucinato desidrogenase no tecido tumoral comparativamente ao tecido não tumoral adjacente, tendo-se verificado uma tendência oposta no gânglio metastizado relativamente ao gânglio adjacente normal. A associação desta flavoproteína ao cancro nem sempre foi clara (Schiavi et al. 2005; King et al. 2006). Alguns autores observaram que esta flavoproteína é dotada de múltiplas atividades que mudam em resposta ao microambiente tumoral (Tomitsukaet al. 2009), o que poderá justificar, pelo menos parcialmente, as diferenças de expressão entre os dois tecidos neoplásicos. As funções desta enzima no ciclo de Krebs resultam na redução de equivalentes da cadeia respiratória. A perda da sua atividade leva à acumulação de sucinato, que pode desencadear o estado de hipoxia (Kaelin 2005, 2011). A acumulação de succinato ou fumarato pode induzir a passagem destes para o citosol e inibir assim a atividade de HIF-1a prolilhidroxilases. Os tumores com expressão diminuída de sucinato desidrogenase apresentam elevados níveis de vascularização e um aumento substancial de HIF-α, com um impacto significativo na bioenergética celular (Gottlieb e Tomlinson 2005; Pollard et al. 2005 a, b). Alterações do ciclo de Krebs, parecem estar associadas a um comprometimento da OXPHOS com diminuição da respiração aeróbica, o que segundo a literatura é mais vantajosa para as células neoplásicas. Efetivamente, verificou-se uma diminuição da expressão de ETFDH e da subunidade NDUFV2 do Complexo I nos tecidos neoplásicos comparativamente com os