Genotipagem de amostras de
Trypanosoma cruzi
isoladas de pacientes
chagásicos de dois municípios da região do Vale do Jequitinhonha, MG,
Brasil.
UNIVERSIDADE FEDERAL DE OURO PRETO - UFOP NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS – NUPEB PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Genotipagem de amostras de
Trypanosoma cruzi
isoladas de pacientes
chagásicos de dois municípios da região do Vale do Jequitinhonha, MG,
Brasil.
Autor: Maykon Tavares de Oliveira Orientadora: Profa. Dra. Marta de Lana
Co-Orientadora: Profª. Drª. Helen Rodrigues Martins
Ouro Preto, MG. 2012
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Biológicas do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como requisito parcial para a obtenção do título de Mestre; área de concentração:
Imunobiologia
"O que chamamos de inspiração é a capacidade de reter e ampliar, com um toque próprio e único, um flash ou insight, uma coisinha de nada que atravessa o nosso pensamento e pode fugir. Porém, boa parte dessa inspiração é fruto da nossa capacidade de concentração, de disciplina, de esforço mental e até de teimosia. Precisamos não de um dia bonito de céu azul, mas de uma boa dose de paciência para produzir alguma coisa interessante, para organizar raciocínios, transformar barro em tijolos e tijolos em casas."
Dedicatória:
Agradeço imensamente a Deus, fonte de luz, força e sabedoria.
À Professora Marta de Lana pela oportunidade, orientação e por ter me concedido esse projeto, acreditando em minha capacidade. Obrigado pelos ensinamentos transmitidos, só tenho a agradecer pela força e pelas demonstrações de carinho!!!
À professora Helen Rodrigues Martins, por ter me ensinado os primeiros passos na trajetória da Ciência. Agradeço muito pelo apoio durante toda a realização desse projeto.
Às grandes amigas, Jaquelline e Lílian, a amizade de vocês foi fundamental. Jack obrigado pelo apoio, incentivo e pelas brincadeiras... Tenho certeza que não foi por acaso que o destino fez que nos conhecêssemos, e mesmo que a distância nos separe, nossa amizade vai perdurar pela eternidade!!!
Ao Aufy pelo empenho e força de vontade em isolar os parasitos de seus pacientes para analisarmos. Certamente sem seu trabalho, esse projeto não teria existido...
A todos os amigos do laboratório de Doença de Chagas, em especial ao Vitor, Arnaldo, Glaucia, Renata, Mari, Feijuada, Rodrigão, Lívia e a todos que convivi e que não estão mais em Ouro Preto, obrigado pela ótima convivência durante todos esses anos!
À professora Vanja Veloso pelo apoio incondicional durante a realização da técnica de RAPD e pela carinhosa amizade.
Ao professor Evandro pela boa convivência, pelas brincadeiras, idéias, e pelo esclarecimento das inúmeras dúvidas durante esses anos.
À professora Maria Terezinha Bahia e ao Professor André Talvani pelos ensinamentos e bons momentos de descontração.
À toda turma de mestrado do NUPEB de 2010, em especial a Maíra, Magna, Vívian, Tassiane, Gabi, Kelvinson e Guilherme, vocês tornaram as disciplinas do mestrado muito mais agradáveis!!!
À Dani, Lud e Aninha pelo auxílio técnico e pela grande amizade.
A todos os professores do NUPEB.
Aos pacientes de Berilo e José Gonçalves de Minas, Vale do Jequitinhonha, MG. O maior valor do nosso trabalho não são as publicações, e sim a possibilidade de tentar associações que talvez levem alguma melhoria a vocês.
À Cida e Mateus, secretários do NUPEB.
Ao CNPQ e FAPEMIG pela concessão de todo financiamento do projeto.
Á Prefeitura Municipal de Berilo pela parceria no Projeto de Doença de Chagas no Vale do Jequitinhonha.
Aos meus irmãos de república pela descontração, força e principalmente por entenderem o quão estressante e corrido é a jornada de um mestrado. Saibam que aproveitei cada minuto ao lado de vocês, aprendi muito com cada um e confesso que sinto e sentirei muita falta dos moradores que dividiram parte da suas vidas conosco, e que já não se encontram aqui. Quero sempre reencontrar todos para lembrarmos os bons momentos que passamos juntos... Meu sincero agradecimento a todos da REPÚBLICA SETE PRAGAS!!!
A espécie do Trypanosoma cruzi possui uma estrutura genética que permite a subdivisão intraespecífica em seis grupos genéticos distintos, denominados TcI, TcII, TcIII, TcIV, TcV e TcVI (Zingales et al., 2009) que tem apresentado diferenças frente a distribuição geográfica, propriedades biológicas e susceptibilidade a droga. É
conhecido o predomínio das DTU’s TcII e TcVI em diversas regiões Brasileiras,
associados tanto ao ciclo doméstico como ao silvestre da Doença e Chagas, e estando intimamente relacionados com as manifestações clínicas graves em pacientes
chagásicos crônicos. Conhecendo o predomínio dessas DTU’s no estado de Minas
Lista de Tabelas:
Tabela I: Resumo da revisão bibliográfica da variabilidade genética do Trypanosoma cruzi.
Tabela II: Informações das amostras de Trypanosoma cruzi e dos pacientes dos quais foram isoladas.
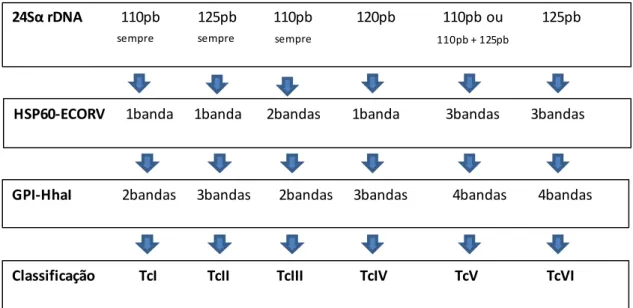
Tabela III: Critérios de classificação dos isolados de Trypanosoma cruzi nas DTU(s) TcI ao TcVI, segundo Lewis et al. (2009) e D’ávilla et al. (2009).
Tabela IV: Primers utilizados na caracterização dos isolados de Trypanosoma cruzi, por RAPD (Brisse et al., 2000b).
Lista de figuras:
Figura I: Mapa do estado de Minas Gerais localizando a região do Vale do Jequitinhonha e mostrando algumas informações dos municípios de Berilo e José Gonçalves de Minas.
Figura 2: Tripé de classificação dos isolados de Trypanosoma cruzi em seus respectivos DTU(s) proposto por Lewis et al. (2009).
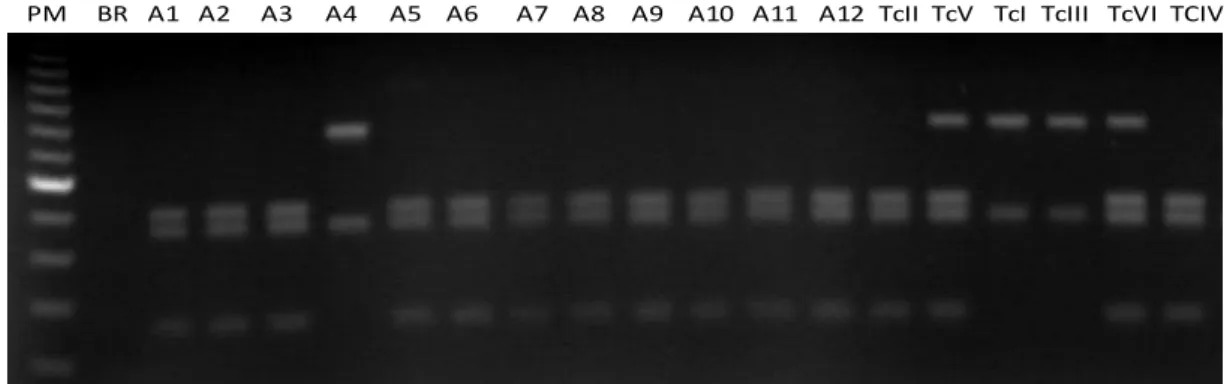
Figura 3: Perfis de DNA obtidos pela genotipagem de isolados de Trypanosoma cruzi provenientes de pacientes da região do Vale do Jequitinhonha, MG obtidos pela amplificação da região 3´do gene 24Sα rDNA.
PM – Peso molecular de 100pb, Br – controle negativo da reação, TcI – clone representativo de TcI (P209 cl1, com perfil 110pb), TcII – clone representativo do grupo TcII (MAS cl1, 125pb), TcIV clone representante do grupo TcIV (CANIII, XXpb??), TcIII- clone representativo da linhagem TcIII ( CM-17, 110pb), TcVI – clone representativo do grupo híbrido TcVI (Tulahuen, 125 pb) e TcV – clone representativo do grupo TcV (Bug2148, 110pb + 125pb). A1 – isolado 229, A2- isolado 452, A3-isolado 748, A4 – isolado 798, A5- 1205, A6 – 1918, A7- 2535, A8- 2491, A9 264; A10- 376; A11- 646 e A12 amostra 2118.
Figura 4: Perfis de DNA obtidos pela genotipagem de isolados de Trypanosoma cruzi provenientes de pacientes chagásicos da região do Vale do Jequitinhonha, MG, por meio da análise do polirmorfismo do gene HSP60 submetidos a RFLP-PCR.
PM – Peso molecular de 100pb, A1- amostra 1918, A2- amostra PSF060, A3- amostra 438, A4- amostra 543, A5- amostra 229, A6-amostra 2119. Br – controle negativo da reação de PCR; TcI a TcVI amostras do perfil de corte dos clones de referência dos 6 grupos de T. cruzi ( TcI – P209 cl1, 1 banda de 432 a 462pb; TcII – MAS cl1 1 banda de 432 a 462pb; TcIII CM-17, perfil de bandas duplas; TcIV CAN III cl1, banda única; TcV Bug2148, bandas triplas; TcVI Tulahuen cl2, bandas triplas).
Figura 5: Perfis de DNA obtidos pela genotipagem de isolados de Trypanosoma cruzi provenientes de pacientes da região do Vale do Jequitinhonha, Minas Gerais, por meio da análise do polirmorfismo do gene GPI/HhaI via RFLP-PCR.
Figura 6: Perfis de DNA obtidos pela genotipagem de isolados de Trypanosoma cruzi provenientes de pacientes da região do Vale do Jequitinhonha, MG, por meio da análise do polirmorfismo do gene da subunidade II da Citocromo Oxidase (COII).
PM – padrão de peso molecular de 1kb, C1-perfil de bandas o clone Cutia cl1 (haplótipo mitocondrial A - DTU TcI, Freitas et al., 2006), C2- clone Tu18 cl2 (haplótipo C – DTU TcII), C3 - M6241 cl6 e C4 - Tulahuen cl2 (haplótipo mitocondrial B - DTU TcIII e DTU TcVI), A1 - amostra 2119, A2- amostra 1205, A3- amostra 376, A4- amostra 2118, A5- amostra 2408, A6 - amostra Be56, A7- amostra 1337, A8- amostra 1918, A9- amostra 229, A10- amostra 748, A11- amostra 501, A12- amostra 2497 e A13- isolado 818, A14 – clone representativo do haplogrupo B (9212210R – TcIV), BR – controle negativo livre de DNA. Entre os isolados nota-se somente a presença dos haplótipos B e C.
Figura 7: Perfis de DNA obtidos pela genotipagem de isolados de Trypanosoma cruzi provenientes de pacientes da região do Vale do Jequitinhonha, MG, por meio da análise do polirmorfismo do espaçador intergênico do miniexon.
PM – padrão de peso molecular de 1KB; C1 - clone Cutia cl1(DTU TcI), C2 clone Tu18cl1 (DTU TcII), C3 e C4 clones X109/2 (DTU TcIII) e 9212210R2 (DTU TcIV), C5 e C6 clones SO3cl5 e Tula cl2 representantes das DTU(s) TcV e TcVI respectivamente, A1: amostra 229; A2 - 452; A3 - 748; A4 - 798; A5 - 1205; A6 - 1337; A7 - 2118; A8 - 2119; A9 - 376; A10 - 2497, A11 - 493; A12 - 820; A13 - 1107; A14 - 2478; A15 - 1918; A16 - 2014; Br: controle negativo da reação. O espaçador intergênico do Mini-exon (Freitas et al.,
2006) é capaz de separar as DTU’s TcIII e TcIV, que apresentam perfis de bandas de 200pb, das demais DTU’s TcI, TcII, TcV e TcVI, esses com fragmentos de 150 a 157pb.
Figura 8: Perfis de RAPD em isolados de Trypanosoma cruzi obtidos de pacientes dos municípios de Berilo e José Gonçalvez de Minas, região do Vale do Jequitinhonha, MG, submetidos a amplificação empregando os primers N9 (Gel A) e B15 (Gel B).
PM – padrão de peso molecular de 100pb, C1 a C6 perfis de bandas apresentado pelos
seis clones de referência dos seis DTU’s do Trypanosoma cruzi, onde nos géis A e B, C1 representa os perfis do clone de referência da DTU TcI, P209 cl1; C2: MAS cl1 (TcII), C3: CM-17 (TcIII), C4: CANIII (TcIV), C5: Bug2148 cl1 (TcV), C6: Tulahen cl2 (TcVI), respectivamente.
No gel A, a amostra A1, corresponde ao isolado 953, A2- 820, A3 - 458, A4 - 523, A5- 2014, A6 - 2478, A7 - 467, A8 - 1536, A9 - 818, A10 - 060/05, A11 - 845, A12 - 452, A13- 1315, A14 - 529, A15 - 1918, A16 - 2497 e A17 - 1107 respectivamente.
Figura 9: Fenograma obtido pelo método de UPGMA (Unweighted Pair-Group Method Analysis) de todos os 51 isolados de Trypanosoma cruzi e respectivos clones representativo de cada DTU do parasito, submetidos a analise do polimorfismo genético analisados no programa TREECON, e Bootstrap com repetições de 1000 vezes.
ALAT Alanina aminotransferase
Alu I Enzima de restrição Alu I
ASAT Aspartato aminotransferase
ATP Adenosina Trifosfato
COII Gene mitochondrial Citocromo Oxidase subunidade II
dNTP’s 2’-desoxinucleotídeos-5’-trifosfato
DO Densidade Óptica
DTU Discrete Typing Unity
DTT Dithiothreitol
ECG Eletrocardiograma
ECORV Endonuclease de restrição do tipo II
EDTA Ácido etilenodietildinitritoteracético
FUNASA Fundação Nacional de Saúde
GPI Glicose-6-fosfato isomerase
gRNAs RNAs guias
Hha I Enzima de restrição
HIV Vírus da Imunodeficiência adquirida
HSP60 Heat shock protein 60
IBGE Instituto Brasileiro de Geografia e Estatística
JGM José Gonçalves de Minas
kDNA DNA do cinetoplasto
LIT Liver Infusion Triptose
µg Microgramas
µL Microlitros
mL mililitros
nm nanômetros
OPAS Organização Pan -Americana de Saúde
pb Pares de base
PCR Reação em cadeia da polimerase
PITs Postos de Informação de Triatomíneos
PBS Solução Salina Tamponada
RAPD Randomly Amplified polymorphic DNA
RFLP Restriction Fragment Length Polymorphism
rRNA RNA ribssômico
SFM Sistema fagocitário mononuclear
SL-IR Espaçador intergênico dos genes mini-exon
Tc Trypanosoma cruzi
UPGMA Unweighted Pair-Group Method Analysis
WHO Word Heath Organization
Z Zimodema
24S rDNA Gene ribossômico 24S
1.0 INTRODUÇÃO ... 1
1.1 A Doença de Chagas: aspectos históricos, biológicos, clínicos e epidemiológicos. ... 2
1.2 O Trypanosoma cruzi ... 6
1.2.1 Organização Genômica do T. cruzi ... 7
1.2.2 Variabilidade Biológica do T. cruzi ... 8
1.2.3 Variabilidade Genética do Trypanosoma cruzi ... 9
1.2.4 Estrutura Populacional do Trypanosoma cruzi ... 15
1.2.5 Correlações com propriedades biológicas do parasito, clínicas e eco epidemiológicas da Doença de Chagas ... 17
1.3 A Doença de Chagas em Berilo, Vale do Jequitinhonha, MG. ... 20
3.0 OBJETIVOS ... 25
3.1 Objetivo geral: ... 26
3.2 Objetivos específicos: ... 26
4. MATERIAL E MÉTODOS ... 27
4.1 Caracterização da Área em Estudo ... 29
4.2 Pacientes e Amostras de T.cruzi ... 30
4.2.1 Obtenção das amostras ... 30
4.3 Obtenção do sedimento celular de T. cruzi ... 32
4.4 Extração de DNA ... 32
4.5 Classificação Genética das amostras isoladas dos pacientes ... 33
4.5.1 Amplificação da região 3’ do gene 24sα rDNA - LSU rDNA ... 33
4.5.2 RFLP–PCR (Restriction fragment length polymorphism) dos genes HSP60 (Proteína do choque térmico) e GPI (Glicose 6-Fosfato Isomerase) ... 34
4.5.3 Caracterização pela PCR do gene Mitocondrial Citocromo Oxidase subunidade II (COX II) ... 35
4.5.4 Espaçador intergênico dos genes mini-exon de T. cruzi (SL-IR) ... 36
4.6 Análise para Classificação dos isolados nas respectivas DTU(s)... 37
5.0 RAPD (Random Amplified Polymorfic DNA) ... 39
6.0 RESULTADOS ... 41
6.1 Análises do polimorfismo do domínio divergente do gene D7 do 24Sα rDNA (LSUrDNA) 42 6.2 Análise de polimorfismo do gene da Proteína do choque térmico (HSP60) ... 43
6.3 Análise de polimorfismo do gene da Glicose-6-fosfato isomerase (GPI) ... 44
6.4 Análise de polimorfismo do gene Citocromo Oxidase II ... 44
6.5 Análise do polimorfismo do Espaçador Intergênico dos Genes Mini-exon de T. cruzi (SL-IR) ... 45
6.6 Identificação das DTU(s) do Trypanosoma cruzi segundo o novo consenso taxonômico (Zingales et al., 2009) ... 46
6.7 RAPD (Random Amplified Polymorfic DNA) ... 49
7.0 DISCUSSÃO ... 53
8.0 CONCLUSÕES ... 67
9.0 REFERÊNCIAS BIBLIOGRÁFICAS ... 70
1.1 A Doença de Chagas: aspectos históricos, biológicos, clínicos e epidemiológicos.
A Doença de Chagas ou Tripanossomíase Americana, causada pelo protozoário
flagelado Trypanosoma cruzi, foi descrita em 1909 pelo pesquisador brasileiro Carlos
Ribeiro Justiniano das Chagas, enquanto trabalhava na campanha anti-malárica no
município de de Lassance - MG durante a construção da estrada de ferro Central do
Brasil. Esse brilhante pesquisador não só decifrou o ciclo biológico do parasito
revelando seus hospedeiros vertebrados e invertebrados, mas também a
epidemiologia e parte da patologia da doença.
A área de abragência da doença de Chagas é ampla e se estende desde o
México até a Argentina, representando uma das doenças parasitárias com maior
impacto social e econômico na América Latina. Segundo a Organização Mundial de
Saúde (WHO, 2010), cerca de 10 a 15 milhões de pessoas ainda encontram-se
infectadas pelo T. cruzi nesse continente e, 100 milhões de indivíduos estão em risco
de infecção. Embora o número de casos da doença tenha caído consideravelmente em
toda América Latina, nas últimas décadas, estima-se a ocorrência de 200 mil novos
casos agudos da doença por ano em toda América latina (WHO 2010). O número de
países endêmicos para a doença reduziu drasticamente de 1986 a 2006 e um dos
grandes responsáveis por tal redução foi a eliminação do principal vetor doméstico do
parasito, o Triatoma infestans (WHO, 2007).
A transmissão do T. cruzi está amplamente relacionada com a presença do
inseto vetor, um hemíptero hematófago pertencente à subfamília Triatominae. Esse
protozoário era exclusivo e restrito ao ambiente silvestre, circulando entre mamíferos
reservatórios naturais e insetos vetores, mas com o processo de invasão e modificação
ambiental promovida pelo homem, ele se aproximou das habitações humanas
estabelecendo um novo ciclo de transmissão, com a colonização de ecótopos artificiais
(Chagas, 1909; Dias, 1992; Dias, 2000).
A principal via de transmissão do T. cruzi ao hospedeiro vertebrado é a vetorial.
No intestino médio do triatomíneo, as formas epimastigotas do parasito mutiplicam-se
por divisão binária e, na região posterior, diferenciam-se em formas infectantes
homem ocorre durante o repasto sanguíneo pela deposição das fezes e ou urina do
inseto vetor contendo a forma infectante sobre a pele com ferimentos ou sobre a
mucosa (Dias, 1934; Brener, 1972; Brener, 1976).
Nestes locais, o parasito irá penetrar em células do sistema mononuclear
fagocitário (SMF) e, nestas células, transformam-se nas formas amastigotas, que se
dividem intracelularmente por divisão binária e se diferenciam em formas
tripomastigotas sanguíneas que infectam o vetor durante o repasto sanguíneo,
fechando assim o ciclo evolutivo deste parasito. Estas, após vários ciclos de
multiplicação promovem o rompimento celular e, uma vez livres, podem penetrar nas
células adjacentes ou cair na circulação sanguínea e linfática, infectando novas células
de outros órgãos e tecidos (Tanowitz et al., 1992).
Além da via vetorial, o parasito pode ser também transmitido por transfusão
sanguínea (Dias e Brener, 1984) e pela via congênita (Chagas, 1911), consideradas a
segunda e terceira vias em importância epidemiológica. Em muitos países onde a
doença é endêmica, ainda não há controle em larga escala dos bancos de sangue (Dias,
2007). Além disso, com as migrações humanas, a doença de Chagas também se tornou
um problema em localidades onde ela não é endêmica como os EUA, o Japão a Europa
e Austrália, devido ao risco de transfusão com sangue de indivíduos infectados, que
migraram das áreas endêmicas para essas regiões (Garraud et al., 2007; Schmunis,
2007).
O risco de transmissão vertical parece variar de 0,5 a 10% entre as diferentes
regiões geográficas, o que poderia estar relacionado à falha no controle pré-natal e
diferenças biológicas entre as cepas circulantes nestas áreas (Bittencourt, 2000).
Atualmente, a transmissão oral tem se tornado uma grande preocupação para
os programas de controle da Doença de Chagas no Brasil, uma vez que vários casos
foram relatados nos estados de Santa Catarina, SC (Ministério da Saúde, 2005)
Amazônia, AM (Marcili et al., 2009) e Bahia, Ba (Dias et al., 2008).
Após a infecção por qualquer uma dessas vias, o indivíduo desenvolverá a fase
casos (98%) e, ocasionalmente, pode ser caracterizada pela presença de sinais de porta
de entrada como o Chagoma de inoculação e o Sinal de Romanhã, edemas,
linfoadenopatias e febre (Dias et al., 1984). Nos casos mais graves, podem ocorrer
miocardite intensa e envolvimento neurológico, principalmente, em crianças menores
de dois anos de idade (Brener, 1992), grupo em que pode atingir cerca de 10-15% de
mortalidade. Essa fase dura em média de um a quatro meses durante a qual são
observadas altas taxas de parasito no sangue detectado pelo exame de sangue a fresco
e por exames histopatológicos que detectam as formas amastigotas nos tecidos.
Após a fase aguda, a maioria dos indivíduos evolui naturalmente para a fase
crônica da infecção, que pode durar por toda a sua vida (Rassi et al., 2000; Prata, 2001;
Rassi et al., 2010). Esta fase é marcada pela escassez de parasitos no sangue, devido ao
desenvolvimento de uma resposta imune específica capaz de controlar a multiplicação
do parasito. Essa fase é caracterizada por um curso clínico bastante variável. A maioria
dos indivíduos (60-75%) apresenta a forma indeterminada da fase crônica da doença
de Chagas, caracterizada pela ausência de sinais e sintomas clínicos, alterações
radiográficas e eletrocardiográficas. Entretanto, cerca de 10 a 30 anos após a infecção,
30-35% dos infectados desenvolvem as formas clínicas sintomáticas, caracterizando as
formas cardíacas, digestivas e ou mista (Rassi et al., 1992) da doença de Chagas, com
graus variáveis de severidade clínica.
Na forma cardíaca são observadas complicações relacionadas com alterações
no ritmo cardíaco e na condução do impulso nervoso (Amorim et al., 1979); enquanto
na forma digestiva os órgãos mais acometidos são o esôfago e o cólon . Esses
problemas podem estar associados à intensa destruição neuronal presente nesses
órgãos e aos aspectos imunológicos que geram inflamação no tecido parasitado
seguida de fibrose (Rezende, 1979).
Para tentar explicar o pleomorfismo do quadro clínico observado na doença de
Chagas, vários estudos foram realizados com intuito de averiguar as possíveis
correlações entre as formas clínicas com a variabilidade genética do parasito. Contudo,
1985; Apt et al, 1987; Brenière et al., 1989; Vago et al., 2000; Silva, 2001;
Lages-Silva et al., 2006; D’Avila et al., 2006; D´avila et al., 2009).
Algumas hipóteses foram propostas para explicar o insucesso em estabelecer
essa correlação, a primeira delas está relacionada ao fato de que os pacientes
poderiam ser infectados por várias subpopulações do parasito e, que a população
recuperada no sangue não refletiria exatamente aquela que estaria gerando as lesões
nos tecidos do indivíduo infectado, reforçando a teoria do Modelo Histiotrópico Clonal
levantada por Macedo e Pena, (1998). No ciclo de transmissão natural do T. cruzi, os
triatomíneos provavelmente estão em contato com diferentes hospedeiros
vertebrados e, conseqüentemente, um mesmo triatomíneo pode realizar seu repasto
sanguíneo em diferentes animais. Além disto, um mesmo animal pode ser infectado
por vários triatomíneos. Esses diferentes eventos favorecem a circulação de
populações multiclonais entre hospedeiros e vetores, as quais poderiam predominar
no ambiente silvestre em conseqüência da existência de um número maior de vetores
e reservatórios em relação ao ciclo doméstico no qual os mamíferos ainda atuariam
como um filtro biológico, selecionando parte ou subclones das subpopulações
existentes (Macedo e Pena, 1998; Macedo et al., 2002, 2004; Veloso et al., 2005;
Lages-Silva et al., 2006).
Outras hipóteses que poderiam estar relacionadas a esse insucesso são,
provavelmente, o fato de a doença ser um processo multifatorial, em que tanto
aspectos do parasito como do hospedeiro estão inter-relacionados ou ainda a escolha
inadequada de alvos no genoma do parasito utilizados como marcadores de
patogenicidade na tentativa de estabelecer a tão desejada correlação entre as formas
clínicas com a variabilidade genética do parasito. Portanto, ainda são necessário mais
estudos nessa área para elucidação dessas lacunas.
Nesse panorama, o parasito, certamente, tem um papel importante nesse
processo, e diferenças na sua distribuição poderiam refletir na prevalência das
diferentes formas clínicas. Já está bem estabelecido que propriedades biológicas
específicas estão mais associadas a certos grupos genéticos do T. cruzi (Toledo et al.,
ao tratamento etiológico, o curso da infecção e, conseqüentemente as manifestações
clínicas (Macedo et al., 2004).
Andrade, (1997) descreveu que as formas clínicas da doença apresentam
diferenças quanto à distribuição geográfica, sendo a forma cardíaca mais associada a
cepas dos Biodemas Tipo I e II (Z2), muito presentes no Brasil e países do Cone Sul; já o
Biodema III foi mais correlacionado com o parasitismo da musculatura esquelética,
com poucas ou nenhuma associação com as formas cardíacas e digestivas. A
predominância da infecção por esse grupo ocorreu mais em países ao norte do Brasil,
países da América Central, incluindo parte do estado da Amazônia.
Em países como a Venezuela e países da América Central, a prevalência de
megaesôfago é extremamente baixa ou praticamente ausente (Brener, 1987). No
Brasil, cerca de 50 a 60% dos pacientes chagásicos crônicos apresentam a forma
indeterminada da doença, 20 a 30% apresentam a forma cardíaca, 8 a 10% apresentam
a forma digestiva. Menos de 2% apresentam as formas clínicas combinadas ou forma
mista da doença. Entretanto, a ocorrência da forma digestiva (megaesôfago e/ou
megacólon) parece ser predominante na região central (Luquetti et al., 1986; Dias,
1992).
Desse modo, a epidemiologia molecular é uma ferramenta importante no
intuito de evidenciar a variabilidade de T. cruzi em uma área endêmica, e vem sendo
utilizada no intuito de permitir um estudo integrado do parasito com aspectos clínicos
e epidemiológicos da doença observados na região em estudo na tentativa de detectar
correlações e estabelecer perfis cepa específicos, que possam orientar o prognóstico,
diagnóstico ou mesmo tratamento da doença de Chagas.
1.2 O Trypanosoma cruzi
O Trypanosoma cruzi (Chagas, 1909) é um protozoário hemoflagelado,
digenético, pertencente à ordem Kinetoplastida e a família Tripanosomatidae,
amplamente disperso no continente americano, do sul dos Estados Unidos ao norte da
Argentina. Diversos trabalhos demonstraram que o T. cruzi apresenta-se como uma
tanto no ambiente doméstico como no silvestre, além de manter um íntimo contato
com os seres humanos, animais reservatórios e vetores (Zingales et al., 1998; Macedo
e Pena, 1998; Macedo et al., 2000; Miles et al., 2009; Yeo et al., 2011).
Concernente a organização estrutural e populacional em T. cruzi, essas são
complexas e seu conhecimento tem sido importante para compreender a intensa
variabilidade intra-específica observada nessa espécie tanto ao nível biológico como
genético.
1.2.1 Organização Genômica do T. cruzi
O Trypanosoma cruzi apresenta seu genoma organizado em uma região de DNA
nuclear e outra extranuclear caracterizada, no caso dos membros da ordem
Kinetoplastida, por uma mitocôndria única e alongada, constituindo o cinetoplasto
(Myler et al., 1993). Essa organela é composta de duas classes de moléculas de DNA
circulares denominadas maxicírculos e minicírculos, correspondentes a cerca de 23% a
30% de todo o DNA celular denominado DNA do cinetoplasto ou kDNA do T. cruzi
(Stuart et al., 1983; Degrave et al., 1988). Os minicírculos estão presentes em torno de
10.000 a 20.000 cópias por célula, que encontram-se concatenadas entre si, sendo
constituídos de quatro regiões conservadas intercaladas por quatro regiões variáveis.
As regiões conservadas contêm a região de replicação do DNA, enquanto as regiões
variáveis estão envolvidas com a produção de pequenos RNAs guias (gRNAs) que
participam da editoração dos mRNAS das enzimas mitocondriais. Os maxicírculos estão
presentes em cerca de 20 a 50 cópias por célula e contém os genes de proteínas
relacionadas com a respiração celular, bem como de RNAs ribossomais (Sanches 1984;
Westemberg et al., 2006).
Como todos eucariotos, o T. cruzi possui além do DNA mitocondrial, o DNA
nuclear, que em conjunto, mantém a homeostase celular. Seu conteúdo total pode
variar de 125 a 330 fentogramas por célula (McDaniel e Dvorak, 1993; Henriksson et
al., 1996). Em relação ao DNA nuclear, os tripanossomátideos apresentam diferenças
na cromatina em comparação com os mamíferos e outros grupos de organismos,
sendo as mesmas pouco compactadas e frágeis, tanto em nível físico como enzimático
grupo é a organização das cromatinas em relação aos eucariotos superiores e a outros
protistas. Seus cromossomos, em número aproximado de 41 pares (Teixeira et al.,
2011), não condensam durante a divisão celular, e por vários anos, os pesquisadores
acreditavam que a falta da condensação dos cromossomos era devido a ausência
histonas aderidas às fitas de DNA. Estudos mais recentes confirmaram a presença
dessas proteínas nesses organismos, mas revelaram diferenças fundamentais na
estrutura da Histona H1, o que poderia explicar a baixa estabilidade estrutural das
cromatinas do T. cruzi (Toro et al., 1988).
Recentemente, o genoma nuclear completo da cepa CL Brener foi publicado na
literatura (El-Sayed et al., 2005) estimando-se que o tamanho do genoma diplóide gire
em torno de 106,4 e 110,7 megabases, contendo cerca de 22570 genes. Cerca de 50%
destes é composto por seqüências repetitivas (DNA satélite), apresentando cerca de
100.000 cópias; os minissatélites com aproximadamente 1000 cópias, e os
microssatélites que diferem no tamanho dos motivos de repetição (Hancock, 1999),
além de genes que codificam proteínas de superfície, retrotransposons e repetições
subteloméricas.
1.2.2 Variabilidade Biológica do T. cruzi
O T. cruzi é uma espécie que possui uma extensa variabilidade biológica, que já
foi observada em relação a sua morfologia (Andrade & Andrade, 1966; Andrade, 1985); a
taxa de crescimento e a virulência (Brener & Chiari, 1963; Brener, 1977) ao tropismo
tecidual (Vago et al., 2000), a suscetibilidade a drogas (Brener et al., 1976; Toledo et
al., 2003; Toledo et al., 2004b) e à composição antigênica (Krettli & Brener, 1982).
Carlos Chagas, em 1909, já descrevia algumas diferenças na biologia do
parasito. Este autor, observando a morfologia das formas tripomastigotas, sanguíneas
verificou a existência de formas largas e delgadas do parasito, achado que foi
posteriormente muito estudado por outros pesquisadores (Brener, 1965; Silva, 1959).
Foi então verificado que as formas delgadas predominam em cepas de alta virulência
com macrofagotropismo, desenvolvem parasitemia precoce e são mais suscetíveis aos
virulência e maior resistência aos anticorpos do hospedeiro (Andrade, 1974; Brener,
1965; Brener, 1969).
Devido a variabilidade biológica da espécie, foi proposta por Andrade em 1974,
o primeiro critério de subdivisão das populações do T. cruzi em agrupamentos que
apresentavam padrões de comportamento biológicos semelhantes em camundongos,
baseado em parâmetros tais como: predomínio das formas largas ou delgadas, curva
de parasitemia, morfologia dos tripomastigotas sanguíneos, tropismo tecidual, taxa de
mortalidade, e lesões histopatológicas. Foram inicialmente definidos três grupos
denominados de Tipos I, II e III. Posteriormente, Andrade e Magalhães (1997),
avançando nesses estudos propuseram o termo biodema para esses grupos, que foram
assim caracterizados:
a) tipo I ou biodema I: seu protótipo é a cepa Y, sendo constituído por cepas
com predomínio das formas delgadas que se multiplicam rapidamente, originando
uma elevada parasitemia e, como conseqüência, a morte dos camundongos após o 7º
e 12º dia da infecção e macrofagotropismo na fase inicial da infecção.
b) tipo II ou biodema II: Possui como referência a cepa São Felipe, que se revela
com predomínio de formas largas e miocardiotropismo. Apresenta multiplicação
relativamente lenta, com picos de parasitemia irregulares entre o 12º e 20º dia de
infecção, podendo, nesse período, ocorrer elevado índice de mortalidade.
c) O tipo III ou biodema III: representado pela cepa Colombiana. Possui
predomínio das formas largas com lenta multiplicação, picos de parasitemia tardios
após o 20º e 30º dia de infecção; tropismo principalmente para a musculatura
esquelética e com baixo índice de mortalidade (Devera et al., 2003).
Essa heterogeneidade poderia contribuir para explicar diferenças regionais
quanto à variabilidade das manifestações clínicas, resposta ao tratamento, e até
mesmo à transmissibilidade do parasito.
1.2.3 Variabilidade Genética do Trypanosoma cruzi
A variabilidade dos isolados do T. cruzi pode ser observada tanto em nível
base na análise do DNA e a expressão de proteínas (Miles et al., 2009; Zingales et al.,
2012).
Estudos pioneiros realizados por Toyé (1974), avaliando o perfil de isoenzimas
gerados por dois sistemas enzimático (ASAT - aspartato aminotransferase e ALAT -
alanina aminotransferase) demonstraram perfis de bandas diferenciados para os
grupos analisados, confirmando assim a existência da diversidade genética nesta
espécie. Posteriormente, diversos estudos foram realizados na tentativa de
demonstrar e comprovar esse pleomorfismo genético, utilizando esse mesmo
marcador, mas com número cada vez maior de loci avaliados. Estes estudos
permitiram evidenciar maior número de grupos genéticos distintos nessa espécie
(Miles et al., 1977 e 1978; Romanha et al., 1979 e 1982; Barnabé et al., 2000) - Tabela I.
Com o advento da biologia molecular, diversos trabalhos foram realizados com
a utilização da técnica da reação em cadeia da Polimerarese (PCR) amplificando
diferentes alvos no genoma do T. cruzi, tanto em nível do genoma nuclear como do
mitocondrial a fim de classificar as subpopulações dessa espécie de acordo com sua
identidade genética. Um breve histórico sobre o desenvolvimento desses marcadores
é apresentando na Tabela I, iniciando com os estudos de RFLP-PCR realizados por Morel et al. (1980), seguidos pelos clássicos trabalhos de genética de populações,
utilizando o RAPD e análises de isoenzimas, propostos por Tibayrenc et al. (1993) até o
estabelecimento do primeiro consenso taxonômico do T. cruzi (Anonymous, 1999).
Essa proposta foi uma tentativa de padronização da classificação da espécie, a fim de
facilitar a comunicação entre a comunidade científica e a correlação de resultados
(Anonymous, 1999). Desse modo, foram definidas três linhagens:
TcI: que incluia as cepas classificadas como Zimodema 1 (Miles et al., 1978), Tipo III (Andrade, 1974) Ribodemas II/ III (Clark & Pung, 1994), Grupo 1(Tibayrenc, 1995) e
linhagem 2 (Souto et al., 1996).
TcII: que incluia as cepas classificadas como Zimodema 2 (Miles et al., 1978), Zimodema A (Romanha et al., 1979), Tipo II (Andrade, 1974) e Ribodema I (Clark &
T. cruzi: que incluia as cepas caracterizadas como híbridas ou cuja caracterização fosse inconclusiva devido a incongruência entre os marcadores, tais como o Zimodema 3
(Miles et al., 1978), Zimodema B (Romanha et al., 1979) Tipo 1 (Andrade, 1974) o
grupo 1/2 (Souto et al., 1996), genótipo 39 (Tibayrenc, 1995).
Entretanto, com o avanço das metodologias de análise multiloci para avaliação
da diversidade genética do parasito, outras subdivisões foram posteriormente
observadas no interior dessa espécie (Brisse et al., 2000; Freitas et al., 2006) . Nesse
contexto, Brisse et al. (2000) propuseram a subdivisão da espécie de T. cruzi em seis
sublinhagens incluindo a DTU I correspondente a linhagem I definida por Anonymous
et al.(1999); DTU IIb correspondente a linhagem II e às DTU(s) IIa, IIc, IId e IIe que
representariam aqueles isolados com classificação ainda inconclusiva quando
estabelecido o consenso de 1999. Por exemplo, a DTU IId e IIe seriam isolados que
apresentaram perfil híbridos e, as DTU(s) IIa e IIc equivalentes ao Zimodema 3 descrito
por Miles et al. (1977).
Com avanços nos estudos tentando correlacionar a genética do parasito com
suas propriedades biológicas fundamentais e aspectos epidemiológicos e clínicos da
doença, ficou evidenciado uma grande variação de propriedades entre membros de
das grandes linhagem do T. cruzi (Toledo et al., 2002; Toledo et al., 2003; Miles et al.,
2009), o que fez com que alguns autores sugerissem que provavelmente as subdivisões
menores apresentariam maior especificidade (Tibayrenc et al., 2003). Desse modo,
outro consenso taxonômico para o T. cruzi foi realizado em Buzios, RJ, durante um
encontro de Protozoologia, e uma nova classificação da espécie foi publicada (Zingales
et al. , 2009), conforme descrito na Tabela I.
Autores Metodologias Resultados e Classificação
Miles et al,. 1977 e 1978
Análises de isoenzimas empregando oito locos enzimático na avaliação de isolados da Am e Ba, Brasil.
Os autores concluíram que, os isolados que apresentassem os mesmos perfis para cada sistema enzimático seriam classificados em Zimodemas (Z1, Z2 e Z3). Os perfis Z1 e Z3 foram mais relacionados aos parasitos obtidos do ciclo silvestre e o grupo Z2 mais relacionados com o ciclo doméstico. Os mesmos descreveram a predominância do grupo Z2 no Brasil e Z3 em outros países do Cone Sul.
Romanha et al,. 1979, 1982
Análises de isoenzimas empregando oito locus isoenzimáticos na avaliação de amostras provenientes de hospedeiros silvestres e pacientes humanos isolados de diversas áreas endêmicas do Brasil.
Os autores propuseram a classificação dos isolados de acordo com os perfis apresentados em quatro Zimodemas: ZA, ZB, ZC e ZD. O zimodema Z2 proposto por Miles em (1978) apresentava forte correlação com o Zimodema ZA de Romanha (1979 e 1982).
Tibayrenc e Ayala 1986;
Tibayrenc e Brenière, 1988
Análises de isoenzimas empregando 15 locus enzimáticos na avaliação de isolados provenientes de vetores, de reservatórios e de pacientes, de diversos países da America Latina e Estados Unidos.
Identificação de 43 grupos genéticos distintos denominados de clonets naturais do T. cruzi,dos quais quatro genótipos ocorrem em maior freqüência e dispersão geográfica, perfazendo cerca de 53,7% das amostras e, por isso, representariam os genótipos principais do parasito: 19, 20, 39 e 32.
Morel et al., 1980 Análise Fragmentos de restrição do KDNA – RFLP dos minicírculos, de cepas provenientes de vetores e pacientes humanos da América Latina.
Encontraram padrões de bandas específico para grupos distintos do parasito, que foram denominados como Esquizodemas. A metodologia demonstrou um grande número de subdivisões que dificultou a interpretação dos resultados.
Sturm et al., 1989 RFLP – PCR de cepas provenientes de diferentes regiões da America Latina, e representantes de todos os zimodemas.
Estudaram RFLP–PCR nos minicírculo e observaram que a metodologia poderia ser realizada diretamente em amostras biológicas sem a necessidade de sua manipulação em cultura.
Tibayrenc et al.,1993;
Análises de 10 primers de RAPD (Random Amplified Polymorfic DNA) e Isoenzimas em 24 isolados provenientes do Brasil, Chile, Bolivia e Venezuela.
Steindel et al., 1993 Análises com 4 primers de RAPD em 32 isolados provenientes de diversos países da América do Sul.
Os perfis de RAPD de 18 cepas pertencentes ao zimodema 1 (Z1), recolhidos de várias regiões da América do Sul, exibiu um padrão consistente e 59% das bandasproduzidasestavam presentes em todas as cepas Z1. Um nível semelhante de consistência foi verificado no número de bandas compartilhadasentre 5 cepas Z2, 4 cepasZBeZC, pertencentes a 2 linhagens. Aanálise fenéticadas 5 diferentes linhagens Z1, com base no compartilhamento de banda mostrou que suas inter-relaçõesespelhoua sua origemgeográfica.A comparação dos perfis de RAPD de estirpes de zimodemas diferentes mostrou que menos de 7% de bandas das cepas em um zimodema estão presentes nas cepas deoutrozimodema.
Souto e Zingales., 1993
Análise do polimorfimo da região divergente do Domínio D7 da
subunidade 24Sα rDNA,
Os autores estudaram o gene que codifica o rRNA 24Sa em diversos isolados de T. cruzi de diversos hospedeiros da América Latina, demonstrando se tratar de um alvo específico nessa espécie. Por meio da técnica de PCR amplificaram e seqüenciaram dois produtos distintos: um fragmento de 125pb e outro de 110pb, permitindo classificar o parasito em dois grupos linhagens I e II, respectivamente . Posteriormente, o aumento do número de amostras permitiu demonstrar a existência de um terceiro grupo de cepas que apresentavam os dois fragmentos (110 e 125 pb), correspondentes à perfis híbridos, atualmente DTU V, que foi então denominados grupo ½ (Souto et al., 1996).
Clark & Pung, 1994 Análise do polimorfismo da subunidade 18S do rRNA por RFLP-PCR.
Souto et al., 1996 Análise do polimorfismo da região inter-gênica. do gene do mine-exon em isolados provenientes de diversos hospedeiros naturalmente infectados da América Latina.
Os isolados apresentaram m produtos amplificados de com 300pb e 350pb. Associados aos resultados para o
polimorfismo do gene 24Sα rDNA os autores
propuseram a classificação do T. cruzi em três grupos: Grupo I que apresenta um fragmento de 125 pb para o rRNA e 330pb para o mini-exon, Grupo II que apresenta um fragmento de 110 pb para o rRNA e 350pb para o mini-exon e grupo 1/2 que apresenta ambos os produtos de amplificação do rRNA e do produto do grupo I do mini-exon.
Anonymous, 1999 1ª Reunião para unificar a classificação da espécie, sendo definidos duas linhagens genéticas, a fim de facilitar as correlações entre os diferentes estudos.
TcI: cepas classificadas como Zimodema 1 (Miles et al., 1978), Tipo III (Andrade, 1974) Ribodemas II/ III (Clark & Pung, 1994), Grupo 1(Tibayrenc, 1995) e linhagem 2 (Souto et al., 1996).
TcII: cepas classificadas como Zimodema 2 (Miles et al., 1978), Zimodema A (Romanha et al., 1979), Tipo II (Andrade, 1974), Ribodema I (Clark & Pung, 1994);. Cepas com classificação inconclusiva foram denominadas somente T. cruzi incluindo aquelas com perfil hibrido (Zimodema B de Romanha et al; Tipo 1 de Andrade, 1974; o grupo 1/2 de Souto et al., 1996; , genótipo 39 de Tibayrenc et al. 1993) ou com incongruência entre marcadores como o Zimodema 3 (Miles et al., 1978)
Brisse et al.,2000ª Análises de RAPD empregando 20 iniciadores RAPD e 22 loci de isoenzimas.
Em isolados
provenientes de diversos países da América Latina e Estados Unidos da América.
Propuseram a existência de seis grupos de T. cruzi ou DTU(s), que foi definida como uma coleção de cepas geneticamente relacionadas e idênticas quando careacterizadas por marcadores moleculares comuns: DTU I, correspondente a linhagem proposta por Anonymous (1999); DTU II, correspondente a linhagem II; DTU III e IV correspondentes ao Zimodema III; DTU V e VI correspondentes ao grupos híbridos.
Brisse et al.,2000b Clonaram regiões amplificadas (SCAR), provenientes da amplificação de 3 primers de RAPD. Utilizaram 87 cepas do T. cruzi, representantes de todos os seis DTU(s) provenientes de diversas regiões da América latina.
A combinação dos três marcadores SCAR resultou em padrões característicos que eram distintos nas seislinhagens.Além disso, as linhagens do T. cruzi
foram distintas doTrypanosomarangeli e T. cruzi
Freitas et al., 2006 Análise do polimorfimso da subunidade II do gene Citocromo oxidase por RFLP analisando amostras representativas das seis DTU(s) estabalecidas por Brisse et al. (2000).
Sugeriram a existência do TcIII. Haplogrupos mitocondrial A, B e C, sendo que o haplótipo A tem correspondência com o Z2 e rDNA tipo 2, o haplótipo B comparados com os híbridos e Z3, e o haplótipo C relacionado com Z2 e rDNA tipo 1. A DTU 2b corresponde ao Zimodema 2 (Miles et al., 1977), as DTU 2c ao Zimodema 3 (Miles et al., 1977).
Rozas et al., 2007 RFLP-PCR de 12 genes constitutivos do protozoário e análise dos resultados para genotipagem via MLP, em 50 amostras isoladas de humanos, hospedeiros vertebrados e invertebrados de uma importante área endêmica do Chile.
Os produtos de digestão dos 12 genes foram avaliados utilizando o método de análise proposto pelos autores MLP. A metodologia foi considerada eficiente na identificação dos seis DTU(s) do protozoário, além de ser capaz de fazer a genotipagem dos isolados diretamente nos tecidos do hospedeiro. A identificação dos DTU(s) segue um algoritmo (MLP), avaliando as sucessivas reações de RFLP-PCR.
Zingales et al., 2009 Segundo Consenso Taxonômico em T. cruzi
Foi definido que a espécie T. cruzi é subdividida em seis grupos denominados TcI, TcII, TcIII, TcIV, TcV e TcVI de acordo com as análises moleculares e biológicas avaliadas e citadas anteriormente. Desse modo, TcI corresponderia ao linhagem TcI definido por Anoymous et al (1999) e a DTU I de Brisse et al. ( 2000); TcII a linhagem TcII de Anonymous et al (1999) e a DTU Iib de Brisse et al., 2000; TcIII ao Z3/Z1 de Miles et al. (1981) DTU IIc de Brisse et al. (2000) e TcIII de Freitas et al. (2006); TcIV ao Z3 e DTU IIa; TcV aos grupos Z2, rDNA ½ e DTU IId; TcVI ao zimodema B e DTU IIe
1.2.4 Estrutura Populacional do Trypanosoma cruzi
Em um importante estudo sobre a variabilidade genética do T. cruzi, Tibayrenc
et al. (1986) pela análise dos perfis isoenzimáticos de amostras provenientes do ciclo
silvestre e do doméstico da Doença de Chagas, de diferentes regiões da América
Latina, demonstraram que o T. cruzi possui estrutura e evolução predominantemente
clonal. Os autores observaram que o número detectado de genótipos foi
extremamente inferior às combinações esperadas para os loci analisados,
evidenciando um grande desvio do equilíbrio da Lei de Hardy-Weinberg. Esses estudos
demonstraram a existência de 43 zimodemas na espécie e, que 16 deles possuíam
diferença em apenas um alelo. Posteriormente, foi demonstrado que alguns
vetores, reservatórios animais e em humanos repetidas vezes, em diferentes áreas
geográficas e em momentos distintos, sendo por estas razões, denominados genótipos
principais do T. cruzi (Tibayrenc e Brenière, 1988).
O modelo de evolução clonal pressupõe que as subpopulações do T. cruzi
podem ser consideradas como unidades genéticas estáveis ao longo do tempo e do
espaço e, que as trocas genéticas entre os mesmos são eventos raros (Bogliolo et al.,
1996; Machado & Ayala, 2001; Brisse et al., 2003; Sturm et al., 2003; Gaunt et al.,
2003; Westenberger et al., 2006). Por essa razão, a estrutura populacional da espécie
tem que ser avaliada pelas mínimas taxas de recombinação acumulativas ocorridas ao
longo do tempo, o que gera variabilidade genética intra-específica e influencia a
estrutura populacional da espécie.
Nesse contexto, atualmente está bem estabelecido que existe seis subdivisões
genéticas (DTU) no interior dessa espécie, que foram denominadas de TcI, TcII, TcIII,
TcIV, TcV e TcVI (Zingales et al., 2009), com provavelmente dois eventos de
hibridização envolvidos na formação dessas linhagens. As DTU TcI e TcII consistem em
linhagens filogenéticas ancestrais, únicas e relativamente homogêneas. No entanto,
estudos recentes têm demonstrado significativa variabilidade no interior de TcI
(Ramirez et al., 2011). O seqüenciamento gênico suporta a idéia de que as DTU(s) TcIII
e IV apresentam afinidade tanto com Tc I quanto TcII, indicando que eles
apresentaram características híbridas derivadas dessas duas DTU(s) geradas
provavelmente, devido de eventos de hibridização entre essas linhagens
(Westenberger et al., 2006); enquanto as DTU(s) V e VI apresentam haplótipos
provenientes de TcII e TcIII (Westenberger et al., 2005; Subileau et al., 2009; Yeo et
al., 2011).
Entretanto, análises de genes mitocondriais (Freitas et al., 2006) sugeriram a
divisão desta espécie em três grupos ancestrais e não em dois como nos estudos
anteriores. Essas linhagens foram denominadas de a) T. cruzi I e (b) T. cruzi II (
correspondentes a TcI e TcII, respectivamente); (c) T. cruzi III (que corresponderia a
cepas da DTU TcIII). Os autores ainda propuseram que a origem dos representantes
híbridos atualmente observados seria decorrente de eventos de hibridização entre TcII
baseadas nos perfis de microssatélites também suportam a existência de dois eventos
de hibridização na origem dos subgrupos híbridos do T. cruzi (Venegas et al., 2009).
1.2.5 Correlações com propriedades biológicas do parasito, clínicas e eco epidemiológicas da Doença de Chagas
O modelo clonal proposto por Tibayrenc e Ayala (1988) para T. cruzi pressupõe
que na espécie a reprodução sexuada ou recombinação genética são nulas ou praticamente ausentes. Como o parasito se reproduz predominantemente por divisão
binária, seu genótipo seria transmitido em bloco a sua progênie, o que resultaria
provavelmente em implicações biológicas importantes. Desse modo, os genótipos
filogeneticamente próximos apresentariam propriedades biológicas e especificidades
eco epidemiológicas muito semelhantes entre si, enquanto os genótipos mais
distantes filogeneticamente apresentariam tais propriedades mais distintas. Essa
hipótese tem sido comprovada por diferentes autores que avaliaram diferentes
propriedades do parasito em cultura celular (Laurent et al., 1997; Revollo et al., 1998),
no hospedeiros invertebrados (Lana et al., 1998) e em hospedeiros vertebrados
(Laurent et al., 1997; Toledo et al., 2002; Toledo et al., 2003; Martins et al., 2006).
Os isolados pertencentes a DTU TcI apresentaram maior capacidade de
multiplicação e sobrevivência em cultura celular e acelular (Andrade, 1985; Andrade e
Magalhães, 1997; Toledo et al., 2002; Andrade et al., 2010), vetores (Dvorak, 1980;
Lana, et al., 1998), grande capacidade de infectar animais de experimentação
(Andrade, 1985; Andrade e Magalhães, 1997; Toledo et al., 2002; Martins et al., 2006),
e maior resistência a drogas tanto in vivo (Brener et al., 1976; Filardi e Brener, 1987;
Toledo et al., 2002) como in vitro (Revollo et al., 1998). Em contraste, os isolados
pertencentes a DTU TcII apresentaram-se valores menores em relaçaõ a essas
variáveis, enquanto os isolados da DTU TcV apresentaram características
intermediárias (Laurent et al., 1997; Revollo et al., 1998; Toledo et al., 2002). Por outro
lado, estoques pertencentes a DTU TcII foram mais patogênicos quando comparados a
DTU TcII (Toledo et al., 2003).
Variações geográficas quanto à distribuição genética das DTU(s) já foram
região da Bacia Amazônica e casos humanos crônicos envolvendo essa linhagem são
extremamente raros, principalmente relacionados a manifestações clínicas graves dos
pacientes (Miles et al, 1981a; Zingales et al, 1999; Coura et al, 2002; Buscaglia e Di
Noia, 2003). Países como Equador, Guatemala, Honduras, Costa Rica e Nicarágua, já
registraram grande ocorrência dessa DTU em diversos hospedeiros em seus território.
Este tem sido o principal genótipo relacionado a infecção humana nessa região
geográfica ( Miles et al., 2009; Ramos et al., 2011). Recentemente, essa DTU tem sido
frequentemente associada a casos agudos graves resultantes de surtos de infecção
oral (Coura, 2006; Dias et al, 2008; Steindel et al., 2008) e a entrada de roedores
silvestres no ambiente domiciliar (Luquetti et al., 1986). Ocorrência interessante dessa
linhagem é a associação com a reativação da doença em pacientes imunossuprimidos,
com a co-infecção Chagas/HIV (Añez et al., 2004; Burgos et al., 2008). Outra
característica importante da DTU TcI é sua resistência aos fármacos disponíveis para
tratamento etiológico da Doença de Chagas experimental demonstrada em modelo
murino (Toledo et al., 2002). É importante ressaltar que o DTU TcI apresenta
substancial heterogeneidade genética intragrupo (Herrera et al, 2007). Estudos em
isolados provenientes do México (Bosseno et al, 2002), Colômbia (Herrera et al., 2007),
Venezuela e da Bolívia (Llewellyn et al., 2009b) sugerem quatro subdivisõe dentro
dessa DTU (Herrera et al, 2007; Falla et al, 2009), embora estes não tenham sido
mencionados no consenso taxonômico de 2009.
Por outro lado a DTU TcII é o principal agente da Doença de Chagas na região
do Cone Sul da América Latina, e estudos epidemiológicos tem indicado a associação
dessa DTU com mamíferos sinantrópicos e humanos (Zingales et al., 1998; Zingales et
al., 1999; Brèniere et al., 1998). Uma outra observação importante relacionada a essa
linhagem é sua associação a casos graves de doença de Chagas no Sul da América
Latina, especialmente na região central, sul e sudeste do Brasil, onde as manifestações
cardíacas, megacólon, e megaesôfago são quase exclusivamente ligados a ela (Freitas
et al., 2005; Yeo et al., 2005; Lages-Silva et al., 2006). Diversos estudos tem associado
também a DTU TcII a infecção em hospedeiros invertebrados e veterbrados nos ciclos
doméstico e silvestre em todo Brasil (Fernandes et al., 1998; Zingales et al., 1998;
D’ávila et al., 2006; Steindel et al., 2008; Brito et al., 2008; D’ávila et al., 2009 e Abollis et al., 2011), indicando a importância epidemiológica dessa linhagem. Outra
característica importante dessa DTU é a resistência ao tratamento etiológico. A DTU
TcII é considerada mais sensível ao tratamento experimental (Revollo et al., 1998;
Toledo et al., 2002) e em pacientes humanos (Coronado et al., 2006).
As DTU TcV e possivelmente TcVI estão envolvidas em infecções humanas na
região do Chaco e países vizinhos, como Bolívia, Chile, norte da Argentina, e sul Brasil
(Virreira et al, 2006b; Cardinal et al, 2008). Trabalhos indicam que o megacólon na
Bolívia está associada predominantemente com TcV e em menor grau, com T. cruzi II
(Virreira et al., 2006b). Notavelmente, o TcV está associado com a transmissão
congênita da Doença de Chagas na Argentina, Bolívia, e na região sul do Brasil (Virreira
et al., 2006a, 2007; Valadares, 2007).
Além das DTU(s) TcII e TcV, diferentes autores têm indicado TcVI como uma
importante linhagem associada com a doença de Chagas no sul da América do Sul
(Miles et al., 2009). No entanto, devido à sua genética, dependendo do método
escolhido para a genotipagem dos isolados, o TcVI não pode sempre ser distinguido de
TcII ou TcV (Campbell et al, 2004; Burgos et al, 2008; Lewis et al, 2009; Macedo e
Segatto, 2010). Assim, a específica contribuição da associação da DTU TcVI em
infecções humanas e hospedeiros vertebrados e invertebrados torna-se difícil de ser
avaliada de forma adequada.
Devido aos problemas relacionados com a genotipagem do T. cruzi alguns
trabalhos foram propostos com a finalidade de se chegar a caracterização rápida e
segura dos isolados nas seis DTU(s) desse parasito. Devido a natureza híbrida de alguns
desses grupos, os protocolos combinam diferentes metodologias. O primeiro deles foi
publicado por Brisse et al. (2001) e que propôs a identificação das seis DTU(s) pela
analise integrada do polimorfismo dos genes 24Sα rDNA (Souto et al., 1996),
juntamente com 18Sα rDNA (Clark e Pung 1994); o segundo foi proposto por Lewis et al. (2009), que representa segundo os autores, uma metodologia simples e acurada,
capaz de identificar todos os genótipos do parasito, avaliando os resultados do
com os padrões do 24Sα rDNA; o terceiro esquema propõe a classificação pela análise
em conjunto do 24Sα rDNA (Souto et al., 1996), SL-IR (Burgos et al., 2007) juntamente com o RFLP do gene Citocromo Oxidase subunidade II (CoII) (Freitas et al., 2006) e
publicado primeiramente por D’ávilla et al. (2009).
Atualmente, grandes esforços têm se concentrados no intuito de investigar a
correlação entre a variabilidade genética do parasito e suas características biológicas,
epidemiológicas e clínicas fundamentais, incluindo ainda a resistência/susceptibilidade
ao tratamento etiológico, a fim de delinear perfis cepa-específicos, que poderão
orientar as medidas de controle, o manejo do paciente e/ou seu tratamento. Desse
modo, é fundamental conhecer a variabilidade genética e a estrutura populacional de
qualquer agente patogênico em uma determinada região, sobretudo em estudos
epidemiológicos, de evolução do parasito, de diagnóstico da doença e seu prognóstico,
ou mesmo na pesquisa básica.
1.3 A Doença de Chagas em Berilo, Vale do Jequitinhonha, MG.
Em um inquérito sorológico realizado no Brasil sobre a prevalência da Doença
de Chagas em meados de 1975 a 1980 foi constatado que 4,22% da população rural
encontrava-se com sorologia positiva para o T. cruzi (Camargo et al., 1984). O estado
de Minas Gerais exibiu umas das maiores prevalência no país, sendo o Norte de Minas,
e especificamente o Vale do Jequitinhonha, uma das regiões mais afetadas pela
Doença, apresentando o município de Berilo uma prevalência de 35,5% de
positividade.
Posteriormente, Dias et al. (1985) realizaram um inquérito sorológico em Berilo
para averiguar a real situação da doença na população e, encontraram 35,1% de
positividade na sorologia para Doença de Chagasna população residente no município
naquele momento. Após a realização desse inquérito várias intervenções foram
realizadas no município objetivando o controle da transmissão vetorial por meio de
ações conjuntas entre a prefeitura e o Programa de Controle da Doença de Chagas no
Em um novo inquérito realizado em 1988, Aguilar et al. avaliaram um grupo de
1150 pessoas, entre jovens e adultos, encontrando uma positividade de 12,69% nessa
amostra. A prevalência foi consideravelmente menor que a encontrada por Dias et al.
em 1985, o que indicava declínio da prevalência, mas que o controle ainda não fora completamente efetivo. Neste mesmo estudo, os autores investigaram ainda alguns
aspectos da doença de Chagas em indivíduos infectados, observaram que a
mortalidade entre os pacientes soropositivos era de 1,9% ao ano, que a cardiopatia
afetava cerca de 2,6% dos pacientes e que existia uma progressiva evolução clínica nos
pacientes infectados pelo T. cruzi circulantes naquela região demonstrados
posteriormente por Montoya (1998). Uma nova avaliação vetorial realizada por Silveira
e Rezende (1994) e Fernandes et al. (1992) verificaram que o P. megistus foi sempre a
espécie mais frequentemente encontrada como vetor da doença de Chagas em Berilo,
nativa na região e muito presente no peridomicílio determinando a manutenção do
ciclo doméstico de T. cruzi e servindo como enlace com o ciclo silvestre.
Contudo, mesmo após o início das ações de controle vetorial na região e
implantação do PDCH e em Berilo houve várias interrupções em suas ações
decorrentes de problemas político e ou financeiros, especialmente na década de 80 e
início da década de 90. Somente no final da década de 90, a FUNASA intensificou o
combate aos triatomíneos vetores que culminou com a implantação da vigilância
epidemiológica e a criação dos PITs (postos de informação de Triatomíneos). Ficando a
região sob a supervisão da Gerência Regional de Saúde de Diamantina. Com o intuito
de avaliar o impacto do programa de controle, Montoya et al. (2003) realizaram um
novo inquérito sorológico no município. Os autores observaram uma prevalência de
positividade em 18% dos avaliados, e de apenas 0,17% entre os menores de 10 anos,
indicativa da efetividade da vigilância epidemiológica.
Em 2002, foi criado o Grupo de Pesquisa em Epidemiologia e Clínica da Doença
de Chagas no Vale do Jequitinhonha, que vem desenvolvendo um amplo trabalho em
dois municípios da região do Vale do Jequitinhonha, MG, que atualmente
correspondem ao município de Berilo liderado pela Universidade Federal de Ouro
Preto-MG em colaboração com pesquisadores de outras instituições brasileiras
região, principalmente, nos municípios de Berilo e José Gonçalves de Minas, que
constituía até 1997 um distrito de Berilo. Nesse contexto, Borges et al. (2006)
realizaram um inquérito sorológico em 1412 escolares de 7 a 14 anos na região e
encontram uma prevalência de 0,4% de positividade de doença de Chagas no
município, menor que a observada nos anos anteriores e fortemente indicativa da
eficácia da vigilância epidemiológica.
Em 2009, Machado-de-Assis et al. (2009) (em preparação) realizaram um
levantamento integral sobre a positividade de triatomíneos vetores nos domicílios e
peridomicílios na região de Berilo, visitando cerca de 5242 unidades domiciliares e
7807 anexos, capturando 391 triatomíneos. Após análise microscópica do conteúdo
intestinal dos insetos nenhum exemplar apresentou infecção pelo T. cruzi,
confirmando que a transmissão vetorial estava controlada na região, e que a vigilância
epidemiológica também estava funcionando efetivamente.
Entretanto, a constatação de ausência de transmissão vetorial não representa
que a região esteja isenta dos problemas relacionados à infecção chagásica pelo fato
da espécie citada ser nativa no município. Aguilar et al. (1988) já haviam demonstrado
que 52% dos pacientes analisados já apresentavam ECG alterados. No município
vizinho de Virgem da Lapa, Borges-pereira (1997) encontrou prevalências de alterações
eletrocardiográficas de 48,5% entre os chagásicos contra 17,2% dos não chagásicos.
Montoya et. al. (1998) ao avaliar a evolução da doença cardíaca nos pacientes do
município de Berilo verificaram que em dez anos foi detectada evolução progressiva
em cerca de 28% dos indivíduos soropositivos. Nossa equipe detectou cerca de mais de
1000 pacientes infectados pelo T. cruzi na faixa etária de 16 a 85 anos, que necessitam
de avaliação e assistência clínica. A avaliação clínica dos pacientes também tem
revelado uma elevada taxa e diversidade de formas clínicas, indicando um alto grau de
morbidade associado à doença de Chagas (dados não publicados), corroborando dados
de outros autores obtidos na região. Esses resultados indicam que além de existir um
grande contingente de indivíduos chagásicos, a evolução da doença é progressiva e
grave na região, o que leva a considerar o tratamento desse pacientes na fase crônica
da infecção como recomendado pela OPAS a partir de 1998, visando melhor
prognóstico da doença. Lana et al. (2009) ao avaliar clinica e laboratorialmente 28