UNIVERSIDADE
CATÓLICA DE
BRASÍLIA
PROGRAMA DE PÓS-GRADUAÇÃO
STRICTO SENSU
EM EDUCAÇÃO FÍSICA
Doutorado
INFLUÊNCIA DO POLIMORFISMO I/D DO GENE DA ENZIMA
CONVERSORA DE ANGIOTENSINA SOBRE A HIPOTENSÃO
PÓS-EXERCÍCIO DE JOVENS NORMOTENSOS
Autor: Emerson Pardono
Orientador: Prof. Dr. Herbert Gustavo Simões
EMERSON PARDONO
INFLUÊNCIA DO POLIMORFISMO I/D DO GENE DA ENZIMA
CONVERSORA DE ANGIOTENSINA SOBRE A HIPOTENSÃO
PÓS-EXERCÍCIO DE JOVENS NORMOTENSOS
Orientador:Prof. Dr. Herbert Gustavo Simões
BRASÍLIA
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
16/02/2011
P226i Pardono, Emerson
Influência do polimorfismo I/D do gene da enzima conversora de angiotensina sobre a hipotensão pós-exercício de jovens normotensos. / Emerson Pardono – 2010.
104f.; il.: 30 cm
Tese (doutorado) – Universidade Católica de Brasília, 2010. Orientação: Herbert Gustavo Simões
DEDICATÓRIA
AGRADECIMENTOS
Existem inúmeras pessoas as quais eu poderia me referir exaustivamente nesse momento. Assim, me resguardo a generalizar.
Primeiramente agradeço à Deus e à minha família, o que inclui o Paulo (pH);
Também agradeço:
Ao professor Dr. Herbert Gustavo Simões pela segura orientação ao longo desses 10 anos, assim como pela grande aprendizagem adquirida ao seu lado. Excelente professor, orientador, gestor...;
À professora Drª. Carmen Silvia Grubert Campbell pelas belas palavras de sabedoria em momentos oportunos, como também pela enorme contribuição na minha formação acadêmica;
Aos grandes professores que colaboraram durante a coleta e dosagem das variáveis, como o “moranguinho”, o “japonês”, o Rafaello, a Iorrani, a Tailce e principalmente o Jeeser. Quanto ao Jeeser, sem a sua disponibilidade, confiança e capacidade, o término da tese seria inviável;
Aos voluntários; sem vocês o trabalho não aconteceria;
Ao Centro de Aperfeiçoamento em Pessoal de Ensino Superior (CAPES) pelo apoio financeiro e à Rede Sarah de Hospitais de Reabilitação que me concedeu horas semanais que possibilitaram o término da tese;
Aos novos irmãos: Luciana, Marcelo, Paulo, Olimar e Rabelo. Vários momentos difíceis nesses últimos anos, não é? Eu estou aqui firme e forte, e vocês no meu coração;
Aos colegas e amigos da Pós-Graduação e do grupo de estudo, bem como aos nossos recém mestres e doutores. Parabéns;
Aos funcionários da Universidade Católica de Brasília, principalmente dos laboratórios e da secretaria de Pós-Graduação em Educação Física;
Aos colegas, amigos e pacientes do Hospital Sarah;
RESUMO
Atualmente sabe-se que tanto fatores ambientais quanto genéticos, além do próprio processo de envelhecimento, interferem na manutenção de níveis pressóricos adequados. Nesse sentido, o exercício físico pode ser considerado um importante instrumento de controle da pressão arterial (PA), uma vez que após a sua realização é observada redução nos valores pressóricos em relação ao pré-exercício, o que é conhecida como hipotensão pós-exercício (HPE). Contudo, como mencionado, a PA sofre influência de inúmeras variáveis e inclusive genéticas, sendo o polimorfismo de inserção/deleção (I/D) no gene da enzima conversora de angiotensina (ECA) bastante investigado nas últimas décadas, dentre outras mutações. Assim, o objetivo do presente estudo foi analisar a possível influência do polimorfismo I/D no gene da ECA sobre a HPE de indivíduos jovens, normotensos e fisicamente ativos. A amostra foi composta por 62 homens com boa aptidão aeróbia (23,3±4,2 anos; 75,5±9,8 kg; 177,7±5,5 cm; 23,9±2,5 kg/m2; 12,0±4,6 % de gordura corpórea; 50,2±6,2 mL.kg.min-1), separados em três grupos em função do polimorfismo I/D (DD: n=16; II: n=15; ID: n=31). Os participantes realizaram além do teste incremental para determinação do VO2máx, outros três testes
randomizados para a análise da HPE, sendo: sessão de performance em 1600m (T1600m), esforço máximo; sessão submáxima de 20 minutos (T20); sessão controle sem exercício (SC). Foram mensuradas a PA e a frequência cardíaca (FC) de repouso pré-exercício, imediatamente ao final das sessões e por uma hora a cada 15 minutos após as sessões, na posição sentada. Os principais resultados foram que tanto a sessão máxima quanto submáxima proporcionaram HPE na amostra investigada, sendo que o grupo com o genótipo II apresentou maior decaimento da PA quando comparado aos grupos DD e ID. Ainda, pôde-se obpôde-servar que o grupo DD não aprepôde-sentou HPE para a PA diastólica (PAD) em ambas as sessões de exercício, diferentemente dos outros grupos genotípicos. Quanto à intensidade do exercício, houve HPE em ambas as sessões T20 e T1600, sendo que em intensidades mais elevadas houve maior queda da PA aos 45 minutos pós-exercício. Quando comparado o valor médio de decaimento (durante uma hora após o exercício) da PA, FC e duplo produto (DP) em função dos genótipos foram observadas diferenças entre T20 e T1600 apenas para a FC e DP dos grupos DD e ID, havendo apenas uma tendência do exercício realizado em maior intensidade de proporcionar maior queda pressórica para cada genótipo. Assim, conclui-se que houve HPE máximo e submáximo em condições não laboratoriais de homens jovens, normotensos e fisicamente ativos, podendo o polimorfismo I/D no gene da ECA ter influenciado a resposta hipotensora ao exercício, com maior decaimento da PA para os indivíduos carreadores do alelo I e principalmente com genótipo II, além de não se observar HPE para a PAD no grupo DD.
ABSTRACT
Currently it’s known that aging and both genetic and environmental factors interfere the maintenance of proper blood pressure levels. Thus, the physical exercise can be considered an important tool for controlling blood pressure (BP), since after exercising normally a decrease in BP is observed in relation to pre-exercise, which is known as post-exercise hypotension (PEH). However, the BP is influence by genetic variables so we can highlight theACE gene insertion/deletion (I/D) polymorphism that was largely investigated during the last years. The purpose of this study was to analyze the possible influence ofACEgene I/D polymorphism on the PEH of young normotensive subjects. Sixty-two physically active men with good aerobic fitness (23.3±4.2 years, 75.5±9.8 kg, 177.7±5.5 cm, 23.9±2.5 kg/m2; 12.0 ± 4.6% body fat, 50.2 ± 6.2 mL.kg.min-1) completed three running tests and a control session on different days. They were separated into three groups according to I/D polymorphism (DD: n=16, II: n=15, ID: n=31). Besides an incremental test to determine VO2max, participants performed three
randomized trials for the analysis of HPE: 1) performance on 1600m (T1600m), maximum effort; 2) submaximal 20 minutes session (T20); 3) control session without exercise (SC). We measured BP and heart rate (HR) at pre-exercise rest, immediately at the end of the sessions and during one hour every 15 minutes after the sessions at the sitting position. The main results were that both maximal and submaximal session provided PEH in the sample investigated, and the group with II genotype had greater decrease in BP compared to DD and ID groups. It was also observed that the DD group did not have PEH for diastolic BP (DBP) in both exercise sessions, unlike the others. Analyzing the exercise intensities, there was PEH in both sessions T20 and T1600, while at higher intensity there was a greater decrease in BP at 45 minutes post-exercise. When the fall average (during one hour after exercise) of BP, HR and double product (DP) were compared we found difference between T20 and T1600 only for HR and DP at DD and ID groups, with a trend of the exercise performed at higher intensity in providing greater blood pressure reduction for each genotype. Thus, we conclude that maximal and submaximal no laboratory effort promoted PEH of normotensive and physically active male, and the ACE gene I/D polymorphism may influence the hypotensive response to exercise, with greater decrease in BP for individuals carrying the I allele and mainly with the II genotype. Also, we didn’t find PEH for DBP to DD group.
ÍNDICE
RESUMO... vi
ABSTRACT... vii
Lista de Esquemas e Quadros ... x
Lista de Tabelas ... xi
Lista de Figuras ... xiii
Lista de Abreviaturas ... xv
1. INTRODUÇÃO... 1
2 OBJETIVOS... 4
2.1. Objetivo Geral ... 4
2.2 Objetivos Específicos ... 4
3. REFERENCIAL TEÓRICO... 5
3.1. Pressão Arterial: Mecanismos regulatórios ... 5
3.2. Pressão Arterial: Fatores Genéticos e Fatores Ambientais ... 8
3.2.1. Fatores Genéticos ... 9
3.2.1.1. GeneECA... 14
3.2.2. Fatores Ambientais ... 17
3.2.2.1. Exercício Físico ... 19
3.3. Hipotensão Arterial Pós-Exercício (HPE) ... 20
3.3.1. HPE e Aspectos Metodológicos ... 23
3.3.2. Relação entre HPE e Polimorfismo I/D do geneECA... 29
4. MATERIAIS E MÉTODOS... 31
4.1. Amostra ... 31
4.2. Desenho Experimental e Procedimentos ... 32
4.2.1. Medidas Antropométricas ... 34
4.2.2. Sessões de Exercícios ... 34
4.2.2.1. Teste Incremental ... 35
4.2.2.2. Teste de Performance em 1600 metros (máximo) ... 35
4.2.2.3. Teste submáximo de 20 minutos ... 37
4.2.2.4. Sessão controle sem exercício ... 38
4.2.3. Aferições da Pressão Arterial ... 38
4.2.5. Amostra biológica e extração de DNA ... 40
4.2.6. Genotipagem do polimorfismo de I/D do gene ECA ... 42
4.3. Procedimentos Estatísticos ... 44
5. RESULTADOS... 46
5.1. Características dos participantes ... 46
5.2. Variáveis gerais obtidas pela realização dos testes de esforço ... 47
5.2.1. Valores médios da PA Sistólica durante as sessões para a análise da HPE ... 49
5.2.2. Valores médios da PA Diastólica durante as sessões para a análise da HPE ... 51
5.2.3. Valores médios da PA Média durante as sessões para a análise da HPE ... 53
5.2.4. Valores médios da PAS durante os testes para os três grupos (DD, II e ID) ... 54
5.2.5. Valores médios da PAD durante os testes para os três grupos (DD, II e ID) ... 55
5.2.6. Valores médios da PAM durante os testes para os três grupos (DD, II e ID) ... 56
5.2.7. Média dos deltas da PAS, PAD e PAM, em mmHg, durante o período de recuperação (uma hora) após as sessões T20 e T1600 para os três genótipos ... 58
5.2.8. Média dos deltas da FC e do DP durante o período de recuperação após as sessões T20 e T1600 para os três genótipos ... 62
6. DISCUSSÃO... 65
6.1. Características amostrais ... 66
6.2. Resultados gerais obtidos pelos testes ... 67
6.3. Hipotensão pós-exercício máximo e submáximo ... 70
6.4. Gene ECA e polimorfismo de inserção/deleção ... 72
6.5. Hipotensão pós-exercício em função dos genótipos DD, II e ID ... 74
6.6. Limitações do estudo ... 77
7. CONCLUSÕES... 79
8. REFERÊNCIAS BIBLIOGRÁFICAS... 81
9. APÊNDICES... 94
9.1.Apêndice 1.Termo de consentimento livre e esclarecido ... 94
9.2.Apêndice 2.Anamnese ... 99
9.3.Apêndice 3.Ficha para Composição Corporal ... 102
9.4.Apêndice 4.Ficha para Coleta de Dados ... 103
10. ANEXOS... 104
Lista de Esquemas e Quadros
Esquema 1.Representação visual da organização e realização do estudo nas suas
diferentes fases ... 33
Esquema 2.Representação visual do T1600, incluindo as variáveis e os momentos de suas coletas ... 36
Esquema 3.Representação visual do T20, incluindo as variáveis e os momentos de
suas coletas ... 37
Esquema 4.Representação visual da SC, incluindo as variáveis e os momentos de
suas coletas ... 38
Quadro 1.Relação de alguns autores e respectivos tipos de exercícios empregados na investigação da ocorrência de HPE nas últimas duas décadas ... 25
Quadro 2.Descrição sucinta quanto ao perfil amostral de alguns estudos
Lista de Tabelas
Tabela 1. Classificação dos valores pressóricos para pessoas acima de 18 anos (Adaptado de PESCATELLOet al., 2004) ………... 18
Tabela 2.Características biométricas da amostra estudada (n=62) ... 34
Tabela 3.Frequência genotípica e alélica da amostra estudada (n=62) ... 46
Tabela 4.Características antropométricas, hemodinâmicas e metabólicas de repouso dos participantes de acordo com os genótipos ... 47
Tabela 5a. Variáveis de aptidão aeróbia obtidas pela realização dos testes, apresentadas de acordo com os genótipos e subdivididas entre os indivíduos fisicamente ativos e atletas ... 48
Tabela 5b. Variáveis gerais obtidas a partir da realização dos testes de esforço, apresentadas de acordo com os genótipos ... 49
Tabela 6. Valores absolutos médios de PAS (em mmHg) durante as três sessões experimentais para todos os voluntários ... 50
Tabela 7. Valores absolutos médios de PAD (em mmHg) durante as três sessões experimentais para todos os voluntários ... 52
Tabela 8. Valores absolutos médios de PAM (em mmHg) durante as três sessões experimentais para todos os voluntários ... 53
Tabela 9. Valores absolutos médios de PAS (em mmHg) durante as três sessões experimentais de cada grupo genotípico, para a análise de HPE dentro de cada genótipo ... 55
Tabela 10.Valores absolutos médios de PAD (em mmHg) durante as três sessões experimentais de cada grupo genotípico, para a análise de HPE dentro de cada genótipo ... 56
Tabela 11. Valores absolutos médios de PAM (em mmHg) durante as três sessões experimentais de cada grupo genotípico, para a análise de HPE dentro de cada genótipo ... 57
Tabela 12. Valores médios da média dos deltas de variação da PAS, da PAD e da PAM (em mmHg) durante o período de 1 hora de recuperação pós T20 e T1600 para os três grupos genotípicos ... 58
Lista de Figuras
Figura 1.Atuação da ECA nos sistemas RAA e CC. Adaptado de Sayed-Tabatabaei
et al. (2006) ... 14
Figura 2. Estrutura do gene ECA, bem como a localização do polimorfismo I/D. Adaptado de Sayed-Tabatabaeiet al. (2006) ... 15
Figura 3.Exemplificação da realização da coleta de 25μL de sangue arterial do lobo da orelha ... 40
Figura 4.Exemplificação da realização de uma coleta intravenosa ... 41
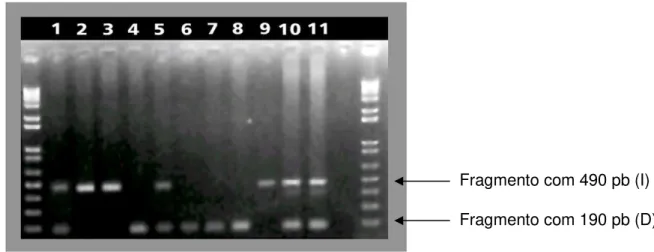
Figura 5.Identificação dos genótipos pelos produtos da PCR visualizados em gel de agarose (1%) para 11 voluntários. Os poços 1, 5, 10 e 11 referem-se aos voluntários heterozigotos, os poços 2, 3 e 9 aos homozigotos II, e os poços 4, 6, 7 e 8 aos homozigotos DD ... 43
Figura 6.Valores médios dos deltas de variação da PAS (em mmHg) durante os três testes. Observa-se que a maioria dos momentos de recuperação após T20 e T1600 diferiu dos pontos correspondentes da SC, menos Rec15 do T1600. Ainda, a Rec45 do T1600 evidenciou maior efeito hipotensor em relação aos pontos correspondentes dos outros testes.*p<0,05 entre os testes;€p<0,05 entre SC e T20;£p<0,05 entre SC e demais testes... 51
Figura 7.Valores médios dos deltas de variação da PAD (em mmHg) durante os três testes. Observou-se diferença entre os momentos correspondentes dos testes em Rec0, bem como entre SC e os demais testes a partir de Rec30. *p<0,05 entre os testes;€p<0,05 entre SC e T20;£p<0,05 entre SC e demais testes... 53
Figura 8.Valores médios dos deltas de variação da PAM (em mmHg) durante os três testes. Todos os momentos de recuperação após T20 e T1600 diferiram dos pontos correspondentes da SC, onde também se evidenciou um maior efeito hipotensor no momento Rec45 do T1600 em relação aos correspondentes dos outros testes. *p<0,05 entre os testes;€p<0,05 entre SC e demais testes... 54
Figura 9. Comparação entre os genótipos e os testes quanto aos valores médios dos deltas de variação da PAS (em mmHg) durante o período pós-exercício. Não foram encontradas diferenças entre os genótipos, tampouco entre os testes de cada genótipo . 59
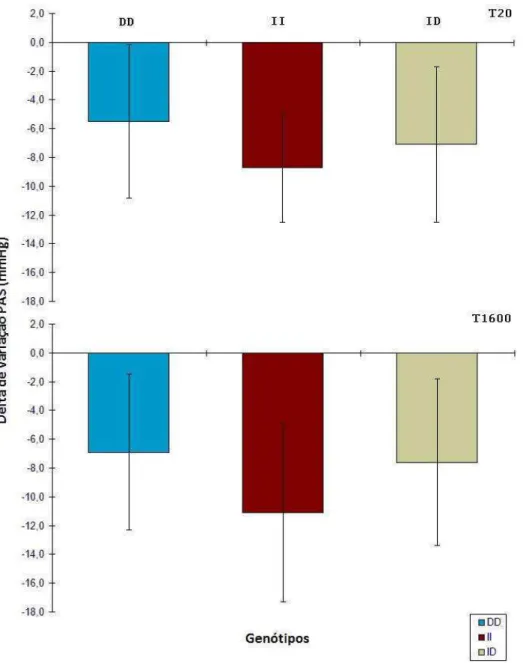
os testes de cada genótipo.**p<0,05 entre II e demais genótipos... 60
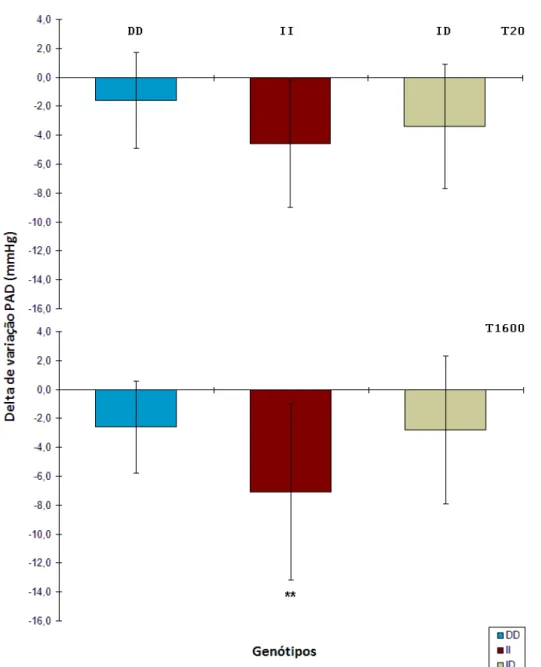
Figura 11.Comparação entre os genótipos e os testes quanto aos valores médios dos deltas de variação da PAM (em mmHg) durante o período pós-exercício. Observou-se que o grupo DD diferiu do II no T20 e o grupo II diferiu dos demais no T1600; não foram encontradas diferenças entre os testes de cada genótipo. *p<0,05 entre DD e II; **p<0,05 entre II e demais genótipos... 61
Lista de Abreviaturas
AGT Angiotensinogênio AngII Angiotensina II
AT1R Receptor do tipo 1 da AngII
DC Débito cardíaco
DD Homozigoto DD quanto ao polimorfismo de inserção/deleção (I/D) do geneECA
DP Desvio padrão DP Duplo produto
ECA Enzima conversora de angiotensina
EDHF Fator hiperpolarizante derivado do endotélio EPOC Excesso de consumo de oxigênio pós-exercício ES Estatura
FC Frequência cardíaca
FCres Frequência cardíaca de reserva
GABA Neurotransmissores gabaégicos Glic Glicemia
H1 Receptores 1 de histamina H2 Receptores 2 de histamina HAS Hipertensão arterial sistêmica HPE Hipotensão arterial pós-exercício
ID Heterozigoto ID quanto ao polimorfismo de inserção/deleção (I/D) do geneECA
II Homozigoto II quanto ao polimorfismo de inserção/deleção (I/D) do geneECA
IMC Índice de massa corpórea Int2 Síntese de aldosterona Lac Lactatemia
LAFIT Laboratório de Avaliação Física e Treinamento LAn Limiar anaeróbio
MAPA Monitorização ambulatorial da pressão arterial NaF Fluoreto de sódio
NCBI Centro Nacional de Informações sobre Biotecnologia NO Óxido nítrico
PA Pressão arterial
PAD Pressão arterial diastólica PAM Pressão arterial média PAS Pressão arterial sistólica PC Peso corporal
PCR Reação em cadeia da polimerase PSE Percepção subjetiva de esforço R Razão de trocas respiratórias
Rec0 Recuperação imediata após os testes e a sessão controle
Rec15 Recuperação no 15º minuto após os testes e após a sessão controle Rec30 Recuperação no 30º minuto após os testes e após a sessão controle Rec45 Recuperação no 45º minuto após os testes e após a sessão controle Rec60 Recuperação no 60º minuto após os testes e após a sessão controle RVP Resistência vascular periférica
SC Sessão controle
SCC Sistema calicreína-cininas
SRAA Sistema renina-angiotensina-aldosterona TI Teste incremental em esteira ergométrica T1600 Sessão máxima de exercício de 1600 metros
T20 Sessão submáxima com duração de 20 minutos de exercício Vm Velocidade média
VO2 Volume de oxigênio
VO2máx Volume máximo de oxigênio consumido durante um esforço máximo
1. INTRODUÇÃO
A hipotensão arterial pós-exercício (HPE) caracteriza-se por uma redução da pressão arterial (PA) para valores abaixo daqueles verificados em repouso pré-exercício (MACDONALD, 2002), sendo observada após exercícios aeróbios (MACDONALD, 2002) e resistidos (LIZARDO e SIMÕES, 2005; REZK et al., 2006), tanto em homens como em mulheres (LIZARDO et al., 2007; SENITKO et al., 2002), em idosos (HAGBERG et al., 1987) e indivíduos de meia idade hipertensos (CUNHAet al., 2006).
O fenômeno HPE tem sido estudado há décadas e atualmente é considerado como importante recurso não farmacológico para o tratamento da hipertensão arterial (CUNHA et al., 2006; MOTAet al., 2009). Indivíduos que apresentam PA sistólica (PAS) igual ou maior a 140 mmHg e PA diastólica (PAD) igual ou maior a 90 mmHg são considerados hipertensos
(PESCATELLO et al., 2004) e estão sob alto risco de doenças coronárias, renais e acidente vascular cerebral (MESSERLIet al., 2007).
Vários fatores de risco podem estar associados ao desenvolvimento da hipertensão arterial, entre eles: idade, mutações genéticas, obesidade, resistência a insulina, consumo aumentado de álcool e sal e sedentarismo (AGARWAL, WILLIAMS e FISHER, 2005). Segundo An et al. (1999), tanto fatores genéticos quanto ambientais, tais como o estilo de vida e nível de atividade física (HALLIWILL, 2001), além do próprio processo de envelhecimento, são relevantes para a variabilidade de fenótipos relacionados à PA, o que pode influenciar a HPE e por conseguinte sua eficácia como tratamento e/ou prevenção da hipertensão arterial.
de inserção/deleção (I/D) no gene ECA, que expressa a enzima conversora de angiotensina (ECA).
Segundo Sayed-Tabatabaei et al. (2006) o genótipo homozigoto DD (ou mesmo a presença do alelo D) pode acarretar em acréscimo de ECA circulantes, o que pode aumentar a vasoconstrição pela maior produção de angiotensina II e diminuir a vasodilatação pela maior degradação de bradicinina. Em adicional, indivíduos com genótipo II, os quais teoricamente apresentam maiores concentração de bradicinina circulante e bio-atividade de óxido nítrico (substâncias vasodilatadoras) (SAYED-TABATABAEI et al., 2006), podem apresentar valores pressóricos mais baixos e inclusive obter maior HPE. Segundo Tanriverdi et al. (2005), atletas com genótipo II apresentavam maior fluxo sanguíneo mediado por dilatação endotélio-dependente.
As inter-relações entre exercício físico (e outros fatores ambientais), bem como entre HPE e fatores genéticos ainda são pouco compreendidas. O que tem sido demonstrado é que as respostas da PA após o exercício físico variam de indivíduo para indivíduo, sugerindo que possam ser mediadas, em grande parte, por variações genéticas. O que torna necessário o adequado controle das variáveis que possam interferir essa análise genética, como os fatores ambientais e a idade avançada.
Assim, em função da possibilidade de fatores ambientais e genéticos influenciarem a HPE, e considerando a reduzida quantidade de estudos investigando variáveis genéticas com a HPE tanto na população mundial de jovens normotensos, como na brasileira, o presente estudo analisou especialmente a possível influência do polimorfismo I/D da ECA sobre a HPE de indivíduos jovens saudáveis. A hipótese do presente estudo foi que haveria influência dos diferentes genótipos sobre a HPE, com indivíduos II e DD apresentando, respectivamente, maior e menor resposta hipotensora pós-exercício.
2. OBJETIVOS
2.1. Objetivo Geral
Analisar a hipotensão pós-exercício (HPE) de duas sessões de corrida (máxima e submáxima) em homens jovens, normotensos e fisicamente ativos, bem como verificar a influência do polimorfismo de inserção/deleção (I/D) no gene da ECA sobre a HPE.
2.2. Objetivos Específicos
- Avaliar a aptidão aeróbia dos voluntários de acordo com os genótipos I/D do gene da ECA;
- Analisar, em função dos genótipos, possíveis diferenças nas variáveis de frequência cardíaca, duplo produto, lactatemia e percepção subjetiva de esforço entre as sessões experimentais;
- Examinar possíveis diferenças entre a HPE das sessões máxima e submáxima para toda a amostra;
- Investigar separadamente em cada grupo genotípico a ocorrência de HPE;
3. REFERENCIAL TEÓRICO
3.1. Pressão Arterial: Mecanismos regulatórios
O débito cardíaco (DC) e a resistência vascular periférica (RVP) são as duas principais variáveis fisiológicas associadas à regulação da pressão arterial (PA), sendo moduladas continuamente pela combinação de mecanismos neurais, hemodinâmicos e humorais (NAVAR, 2005), descritos sucintamente a seguir.
O centro vasomotor do tronco cerebral, localizado no terço inferior da ponte e dois terços superiores do bulbo, está associado ao controle imediato da PA, atuando sobre as funções vasoconstritoras e cardioaceleradoras do sistema nervoso simpático e inibindo (ou ativando) reciprocamente os sinais vagais parassimpáticos, proporcionando vasoconstrição arterial e venosa sistêmicas, resultando no aumento da pré-carga cardíaca, levando a batimentos cardíacos mais fortes e frequentes, e a um maior volume sistólico, com consequente aumento da PA (GUYTON e HALL, 1998).
O estímulo original aferente ao centro vasomotor, responsável pela ativação do mecanismo de controle da PA, é gerado pela ativação dos barorreceptores arteriais situados nas paredes do arco aórtico (barorreceptores aórticos) e dos seios carotídeos (barorreceptores carotídeos) a partir de alterações do estiramento da parede vascular determinada por variações da frequência e do volume de sangue ejetado pelo coração. A principal função dos barorreceptores é manter a PA estável, esteja o indivíduo em repouso ou desenvolvendo qualquer atividade em que haja alterações fisiológicas antagonistas à condição de homeostasia (HAIBARA e SANTOS, 2000, GUYTON e HALL, 1998).
emergência das raízes nervosas que inervam o coração. Estes indivíduos apresentam um controle instável da PA, principalmente em função da ausência da modulação simpática, sendo evidenciada, durante o exercício físico, baixa frequência cardíaca entre outras alterações, e consequente redução da RVP, que não é regulada pelo aumento no DC (CLAYDONet al., 2006).
Em condições fisiológicas a PA também é modulada por mecanismos de controle de longo prazo, fundamentais para sua regulação, entre eles a função renal e a liberação de renina na circulação. O controle renal sobre a liberação de renina ocorre, de maneira resumida, a partir de três vias: (1) detecção das alterações no fluxo de NaCl pela mácula densa renal (periglomerular); (2) variação da PA no vaso pré-glomerular e (3) ativação de receptores β -adrenérgicos pela noradrenalina das células justaglomerulares (BRUNTON, LAZO e PARKER, 2006).
As células renais justaglomerulares, estimuladas pela concentração do sódio, pela perda de volume plasmático ou por ativação simpática, liberam na circulação a enzima renina, que atua sobre o peptídeo angiotensinogênio inativo produzindo a angiotensina I, que, por sua vez, sofre a ação da enzima conversora de angiotensina (ECA), catalisando sua conversão em angiotensina II (AngII), uma importante substância vasoconstritora (SAYED-TABATABAEI
et al., 2006). A ativação da AngII proporciona maior liberação de aldosterona, hormônio esteróide sintetizado na zona glomerular do córtex das glândulas supra-renais, estimulando, nesse caso, os túbulos renais a reabsorverem mais sódio, potássio e água do filtrado glomerular e, consequentemente, aumentando a PA (GUYTON e HALL, 1998).
garantindo assim um adequado tônus vascular pela liberação de substâncias vasodilatadoras, como a bradicinina, que sinaliza às células endoteliais a liberarem mais óxido nítrico (NO), outra importante substância vasodilatadora (SCHMAIER, 2002; CUNHA, 2008, MOREIRA, 2009).
Alterações que promovam a hiperatividade da cascata de reações do SRAA e liberação aumentada de AngII, podem induzir à lesões no endotélio de vasos periféricos e glomerulares, e ainda promover tanto hipertensão arterial sistêmica (HAS) quanto glomerular (BREWSTER e PERAZELLA, 2004). Ainda, o aumento nas concentrações de AngII, bem como uma possível redução da biodisponibilidade da bradicinina, resultam em uma menor bioatividade de substâncias vasodilatadoras liberadas pelo endotélio, como o NO (SAYED-TABATABAEIet al., 2006).
Existem evidências que sugerem interação entre o NO, a AngII e os estímulos aferentes para o Sistema Nervoso Central visando controlar os níveis médios da atividade nervosa simpática. A menor bioatividade do NO em função dos níveis elevados de AngII pode causar uma excitação simpática aumentada, mesmo com estímulos aferentes normais dos barorreceptores. Desta forma, no caso de surgir lesões endoteliais decorrentes da maior atividade do SRAA, pode haver prejuízo na produção de agentes vasodilatadores, o que contribuirá ao aumento nos níveis pressóricos (RAMCHANDRAet al., 2005).
do tônus vascular ocorre a partir de quatro mecanismos, sendo: (1) vasodilatação endotélio-mediada pela indução do fluxo sanguíneo; (2) controle miogênico; (3) vasodilatação metabólica e (4) controle simpático (GIESLEN, SCHULER e ADAMS, 2010).
Ressalta-se que outras importantes substâncias também estão envolvidas na constante modulação da PA, as quais não foram descritas na presente revisão. Dentre estas, destaca-se o hormônio vasopressina, que comumente é reportado na literatura. Este hormônio é liberado na circulação em resposta à diminuição do volume plasmático (hipovolemia) ou devido ao aumento da osmolaridade plasmática, e tem como principal função a indução do aumento da constrição dos vasos sanguíneos pelos mecanismos supracitados (HOLMES et al., 2001; BALDASSOet al., 2007).
De maneira geral, todos os mecanismos neurais, hemodinâmicos e humorais atuam de maneira integrada a fim de manter os valores pressóricos em níveis homeostáticos (GUYTON e HALL, 1998; BRUNTON, LAZO e PARKER, 2006). No entanto, tanto fatores genético como ambientais podem influenciar nos níveis normais de PA, assim como o próprio processo de envelhecimento.
3.2. Pressão Arterial: Fatores Genéticos e Fatores Ambientais
insulina, consumo aumentado de álcool e sal e sedentarismo (AGARWAL, WILLIAMS e FISHER, 2005).
Os vários fatores genéticos e ambientais constituem fenótipos intermediários, onde a HAS pode ser entendida como um fenótipo final, e resultante desses diversos fenótipos intermediários (LIMA, HATAGIMA e SILVA, 2007).
Contudo, à parte os fatores genéticos e ambientais, o processo de envelhecimento do organismo também é considerado com um fator que também desencadeia disfunções na regulação da PA. Observa-se no ser humano, com o avançar da idade e independentemente do estilo de vida, degeneração do revestimento endotelial que resulta na menor liberação de substâncias vasodilatadoras e consequente decréscimo da função vascular. Desta forma, por ainda não ser possível interferir tanto nos fatores genéticos como no processo de senescência e sua ação sobre a PA, deve-se atuar sobre a influência negativa dos fatores ambientais com o intuito de manter uma boa função endotelial e retardar os efeitos fisiológicos deletérios deste processo de envelhecimento (TADDEIet al., 1997, BARAC e PANZA, 2009).
Nesse sentido, com o objetivo de reduzir a interferência da idade avançada e dos fatores ambientais negativos sobre a PA, e maximizar a análise da influência genética sobre a hipotensão pós-exercício (esse último será melhor descrito posteriormente), o presente estudo foi desenvolvido em jovens saudáveis, normotensos e fisicamente ativos, como será posteriormente descrito no capítulo 4, página 30.
3.2.1. Fatores Genéticos
Newton-Cheh (2010) atribuíram que a herdabilidade de valores elevados de PA, na verdade, possa variar de 50 a 60% na população.
Segundo Cowley (2006), centenas de fenótipos relacionados à PA e regiões genômicas foram mapeadas em humanos e ratos. No entanto, o número total de genes e alelos contribuindo com o fenótipo da PA elevada ainda continua desconhecido. A identificação de genes relacionados à hipertensão familiar segregando mendelianamente e mais recentemente os estudos de varredura genômica baseados em polimorfismos de uma única base tem oferecido importantes contribuições (BINDER, 2007), onde experimentos com organismo modelo e ratos sugerem a participação de pelo menos 10 ou mais genes para este fenótipo final (COWLEY, 2006).
Embora o efeito de muitos genes ainda não seja conhecido sobre a PA, alelos de muitos e diferentes genes são indicados por contribuir com a HAS, e os efeitos da combinação desses alelos podem ser diferentes entre os indivíduos. Até 2006 mais de 150 estudos de associação já haviam sido publicados sobre HAS e as observações de análise de ligação e estudo de associação tem consistentemente mostrado que o aumento na PA não é devido a uma variante genética simples (BINDER, 2007).
Em um estudo de revisão, Cowley (2006) relata que existem aproximadamente 26 genes candidatos que possam se associar à HAS, onde os principais cromossomos estudados e relacionados com a HAS são: 1, 2, 3, 17 e 18. Ainda, esse autor conclui que a base genética para a identificação dos valores elevados de PA não será rapidamente conhecida pela comunidade científica. Estudo de meta análise, com 34.433 indivíduos, identificou 14 genes candidatos à associação com a HAS, envolvendo os cromossomos 1, 3, 4, 10, 12, 15, 17 (ARORA e NEWTON-CHEH, 2010).
interferência de múltiplos alelos. Individualmente um gene pode ter pouca influência no fenótipo final, mas em associação podem ter efeito aditivo significativo. Inclusive, as mutações em diferentes sítios no mesmo gene também podem contribuir para aumentar a complexidade do entendimento do impacto dos genes sobre os fenótipos relacionados à PA.
O controle da PA é determinado por inúmeros fatores fisiológicos, como anteriormente descritos, sendo todos eles relacionados à função de diferentes genes. Nesse sentido, faz-se necessário descrever brevemente algumas características dessas variáveis regulatórias e suas associações com os seus mecanismos genéticos, além da associação de genes e polimorfismos com a hipertensão, uma vez que a seleção dos genes candidatos à investigação é feita pelo sistema fisiológico implicado na regulação da PA (BINDER, 2007).
O SRAA é um dos componentes da complexa rede que regula a PA. Seu papel na fisiopatologia da HAS tem sido extensamente estudado, bem como os genes que regulam a expressão de proteínas envolvidas nesse sistema, como a renina, o angiotensinogênio (AGT), a ECA e os receptores para AngII. Sabendo-se do papel fisiológico dessas proteínas fica claro que os genes relacionados a elas possam implicar na etiologia da HAS, e sendo os mais extensivamente estudados (LIMA, HATAGIMA e SILVA, 2007; AGARWAL, WILLIAMS e FISHER, 2005).
No entanto, alguns estudos de associação envolvendo caso controle e estudos de ligação não demonstraram uma relação dos polimorfismos do SRAA com a HAS bem definida. Há relatos de efeitos combinados de genótipos relacionados ao SRAA e a elevada prevalência de HAS, embora nenhum efeito individual de cada genótipo tenha sido detectado (LIMA, HATAGIMA e SILVA, 2007).
Os dois genes mais estudados quanto à associação com a hipertensão são o geneAGT
Polimorfismos no gene AGT foram os primeiros a serem relacionados com predisposição à HAS. A substuição de uma timina por uma citosina na posição 704, no exon 2 do geneAGT, ocasiona a substituição de um resíduo de metionina por um resíduo de treonina, no códon 235 (M235T). Em diferentes populações já foi observado que indivíduos homozigotos para o alelo mutante possuem níveis plasmáticos maiores de proteína AGT que os homozigotos para o alelo selvagem. O alelo mutado também pode apresentar uma variante da região promotora do gene AGT, substituição de adenina por guanina (A-6G). Essa alteração no promotor modifica a interação de fatores de transcrição com o promotor do gene
AGT, bem como o nível de expressão desse gene, aumentando a produção de AngII que, por sua vez, aumentaria os valores pressóricos (KOBASHI, 2006).
Outros grupos de fatores importantes no controle da PA são os genes relacionados aos adrenorreceptores, onde os principais receptores são: adrenorreceptorβ2, adrenorreceptorβ3, receptor D2 de dopamina e adrenorreceptorα2. Apesar de serem excelentes genes candidatos à hipertensão, poucos estudos em polimorfismos desses genes têm sido desenvolvidos. Com um número limitado de marcadores genéticos usados e devido, em parte, aos fenótipos intermediários, os artigos publicados não são consistentes para confirmar associação entre esses polimorfismos e o fenótipo final. Assim como os estudos genéticos de proteínas associadas com a funções vasculares (endotelina 1 e síntase endotelial de NO) também forneceram resultados contraditórios e inconclusivos (AGARWAL, WILLIAMS e FISHER, 2005).
Outra possibilidade de estudo é a combinação de polimorfismos de vários locos, pois assim é possível aumentar a probabilidade de associação com a hipertensão ou com fenótipos intermediários. Entretanto, estudos com múltiplos genes podem atuar epistaticamente, e necessariamente requerem populações numerosas já que o número de indivíduos amostrados diminui drasticamente com a combinação genotípica (AGARWAL, WILLIAMS e FISHER, 2005).
Observa-se que o uso de diferentes técnicas para o estudo genético da HAS tem aumentado nos últimos quinze anos. A expectativa é que a identificação das mutações possa estabelecer onde está a causa primária da anormalidade genética e com isso promover o ponto inicial que determina como a fisiologia normal é perdida para resultar na hipertensão (KRIEGER e PEREIRA, 2006), mesmo que ainda não se conheça o número exato de genes envolvidos na HAS, seu modo de transmissão, seu efeito quantitativo na PA e sua interação com outros genes e com os fatores ambientais.
O principal obstáculo para identificar as variantes genéticas relevantes é a etiologia heterogênea da hipertensão, onde muitos estudos podem subestimar o impacto desses genes, uma vez que os padrões ambientais, como a obesidade e o uso excessivo de sal, também podem ser modulados por fatores genéticos (KRIEGER e PEREIRA, 2006).
Apesar do conhecimento sobre a genética da hipertensão ainda não ter aspectos conclusivos, o componente genético é determinante tanto nos fenótipos intermediários quanto no fenótipo final. Nesse sentido, por ser uma característica determinada por genes é importante entender o processo de seleção natural que contribuiu para o estabelecimento e fixação de um genoma que favoreceu a HAS.
Segundo este autor, populações de ambientes quentes e úmidos são mais suscetíveis à HAS do que àquelas de ambientes frios. Evidências sugerem que a suscetibilidade genética à HAS foi ampliada frente ao processo evolutivo, pois a propensão a reter sal e água podem ser características favoráveis em ambientes antigos, onde a perda de calor, fundamental em ambientes quentes, ocorre pelo suor. No entanto, ao perder grandes quantidades de água e sal, ocorre hipovolemia e decréscimo na capacidade de dissipar calor. Assim, os indivíduos geneticamente adaptados ao grande apetite por sal e ao aumento da conservação renal de sódio eram mais bem adaptados evolutivamente ao ambiente quente.
3.2.1.1. Gene ECA
De acordo com o Centro Nacional de Informações sobre Biotecnologia (NCBI), este gene chamado ECA codifica uma enzima (ECA) que catalisa a conversão da angiotensina I em um peptídeo fisiologicamente ativo, a angiotensina II (AngII), bem como inativa o metabólito bradicinina (figura 1).
O gene da ECA está localizado no braço longo do cromossomo 17 (17q23) doHomo sapiens, possuindo 21 kilo bases (kb) de comprimento e sendo composto por 26 exons e 25 introns (figura 2). Ainda, de acordo com o NCBI, estão listados mais de 160 polimorfismos no gene ECA, a maioria são polimorfismos de uma única base (SNPs). No entanto, um dos polimorfismos mais estudados nesse gene é a inserção (I) ou deleção (D) de uma sequência
ALUde 287 pares de bases nitrogenadas (I/D) no intron 16 (figura 2).
Figura 2.Estrutura do geneECA, bem como a localização do polimorfismo I/D. Adaptado de Sayed-Tabatabaeiet al. (2006).
No Brasil, estima-se que a frequência genotípica dessa mutação, entre as regiões brasileiras, seja de 20% para homozigotos II, 43% para heterozigotos ID e de 37% para homozigotos DD, com exceção à região Sul, onde a frequência de homozigotos DD foi maior (54%) (INACIO, FILHO e VIEIRA, 2004). Essas frequências foram semelhantes às encontradas por Leite (2008) a partir de uma pesquisa realizada em mulheres idosas do Distrito Federal.
Inúmeros estudos de associação entre o polimorfismo I/D do gene ECA e fenótipos diversos foram desenvolvidos ao longo dos anos. Em revisão publicada por Binder (2007), nota-se que estudos mais antigos já haviam associado níveis elevados da ECA em pacientes com problemas cardíacos, além de organismos modelo terem demonstrado que o gene ECA
com a disfunção endotelial no estágio precoce da HAS (PENESOVAet al., 2006). Resultados conflitantes foram publicados confirmando a associação da variante polimórfica da ECA com HAS, onde dois estudos de meta-análise não foram adequados para descrever uma associação independente do polimorfismo I/D do geneECAcom a HAS (BINDER, 2007).
Os estudos nem sempre confirmam a associação primária de mutações no gene ECA
com predisposição à HAS, mas evidenciam o envolvimento de forma secundária no mecanismo, dependendo do componente genético individual (AGARWAL, WILLIAMS e FISHER, 2005). Segundo Sayed-Tabatabaeiet al.(2006) o genótipo homozigoto para DD (ou mesmo a presença do alelo D) acarreta em acréscimos de ECA circulantes, o que aumentaria a vasoconstrição (ativando a AngII) e a redução da vasodilatação pela inibição da bradicinina (ver figura 1), e podendo ocasionar aumentos da PA. Isso nos remete a uma hipótese de menor ou nenhuma hipotensão pós-exercício (como será abordado posteriormente) em indivíduos homozigotos DD. Estudo desenvolvido na década de 90 verificou que o nível de atividade da ECA apresentava-se em dobro nos indivíduos homozigotos DD em relação aos homozigotos II, permanecendo os sujeitos com genótipo ID com níveis intermediários de atividade da ECA (RIGATet al., 1990).
De acordo com os resultados de Ergen et al.(2004), indivíduos diabéticos com e sem nefropatia apresentam maiores quantidades de alelos D para o polimorfismo I/D da ECA. Também há tendência de associação entre o alelo D do polimorfismo I/D com a HAS, não havendo com a obesidade em mulheres coreanas (KIM, 2009). Esse mesmo estudo evidenciou associação entre o genótipo DD com valores elevados de colesterol total e LDL-colesterol.
entanto, em um estudo realizado em 2006 demonstrou-se que o polimorfismo I/D obteve pouca influência no desempenho físico de adolescentes esportistas (MORANet al., 2006).
Parte das pesquisas não demonstram associação entre o polimorfismo I/D do gene
ECA com a aptidão aeróbia (RANKINEN et al., 2000; DAY et al., 2007; LEITE, 2008), sendo que outros relatam associação desse fenótipo com o genótipo homozigoto II, ou pelo menos com o alelo I (HAGBERG et al., 1998; HAGBERG et al., 2002; COLLINS et al., 2004) ou com o genótipo homozigoto DD (ZHAOet al., 2003; CAMet al., 2005).
De maneira geral, espera-se que haja influência do genótipo homozigoto II na determinação de valores mais elevados de aptidão aeróbia, uma vez que esses indivíduos apresentam um maior percentual de fibras do tipo 1, contrariamente aos indivíduos homozigotos DD que apresentam mais fibras do tipo 2b (ZHANG et al., 2003). No entanto, em estudo avaliando força em membros inferiores não se verificou associação entre o polimorfismo I/D e esse fenótipo (TOBINAet al., 2006), contrariamente a nove semanas de treinamento isométrico, que proporcionou maiores ganhos de força para os indivíduos que possuíam o alelo D (FOLLANDet al., 2000).
3.2.2. Fatores Ambientais
A atual epidemia mundial de HAS possivelmente esteja relacionada ao estilo de vida do período moderno, onde são evidenciados alta ingestão de sal, sedentarismo, entre outros fatores ambientais negativos, bem como a interação dessas variáveis com a suscetibilidade ancestral (YOUNG, 2007).
A HAS é relatada na literatura como um dos principais fatores de risco associados às doenças cardiovasculares, sendo que a sua prevalência em algumas regiões do Brasil alcança valores de aproximadamente 40% da população (YUNIS e KROB, 1998). Segundo Pescatello
et al. (2004), os valores de PA podem ser a classificados de acordo com a tabela 1.
Segundo Hamer e Boutcher (2006) e Halliwill (2001), a alimentação e a composição corporal, bem como o nível de condicionamento cardiovascular e de exercício físico são variáveis relevantes na modulação crônica da PA.
associando-se a um possível aumento do risco de doenças cardiovasculares (GUEDES e GUEDES, 2001). Assim, em função do exposto, os fatores ambientais podem de certa forma, interferir na manutenção do tônus vascular, que está diretamente associada à regulação da PA. Por fim, por influência de fatores genéticos, ambientais e do envelhecimento, observam-se alterações nas características funcionais das fibras elásticas e colágenas da parede arterial. Assim, entende-se que os fatores supracitados associam-se à HAS em função do estreitamento do lúmen vascular decorrente do remodelamento eutrófico (RIZZONI e AGABITI-ROSEI, 2001).
3.2.2.1. Exercício Físico
Os mecanismos fisiológicos envolvidos nos sistemas de controle biológico da PA atuam, quer no intuito de mantê-la em situação de homeostasia, quer a fim de proporcionar ao organismo um estado estável durante situações de estresse, como durante o exercício físico (POWERS e HOWLEY, 2005), embora seja intensidade/volume-dependente.
O exercício físico se caracteriza pela quebra da homeostasia, onde inúmeras adaptações fisiológicas são necessárias para o funcionamento orgânico nestas condições, inclusive adaptações cardiovasculares como os aumentos da frequência cardíaca, do volume sistólico, do DC e da PA sistólica, bem como a redução da RVP, principalmente durante exercícios com intensidades retangulares. No entanto, a magnitude destas alterações depende do tipo de exercício e do seu volume e intensidade, e até mesmo da quantidade de massa muscular envolvida (BRUMet al., 2004).
decorrentes de ajustes autonômicas e hemodinâmicas (MONTEIRO e SOBRAL FILHO, 2004).
De maneira geral, exercícios realizados em intensidades próximas ao limiar anaeróbio proporcionam reduções dos níveis glicêmicos em pessoas diabéticas do tipo 2, sendo este um importante método para o controle dodiabetes mellitose de suas patologias correlatas, como a HAS (HIYANE, 2006). Ainda, após a realização de um exercício também se observa um consumo aumentado de oxigênio em relação ao repouso (excesso de consumo de oxigênio pós-exercício - EPOC) que resulta em aceleração metabólica e consequente controle da composição corporal (ROBERGS e ROBERTS, 2002) em função do aumento na oxidação de gordura (BINZEN, SWAN e MANORE, 2001), sendo também verificada uma redução da PA, conhecida como hipotensão arterial pós-exercício, que é considerada uma importante ferramenta para o controle da PA e de suas patologias, como a HAS (MOTAet al., 2009).
Assim, o exercício físico regular promove alterações fisiológicas que auxiliam no tratamento/prevenção de diferentes quadros clínico, como a melhora do controle glicêmico (CAMBRI e SANTOS, 2006), a redução do peso corpóreo (ROBERGS e ROBERTS, 2002) e um melhor controle da PA de repouso (MOTA, 2010). Ainda, segundo Gielen, Schuler e Adams (2010), o treinamento físico promove importantes efeitos vasculares, tais como menor rigidez e maior complacência aórtica, aumentos na vasodilatação endotelial, na produção de NO e na formação de capilares.
3.3. Hipotensão Arterial Pós-Exercício (HPE)
importante recurso não farmacológico para o tratamento da HAS (CUNHA et al., 2006; MOTA, 2006), uma vez que a realização de uma única sessão de exercício físico resulta em um efeito hipotensor que pode perdurar por até 23 horas pós-exercício quando comparado ao dia controle sem exercício físico (MACDONALD, 2002).
O efeito hipotensor provocado pelo exercício físico possivelmente possa contribuir para um melhor controle da PA de indivíduos que apresentam PA sistólica (PAS) igual ou maior a 140 mmHg e PA diastólica (PAD) igual ou maior a 90 mmHg, uma vez que são considerados hipertensos e estão sob alto risco de doenças coronárias, renais e acidente vascular cerebral (MESSERLI et al., 2007). Segundo Pescatello et al. (2004), reduções nos valores de PAS são capazes de diminuir a incidência de doenças coronarianas, acidente vascular cerebral e mortalidade na população de uma maneira geral.
Inúmeros mecanismos estão associados ao fenômeno da HPE, alterando tanto o DC quanto a RVP. A redução do volume sanguíneo e da ativação do sistema nervoso simpático eferente, bem como a ativação aferente de ergoreceptores (dos músculos esquelético e cardíaco), as reduções na produção de vasopressina, noradrenalina, renina e AngII, e os aumentos nas liberações de adenosina, lactato sanguíneo e potássio, bem como das concentrações de NO podem estar associados à HPE (GUYTON e HALL, 1998; FORJAZet al., 2000; HALLIWILL, 2001; MACDONALD, 2002; LATERZAet al., 2007).
A inibição na liberação de substâncias endógenas vasodilatadoras também foi investigada durante a HPE. A manutenção da vasodilatação periférica após um exercício dinâmico com intensidade moderada foi resistente ao bloqueioα-adrenérgico e à inibição da síntase endotelial de NO em jovens saudáveis e normotensos (HALLIWILL, MINSON e JOYNER, 2000).
De maneira geral, aproximadamente 30% do aumento na condução vascular sistêmica observada após uma sessão de exercício pode estar relacionada aos leitos vasculares dos músculos esqueléticos. Contudo, a contribuição de outros leitos, tais como cerebral, renal, visceral e cutâneo também podem contribuir para o aumento na condução vascular sistêmica durante a HPE (PRICHERet al., 2004).
Williamson, McColl e Mathews (2004) observaram reduções no fluxo sanguíneo de regiões cerebrais corticais após exercício, as quais se relacionam a regulação cardiovascular durante o exercício, e podendo também, estar envolvidas na HPE. O decréscimo no fluxo sanguíneo na região cerebral do córtex insular e na atividade talâmica nos primeiros 30 minutos de HPE, podem ser importantes fatores neurais que contribuem para o início da HPE (WILLIAMSONet al., 2009). Ainda, segundo Kajekar et al. (2002) a HPE também pode se associar à maior sinalização de neurotransmissores gabaégicos (GABA) para neurônios de atividade simpática localizados na região medular.
Estudo publicado em 2004 demonstrou que uma hora após exercício realizado a 60% do VO2pico resultou em HPE, ocorrendo uma condução vascular sistêmica aumentada em
temperatura interna e modificações transitórias na condução vascular cutânea no período pós-exercício, estes não parecem desempenhar um papel obrigatório na mediação da HPE em condições termoneutras (WILKINS, MINSON e HALLIWILL, 2004). Em complemento, a HPE não foi inteiramente relacionada com a desidratação do corpo ou redução do volume plasmático em estudo realizado com ultramaratonistas (HOLTZHAUSEN e NOAKES, 1995). Os inúmeros estudos ressaltam quanto à impossibilidade de afirmar que apenas um desses mecanismos supracitados seja o responsável pela HPE, principalmente em função da complexidade referente à modulação da PA (YOUNG, 2007), assim a HPE parece ser provavelmente de origem multifatorial (HOLTZHAUSEN e NOAKES, 1995). Nesse sentido, tanto fatores genéticos quanto ambientais devem ser considerados e podem influenciar a HPE (como abordado anteriormente), bem como o emprego de diferentes metodologias pode resultar diferenças quanto à magnitude e a duração da HPE.
3.3.1. HPE e Aspectos Metodológicos
A HPE é estudada a partir da aferição da PA em um dado período de tempo, que pode variar de cinco a 420 minutos (CLAYDON et al., 2006; MOTA, 2006; respectivamente), ou mesmo até 24 horas (GALETTAet al., 2006) após a realização da atividade.
monitorização ambulatorial da pressão arterial (MAPA), que registra os níveis de PA durante 24 horas enquanto os indivíduos realizam suas atividades diárias.
A MAPA tem demonstrado boa correlação com a estimativa de danos em órgãos-alvo, inclusive sendo reprodutível após a realização de exercícios físicos (LEHMKUHL et al., 2005). Contudo, a relevância dos outros métodos indiretos para a avaliação da HPE deve ser considerada, mesmo por um período de tempo menor e controlado, uma vez que são facilmente aplicáveis e parecem ser suficientemente sensíveis para estimar o stress
cardiovascular mesmo em diferentes intensidades, como àquelas aplicadas em exercícios resistidos (POLITO e FARINATTI, 2006).
Outras variáveis que possam influenciar a HPE também são estudadas, como o horário em que o exercício é realizado (JONESet al., 2008; JONES et al., 2009), a posição em que o indivíduo permanece durante a avaliação da PA após o exercício (RAINE et al., 2001), o EPOC (WILLIAMS, PRICHER e HALLIWILL, 2005), o nível de condicionamento físico e o gênero (SENITKO, CHARKOUDIAN e HALLIWILL, 2002), o período do ciclo menstrual (ESFORMES et al., 2006) e a utilização de métodos contraceptívos (BIRCH, CABLE e GEORGE, 2002), a utilização de recursos ergogênicos, como a administração de cafeína (NOTARIUS, MORRIS e FLORAS, 2006), e a inibição de substâncias vasodilatadoras, como a síntase endotelial de NO (HALLIWILL, MINSON e JOYNER, 2000).
Parece que exercícios realizados em esteira ergométrica são mais eficazes que exercícios realizados em bicicleta ergométrica, induzindo maior HPE em indivíduos normotensos (LIZARDO et al., 2007; DUTRA et al., 2008). No entanto, de acordo com os resultados de Almeida et al. (2010) conclui-se que o cicloergômetro de braço pode ser tão efetivo quanto a bicicleta ergométrica em promover reduções da PA no período pós-exercício em indivíduos normotensos. Assim como em sujeitos com hipertensão limítrofe, onde a massa do músculo exercitado não afetou diretamente a magnitude da HPE, embora possa influenciar a duração dessa resposta (MACDDONALD, MACDOUGALL e HOGBEN, 2000).
De acordo com os resultados de Forjaz et al. (1998) e Machet al. (2005), exercícios de maior duração proporcionam melhor HPE, obtendo maior magnitude e queda mais prolongada na PA. No entanto, em estudo de revisão sobre hipotensão pós-exercício aeróbio, relatou-se não ser possível afirmar de maneira categórica que a duração do exercício físico modula a magnitude e a duração da HPE em função dos resultados contraditórios encontrados na literatura (CASONATTO e POLITO, 2009).
Com relação à intensidade do exercício, Forjaz et al. (1998b) não encontraram HPE em diferentes intensidades de exercício em indivíduos normotensos. Ainda, segundo Lizardo
et al. (2007), as intensidades de exercício empregadas em seu estudo não pareceram exercer influência na HPE realizado em esteira ergométrica e em cicloergômetro. Contudo, Hagberg
complicações secundárias à patologia, uma vez que os exercícios mais intensos normalmente geram maior sobrecarga cardiovascular e podem proporcionar maiores riscos para essas populações (VALLEet al., 2006).
Ainda com relação ao volume e intensidade do exercício, de acordo com estudo recente, a HPE pareceu clinicamente semelhante após exercício de alta intensidade e curta duração quando comparado ao exercício de moderada intensidade e maior duração, tendo ambos os exercícios uma mesma carga total de trabalho (JONES et al., 2007).
Segundo Pescatello e Kulikowich (2001), indivíduos com valores mais elevados de PA pré-exercício obtiveram maiores reduções de PA após o exercício. Forjaz et al. (2000) também verificaram maior HPE nos indivíduos (normotensos e hipertensos) com níveis de PA pré-exercício mais elevados.
Assim, o valor de PA de repouso parece ser um importe preditor para a cinética da PA após a realização do exercício, onde a magnitude da HPE parece ser inversamente proporcional ao valor de repouso. Contudo, Atkinson, Cable e George (2005) embora concordem que essa “predição” possa ser verdadeira, ressaltam que considerar apenas uma análise de regressão entre PA pré-exercício e delta de variação (PA pós-exercíciomenos PA de repouso) possa ser problemático para essa análise, devendo haver uma relação fisiológica real entre si.
PA (COWLEY, 2006), podemos destacar os polimorfismos relacionados ao SRAA, como as mutações nos genes que expressão o receptor do tipo 1 da AngII (AT1R), a síntese de
aldosterona (Int2) e a ECA (BLANCHARDet al., 2006).
3.3.2. Relação entre HPE e Polimorfismo I/D do gene da ECA
Resumidamente, poucos estudos associaram o polimorfismo I/D do gene da ECA com a hipotensão pós-exercício (BLANCHARD et al., 2006; PESCATELLO et al., 2007; CUNHA, 2008; MOREIRA, 2009; MOTA, 2010; SANTANA, 2010), sendo esses quatro últimos desenvolvidos em nossos laboratórios. Ainda, observa-se poucos estudos avaliando a HPE a partir de exercícios físicos realizados em condições não laboratoriais (HOLTZHAUSEN e NOAKES, 1995; DUJICet al., 2006), tampouco relacionando a HPE em testes de campo com o polimorfismo I/D do gene da ECA.
Blanchardet al.(2006), ao estudar a associação do polimorfismo I/D do gene da ECA com a hipotensão exercício, encontraram diferenças entre os valores pressóricos pós-exercício dos grupos DD e II/ID. Ainda, Pescatelloet al.(2007) reforçaram que a HPE possa ser modulada pelas interações entre ingestão dietética de cálcio, intensidade do exercício e polimorfismos no SRAA. Segundo Moreira (2009), o grupo carreador do genótipo DD obteve menor benefício do exercício em atenuar a elevação da PA.
ECA, não havendo associação entre HPE e os genótipos de I/D do gene da ECA (MOTA, 2010).
Como abordado, o genótipo DD acarreta em acréscimos de ECA circulantes, o que pode ocasionar aumentos da PA pela inibição da bradicinina e ativação de AngII (SAYED-TABATABAEIet al., 2006). Nesse sentido, Tanriverdiet al.(2005) encontraram maior fluxo sanguíneo pela dilatação endotélio-dependente em atletas com genótipo II, possivelmente pela maior concentração de bradicinina e bio-atividade do NO. Segundo Santana (2010), voluntarias carreadores do alelo I apresentaram maiores respostas endoteliais de liberação de NO após exercício máximo e submáximo, contrariamente ao genótipo DD.
Em adicional, sabe-se que a maioria dos indivíduos diabéticos possui valores aumentados de PA, podendo se associar aos baixos valores de bradicinina, entre outros. De acordo com os resultados de Ergen et al.(2004), indivíduos diabéticos com e sem nefropatia apresentavam maiores quantidades de alelos D para o polimorfismo I/D no gene da ECA.
Taguchiet al. (2000) verificaram que diabéticos tipo 2 não controlados apresentaram elevadas quantidades de insulina pós-exercício (semelhante aos não diabéticos), porém a quantidade de bradicinina encontrada foi muito baixa em relação aos não diabéticos, nos remetendo a idéia de que os diabéticos possam apresentar maior frequência de alelo D para o polimorfismo I/D do gene da ECA, o que influencia tanto a captação de glicose pelo tecido alvo quanto a dilatação endotélio-dependente, e possivelmente a HPE.
4. MATERIAIS E MÉTODOS
Previamente ao inicio das coletas dos dados, o presente estudo foi submetido ao Comitê de Ética e Pesquisa em Seres Humanos da Universidade Católica de Brasília (CEP-UCB) que avaliou e aprovou a metodologia a ser aplicada, conforme o parecer de número 45/2008 (Anexo 1). A pesquisa caracterizou-se como descritiva e de corte transversal, a partir da realização de quatro testes de esforço para cada participante.
4.1. Amostra
Para que pudéssemos incluir ou excluir os voluntários do estudo, alguns critérios iniciais foram adotados. Caso o voluntário fosse enquadrado em todos os itens listados abaixo, automaticamente este era incluído no estudo:
a) Ser homem, fisicamente ativo (no mínimo três meses de prática regular) e com faixa etária de 18 e 30 anos (a fim de minimizar possíveis efeitos deletérios do envelhecimento);
b) Apresentar o termo de consentimento livre e esclarecido assinado; c) Ser normotenso;
d) Não relatar possuir alterações endócrinas, cardiovasculares, ortopédicas e/ou neurológicas previamente diagnosticadas;
e) Não ser tabagista e não ser usuário de recursos ergogênicos ou drogas que afetassem a PA em repouso, durante o exercício e após o exercício.
prática regular mínima em pelo menos uma dessas atividades era de três vezes semanais, sendo iniciada há pelo menos três meses dos testes.
Desses 90 voluntários, apenas 62 concluíram todos os testes. Os demais, por eventualidades diversas, não realizaram todos os testes e por essa razão os seus resultados não foram incluídos no presente estudo, configurando assim, uma amostra final de 62 voluntários (Esquema 1). Complementarmente, como 10 dos 62 voluntários eram atletas, as variáveis de aptidão aeróbia dos voluntários foram subdivididas entre os indivíduos fisicamente ativos e os atletas (Tabela 5a) para melhor caracterizá-los, sendo posteriormente agrupados na Tabela 5b.
4.2. Desenho Experimental e Procedimentos
Os testes foram realizados no Laboratório de Avaliação Física e Treinamento (LAFIT) e na pista de atletismo, ambos localizados no Campus de Taguatinga da UCB. O laboratório possui, além de profissionais capacitados na área de Educação Física, um médico cardiologista e infra-estrutura apropriada para a realização de pesquisas envolvendo exercício físico em seres humanos, contendo: aparelho de eletrocardiograma, esfigmomanômetros e estetoscópios, medicamentos para possíveis emergências, bem como desfibrilador, além de equipamento ergoespirométrico, frequencímetros, medidores automáticos de PA entre outros. Quanto à pista de atletismo, situa-se a menos de 100 metros do referido laboratório o que facilitou o deslocamento dos voluntários ao LAFIT após o termino dos testes realizados em pista.
experimentais em dias distintos e em um mesmo período do dia (matutino ou vespertino; de forma randomizada), e com intervalos de no mínimo 72 horas entre as sessões de exercício.
Esses protocolos foram compostos por dois testes máximos, um teste submáximo e uma sessão controle sem exercício. Após a realização dos testes houve aferição da PA durante um período de 60 minutos, com exceção ao teste incremental realizado em esteira ergométrica (Esquema 1). Os testes e as coletas serão descritos com maiores detalhes a seguir.
Esquema 1.Representação visual da organização e realização do estudo nas suas diferentes fases após aprovação do CEP-UCB.
4.2.1. Medidas Antropométricas
As medidas de peso corporal (PC) e estatura (ES) foram obtidas por uma balança mecânica de marca Welmy (modelo 110 adulto). O índice de massa corpórea (IMC) foi obtido pelos resultados dessas duas medidas a partir do seguinte cálculo: PC/ES2, em quilogramas e metros respectivamente. As dobras cutâneas foram realizadas utilizando-se um adipômetro de marca Lange (escala de 0-60 mm e resolução de 1 mm). Após a realização das medidas foi calculado o peso gordo a partir da densidade corporal obtida pela equação de predição de sete dobras de Jackson e Pollock (1978). As características biométricas dos participantes estão descritas na tabela 2.
4.2.2. Sessões de Exercícios
Os voluntários foram orientados a realizar o desjejum com pelo menos duas horas de antecedência dos testes e a não realizar exercício físico intenso, ingestão de álcool e cafeína, bem como alimentar-se normalmente (evitando o excesso de ingestão calórica) e a manter o padrão de sono durante as 48 horas que antecederam as sessões de exercício.
médios de repouso destas variáveis. Este período foi denominado como pré-exercício (repouso).
4.2.2.1. Teste Incremental
Os voluntários foram submetidos, no LAFIT, a um teste ergoespirométrico incremental em esteira ergométrica (Imbramed Millenium Super ATL, Porto Alegre, Brasil) a partir de um protocolo rampeado.
O teste consistiu-se por uma velocidade inicial de 6,0km.h-1, inclinação fixa em 1% e cargas crescentes de 0,75km.h.min-1até a exaustão voluntária máxima do participante. Foram adotados como critérios de exaustão a percepção subjetiva de esforço (PSE) acima de 17 na escala de Borg, razão de trocas respiratórias (R) acima de 1.1, e/ou valores de frequência cardíaca (FC) acima de 95% da máxima prevista para a idade.
A análise de gases foi obtida respiração a respiração pelo analisador de gases Cortex Metalyzer 3B (Leipzig, Alemanha), sendo que os maiores valores registrados de volume de oxigênio (VO2) durante os 20 segundos finais do teste foram considerados para a
determinação do volume máximo de oxigênio consumido (VO2máx) de cada participante. O
equipamento era calibrado antes de cada teste, valendo-se de amostras conhecidas de O2 e de
dióxido de carbono, onde também foi calibrado o fluxo com uma seringa de 3L.
4.2.2.2. Teste de Performance em 1600 metros (máximo)
lactatemia de repouso. Posteriormente, os voluntários se deslocaram à pista de atletismo e realizaram um aquecimento de cinco minutos.
Os participantes correram a distância fixa de 1600 metros no menor tempo possível (T1600), sendo esse tempo usado para o cálculo da velocidade média (Vm), em m.min-1 (performance), bem como para a determinação indireta da capacidade aeróbia (limiar anaeróbio indireto obtido pela equação proposta por Soteroet al., 2009). A partir do teste foi possível obter outras variáveis, tais como a FC máxima alcançada no teste, a PSE máxima e a [lac] pico, bem como os valores pressóricos no primeiro minuto após o teste. Imediatamente ao término desta aferição de PA, os voluntários retornaram ao LAFIT, onde se iniciava a contagem de 60 minutos de repouso na posição sentada, com aferição constante da PA para avaliação da hipotensão pós-exercício máximo, conforme a representação gráfica do Esquema 2.
4.2.2.3. Teste submáximo de 20 minutos
Os voluntários realizaram os mesmos procedimentos iniciais do T1600 e se deslocaram para a pista de atletismo. Os participantes realizaram, após o aquecimento, um teste de corrida submáximo composto por uma intensidade de exercício equivalente a 75-80% da FC de reserva (FCres) e duração de 20 minutos (T20) (Esquema 3), semelhante a metodologia empregada por Mota (2006) em esteira ergométrica. Como auxílio no controle da intensidade os voluntários utilizaram um frequencímetro de marca Polar (Polar Sport Tester), onde mantiveram a FC entre a zona alvo pré-calculada. A identificação dessa FC alvo (75-80% da FCres) foi obtida pelo cálculo da seguinte equação:
75-80% FC reserva = (FC reserva x 75-80%) + FC de repouso Onde:
FC reserva = FC máxima – FC repouso.
4.2.2.4. Sessão controle sem exercício
A sessão controle (SC) foi aplicada a fim de verificar a cinética da PA após um determinado período sem exercício, para contatar, ou não, que a hipotensão após o exercício físico estava realmente relacionada a este último. Desta maneira, a SC foi conduzida com um período pré-exercício de 20 minutos para determinação da PA de repouso, mais 20 minutos permanecendo na posição sentada (simulando o tempo total de deslocamentos entre LAFIT -pista de atletismo - LAFIT, e tempo dos demais testes), e outros 60 minutos utilizados para a análise da ocorrência de HPE (Esquema 4).
Esquema 4.Representação visual da SC, incluindo as variáveis e os momentos de suas coletas.
4.2.3. Aferições da Pressão Arterial
coração. A cada cinco minutos durante os 20 minutos de repouso pré-exercício e após a realização das sessões T1600, S20 e SC foram feitos os registrados dos valores de PA sistólica (PAS), PA diastólica (PAD) e a PA média (PAM). No presente estudo foi utilizada a média dos valores obtidos em repouso (Rep) para a PAS, PAD e PAM, bem como os valores aferidos a cada 15min durante o período de 60min após as sessões (Rec0, Rec15, Rec30, Rec45 e Rec60). A PAM foi obtida pela seguinte fórmula: PAM = PAD + [(PAS - PAD) / 3].
4.2.4. Mensurações de outras variáveis
A frequência cardíaca (FC) foi registrada nos mesmos momentos em que a aferição da PA foi conduzida durante todas as sessões do estudo. A FC foi obtida por um monitor de FC de marca Polar (Polar Sport Tester). Ainda, durante o T20 a FC foi continuamente monitorada a fim de garantir a manutenção da FC na zona alvo pré-calculada (75 a 80% da FCres). Para tal, a zona alvo de FC foi exposta previamente ao voluntário que a monitorava constantemente pelo relógio e nos informava, a cada volta realizada na pista de atletismo, os valores de FC. O participante foi orientado a aumentar ou diminuir a velocidade de corrida a fim de permanecer na zona alvo pré-calculada.
A partir da determinação da PAS e da FC o duplo produto (DP) foi calculado pela multiplicação desses dois valores, sendo utilizado os mesmos momentos empregados pelos valores pressóricos e de FC.
A amostra sanguínea foi obtida pelo lóbulo da orelha após anti-sepsia com álcool e algodão, e uma punção utilizando-se luvas cirúrgicas e lancetas descartáveis (figura 3). As amostras de 25μL de sangue foram então coletadas utilizando-se de capilares de vidro heparinizados e calibrados, e depositadas em microtubos “Eppendorf” contendo 50μL de fluoreto de sódio (NaF 1%) conforme metodologia descrita por Simões et al. (2003), a qual promove hemólise e interrupção na produção de lac. As dosagens das amostras foram realizadas a partir do método eletroenzimático, pelo analisador YSI 2700 SELECT.
Figura 3.Exemplificação da realização da coleta de 25μL de sangue arterial do lobo da orelha.
4.2.5. Amostra biológica e extração de DNA
Com objetivos éticos, os sujeitos autorizaram o armazenamento das amostras biológicas coletadas, sob a guarda do pesquisador, no laboratório de Biotecnologia e no LAFIT da UCB. Também permitiram que a extração de seu DNA fosse realizada somente para a posterior genotipagem quanto ao polimorfismo I/D do gene da ECA, bem como para a análise de outras variantes polimórficas relacionadas àperformancee regulação da PA.