UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE FITOTECNIA CURSO DE AGRONOMIA
RHANNALDY BENÍCIO REBOUÇAS
Cactodera cacti (NEMATODA: HETERODERIDAE): OCORRÊNCIA NATURAL EM MANDACARU (Cereus jamacaru DC.) NO CEARÁ E INVESTIGAÇÃO DE
HOSPEDEIRAS EM CACTÁCEAS E HORTALIÇAS
RHANNALDY BENÍCIO REBOUÇAS
Cactodera cacti (NEMATODA: HETERODERIDAE): OCORRÊNCIA NATURAL EM
MANDACARU (Cereus jamacaru DC.) NO CEARÁ E INVESTIGAÇÃO DE
HOSPEDEIRAS EM CACTÁCEAS E HORTALIÇAS
Monografia apresentada ao Curso de Agronomia do Centro de Ciências Agrárias da Universidade Federal do Ceará, como requisito parcial à obtenção do titulo de Bacharel em Agronomia.
Orientadora: Profª. D.Sc Carmem Dolores Gonzaga dos Santos
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
R242c Rebouças, Rhannaldy Benício.
Cactodera cacti (Nematoda: Heteroderidae) : ocorrência natural em mandacaru (Cereus jamacaru DC.) no Ceará e investigação de hospedeiras em cactáceas e hortaliças / Rhannaldy Benício Rebouças. – 2017.
68 f. : il. color.
Trabalho de Conclusão de Curso (graduação) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Curso de Agronomia, Fortaleza, 2017.
Orientação: Profa. Dra. Carmem Dolores Gonzaga dos Santos.
1. Heteroderídeo de cactáceas. 2. Fitonematoide. 3. Ocorrência natural. I. Título.
RHANNALDY BENÍCIO REBOUÇAS
Cactodera cacti (NEMATODA: HETERODERIDAE): OCORRÊNCIA NATURAL EM
MANDACARU (Cereus jamacaru DC.) NO CEARÁ E INVESTIGAÇÃO DE
HOSPEDEIRAS EM CACTÁCEAS E HORTALIÇAS
Monografia apresentada ao Curso de Agronomia do Centro de Ciências Agrárias da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Bacharel em Agronomia.
Área de concentração: Fitossanidade, Nematologia.
Aprovada em: ___/___/______.
BANCA EXAMINADORA
________________________________________ Profª. Dra. Carmem Dolores Gonzaga Santos (Orientadora)
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Cristiano Souza Lima
Universidade Federal do Ceará (UFC)
_________________________________________ MSc. Francisco Leandro de Paula Neto
AGRADECIMENTOS
Agradeço primeiramente a DEUS pelo dom da vida e por ter me dado saúde e força para superar as dificuldades.
Ao meu pai Francisco Rebouças e à minha mãe Marlene Benício, pelo amor incondicional, amizade, conselhos e total apoio em todas as decisões e momentos da minha vida.
À Universidade Federal do Ceará que por meio dos professores do curso de Agronomia obtive a formação acadêmica de qualidade.
À Universidade Federal Rural da Amazônia onde tive o prazer de conhecer a Agronomia pela primeira vez.
Ao Profª. Dra. Carmem Dolores Gonzaga Santos, pela excelente orientação, incentivo, dedicação, paciência, amizade nesses semestres em que estive na Fitopatologia.
Aos participantes da banca examinadora Prof. Dr. Cristiano Souza Lima (UFC) e MSc. Francisco Leandro de Paula Neto (MAPA) pelo tempo dedicado, pelas valiosas colaborações e sugestões.
Ao meu irmão Rebyson Rebouças e minha irmã Rhayra Rebouças pelo companheirismo e amizade.
À minha namorada, Monalisa Secundino, por me fazer uma pessoa muito mais paciente, pelo amor, carinho, conselhos e força dados desde que a conheci, nessa jornada que está apenas começando. Te amo.
Aos amigos que fiz no Laboratório de Fitopatologia, Bruno, Isabelle, Kelly, Laianny, Lainara, Lucas Letícia, Natália, Maciel e Vitor pelas contribuições na minha formação profissional.
Às instituições e setores que tive o prazer de colaborar e aprender: EMBRAPA – Amazônia Oriental na orientação da Drª Márcia Mascarenhas Grise, Núcleo de Ensino e Estudo em Forragicultura, NEEF, sob a orientação do Prof. Magno José Duarte Cândido, junto à Monitoria de Fitopatologia II Agronomia/UFC, na orientação da Profª Carmem Dolores Gonzaga Santos.
A todos os integrantes do D.I.V.A., pelas amizades que fiz, bate-papo e pelos momentos de extroversão.
A todos profissionais e amigos, que direta ou indiretamente contribuíram para minha formação pessoal e profissional.
RESUMO
Em julho de 2016, o nematoide heteroderídeo Cactodera cacti foi encontrado
naturalmente associado à raízes de plantas adultas de mandacaru (Cereus jamacaru
D.C.) em área de cultivo, predominantemente, de hortaliças em Fortaleza-CE. A identificação do nematoide foi realizada por meio de estudos morfológicos e moleculares junto à Agronômica - Laboratório de Diagnóstico Fitossanitário e Consultoria (Porto Alegre-RS). Este trabalho apresenta o primeiro relato de C. cacti no
estado do Ceará, Brasil, e inclui informações obtidas dos estudos iniciais com o referido patógeno. Considerando a importância mundial desse fitonematoide para as cactáceas e da ameaça que esse patógeno pode representar para as espécies comercialmente exploradas no estado, procedeu-se a uma investigação de suas hospedeiras incluindo cactáceas ornamentais, forrageiras e frutíferas, além de soja e hortaliças. Como inóculo do nematoide, foram empregados ovos obtidos de cistos do
C. cacti provenientes de raízes de mandacaru e de solo infestado. Alíquotas da
suspensão contendo de 1.800 a 3.200 ovos foram inoculados em solo com mudas das cactáceas ornamentais Echinopsis multiplex, Nopalea cochenillifera, Mammillaria
prolifera, Cereus jamacaru, da cactácea frutífera pitaia (Hylocereus undatus), da palma
forrageira (Opuntia ficus-indica), como também de tomate (Solanum lycopersicum L.)
‘Santa Cruz’, coentro (Coriandrum sativum L.) ‘Verdão’, pimentão (Capsicum annuum
L.) ‘All Big’, rúcula (Eruca sativa Miller) ‘Antonela’, berinjela (Solanum melogena L.)
‘Roxa’, pepino (Cucumis sativus L.) ‘Verde Comprido’, repolho (Brassica capitata L.)
‘Chato de Quintal’, couve (Brassica oleracea L.) ‘Manteiga da Geórgia’ e soja (Glycines max (L.) Merrill) ‘NS7209’ , em casa de vegetação (31 + 3ºC). As hortaliças e a soja
foram incluídas no ensaio pelo motivo do fitonematoide ter sido encontrado nas proximidades de canteiros de plantas olerícolas. Depois de 40 a 60 dias, as plantas foram retiradas dos vasos e as raízes analisadas em microscópio estereoscópico. O exame revelou o parasitismo do nematoide nas espécies E. multiplex, M. prolifera, N.
cochenillifera, mandacaru, pitaia e palma forrageira, uma vez que a presença de
fêmeas e de cistos foi constatada no sistema radicular de todas elas. Não foi
observada infecção nas raízes das hortaliças e soja testadas. Concluiu-se, pelos resultados, que C. cacti parasita, preferencialmente, plantas da família Cactaceae,
podendo vir a constituir risco à
produção de cactáceas no estado do Ceará.
ABSTRACT
In July 2016, the nematode Cactodera cacti was found naturally associated with the
roots of adult plants of Cereus jamacaru D.C., known locally as mandacaru, in a
predominantly vegetable-growing area of Fortaleza-CE. This study represents the first report of this nematode in the State of Ceará, Brazil, and describes initial studies with the pathogen. The identification of this nematode was realized through morphological and molecular studies at the Agronômica Consulting Laboratory for Phytosanitary Diagnosis (Porto Alegre-RS). Considering the global importance of this phytonematode to cactaceae, and the threat that the pathogen may pose to commercially important species in the state, an investigation was carried out of its hosts, including ornamental, forage and fruit cacti, as well as soybean and vegetables. Eggs taken from cysts of C. cacti in roots of the mandacaru and from
infested soil were used as the nematode inoculum. Aliquots of the suspension containing from 1,800 to 3,200 eggs were inoculated into soil with seedlings of the ornamental cacti Echinopsis multiplex, Nopalea cochenillifera, Mammillaria prolifera,
and Cereus jamacaru; of the fruit cactus (Hylocereus undatus), and forage palm
(Opuntia ficus-indica); as well as the tomato (Solanum lycopersicum L.) 'Santa Cruz',
coriander (Coriandrum sativum L.) 'Verdão', the pepper (Capsicum annuum L.) 'All
Big', Arugula (Euca sativa Miller) 'Antonela', eggplant (Solanum melogena L.) 'Roxa',
cucumber (Cucumis sativus L.) 'Verde Comprido', cabbage (Brassica capitata L.)
'Chato de Quintal', kale (Brassica oleracea L.) 'Georgia Butter' and the soybean
(Glycines max (L.) Merrill) 'NS7209', in greenhouse (31 + 3ºC). The vegetables and
soybean were included in the trial as the phytonematode had been found in the vicinity of vegetable crops. After 40 to 60 days, the plants were removed from the pots, and the roots analysed with a stereo microscope. The examination revealed nematode parasitism in E. multiplex, M. prolifera, N. cochenillifera, mandacaru, pitaia
and forage palm, as the presence of females and cysts was found in the root system of all the above plants. No infection was seen in the roots of the vegetables or soybean under test. It was concluded from the results that C. cacti, preferably infests
plants of family Cactaceae, and could become a risk to the production of Cactaceae in the state of Ceará.
LISTA DE FIGURAS
Figura 1 Exemplificação das quatro subfamílias de Cactaceae... 17
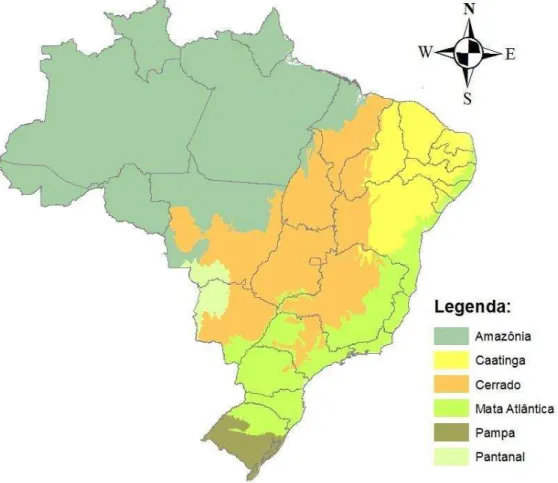
Figura 2 Mapa esquemático de representações dos biomas brasileiros... 18
Figura 3 Exemplificação de árvore de mandacaru no Nordeste... 22
Figura 4 Exemplificação de cultivo de palma forrageira... 26
Figura 5 Exemplificação de cultivo de pitaia tutorada... 29
Figura 6 Ciclo de vida de Cactodera cacti... 38
Figura 7 Mandacaru naturalmente infectado com Cactodera cacti no Campus do Pici. Setas apontam para as raízes superficiais coletadas... 41
Figura 8 Cactodera cacti: Fêmea (A); Detalhe de cisto incrustado em raiz de mandacaru (B); Cistos contendo ovos (C); Numerosos cistos obtidos do solo (D)... 42
Figura 9 Cistos de Cactodera cacti retido nas peneiras de 40 mesh (A) e na peneira de 100 mesh (B)... 44
Figura 10 Placa com cistos de Cactodera cacti (A). Ponteira usada na coleta de cistos (B)... 45
Figura 11 Cactáceas ornamentais inoculadas com Cactodera cacti no primeiro ensaio... 47
Figura 12 Plantas inoculadas com Cactodera cacti: Pepino (A); Pimentão (B); Coentro (C); Berinjela (D); Tomate (E); Pitaia (F); Couve (G); Soja (H); Rúcula (I); Repolho (J)... 50
Figura 13 Tomate (Solanum lycopersicum) ‘Santa Cruz’ sendo inoculada com 3.200 ovos de Cactodera cacti... 51
Figura 14 Plantas de Echinopsis multiplex (A), Opuntia cochenillifera (B), Mammillaria prolifera (C) e Cereus jamacaru (D) inoculadas com Cactodera cacti. No detalhe, raízes com cistos do nematoide... 53
Figura 16 Fêmeas de Cactodera cacti obtidas de raízes de pitaia (A) e cistos
jovens e maduros retirados de raízes de palma (B)... 54
Figura 17 Cisto de Cactodera cacti retirado do sistema radicular de pitaia após
ser pressionado expondo ovos e juvenis de segundo estádio vivos (A); Detalhe de juvenil de segundo estádio (B)... 55
LISTA DE TABELAS
SUMÁRIO
1 INTRODUÇÃO... 14
2 REVISÃO DE LITERATURA... 16
2.1 Cactáceas... 16
2.2 Mandacaru... 21
2.2.1 Principais pragas e doenças associados ao mandacaru... 23
2.3 Palma forrageira... 24
2.3.1 Principais pragas e doenças da palma forrageira... 27
2.4 Pitaia... 28
2.4.1 Principais pragas e doenças da pitaia... 31
2.5 Cactos ornamentais... 32
2.5.1 Principais pragas e doenças de cactos ornamentais... 33
2.6 Fitonematoides... 34
2.7 Nematoides formadores de cistos... 35
2.7.1 Gênero Cactodera... 36
2.7.1.1 Classificação taxonômica...... 37
2.7.1.2 Ciclo de vida... 37
3 MATERIAIS E MÉTODOS... 40
3.1 Histórico do nematoide no Ceará... 40
3.2 Método de extração de cistos empregado para heteroderídeo... 43
3.3 Método adaptado de Shepherd para extração de cistos de Cactodera do solo... 44
3.3.1 Obtenção de ovos de Cactodera cacti para inoculação no primeiro ensaio.. 45
3.3.1.1 Inoculação no primeiro ensaio... 46
3.3.2 Obtenção de ovos de Cactodera cacti para inoculação no segundo ensaio..... 47
3.3.2.1 Inoculação no segundo ensaio... 48
3.3.3 Obtenção de cistos e ovos de Cactodera cacti para inoculação no terceiro ensaio... 49
3.3.3.1 Inoculação no terceiro ensaio... 49
4.1 Resultados do primeiro ensaio. 52
4.2 Resultados do segundo ensaio. 53
4.3 Resultados do terceiro ensaio. 56
5 CONCLUSÃO. 57
14
1 INTRODUÇÃO
A família Cactaceae Juss. tem seu centro de origem localizado nas Américas e possui numerosas espécies de cactos dentre arbustos, subarbustos, árvores, ervas e lianas, distribuídas em todo o mundo (THE PLANT, 2013). No Brasil há pelo menos 37 gêneros nativos com 330 espécies distribuídas nas cinco regiões geográficas. A maior diversidade de cactáceas encontra-se na região Nordeste com destaque para os gêneros Cereus, Opuntia e Pilosocereus (SALES et. al., 2014). A
exploração de cactáceas como alternativa alimentar vem se intensificando no Brasil e em vários países da América Latina e já são muitos os apreciadores da culinária exótica (SILVA et. al., 2015).
O mandacaru (Cereus jamacaru D.C.) se destaca como uma das espécies
mais abundantes na Caatinga. Possui grande importância medicinal, econômica e ambiental para a população nordestina. Tem sido empregada na construção civil, no tratamento de doenças, como forrageira e como planta ornamental (BRAGA, 1976; SALES et. al., 2014).
As palmas (Opuntia ficus-indica Mill e Nopalea cochenillifera Salm Dyck)
são plantas bastante adaptadas às condições climáticas do semiárido e nos últimos anos houve um aumento significativo no seu cultivo no Nordeste. Além da utilização para alimentação animal, a palma também é largamente utilizada na alimentação humana, cerca viva e em ornamentações de jardins (BARBERA, 1995).
A pitaia (Hylocereus undatus (Haw.) Britton & Rose, também conhecida
como "fruta-do-dragão", vem sendo avaliada como uma novidade promissora para a fruticultura brasileira, em razão do sabor doce e suave de seus frutos. Na região Nordeste, a pitaia tem se destacado na Chapada do Apodí, nos municípios de Limoeiro do Norte e Quixeré-CE com produção comercializada, principalmente, em mercados de Fortaleza. A pitaia pode ser utilizada tanto na alimentação humana quanto na alimentação animal, como forragem (SFAGRO, 2017; SILVA, 2014).
Há alguns anos o cultivo de cactos ornamentais têm se popularizado em razão da grande variedade de formas e colorações, atraindo a atenção de numerosos colecionadores de plantas e gerando emprego (TAKANE, 2009).
15
As espécies de nematoides formadores de cistos (Heteroderidae, Heteroderinae) do gênero Cactodera Krall e Krall, 1978, tem sido as mais
comumente associadas às cactáceas em todo o mundo. Das 15 espécies descritas, a C. cacti tem se destacado por afetar elevado número de plantas de diversos
gêneros da família Cactaceae (NEMABASE, 2016). Em mandacaru, o nematoide foi relatado pela primeira vez em 2011, ocorrendo em plantas cultivadas na China provocando sintomas de amarelecimento e murcha (DUAN; WANG; CHEN, 2012). Esse nematoide também tem sido encontrado afetando a palma e a pitaia em vários países, tornando-se importantes nessas culturas uma vez que as mesmas são cultivadas mais intensamente em várias regiões (PIEDRAHITA; PÉREZ; PATIÑO, 2012; PEREZ; VELEZ; ZERMENO, 2015).
No Brasil, os heteroderídeos mais comuns são Heretodera glycines e H.
fici, uma vez que causam sérios prejuízos nas culturas da soja e figueira,
respectivamente (FERRAZ; MONTERIO, 2011).
A espécie C. cacti foi relatada no Brasil parasitando algumas cactáceas
ornamentais (SANTOS; PREZOTTO; MAIA, 2001) no ano de 2001, e depois na cactácea ornamental Flor de maio (Schlumbergera sp.) em 2007 (OLIVEIRA et. al.
2007), ambos os casos afetando o desenvolvimento das plantas envasadas e ocorrendo apenas em São Paulo.
Em julho de 2016, o C. cacti foi encontrado naturalmente associado a
raízes de plantas adultas de mandacaru em áreas de exploração de hortaliças em Fortaleza-CE. Este é o primeiro relato do nematoide no Ceará e os estudos iniciais com o patógeno estão expostos no presente trabalho.
Desta forma, considerando a importância mundial desse fitonematoide para as cactáceas e da ameaça que esse patógeno pode representar para as espécies comercialmente exploradas no estado, tornou-se objetivo deste trabalho investigar o potencial de parasitismo de C. cacti em cactáceas ornamentais,
16
2 REVISÃO DE LITERATURA
2.1 Cactáceas
A família Cactaceae Juss. possui 176 gêneros e pelo menos 2.233 espécies de cactos dentre arbustos, subarbustos, árvores, ervas e lianas, distribuídas em todo o mundo (THE PLANT, 2013). Essa família tem seu centro de origem localizado nas Américas, podendo os cactos, serem encontrados do norte do Canadá até a Patagônia na Argentina (ALENCAR, 2009). O continente americano possui quatro centros de diversidade dessa família. O primeiro centro é compreendido pelos países do México e Estados Unidos, os mais expressivos, o segundo maior é localizado na região andina que compreendo os países Peru e Bolívia. O terceiro maior centro de diversidade é localizado no Brasil, particularmente no leste (florestas, restingas, caatinga, cerrado e campos rupestres) e finalmente o quarto que inclui o Paraguai, Uruguai, Argentina e regiões centro-oeste e sul do Brasil (ZAPPI; TAYLOR; LAROCCA, 2011; TAYLOR, 1997). No Brasil, o maior centro de dispersão das cactáceas está localizado na Bahia. Apesar das cactáceas serem cultivadas em todo mundo, sua predominância está em regiões que apresentam climas semiáridos e áridos, onde o déficit hídrico e altas temperaturas estão presentes (TAKANE; PIVETTA; YANAGISAWA, 2009).
17
Figura 1: Exemplificação das quatro subfamílias de Cactaceae:A) Cactoideae; B) Opuntioideae; C) Pereskioideae e D) Maihuenioideae.
Fonte: A)https://upload.wikimedia.org/wikipedia/commons/thumb/2/22/Echinocereus_palmeri_ B) http://www.cacti.co.nz/images/library-o-opuntia-galapageia-opuntia-galapageia-20213-c.jpg.;
C)https://br.pinterest.com/pin/469429961138610464/
D) https://grootscholten.fotki.com/plant-collections/cactus-opuntia/poeppigii.html
A família das Cactáceas no Brasil possui um total de 37 gêneros nativos com 330 espécies distribuídas nas cinco regiões geográficas: Norte (17), Centro-Oeste (33), Sul (70), Nordeste (90) e Sudeste (120). Destas, 163 espécies são endêmicas nos seis biomas: Amazônia (01), Pantanal (04), Pampas (08), Cerrado (29), Mata Atlântica (58) e Caatinga (63) (Figura 2). Na Caatinga, as espécies endêmicas encontram-se, principalmente, na região do semiárido com destaque aos gêneros Cereus, Opuntia e Pilosocereus (ZAPPI; TAYLOR; LAROCCA, 2011;
GONZAGA et. al., 2014). (SALES et. al., 2014).
A B
18
As cactáceas são dicotiledôneas suculentas, xerófitas, perenes e adaptadas às condições climáticas das regiões semiáridas das Américas. Apresentam numerosas adaptações a ambientes secos e possuem interessantes estratégias de sobrevivência. Nos cactos existem em extensa variação de formatos e tamanhos (DAVET, 2005).
Figura 2: Mapa esquemático de representações dos biomas brasileiros.
Fonte: http://www.florestal.gov.br/snif/images/stories/RecursosFlorestais/bioma_img_snif.jpg.
As cactáceas, em geral, possuem porte que varia de sete centímetros até 20 metros de altura (MENEZES, TAYLOR, LOIOLA, 2013), contudo há espécies como a Blossfeldia liliputiana que possui apenas de cinco a 20 milimetros de
19
caules são fotossintéticos e apresentam tecidos que estocam ou acumulam água (parênquima aquífero), enquanto que outros apresentam folhas reduzidas e modificadas em espinhos protetores. Porém, na maioria das vezes são armados com acúleos e/ou gloquídeos (tufos de espinhos), inseridos geralmente nas aréolas, o que possibilita economizar e reter água em seus tecidos. Comumente, o caule se apresenta suculento com formas diversas, sendo mais comuns os colunares, alados, achatados e globosos. As folhas, quando presentes, são dispostas em espiral ao longo do caule sendo simples e inteiras. A inflorescência é solitária e pode alcançar até 30 centímetros de comprimento. As características florais vaiam de cor, forma, tamanho, odor e duração de antese (SBRISSA; MELO, 2012; ZAPPI; TAYLOR; LAROCCA, 2011, SOUZA; CALVENTE, 2013). A polinização pode ocorrer por insetos (abelhas, borboletas e mariposas), beija-flores e morcegos. Há sistemas reprodutivos autocompatíveis e autoincompatíveis, existindo a propagação por sementes e propagação vegetativa, por estaquia e enxertia. A polinização de algumas espécies de cactos é noturna, pois as suas flores fecham ao amanhecer. Os frutos das cactáceas podem ser suculentos ou secos, podendo apresentar-se com o pericarpo liso, escamado, piloso, eriçado, ou ainda espinhoso (BARTHLOOT, HUNT, 1993, CORREIA et. al. 2012). Tem o formato variando de elipsoide a ovoide,
com numerosas sementes, podendo ser deiscentes ou indeiscentes na maturação. Apresentam cores variadas sendo alguns comestíveis e de crescente importância econômica (COLAÇO et. al., 2006, SILVA ; SAZIMA, 1995, REGO;
FRANCESCHINELLI, ZAPPI, 2012). As cactáceas, em geral, vivem em torno de 25 anos, podendo algumas delas viverem por mais de 200 anos (DREZNER, 2014).
20
O mecanismo fotossintético das cactáceas é diferenciado, pois seus estômatos se abrem e adquirem o CO2 durante a noite onde a temperatura é mais
amena, justamente para não perder a água dos seus tecidos. Durante o dia o estômato encontra-se fechado e a fotossíntese é realizada. Esse processo fotossintético é conhecido como Fotossíntese MAC (Metabolismo Ácido das Crassuláceas) ou em inglês como CAM (Crassulacean Acid Metabolism) que
conferem às espécies que detém desse mecanismo uma economia de água e grande resistência às condições ambientais inadequadas (PIMENTEL, 1998; TAKANE, 2009).
As cactáceas, como plantas suculentas, caracterizam-se por apresentar semelhança quanto à adaptação às condições ambientais desaforáveis, seja ela estresse hídrico ou estresse térmico (TAKANE, 2009). As diversas espécies de plantas que são chamadas de suculentas apresentam modificações anatômicas em algumas estruturas, sejam elas folhas, caule ou raiz tornando-se capaz de armazenar um grande volume de água, e por esse motivo são popularmente chamadas de plantas suculentas (TAKANE, 2009).
As cactáceas possuem destacada participação ecológica em vários ecossistemas. Várias delas são exploradas comercialmente na indústria alimentícia e cosmética, como plantas medicinais, no consumo in natura, como cerca viva,
outras são forrageiras para o gado no período seco na Caatinga e há ainda espécies que são apreciadas como plantas ornamentais (SOUZA; CALVENTE, 2013; MENEZES; RIBEIRO-SILVA, 2015).
No Brasil e em vários países da América Latina, o emprego de cactáceas como alternativa alimentar vem se intensificando e já são bastante utilizadas por apreciadores de culinária exótica ou algumas vezes pela população de baixa renda (SILVA et. al., 2005).
Dentre as várias espécies que se destacam pela ocorrência na região Nordeste do Brasil, podem ser citadas: o mandacaru (Cereus jamacaru De
Candolle), o facheiro (Pilosocereus pachycladus F. Ritter), o xique-xique
[Pilosocereus polygonus (Lam.) Byles & G. D. Rowley], a coroa-de-frade [Melocactus bahiensis (Britton & Rose) Luetzelb.], a pitaia [Hylocereus undatus (Haw.) Britton &
Rose] e as palmas (Opuntia ficus-indica Mill e Nopalea cochenillifera Salm-Dyck)
21
2.2 Mandacaru
O mandacaru pertence à subfamília Cactoideae, tribo Cereeae e ao gênero Cereus. É uma espécie nativa do Brasil e está amplamente disseminada no
Nordeste brasileiro. Este gênero foi primeiramente descrito por Hermann, em 1698 e depois por Miller em 1754 e possui pelo menos 48 espécies registradas (SALES, et.
al., 2006; THE PLANT, 2013).
São sinonímias de nomes cientificos para Cereus jamacaru: Cactus jamacaru (D.C.) Kosteletzky, Cereus horribarbis Otto in Salm-Dick, Cereus jamacaru
var. caesius Salm-Dyck, Cereus jamacaru var. glaucus Ladenberg, Cereusjamacaru
subsp. goiasensis (F. Ritter) P. J. Braun & Esteves, Cereus jamacaru subsp. jamacaru, Piptanthocereus goiasensis (F. Ritter), Piptanthocereus jamacaru
Riccobono (THE PLANT, 2013).
O seu nome em tupi "iamandakaru" significa feixe ou molho pungente, cheio de espinhos. Outras denominações são mandacaru de boi e cardeiro (BRAGA, 1975; ALVES; ALVES; PEREIRA, 2016).
O mandacaru, ainda que se destaque como uma das espécies mais abundantes na Caatinga está reduzindo sua ocorrência, porém não está sob risco de extinção. É amplamente encontrado nos estados de Alagoas, Bahia, Ceará, Maranhão, norte de Minas Gerais, Paraíba, Pernambuco, Piauí, Rio Grande do Norte e Sergipe, em áreas urbanas, litorais e pastos (ROCHA; AGRA, 2002; BRAUN; MACHADO; TAYLOR, 2013; ZAPPI; TAYLOR; LAROCCA, 2011). As plantas de mandacaru se desenvolvem muito bem no estado do Ceará, mostrando-se adaptáveis às condições edafoclimáticas do local (MAIA, 2004).
22
subapicais, inseridas acima das áreolas, são brancas e medem de 12 a 30 cm de comprimento. São hermafroditas, isoladas, sésseis e possuem antese noturna sendo visitadas por mariposas e morcegos. Suas sépalas e pétalas são distintas, sendo o cálice castanho claro e as pétalas brancas ou brancas-amareladas. O fruto é do tipo baga, medindo de 10 a 13 centímetros, elipsoide a piriforme, mucilaginoso, exibindo epicarpo liso, brilhante de colocação vermelha a magenta com polpa branca, funicular. As sementes são numerosas, negras, diminutas (1,5 a 2,5 mm) e brilhantes. Os frutos são bastante consumidos por pássaros e morcegos (ROCHA; AGRA, 2002; CNIP, 2017; SALES et. al., 2014, BRAGA, 1976).
Figura 3 – Exemplificação de árvore de mandacaru no Nordeste.
Fonte: http://www.cerratinga.org.br/wp-content/uploads/2013/05 /mandacaru- arvore-dodesign-s.jpg.
O mandacaru possui grande importância medicinal, econômica e ambiental. Esta planta é amplamente utilizada pela população nordestina na construção civil, no tratamento de doenças, como forrageira e em ornamentação. Na construção civil retiram-se do tronco tábuas de até 30 cm de largura para fabricação de portas e janelas (SALES et. al., 2014; BRAGA 1976) como também utilizam a
23
analgésico, antibiótico, antiemético, diurético e para tratar problemas intestinais, renais, gripes, bronquites, curar alguns tipos de úlceras e para o controle de diabetes e de verminoses (DAVET et. al., 2009; SALES et. al., 2014; ANDRADE; MARQUES;
ZAPPI, 2006). Na alimentação de bovinos e caprinos como volumoso no período de seca (ANDRADE et. al., 2006) e como fonte de água na alimentação de ruminantes.
Depois de queimados os artículos servidos aos animais fornecem água, proteína, fibra e minerais (BRAGA, 1976, FREIRE, 2009). O mandacaru também se destaca pelo seu potencial como planta ornamental devido à coloração da sua epiderme, suas formas exóticas e facilidade de cultivo (LIMA, 1996, CORREIA et. al., 2012).
Apesar desse uso, ainda é escasso o conhecimento da população sobre usos e benefícios do mandacaru como também das potencialidades desta cactácea pelos pesquisadores (SALES et. al., 2014).
Para que esta espécie viesse adaptar-se à região foram necessários milhares de anos, porém o manejo inadequado do mandacaru pelo homem pode resultar numa ameaça de extinção da espécie e se vier a acontecer, tanto a atividade agrícola como o ambiente terão grandes prejuízos (CERRATINGA, 2017).
2.2.1 Principais pragas e doenças associadas ao mandacaru
Apesar de ser uma espécie bastante resistente a várias intempéries climáticas, o mandacaru possui vários patógenos a ele associados, principalmente na época chuvosa no nordeste brasileiro (FREIRE, 2009).
Em relação a insetos que causam danos à cultura, duas espécies foram identificadas ocorrendo naturalmente em plantas do gênero Cereus: a cochonilha
[Diaspis echinocacti (Bouché, 1833)], também conhecida como cochonilha da palma
parasitando naturalmente plantas de mandacaru (LIMA & GAMA (2001). MONTEIRO & BECKER (2002) relataram que as larvas da mariposa Sigelgaita heinrich
(Lepidoptera, Pyralidae) também parasitam plantas do gênero Cereus.
Dentre as doenças relacionadas ao mandacaru estão: a podridão azul (Dichotomophthora cactacearum), a podridão-de-fitóftora (Phytophthora sp.), a
podridão-de-lasiodiplodia (Lasiodiplodia theobromae) (FREIRE, 2009).
24
provocando sintomas muito característicos de deficiência nutricional. A espécie
Meloidogyne incognita relatada associada a raízes de mandacaru em condições
naturais (PONTE, 1969, 1973) e M. enterolobii infestando plantas envasadas de
mandacaru (FREIRE, 2015; SILVA; SANTOS; SILVA, 2016). Em 2011, o heteroderídeo Cactodera cacti foi relatado pela primeira vez em plantas de
mandacaru cultivadas em estufas no norte da China provocando sintomas de amarelecimento e murcha (DUAN; WANG; CHEN, 2012).
2.3 Palma Forrageira
Compreende-se por palma forrageira, plantas dos gêneros Opuntia Mill. e Nopalea Salm Dyck., ambas pertencentes à subfamília Opuntioideae dentro da
família Cactaceae. A Opuntia ficus-indica Mill e Nopalea cochenillifera Salm Dyck
têm seu centro de origem localizado no México. Palmas do gênero Opuntia
caracterizam-se por serem uma palma com cladódios (raquetes) maiores, chamada de gigante, graúda ou redonda. Já as palmas do gênero Nopalea são caracterizadas
por formarem raquetes menores e são chamadas vulgarmente de palma miúda ou doce (SANTOS et. al., 2006; ARREOLA; ISHIKI; TERRAZAS 2015, BECCARO et.
al., 2013). O gênero Nopalea possui sete espécies, entretanto apenas uma está
presente sendo cultivada no Brasil (N. cochenillifera), enquanto o gênero Opuntia
detém de 191 espécies aceitas, destas, sete têm ocorrência no Brasil (Opuntia
dillenii, O. elata, O. ficus-indica, O. megapotamica, O. monacantha, O. retrorsa e O.
stricta) GRIFFITH; PORTER, 2009; BRAZILIAN FLORA, 2014; THE PLANT, 2013).
Acredita-se que ambas as palmas, nativas do México, foram introduzidas no Brasil a partir dos colonizadores portugueses, que trouxeram as plantas com o intuito de hospedar e procriar um inseto [Dactylopius coccus Costa (Homoptera,
25
A palma gigante (O. ficus-indica) possui os seguintes sinônimos de nomes
científicos: Cactus ficus-indica L. C. opuntia L, O. arcei Cárdenas, O. castillae
Griffiths, O. chinensis (Roxb.) K. Koch, O. cordobensis Speg. O. ficus-barbarica
A.Berger, O. incarnadilla Griffiths, O. megacantha Salm-Dyck e O. vulgaris Mill. Essa
espécie, também pode ser chamada pelos agricultores nordestinos de palma-graúda, palma-grande, palma redonda, palma sem espinho, palma-da-índia, palmatória, palma-santa, palma-azeda, cactus-burbank, do-inferno figueira-da-índia, figo-figueira-da-índia, figueira-da-barbaria, figueira-moura e tuna-de-castilha (ARAUJO FILHO 2000, THE PLANT, 2013)
A palma gigante caracteriza-se por ser um cacto de porte arbóreo com 2,5 a 5 metros de altura (figura 4), seu caule é suculento e bem definido (0,6 a 1,5 m de altura). Suas raízes são carnosas e superficiais podendo se dispersar de 4 a 8 metros da raiz principal. As raízes absorventes encontram-se principalmente nos primeiros centímetros, atingindo a profundidade máxima de 30 cm de comprimento, dependendo do tipo de solo que estão plantadas. Do caule surgem ramificações de formato oblongo a espatulado-oblongo (forma de raquetes) medindo cerca de 30 a 40 cm de altura e 18 a 25 cm de largura. São de coloração verde, fotossintetizantes, possui uma placa de cera, cuja espessura varia entre 10 a 15 µm. Na superfície dos cladódios estão presentes as aréolas, distribuídas numa forma helicoidal. Os espinhos são quase ausentes, desenvolvendo um tufo de minúsculos espinhos em algumas aréolas. Em condições ambientais adequadas o tecido meristemático presente nas aréolas dão origem a novos cladódios, flores e frutos. As flores tem coloração amarela ou laranja, medem de 7 a 10 cm de comprimento. O fruto é doce, suculento e apresenta coloração variando de amarelo, vermelho e púrpura. Possui formato ovoide de tamanho variando de 5 a 10 cm de comprimento e 4 a 8 cm de largura e casca contém pequenos espinhos. Apresenta numerosas e pequenas sementes pretas, de 3 a 4 mm de diâmetro (OLIVEIRA et. al., 2010, SCHEINVAR,
26
Figura 4 – Exemplificação de cultivo de palma forrageira.
Fonte:https://wwwnaturezaemfotos.blogspot.com.br/2014/
01/flora-norestina-palma-forrageira-gigante.html
A palma gigante é uma espécie bastante adaptada ao clima da região semiárida. Ela se destaca por ser uma alternativa essencial para essas regiões, tendo em vista que a sua fisiologia de absorção, armazenamento e economia de água favorece seu cultivo, mesmo em regiões de baixas precipitações, sendo bem adaptadas ao cenário nordestino (NUNES, 2011; SANTOS et. al., 2006).
Nos últimos anos, houve um aumento significativo no cultivo de palma forrageira, principalmente na região Nordeste, mais precisamente nos estados de Pernambuco e Alagoas (ARAÚJO et. al., 2005) devido à sua utilização para a
nutrição de vacas leiteiras, sendo considerada a principal forrageira fornecida a esses animais em tempo de seca e com grande importância social e econômica. Estima-se existirem hoje, no Nordeste, aproximadamente 500 mil hectares cultivados de palma (MOURA et. al., 2011).
27
o consumo das frutas e suas cascas, produção de licor e de óleos comestíveis da semente, doces, geleias e purês, além de serem consumidos como verduras (cladódios jovens, processados em salmoura ou vinagre e cozidos). Na produção de energia a palma também se faz presente com o biogás, álcool e lenha. A palma também atua como um fitoterápico para pacientes que sofrem de diarreia, disenteria amebiana, obesidade, diabetes, hiperlipidemia e ainda age como anti-inflamatório e diurético. Vários cosméticos podem ser feitos a base de palma como, xampu, creme umectante, sabonetes, adstringentes e loções para o corpo. Além desses usos e produtos, a palma é usada também para fazer colas, adesivos, mucilagem para a indústria alimentícia, antitranspirantes e é bastante utilizada como planta ornamental e paisagística (BARBERA, 1995).
A palma também pode ser utilizada como cerca viva, já que algumas variedades têm espinhos bastante numerosos e finos. É também utilizada como quebra vento e na conservação e proteção do solo (BARBERA, 1995).
2.3.1. Principais pragas e doenças da palma forrageira.
Além da cochonilha do carmim, que se tronou uma praga para a palma, há vários insetos que podem afetar as cactáceas forrageiras. São exemplos os besouros (Coleoptera), formigas (Hymenoptera), gafanhotos (Orthoptera), lagartas (Lepidoptera), tripes (Thysanoptera) que são de ocorrência acidental, não se configurando como pragas. Entretanto, no Nordeste brasileiro, o inseto que se destaca como praga da palma é a cochonilha de escama Diaspis echinocacti
(Bouché, 1833) (Hemiptera, Diaspididae), também conhecida por escama, piolho ou mofo da palma a qual provoca danos e prejuízos à cultura (SANTOS et. al., 2006).
28
Existem ainda os roedores como ratos e preás que comem e dilaceram a base da palma para se alimentar e consequentemente ocorre o tombamento dessas plantas (SANTOS et. al., 2006)
Várias doenças fúngicas assolam a cultura da palma forrageira, dentre elas estão: podridão negra (L. theobromae), a podridão seca escamosa (Scytalidium
lignicola), gomose (Dothiorella ribis), podridão de fusarium (Fusarium solani),
rizoctoniose (Rhizoctonia solani), mancha de alternaria (Alternaria tenuis), podridão
de Macrophomina (Macrophomina phaseolina), podridão de sclerotium (Sclerotium rolfisii), podridão Polaciana (Pollaccia sp.) mancha de macrophoma (Macrophoma
sp.) e antracnose (Colletotrichum gloeosporioides) (BARBOSA, 2007).
A podridão mole (Pectobacterium carotovorum subsp. carotovorum) é a
única doença da palma causada por bactéria que se tem conhecimento (BARBOSA, 2007).
Lopes et. al. (2013) relatou que nematoide da espécie M. incognita foi
encontrado parasitando raízes de palma doce. Esse nematoide age retirando água e sais minerais que serviriam para a nutrição e manutenção da planta. Outros onze gêneros de nematoides já foram relatados na palma, com destaque para C. cacti,
que tem se mostrado muito importante na cultura no México (PÉREZ; VÉLEZ; ZERMEÑO, 2015)
2.4 Pitaia
A pitaia é uma planta da família das cactáceas pertencente ao gênero
Hylocereus (A.Berger) Britton & Rose (Figura 5). Tem seu centro de origem nas
Américas e se encontra distribuída em diversos países do continente, e apresenta potencial agronômico e econômico, devido sua rusticidade (ORTIZ-HERNÁNDEZ; CARRILLO-SALAZAR, 2012). Hoje em dia a pitaia é cultivada no mundo todo, sendo a Colômbia e o México os países que detém a maior produção dessa fruta (CANTO, 1993).
Pitaia, Hylocereus undatus Haworth, que na sua linguagem mãe
(arahuaca) significa fruto de escamas, também conhecido como "fruta-do-dragão", é o nome empregado tanto para a planta como para o fruto. As sinonímias de nomes científicos para essa espécie são Cereus undatus Haw. e Hyalocereus undatus
29
subfamília Cactoideae e a tribo Hylocereeae. A H. undatus possui fruto vermelho
com polpa branca (SILVA, 2014; BASTOS et. al., 2006, MARQUES, 2008;
BARTHLOTT; HUNT, 2000; CATALOGO OF LIFE, 2017).
Figura 5 – Exemplificação de cultivo de pitaia tutorada.
Fonte:http://www.floresefolhagens.com.br/pitaia-ou-pitaya/
O gênero Hylocereus possui, atualmente, 19 espécies das quais H.
undatus, H. monacanthus e H. megalanthus são as mais cultivadas em todo mundo,
havendo uma variação nas cores da casca e da polpa (ORTIZ-HERNÁNDEZ; CARRILLO-SALAZAR, 2012). A espécie H. megalanthus era anteriormente
denominada Selenicereus megalanthus, porém após vários trabalhos de
sequenciamento genético foi verificado que pertencia ao gênero Hylocereus (SILVA
2014).
30
de cladódios, os quais são esverdeados e com função fotossintetizante. Apresentam tamanho médio de 20 cm e suas asas ou costelas possuem largura de aproximadamente 2,3 cm. Nos cladódios não há folhas verdadeiras, mas estão presentes diminutos espinhos (2 a 4 mm de comprimento), que são as folhas modificadas. As plantas apresentam flores hermafroditas grandes (cerca de 30 cm de comprimento), aromáticas e brancas com vários estames, arranjados em duas fileiras ao redor do pistilo. Nas flores há uma grande quantidade de pólen de cor amarelada. As sépalas normalmente são esverdeadas, tendo variações na coloração de acordo com a espécie. Os frutos são do tipo baga em formato globoso ou ovoide, vermelho ou amarelo, com polpa branca ou vermelha, medindo de 10 a 20 cm de diâmetro. As brácteas recobrem o fruto dando uma aparência de escamas. Estas últimas tem pigmentação que possuem cor amarela ou vermelha, algumas sendo verde na extremidade, de acordo com a espécie. As sementes são pequenas, pretas e comestíveis (BELLEC; VAILLANT; IMBERT, 2006; DONADIO, 2009; LIMA, 2013; ANDRADE, 2007; MARQUES, 2008; NUNES, 2014).
No cenário brasileiro, as pitaias são avaliadas como uma novidade promissora. Os atributos como: sabor doce e suave, polpa firme e repleta de sementes com ação laxante têm despertado interesse nos produtores por sua grande aceitação nos mercados consumidores. O alto valor pago pelo quilo da fruta, que pode variar de dez a noventa e nove reais dependendo da época do ano, da nacionalidade e da demanda (SFAGRO, 2017). Estes aspectos constituem um grande atrativo para o plantio dessa frutífera (JUNQUEIRA et. al., 2002; MARQUES,
2008).
No Brasil, há poucas áreas de cultivo de pitaia, distribuídas no Nordeste, Sul e Sudeste. Porém, a maioria dos plantios está concentrada especialmente em São Paulo, com destaque para a região de Catanduva. Em 2005, a quantidade de pitaia comercializada na CEAGESP foi de apenas 53 quilos. Até junho de 2017, essa quantidade já havia ultrapassado 500 toneladas (MOREIRA et. al., 2012;
PROHORT, 2017). Na região Sudeste, há registro de uma produtividade média anual de 14 toneladas de fruto/ha (BASTOS et. al.,2006).
31
plantada da cultura com contínua produção, que é comercializa em Fortaleza. O município de Beberibe-CE também vem ganhando destaque na produção dessa fruta no Nordeste (NUNES et. al., 2014; SILVA 2014; MOREIRA et. al. 2012).
A pitaia apresenta diversos usos, podendo ser utilizada tanto na alimentação humana quanto na alimentação animal, como forragem. Na alimentação humana, podem ser consumidos tanto os frutos quanto as flores e os cladódios, estes últimos geralmente na forma de verdura. Algumas pesquisas feitas com a planta, afirmam que nos frutos e flores encontram-se pigmentos naturais, as betalaínas, identificadas como um forte antioxidante natural que ajudam a eliminar radicais livres (STRACK; T.VOGT; SCHLIEMANN, 2003; ABREU et. al., 2012
NETZEL et. al., 2005).
A fruta é ótima para auxiliar na perda de peso e diminuir os níveis de colesterol ruim (LDL). Ajuda no bom funcionamento do intestino, combate doenças cardíacas, previne diabetes, previne câncer de cólon e hipertensão. Melhora os sintomas da gastrite e possui propriedades anti-inflamatórias. A cultura também apresenta importância ornamental, devido à beleza das suas flores, e pode ser usada como cercas-vivas, devido aos seus espinhos (SILVA, 2014; GONÇALVES, 2017).
2.4.1. Principais pragas e doenças da pitaia.
Embora a exploração da pitaia no Brasil ainda seja pequena já existem alguns pomares comerciais instalados. Com a intensificação do cultivo, o aparecimento de pragas e de doenças tende a aumentar. Os principais problemas encontrados no campo de produção são as abelhas Irapuá [Trigona spinipes Trigona
spinipes (Fabricius, 1793)] e as formigas dos gêneros Atta (Fabricius, 1805) e Solenopsis (Westwood, 1840). As abelhas depreciam o produto, uma vez que
raspam a casca do fruto expondo a polpa, perdendo totalmente seu valor comercial. As formigas podem causar os mesmos danos no fruto e na flor e ainda provocar danos aos cladódios jovens (SILVA, 2014; COSTA et. al., 2016).
Em outros países onde a pitaia é cultivada, existem relatos de várias pragas sendo as principais: a mosca da podridão basal (Neosilba sp.), a mosca do
32
fitófagos (Machtima crucigera e Leptoglossus zonatus) (DELGADO; LÓPEZ;
KONDO, 2010; MEDINA; KONDO, 2012; HOA et. al.., 2006).
Os fungos [Botryosphaeria dothidea (Moug.) Ces. & De Not., 1863] e
[Bipolaris cactivora (Petr.) Alcorn, 1983] foram relatados afetando cladódios e frutos
de Hylocereus no México (VALENCIA-BOTÍN; KOKUBU; ORTÍZ-HERNÁNDEZ,
2012).
Em 2001, foi relatada, em Taiwan, pela primeira vez a ocorrência de um virus em H. undatus. Tratava-se de Cactus virus X causando manchas sistêmicas
nos cladódios da planta (LIOU; HUNG; LIOU, 2001).
Diversas espécies de nematoides, entre os quais Helicotylenchus
dihystera, Meloidogyne spp., Rotylenchulus sp. e C. cacti foram relatadas
parasitando naturalmente raízes de pitaia na Tailândia, Estados Unidos e México (LABORATORY, 2011; PIEDRAHITA; PÉREZ; PATIÑO, 2012).
No Brasil existem poucas ocorrências de doenças na pitaia. Em 2008, foi relatado C. gloeosporioides em pitaia (H. megalanthus) ocorrendo na região de
Botucatu em São Paulo (TAKAHASHI et. al., 2008).
Outras pragas que no Brasil podem ocorrer ocasionalmente na pitaia e causar danos são as cochonilhas, pulgões, caracóis, lesmas que têm preferência por tecidos tenros e se alimentam de novos brotos da planta, fazendo que haja uma diminuição no desenvolvimento da planta e possivelmente deformidades (SILVA, 2014). Além disso, também pássaros, na época de frutificações, podem trazer prejuízos aos produtores, uma vez que a fruta é visualmente bastante atrativa (COSTA, 2012).
2.5 Cactos ornamentais
33
CÁCERES, 2003). Anualmente o mercado de plantas ornamentais tem uma taxa de crescimento que varia em média 8% a 12% por ano, com preços variando de um a mil reais, o que significa uma movimentação na economia brasileira em torno de 4,2 bilhões de reais/ano (CARNEIRO, 2003; VAZ, 2017).
O cultivo de cactos ornamentais, além de ser bastante lucrativo fomenta uma grande geração de emprego, considerando a mão-de-obra envolvida em todo o processo produtivo, desde o preparo de mudas, tratos culturais, transplante e colheita. Com a tecnificação, alguns produtores são capazes de produzir milhares de vasos com cactos ornamentais todos os anos (TAKANE, 2009).
2.5.1 Principais pragas e doenças de cactos ornamentais.
Os cactos ornamentais são poucos afetados por pragas e doenças, porém patógenos, principalmente fungos associados à podridão como Fusarium sp podem
causar danos e ser um fator limitante para a produção de cactos ornamentais. No que se refere a insetos, a cochonilha de escama (D. echinocacti) em baixas
populações não causa grandes danos às plantas, mas em caso de grande infestação podem causar sérios prejuízos levando as plantas à morte. Tripes e pulgões também podem ser encontrados parasitando plantas ornamentais (TAKANE, 2009).
No Brasil, o nematoide C. cacti foi relado em duas associações com
cactáceas ornamentais. O primeiro registro foi feito em amostras de alguns lotes de cactáceas ornamentais procedentes da região de Jundiaí-SP causando o retardamento de desenvolvimento das plantas (SANTOS; PREZOTTO; MAIA, 2001).
O mesmo nematoide foi encontrado na cactácea ornamental flor-de-maio (Schlumbegera sp) oriunda de Jundiaí e de Jacareí-SP afetando o crescimento ds
plantas, reduzindo o número de flores e alterando a cor da parte aérea (OLIVEIRA
et. al., 2007)
34
2.6 Fitonematoides
Os nematoides fitoparasitas afetam diversas partes da planta como caule, folhas e sementes, mas estão associados, principalmente, a órgãos subterrâneos como raízes, tubérculos, rizomas e bulbos. Esses organismos penetram na planta e se movimentam no tecido vegetal causando danos mecânicos, toxidez e também agem com ação espoliadora, retirando água e nutriente da planta para seu próprio desenvolvimento (FERRAZ et. al., 2012).
Os fitonematoides pertencem ao Filo Nematoda (ou Nemata). São animais microscópicos (0,2 a 3,0 mm), pseudocelomados, na maioria das vezes alongados, havendo distinção entre machos e fêmeas pelos órgãos reprodutores. Porém, pode haver variação no formato do corpo da fêmea que se apresenta mais volumosa, sendo nesse caso, um dimorfismo sexual. Possuem estilete caniculado, com o qual injetam enzimas ou toxinas no tecido vegetal e deles retiram o conteúdo citoplasmático fluido. Possuem sistema digestivo completo, mas não possuem sistema respiratório, tampouco sistema circulatório. As trocas gasosas ocorrem pela cutícula. Seu corpo é revestido de cutícula transparente, rica em proteína, sendo lisa ou estriada. Apresenta simetria bilateral e não possui segmentações. São animais aquáticos, encontrados em todos os tipos de solo, bastando que haja pelo menos uma película de água para mantê-los vivos. A reprodução pode ser do tipo sexuada ou por partenogênese (TIHOHOD, 1993; FERRAZ et. al., 2012; FERRAZ; BROWN,
2016).
Os fitonematoides se encontram amplamente disseminados nas áreas de produção agrícola do Brasil afetando numerosas espécies cultivadas. Em razão de seu tamanho diminuto e dos sintomas induzidos na planta serem confundidos com déficit hídrico, nutricional e tratos culturais mal conduzidos, muitas vezes sua presença na área é negligenciada. Sua disseminação ocorre por meio de mudas, material propagativo, água de irrigação, chuvas e movimento de solo (TIHOHOD, 1993; FERRAZ et. al., 2012).
Avaliações de perdas econômicas já estimaram que o montante de prejuízos na agricultura devido à presença de fitonematoides ultrapassou os 80 bilhões de dólares americanos, cerca de 262 bilhões de reais (NICOL et. al. 2011).
35
Ditylenchus, Bursaphelenchus, Rotylenchulus, Xiphinema, Naccobus e Aphelenchoides (LOPES; FERRAZ, 2016).
2.7 Nematoides formadores de cistos
Os nematoides formadores de cistos pertencem à família Heteroderidae e subfamília Heteroderinae. Nessa sub-familia, estão presentes 21 gêneros de nematoides, dos quais apenas cinco têm realmente a capacidade de formar cistos:
Cactodera Krall & Krall, 1978; Dolichodera Mulvey & Ebsary, 1980; Globodera
Skarbilovich, 1959; Heterodera Schmidt, 1871 e Punctodera Mulvey & Stone, 1976.
O número de espécies descritas tem aumentado muito nas últimas cinco décadas (EVANS; ROWE, 1998).
Nesses cinco gêneros, as fêmeas são globosas com cor branca ou amarelada. Com a maturação tornam-se castanho-escuras. Algumas liberam parte dos ovos em uma massa gelatinosa (Heterodera) outras, porém retêm todos os ovos
em seu corpo (Globodera, Punctodera, Dolichodera e Cactodera). Com a retenção
de parte ou de todos os ovos, ocorre uma compressão interna deslocando os órgãos e provocando sua morte. A cutícula além de escura, torna-se espessa e muito resistente. Essas estruturas (fêmeas mortas retendo ovos) são denominadas cistos, as quais conferem longa sobrevivência aos nematoides (AMORIM; REZENDE; BERGAMIM FILHO, 2011; WILSON, 2017).
Em 1951, os nematoides formadores de cistos já eram uma grande preocupação na agricultura, uma vez que causavam danos a várias culturas como soja, batata, cereais, brássicas, tomate e beterraba açucareira. Naquela década a distribuição dos nematoides do gênero Heterodera era concentrada em regiões de
clima temperado, com aproximadamente 12 espécies, conforme estudo dos nematologistas da época. Atualmente, o gênero Heretodera detém 80 espécies
acomodados em 7 grupos distintos distribuídos em regiões temperadas, tropicais e sub-tropicais, parasitando plantas de 18 famílias botânicas diferentes: Anarcardiaceae, Asteraceae, Betulaceae, Chenopodiaceae, Cruciferae, Cyperaceae, Fabacea, Lamiaceae, Moraceae, Plumbaginaceae, Poacea, Polygonaceae, Rosacea, Saxifragaceae, Salicaceae, Umbelliferae e Urticaceae (EVANS; ROWE 1998). No Brasil, Heterodera glycines e H. fici, já foram relatados causando danos à
36
2.7.1 O Gênero Cactodera
O gênero Cactodera foi proposto por Krall e Krall, em 1978, para abrigar a
espécie Cactodera cacti, espécie tipo, anteriormente denominada de Heterodera
cacti Filipjev & Schuurmans Stekhoven, 1941. Esta espécie foi primeiramente
relatada em Cereus speciosa e Phyllocactus akkermanni por Adam em 1932, o qual
acreditava juntamente com o Goffart, importante nematologista da época, tratar-se de uma raça de H. schachtii adaptada aos cactos. Os cistos tinham forma esférica,
porém tinham o cone vulvar diminuto, com fenestração circular, ausência de fenestração anal e ausência de uma massa externa de ovos. Tais características eram muito diferentes das espécies do gênero Heterodera (EVANS; ROWE, 1998).
Em 1941, a espécie foi denominada de Heterodera cacti por Filipjev & Schuurmans
Stekhoven, e finalmente reclassificada para C. cacti (ESSER, 1992; EVANS; ROWE,
1998).
O gênero Cactodera é caracterizado por ter o estádio de cisto presente e
pelas fêmeas com corpo de formato de limão ou globoso. Quando jovens as fêmeas são branco- leitosas (0,37- 0,63 mm) (GRANEY; BIRD, 1990) e na maturação a coloração da cutícula tornam-se amarelas a castanha, formando, em seguida, os cistos. Nas fêmeas maduras e nos cistos, o cone vulvar (região da vulva localizada sobre uma elevação de aspecto cônico) e o ‘pescoço’ são curtos. Ao microscópio eletrônico de varredura, observam-se na cutícula dos cistos uma rugosidade constituída de estrias irregulares transversas, com linhas verticais ou oblíquas curtas. A vulva apresenta fenestração única de formato circular com uma abertura de 20 µm de diâmetro (muito curta para passagem de ovos), não apresenta fenestração anal e todos os ovos (cerca de 300 a 400 ovos) são acomodados dentro do cisto, não apresentando saco de ovos (WILSON, 2017).
37
2.7.1.1 Classificação taxonômica
FILO Nematoda - Potts, 1932
CLASSE Chromadorea - Inglis, 1983
SUBCLASSE Chromadoria - Pearse, 1942 ORDEM Rhabditida - Chitwood, 1933
SUBORDEM Tylenchina - Chitwood, 1950
INFRAORDEM Tylenchomorpha - De Ley & Blaxter, 2002 SUPERFAMILIA Tylenchoidea - Orley, 1980
FAMILIA Heteroderidae - Filipjev & Schuurmans Stekhoven, 1941 SUBFAMILIA Heteroderinae - Filipjev & Schuurmans Stekhoven, 1941
GÊNERO Cactodera - Krall and Krall, 1978
ESPÉCIE - Cactodera cacti (Filipjev & Schuurmans Stekhoven, 1941)
Krall & Krall, 1978 (CAIXETA; FURLANETTO; CARES, 2015).
2.7.1.2 Ciclo de vida
38
seu corpo fique exposto para fora da raiz com a parte anterior (região esofagiana) fixada à raiz. Assim, a fêmea é visualizada como uma pequena esfera branca ou amarela com cerca de 0,5 mm de diâmetro. Apesar do corpo visível externamente, o hábito do nematoide é do tipo endoparasita sedentário. Para originar um adulto macho, o J4 passa por um processo de metamorfose e se transforma em um individuo fusiforme (0,9 - 1,13 mm). Os machos ocorrem em grande número e são sexualmente ativos (AMORIM; REZENDE; BERGAMIM FILHO, 2011; GRANEY; BIRD, 1990; SEINHORST, 1985) .
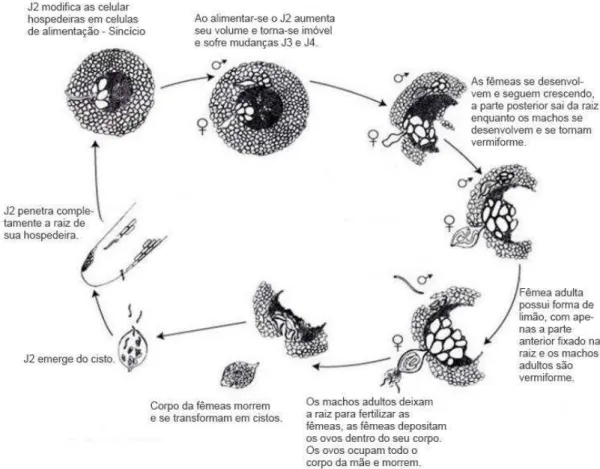
A reprodução de heteroderídeos é principalmente por anfimixia, onde há cópula. A fêmea retém os ovos, preenchendo a totalidade do seu corpo, em seguida torna-se marrom, origina o cisto que se desprende da raiz. O ciclo completo de ovo a ovo dura em torno de 30 dias para a maioria dos nematoides formadores de cistos (Figura 6), podendo ser mais curto ou mais longo dependendo da temperatura (AMORIM; REZENDE; BERGAMIM FILHO, 2011).
Figura 6 - Ciclo de vida de Cactodera cacti.
39
Existem quinze espécies de Cactodera (C. acnidae, C. amaranthi, C.
aquatica, C. betulae, C. cacti, C. chaubattia, C. eremica, C. estonica, C. evansi, C.
galinsogae, C. johanseni, C. milleri, C. thorne, C. torreyanae e C. weissi ) que
parasitam espécies vegetais dentro das famílias Amaranthaceae, Asteraceae, Betulaceae, Brassicaceae, Cactaceae, Caryophyllaceae, Chenopodiaceae, Poaceae, Polygonaceae, Portulacaceae, Rosaceae e Solanaceae. A espécie C.
cacti foi relatada associada a plantas dentro das famílias Cactacea, Apiaceae,
Euphorbiaceae (ESSER, 1992).
Acredita-se que o gênero Cactodera tenha se evoluído perto do México, já
que é considerado o centro de origem das cactáceas. O C.cacti pode ser encontrado
em plantas nativas na Argentina, Brasil, Colômbia, México e partes dos EUA. O gênero não parasita apenas plantas de clima tropical ou subtropical, também é encontrado em regiões temperadas (EVANS; ROWE, 1998).
Registros de C. cacti no Brasil ocorreram nos anos de 2001 e 2007 e
somente em São Paulo, nos quais o nematoide foi relatado parasitando algumas cactáceas ornamentais em vasos (SANTOS; PRETOZZO; MAIA, 2001) e posteriormente afetando a ornamental Flor de maio (Schlumbergera sp.) em
condições de casa de vegetação (OLIVEIRA et. al., 2007), não constituindo, assim,
relatos de ocorrência natural do patógeno em campo.
Não há muitos estudos sobre os efeitos das espécies de Cactodera em
culturas, em grande parte porque as hospedeiras parecem não ser economicamente importantes. Uma situação possível de se constituir grande problema seria nos casos em que as plantas hospedeiras fossem cultivadas com interesse comercial, como, o caso da
Opuntia (Palma) que é explorada como uma cultura comercial no México. Nessa
situação, o nematoide poderia provocar danos diretos ou favorecer a infecção por patógenos secundários resultando em perdas (BALDWIN; MUNDO-OCAMPO, 1991).
40
3. MATERIAIS E MÉTODOS
Este trabalho foi conduzido em condições de casa de vegetação com uma espécie de nematoide formador de cisto, da família Heteroderidae, cuja ocorrência natural no estado do Ceará nunca havia sido registrada.
As análises dos ensaios foram realizadas junto ao Laboratório de Fitopatologia, Setor de Fitossanidade pertencente ao Departamento de Fitotecnia do Centro de Ciências Agrárias, da Universidade Federal do Ceará (UFC) - Campus do Pici, Fortaleza-CE.
Estudos específicos visando a correta identificação do patógeno, foram realizados na Agronômica - Laboratório de Diagnóstico Fitossanitário e Consultoria (Porto Alegre-RS), após o devido encaminhamento realizado pelo Ministério de Agricultura, Pecuária e Abastecimento - MAPA.
O período de realização do trabalho foi entre agosto de 2016 e junho de 2017.
3.1 Histórico do nematoide no Ceará
Inicialmente, várias amostras de solos foram coletadas no Campus do Pici para aulas práticas da disciplina Fitopatologia II, obrigatória para os alunos do Curso de graduação em Agronomia. As amostras de solo coletadas serviriam para demonstrar aos alunos a Extração de Nematoides do Solo, segundo a técnica desenvolvida por Jenkins (1964) denominada "Método da Flotação Centrífuga em Solução de Sacarose" (TIHOHOD, 1993). Nessa técnica a amostra de solo é depositada em um balde adicionando-se água corrente. Após agitação e decantação do solo, a suspensão é vertida sobre peneiras de 20 (abertura 0,84 mm) de e 400 mesh (abertura 0,037 mm) sobrepostas. O material retido na peneira de 400 mesh é recolhido utilizando jatos de água e distribuído em tubos de centrífuga, submetendo-os à uma centrifugação a 1.800 rpm por cinco minutsubmetendo-os. O sobrenadante é descartado, sendo adicionado ao sedimento uma solução de sacarose a 45%. Após ressuspensão e nova centrifugação por apenas um minuto, o sobrenadante é recolhido em peneiras de 400 mesh. O material é lavado sob água corrente para retirada da sacarose e recolhido com jatos de água em placas de Petri para exame dos exemplares de nematoides extraídos do solo.
41
pudessem analisar as formas de fitonematoides migradores comumente presentes no solo. Em uma dessas extrações, foi evidenciada a presença de alguns cistos de nematoides repletos de ovos e juvenis no seu interior. Esse fato causou surpresa uma vez que era desconhecida a existência de nematoides formadores de cisto no Ceará.
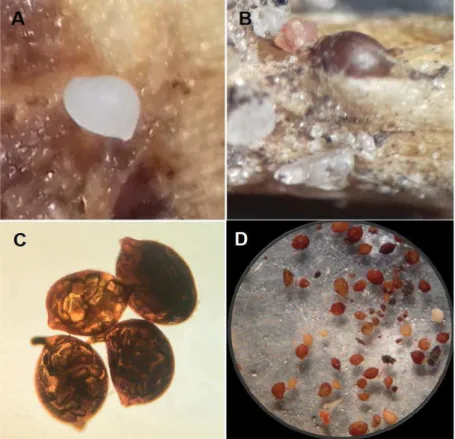
A partir de então, passou-se a procurar o seu hospedeiro natural nos locais onde fora coletado as amostras do solo. Após algumas análises de raízes de plantas presentes nas imediações dos locais de coleta, foi constatado que o nematoide estava infectando naturalmente raízes de plantas adultas de mandacaru, cactácea típica do Nordeste (Figura 7). Nas raízes superficiais da planta coletadas no local, foram observadas fêmeas e numerosos cistos do nematoide. Nas amostras de solo obtidas no local também estavam presentes grande quantidade de cistos (Figura 8).
Após uma breve revisão na literatura sobre nematoides em cactáceas, as informações obtidas levaram a suspeitar tratar-se da espécie Cactodera cacti,
heteroderídeo já relatado em mandacaru.
Figura 7- Mandacaru naturalmente infectado com Cactodera cacti no Campus do
Pici. Setas apontam para as raízes superficiais coletadas.
42
Figura 8 - Cactodera cacti: Fêmea (A); Detalhe de cisto incrustado em raiz de
mandacaru (B); Cistos contendo ovos (C); Numerosos cistos obtidos do solo (D).
Fonte: Autor.
Após relato da ocorrência do novo patógeno no estado do Ceará ao MAPA, o mesmo providenciou que fosse efetuada a identificação da espécie do nematoide a partir de amostras coletadas e preparadas na UFC e enviadas para a Agronômica - Laboratório de Diagnóstico Fitossanitário e Consultoria (RS).
O relatório encaminhado ao MAPA pelo referido Laboratório, informava que, de acordo com estudos de caracteres morfológicos realizados com o patógeno, aliado à técnica Polymerase Chain Reaction (PCR) utilizando primers específicos
[PRI736 (D3B), PRI737 (D2ab)] para o heteroderídeo das cactáceas, o nematoide associado ao mandacaru era realmente o Cactodera cacti (Filipjev & Schuurmans
Stekhoven, 1941) Krall & Krall, 1978.
Este resultado configura-se como o primeiro relato do heteroderídeo parasitando naturalmente plantas de mandacaru no estado do Ceará e no Brasil.
43
hospedeiras.
Para o desenvolvimento deste trabalho, foram conduzidos três ensaios com diferentes espécies vegetais, incluindo: a) cactáceas ornamentais, b) cactáceas forrageira e frutífera, c) plantas hortaliças, visando-se, em todos os ensaios, a identificação de hospedeiros do nematoide.
Tentativa de extração de fêmeas e cistos foram, inicialmente, realizadas com uma metodologia adaptada da proposta por Coolen e D'Herde (1972) para nematoides de raízes. Nesta extração modificada, raízes de mandacaru foram manualmente lavadas sobre peneiras de 100 mesh. O material retido nessa peneira foi transferido para tubos de centrífugas utilizando-se pisseta com água. Em seguida, adicionaram-se, aproximadamente, 5 gramas de caulim e centrifugou-se a suspensão a 1.800 rpm por 5 minutos. Nessa etapa os cistos não sedimentaram sendo recolhidos, à parte, no descarte do sobrenadante. Ao precipitado adicionou-se sacarose com concentração variando de 45 a 60%. O sedimento foi ressuspendido e novamente centrifugado na mesma velocidade por 1 minuto. O sobrenadante foi colhido em peneira de 100 mesh e em seguida analisado. Entretanto não foi possível obter fêmeas, pois nessa ocasião as mesmas sedimentavam juntamente com caulim.
Diante do exposto, foi necessário buscar nova metodologia para otimizar a obtenção de cistos.
3.2 Método de extração de cistos empregado para heteroderídeo
A população de C. cacti utilizada no primeiro ensaio foi obtida a partir de
solo e raízes de mandacaru naturalmente infestadas. Para a obtenção de ovos para a inoculação, foi utilizada uma adaptação da técnica de extração de cistos de
Heterodera glycines a partir do solo seco desenvolvida pelo Shepherd em 1970