UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM - FFOE MESTRADO EM CIÊNCIAS FARMACÊUTICAS
Andréa Bessa Teixeira
Avaliação das atividades antimicrobiana e antioxidante
dos óleos essenciais das folhas dos quimiotipos I, II e III de
Lippia alba
(Mill.) N. E. Brown
ANDRÉA BESSA TEIXEIRA
Avaliação das atividades antimicrobiana e antioxidante
dos óleos essenciais das folhas dos quimiotipos I, II e III de
Lippia alba
(Mill.) N. E. Brown
Fortaleza
2009
Dissertação apresentada à Coordenação do Programa de Pós-Graduação em Ciências Farmacêuticas da Universidade Federal do Ceará para a obtenção do Título de Mestre em Ciências Farmacêuticas.
Orientadora: Profa. Dra. Nádia Accioly Pinto Nogueira
ANDRÉA BESSA TEIXEIRA
Avaliação das atividades antimicrobiana e antioxidante dos óleos essenciais
das folhas dos quimiotipos I, II e III de
Lippia alba
(Mill.) N. E. Brown
Dissertação apresentada à Coordenação do Programa de Pós-Graduação em Ciências Farmacêuticas da Universidade Federal do Ceará, para a obtenção do Título de Mestre em Ciências Farmacêuticas.
Aprovada em ____/____/____
Banca Examinadora:
___________________________________________________________ Profa. Dra. Nádia Accioly Pinto Nogueira (orientadora)
Departamento de Análises Clínicas e Toxicológicas (UFC)
___________________________________________________________ Prof. Dr. Thalles Barbosa Grangeiro
Departamento de Biologia (UFC)
___________________________________________________________ Profa. Dra. Maria Goretti Rodrigues de Queiroz
DEDICATÓRIA
AGRADECIMENTOS
A Deus, minha fonte inesgotável de fé e força maior, que proporcionou estes momentos de felicidade, amor e ciência a minha pequena sabedoria.
Aos meus pais, Francisco José Tavares Teixeira e Maria Aparecida Bessa Teixeira, e irmãs, Luciana Bessa Teixeira e Janaína Bessa Teixeira, pelo amor incondicional, que sempre me fortaleceu para realização de todos os sonhos. Vocês são os maiores exemplos de conduta que seguirei até o fim dos meus dias e primordiais em todas as minhas vitórias e assim, em tudo que tenho e sou. Eu amo muito vocês.
As Tias Joseni Bessa e Tereza Bessa, que com seu tão imenso amor e dedicação me fazem sentir como uma filha. Obrigada por sempre torcerem pelo meu sucesso.
À minha orientadora Profa. Dra. Nádia Accioly Pinto Nogueira, pelo imprescindível e valioso apoio, pelos ensinamentos, tanto profissionais como pessoais, pela confiança, dedicação e paciência, principalmente nos momentos mais delicados da minha vida. Minha sincera gratidão e profundo reconhecimento.
À Profa. Dra. Luzia Kalyne Almeida Moreira Leal, a quem coube a co-orientação desta dissertação, desejo manifestar os meus agradecimentos pela pronta disponibilidade, sempre que precisei de ajuda, e pelo encorajamento que naturalmente me foi transmitido.
À Dânya Bandeira Lima, minha excelente estagiária, pela ajuda, força, incentivo e total dedicação. Trabalhamos, aprendemos, rimos, conversamos, choramos enfim, tantos momentos que serviram para o nosso crescimento. Continue sempre assim. Você será um exemplo de profissional.
À minha amiga Maria Mirele, que apesar de um pouco distante, sei que posso contar sempre com você e que o seu pensamento de energia me deu forças para mais essa conquista. Nas amizades verdadeiras o tempo nunca passa e as distâncias nunca existem. Eu te agradeço de todo coração e também te adoro muito!
Às minhas amigas Suzana Bezerra e Maria Cristina que juntas trilhamos o mesmo caminho de luta e vitória. A companhia de vocês foi um diferencial que me motivou, principalmente nesta fase final. Obrigada pela paciência, pelas horas agradáveis de estudo e debate, pelos ótimos momentos de desabafo e lógico, pelos grandes eventos de descontração. Continuaremos em frente.
À família “de Souza Cavalcante” a qual me deram a oportunidade de conhecer, fazer parte e proporcionar momentos felizes. Vocês me ajudaram muito. Não deixaram de me apoiar, de torcer por mim e de me incentivar a seguir em frente com ânimo, mesmo em momentos difíceis. Guardarei para sempre vocês no meu coração.
As minhas amigas do “Clube da Luluzinha”, Sarah Rachel, Danielle Oliveira e Lyanna Ferreira, pelas tão boas risadas, brincadeiras, pelos planos e confidencias, pela partilha, crescimento enfim, pelos vários momentos alegres. Adoro fazer parte deste “Clube”.
A toda família do LabMicro (Lívia, Mirlayne, Elieyde, Cássia, Larissa, Eric, Felipe) que sempre esteve disposta a colaborar e pelos momentos de alegria e amizade. Sentirei saudades.
Aos meus queridos funcionários de trabalho em Canindé, especialmente a Mayra Cavalcante, que tanto ajudou quando precisei me ausentar. Obrigada amiga, pela sua dedicação, força, torcida e pela paciência e disponibilidade em me auxiliar nos resultados.
Aos parceiros de trabalho, Eduardo Ribeiro, Jean Guilherme, Mailson e Anderson Souza, pela fundamental colaboração e empenho na realização da atividade antioxidante.
A secretária Raimundinha pelo valioso auxílio, paciência e amizade.
Aos meus amigos do mestrado pela agradável parceria concedida durante este período.
Aos membros da banca: Profa. Dra. Goretti Rodrigues e Prof. Dr. Thalles Barbosa por terem assumido a difícil tarefa de avaliar e contribuírem na importante fase de conclusão do meu trabalho.
“Para realizar grandes conquistas, devemos não apenas agir, mas também sonhar; não apenas planejar, mas também acreditar. Nas grandes batalhas da vida, o primeiro passo para a vitória é o desejo de vencer!”
RESUMO
AVALIAÇÃO DAS ATIVIDADES ANTIMICROBIANA E ANTIOXIDANTE DOS ÓLEOS ESSENCIAIS DAS FOLHAS DOS QUIMIOTIPOS I, II E III DE Lippia alba (Mill.) N. E. Brown. Aluna: Andréa Bessa Teixeira. Orientadora: Profa. Dra. Nádia Accioly Pinto Nogueira. Co-Orientadora: Luzia Kalyne Almeida Moreira Leal. Dissertação de Mestrado. Programa de Pós-Graduação Em Ciências Farmacêuticas. Departamento de Análises Clínicas e Toxicológicas e Departamento de Farmácia. Universidade Federal do Ceará.
A espécie Lippia alba (erva-cidreira) é muito usada na medicina popular. A composição de seu óleo essencial apresenta variações quantitativas e qualitativas, levando à classificação de diferentes quimiotipos. Um rico potencial farmacológico está relacionado à ampla variação na composição química desses óleos, o que desperta o interesse de pesquisadores em estabelecer explicações científicas para tais atividades. O objetivo do trabalho foi avaliar as atividades antimicrobiana e antioxidante dos óleos essenciais dos quimiotipo I, II e III, de folhas, de L. alba, bem como investigar suas possíveis relações com a composição química de seus óleos essenciais. A caracterização química dos constituintes dos óleos essenciais foi realizada utilizando a CG-MS, determinando-se a porcentagem dos constituintes presentes nas amostras. O potencial antimicrobiano dos óleos foi determinado pelo método de difusão em ágar, e as CIM e CLM pelos métodos da microdiluição em caldo de cultura e do plaqueamento em ágar, respectivamente. A atividade antioxidante foi avaliada pela dosagem de TBARS e pela determinação da atividade de remoção de radicais livres pelo DPPH. Os óleos essenciais das folhas de L. alba foram reconhecidos pela presença de seus constituintes majoritários em quimiotipo I (citral-mirceno); quimiotipo II (citral-limoneno) e quimiotipo III (carvona-limoneno). Os três óleos essenciais apresentaram atividade sobre S. aureus, mesmo as multirresistentes, e C. albicans. Para as bactérias Gram-negativas, os três quimiotipos apresentaram ação sobre o A. lwoffi; os quimiotipos II e III inibiram o crescimento do A. baumannii; e apenas o quimiotipo II foi que teve ação sobre E. coli ATCC 10536. As mais baixas CIM e CLM obtidas para os óleos essenciais dos quimiotipos I, II e III, foram de 0,312 e 0,625mg/mL, 0,312 e 0,312mg/mL e 0,625 e 0,625mg/mL, respectivamente. A técnica de difusão em ágar serviu como uma etapa preliminar na determinação do potencial antimicrobiano e a determinação da CIM por diluição em caldo acompanhada de leitura das densidades óticas das culturas, mostrou valores de absorbâncias semelhantes ao grupo controle positivo até uma determinada concentração e então aumentaram, indicando um maior crescimento microbiano. Os três quimiotipos do OELA reduziram a peroxidação lipídica induzida no hipocampo e cérebro de ratos, contudo não apresentaram atividade seqüestradora de radicais livres mensuradas através do teste do DPPH. Assim, os resultados sugerem que os óleos essenciais dos quimiotipo I, II e III de L. alba, possuem excelente atividade antimicrobiana, principalmente sobre S.aureus e C. albicans; que o método de difusão é um excelente método de triagem; que o método da diluição, por inspeção visual e leitura de absorbância, permite determinar alem da CIM, a CLM e avaliar a cinética de inibição de crescimento microbiano; o potencial antioxidante mostrado pelo OELA no hipocampo e córtex de rato, torna esses produtos uma ferramenta farmacológica em potencial no tratamento de doenças neurodegenerativas, contudo, para isso estudos adicionais são necessários; e que as diferenças na composição do óleo é um fator que deve ser considerado importante nos estudos farmacológicos.
ABSTRACT
EVALUATION OF ANTIOXIDANT AND ANTIMICROBIAL ACTIVITIES OF ESSENTIAL OILS OF LEAVES OF CHEMOTYPE I, II AND III OF Lippia alba (Mill.) N. E. Brown. Author: Andréa Bessa Teixeira. Advisor: Prof. Dr. Nádia Accioly Pinto Nogueira. Co-Advisor: Luzia Kalyne Almeida Moreira Leal. Dissertation. Post-Graduate in Pharmaceutical Sciences. Department of Clinical and Toxicological Analysis and Department of Pharmacy. Federal University of Ceará.
The species Lippia alba (erva cidreira) is widely used in folk medicine. The composition of essential oil varies quantitative and qualitative, leading to the classification of different chemotypes. A rich pharmacological potential is related to the wide variation in chemical composition of these oils, which arouses the interest of researchers in establishing scientific explanations for such activities. The objective of this study was to evaluate the antimicrobial and antioxidant activities of essential oils of chemotype I, II and III, leaves of L. alba, and to investigate their possible relationships with the chemical composition of their essential oils. The chemical characterization of constituents of essential oils was performed using GC-MS by determining the percentage of constituents present in the samples. The antimicrobial activity of oils was determined by agar diffusion, and MIC and CLM methods by microdilution broth culture and plated on agar, respectively. The antioxidant activity was assessed by measurement of TBARS and by determining the activity of removal of free radicals by DPPH. Essential oils from leaves of L. alba were recognized by the presence of its major constituents in chemotype I (citral-myrcene), chemotype II (citral-limonene) and chemotype III (carvone-limonene). The three essential oils showed activity against S. aureus, even resistant, and C. albicans. For Gram-negative bacteria, the three chemotypes present action on the A. lwoffi; the chemotypes II and III inhibited the growth of A. baumannii, and only the chemotype II was that acted on E. coli ATCC 10536. The lowest MIC obtained for CLM and essential oils of chemotypes I, II and III were 0,312 and 0,625mg/mL, 0,312 and 0,312mg/mL and 0,625 and 0,625mg/mL, respectively. The diffusion technique in agar served as a preliminary step in determining the antimicrobial activity and MIC determination by broth dilution accompanied by reading of optical densities of cultures showed absorbance values similar to the positive control group by a certain concentration and then increased indicating a higher microbial growth. Three chemotypes of OELA reduced lipid peroxidation induced in the hippocampus and brain of rats, but showed no scavenging activity of free radicals measured by the DPPH test. Thus, the results suggest that essential oils of chemotype I, II and III of L. alba, have excellent antimicrobial activity, especially on S. aureus and C. albicans, whereas the diffusion method is an excellent screening method, the dilution method, by visual inspection and reading of absorbance, in addition to determine the MIC, the CLM and evaluate the kinetics of inhibition of microbial growth, the antioxidant potential shown OELA by the hippocampus and cortex of rats makes these products a potential pharmacological tool in the treatment of neurodegenerative diseases, however, for that additional studies are needed, and that differences in the composition of the oil is a factor to be considered important in studies pharmacological.
LISTA DE ABREVIATURAS
ATCC American Type Culture Collection
BHI Brain Heart Infusion
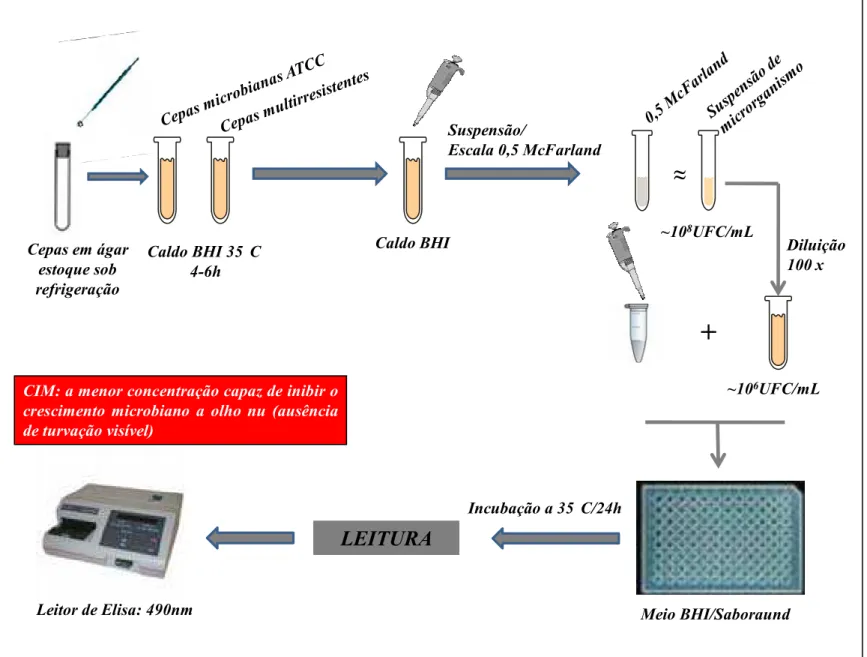
CIM Concentração Inibitória Mínima
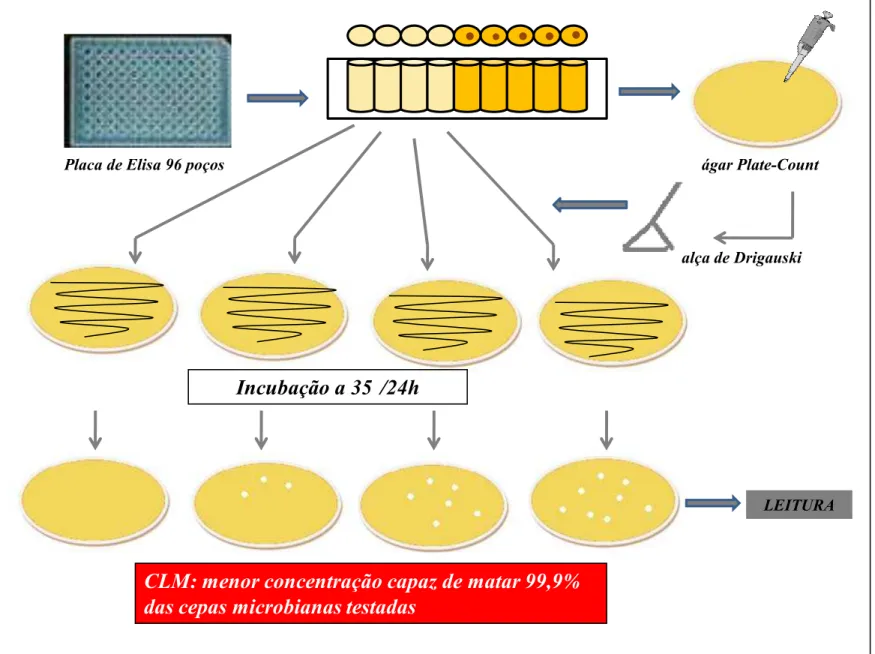
CLM Concentração Letal Mínima
CLSI Clinical and a Laboratory Standards Institute
CG-MS Cromatografia gasosa com detecção por espectrometria de massas
DPPH 2,2-diphenyl-1-picrylhydrazyl
EPM Erro Padrão Médio
HI Halo de inibição
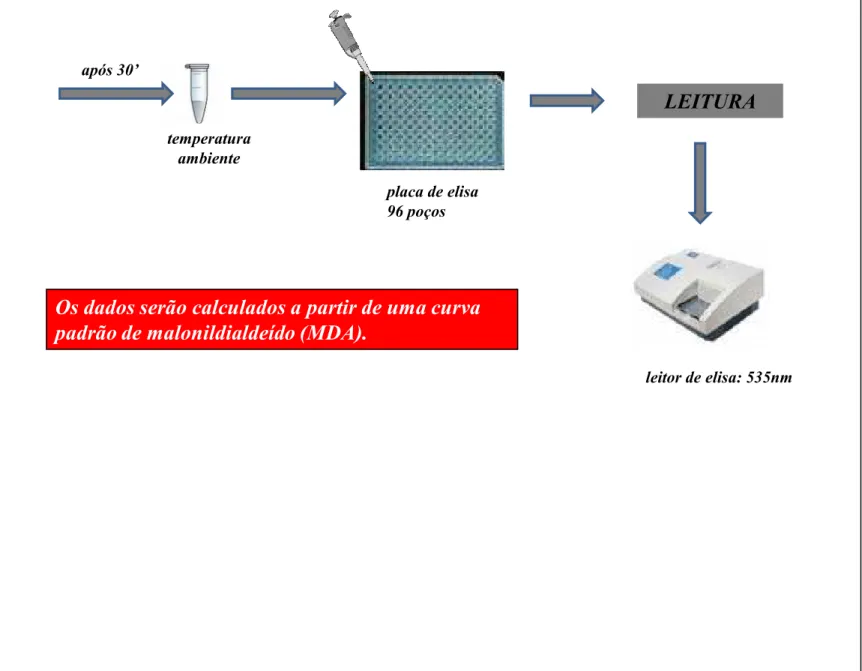
MDA Malonildialdeído
OELA Óleo essencial de Lippia alba N.E.Brown
TBARS Substâncias reativas do ácido tiobarbitúrico
LISTA DE FIGURAS
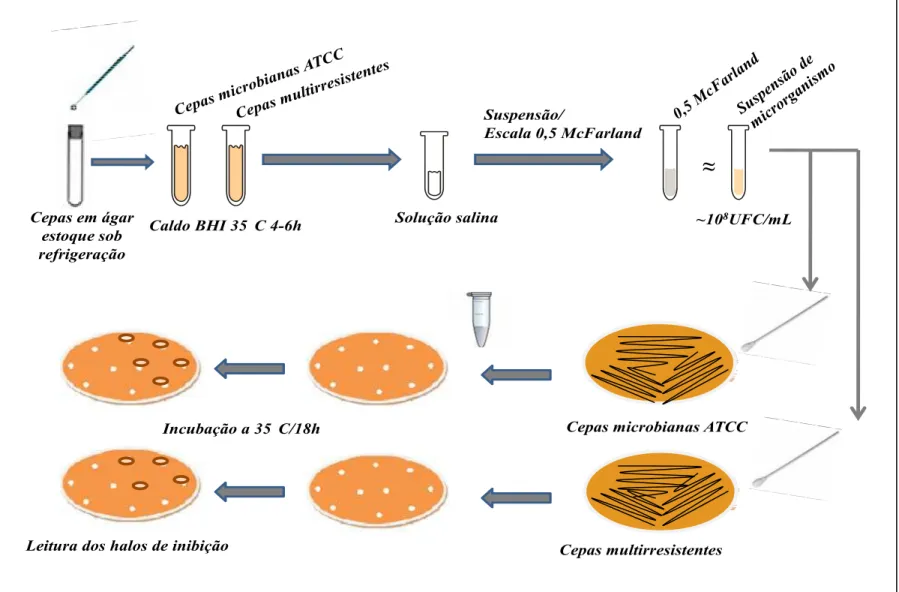
Figura 01: Fluxograma da técnica de difusão em poço. 55
Figura 02: Fluxograma da técnica de microdiluição em caldo para a determinação da
CIM. 61
Figura 03: Fluxograma da técnica de Pour-Plate para a determinação da CLM. 63
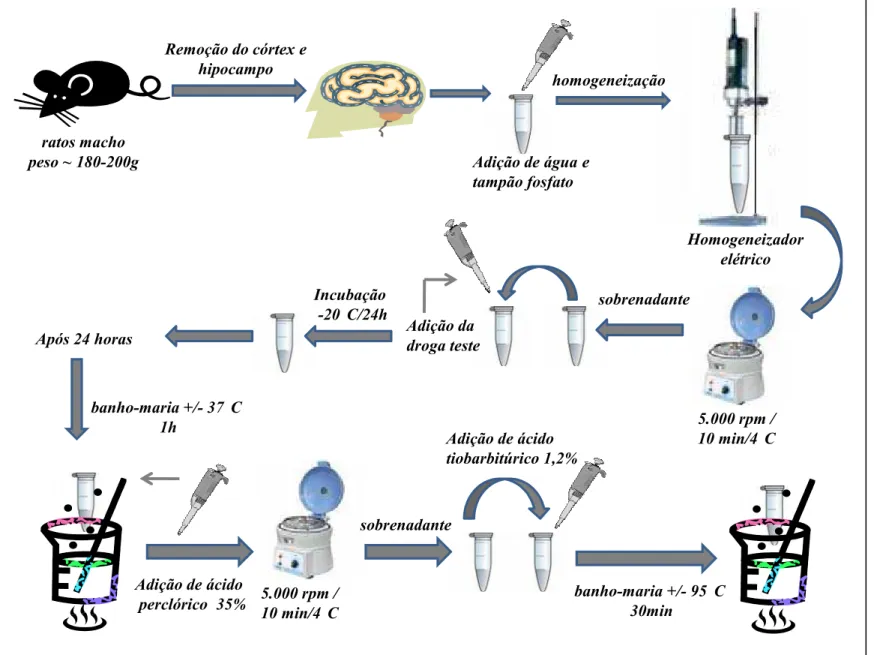
Figura 04: Fluxograma da dosagem das substâncias reativas de ácido tiobarbitúrico. 65
Figura 05: Fluxograma da dosagem das substâncias reativas de ácido tiobarbitúrico
(continuação). 66
Figura 06: Fluxograma do ensaio do radical livre DPPH 68
Figura 07: Cromatograma do óleo essencial das folhas de Lippia alba N. E. Br., quimiotipo I, realizado através da cromatografia gasosa com detecção por
espectrometria de massas (CG-MS) (ADAMS, 2001). 73
Figura 08: Cromatograma do óleo essencial das folhas de Lippia alba N. E. Br., quimiotipo II, realizado através da cromatografia gasosa com detecção por
espectrometria de massas (CG-MS) (ADAMS, 2001). 74
Figura 09: Cromatograma do óleo essencial das folhas de Lippia alba N. E. Br., quimiotipo III, realizado através da cromatografia gasosa com detecção por
espectrometria de massas (CG-MS) (ADAMS, 2001). 75
Figura 10: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre S. aureus ATCC 6538P
determinados pelo método de difusão em ágar. 82
10231 determinados pelo método de difusão em ágar. 82
Figura 12: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre E. coli ATCC 10536
determinados pelo método de difusão em ágar. 83
Figura 13: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre A. lwoffi determinados
pelo método de difusão em ágar. 85
Figura 14: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre A. baumannii
determinados pelo método de difusão em ágar. 85
Figura 15: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre S. aureus 1 determinados
pelo método de difusão em ágar. 86
Figura 16: Diâmetro dos halos de inibição de crescimento microbiano pelos óleos essenciais das folhas de L. alba, quimiotipos I, II e III sobre S. aureus 2determinados
pelo método de difusão em ágar. 86
Figura 17: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo I, sobre S. aureus ATCC 6538P. 91
Figura 18: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo I, sobre C. albicans ATCC 10231. 91
Figura 19: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo I, sobre de S. aureus 1. 92
Figura 21: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo I, sobre A. lwoffi. 93
Figura 22: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre S. aureus. 94
Figura 23: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre C. albicans. 94
Figura 24: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre de E. coli. 95
Figura 25: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre de A. lwoffi. 95
Figura 26: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre A. baumannii. 96
Figura 27: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre S. aureus 1. 96
Figura 28: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo II, sobre S. aureus 2. 97
Figura 29: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo III, sobre S. aureus. 98
Figura 30: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo III, sobre C. albicans. 98
Figura 32: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo III, sobre S. aureus 2. 99
Figura 33: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo III, sobre de A. lwoffi. 100
Figura 34: Cinética da inibição do crescimento microbiano do óleo essencial das folhas de L. alba, quimiotipo III, sobre de A. baumannii. 100
Figura 35: Atividade antioxidante do óleo essencial das folhas de Lippia alba, quimiotipo I, II e III determinado através da dosagem de substâncias reativas do ácido tiobarbitúrico (TBARS) (AGAR et al., 1999). 102
Figura 36: Atividade antioxidante do óleo essencial das folhas de Lippia alba, quimiotipo I, determinado pelo método de DPPH (SAINT-CRICQ DE GAULEJAC
et al., 1999). 103
Figura 37: Atividade antioxidante do óleo essencial das folhas de Lippia alba, quimiotipo II, determinado pelo método de DPPH (SAINT-CRICQ DE GAULEJAC
et al., 1999). 104
Figura 38: Atividade antioxidante do óleo essencial das folhas de Lippia alba, quimiotipo III, determinado pelo método de DPPH (SAINT-CRICQ DE GAULEJAC
LISTA DE FOTOS
Foto 01: Espécie Lippia alba N.E. Brown cultivada no Horto de Plantas Medicinais Prof. Francisco José de Abreu Matos da Universidade Federal do Ceará: a: L. alba quimiotipo I; b: L. alba quimiotipo II e c: L. alba quimiotipo III 49
Foto 02: Semeadura das suspensões bacterianas na superfície de ágar Mueller-Hinton. 56
Foto 03: Confecções de poços de 5mm de diâmetro interno no ágar com auxílio de
um perfurador. 56
Foto 04: Remoção do ágar com auxílio de uma pinça para a formação dos poços. 57
Foto 05: Aplicação de volumes de 25µL dos óleos essenciais de folhas de L. alba em
diferentes concentrações. 57
Foto 06: Leitura das placas e interpretação dos resultados. 58
Foto 07: Ensaio de difusão em ágar do óleo essencial das folhas de L. alba, quimiotipo II,
sobre a cepa de S. aureus. 78
Foto 08: Ensaio de difusão em ágar do óleo essencial das folhas de L. alba, quimiotipo II,
sobre a cepa de P.aeruginosa. 78
Foto 09: Ensaio de microdiluição em caldo mostrando a CIM detectado a “olho nu”
LISTA DE TABELAS
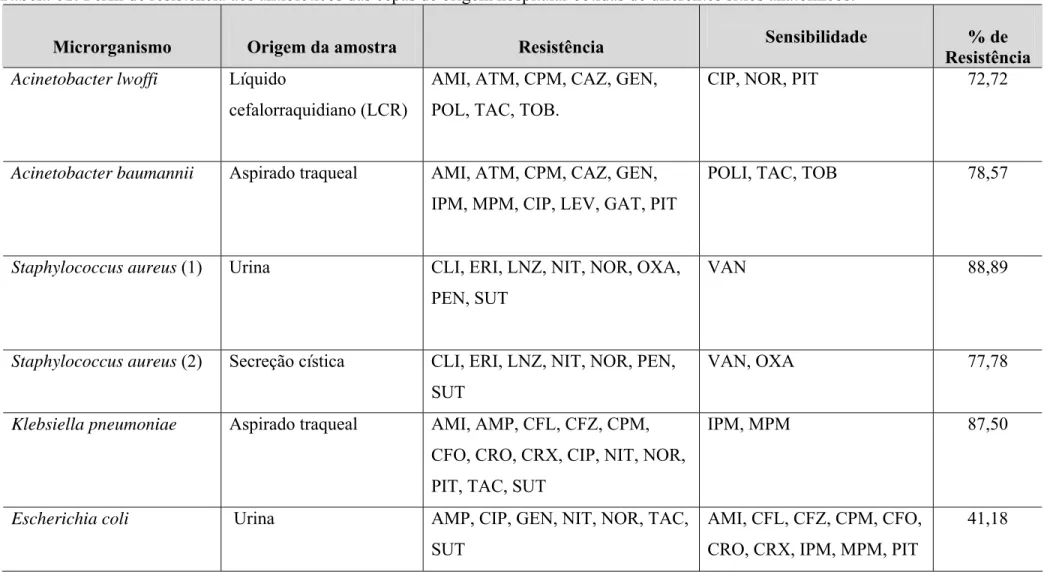
Tabela 01: Perfil de resistência aos antibióticos das cepas de origem hospitalar obtidas
de diferentes sítios anatômicos. 52
Tabela 02: Rendimento médio dos óleos essenciais das folhas de Lippia alba N.E. Brown, quimiotipos I, II e III, extraído pela técnica de destilação com arraste de vapor d’água.
71
Tabela 03: Porcentagens dos componentes químicos dos óleos essenciais das folhas de Lippia alba N. E. Br., quimiotipos I, II e III realizado através da cromatografia gasosa com detecção por espectrometria de massas (CG-MS). 76
Tabela 04: Potencial antimicrobianodos óleos essenciais de folhas da Lippia alba N.E. Brow, quimiotipos I, II e III, sobre cepas microbianas originárias da ATCC, determinado pela técnica de difusão em ágar (CLSI 2003). 79
Tabela 05: Potencial antimicrobiano dos óleos essenciais de folhas da Lippia alba N.E. Brow, quimiotipos I, II e III, sobre cepas microbianas multirresistentes de origem hospitalar, determinado pela técnica de difusão em ágar (CLSI 2003). 80
Tabela 06: Concentração Inibitória Mínima (CIM) e Concentração Letal Mínima (CLM) dos óleos essenciais de folhas de Lippia alba N.E. Brown, quimiotipos I, II e III da sobre cepas microbianas originárias da ATCC e cepas microbianas multirresistentes de origem hospitalar, determinado pela técnica da microdiluição em caldo de cultura (CLSI, 2003) e de plaqueamento em meio sólido (BARON et al., 1994). 89
Tabela 07: Atividade antioxidante pelo método de DPPH expresso em percentagem de inibição dos óleos essenciais das folhas de L. alba, quimiotipo I, II e III.
SUMÁRIO
1 INTRODUÇÃO
1.1 Considerações Gerais 22
1.2 Óleos essenciais 24
1.3 Antimicrobianos e resistência bacteriana 26
1.4 Antimicrobianos de origem vegetal 29
1.5 Espécies Reativas de Oxigênio e Estresse Oxidativo 32
1.6 Estresse Oxidativo e Doenças Neurodegenerativas 34
1.7 A Família Verbanaceae e o gênero Lippia 36
1.8 A espécie Lippia alba (Mill) N. E. Brown e seus quimiotipos 38 1.9 Aplicações e propriedades biológicas da Lippia alba 41 1.10 Plantas medicinais: a importância e necessidade de estudos
multidisciplinares 44
2 OBJETIVOS
2.1 Objetivo Geral 47
2.2 Objetivos Específicos 47
3 MATERIAIS E MÉTODOS
3.1 Material botânico 49
3.2 Óleo essencial 50
3.2.1 Extração do óleo essencial de folhas de L. alba 50
3.2.2. Análise do óleo essencial 50
3.2.3 Preparação das diluições seriadas dos óleos essenciais de folhas de L. alba 50
3.3 Cepas Microbianas 51
3.3.1 Cepas microbianas ATCC 51
3.3.2 Cepas microbianas multirresistentes isoladas de espécimes clínicos 51
3.3.3 Manutenção das cepas microbianas 51
3.4 Determinação do Potencial Antimicrobiano dos Óleos Essenciais de Folhas
da L. alba 53
3.4.1 Determinação da atividade antimicrobiana 53
3.5 Avaliação da atividade antioxidante, in vitro, dos óleos essenciais de folhas
da L. alba 64
3.5.1 Avaliação do efeito dos óleos essências das folhas de L. alba, quimiotipos I, II e III, sobre a peroxidação lipídica induzida pelo choque térmico em cérebro de ratos: dosagem de substâncias reativas do ácido tiobarbitúrico 64
3.5.2 Ensaio do radical livre DPPH 67
3.6 Análise Estatística 69
3.7 Comitê de Ética 69
4 RESULTADOS
4.1 Avaliação do rendimento médio e caracterização química dos constituintes dos óleos essenciais das folhas de Lippia alba N.E.Brown, quimiotipos I, II e III. 71 4.1.1 Rendimento médio dos óleos essenciais das folhas de Lippia alba,
quimitipos I, II e III. 71
4.1.2 Composição química dos constituintes dos óleos essenciais das folhas de
Lippia alba, quimitipos I, II e III. 72
4.2 Avaliação do potencial antimicrobiano, determinação da Concentração Inibitória Mínima (CIM) e da Concentração Letal Mínima (CLM) dos óleos essenciais das folhas de Lippia alba, quimiotipos I, II e III. 77 4.2.1 Potencial antimicrobiano dos óleos essenciais das folhas de Lippia alba, quimitipos I, II e III determinado pelo método de difusão em ágar (CLSI,
2003). 77
4.2.2 Concentração Inibitória Mínima (CIM) e Concentração Letal Mínima (CLM) dos óleos essenciais das folhas de Lippia alba, quimiotipos I, II e III determinadas pelos métodos de microdiluição em caldo de cultura (CLSI, 2003) e plaqueamento em meio sólido (BARON et al., 1994). 87 4.3 Avaliação da atividade antioxidante dos óleos essenciais das folhas de
Lippia alba, quimiotipos I, II e III. 101
4.3.1 Atividade antioxidante dos óleos essenciais das folhas de Lippia alba, quimiotipos I, II e III determinado através da dosagem de substâncias reativas do ácido tiobarbitúrico (TBARS) (AGAR et al., 1999). 101 4.3.2 Atividade antioxidante dos óleos essenciais das folhas de Lippia alba, quimiotipos I, II e III determinado pelo método de DPPH (SAINT-CRICQ DE
5 DISCUSSÃO
5.1 Avaliação do rendimento médio e caracterização química dos constituintes dos óleos essenciais das folhas de Lippia alba N.E.Brown, quimiotipos I, II e III. 107 5.2 Avaliação do potencial antimicrobiano, determinação da Concentração Inibitória Mínima (CIM) e da Concentração Letal Mínima (CLM) dos óleos essenciais das folhas de Lippia alba, quimiotipos I, II e III. 110 5.3 Avaliação da atividade antioxidante dos óleos essenciais das folhas de
Lippia alba, quimiotipos I, II e III. 121
6 CONCLUSÃO 124
1 INTRODUÇÃO
1.1 Considerações Gerais
“A busca de novos medicamentos em plantas é hoje a
esperança mais concreta para pacientes que possuem doenças graves.
A alternativa mais rápida e barata são as plantas que produzem
substâncias químicas que podem ser usadas como medicamentos.
Partindo de vegetais, as chances de acertos são de uma para cinco
mil tentativas” (FERESIN et al, 2001).
A utilização da fitoterapia não é nova, se tem demonstrado “factos” que indicam que desde o ano de 2100 A.C. a civilização mesopotâmica utilizava as plantas medicinais. Hoje em dia, não existe dúvida sobre a importância das plantas e apesar do desenvolvimento alcançado pela síntese química, estas constituem um arsenal de substâncias biologicamente ativas. As plantas medicinais têm um papel importante no cuidado da saúde das pessoas no mundo. A sociedade humana, em todas as épocas, tem acumulado um vasto arsenal e conhecimento tradicional sobre o uso das plantas para fins medicinais.
O homem moderno pode ser compreendido e diferenciado das demais épocas por seu elevado consumo de medicamentos e conseqüentemente, a procura do mercado mundial por produtos de origem natural, em substituição aos sintéticos, aumenta consideravelmente.
O uso de produtos naturais como matéria-prima para a síntese de substâncias bioativas, especialmente fármacos, tem sido amplamente relatada ao longo dos tempos (SIMÕES, 2004). Essa importância dos produtos naturais nas formulações de medicamentos pode ser vista quando se considera que, mesmo nos países industrializados, 45% dos produtos farmacêuticos provêm de produtos naturais e essa proporção é ainda maior nos países subdesenvolvidos (HOLTEZ et al, 2002).
incessantemente a descoberta de novas formulações à base de extratos, óleos ou mesmo produtos sintéticos.
O Brasil é um país com grande diversidade em sua flora, por isso constitui um grande campo de estudo e pesquisa, facilitando assim a descoberta de princípios ativos vegetais. Muitas espécies de vegetais são extensamente utilizadas na medicina popular, com diferentes finalidades terapêuticas, levando-as a serem alvos constantes e crescentes de inúmeros estudos, para o conhecimento de suas propriedades químicas e farmacológicas, bem como para a comprovação de sua segurança e do seu uso popular (BARBOSA-FILHO et al, 2006; ROCHA et al, 2005).
Segundo a Organização Mundial de Saúde, 80% da humanidade não têm acesso ao atendimento primário de saúde, por estarem muitos distantes dos centros de saúde ou por não possuírem recursos para adquirir os medicamentos prescritos. Para essa população, as terapias alternativas são as principais formas de tratamento, e as plantas medicinais os principais medicamentos (AKERELE, 1993).
Em muitas comunidades e grupos étnicos, o conhecimento sobre plantas medicinais simboliza geralmente o único recurso terapêutico. Nos dias atuais, nas regiões mais pobres do País e até mesmo nas grandes cidades brasileiras, plantas medicinais são comercializadas em feiras livres, mercados populares e encontradas em quintais residenciais.
MARTINS et al (1995) relatam um aumento acentuado do uso de plantas medicinais pela população mundial e a tendência é de contínuo crescimento. Segundo estudos de SOUSA et al (1991) e MATOS (1998) o principal uso de plantas medicinais é no tratamento das doenças respiratórias, seguido das inflamações em geral e das diversas formas de doenças intestinais. Quanto a efetividades terapêuticas dessas plantas documentadas por esses autores, muitas já possuem informações farmacológicas que podem justificar o seu uso popular. Assim, esse tipo de cultura medicinal desperta o interesse de pesquisadores em estudos para terapia natural envolvendo componentes de plantas na área farmacêutica e as pesquisas com esses produtos naturais assumem papel importante para a saúde humana.
1.2 Óleos essenciais
Desde muitos séculos atrás, os óleos essenciais são relatados e explorados. Embora ainda hoje não se tenha documentado completamente o início exato, sabe-se que as referências históricas de obtenção e utilização desses óleos estão ligadas, originalmente, aos países orientais, com destaque para o Egito, Japão, China e Índia. Acredita-se que os primeiros usos dos óleos essenciais tenham sido através de bálsamos, ervas aromáticas e resinas que eram usadas para embalsamar cadáveres em cerimônias religiosas a milhares de anos atrás (SILVA-SANTOS, 2002; LAVABRE, 1992; BRAGA, 1971).
Aqui no Brasil, sua produção teve início em 1927, tendo como base o puro e simples extrativismo de essências nativas, como o pau-rosa (Aniba rosaeodora). Sua exploração foi tamanha que atualmente o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA) colocou essa planta na lista de espécies em perigo de extinção. No entanto, como atividade verdadeiramente organizada, a produção de óleos essenciais no Brasil só foi consolidada basicamente na sua venda voltada ao mercado externo, com a obtenção dos óleos de menta, laranja, canela, eucalipto, capim-limão e outros. Isto ocorreu durante a Segunda Guerra Mundial, devido à grande demanda imposta pelas indústrias do ocidente, que se viram privadas de suas tradicionais fontes de suprimento, em virtude da desorganização do transporte e do comércio (BRAGA, 1971).
O mercado internacional de óleos essenciais corresponde atualmente a US$ 1,8 bilhões, sendo que a participação do Brasil neste momento é estimada em apenas 1%, principalmente em resposta à exportação de óleos de laranja, limão, eucalipto, pau-rosa, lima e alecrim-pimenta. As comunidades científicas estão cada vez mais organizadas e diversos novos óleos podem vir a contribuir para o quadro de exportação (SILVA-SANTOS, 2002).
Os óleos essenciais apresentam composições complexas, algumas vezes, de centenas de diferentes compostos químicos, com ação sinérgica ou complementar entre si. De forma geral, são misturas complexas contidas em diversos órgãos vegetais e constituídas principalmente de terpenos, sesquiterpenos, ésteres, alcoois, fenóis, aldeídos, óxidos, peróxidos, cetonas e ácidos orgânicos. Em sua composição também são encontrados antibióticos, vitaminas, hormônios e anti-sépticos (SIANI et al, 2000). Nessa mistura, tais compostos apresentam-se em diferentes concentrações, normalmente, um deles é o composto majoritário, existindo outros em menores teores e alguns em baixíssimas quantidades (traços). Os estudos relatam que a constituição química do óleo essencial nem sempre é constante, podendo variar significativamente, de acordo com o processamento de colheita e pós-colheita (parte da planta coletada, hora da coleta, época do ano), do material genético da planta (variedade do vegetal), bem como das condições de cultura e desenvolvimento do vegetal (tipo de solo e clima) (SIMÕES, 2004; LAVABRE, 1992), tendo como conseqüência, influencia diretamente no potencial farmacológico dessas plantas (MATOS, 2001).
A ampla variação química do óleo essencial permite a separação das espécies em quimiotipos (QT) ou raças químicas. A ocorrência de quimiotipos é freqüente em plantas ricas em óleos voláteis e é um termo aplicado a plantas da mesma espécie, com a mesma aparência externa (botanicamente idênticas), mas que diferem, às vezes consideravelmente, na composição química dos óleos essenciais (SIMÕES, 2004; CASTRO, 2001). Por exemplo, para Chrysanthemum vulgare (L.) Berhn, popularmente conhecida como catinga-de-mulata, apenas na Hungria, foram caracterizados 26 quimiotipos, com diferenças significativas na composição de seus óleos (TEUSCHER, 1990).
Muitos estudos têm comprovado as propriedades farmacológicas de compostos extraídos de óleos essenciais de plantas. Pode ser citada como propriedades farmacológicas relativamente bem estabelecidas a ação carminativa do óleo de funcho, erva-doce, camomila, menta; a ação sobre o Sistema Nervoso Central, como estimulante (óleos voláteis contendo cânfora), depressor (melissa, capim-limão) ou mesmo provocando convulsões em doses elevadas (sálvia, canela); a ação anestésica local do óleo do cravo-da-índia pelo seu alto teor em eugenol e a ação antiinflamatória do óleo de camomila, que contém azulenos (SIMÕES, 2004).
1.3 Antimicrobianos e resistência bacteriana
As primeiras descrições sobre o uso de antimicrobianos datam de 3.000 anos atrás, quando médicos chineses usavam bolores para tratar edemas inflamatórios e feridas infeccionadas, e os sumérios recomendavam um emplasto com uma mistura de vinho, cerveja, zimbro e ameixas (TAVARES, 2001).
No início do século XX, surgiram os primeiro quimioterápicos de ação sistêmica. Os esforços do cientista alemão Paulo Ehrlich, considerado pai da quimioterapia, que descobriu o salvarsan (sal do arsênico) usado no tratamento da sífilis e da febre recorrente, revolucionaram a terapêutica das infecções e provocaram o desenvolvimento da pesquisa, objetivando a obtenção de novas substâncias medicamentosa sintetizadas em laboratórios (TORTORA, 2003).
Outro marco importante na história dos antimicrobianos foi a descoberta por Alexander Fleming em 1928 da penicilina, o primeiro antibiótico de utilidade clínica. Fleming estudando culturas de Staphylococcus aureus observou que uma das culturas tinha sido contaminada por bolores e em volta dessas colônias não havia mais crescimento bacteriano. Então Fleming e seu colega, Dr. Pryce, descobriram que a substância responsável pela inibição do crescimento do S.aureus era produzida pelo fungo Penicillium nonatum, a qual foi denominada de penicilina (KONEMAN et al, 2001).
O advento dos antibióticos e dos quimioterápicos permitiu o controle e cura das doenças infecciosas, mudando a evolução natural dessas doenças de forma marcante. No entanto, o uso indiscriminado de antimicrobianos, provocou a partir da década de 70, um processo de aceleração do aparecimento de cepas bacterianas resistentes aos antimicrobianos, principalmente nos ambientes hospitalares (LINARES-RODRIGUES et al, 2005; WAGENLEHNER et al, 2005).
O termo “resistência” se refere aqueles microrganismos que tem a capacidade de crescer in vitro em presença das concentrações que esta droga atinge no sangue. A resistência pode ser de dois tipos: natural ou intrínseca e adquirida (TORTORA, 2003; KONEMAN et al, 2001; TAVARES, 2001;).
A resistência natural ou intrínseca faz parte das características biológicas primitivas dos microrganismos e é observada regularmente em uma determinada espécie bacteriana em relação a diferentes antimicrobianos. Resulta de genes cromossômicos que codificam a existência, na célula, de estruturas ou mecanismos que impedem o antibiótico de agir em seu receptor ou que codificam a falta do sitio de ação da droga ou que determinam a existência de receptores inadequados para a ligação com uma substancia especifica (TORTORA, 2003; KONEMAN et al, 2001; TAVARES, 2001).
A resistência adquirida a uma determinado antimicrobiano é aquela que surge em uma bactéria primitivamente sensível a este mesmo antimicrobiano. Essa resistência acontece devido a mutações que ocorrem no microrganismo durante seu processo reprodutivo e resulta de erros de cópia na seqüência de bases que formam o DNA ou por meio de transferências do material genético, em que consiste na importação de genes causadores da resistência, pelos mecanismos de transdução, transformação e conjugação, que, freqüentemente, envolve genes situados em plasmídios e transposons (TORTORA, 2003; KONEMAN et al, 2001; TAVARES, 2001).
Os diferentes mecanismos de resistência podem tornar a cepa microbiana capaz de resistir parcial ou totalmente à ação, não apenas de um antibiótico, mas de vários, pertencentes a uma mesma classe e às vezes a classes diferentes (OTAIZA, 2002).
Os estafilococos vêm mostrando crescente resistência a lactâmicos beta-lactamase-resistentes, como é o caso dos S. aureus resistente a meticilina - MRSA (Methicilin Resistant Staphylococcus aureus) ou a oxacilina (OxacilinResistant Staphylococcus aureus) – ORSA, principalmente em hospitais de grande porte, com serviços de emergência abertos ao público e centros de referencias para pacientes infectados.É reconhecido como um dos mais importantes patógenos causadores de infecções nosocomiais em todo o mundo e o surgimento e disseminação de cepas cada vez mais virulentas e multirresistentes é um fator preocupante (TAVARES, 2001).
Um exemplo, dessa preocupação, é que em 2002 já foram confirmados nos Estados Unidos da América (EUA) tanto em laboratório como em clínica, linhagens mutantes com sensibilidade reduzida à vancomicina (FRIDKIN, 2002), como também, nesse mesmo ano, descreve o primeiro caso documentado de infecção causada por S. aureus com resistência completa a vancomicina (VRSA) (Vancomicina MIC > 32mcg/mL) (SIEVERT et al, 2002).
Além do S. aureus, dentre os microrganismos que sofrem grandes modificações na sensibilidade aos antimicrobianos com o correr dos anos, destacam-se as enterobactérias, como a Escherichia coli e Klebsiella pneumoniae, a Pseudomona aeruginosa, o Acinetobacter baumannii, os fungos e as leveduras do gênero Candida, especialmente a Candida albicans (KONEMAN et al, 2001, TAVARES, 2001 CHARTONE-SOUZA et al, 1998). Esses patógenos representam cada vez mais um desafio emergente ao tratamento das infecções causadas por eles.
Em um estudo feito por MENEZES e colaboradores em 2004, determinando o perfil de resistência de A.baumannii a antimicrobianos nas unidades de terapia intensiva e semi-intensiva do Hospital Geral de Fortaleza, verificaram que 62 (14%) das 437 amostras analisadas foram positivas para essa bactéria, sendo o maior número de isolados do aspirado traqueal e sangue. Quanto ao perfil de resistência observaram que as cepas isoladas de cateteres foram resistentes a quase todos os antimicrobianos, com exceção das quinolonas e imipenen (MENEZES et al, 2004).
Atualmente, o problema de resistência tornou-se mais grave devido às dificuldades para a descoberta e o lançamento de novos antimicrobianos no mercado, pois são necessários muitos anos e um custo altíssimo para que um antimicrobiano esteja á disposição no mercado, o que leva a esses produtos estarem cada vez mais escassos e mais caros.
descoberta nos últimos anos, apesar das intensas pesquisas das indústrias farmacêuticas e CHARTONE-SOUZA (1998) confirma que uma das alternativas usadas pelas indústrias farmacêuticas tem sido a modificação química da estrutura dos antimicrobianos já existentes, na tentativa de torná-los mais eficientes ou de recuperar a atividade prejudicada pelos mecanismos bacterianos de resistência.
Dessa forma, esses dados antecipam os gravíssimos problemas que poderão trazer essas cepas microbianas resistentes, caso não surjam novos antimicrobianos ou terapias alternativas para combatê-las.
1.4 Antimicrobianos de origem vegetal
“O problema da resistência microbiana é crescente e a
perspectiva futura do uso de drogas antimicrobianas, é incerta”.
(NASCIMENTO et al, 2000).
Como descrito anteriormente, um dos maiores problemas de saúde pública enfrentados nas últimas décadas consiste no agravamento da resistência a antimicrobianos em populações bacterianas e fúngicas, principalmente em cepas de origem hospitalar e que o Brasil é um rico ambiente para estudos com produtos naturais, os quais constituem uma importante fonte de novos compostos para serem utilizados na terapêutica. Nestes dois aspectos, a busca por novas substâncias antimicrobianas a partir de fontes naturais vem ganhando importância e está cada vez mais intensificada.
Acredita-se que as plantas medicinais sejam as melhores fontes de obtenção dessas novas drogas e muitos estudos têm sido conduzidos, em diferentes partes do mundo para comprovar sua eficiência. Muitas plantas são usadas por sua atividade antimicrobiana, a qual se deve a compostos sintetizados em seu metabolismo secundário (NASCIMENTO et al, 2000).
A atividade antimicrobiana de plantas medicinais tem sido pesquisada em diversas espécies e relatada em muitos países como no Cuba, Índia, México e Malásia que possuem uma flora diversificada e uma rica tradição na sua utilização (DUARTE et al, 2005, STASI et al, 2002, NASCIMENTO et al, 2000).
plantas medicinais, o que resulta no interesse da realização de importantes pesquisas sobre atividade antimicrobiana de vegetais e o uso de componentes de plantas nessa área tem aumentado gradualmente.
O uso de extratos vegetais e fitoquímicos com conhecida atividade antimicrobiana assume importante significado nos tratamentos terapêuticos. Muitas espécies vegetais são reconhecidas por suas substâncias ativas que apresentam atividade antimicrobiana contra um grande número de microrganismos, incluindo espécies resistentes a antibióticos e antifúngicos (NASCIMENTO et al, 2000).
Em estudo realizado por SOUZA etal em 2004, foi avaliada a atividade biológica de 49 plantas em farmácias comunitárias caseiras no Rio Grande do Sul. De dezoito espécies analisadas quanto a sua atividade antimicrobiana, onze (Chaptalia mutans, Cordia monosperma, Echinodorus grandiflorus, Eugenia uniflora, Leonurus sibiricus, Luehea divaricata, Malva sylvestris, Ocotea odorifera, Parapiptadenia rigida, Pluchea sagittalis, Psidium cattleyanum e Senna neglecta) inibiram no mínimo um dos microrganismos testados.
Em outra pesquisa, foi analisada a atividade antimicrobiana do extrato de 120 espécies de plantas de 28 diferentes famílias botânicas. Oitenta e um desses extratos, obtidos de 58 plantas, mostraram-se ativos contra S. aureus, enquanto cinco extratos, de quatro plantas, inibiram o crescimento de Pseudomonas aeruginosa (SANTOS-FILHO et al, 1990).
BASTOS em 2007, estudando o uso de preparações caseiras de plantas medicinais utilizadas no tratamento de doenças infecciosas, verificou que das quarenta e cinco amostras analisadas, 25 (55,6%) apresentaram atividade inibitória sobre o crescimento de pelo menos um dos microrganismos testados. Duas dessas amostras (romã e cebolinha + pepaconha + cumaru + beterraba + alho + mel de abelha) foram capazes de inibir todas as cepas testadas; as amostras de alfavaca + eucalipto e cebolinha branca + eucalipto + aroeira + pepaconha foram ativas contra Pseudomonas aeruginosa, microrganismo bastante conhecido por sua múltipla resistência a drogas.
Em 2004, FARAGO e colaboradores analisaram a atividade antibacteriana de óleos essenciais de Ocimum selloi Benth, conhecida popularmente como alfavaca, pertencentes às variedades estragol e eugenol. Os resultados in vitro demonstraram que tanto a variedade estragol como a eugenol inibiram o crescimento das cepas de S.aureus ATCC 25923 e de E.coli ATCC 25922, mas que nenhuma teve ação contra P.aeruginosa ATCC 27853.
PEREIRA e colaboradores (2004) analisaram a atividade antibacteriana de óleos essenciais de Ocimum gratissimum L., Cybopogum citratus (DC) Stapf. e Salvia officinalis L. sobre 100 cepas de bactérias isoladas de indivíduos da comunidade com diagnóstico de infecção urinária. Os resultados mostraram ser a ação inibitória do óleo essencial de Salvia officinalis L., superior as apresentadas pelos óleos essenciais extraídos das outras ervas, tendo eficácia de 100% sobre espécies dos gêneros Klebsiella e Enterobacter, 96% sobre Escherichia coli, 83% sobre Proteus mirabilis e 75% sobre Morganella morganii. Foi verificado que os óleos essenciais das outras duas espécies, embora menos potentes que o óleo essencial de Salvia officinalis L., foram capazes de inibir o crescimento de 16% das cepas estudadas.
LIMA et al, 2006, avaliaram a atividade antifúngica de óleos essenciais sobre espécies de Candida (C. albicans, C. guilliermondii, C. krusei, C. parapsilosis, C. stellatoidea e C. tropicalis) e observaram que todos os óleos essenciais extraídos de Cinnamomum zeylanicum Blume, Citrus limon Risso, Eucalyptus citriodora HK, Eugenia uniflora L., Peumus boldus Benth e Rosmarinus officinallis L. foram capazes de inibir o crescimento de pelo menos uma das cepas fúngicas testadas e que os óleos essenciais de C. zeylanicum e P. boldus inibiram o crescimento da maioria das cepas.
Nesse sentido, os óleos essenciais assumem um importante papel no combate ao desenvolvimento de resistência microbiana, levando a oportunidade de serem encontrados compostos com propriedades antimicrobianas, muitas vezes superiores aos fármacos atuais.
1.5 Espécies Reativas de Oxigênio e Estresse Oxidativo
O oxigênio é um composto essencial para os seres vivos. As moléculas de oxigênio diatômico na atmosfera terrestre são as maiores promotoras de reações nas células vivas. Exceto aqueles organismos que são especialmente adaptados para viver em condições anaeróbias, todos os animais e plantas requerem oxigênio para uma eficiente produção de energia (HALLIWELL & GUTTERIDGE, 2000).
Cerca de 2% a 5 % do oxigênio consumido, dá origem a intermediários altamente reativos, denominados Espécies Reativas de Oxigênios (EROs). Estas espécies incluem o oxigênio singlete (1O2), o radical ânion superóxido (O2--), o peróxido de hidrogênio (H2O2),
radical hidroxila (OH •) entre outros (SALVADOR & HENRIQUES, 2004).
O Radical Livre é qualquer átomo, molécula ou íon que possui um ou mais elétron livre na sua orbita externa, o que caracteriza uma grande instabilidade elétrica e capacidade reativa, podendo reagir com qualquer composto que esteja próximo, a fim de captar um elétron desse composto para sua estabilização. A maioria desses radicais livres é derivada do metabolismo do O2 pelo organismo, pois em condições normais é inevitável a produção das
EROs durante o processo de respiração celular que ocorre nas mitocôndrias das células, a fim de gerar ATP. A mitocôndria, que consome mais de 90% de oxigênio, é a principal fonte de espécies reativas de oxigênio e de radicais livres (LEE et al, 2002).
Além da respiração celular, as EROs também podem ser geradas pela ativação dos leucócitos, como parte da resposta imune, usadas contra bactérias e fungos invasores do organismo, produzindo ação lesiva a estes microrganismos, ou pela oxidação exógena, causada pela poluição, fumo, solventes orgânicos, pesticidas e radiações, por exemplo (HALLIWELL, 2001; NISSEN et al, 2001).
alterações no DNA e a modificação nas bases e na modulação da expressão gênica (SIES, 1991).
Para se defender da toxidade das EROs, as nossas células saudáveis apresentam mecanismos específico, que constituem o potencial biológico antioxidante. A condição fisiológica da célula exige equilíbrio entre os sistemas pró-oxidante e antioxidante. O desequilíbrio do estado estacionário em favor do sistema pró-oxidante promove injurias celulares, sendo a condição denominada de estresse oxidativo (SALVADOR & HENRIQUES, 2004).
O estresse oxidativo pode ser definido como o acumulo intracelular de níveis tóxicos de espécies reativas de oxigênio por meio de saturação do sistema antioxidante, causando danos moleculares às estruturas celulares, com conseqüente alteração funcional e prejuízo das funções vitais (DROGE, 2002).
Da ação das EROs sobre ácidos nucléicos, decorrem modificações estruturais da molécula do DNA, implicando alterações tais como mutações mutagênicas; sobre carboidratos (principalmente em glicosaminoglicanos) são capazes de provocar quebra nas cadeias dos carboidratos resultando em alterações no metabolismo energético celular e em perda do reconhecimento do contato celular, podendo levar a divisões celulares não limitadas pelo contato de células vizinhas; em proteínas causam fenômeno conhecido com peroxidação protéica, responsável por quebra de cadeias polipeptídicas, perda ou alteração de atividade enzimática, levando em alterações funcionais e estruturais nas células; sobre lipídeos resulta em peroxidação lipídica, que é principalmente responsáveis por alterações da permeabilidade da membrana celular. Desta forma, o resultado do estresse oxidativo é, com freqüência, a morte celular (AUDDY etal, 2003, DROGE, 2002).
Dessa forma, o sistema de defesa antioxidante, mesmo presente em baixas concentrações em relação ao substrato oxidante, é necessário e capaz de inibir ou retardar as taxas de oxidação. Esse sistema antioxidante pode ser não enzimático ou enzimático e não se tornam radicais livres pela doação de elétrons, pois eles são estáveis em ambas as formas (SIES, 1991).
Os antioxidantes enzimáticos são compostos pelas seguintes enzimas: superóxido-dismutase (SOD), catalase e glutationa-peroxidase (GSH-Px). A catalase, que é uma enzima bastante abundante encontrada no sangue, medula óssea, rim e fígado, tem a função de reduzir o H2O2 em H2O e O2 (HALLIWELL, 2001). A enzima superóxido-dismutase acelera a
H+. E o sistema glutationa, atua no combate da redução do peróxido de hidrogênio (H2O2),
convertendo a glutationa reduzida (GSH) em oxidada (GSSG). Essa reação é catalisada pela enzima glutationa-peroxidase (GSH-Px). A recuperação da glutationa reduzida é feita pela enzima glutationa-redutase (GSH-Rd) (DROGE, 2002).
Quanto ao sistema de defesa antioxidante nãoenzimáticos, os principais são o -caroteno (vitamina A), ácido ascórbico (vitamina C), α-tocoferol (vitamina E), glutationa, ácido úrico, bilirrubina, zinco, cobre e os bioflavonóides, derivados de plantas (HALLIWELL, 2001).
O estresse oxidativo tem sido implicado como mediadores de várias patologias tais como doenças cardiovasculares, câncer, artrite reumatóide, a distrofia muscular, desordens neurológicas e processos de envelhecimento (NORDBERG & ARNÉR, 2001). Os radicais livres correlacionados com essas doenças atuam, não como agentes etiológicos e sim como fatores que participam diretamente dos mecanismos fisiopatológicos, os quais determinam a continuidade e as complicações de diversos estados patológicos (ROVER JUNIOR et al., 2001).
1.6 Estresse Oxidativo e Doenças Neurodegenerativas
O estresse oxidativo é um importante processo que vem sendo relatado na patogênese de algumas condições que afetam o Sistema Nervoso Central (SNC), contribuindo para o desenvolvimento de doenças neurodegenerativas tais como epilepsia, esclerose múltipla, demências e doenças de Alzheimer e de Parkinson (SALVADOR & HENRIQUES, 2004) que estão entre as doenças neurodegenerativas mais comuns.
Com a tendência de aumento do tempo de vida médio da população, a prevalência dessas doenças também tem aumentado. As causas das desordens neurodegenerativas não estão totalmente esclarecidas, e, com exceção da doença de Parkinson, não existem tratamentos que alterem significativamente a progressão dessas patologias. As chances de apresentar Alzheimer aumentam significativamente após os 60 anos, com uma prevalência de 47% em pacientes com mais de 85 anos (EVANS et al, 1989). Dessa forma, além da idade as disfunções mitocondriais e o estresse oxidativo possuem um papel importante na morte neuronal característica dessas doenças (ESPOSITO etal, 2002).
energia para seu funcionamento normal e a mitocôndria é a estrutura intracelular responsável pela produção dessa energia. Para a produção eficiente de energia na forma de ATP, a mitocôndria possui uma alta demanda por oxigênio, já que utiliza uma grande quantidade de O2 em uma massa de tecido relativamente pequena, o que torna esse tecido altamente
susceptível à ação das espécies reativas (HALLIWELL, 2001; HALLIWELL & GUTTERIDGE, 2000).
Outros fatores também contribuem para essa susceptibilidade como o alto conteúdo lipídico, principalmente de ácidos graxos poliinsaturados, os quais servem de substratos para a peroxidação lipídica; os altos níveis de ferro presentes no cérebro, os quais favorecem a lipoperoxidação; o baixo potencial antioxidante, sendo os níveis de catalase particularmente baixos em muitas regiões cerebrais; e a presença de neurotransmissores auto-oxidáveis, entre outros fatores (HALLIWELL & GUTTERIDGE, 2000).
Entre as evidencias que mostram o envolvimento de espécies reativas em doenças neurodegenerativas estão o aumento dos parâmetros do estresse oxidativo no cérebro, incluindo níveis aumentado de ácido malonildialdeído (MDA), 4-hidroxinonenal (HME) e a oxidação protéica de grupos carbonil e 3-nitrotirosina, assim como concentrações reduzidas de antioxidantes não enzimáticas GSH e ascorbato, e das enzimas antioxidantes catalase e glutationa peroxidase (GSH-PX) (JENNER & OLANOW, 1996; PERRY et al, 1982).
Na doença de Alzheimer, a mais comum dentre as doenças neurodegenerativas, é possível que o estresse oxidativo tenha um papel chave na morte neuronal. Estudos clínicos mostraram níveis elevados de peroxidação lipídica e das enzimas catalase, SOD e GSH-Px em várias regiões do cérebro de pacientes com Alzheimer. Por outro lado, as concentrações intracelulares de glutationa (GSH), apresentaram-se diminuída. Níveis altos de nitrotirosina, um aminoácido oxidado, têm sido encontrados em neurônios de pacientes com Alzheimer (SALVADOR & HENRIQUES, 2004).
Na doença de Parkinson, foram observadas evidências do aumento do estresse oxidativo em autópsias da substância nigra do cérebro, indicando que esse tem papel importante na degeneração de neurônios (PARASKEVAS et al, 2003). Levantou-se a possibilidade de que um estresse oxidativo induzido pela dopamina possa ser à base da vulnerabilidade dos neurônios dopaminérgicos na Doença de Parkinson. Na degradação da dopamina, ocorre a produção de peróxido de hidrogênio (H2O2), que na presença de Fe2+,
degeneração de neurônios dopaminérgicos (GOODMAN & GILMAN, 1996). Já RIOBO e colaboradores (2002) propõem um papel direto de óxido nítrico, e de seu produto, peroxinitrito, na fisiopatologia da Doença de Parkinson.
Assim, devemos salientar que as EROs podem ser causa ou conseqüência de doenças humanas associadas ao estresse oxidativo. Por isso, antioxidantes sintéticos e naturais tem sido recomendados para o alívio dos sinais e sintomas destas doenças e, mesmo, para bloquear sua evolução. No entanto, muito deve ser investigado acerca do benefício desses antioxidantes exógenos, para garantir a dose, a via de administração e qual o antioxidante ideal para cada doença.
Neste contexto, a biodiversidade brasileira, em particular a flora do Nordeste, tem sido amplamente investigada quanto ao seu potencial terapêutico nas doenças neurológicas. De fato, os produtos naturais parecem ser uma fonte promissora de substancias com atividade antioxidante e pesquisas realizadas nos últimos anos evidenciam que o enriquecimento dos sistemas orgânicos com antioxidantes naturais
1.7 A família Verbenaceae e o gênero Lippia
As Verbenaceae constituem uma família de plantas presentes em praticamente todos os ecossistemas terrestres, sendo uma das cinco mais importantes entre as eudicotiledôneas dos campos rupestres (CASTRO, 2001; LORENZI & MATOS, 2002).
A família Verbenaceae, subfamília Verbenoideae, apresenta aproximadamente 36 gêneros e 1.305 espécies. Os gêneros mais representativos são: Verbena (200 spp.), Lippia (150), Citharexylum (70), Stachytarpheta (70), Glandularia (60) e Duranta (30) (TRONCOSO, 1974).
O gênero Lippia, o segundo maior da família, foi primeiramente descrito em 1.753 por Linnaeu (BRANDÃO, 2003) e reúne um grande número de espécies. Para TRONCOSO (1974) e SALIMENA (2000), o número de espécies estimado é de 160, estando a maior parte no Brasil, no México, no Paraguai e na Argentina, com poucas espécies endêmicas na África. O Brasil apresenta a maior diversidade em espécies do gênero Lippia, 111 espécies. Sendo os principais centros de diversidade específica do gênero Lippia localizados na Cadeia do Espinhaço, em Minas Gerais e na Chapada Diamantina, na Bahia (SALIMENA, 2000).
para os mais diversos fins. Tradicionalmente, usadas no tratamento de infecções gastrintestinais, respiratórias e cutâneas.
Em geral, as espécies do gênero Lippia apresentam na composição química de seus tecidos, alguns compostos em comuns, encontrados em várias espécies diferentes, com atividades farmacológicas antimalárica, antiviral e citostática. Em muitos casos, as partes usadas são as folhas e as flores, as quais são comumente preparadas em infusão ou decocção, mas também utilizadas oralmente ou através de emplastos e lavagens para ferimentos (LORENZI & MATOS, 2002; PASCUAL et al, 2001).
Alguns constituintes químicos presentes em L. alba (Mill.) N. E. Br. tem ação sedativa, antiespasmódica e estomáquica (GOMES et al, 1993). O extrato aquoso de L. sidoides é dotado de acentuado efeito antisséptico, antiinflamatório e cicatrizante (PASCUAL et al, 2001).
FERNANDES-FILHO et al (1998) realizaram a preparação e a análise clínica de um anti-séptico bucal à base de óleo essencial de L. sidoides Cham (alecrim-pimenta). O estudo que foi conduzido em 20 voluntários demonstrou que o anti-séptico bucal à base de óleo essencial de L. sidoides reduziu em 6% a placa bacteriana nos indivíduos que fizeram seu uso exclusivo por 7 dias, não sendo permitido durante este período realizar a escovação ou qualquer outro tipo de higienização bucal.
O óleo essencial de L. sidoides é rico em timol e carvacrol, apresentando atividade bactericida e fungicida. Em virtude destas propriedades, esse vegetal é cultivado em horto de plantas medicinais e faz parte do elenco de plantas selecionadas pelo Governo do Estado o Ceará como fitoterápico. Na Faculdade de Farmácia – UFC foi desenvolvido um anti-séptico bucal à base de óleo essencial de L. sidoides (alecrim-pimenta) elaborado pelo setor de Farmacotécnica com o objetivo de validar seu uso em programas alternativos na prevenção de cárie dental (BOTELHO, 2005).
A L. dulcis Trevir é principalmente usada no tratamento da tosse e bronquite (COMPADRE et al, 1986). Além de suas propriedades medicinais, suas folhas são também utilizadas na preparação de alimentos e apresenta como componente principal a hernandulcina, que é um constituinte sesquiterpeno do óleo essencial extraído de flores e folhas e que tem como característica de ser bem mais doce que a sacarose (KANEDA et al, 1992; COMPADRE et al, 1986)
L. citriodora e L. graveolens são utilizadas em preparações alimentar e também como estimulador de apetite (PASCUAL, 2001; MORTON, 1981). CAVALCANTI em 2006 mostrou que o óleo essencial da L. gracillis Shauer apresentou atividade tuberculostática sobre treze cepas de Mycobacterium tuberculosis, inclusive àquelas que resistentes à isoniazida.
Em várias regiões, algumas espécies do gênero Lippia também têm sido utilizadas como condimento culinário e na produção de aromatizantes, cosméticos e perfumes.
Apesar de muitas espécies apresentarem atividades biológicas comprovadas, várias outras ainda não foram estudadas, sendo provavelmente bastante promissoras para o isolamento de novas substâncias químicas com diferentes potenciais farmacológicos.
1.8 A espécie Lippia alba (Mill) N. E. Brown e seus quimiotipos
L. alba (Mill.) N. E. Brown, umas das principais espécies do gênero Lippia, é um arbusto com até dois metros de altura, bastante rústico e vigoroso, perene, muito ramificado e de morfologia variável (BRAGA et al, 2005; MATOS et al, 2001). São plantas que apresenta ramos finos, esbranquiçados, arqueados e quebradiços. Folhas opostas, elípticas, de largura variável, com bordos serreados e ápice agudo. Flores reunidas em inflorescências capituliformes de eixo curto (MATOS, 1998). Podem ser encontradas em solos arenosos e nas margens dos rios, açudes, lagos e lagoas, em regiões com clima tropical e temperado, porém preferencialmente em regiões de clima tropical (BRAGA et al, 2005).
Muito usada como planta medicinal é popularmente conhecida como erva-cidreira de arbusto, erva-erva-cidreira do campo, alecrim do campo, chá-do-tabuleiro, erva-cidreira
presença de substância como o citral e o citronelal, os quais conferem o odor cítrico característico da planta (PASCUAL et al, 2001).
Na comunidade científica, as diversas sinonímias que são conferidas a Lippia alba (Mill.) N. E. Brown também causam confusão e segundo a revisão de PASCUAL et al (2001), ela pode receber o nome de L. germinata, L. microphylla Griseb, L. germinata H. B. K., L. globiflora Kuntze, L. lantanoides Coult, Lantana alba Mill e Phyla germinata H. B. K.
A L. alba possui um rico potencial farmacológico que está relacionado à ampla variação na composição química de seu óleo essencial. Essa variação leva a classificação desta espécie em quimiotipos, que são denominados de acordo com o componente químico majoritário presente em seus óleos essenciais (JULIÃO et al, 2003; MATOS, 1996; BRAGA, 1976).
Além da variação química em seus óleos essenciais, os exemplares de diferentes quimiotipos de L. alba também apresentam variações morfológicas, principalmente devido à sua grande plasticidade fenotípica (CORREA, 1992), ou seja, o ambiente em que a planta se encontra pode determinar seu hábito de crescimento, constituição fitoquímica, forma e coloração das folhas (TAVARES et al, 2003). Esta variação morfológica, muitas vezes, leva a problemas e complexidades na taxonomia do gênero, gerando dificuldades na correta identificação da espécie.
Estudos da composição química do óleo essencial da L. alba em diferentes regiões vem apresentando variações quantitativa e qualitativa dos constituintes, o que realmente comprova a existência de muitos quimiotipos nesta espécie (CASTRO et al, 2001). No entanto, as pesquisas relatam que os principais constituintes da composição química do óleo dessa planta, são os monoterpenóides (borneol, cânfora, 1,8-cineol, citronelol, geranial, linalol, mirceno, neral, piperetona, sabineno, 2-undecanona) e os sesquiterpenóides (a-muuroleno, b-cariofileno, b-cubebeno, b-elemeno, gcadieno, alo-aromadendreno, óxido de cariofileno) (PASCUAL et al, 2001).
Na Argentina, por exemplo, são conhecidos cinco quimiotipos de L. alba: citral/linalol, d-limoneno/lippiona, d-piperitona, citral e piperitona/limoneno+1,8 cineol, encontrados em diversas regiões com diferentes características climáticas, tipos de solos e variado grau de umidade (PINO & ORTEGA, 1996)
foram: limoneno (6,5%), carvona (28,95%), piperitenona (6,35%) e b-guaieno (11,53%) (PINO & ORTEGA, 1996).
No Nordeste do Brasil, foi verificada a ocorrência de quimiotipos que diferenciam seus óleos essenciais principalmente em relação à predominância de monoterpenos tais como citral (55,1%), mirceno (10,5%) e limoneno (1,5%) (JULIÃO et al, 2003; MATOS, 1996).
No estado do Pará, o estudo dos óleos essenciais das partes aéreas da L. alba coletadas em três municípios, permitiram a divisão desta espécie em três grupos segundo os seus componentes: grupo A, caracterizado por alto teor de 1,8 cineol (34,9%) e carvona (31,8%); grupo B, com 32,1% de limoneno e 31,8% de carvona e o grupo C, caracterizado com grandes quantidades de geranial (22,5%) e germacreno-D (25,4%) (ZOGHBI et al, 1998).
Um estudo fitoquímico feito por MENDES (2001) classificou os exemplares de L. alba em oito formas, de acordo com os diferentes locais de coleta: formas 1 e 4 – Mato Grosso do Sul, forma 2 – Rio Grande do Sul, formas 3, 5 e 6 – Acre, forma 7 – Paraná e forma 8 – Goiás. A análise dos componentes principais dos óleos essenciais permitiu o agrupamento das formas em quatro grupos distintos: nas formas de 1 e 7 foram encontrados o linalol e 1,8 cineol; na forma 2, a cânfora, o óxido de cariofileno, o B-mirceno, o transcariofileno, o linalol, o cafeno, e o p-cimeno; nas formas 4, 6 e 8, o citral; e nas formas 3 e 5, o D-limoneno, germacreno-D e a carvona.
No Ceará, foi verificado a ocorrência de três quimiotipos de cidreiras, que apresentam diferenças quanto à composição química de seus óleos essenciais e de seus componentes majoritários em relação aos teores de citral, carvona, mirceno e limoneno. Os quimiotipos receberam as designações de acordo com os constituintes majoritários encontrados: o quimiotipo I, com teores elevados de mirceno e citral, mais raro no Ceará; o quimiotipo II, com teores elevados de limoneno e citral e o quimiotipo III, com limoneno e carvona e ausência de citral (MATOS et al, 2001). Diferentes do quimiotipo I, os quimiotipos II e III são morfologicamente semelhantes.
1.9 Aplicações e propriedades biológicas da Lippia alba
A Organização Mundial de Saúde estima que grande parte da população mundial continue a depender de plantas medicinais para os cuidados primários da saúde, sobretudo nas regiões mais desfavoráveis. De fato, o consumo de produtos caseiros à base de plantas já é uma realidade assimilada não só pela indústria farmacêutica, mas também pelo poder público (LORENZI & MATOS, 2002; STASI et al, 2002; AKERELE, 1993). Tanto assim, que prefeituras de vários capitais, inclusive de Fortaleza, além de inúmeras cidades do interior, já distribuem gratuitamente estes medicamentos à população, nos postos de saúde (MATOS, 1998).
Segundo MING (1992), uma espécie muito promissora para as indústrias farmacêutica, de aromas e perfumaria, é a Lippia alba. De acordo com a lista de espécies elaboradas e publicadas pela Central de Medicamentos (CEME) para o Programa de Pesquisas em Plantas Medicinais (PPPM) do Ministério da Saúde, a L. alba é dita como uma das espécies medicinais mais utilizadas pela população brasileira (SANTOS & INNECCO, 2004) e foi incluída em projetos como “Farmácias Vivas”, da Universidade Federal do Ceará (MATOS, 1998), que visa oferecer sem fins lucrativos, assistência farmacêutica fitoterápica às comunidades carentes.
Preparados a base de L. alba (erva-cidreira) são utilizados na medicina popular para o tratamento de diversos males. No Brasil, existem vários estudos que avaliam o uso de plantas medicinais para fins terapêuticos, os quais comprovam ser a espécie L. alba bastante mencionada pela população.
Na cidade de Fortaleza, em um estudo realizado sobre o uso de preparações caseiras de plantas medicinais, BASTOS (2007) mostrou que das 32 espécies utilizadas pelos entrevistados, uma das plantas mais citadas para fins medicinais é a espécie Lippia alba (erva-cidreira) (7,7%). De acordo com esse estudo, suas folhas são usadas na forma de chá para dor de barriga, calmante, gripe, febre, dor e diarréia.
De acordo com OLIVEIRA & ARAÚJO (2007), a erva-cidreira (Lippia alba N. E. Brow) foi a segunda (14,6%) espécie de planta mais utilizada pelos idosos na prevenção ou controle da elevação da pressão arterial.