UNIVERSIDADE FEDERAL DA PARAÍBA
PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA E MONITORAMENTO AMBIENTAL
LEANDRO DO NASCIMENTO MÁXIMO
ESTRUTURA E DINÂMICA DE POPULAÇÕES E
COMUNIDADES DE MACROALGAS EM AMBIENTES
RECIFAIS DA PARAÍBA
LEANDRO DO NASCIMENTO MÁXIMO
ESTRUTURA E DINÂMICA DE POPULAÇÕES E COMUNIDADES DE MACROALGAS EM AMBIENTES RECIFAIS DA PARAÍBA
Dissertação apresentada ao Programa de Pós-Graduação em Ecologia e Monitoramento Ambiental (PPGEMA) da Universidade Federal da Paraíba, como exigência parcial para obtenção do Título de Mestre em Ecologia
Orientador: Prof.º Dr. George Emmanuel Cavalcanti de Miranda
M464e Máximo, Leandro do Nascimento.
Estrutura e dinâmica de populações e comunidades de macroalgas em ambientes recifais da Paraíba / Leandro do Nascimento Máximo.-- João Pessoa, 2015.
100f. : il.
Orientador: George Emmanuel Cavalcanti de Miranda Dissertação (Mestrado) – UFPB/CCAE 1. Ecologia. 2. Macroalgas – comunidades. 3. Explotação
comercial. 4. Atividade turística. 5. Variação temporal. 6. Bioindicação.
LEANDRO DO NASCIMENTO MÁXIMO
ESTRUTURA E DINÂMICA DE POPULAÇÕES E COMUNIDADES DE MACROALGAS EM AMBIENTES RECIFAIS DA PARAÍBA
Dissertação apresentada ao Programa de Pós-Graduação em Ecologia e Monitoramento Ambiental (PPGEMA) da Universidade Federal da Paraíba, como exigência parcial para obtenção do Título de Mestre em Ecologia
Data da Aprovação: 19/05/2015
Banca Examinadora
___________________________________________________ Prof. Dr. George Emmanuel Cavalcanti de Miranda (Orientador)
___________________________________________________ Prof. Dr. Ronaldo Bastos Francini Filho (Examinador Interno)
INTRODUÇÃO GERAL
Agradeço a CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela bolsa de mestrado concedida, sem a qual esse trabalho não seria realizado.
À meu orientador Prof. Dr. George Emmanuel Cavalcanti de Miranda pela oportunidade de poder compartilhar de seus conhecimentos e tão valiosos ensinamentos, fundamentais na realização desse trabalho, além do apoio e da confiança.
À Universidade Federal da Paraíba, em especial ao Departamento de Sistemática e Ecologia e ao Programa de Pós-Graduação e Ecologia e Monitoramento Ambiente, pela oportunidade de crescimento profissional.
Aos meus QUERIDOS amigos Joana D’arc (Jojo), Elize e Naor pelos conselhos, apoio e alegria nos momentos difíceis que enfrentei e por não me deixar abater.
Aos colegas de LAM Daniel, Natália, Êmilly e Varínia pelas conversas, ajuda fundamental nas coletas e na triagem de material e momentos amenos no laboratório. À minha família, por serem pessoas que estiveram presentes nos momentos doces da conquista e nos momentos amargos da tristeza, por sempre acreditarem no meu potencial e em especial minha irmã Letícia, pela amizade, carinho e amor.
À Breno Cesar por todo o apoio, carinho, atenção, conversas, risos, choros, alegrias, distrações, broncas, banhos de mar e abrigo nesses últimos anos, que foi uma peça fundamental sem a qual esse trabalho não seria sido feito.
Este trabalho é resultado da colaboração de muitas pessoas que são parte da minha história e que me fizeram tão bem nesses dois anos, me proporcionando amizades queridas que levarei comigo, ensinamentos essenciais para o desenvolvimento do trabalho e para me permitir sentir-se uma pessoa melhor pois sem eles o mesmo não teria existido. A todos vocês...
À minha família e a todos
aqueles que como eu,
encontram paz e inspiração
As algas constituem alguns dos organismos mais importantes nos ambientes recifais, pois compõem a base da cadeia trófica, atuam como estruturadoras do habitat e servem como potenciais bioindicadoras de qualidade ambiental. Este trabalho teve por objetivo analisar a estrutura e a dinâmica de assembléias de macroalgas em ambientes recifais rasos da Paraíba e avaliar a utilização destes organismos/processos como mecanismo bioindicador. A dissertação foi dividida em três estudos de caso nos quais a estrutura e/ou dinâmica das populações e comunidade de macroalgas possuem papel fundamental: O primeiro teve por objetivos conhecer o status da população de Gracilaria caudata J. Agardh e comunidade de macroalgas associadas ao ambiente recifal de Ponta de Mato, Cabedelo/PB, após o impacto de sobreexplotação ocorrido a quase 20 anos, tendo como base de comparação um banco de dados pretéritos dessa população. O forte impacto sobre a população dominante teve como resposta a substituição de espécies e a área outrora dominada por G. caudata é atualmente dominada por Jania subulata (Ellis & Solander) Sonder e Sargassum sp. O segundo trabalho teve por objetivo avaliar a qualidade ambiental de dois ambientes recifais submetidos a diferentes pressões turísticas, Picãozinho e São Gonçalo ambos localizados no município de João Pessoa/PB. Nas áreas de intensa atividade turística, as algas apresentaram-se com riqueza, biomassa e diversidade mais baixas quando comparados com as áreas que não recebem turistas, sugerindo que o ambiente está sob efeito de distúrbios e regime de estresse. O terceiro caso de estudo teve por objetivo analisar a estrutura e a dinâmica das comunidades macrofitobênticas do recife de Formosa, Cabedelo/PB sob uma perspectiva temporal. Houve variação temporal nos descritores de riqueza e biomassa, com os valores mais baixos registrados nos meses de Agosto/2013 e Agosto/2014, e os mais altos em Fevereiro/2014 e Maio/14. O entendimento de como os impactos (naturais ou antropogênicos) afeta a distribuição e a dinâmica das espécies é importante na seleção e potencial utilização de espécies bioindicadoras de distúrbios ambientais.
Palavras chave: Comunidades de macroalgas. Explotação comercial. Atividade
turística. Variação temporal. Bioindicação.
Algae are some of the most important organisms in reef environments as make up the base of the food chain, act as habitat structuring and serve as potential environmental health bio-indicators. This study aimed to analyze the structure and dynamics of macroalgae assemblages in Paraíba shallow reefs and evaluate the use of these bodies / processes as a mechanism bioindicador. This work was divide into three case studies in which the structure and dynamics of macroalgae assemblage play a fundamental role. The first work aimed to know the status of the population of
Gracilaria caudata J. Agardh and macroalgae community associated with the Ponta de Mato reef, Cabedelo/PB, after the overexploitation impact occurred nearly 20 years and as a comparison based on a previous database. The strong impact on the dominant population was answered replacement of species and area once dominated by G. caudata was currently dominate by Jania subulata (Ellis & Solander) Sonder and Sargassum sp. The second study aimed to assess environmental health from two reef environments subjected to different tourist pressures, Picãozinho and São Gonçalo both located in João Pessoa/PB. In areas of intense tourist activity, the algae presented with lower richness, biomass and diversity compared with areas that receive no tourists, suggesting that the environment is under the influence of disorders and stress regime. The third case study aimed to analyze the structure and dynamics of macroalgae assemblages of Formosa reef, Cabedelo/PB with a time perspective. There was temporal variation in descriptors richness and biomass, with the lowest figures recorded in August/2013 and August/2014 and the highest in February/2014 and May/14. Understanding how the impacts (natural or anthropogenic) affect the distribution and dynamics of the species is important in the selection and potential use of bio-indicator species of environmental disturbances.
Key words: Macroalgae assemblages. Commercial exploitation. Tourism activity.
Temporal variation. Biindication.
Figura 1. Esquema do litoral paraibano, evidenciando os ambientes recifais onde foram realizados os estudos deste trabalho ... 17 Figura 2. Esquema dos ambientes recifais localizados em Cabedelo/PB, objetos de estudo desse trabalho ... 30 Figura 3. Esquema de localização dos locais de coleta de material em Ponta de Mato, Cabedelo (PB). As letras indicam as três áreas delimitadas para sorteio dos pontos ... 32 Figura 4. Esquema do desenho amostral para sorteio dos pontos de coleta nas unidades A, B e C em Ponta de Mato, Cabedelo/PB ... 32 Figura 5. Média de Biomassa (g.m-2) de G. caudata nos períodos de coleta ... 34
Figura 6. Riqueza (S) das espécies encontradas nas unidades amostrais em Ponta de Mato, Cabedelo/PB ... 39 Figura 7. Porcentagem relativa da Biomassa Total (BT) das espécies presentes em Formosa, Cabedelo (PB), que mais contribuíram com esse descritor ... 40
Figura 8. Diversidade (H’) das espécies encontradas nas unidades amostrais em
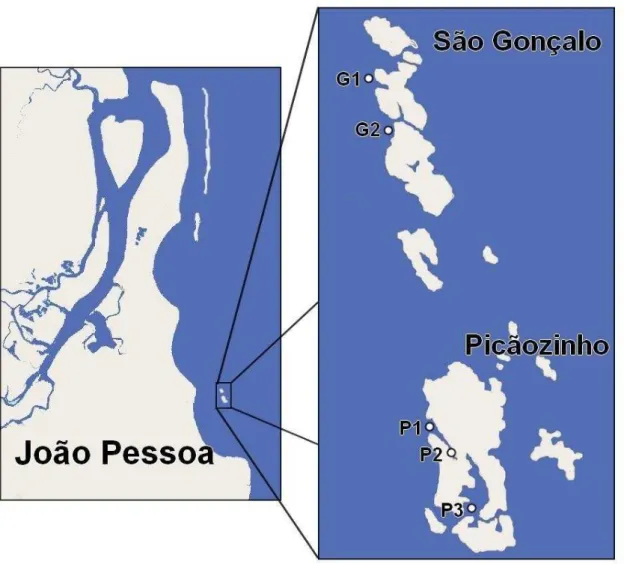
Ponta de Mato, Cabedelo/PB ... 41 Figura 9. Dominância (D) das espécies encontradas nas unidades amostrais em Ponta de Mato, Cabedelo/PB ... 42 Figura 10. Ambientes recifais objetos de estudo em João Pessoa/PB. Os pontos indicam as estações de coleta em Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2) ... 53 Figura 11. Esquema do desenho amostral utilizado para as coletas em cada estação nas áreas de Picãozinho e São Gonçalo ... 53 Figura 12. Média da riqueza (S) (espécies/ unidade amostral) por estações de coleta/mês em Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2) ... 58 Figura 13. Biomassa média (Kg.m-2) por estações de coleta/mês em Picãozinho (P1,
P2 e P3) e São Gonçalo (G1 e G2) ... 60 Figura 14. Diversidade (Shannon) por estações de coleta/mês em Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2) ... 61
Figura 15. Dominância (Simpson) por estações de coleta/mês em Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2) ... 62 Figura 16. Esquema de localização das três estações de coleta no recife de Formosa, Cabedelo (PB). Os traços indicam os locais e as direções em que foram lançados os transectos ... 74 Figura 17. Porcentagem de Frequência total das espécie nas unidades amostrais. █ Muito Frequentes; █ Frequentes; █ Pouco Frequentes; █ Raras; █ Muito Raras ... 79 Figura 18. Média da riqueza (S) (espécies/unidade amostral) por período de coleta em Formosa, Cabedelo/PB ... 80 Figura 19. Dendograma de similaridade (Bray-Curtis) para a riqueza mensal em Formosa, Cabedelo/PB ... 81 Figuras 20. Diversidade (Shannon) da comunidade por período de coleta em Formosa, Cabedelo/PB ... 82 Figuras 21. Dominância (Simpson) da comunidade por período de coleta em Formosa, Cabedelo/PB ... 82 Figura 22. Porcentagem da biomassa total por espécies no ambiente recifal de Formosa, Cabedelo/PB ... 83 Figura 23. Média de biomassa (kg m-2) total nos meses de coleta em Formosa,
Tabela 1. Matriz de Riqueza (S) por Estação e por Local de Coleta no ambientes recifais de Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2), João Pessoa/PB, nos meses de Maio/14 e Outubro/14 ... 57 Tabela 2. Matriz de Biomassa média (Kg m-2) por Estação e por Local de Coleta no
ambientes recifais de Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2), João Pessoa/PB, nos meses de Maio/14 e Outubro/14 ... 59 Tabela 3. Matriz de Diversidade e Dominância por Estação e por Local de Coleta no ambientes recifais de Picãozinho (P1, P2 e P3) e São Gonçalo (G1 e G2), João Pessoa/PB, nos meses de Maio/14 e Outubro/14 ... 60 Tabela 4. Matriz de riqueza (S) por período de coleta em Formosa, Cabedelo/PB ... 78 Tabela 5. Valores de Diversidade e Dominância para os períodos amostrados em Formosa, Cabedelo/PB ... 82 Tabela 6. Média de Biomassa (Kg m-²) por período de coleta no ambiente recifal de
Apêndice A: Matriz de Presença (1) e Ausência (0) das espécies de macroalgas no ambiente recifal de Ponta de Mato, Cabedelo/PB ... 90 Apêndice B: Matriz de biomassa (Kg.m-2) das espécies de macroalgas no ambiente
recifal de Ponta de Mato, Cabedelo/PB ... 92 Apêndice C: Matriz de Riqueza média (S) para as áreas de Picãozinho (P) e São Gonçalo (G) por estação/período de coleta. (M = Maio; O = Outubro) ... 94 Apêndice D: Matriz de Biomassa (Kg.m-2) para as áreas de Picãozinho (P) e São
Gonçalo (G) sem a exclusão das espécies calcificadas (M = Maio; O = Outubro) .... 95 Apêndice E: Matriz de riqueza média (S) de espécies em Formosa/PB para os períodos de coleta ... 96 Anexo F: Matriz de Biomassa (Kg.m-2) média das espécies em Formosa/PB para os
Anexo 1. Localização dos pontos de coleta de G. caudata no recife de Ponta de Mato, Cabedelo/PB. Adaptado de Miranda (2010) ... 98 Anexo 2: Biomassa (g.m-2) de G. caudata, da etapa amostrada em Outubro/2014,
INTRODUÇÃO GERAL ... 15
1 AMBIENTES RECIFAIS ... 15
2 COMUNIDADES DE MACROALGAS ... 17
3 PROBLEMATIZAÇÃO ... 20
REFERÊNCIAS ... 22
CAPÍTULO 1. AVALIAÇÃO DE LONGO PRAZO DA ESTRUTURA POPULACIONAL DE GRACILARIA CAUDATA J. AGARTH APÓS SOBREEXPLOTAÇÃO EM UM AMBIENTE RECIFAL DA PARAÍBA, BRASIL ... 27
Resumo ... 27
1 INTRODUÇÃO ... 28
2 MATERIAIS E MÉTODO ... 30
2.1 Área de Estudo ... 30
2.2 Estações de Coleta e Delineamentos amostrais ... 30
2.3 Descritores e Análises Estatísticas ... 33
3 RESULTADOS E DISCUSSÃO ... 34
3.1 Avaliação da Biomassa de G. caudata ... 34
3.2 Estrutura da comunidade macrofitobêntica ... 37
3.2.1 Sinopse dos taxa identificados ... 37
3.2.2 Riqueza (S) ... 39
3.2.3 Biomassa Total (BT), Diversidade (H’) e Dominância (D) ... 40
4 CONCLUSÕES ... 44
REFERÊNCIAS ... 45
CAPÍTULO 2: ESTRUTURA DAS COMUNIDADES DE MACROALGAS SOB INFLUÊNCIA IMPACTO DO TURISMO NOS AMBIENTES RECIFAIS DE PICÃOZINHO, JOÃO PESSOA/PB ... 49
Resumo ... 49
1 INTRODUÇÃO ... 50
2 MATERIAIS E MÉTODO ... 52
2.1 Área de Estudo ... 52
2.2 Estações de Coleta e Delineamento amostral ... 52
3 RESULTADOS E DISCUSSÃO ... 55
3.1 Sinopse dos taxa identificados ... 55
3.2 Riqueza ... 57
3.3 Biomassa Total (BT), Diversidade (H’) e Dominância (D) ... 59
4 CONCLUSÕES ... 65
REFERÊNCIAS ... 66
CAPÍTULO 3: ESTRUTURA E DINÂMICA DA COMUNIDADE DE MACROALGAS DE MESOLITORAL EM AMBIENTE RECIFAL NA PARAÍBA, BRASIL ... 70
Resumo ... 70
1 INTRODUÇÃO ... 71
2 MATERIAIS E MÉTODO ... 73
2.1 Área de Estudo ... 73
2.2 Estações de Coleta e Delineamento amostral ... 73
2.3 Descritores e Análises Estatísticas ... 74
3 RESULTADOS E DISCUSSÃO ... 76
3.1 Sinopse dos taxa identificados ... 76
3.2 Frequência e Riqueza ... 78
3.3 Biomassa (B), Diversidade (H’) e Dominância (D) ... 82
4 CONCLUSÕES ... 86
REFERENCIAS ... 87
APÊNDICES ... 90
1. AMBIENTES RECIFAIS
Ambientes recifais são ecossistemas tropicais, locais de vasta importância por possuírem grande biodiversidade, com organismos associando-se em teias alimentares de grande complexidade (LITTLER; LITTLER, 1984; ADEY, 1998; MOBERG; FOLKE, 1999; CASTRO, 2000; MMA, 2003), apresentando um número de espécies semelhante ao de florestas tropicais (SPALDING; RAVILLIOUS; GREEN, 2001; CORREIA, 2005). Mesmo situando-se em águas oligotróficas, possuem um fluxo de energia intenso e dinâmico, fazendo com que esses ambientes apresentem altas taxas de produtividade (LITTLER; LITTLER, 1984; CASTRO; HUBER, 2012). Possuem ainda importância cultural, farmacêutica e econômica (MOBERG; FOLKE, 1999; SPALDING, RAVILLIOUS; GREEN, 2001; MMA, 2003; COSTA et al. 2007; BRANDER; BEUKERING; CESAR, 2007; SHEARS, 2007; PRATES; GONÇALVES; ROSA 2012).
No mundo, os ambientes recifais podem ser encontrados principalmente em regiões tropicais de águas rasas e quentes, com temperaturas médias iguais ou superiores a 20º C, atingindo profundidades não muito superiores a 40 metros (SPALDING, RAVILLIOUS; GREEN 2001; VILLAÇA, 2009). Existem duas grandes formações recifais distintas no planeta: a Indopacífica, com 91,8% de toda a área recifal do mundo; e a Atlântica, com 7,6%. Uma menor formação pode ser encontrada no leste do Pacífico, com apenas 0,6% da área total (SPALDING, RAVILLIOUS; GREEN, 2001). A formação Atlântica estende-se desde as Bermudas até o Brasil (CORREIA, 2005).
No litoral brasileiro, esses ambientes distribuem-se por aproximadamente 3 mil Km, concentrando-se principalmente na região Nordeste, desde o Parcel de Manoel Luiz na costa do Maranhão até Viçosa, no sul da Bahia, onde encontra-se a região de Abrolhos (CASTRO, 2000; CORREIA, 2005; FERREIRA; MAIDA, 2006; FIGUEIREDO et al., 2008). Constitui-se como os únicos ecossistemas recifais do Atlântico Sul (PRATES; GONÇALVES; ROSA, 2012) mas apresentam-se de forma descontínua,
na maioria das vezes como estreitas linhas próximas à costa (CASTRO, 2000; FIGUEIREDO et al., 2008).
Existem dois tipos de formações, de acordo com a origem: Recifes de Arenito e Recifes Biogênicos (KEMPF, 1967/69; CORREIA, 2005). Na Paraíba os ambientes recifais ocorrem na subzona marítima e podendo distanciar-se da costa em até 1,6 Km, aproximadamente. Apresentam-se quase retilíneas e paralelas a costa, formando um longo alinhamento de segmentos descontínuos (CARVALHO, 1983, SASSI, 1987). O litoral do estado da Paraíba localiza-se na costa Nordeste do Brasil, entre a foz do rio Guaju (06º26’00” S e 34º52’00” W) e a foz do rio Goiana (07º34’00” S e 34º45’00” W) (GOVERNO DO ESTADO DA PARAÍBA, 1985). Do ponto de vista geomorfológico, é caracterizado por baixos planaltos costeiros e por planícies e extensos cordões arenosos. Os pontos em que o litoral apresenta uma natureza rochosa possuem uma origem sedimentar, de natureza calcária ou arenítica. O litoral é definido por uma sucessão de enseadas intercaladas por intervalos retilíneos. Essas enseadas limitam-se por projeções arenosas ou formadas por rochas sedimentares que formam os “pontais” (CARVALHO, 1983; SASSI, 1987).
Os segmentos recifais do litoral da Paraíba são divididos, segundo Sassi (1987), em: (I) recifes de franja localizados mais próximos à praia, associados aos pontais da linha de costa e (II) formações do tipo barreira que apresentam-se descontínuas, retilíneas e paralelas à linha de praia, na direção Norte-Sul. Essa formações em barreira fazem parte de extensos cordões descontínuos que se estendem desde o norte do Ceará até o Sul da Bahia (CARVALHO, 1983). Na Paraíba, esses segmentos estendem-se desde o limite sul do estado até pouco depois da desembocadura do Rio Paraíba, reaparecendo depois entre a região de Barra de Mamanguape até a Baia da Traição (CARVALHO, 1983; SASSI, 1987).
De acordo com a classificação climática de Köpen (Atlas Geográfico da Paraíba, 1985) o clima da região é As’, sendo classificado como quente e úmido. O período de chuvas corresponde ao outono-inverno e vai de março a agosto, e o período seco ao período de primavera-verão, indo de setembro a fevereiro.
localizados em Cabedelo/PB e os recifes de Picãozinho e São Gonçalo, localizados em João Pessoa/PB.
Figura 1. Esquema do litoral paraibano, nos municípios de Cabedelo e João Pessoa, evidenciando os
ambientes recifais onde foram realizados os estudos deste trabalho.
2. COMUNIDADES DE MACROALGAS
preferem o termo “recife biogênico” ou ainda “recife de algas” (FIGUEIREDO, 2000; CASTRO; HUBER, 2012).
As algas constituem um grupo polifilético com relações filogenéticas não claramente entendidas. Há ainda muita discussão sobre as relações que envolvem as
algas “verdes”, “vermelhas” e “pardas” (EVERT; EICHHORN, 2014). Incluem-se neste
grupo desde pequenos talos unicelulares a grandes talos de macrófitas, cada um com características particulares que os divide em uma dezena de linhagens (GRAHAM; WILCOX, 2009). As algas correm em quase todos os tipos de ambientes, mas é nos aquáticos que são mais comumente encontradas, tendo importante função como produtores primários na cadeia alimentar (LOBBAN; HARRISON, 1997; LEE, 2008; NASSAR, 2012). Nos oceanos, esses organismos formam um elo vital na produtividade, pois a sua distribuição, crescimento e composição de comunidades são de grande importância para o ambiente marinho (ROUND, 1973).
As algas bentônicas marinhas vivem fixas ao substrato entre o topo da zona entremarés até o máximo de profundidade que a luz adequada ao crescimento penetra, interagindo com outros organismos e todos com o ambiente físico-químico (LOBBAN; HARRISON, 1997). Entre os fatores ecológicos que influenciam o crescimento, a distribuição, a densidade e a diversidade das algas marinhas podemos destacar: fatores físicos (substrato, temperatura, luminosidade e pressão); fatores químicos (salinidade, pH e nutrientes dissolvidos); fatores hidrodinâmicos e de perturbação (ação das ondas, profundidade, turbidez); e fatores biológicos (herbivoria, competição, epifitismo, etc) (FELDMANN, 1951; LOBBAN; WYNNE, 1981; LOBBAN; HARRISON, 1997; MCCOOK, 1999).
Um grupo característico de algas marinhas denominado “turf”, formado
taxonomicamente avaliada, com a riqueza de espécies muitas vezes indeterminada (COSTA et al., 2002; FIGUEIREDO et al, 2008). Figueiredo (2005) observou que o padrão de cobertura do substrato por turfs está localizado em locais com maior nível de herbivoria, enquanto que as demais macroalgas se localizavam em locais sem grande pressão de herbívoros, locais estes que sofrem com sobrepesca. Outro fator que pode alterar o padrão de cobertura é o impacto antrópico sofrido pela comunidade, e dentre estes, destaca-se o pisoteio (CROWE et al. 2000). Comunidades bênticas quando submetidas a pisoteio geralmente apresentam baixa diversidade e densidade de algas em comparação com áreas mais protegidas, o que causa uma rápida queda em quantidade de cobertura e biomassa, levando essa comunidade a um estado dominado pelo turf (CROWE et al. 2000; MILAZZO et al., 2002).
Estudos em comunidades bênticas mostram grande potencial das algas em evidenciar efeitos cumulativos de distúrbios no ecossistema marinho (PINEDO et al., 2007). Por serem organismos sésseis, possuírem ampla distribuição e responderem a estressores ambientais através de dominância e desaparecimento de espécies sensíveis, as macroalgas se tornam um eficiente sensor biológico para a determinação de um status de qualidade ecológica (MUNDA, 1993; PINEDO et al., 2007). Fatores como tempestades, poluição, erosão e mudanças na temperatura da água mudam drasticamente a estrutura das comunidades associadas nesse ecossistema (MCCLANAHAN, 2000; DINSDALE; HARRIOTT, 2004; MCMANUS; POLSENBERG, 2004).
As comunidades de macroalgas podem ainda variar no tempo e espaço (CAPOTE, 2009; CONCENTINO et al, 2010), com escalas que variam de anos a décadas, mesmo na ausência de distúrbios maiores (DETHIER, 2002). Cruz (2007) menciona que as correntes marítimas e as variações climáticas possuem maior influência nessas variações em grande escala e as interações interespecíficas tais como mutualismo, predação e competição agem em escalas menores. Distinguir as mudanças naturais das induzidas pelo homem é a chave para o maior conhecimento acerca da comunidade em estudo (VAN WOESIK, 1994).
O conhecimento sobre como ocorre a dinâmica temporal na estrutura das comunidades é de suma importância para avaliar como influências externas podem modificar esses ambientes (VAN WOESIK, 1994; ROSSO, 1995), mas o conhecimento do padrão histórico de distúrbios físicos e biológicos e de outros processos que podem conduzir a essa variação temporal quase nunca é avaliado. (DETHIER, 2002; CONCENTINO et al, 2010).
3. PROBLEMATIZAÇÃO
Mesmo provendo muitos valores e serviços, os ambientes recifais tem sofrido diversas alterações causadas por intervenções antropicas, tais como a poluição e eutrofização das águas, sedimentação, sobreexplotação de recursos, atividades turísticas e mudanças climáticas relativas aos aumentos de temperatura e dos níveis dos oceanos (SMITH et al., 2006; BRANDER; BEUKERING; CESAR, 2007; COSTA
et al, 2007; WILKINSON, 2008).
Para a comunidade algal, todos esses fatores se refletem na troca de relações de dominâncias, composição específica ou alterações dos padrões de zonação, estratificação e sucessão estacional das comunidades e populações algais. Para as populações, pode-se perceber variação de distribuição e biomassa (ARECES, 2001). Essa gama de respostas permite a utilização das macroalgas como bioindicadoras de qualidade ambiental (TRAINOR, 1983; MUNDA, 1993; NEWS, 1995; DOKULIL, 2003; STEVENSON; SMOL, 2003; PINEDO et al., 2007, VASCONCELOS, 2012; JESUS; MACHADO; MUNIZ, 2013).
explotação comercial da espécie Gracilaria caudata J. Agardh no passado recente, já bem descrito e documentado; (II) em Picãozinho, João Pessoa (PB), onde a intensa atividade turística causa um impacto sistemático na comunidade; e (III) em Formosa, Cabedelo (PB), onde a comunidade aparentemente não sofre impacto antrópico direto.
Em Ponta de Mato, a população de G. caudata sofreu uma sistemática explotação comercial sem controle ou acompanhamento entre as décadas de 1970 e 1990. Estudos anteriores (MIRANDA, 2000; 2010) apontaram um declínio do banco de G. caudata, sugerindo implicações ecológicas que afetaram toda a comunidade entorno, entre elas a eventual substituição de dominância da população de G. caudata por outras espécies. Considerando a existência de um banco de dados de quase 20 anos sobre essa população submetida a exploração comercial (MIRANDA, 2000; 2010), faz-se necessário um levantamento atual de dados sobre o estado em que se encontra a população e possíveis modificações na estrutura da comunidade.
Os recifes de Picãozinho, são considerados grandes atrativos para os turistas que visitam João Pessoa, estando presente em praticamente 100% do material de divulgação das agências de turismo (DEBEUS; CRISPIM, 2008) e, provavelmente junto com pesca artesanal e pesca esportiva, representam seus principais usos pelo homem (COSTA et al., 2007). Impactos locais associados com o turismo tem influência sobre a estrutura da comunidade de macroalgas, por esse motivo, é necessário um levantamento de dados de como esse impacto influencia e modifica a estrutura dessa comunidade.
O recife de Formosa não está submetido aos impactos diretos descritos acima, entretanto existem poucos trabalhos sobre a estrutura e a dinâmica da comunidade de macroalgas em mesolitoral (ARAÚJO, 2008) e em infralitoral (CARVALHO, 1980, 1983; SILVA, 1987; MIRANDA, 2000) para o estado da Paraíba. Sendo assim, faz necessário conhecer a estrutura e a dinâmica temporal dessa comunidade, avaliando, entre outros aspectos, a qualidade ambiental.
REFERÊNCIAS
ADEY, W. H. 1998. Coral reefs: algal structured and mediated ecosystems in shallow, turbulent, alkaline waters. Journal of Phycology, 34: 393–406.
AIROLDI, L. 1998. Roles of disturbance, sediment stress, and substratum retention on spatial dominance in algal turf. Ecology, 79 (8): 2759–2770.
ARAÚJO, P. G.; MIRANDA, G. E. C.; KANAGAWA, A. I. 2008. Repartição espacial da comunidade macrobêntica dos recifes da APA da Barra do Rio Mamanguape, Paraíba, Brasil. Revista Nordestina de Biologia, 19 (1): 29-50.
ARECES, A. J. 2001. La ficoflora intermareal como bioindicadora de calidad ambiental. Estúdio de caso: El litoral habanero. Sustentabilidad de la biodiversidad. ALVEAL, K.; ANTEZANA, T. (Eds.) Universidad de Concepción, Chile. p. 569-589.
BRANDER, L. M.; BEUKERING, P. V.; CESAR, H. S. J. 2007. The recreational value of coral reefs: Meta-analysis. Ecological Economics, 53: 209-218.
CARVALHO, F. A. F. 1980. A flora marinha bentônica do litoral da Paraíba: Perspectivas econômicas. Bolm Inst. Oceongráfico. 29 (2): 83-85.
CARVALHO, F. A. F. 1983. Bionomia bêntica do complexo recifal no Litoral do estado da Paraíba, com ênfase nas macrófitas. Tese (Doutorado). Universidade de São Paulo, Instituto Oceanográfico São Paulo, 180p.
CASTRO, C. B. 2000. Avaliação e ações prioritárias para a conservação da biodiversidade da zona costeira e marinha – Recifes de Coral. Disponível em: http://www.icmbio.gov.br/parnaabrolhos/images/stories/downloads/Clovis_2000.pdf. Acessado em: 06 de jun. de 2013.
CASTRO, P; HUBER, M. E. 2012. Biologia Marinha. 8 ed. Porto Alegre: AMGH.
COCENTINO, A. L. M., FUJII, M. T., REIS, T. N. V., GUIMARÃES-BARROS, N. C., MARCIA DE FRANÇA ROCHA, M. F. & NEUMANN-LEITÃO, S. 2010. Diversity and distribution Patterns of the infralittoral green macroalgae from Potiguar basin, Rio Grande do Norte, Northeastern Brazil. Acta Bot. Bras. 24(4): 986-996.
CORREIA, M. D. 2005. Ecossistemas marinhos: recifes, praias e manguezais Maceió: EDUFAL. 55p.
COSTA, O. S.; ATTRILL, M. J.; A. G. PEDRINI, A. G.; DE-PAULA, J. C. 2002. Spatial and Seasonal Distribution of Seaweeds on Coral Reefs from Southern Bahia, Brazil. Botanica Marina. 45: 346-355.
CROWE, T. P.; THOMPSON, R. C.; BRAY, S.; HAWKINS, S. J. 2000. Impacts of anthropogenic stress on rocky intertidal communities. Journal of Aquatic Ecosystem Stress and Recovery, 7: 273–297.
CRUZ, J. 2007. Análisis espacial de las comunidades intermareales asociadas a los litorales rocosos de Venezuela. Ciencias Marinas, 33 (2): 133 – 148.
DEBEUS, G.; CRISPIM, M. C. 2008. O turismos nas piscinas naturais de Picãozinho, João Pessoa, PB – Percepções conflitos e alternativas. Revista de Estudos Ambientais, 10 (1): 21 – 32.
DETHIER, M. N. 2002. Site Classification and Selection. In MURRAY, S. N.; AMBROSE R.F.; DETHIER, M. N. Methods for Performing Monitoring, Impact, and Ecological Studies on Rocky Shores. OCS Study MMS 01-070.
DINSDALE, E. A.; HARRIOTT, V. J. 2004. Assessing anchor damage on coral reefs: a casestudy in selection of environmental indicators. Environmental Management, 33 (1): 126–139.
DOKULIL. M. T. 2003. Algae as ecological bio-indicators. In MARKERT, B. A.; BREURE, A. M.; ZECHMEINSTER, H. G. (Eds). Bioindicators and biomonitors. Elsevier Science Ltda
EVERT, R. F.; EICHHORN, S. E. 2014. Haven – Biologia Vegetal. 8ª edição. Guanabara Koogan, Rio de Janeiro.
FELDMANN, J. 1951. Ecology of Marine Algae. In SMITH, G. M. Manual of Phycology. Ronald Press, New York, pp. 313–34.
FERREIRA, B. P.; MAIDA, M. 2006. Monitoramento dos recifes de coral do Brasil. Brasilia. MMA. 250p.
FIGUEIREDO, M. A. O. 2000. Recifes de corais ou recifes de algas? Ciências Hoje. 166 (28): 74-75.
FIGUEIREDO, M. A. O. 2005. Diversity of Macrophytesin the Abrolhos Bank, Brazil. In. DUTRA, G. F.; ALLEN, G. R.; WERNER, T.; MAKENNA, S. A. (eds). A Rapid Marine Biodiversity Assessment of the Abrolhos Bank, Bahia, Brazil. RAP Bulletin of Assessment 38: 67-74.
FIGUEIREDO, M. A. O.; HORTA, P. A.; PEDRINI, A. G.; NUNES, J. M. C. 2008. Benthic marine algae of the coral reefs of Brazil: A literature review. Oecol. Bras., 12 (2): 258 – 269.
Benthic Assemblages of the Abrolhos Bank, Eastern Brazil: Inferences on Natural and Anthropogenic Drivers. Benthic Assemblages of the Abrolhos Bank, Brazil, 8 (1): 1-12.
GRAHAM, L. E., WILCOX, L. W. 2009. Algae. Prentice-Hall, New Jersey. 640 pp
GOVERNO DO ESTADO DA PARAÍBA. 1985. Atlas Geográfico do Estado da Paraíba. João Pessoa, Grafset. 100p.
JESUS, P. B.; MACHADO, G. E. M.; MUNIZ, R. A. 2013. Macroalgas marinhas como indicadores de impactos ambientais em Itacoatiara, Niterói, RJ: subsídios para futuros programas de monitoramento ambiental. Caderno de Estudos Geoambientais, 4 (1): 67-80.
KEMPF, M. 1967/69. A plataforma continental de Pernambuco (Brasil): Nota preliminar sobre a natureza do fundo. Trabalhos Oceanográficos da Universidade Federal de Pernambuco. 9: 111-124.
LEE, R.E. 2008. Phycology. 4ª ed. Cambridge University Press.
LITTLER M.; LITTLER D. S. 1984. Models of tropical reef biogenesis: the contribution of algae. In: ROUND F. E; CHAPMAN D. J. (Eds). Progress in Phycological Research. Vol. 3. Bristol, Biopress Ltda., pp. 323-364.
LOBBAN, C. S.; HARRINSON, P. J. 1997. Seaweed Ecology and Physiology. Cambridge University Press.
LOBBAN, C. S.; WYNNE, M. J. 1981. The Biology of Seaweeds. Botanical Monograph Series 17. University of California Press.
MCCLANAHAN, T. R. 2000. Bleaching damage and recovery potential of maldivian coral reefs. Marine Pollution Bulletin, 40 (7): 587- 597.
MCCOOK, L. J. 1999. Macroalgae, nutrients and phase shifts on coral reefs: scientific issues and management consequences for the Great Barrier Reef. Coral Reefs. 18: 157-367
MCMANUS, J. W.; Polsenberg, J. F. 2004. Coral–algal phase shifts on coral reefs: ecological and environmental aspects. Progress in Oceanography, 60: 263–279.
MINISTÉRIO DO MEIO AMBIENTE. 2003. Atlas dos Recifes de Coral nas Unidades de Conservação Brasileiras. Brasília: MMA/SBF. 117p
MILAZZO, M.; CHEMELLO, R.; BADALAMENTI, F.; CAMARDA, R.; RIGGIO, S. 2002. The impacto f human recreational activities in marine protect áreas: What lesson should be learnt in the Mediterranean Sea? Marine Ecologie, 23: 280-290.
Paraíba. Dissertação (Mestrado). Universidade de São Paulo, Instituto de Biociências. 107p.
MIRANDA, G. E. C. 2010. Monitoramento, manejo e restauração de populações de Gracilaria caudata (Rhodophyta, Gigaryinales) degradadas pela exploração comercial. Tese (Doutorado). Universidade Federal de Pernambuco. 89p.
MOBERG, F.; FOLKE, C. 1999. Ecological goods and services of coral reef ecosystem. Ecological Economics, 29: 215-233.
MUNDA, I. M. 1993. Changes and degradation of seaweed stands in the Northern Adriatic. Hydrobiologia. 260-261: 239-253.
NASSAR, C. 2012. Macroalgas marinhas do Brasil: Guia de campo das principais espécies. Technichal Books, Rio de Janeiro.
NEWS, T. R. (1995). An introduction to invertebrate Conservation Biology. Oxford: Oxford Science Publications, 194p.
NYSTRÖM, M.; FOLKE, C.; MOBERG, F. 2000. Coral reef disturbance and resilience in a human-dominated environment. Tree, 15 (10): 413-417.
PRATES, A. P. L.; GONÇALVES, M. A. ROSA, M. R. 2012. Panorama da conservação dos ecossistemas costeiros e marinhos no Brasil. Brasília: MMA. 152p.
PINEDO, S.; GARCÍA, M.; SATTA, M. P.; DE TORRES, M.; BALLESTEROS, E. 2007. Rocky-shore communities as indicators of water quality: A case study in the Northwestern Mediterranean. Marine Pollucion Bulletin, 55: 126-135.
ROSSO, S. 1995. Dimensionamento amostral em estudos descritivos de comunidade de organismos sésseis e semi-sésseis. Oecologia Brasiliensis, 1: 193-223.
ROUND, F. E. 1973. Biologia das algas. Guanabara Dois, Rio de Janeiro.
SASSI, R. 1987. Fitoplâncton da formação recifal da Ponta dos Seixas (Lat.
7º9’16’’S, Long 34º47’35’’W), Estado da Paraíba, Brasil: Composição, ciclo anual e alguns aspectos fisio-ecológicos. Tese (Doutorado). Universidade de São Paulo, Instituto Oceanográfico São Paulo, 163p.
SHEARS N. T. 2007. Biogeography, community structure and biological habitat types of subtidal reefs on the South Island West Coast, New Zealand. New Zealand, Department of Conservation: Science for Conservation, 281p.
SMITH, J. E.; SHALL, M.; EDWARDS, R. A.; OBURA, D.; PANTOS, O.; SALA, E.; SANDIN, S. A. SMRIGA, S.; HATAY, M.; HOWHER, F. L. 2006. Indirect effects of algal on coral: algae-mediated, microbe-induced coral mortality. Ecology Letters, 9: 835-845.
SPALDING, M. D.; RAVILIOUS, C.; GREEN, E. P. 2001. World Atlas of Coral Reefs. Berkeley, CA: University of California Press and UNEP/WCMC.
STEVENSON, R. J.; SMOL, R. P. 2003. Use of algae in environmental assessments. In: WEHR, J. D.; SHEATH, R. G. (Eds.). Elsevier Science, Estados Unidos, p. 775-804.
TRAINOR, F.R. (1983). Algae as Ecological Indicators; Shubert, L. E., ed.; Academic Press: UK, 1983, p. 3
VAN WOESIK, R. 1994. Natural disturbances to coral communities. Disponível em: <http://my.fit.edu/~rvw/Lectures/Nat%20dist.htm> Acesso em: 14 de julho de 2014.
VASCONCELOS, E. R. T. P. P. 2012. Índice de distúrbio ambiental (IDA) através das macroalgas marinhas bentônicas dos recifes areníticos de Pernambuco. Dissertação (Mestrado). Universidade Federal de Pernambuco. 60p
VILLAÇA, R. C. 2009. Recifes biológicos. In: PEREIRA, R.C.; SOARES-GOMERS, A. (orgs). Biologia Marinha. 2ª ed. Ed. Interciência. Rio de Janeiro. pp. 399-420.
WILKINSON, C. 2008. Status of Coral Reefs of the World 2008, Australian Institute of Marine Science (AIMS), Global Coral Reef Monitoring Network(GCRMN), Townsville, Australia.
CAPÍTULO 1
AVALIAÇÃO DE LONGO PRAZO DA ESTRUTURA POPULACIONAL DE
GRACILARIA CAUDATA J. AGARTH APÓS SOBREEXPLOTAÇÃO EM UM
AMBIENTE RECIFAL DA PARAÍBA, BRASIL
Resumo
O gênero Gracilaria possui grande importância comercial, e sua demanda provocou a explotação de diversos bancos naturais, inclusive no Brasil onde muitos bancos de macroalgas foram explotados. Na Paraíba, a principal espécie explotada foi Gracilariacaudata e o descontrole na sua obtenção impactou suas populações. O trabalho teve por objetivo conhecer o status da população no ambiente recifal de Ponta de Mato em Cabedelo/PB e comparar com um banco de dados de aproximadamente 20 anos, além de se descrever a estrutura da comunidade macrofitobêntica anos após o impacto. Os valores de biomassa de G. caudata obtidos apresentaram forte redução com diferenças significativas com a base de dados dados pretéritos existente. Mesmo com o forte declínio da população dominante, o ambiente recifal não encontra-se com baixa cobertura algal pois os espaços abertos devido a explotação foram recolonizados por outras espécies, já presentes no ambiente mas com cobertura reduzida, sendo as principais: Jania subulata (Ellis & Solander) Sonder e Sargassum sp., que assumiram o papel de dominante (cobertura) no ambiente que antes era ocupado por G. caudata.
Palavras-chave: Explotação comercial, Gracilaria caudata, Biomassa, Substituição de Espécies
1 INTRODUÇÃO
O gênero Gracilaria Greville (Gracilariales, Rhodophyta) possui grande importância econômica e algumas espécies são explotadas em várias regiões do mundo por serem fontes de matéria prima para a produção de hidrocolóides (agaranas), presentes na parede celular, que são muito utilizados pelas indústrias alimentícias, farmacêuticas e têxtil (SILVA et al., 1987; OLIVEIRA; ALVEAL, 1990; MACCHIAVELLO et al. 1999; MIRANDA, 2000; MARINHO-SORIANO; MORALES; MOREIRA, 2002; MARINHO-SORIANO et al., 2007). Possuem também importância ecológica na manutenção dos ecossistemas aquáticos por serem fontes de alimento para diversos organismos marinhos, produzirem oxigênio e atuarem na ciclagem de nutrientes (GRAHAM; WILCOX, 2009).
O fato das espécies desse gênero estarem entre as mais importantes para o comércio aumentou consideravelmente a sua procura (MCLACKLAN; BIRD, 1986) e essa grande demanda foi motivo de diversos estudos (MCLACKLAN; BIRD, 1986; SANTELICES; DOTY, 1988; OLIVEIRA, 1997, 1998; OLIVEIRA; MIRANDA, 1998; CASTELLANOS-GONZÁLES; SHARP; LÉON-PEREZ, 2003; KALIAPERUMAL; KALIMUTHU; RAMALINGAN, 2004). A explotação deixou significativas marcas em populações nativas explotadas, principalmente naquelas com potencial econômico (OLIVEIRA, 1998; OLIVEIRA; MIRANDA, 1998; MIRANDA, 2000, 2010; BEZERRA; MARINHO-SORIANO, 2010). Essa prática de explotação comercial foi mais ditada pelos preços oferecidos pela matéria prima do que pela otimização e manejo dos bancos naturais, uma prática que pode ser descrita como oportunista, que com a ausência de uma gestão adequada, cometeu excessos ao redor de todo o mundo (SANTELICES; DOTY, 1988).
Na Paraíba, a espécie explotada predominantemente foi Gracilaria caudata J. Agardh e sua população sofreu um grande declínio devido a essa intensa atividade comercial (OLIVEIRA; MIRANDA, 1998; MIRANDA, 2000; MIRANDA, 2010; COSTA, 2013). A população presente na praia de Ponta de Mato, em Cabedelo (PB) foi explotada comercialmente entre as décadas de 70 e 90 e devido a isso está com a viabilidade econômica comprometida (OLIVEIRA; MIRANDA, 1998; MIRANDA, 2000, 2010).
A falta de acompanhamento de uma explotação sistemática tem grandes implicações ecológicas, não só para a população alvo, no caso G. caudata, mas para toda a comunidade em que a espécie está inserida. Há necessidade de saber como as populações e comunidades de macroalgas de um banco explotado comercialmente se comportam em face do impacto sofrido, tendo em vista que esses organismos respondem mais satisfatoriamente a impactos ambientais (naturais ou antropogênicos) (MUNDA, 1993; DOKULIL, 2003; STEVENSON; SMOL, 2003; PINEDO et al., 2007).
2 MATERIAIS E MÉTODOS
2.2 Área de Estudo
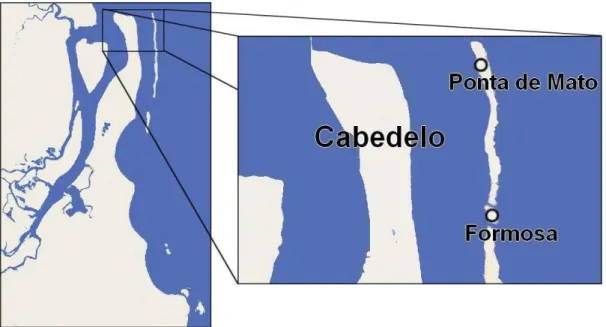
O município de Cabedelo está localizado a aproximadamente 18 km da capital do estado da Paraíba. Suas formações recifais se distanciam em torno de 1,5 km da costa e possuem, na parte visível,substrato consolidado formado principalmente por algas calcárias e elementos coralíneos de origem animal, podendo ainda ser encontrado sedimento arenoso sob o substrato consolidado (MIRANDA, 2000). O
recife de Ponta de Mato (6º57’54”S; 34º49’06”W) é uma formação recifal que aflora
em marés abaixo de 0,4 m e está localizado nas proximidades da Praia de Ponta de Mato (Cabedelo/PB) (Figura 2).
Figura 2. Esquema dos ambientes recifais localizados em Cabedelo/PB, objetos de estudo desse trabalho.
2.2 Estações de Coleta e Delineamento amostral
Na área de estudo, foram sorteados 26 pontos e referenciados através de GPS (Anexo 1), estes pontos correspondem aos locais onde foram realizadas as coletas por Miranda (2000) e estão inseridos no banco explotado pela comunidade. Em cada ponto foi lançado um quadrado de 0,5 x 0,5 m (0,25 m2) e todos os indivíduos de G.
caudata que estavam no seu interior foram coletados, transportados para o Laboratório de Algas Marinhas da UFPB e secos em estufa por 72 horas a 90ºC, para a medida de seu peso seco. A biomassa foi obtida calculando o peso seco em função da área (g.m-2).
Para avaliar a estrutura da comunidade macrofitobêntica do ambiente recifal na área de estudo e comparar co m os dados pretéritos, foi utilizado um desenho amostral similar ao proposto por Miranda (2000). Foram demarcadas três unidades fixas de 10 x 5 m (50 m²) sobre a estrutura recifal, dispostas a aproximadamente 1 km da linha da costa (Figura 3), paralelas a esta, com distância variando entre 50 m a 100 m entre elas e designadas pelas letras A, B e C. Para o autor supracitado, a demarcação das
áreas nesses locais baseou-se na presença de G. caudata em quantidades significativas (explotável) na época do estudo. As três unidades foram demarcadas através de um plano cartesiano com eixos x e y, com 5 e 10 metros, respectivamente, de onde foi feito um sorteio aleatório das coordenadas de 5 elementos amostrais de 0,5 x 0,5 m² em cada área delimitada (Figura 4).
Figura 3. Esquema de localização dos locais de coleta de material em Ponta de Mato, Cabedelo (PB). As letras indicam as três áreas delimitadas para sorteio dos pontos.
Figura 4. Esquema do desenho amostral para sorteio dos pontos de coleta nas unidades A, B e C em Ponta de Mato, Cabedelo/PB.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50
y
2.2 Descritores e Análises Estatísticas
Para comparar os valores atuais da biomassa da população da espécie G.
caudata com os dados anteriores de Miranda (2000, 2010) e dados não publicados coletados pelo Laboratório de Algas Marinhas da UFPB (2001, 2003, 2005, 2006, 2007, 2008, 2009, 2014) (Anexo 2), foi feita a análise de Kruskal-Wallis pois os dados não atenderam aos requisitos de normalidade e homocedasticidade, a posteriori foi realizado o teste de Friedman (ZAR, 2010). Desta análise foram excluídos os períodos anteriores que obtiveram biomassa zero (2001, 2003, 2007, 2009).
Para avaliar a estrutura da comunidade macrofitobêntica na área, as análises foram realizadas com base na comparação da Riqueza (S) (Apêndice A), diversidade
de Shannon (H’) e da dominância de Simpson (D) (Anexo 3) (MAGURRAN, 2004)
3 RESULTADOS E DISCUSSÃO
3.1 Avaliação da Biomassa de G. caudata
Pode-se observar que os valores mais elevados de biomassa ocorreram em abril de 1996 (899,23 g m-2; +/- 864,82) e março de 1997 (1081,5 g m-2; +/- 975,65),
antes da atividade de exploração realizada em abril de 1997 (Miranda 2010). Após, nota-se uma queda na biomassa nas coletas seguintes, com biomassa zero em alguns anos (2001, 2003, 2007 e 2009). No presente trabalho, foi encontrada uma biomassa média de 0,3723 g.m-2 (+/- 0,7489). A tabela com todos os valores de biomassa de G. caudata pode ser observado no Anexo 2.
A análise de Kruskal-Wallis evidenciou diferenças significativas entre os períodos antes da explotação comercial (Abril/96 e Março/97) e os períodos após essa explotação (p ≤ 0,00001). Os dados de Abril/96 e Março/97 não possuem diferenças significativas entre si (p = 0,5), bem como os dados de Maio/97, Março/05,
Fevereiro/06 e Fevereiro/08 (p ≥ 0,34). O teste a posteriori mostrou a existência de
diferenças significativas entre Outubro/14 e o restante dos períodos (p ≤ 0,03).
Figura 5. Média de Biomassa (g.m-2) de G. caudata nos períodos de coleta. Barras indicam o desvio
padrão. Letras diferentes indicam diferenças significativas (Kruskal-Wallis/Friedman). Escala logarítmica.
Essa diferença significativa entre os valores de biomassa apresentados em Abril/96 e Março/97 com o restante dos outros dados é marcada pela última coleta explotatória da população ocorrida em Abril/97 (MIRANDA, 2010). Observando os
0,1 1 10 100 1000 10000
Abr/96 Mar/97 Mai/97 Fev/01 Jan/03 Mar/05 Fev/06 Fev/07 Fev/08 Jan/09 Out/14
Bi
om
ass
a
(g.m
-2 )
c b
b b
a
dados pode-se notar que após a explotação comercial ocorrida nesse período, houve uma queda brusca na biomassa da população, que não conseguiu mais recuperar-se nos anos seguintes, com alguns períodos em que a espécie sequer ocorreu (Fevereiro/01, Janeiro/03, Fevereiro/08 e Janeiro/09).
A explotação comercial removeu quase que completamente com a população em tela, deixando no ambiente aproximadamente 1% de população original (Miranda, 2010). Apesar da elevada capacidade regenerativa e de colonização de G. caudata, é necessário manter um estoque mínimo para garantir a recuperação da população explotada (MIRANDA, 2000; FARIAS; MIRANDA; LIMA, 2004). Miranda (2010) concluiu que o estoque deixado para uma possível recolonização por esporos e/ou estruturas vegetativas foi insuficiente para que a população natural fosse recuperada. Então, considerando-se a necessidade de manutenção de pelo menos 10% da biomassa da população para uma efetiva recuperação (MIRANDA, 2000), pode-se concluir que a sobreexplotação na região comprometeu a capacidade da mesma de se recuperar, não tendo até a presente data se restabelecido na região.
Estudos sobre a sobreexplotação de algas com consequente declínio dos respectivos bancos foram feitos por diversos pesquisadores (SANTELICES; DOTY, 1987; OLIVEIRA; PLASTINO, 1992; ANDERSON et al., 1993; MIRANDA, 2000, 2010). A falta de estudos mais recentes relatando o declínio de bancos de macroalgas baseia-se na mudança de foco de pesquisadores para o cultivo de macroalgas para fins comerciais e de maricultura, como nos estudos de Lüning; Pang (2003), Kaliaperumal; Kalimuthu; Ramalingan, (2004), Buschmann; Hernández-González; Varela, (2008), Bezerra e Marinho-Soriano (2010) e Bixer; Porse (2011).
Vale ressaltar que apesar do desaparecimento local da população de G.
3.2 Estrutura da comunidade macrofitobêntica
3.2.1 Sinopse dos taxa identificados
Foi encontrado um total de 39 espécies de macroalgas: 10 Chlorophyta, sete Ochrophyta (Phaeophyceae) e 22 Rhodophyta. O gênero mais representativo foi Gracilaria, com 5 espécies, seguido pelos gênero Caulerpa, Dictyopteris, Bryothamnion e Jania, com 2 espécies cada. A lista a seguir corresponde às espécies coletadas em outubro/14.
CHLOROPHYTA Acetabularia sp.
Caulerpacupressoides Weber-van Bosse Caulerpaprolifera (Forsskål) J. V. Lamouroux Codium isthmocladum Vickers
Halimedaopuntia (Linnaeus) Lamouroux Neomerisannulata Dickie
Pennicilluscapitatus Lamarck
Udoteaflabellum (J. Ellis & Solander) M. A. Howe Ulvafasciata Delile
Ulvalactuca Linnaeus
OCHROPHYTA
Canistrocarpus cervicornis KützingDe Paula & De Clerck Dictyopteris delicatula J. V. Lamouroux
Dictyopteris jamaicensis W. R. Taylor Dictyota mertensii (Martius) Kützing
Lobophora variegata (Lamouroux) Wom. ex E. C. Oliveira Padinaboergesenii Allender & Kraft
Sargassum sp
RHODOPHYTA
Amansiamultifida J. V. Lamouroux
Amphiroa fragilissima (Linnaeus) J. V. Lamouroux Bryothamnionseaforthii (Turner) Kützing
Bryothamniontriquetrum (S. G. Gmelin) M. A. Howe
Chondracanthusacicularis (Roth) Fred. in Hom, Guiry, Fredericq & Leister Cryptonemia crenulata (J. Agardh) J. Agardh
Dichotomaria marginata (J.Ellis & Solander) Lamarck Gelidiella acerosa (Forsskål) Feldmann & G. Hamel Gelidiumpusillum (Stackhouse) Le Jolis
Gracilariacaudata J. Agardh
Gracilaria cervicornis (Turner) J. Agardh Gracilariacuneata Areschoug
Gracilariadomingensis (Kützing) Sonder ex Dickie Gracilaria sp.
Hypnea spinella (C. Agardh) Kützing Janiacapillacea Harvey
Jania subulata (Ellis & Solander) Sonder Laurencia sp.
Solieria filiformis (Kützing) P. W. Gabrielson
3.2.2 Riqueza (S)
Os valores aqui representados correspondem aos valores obtidos no presente estudo comparados às médias, obtidas por Miranda (2000), Os valores de Riqueza (S) apresentaram um aumento considerável dos dados atuais em comparação com os anteriores. A maior Riqueza foi anteriormente encontrada em Dezembro/96 foi de 14,7 (+/- 2,7) espécies por unidade amostral, sendo a média atual de 20,7 (+/- 2,8) espécies por unidade amostral (Figura 6).
Figura 6. Riqueza (S) das espécies encontradas nas unidades amostrais em Ponta de Mato, Cabedelo/PB. Barras indicam desvio padrão. Letras diferentes indicam diferenças significativas
(ANOVA).
A análise de variância (ANOVA) realizada com essa base de dados mostrou diferenças significativas entre a coleta de Outubro/14 com os outros meses de coleta (p ≤ 0,0004). A mesma análise mostrou não existir diferenças significativas entre a maioria dos meses, exceto por Novembro/96, Dezembro/96, Fevereiro/97 e Abril/97 (p ≤ 0,04).
A grande diferença encontrada para as médias de riquezas entre a coleta atual e as anteriores pode ser explicada por dois motivos. O primeiro está relacionado à diferença de metodologias amostrais empregadas pelos autores, sendo que Miranda (2000) utilizou-se da cobertura para obter os dados e no presente trabalho utilizamos a biomassa. Desta forma, comprometendo uma efetiva comparação entre as áreas no espaço-tempo. A segunda explicação pode ser encontrada no fato de que a
0 5 10 15 20 25 Ri q u eza (es p /u n id . amos tra l) Períodos Amostrais
comunidade encontra-se “reestruturada”, com a colonização do local por novas espécies, bem como uma nova relação de proporção levando em consideração a competição por espaço na ausência da espécie que era a dominante, a baixa resiliência sensu Souza (1979), levou a uma mudança na relação de dominância e riqueza na região. Em uma mudança de fase, o impacto dá a oportunidade para o ambiente criar novas coisas, para inovação e para o seu desenvolvimento (FOLKE, 2006).
3.2.3 Biomassa Total (BT), Diversidade (H’) e Dominância (D)
As espécies que mais contribuíram para a biomassa nas três áreas foram Jania subulata com média de 62,66 g.m-2 (+/- 49,89) por unidade amostral e Sargassum sp. com 60,53 g.m-2 (+/- 36,57), juntas respondendo por 52% da Biomassa total. A espécie G. caudata apresentou 0,19 g.m-2 (+/- 0,62) (Figura 7). A relação detalhada da Biomassa por espécie pode ser observada no Anexo 4.
Figura 7. Porcentagem relativa da Biomassa Total (BT) das espécies presentes em Formosa, Cabedelo (PB), que mais contribuíram com esse descritor
.
Miranda (2000) que estudou a Biomassa e cobertura de G.caudata na mesma área e estimou um valor médio de 72,1 g.m-2, ocupando uma área de cobertura de
cerca de 25%, comparando a biomassa pretérita com o valor atual, podemos inferir
Jania subulata (26%)
Sargassum sp. (26 %)
Vidalia obtusiloba (9%)
Penicilus capitatus (7%)
Jania capillacea (5%)
Gracilaria cervicornis (5%)
Padina boergesenii (4%)
Dictyopteris delicatula (4%)
Dichotomaria marginata (3%)
Canistrocarpus cervicornis (1%)
Gracilaria caudata (0,07%)
que a população praticamente desapareceu, sendo localmente substituída por J.
subulata e Sargassum sp.
Calculados a partir dos valores de cobertura (Março/96 a Maio/97) e Biomassa Média (Outubro/14), os resultados obtidos para Diversidade de Shannon (H’) e Dominância de Simpson (D) podem ser observados nas Figuras 8 e 9. Os valores detalhados encontram-se no Anexo 5.
Uma análise de variância (ANOVA) feita com os valores de Diversidade mostrou que os períodos amostrados não possuem diferenças significativas com o mesmo período do estudo de Miranda (2000) (p ≤ 0,04), o mesmo ocorreu com a análise de variância feita com os valores para o índice de Dominância (p ≤ 0,03) (Figuras 8 e 9)
Para se entender melhor os descritores Diversidade de Shannon (H’) e a Dominância de Simpson (D), eles devem ser analisados em conjunto. Esses descritores variam de forma inversa, quanto maior a Diversidade menor a Dominância, e vice-versa. Isso pode ser visto claramente observando as Figuras 8 e 9. Os valores de Diversidade (H’) e Dominância (D) variam naturalmente durante o ano devido a variações das condições ambientais e/ou bióticas que afetam a comunidade. Esse impacto natural não impacta uma população isoladamente, mas a comunidade como um todo, o que explica a não existência de diferenças significativas em blocos de meses de estudo nos valores de Diversidade e Dominância.
Figura 8. Diversidade (H’) das espécies encontradas nas unidades amostrais em Ponta de Mato,
Cabedelo/PB. Barras indicam desvio padrão. Letras diferentes indicam diferenças significativas (ANOVA). 0 0,5 1 1,5 2 2,5 3 Ín d ice d e Di ve rs id ad e (H') Períodos Amostrados
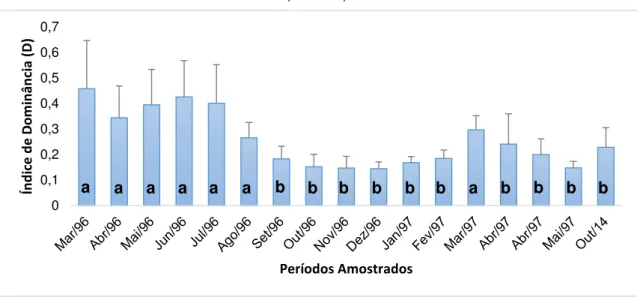
Figura 9. Dominância (D) das espécies encontradas nas unidades amostrais em Ponta de Mato, Cabedelo/PB. Barras indicam desvio padrão. Letras diferentes indicam diferenças significativas
(ANOVA).
Comparando áreas impactadas pela coleta da espécie G. caudata, com não impactadas na mesma região, Miranda (2000) percebeu que os impactos sofridos pela comunidade de Ponta de Mato, Cabedelo/PB, tiveram grande influência nos valores desses descritores (diversidade e dominância), uma vez que, segundo Augieur; Bouderesque (1971), alguns impactos atuam principalmente diminuindo a expressão da espécie dominante, o que acaba favorecendo o desenvolvimento de espécies com menor expressão, sendo esse distúrbio importante para a diminuição da dominação excessiva de uma ou mais espécies (BIRCH, 1981), com consequente aumento na diversidade.
A sobreexplotação da população de G. caudata teve como consequência a diminuição da dominância (D) na área em que foi impactada, resultando em espaços abertos que foram ocupados por outras espécies sub-dominantes ou mesmo oportunistas, como observado por Eston; Bussab (1990) e Santelices (1991). Para Miranda (2000), essa deve ser a principal preocupação por parte das ações de manejo desse tipo de recurso, uma vez que algumas delas podem ter pequenas reversibilidades. Esse autor ainda destacou a possibilidade de outras espécies, como por exemplo Sargassum sp. se tornar dominante, o que foi observado no presente estudo, levantando a hipótese de que a substituição espécies pode surgir como um
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 Ín d ic e d e D o m in ân ci a (D) Períodos Amostrados
efeito da resiliência do sistema no nível de organização da comunidade e sobre os índices observados, esta mudança é conceituada por outros autores como mudança de fase ou estado alternativo de estabilidade (LEWONTIN, 1969; HOLLING, 1973; SUTHERLAND, 1974) entretanto esta tem foco no nível de populações.
4. CONCLUSÕES
A população de Gracilaria caudata teve um declínio significativo no ambiente recifal de Ponta de Mato, Cabedelo/PB devido a sobreexplotação comercial sofrida pela banco na década de 90, inviabilizando sua recuperação populacional e consequente explotação.
O ambiente recifal se reestruturou de maneira que outras espécies assumiram a dominância anteriormente estabelecida por G. caudata destacando-se por Jania subulata e Sargassum sp..
REFERÊNCIAS
ANDERSON, R. J.; LEVITT, G. J.; KEATS. D. W.; SIMONS, R. H. 1993. The role of the herbivores in the colapse of the Gracilaria resourses at Saldanha Bay, South Africa. Hydrobiologia, 260/261: 285-290.
AUGIER, H. BOUDERESQUE. C. F. 1971. Notions d’écobiocénotique marine. CRDP, Marcelle, 109p.
BEZERRA, A. F.; MARINHO-SORIANO, E. 2010. Cultivation of the red seaweed Gracilaria birdiae (Gracilariales, Rhodophyta) in tropical waters of northeast Brazil. Biomass and Bioenergy, 34: 1813-1817.
BIRCH, D. W. 1981. Dominance in Marine Ecosystems. Amer. Naturalist, 18: 262-274.
BIXLER, H. J.; PORSE, H. 2011. A decade of change in the seaweed hydrocolloids industry. Jour. Appl. Phycoly, 23: 321–335.
BUSCHMANN, A. H.; HERNÁNDEZ-GONZÁLEZ, M. C.; VARELA, D. 2008. Seaweed future cultivation in Chile: perspectives and challenges. Int. Jour. of Environment and Pollution, 33 (4): 432-456.
CARVALHO, F. A. F. 1987. Produção, comercialização, e Industrialização de algas marinhas na América do Sul. Arq. Ciên. Mar., 26: 51-58.
CASTELLANOS-GONZÁLES, M. E.; SHARP, G. J.; LÉON-PEREZ, A. R. 2003. Management strategies for sustainable exploitation of red algae, Gracilaria sp, an agarophyte from Cienfuegos Bay, Cuba. Rev. Invest. Mar. 24 (3): 247-254.
COSTA, E. S. 2013. Algas Gracilarióides (Gracilariaceae, Rhodophyta) na costa brasileira: Uma abordagem morfológica e molecular. Tese (Doutorado). Universidade de São Paulo, Instituto de Biociências. 153p.
DOKULIL. M. T. 2003. Algae as ecological bio-indicators. In: MARKERT, B. A.; BREURE, A. M.; ZECHMEINSTER, H. G. (Eds). Bioindicators and biomonitors. Elsevier Science Ltda.
ESTON, V. R.; BUSSAB, W. 1990. An experimental analysis of ecological dominance in a rocky subtidal macroalgal community. Jour. Exp. Mar. Biol. Ecol., 136: 170-195.
FARIAS, J. N.; MIRANDA, G. E. C.; LIMA, E. A. (2004). Impacto causado pela sobre-exploração da espécie Gracilaria caudata J. Agardh (Gracilariales, Rhodophyta)
na praia de Ponta do Mato, Cabedelo Paraíba, Brasil. X RBFIC, resumo anais. CD room.
GRAHAM, L. E., WILCOX, L. W. 2009. Algae. Prentice-Hall, New Jersey. 640 pp
GUIRY, M. D.; GUIRY, G. M. (2015). Algae Base. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; Acessado em: 13 de Fevereiro de 2015.
HOLLING, C. S. 1973. Resilience and stability of ecological systems. Annual Review of Ecological Systems. 4: 1–24
JOLY, A. B. 1967. Gênero de algas marinhas da costa atlântica Latino-Americana. São Paulo: USP.
KALIAPERUMAL, N.; KALIMUTHU, S.; RAMALINGAM, J. R. 2004. Present scenario of seaweed exploitation and industry in India. Seaweed Res. Utiln. 26 (1-2): 47-53.
KANAGAWA, A. I. 1984. Clorofíceas marinhas bentônicas do estado da Paraíba – Brasil. Tese (Doutorado). Instituto de Biociências, Universidade de São Paulo.
LEWONTIN, R. C. 1969. The meaning of stability. Brookhaven Symposia in Biology. 22: 13–2.
LÜNING, K.; PANG, S. 2003. Mass cultivation of seaweeds: current aspects and approaches. Jour. Appl. Phyc., 15: 115–119.
MACCHIAVELLO, J.; SAITO, R.; GARÓFALO, G.; OLIVEIRA, E. C. 1999. A comparative analysis of agarans from comercial species of Gracilaria (Gracilariales, Rhodophyta) grown invitro. Hydrobiologia, 398/399: 397-400.
MAGURRAN, A. E. 2004. Measuring Biological Diversity. Blackwell Science Ltd, Oxford.
MARINHO-SORIANO, E.; MORALES, C.; MOREIRA, W. S. C. 2002. Cultivation of Gracilaria (Rhodophyta) in shrimp pond effluents in Brazil. Aquaculture Research, 33: 1081-1086.
MARINHO-SORIANO, E.; CAMARA, M. R.; CABRAL, T. M.; CARNEIRO, M. A. A. 2007. Preliminary evaluation of the seaweed Gracilariacervicornis (Rhodophyta) as a partial substitute for the industrial feeds used in shrimp (Litopenaeus vannamei) farming. Aquaculture Research, 38: 182-187.
MCLACKLAN, J.; BIRD, C. J. 1986. Gracilaria (Gigartinales, Rhodophyta) and productivity. Aquat. Bot, 26: 27-49.
MIRANDA, G. E. C. 2000. Avaliação do impacto da exploração (simulada) da alga agarófita Gracilaria caudata J. Agardh (Rhodophyta) no litoral do estado da
MIRANDA, G. E. C. 2010. Monitoramento, manejo e restauração de populações de Gracilaria caudata (Rhodophyta, Gigaryinales) degradadas pela exploração
comercial. Tese (Doutorado). Universidade Federal de Pernambuco. 89p.
MUNDA, I. M. 1993. Changes and degradation of seaweed stands in the Northern Adriatic. Hydrobiologia. 260-261: 239-253.
NUNES, J. M. C. 1999. Phaeophyta da região metropolitana de Salvador, Bahia, Brasil. Tese (Doutorado). Instituto de Biociências, Universidade de São Paulo.
ODUM, E. P.; BARRETT, G. W. 2007. Fundamentos de Ecologia. 5ª Edição. Cengage Learning, São Paulo.
OLIVEIRA, E. C. 1997. Algas marinhas: um recurso ainda pouco explorado pelo Brasil. Panorama da Aquicultura, 7: 24-26
OLIVEIRA, E. C. 1998. The seaweed resources in Brazil. In: CRITCHLEY, A. T.; OHNO, M. (Eds). Seaweed resources in the world. JICA, Japão,
OLIVEIRA, E. C.; ALVEAL, K. 1990. The mariculture of Gracilaria (Rhodophyta) for the production of agar. In: AKATSUKA, I. (Ed). Introduction to Applied Phycology. SBP Academic Publishing, The Hauge.
OLIVEIRA, E. C.; ALVEAL, K.; ANDERSON, R. J. 2000. Mariculture of agar-producing gracilarioide red algae. Reviews in Fish Science, 8 (4): 345-377.
OLIVEIRA, E. C.; MIRANDA, G. E. C. 1998. Aspectos sociais e econômicos da exploração de algas marinhas no Brasil. In: PAULA, E. J. e Outros (Eds). Anais do IV Congresso Latino-Americano, II Reunião Ibero-Americana e VII Reunião Brasileira de Ficologia.
OLIVEIRA, E. C.; PLASTINO, E. M. 1992. The exploitation os seaweeds in Brazil – The need for a new code to assure sustainable yelds. In: CORDEIRO-MARINHO, M. (ed). Soc. Bras. de Ficologia. São Paulo.
OSSE, A. C. 1996. Aspectos da estrutura espaço temporal de comunidade intermareal do costão rochoso da Ponta de Fortaleza – Ubatuba-SP. Dissertação (Mestrado), Universidade de São Paulo. 140p.
PEDROSA, K. K. A. L. 2004. Levantamento florístico das feofíceas no litoral do estado da Paraíba – Brasil. Dissertação (Mestrado). Universidade Federal Rural de Pernambuco.
PINEDO, S.; GARCÍA, M.; SATTA, M. P.; DE TORRES, M.; BALLESTEROS, E. 2007. Rocky-shore communities as indicators of water quality: A case study in the Northwestern Mediterranean. Marine Pollucion Bulletin, 55: 126-135.
PINTO-COELHO, R. M. 2006. Fundamentos em Ecologia. 2ª edição. Artmed Editora, Porto Alegre.
RICKLEFS, R. E. 2010. A economia da natureza. 6ª edição. Guanabara Koogan, Rio de Janeiro.
SANTELICES, B. 1991. Prodution ecology of Gelidium. Hydrobiologia, 221: 31-44.
SANTELICES, B.; DOTY, M. S. 1989. A Review of Gracilaria Farming. Aquaculture, 78: 95-133.
SHANNON, C. E. 1948. A mathematical theory of communication. Bell Syst. Techn. J. 27: 379-423, 623-656.
SILVA, R. L.; PEREIRA, S. M. B.; OLIVEIRA FILHO, E. C. ESTON, V. R. 1987. Structure of a commercial bed of Gracilaria spp in northeastern Brazil. Botanica Marina, 30 (6): 517-523.
SIMPSON, E. H. 1949. Measurement of diversity. Nature 163: 688.
SOUZA, W. P. 1979. Experimental investigations of disturbance end ecological succession in a rocky intertidal algal community. Ecol. Monogr., 49: 227-254.
STEVENSON, R. J.; SMOL, R. P. 2003. Use of algae in environmental assessments. In: WEHR, J. D.; SHEATH, R. G. (Eds.). Elsevier Science, Estados Unidos, p. 775-804.
SUTHERLAND, J. P. (1974). Multiple stable points in natural communities. The American Naturalist. 108 (964): 859–873.
TOWNSEND, C. R.; BEGON, M.; Harper, J. L. 2006. Fundamentos em Ecologia. 2ª edição. Artmed, Porto Alegre.
UMAR, M. J.; MCCOOK, L. J.; PRICE, I. R. 1998. Effects of sediment deposition on the seaweed Sargassum on a fringing coral reef. Coral Reef, 17: 169-177.