Universidade Federal de Ouro Preto
Programa de Pós - Graduação Engenharia Ambiental
Mestrado em Engenharia Ambiental
Dissertação de Mestrado
"Preparação e caracterização de adsorventes para remoção
de contaminantes
orgânicos”
Autor: Renard de Jesus Taveira Lana
Orientador: Prof. Dr. José Fernando de Paiva
Co-orientadora: Profa. Dra. Flávia Cristina Camilo Moura
ii
Universidade Federal de Ouro Preto
Programa de Pós-Graduação em Engenharia Ambiental
Renard de Jesus Taveira Lana
"Preparação e caracterização de adsorventes para remoção
de contaminantes
orgânicos”
Dissertação apresentada ao Programa de Pós-Graduação em Engenharia Ambiental, Universidade Federal de Ouro Preto, como parte dos requisitos necessários para a obtenção do título: “Mestre em Engenharia
Ambiental – Área de Concentração: Saneamento Ambiental”.
Orientador: Prof. Dr. José Fernando de Paiva
Co-orientadora: Profa. Dra. Flávia Cristina Camilo Moura
v “Você pode encarar um erro como uma besteira a ser esquecida, ou como um resultado que aponta uma nova direção.”
vi
Agradecimentos
A Deus, por sempre estar ao meu lado.
Aos meus pais Antônio e Maria, por sempre me incentivarem e apoiarem em todas as minhas escolhas. Aos meus irmãos pelo companheirismo e por sempre acreditarem em mim. Amo vocês!
À minha família, padrinho João Lana sem você nada disso seria possível, Vovó Maria, tios e primos, muito obrigado pelo apoio.
À minha namorada Eugênia, pelo apoio, amor e compreensão durantes estes períodos, e especialmente por fazer parte da minha vida.
Aos tios Sidney e Rosimeire, pelo incentivo e por me acolherem durante estes períodos, se não tudo seria mais difícil.
À minha querida e eterna República Barraca Armada, por estar sempre de braços abertos. Aos queridos irmãos tarados com quem convivi, obrigado por me aturarem por todos estes anos! Aonde quer que eu vá vocês estarão comigo.
A todos os amigos, que me incentivaram e fizeram parte do meu dia-a-dia.
Aos professores Anderson e Kátia do departamento de química pelas análises Raman e TGs.
Ao Aluir pela fundamental colaboração no desenvolvimento do trabalho.
Ao professor Geraldo Magela do departamento de química da UFOP pela ajuda e atenção nas análises Mössbauer e difração de Raio X.
Ao Grupo de Tecnologias Ambientais (GRUTAM) da UFMG pela ajuda e atenção. Ao professor José Fernando pela oportunidade, incentivo, compreensão e apoio. À professora Flávia pela confiança, oportunidade, atenção, comprometimento e ensinamentos valiosos durante a minha pós-graduação.
vii Sumário
Capítulo 1 - Introdução ... 1
Capítulo 2 - Revisão Bibliográfica ... 2
2.1. Vermiculita ... 2
2.2. Estrutura e composição química da vermiculita ... 3
2.3. Reservas, produção e comercialização ... 5
2.4. Vermiculita Hidrofobizada ... 7
Capítulo 3 - Parte Experimental ... 9
3.1. Reagentes ... 9
3.2. Representação Esquemática do trabalho ... 9
3.3. Impregnações da vermiculita com sais de ferro e/ou molibdênio ... 10
(i) Impregnação com sais de ferro:... 10
(ii) Impregnação com sais de ferro e molibdênio:... 10
3.4. Hidrofobização da vermiculita ... 11
(i) Hidrofobização utilizando etanol como fonte de carbono: ... 11
(ii) Hidrofobização utilizando sacarose como fonte de carbono ... 13
3.5 Testes de absorção/adsorção de óleos ... 14
3.6. Caracterização das amostras ... 15
Espectroscopia Mössbauer ... 15
Difração de Raios-X. ... 15
Termogravimetria ... 15
Espectroscopia Raman ... 16
Microscopia Eletrônica de Varredura ... 16
Capítulo 4 - Objetivos ... 17
4.1 Objetivo Geral ... 17
4.2 Objetivos Específicos ... 17
viii
Aplicação dos materiais compósitos para remoção de contaminantes orgânicos ... 17
Capítulo 5 - Hidrofobização Utilizando etanol ... 18
5.1 Preparação dos compósitos VE/ filamentos de carbono por CVD ... 18
5.2. Efeito da Temperatura de CVD ... 19
Espectroscopia Mössbauer ... 19
Difração de Raios-X. ... 21
Termogravimetria ... 22
Espectroscopia Raman ... 23
Microscopia Eletrônica de Varredura ... 24
Estudos de Remoção de Óleo ... 26
5.3. Efeito da Concentração de etanol ... 27
Espectroscopia Mössbauer ... 27
Difração de Raios-X. ... 29
Termogravimetria ... 30
Espectroscopia Raman ... 31
Estudos de Remoção de Óleo ... 32
5.4. Efeito da Concentração de Ferro ... 33
Espectroscopia Mössbauer ... 33
Difração de Raios-X. ... 38
Termogravimetria ... 40
Espectroscopia Raman ... 42
Estudos de Remoção de Óleo ... 43
5.5. Efeito Combinação de Fe com Mo ... 44
Espectroscopia Mössbauer ... 44
Difração de Raios-X. ... 47
Termogravimetria ... 47
ix
Microscopia Eletrônica de Varredura ... 49
Estudos de Remoção de Óleo ... 50
5.6. Conclusões ... 51
Capítulo 6 - Hidrofobização utilizando sacarose ... 52
6.1. Preparação dos compósitos VE/carbono por pirólise de sacarose ... 52
6.2. Efeito da Concentração de sacarose ... 53
Espectroscopia Mössbauer ... 53
Difração de Raios X ... 55
Termogravimetria ... 56
Espectroscopia Raman ... 57
Estudos de absorção/adsorção de óleo ... 58
6.3. Efeito do Tempo de Reação ... 59
Espectroscopia Mössbauer ... 59
Difração de Raios X ... 61
Termogravimetria ... 62
Espectroscopia Raman ... 63
Microscopia Eletrônica de Varredura ... 64
Estudos de Remoção de Óleo ... 66
6.4. Efeito da Granulometria ... 67
Espectroscopia Mössbauer ... 67
Difração de Raios X ... 69
Termogravimetria ... 70
Espectroscopia Raman ... 71
Estudo de absorção/adsorção de óleo ... 71
6.5. Efeito da Expansão da Vermiculita pela Sacarose ... 72
6.6.Conclusões ... 73
x Referências bibliográficas ... 75
Lista de Figuras
Figura 2.1: Imagens de: (a) amostra de vermiculita in natura; (b) amostra de vermiculita
esfoliada (Ugarte e Monte, 2005) ... 3
Figura 2.2: Representação da estrutura da vermiculita. Imagem adaptada do sítio da
(Web: Webmineral) ... 4
Figura 2.3: Localização do cátion magnésio e das camadas de água, na região entre
camadas da vermiculita(Web: Webmineral) ... 5
Figura 2.4: Emprego da vermiculita hidrofobizada (VEH) na remediação de acidentes
ambientais. ... 8
Figura 3.1: Representação esquemática das etapas do trabalho ... 9 Figura 3.2: Conjunto para síntese CVD – (Chemistry Vapor Deposition) utilizando etanol
como fonte de carbono. ... 12
Figura 3.3: Conjunto para síntese utilizando sacarose como fonte de carbono. ... 14 Figura 5.1: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e VE/Fe5% após CVD com 8mL de etanol em diferentes temperaturas ... 19
Figura 5.2: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e VE/Fe5% após CVD com 8 mL de etanol em diferentes temperaturas ... 21
Figura 5.3: Difratogramas das amostras de vermiculita pura e VE/Fe5% após CVD com 8
mL de etanol em diferentes temperaturas...22
Figura 5.4: Termogravimetria para as amostras de vermiculita pura e VE/Fe5% após
CVD com 8mL de etanol em diferentes temperaturas ... 23
Figura 5.5: Espectros Raman para as amostras de vermiculita pura e VE/Fe5% após CVD
xi
Lista de Figuras (Continuação)
Figura 5.6: Imagens de MEV da VE antes da hidrofobização (a) e depois do CVD com
8mL de etanol em diferentes temperaturas (b-c 600°C, d-e 700°C e f-i 800°C) ... 25
Figura 5.7: Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas em
diferentes temperaturas e VE-P ... 26
Figura 5.8: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e após CVD com diferentes quantidades de etanol ... 27
Figura 5.9: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e após CVD com diferentes quantidades de etanol ... 28
Figura 5.10: Difratogramas das amostras de vermiculita pura e após CVD com diferentes
quantidades de etanol ... 30
Figura 5.11: Termogravimetria das amostras de vermiculita pura e após CVD com
diferentes quantidades de etanol ... 31
Figura 5.12: Espectros Raman dos compósitos VE / carbono após CVD com etanol em
diferentes quantidades e VE-P ... 31
Figura 5.13: Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas com
etanol em diferentes quantidades e VP ... 32
Figura 5.14: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em
temperatura de 600°C ... 33
Figura 5.15: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e VE/Fe1, 5,10% após CVD com
8mL de etanol em temperatura de 600°C ... 35
Figura 5.16: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e VE/Fe1, 5,10% após CVD com 16mL de etanol em
xii
Lista de Figuras (Continuação)
Figura 5.17: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e VE/Fe1, 5,10% após CVD com
16mL de etanol em temperatura de 600°C ... 38
Figura 5.18: Difratogramas das amostras de vermiculita pura e VE/Fe1, 5,10% após CVD
com 8mL de etanol em temperatura de 600°C ... 39
Figura 5.19: Difratogramas das amostras de vermiculita pura e VE/Fe1, 5,10% após CVD
com 16mL de etanol em temperatura de 600°C ... 39
Figura 5.20: Termogravimetria obtidos a temperatura ambiente, para as amostras de
vermiculita pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em temperatura de 600°C ... 40
Figura 5.21: Termogravimetria obtidos a temperatura ambiente, para as amostras de
vermiculita pura e VE/Fe1, 5,10% após CVD com 16mL de etanol em temperatura de 600°C ... 41
Figura 5.22: Espectros Raman dos compósitos VE/carbono de vermiculita pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em temperatura de 600°C ... 42 Figura 5.23: Espectros Raman dos compósitos VE / carbono de vermiculita pura e
VE/Fe1, 5,10% após CVD com 16mL de etanol em temperatura de 600°C . 42 Figura 5.24: Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas com
diferentes quantidades de ferro após CVD com 8mL de etanol em temperatura de 600°C eVP ... 43
Figura 5.25: Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas com
diferentes quantidades de ferro após CVD com 16mL de etanol em temperatura de 600°C e VE-P ... 44
Figura 5.26: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e para as amostras contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 45
Figura 5.27: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
xiii
Lista de Figuras (Continuação)
Figura 5.28: Difratogramas das amostras de vermiculita pura e para as amostras contendo
5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 47
Figura 5.29: Termogravimetria para as amostras de vermiculita pura e para as amostras
contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 48
Figura 5.30: Espectros Raman dos compósitos VE / carbono de vermiculita pura e para as
amostras contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 49
Figura 5.31: Imagens de MEV da VE antes da hidrofobização (a) e para as amostras
contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a temperatura de 600°C (b-h) ... 50
Figura 5.32: Gráfico da absorção de óleo gÓleo/gvermiculita para as amostras de vermiculita
pura e para as amostras contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 51
Figura 6.1: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e após pirólise com diferentes quantidades de sacarose 53
Figura 6.2: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e após pirólise com diferentes quantidades de sacarose ... 54
Figura 6.3: Difratogramas das amostras de vermiculita pura e após pirólise com diferentes
quantidades de sacarose 10, 20 e 40% ... 56
Figura 6.4: Termogravimetria para as amostras de vermiculita pura e após pirólise com
diferentes quantidades de sacarose ... 57
Figura 6.5: Espectros Raman dos compósitos VE / carbono de vermiculita pura e após
pirólise com diferentes quantidades de sacarose 10, 20 e 40% ... 57
Figura 6.6: Gráfico da absorção de óleo góleo/gvermiculita em amostras de VE-P, 10, 20
e 40% de sacarose durante o pirólise ... 58
Figura 6.7: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
xiv
Lista de Figuras (Continuação)
Figura 6.8: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras de vermiculita pura e após pirólise com sacarose em diferentes tempos de reação ... 61
Figura 6.9: Difratogramas das amostras de vermiculita pura e após pirólise com sacarose
em diferentes tempos de reação ... 62
Figura 6.10: Termogravimetria para as amostras de vermiculita pura e após pirólise com
sacarose em diferentes tempos de reação ... 63
Figura 6.11: Espectros Raman dos compósitos VE / carbono de vermiculita pura e após
pirólise com sacarose em diferentes tempos de reação ... 63
Figura 6.12: Imagens de MEV da VE antes da hidrofobização (a) e com pirólise em
solução de sacarose 20% e 10min de reação a temperatura de 600°C (b-h)65
Figura 6.13: Gráfico da absorção de óleo gÓleo/gvermiculita em as amostras de vermiculita
pura e após pirólise com sacarose em diferentes tempos de reação ... 66
Figura 6.14: Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de
vermiculita pura e após pirólise com sacarose em diferentes granulometrias ... 67
Figura 6.15: Composição das fases de ferro (%) obtida por Mössbauer à temperatura
ambiente, para as amostras para as amostras de vermiculita pura e após pirólise com sacarose em diferentes granulometrias ... 68
Figura 6.16: Difratogramas das amostras de vermiculita pura e após pirólise com sacarose
em diferentes granulometrias ... 69
Figura 6.17: Termogravimetria para as amostras de vermiculita pura e após pirólise com
sacarose em diferentes granulometrias ... 70
Figura 6.18: Espectros Raman dos compósitos VE / carbono de vermiculita pura e após
pirólise com sacarose em diferentes granulometrias ... 71
Figura 6.19: Gráfico da absorção de óleo gÓleo/gvermiculita em as amostras de vermiculita
xv
Lista de Figuras (Continuação)
xvi
Lista de Tabelas
Tabela 2.1: Produçãomundial e reservas de vermiculita (DNPM, 2011) ... 6 Tabela 5.1: Condições usadas para preparar os diferentes compósitos VE/carbono ... 18 Tabela 5.2: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e VE/Fe5% após CVD com 8mL de etanol em diferentes temperaturas ... 20
Tabela 5.3: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e após CVD com diferentes quantidades de etanol ... 28
Tabela 5.4: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e VE/Fe1, 5,10% após CVD com 8mL de etanol
em temperatura de 600°C ... 34
Tabela 5.5: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e VE/Fe1, 5,10% após CVD com 16mL de etanol
em temperatura de 600°C ... 37
Tabela 5.6: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e para as amostras contendo 5%Fe e 5%Fe15% Mo durante o CVD com etanol a 600°C ... 45
Tabela 6.1: Condições usadas para preparar os diferentes compósitos VE/carbono ... 52 Tabela 6.2: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e após pirólise com diferentes quantidades de sacarose ... 54
Tabela 6.3: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita pura e após pirólise com sacarose em diferentes tempos de reação ... 60
Tabela 6.4: Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
xvii
Lista de Tabelas (Continuação)
Tabela 6.5: Parâmetros obtidos a temperatura ambiente, para avaliar a expansão das
xviii
Abreviaturas e Símbolos
CONAMA Conselho Nacional de Meio Ambiente COPASA Companhia de Saneamento de Minas Gerais CNT Carbon Nanotubes
CVD Chemical Vapor Deposition VE Vermiculita Esfoliada
VEH Vermiculita Esfoliada Hidrofobizada VE-P Vermiculita Esfoliada Pura
DNPM Departamento Nacional de Produção Mineral DRX Difração de Raios X
TG Termogravimetria
xix
Resumo
Neste trabalho, compósitos altamente hidrofóbicos baseados em vermiculita e carbono foram preparados, caracterizados por diferentes técnicas tais como espectroscopia Mössbauer, difração de raios X, espectroscopia Raman, análise térmica e microscopia eletrônica de varredura. Os materiais foram utilizados em processos de remoção de contaminantes orgânicos em meio aquoso.
Na primeira parte do trabalho, foi utilizado o processo de deposição de vapor químico – CVD (chemical vapor deposition) utilizando etanol como fonte de carbono para modificar a superfície da argila vermiculita esfoliada (VE). Além disso, utilizou-se Fe e Mo impregnados na superfície da argila vermiculita como catalisador na formação de diferentes formas de carbono depositados em diferentes temperaturas.
Na segunda parte do trabalho, a vermiculita foi hidrofobizada através da pirólise da sacarose para crescer uma camada de carbono em sua superfície. Este material carbonáceo permite uma melhor interação com contaminantes orgânicos. Este compósito pode ser usado para absorver óleos e outros contaminantes orgânicos derramados na água, atingindo a capacidade de aproximadamente. 3,5góleo/gcompósito.
A presença desta pequena quantidade de carbono produziu um forte aumento na absorção de óleo de motor. Estes resultados foram discutidos em termos da hidrofobização da superfície da VE.
xx
Abstract
In this work, hydrophobic composites based on expanded vermiculite and carbon were prepared and characterized by Mössbauer spectroscopy, XRD, Raman spectroscopy, TGA and SEM. The materials were used for spilled oils removal process.
In the first part of the work, it was used ethanol as a carbon source in the CVD process to modify the surface of exfoliated vermiculite (EV). In addition, it was used Fe and Mo as catalysts to promote the carbon growth in different forms on the surface of expanded vermiculite (EV).
In the second part, the expanded vermiculite was hydrophobized by pyrolysis of sucrose to grow a carbon layer on the vermiculite surface. This carbonaceous material allows a better interaction with organic contaminants. The prepared composites were uded to absorb organic contaminants in the water, reaching a capacity of approximately 3,5goil/gcomposite.
The presence of the small amount of carbon produced a strong increase in the motor oil absorption. These results were discussed in terms EV surface hydrophobzation.
1
Capítulo 1
–
Introdução
É de nosso conhecimento que a poluição das águas é um problema que requer atenção especial e solução imediata. É visando alternativas para minimizar esse problema ambiental que novas técnicas de descontaminação estão sendo desenvolvidas.
No Brasil há diversos órgãos como CONAMA E COPASA que disponibilizam diretrizes e normas que estabelecem limites para lançamentos de efluentes contaminados com material oleoso.
Hoje em dia, há inúmeras técnicas comercias para descontaminação de água por compostos orgânicos. Atendo-se somente ao derramamento de petróleo no mar podemos citar as mais importantes: Barreiras de contenção, dispersantes químicos, queima in-situ e
remoção mecânica (Ferrão, 2005).
Para outros tipos de contaminação, a precipitação química, troca iônica e degradação biológica, são métodos utilizados para ajustar as propriedades do efluente para seu lançamento de acordo com as políticas ambientais. Porém, produtos de ação adsorventes, mais econômicos e de maior eficiência, vêm sendo utilizados para substituir essas técnicas tradicionais.
Entre os materiais podemos destacar minerais que possuem capacidade de adsorver compostos apolares, ou seja, reter óleos descartados no meio ambiente. Nesse caso, especificamente, damos relevância a um argilomineral, a vermiculita.
Muitos estudos foram realizados ao longo dos anos, objetivando o desenvolvimento de processos de expansão e hidrofobização da vermiculita, bem como a viabilidade econômica do seu uso industrial. Os resultados destes estudos apontam a vermiculita como um mineral de grande importância econômica, devido a gama de utilizações que lhe pode ser dada, principalmente na sua forma expandida. Dentro deste contexto, as argilas
2
Capítulo 2
–
Revisão Bibliográfica
2.1. Vermiculita
O nome vermiculita vem do latim vermicularis, devido ao fato de que, quando
submetido a altas temperaturas, este material perde água, intumesce e toma a forma de um verme (Machado, 2000), como é mostrado na Figura 2.1.
Vermiculita é um aluminosilicato hidratado de ferro e de magnésio, pertencente à família dos filossilicatos, que possui estrutura cristalina micáceo-lamelar com cátions trocáveis em posições interlamelares. Uma representação geral da sua fórmula de uma célula unitária é (Mg, Fe)3 [(Si, Al)4 O10] (OH)2 4 H2O.
A vermiculita tem a sua estrutura composta por superfícies lamelares de silicatos, intercaladas com camadas de água. Quando aquecida entre 650 e 1.000°C apresenta uma curiosa propriedade de expansão, devido à brusca transformação da água em vapor; a pressão exercida pelo vapor promove o afastamento das lamelas e uma deformação axial do mineral. Este fenômeno, chamado de esfoliação, promove um aumento no volume inicial do mineral bruto, que varia entre 15 e 25 vezes (FERRAZ, 1971).
3
Figura 2.1. Imagens de: (a) amostra de vermiculita in natura; (b) amostra de vermiculita esfoliada (Ugarte e
Monte, 2005).
A utilização da vermiculita como material adsorvente tem-se mostrado promissora, devido às propriedades de troca iônica que possui semelhante às zeólitas e algumas argilas, podendo ser utilizada na remoção de compostos orgânicos poluentes derramados em superfícies de águas doce ou salgada. Porém, tentativas de se utilizar a vermiculita, puramente expandida, no tratamento de águas contaminadas com óleos ou no combate a vazamentos de petróleo e seus derivados demonstraram que, apesar das suas altas porosidade e superfície específica, a vermiculita expandida possui baixa capacidade de adsorção de compostos orgânicos, havendo a necessidade da sua hidrofobização (MARTINS, 1992).
2.2. Estrutura e composição química da vermiculita
Em 1934, (Gruner e Kazantzev) de forma independente e paralela, iniciaram os estudos de caracterização e compreensão da estrutura da vermiculita, definindo-a como um mineral distinto, ou seja, um grupo único. Gruner mostrou que a estrutura do mineral consistia de camadas de silicato, semelhantes as da mica e do talco, com uma dupla camada de moléculas de água entre elas. Em 1938, (Hendricks e Jefferson) confirmaram os dados de Gruner e criaram uma teoria para explicar a configuração da intercamada de água. Já (Kazantev, 1934) mostrou que a célula unitária possuía potássio parcialmente trocado por H+ e ferro parcialmente por magnésio.
SiO4 na forma de tetraedros formam as lamelas, planos ou camadas contínuas, que
se ordenam em forma hexagonal, condensadas com camadas de Al(OH)3 ou Mg(OH)2 na
forma de octaedros Figura 2.2, originando os filossilicatos, dentre eles a vermiculita (Alves e Couto, 1980).
4
Figura 2.2 Representação da estrutura da vermiculita. Imagem adaptada do sítio da (Web: Webmineral). Os elementos de coordenação 4 (Si e Al) formam tetraedros com o oxigênio, que uma vez reunidos formam as camadas tetraédricas. Nestas camadas, os tetraedros estão ligados entre si, pelos átomos de oxigênio da base, formando anéis hexagonais. Somente cátions pequenos (Si, Al e o Fe3+ algumas vezes) podem assumir a configuração tetraédrica (Machado,2000; Eslinger e Pevear,1980).
Os elementos com número de coordenação 6 (Al, Mg e Fe) formam com a hidroxila, octaedros que reunidos, dão origem as camadas octaédricas, que podem ter cátions de maior raio (Eslinger e Pevear,1980).
5
Figura 2.3 Localização do cátion magnésio e das camadas de água, na região entre camadas da vermiculita.
Imagem adaptada do sítio da (Web: Webmineral).
As moléculas de água e os cátions presentes na intercamada ocupam sítios definidos, entre as camadas na vermiculita (Eslinger e Pevear,1980). As moléculas de água se arranjam em coordenação octaédrica com o cátion magnésio. Este cátion se coloca entre as camadas de água, que está entre as camadas do silicato, em posição verticalmente abaixo e acima do alumínio ou silício das camadas tetraédricas adjacentes (Figura 2.3). Há também a possibilidade de formação de ligações de hidrogênio entre os átomos de hidrogênio da água e o oxigênio da camada tetraédrica (Eslinger e Pevear,1980).
2.3. Reservas, produção e comercialização
A produção mundial em 2009 cresceu 6,4% em comparação com o ano anterior. Os três maiores produtores concentram 81,6% da produção mundial e incrementaram as suas produções em torno de 10%. O líder mundial na produção de vermiculita é a África do Sul, com 39% da produção mundial, seguido pela China com 23,1% e Estados Unidos com 19,3%. A Rússia ocupa a 4ª colocação e em 2009 ultrapassou o Brasil, que figura como o 5º maior produtor, tendo a sua participação mundial reduzida de 5,6% em 2008 para 4,0% em 2009.
6
Em 2009, a produção mundial foi superior a 500 mil toneladas, desse montante, o Brasil representou aproximadamente 23 mil toneladas, em produção do mineral não esfoliado. A Tabela 2.1 mostra um panorama das reservas e produções mundiais, nos últimos dois anos (DNPM, 2011).
Tabela 2.1 Produção mundial e reservas de vermiculita (DNPM, 2011).
Discriminação Reservas (103t) Produção (t)
Países 2009 2008 2009 %
Brasil 6.600 29.000 22.700 4,0
África do Sul 14.000 200.000 220.000 39,0
China - 120.000 130.000 23,1
Estados Unidos 25.000 100.000 110.000 19,5
Rússia - 25.000 25.000 4,4
Austrália - 13.000 15.000 2,7
Zimbábue - 15.000 15.000 2,7
Outros países - 28.000 26.000 4,6
Total - 530.000 563.700 100
Em 2009, os estados de Goiás (84,4%), Pernambuco (12,9%) e Bahia (2,7%), foram responsáveis pela produção de 22.741 toneladas de vermiculita beneficiada não-expandida. Houve uma redução de 21,7% em relação ao ano anterior, devido à paralisação da produção no Estado do Piauí, que contribuiu com 24,7% da produção nacional em 2008, cuja jazida, que pertence a Eucatex Mineral Ltda, foi exaurida. O processo de extração da substância no país é executado a céu aberto, semi ou totalmente mecanizado, ocorrendo uma sazonalização de maior produção nos meses secos (DNPM, 2011).
7
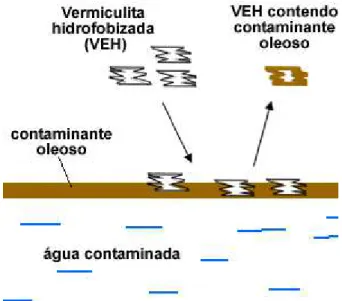
2.4
Vermiculita Hidrofobizada
A vermiculita esfoliada por flutuar na superfície da água (Santos e Navajas, 1976) tem sido investigada para remover óleo derramado em superfície de águas, devido à forte ação capilar da estrutura de poros (Machado et al., 2006; Machado, 2000). A vermiculita
esfoliada possui capacidade de absorção de substâncias apolares inferior a materiais já utilizados para esse fim, como polímeros, carvão ativado e etc. Uma forte desvantagem da vermiculita é a elevada absorção de água e baixa absorção dos contaminantes orgânicos hidrofóbicos, devido à forte hidrofílicidade da superfície da argila. Já a vermiculita esfoliada e hidrofobizada, possui capacidade de absorção de material oleoso superior ao argilomineral sem tratamento (Machado, 2000).
Vários trabalhos e patentes reportam diferentes processos para hidrofobizar a superfície da vermiculita usando, por exemplo, siloxano (Martins, 2006) e revestimento de polímeros (Machado et al., 2006). Entretanto, todos estes processos são relativamente
complexos e ainda apresentam uma capacidade de remoção de óleo relativamente baixa. Neste trabalho, foi utilizada a superfície lamelar da argila vermiculita para crescer nanotubos e nanofibras de carbono via síntese CVD (chemical vapor deposition), utilizando etanol como fonte de carbono.
O processo CVD para a produção catalítica de nanotubos de carbono (CNT) tem sido extensivamente investigado nos últimos anos (Oncel e Yurum, 2006; Dupuis, 2005), utilizando uma grande variedade de catalisadores, por exemplo, Fe/Mo, Ni, Co, e diferentes fontes de carbono, por exemplo, CH4, hidrocarbonetos C2 e C3, CO e etanol.
Devido à sua relativa simplicidade, baixo custo e alto rendimento, bem como a possibilidade de controlar vários aspectos na síntese de CNT, o processo CVD tem provado ser muito promissor para produção de nanotubos de carbono em grande escala. Diferentes óxidos, assim como Al2O3, SiO2, MgO, tem sido usados como suporte para o
crescimento de CNT (Ago et al.,2005; Qingwen et al., 2002). Superfícies bem definidas,
tais como “wafers” de silício, foram também utilizadas para o crescimento altamente
organizado e alinhado de CNT conhecidos como “tapetes” (Pichot et al., 2004; Li et al.,
2000).
Recentemente, a deposição de carbono utilizando (metano e metanol) em um processo de CVD foi empregado para modificar a superfície da VE (Purceno et al.,2011;
8
obtidos resultados promissores para remediação, especialmente nos derramamentos de óleos.
A natureza hidrofóbica de materiais a base de carbono, como as nanofibras e nanotubos de carbono, atribui a estes materiais propriedades muito promissoras para a remediação ambiental em acidentes de derramamento de contaminantes oleosos (Moura e Lago, INPI). Neste projeto, o processo de hidrofobização será realizado através da deposição de nanofilamentos e nanotubos de carbono na superfície da matriz inorgânica, rica em ferro, que pode atuar como catalisador no processo (Moura e Lago, 2009).
Neste trabalho, foi utilizado o processo CVD para produzir um emaranhado complexo de carbono, especialmente na forma de nanotubos e nanofibras na superfície da vermiculita. Esta nanoestrutura de carbono produz um material altamente hidrofóbico com
um efeito “esponja” conferindo ao material uma alta capacidade de remoção de óleo. Esta
é uma das primeiras aplicações ambientais de nanotubos de carbono.
A vermiculita hidrofobizada, pode ser utilizada para remediação de acidentes ambientais, ou até mesmo pequenos derramamentos de óleos e contaminantes oleosos em
cursos d’agua ou no mar. O processo de absorção/adsorção é mostrado na Figura 2.4.
Figura 2.4. Emprego da vermiculita hidrofobizada (VEH) na remediação de acidentes ambientais.
Como fonte de carbono para o CVD, foi utilizada na primeira etapa do trabalho o etanol (C2H5OH). Na segunda parte do experimento utilizou-se a sacarose. A utilização do
9
Capítulo 3 - Parte Experimental
3.1.
Reagentes
O Mo(acac)2O2 (VETEC), FeCl3.5H2O (VETEC), metanol (SYNTH) e a sacarose
foram utilizados sem nenhum tratamento. A vermiculita foi doada pela Empresa Vermiculita, já na forma esfoliada e não recebeu nenhum tratamento prévio antes de ser utilizada.
3.2.
Representação Esquemática do trabalho
A Figura 3.1 mostra um diagrama de todas as etapas e condições de trabalho realizadas desde a escolha da matriz, até os testes de aplicação.
10
3.3
Impregnações da vermiculita com sais de ferro e/ou molibdênio
(i)
Impregnação com sais de ferro
Para impregnar as amostras de vermiculita com sal de ferro, as seguintes etapas foram seguidas:
Uma amostra de 10g de vermiculita esfoliada foi pesada e reservada.
Um béquer de 600mL foi colocado sobre uma chapa de aquecimento com agitação magnética, a ele foi adicionado 200mL de metanol e aquecido a 70°C.
Uma amostra de FeCl3.5H2O teve seu peso calculado seguindo a proporção variável
de ferro metálico em relação a massa da amostra vermiculita.
A amostra de FeCl3.5H2O previamente calculada foi adicionada ao béquer com
metanol e com a ajuda de um agitador magnético a amostra foi solubilizada.
Após dissolução total da amostra, a amostra de vermiculita previamente pesada foi adicionada ao béquer com a solução de FeCl3.5H2O em metanol.
A solução com a vermiculita foi deixada sobre aquecimento até a secura.
Após a secura, a amostra foi levada a estufa a 70°C por 60 min para a retirada de qualquer resíduo do solvente.
(ii)
Impregnação com sais de ferro e molibdênio
Para impregnar as amostras de vermiculita com sais de ferro e molibdênio as seguintes etapas foram seguidas:
Uma amostra de 10g de vermiculita esfoliada foi pesada e reservada.
Um béquer de 600mL foi colocado sobre uma chapa de aquecimento com agitação magnética, a ele foi adicionado 200mL de metanol e aquecido a 70°C.
Uma amostra de FeCl3.5H2O teve seu peso calculado seguindo a proporção de 5%
de ferro em relação a massa da amostra vermiculita.
Após calculada, a amostra de FeCl3.5H2O foi pesada e reservada.
Uma amostra de Mo(acac)2O2 teve seu peso calculado seguindo a proporção de
15% de molibdênio em relação a massa do ferro anteriormente calculado.
11
A amostra de FeCl3.5H2O previamente pesada foi adicionada ao béquer com
metanol e com a ajuda de um agitador magnético a amostra foi solubilizada.
Após dissolução total da amostra, a amostra de Mo(acac)2O2 previamente pesada
foi adicionada ao béquer com a solução de FeCl3.5H2O em metanol.
Com a ajuda de um agitador magnético a amostra de Mo(acac)2O2 foi totalmente
solubilizada.
Após a dissolução completa dos sais de ferro e molibdênio, a amostra de vermiculita previamente pesada foi adicionada ao béquer.
Sempre sob agitação magnética o conjunto foi deixado sob aquecimento a 70°C até a secura do metanol.
Após a secura do metanol, a amostra foi levada a estufa a 70°C por 60 min. para assegurar a retirada completa do metanol.
3.4
Hidrofobização da vermiculita
(i)
Hidrofobização utilizando etanol como fonte de carbono
Para produzir amostras hidrofobizadas de vermiculita, tendo etanol como fonte de carbono, utilizou-se um sistema para síntese CVD - (Chemical Vapour Deposition). Seguindo as seguintes etapas:
As amostras produzidas pelas impregnações no iten 3.3, foram acondicionadas, uma de cada vez, em um tubo de quartzo de 40 mm, de maneira que a amostra se posicionasse mais concentrada no centro do tubo.
O tubo foi colocado dentro de um forno “Lindberg Blue M” como é mostrado na
Figura 3.2.
Um pedaço de mangueira de silicone conectava a saída da bureta a um tubo de nylon que era conectado a mais um pedaço de mangueira de silicone e esta era ligada diretamente a entrada do tubo de quartzo, onde estava acondicionada a amostra.
12
As amostras foram aquecidas até temperaturas que variaram de 400-900°C a uma taxa de aquecimento de 20°C/min.
Após 60 min as amostras foram resfriadas até a temperatura ambiente e acondicionadas em potes plásticos de 50g.
13
(ii)
Hidrofobização utilizando sacarose como fonte de carbonoPara produzir amostras hidrofobizadas de vermiculita, tendo sacarose como fonte de carbono, utilizou-se um sistema para pirólise. Seguindo as seguintes etapas:
Soluções de sacarose de 10-40% p/p em água foram preparadas e reservadas.
10 gramas de vermiculita de diferentes granulometrias foram pesadas e imersas na solução de sacarose por cerca de 30 segundos. Com a ajuda de uma peneira as amostras foram removidas da solução e deixadas 5 minutos em repouso para escorrer o excesso de solução.
As amostras produzidas foram acondicionadas, uma de cada vez, em um tubo de quartzo de 40 mm, de maneira que a amostra se posicionasse mais concentrada no centro do tubo.
O tubo foi colocado dentro de um forno “Lindberg Blue M” como é mostrado na
Figura 3.3.
Uma das extremidades do tubo de quartzo foi conectada a um pedaço de mangueira de silicone e imersa em um béquer com água para retenção de possíveis efluentes gasosos. A Figura 3.3 fornece uma visão esquemática do conjunto.
As amostras foram aquecidas até temperaturas que variaram de 300 e 600°C a uma taxa de aquecimento de 20°C/min e por tempos que variaram de 1 a 60 min.
14
Figura 3.3 Conjunto para síntese utilizando sacarose como fonte de carbono.
3.5
Testes de absorção/adsorção de óleos
As amostras foram testadas quanto à absorção/adsorção de óleo de motor. Os testes foram feitos em triplicata seguindo as seguintes etapas:
Com a ajuda de um béquer de 10mL, cadinhos de papel alumínio foram moldados e identificados por números.
Os cadinhos foram pesados e seus pesos anotados.
Em cada cadinho foi pesado cerca de 0,1 g de vermiculita, dando preferência a grãos maiores, pela facilidade de manuseio.
Em um béquer de 250mL foi adicionado cerca de 100mL de óleo de motor.
Cada amostra de vermiculita era deixada em contato com óleo por 3mim. e em seguida retirada do béquer com ajuda de uma pequena peneira de metal.
A peneira foi deixada por alguns segundos apoiada na lateral do béquer para escoamento do excesso de óleo, e em seguida a amostra com o óleo absorvido/adsorvido era retornada ao cadinho de origem.
15
Do peso cadinho/amostra/óleo diminui-se o peso cadinho/amostra e obteve-se a massa de óleo absorvida/adsorvida por 0,1 g de vermiculita.
3.6
Caracterização das amostras
Espectroscopia Mössbauer
As análises Mössbauer foram realizadas no laboratório de espectroscopia Mössbauer do DEQUI/UFOP.
Os espectros foram obtidos em temperatura ambiente, em um espectrofotômetro Mössbauer convencional (aceleração constante, fonte de 57Co em matriz de Rh, utilizando
α-Fe como padrão). Os espectros foram obtidos para as amostras em pó, usando geometrias de transmissão. No modo transmissão, são detectados os fótons transmitidos através do absorvedor. Os desvios isoméricos são relativos ao α-Fe.
Difração de Raios-X
As amostras de vermiculita expandida e vermiculita hidrofobizada foram analisadas no laboratório de raios X do Departamento de Química da Universidade Federal de Ouro Preto. Os difratogramas de raios X foram obtidos em um equipamento XRD 6000 da Shimadzu, equipado com tubo de ferro e monocromador de grafite. As medidas foram feitas com velocidade de 2º/min entre 5-70º (2θ). Os difratogramas foram interpretados com o programa Jade+.
Termogravimetria
As amostras de vermiculita hidrofobizada com sacarose e expandida foram submetidas à termogravimetria no Departamento de Química da UFMG – Universidade Federal de Minas Gerais. Para esta técnica foi utilizado uma termobalança Shimadzu TGA50H, em fluxo de ar e N2-100mL.min-1, com taxa de aquecimento de 10°C.min-1.
16
Espectroscopia Raman
As amostras de vermiculita hidrofobizada e expandida foram caracterizados por espectroscopia Raman (Renishaw) no Departamento de Química da UFOP – Universidade Federal de Ouro Preto. As análises foram efetuadas com excitação de laser com comprimento de onda de 633nm em microscópio com imagem confocal. Os espectros apresentados representam a média de dez espectros tomados de diferentes pontos da amostra para minimizar a dispersão de posição da amostra.
Microscopia Eletrônica de Varredura
17
Capítulo 4
-
Objetivos
4.1. Objetivo Geral
Preparar e caracterizar compósitos VE/carbono para serem utilizados como adsorventes de contaminantes oleosos.
4.2. Objetivos Específicos
Estudo da deposição de carbono na superfície da argila vermiculita
esfoliada
(i) Estudar processos de hidrofobização da argila vermiculita esfoliada através do recobrimento da sua superfície por uma camada de carbono. Foi também investigada a adição de Fe e Fe/Mo, que devem favorecer a formação de diferentes estruturas de carbono; além de investigar tempos de reações e concentrações de reagentes.
(ii) Otimizar condições para favorecer a formação de filamentos e nanotubos de carbono.
(iii)
Estudar como fontes de carbono: Etanol e sacarose (fontes renováveis de carbono).Aplicação dos materiais compósitos para a remoção de contaminantes
orgânicos
(i) Realização de testes de adsorção de contaminantes oleosos.
18
Capítulo 5 - Hidrofobização Utilizando Etanol
5.1 Preparação dos compósitos VE/carbono por CVD com etanol
Os compósitos vermiculita/carbono foram preparados através da impregnação de FeCl3 e/ou Mo(acac)2O2 na superfície da argila vermiculita utilizando-se metanol como
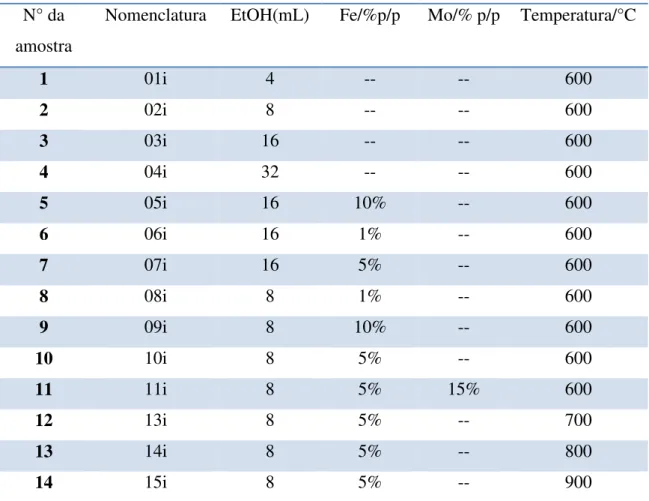
solvente, seguido de um processo CVD utilizando-se etanol como fonte de carbono. A Tabela 5.1 mostra os precursores, onde foram estudados os seguintes efeitos: (i) temperatura do processo CVD, (ii) concentração do etanol, (iii) concentração de ferro e (iv) adição de molibdênio.
Tabela 5.1. Condições usadas para preparar os diferentes compósitos VE/carbono.
N° da amostra
Nomenclatura EtOH(mL) Fe/%p/p Mo/% p/p Temperatura/°C
1 01i 4 -- -- 600
2 02i 8 -- -- 600
3 03i 16 -- -- 600
4 04i 32 -- -- 600
5 05i 16 10% -- 600
6 06i 16 1% -- 600
7 07i 16 5% -- 600
8 08i 8 1% -- 600
9 09i 8 10% -- 600
10 10i 8 5% -- 600
11 11i 8 5% 15% 600
12 13i 8 5% -- 700
13 14i 8 5% -- 800
14 15i 8 5% -- 900
Os materiais obtidos foram caracterizados por MEV, Termogravimetria, espectroscopia Raman, DRX e espectroscopia Mössbauer.
19
Os materiais obtidos foram utilizados em testes de adsorção/absorção de contaminantes orgânicos, como óleo de motor.
5.2. Efeito da Temperatura de CVD
Os materiais precursores foram preparados com 5% de ferro (VE/Fe5%) e foram
submetidos ao processo CVD com 8 mL de etanol em diferentes temperaturas entre 600 e 900 °C.
Espectroscopia Mössbauer
A Figura 5.1 mostra os espectros Mössbauer para as amostras de vermiculita esfoliada pura e de VE/Fe5% após CVD com 8mL de etanol em diferentes temperaturas. Os
parâmetros hiperfinos podem ser observados na Tabela 5.2.
90 95 100
90 95 100
90 95 100
90 95 100
-10 -5 0 5 10
90 95 100
Pura
600°C
Tr
an
sm
issم
o
re
la
tiva
/
u.
a.
700°C
800°C
900°C
Velocidade / mm s-1
20 Tabela 5.2. Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8mL de etanol em
diferentes temperaturas.
Amostras Fases δ±0,05
(mm/s)
∆±0,05 (mm/s) *
BHF± (kOe) Área ±2 (%)
Pura Fe+3 Fe+2 0,36 1,24 0,94 2,28 - - 94 6 600° Fe3O4
Fe+3 Fe+2 0,26 0,66 0,32 1,12 0 0 0,91 2,37 490 460 - - 16 17 29 38 700° X Fe+3 Fe+2 0,23 0,33 1,10 1,74 0,93 2,48 269 - - 4 25 71 800° Fe+3
Fe+2 0,28 1,14 1,13 2,39 - - 13 87
900° Fe0
Fe+3 Fe+2 0,04 0,36 1,15 1,14 -0,09 0,74 2,87 2,19 333 - - - 6 9 32 53
*Para sextetos considerar ∆ como deslocamento quadrupolar.
21 -100 0 100 200 300 400 500 600 700 800 900 1000
0 20 40 60 80 100
F
a
se
s
d
e
f
e
rro
%
Temperatura/°C
Fe+3
Fe+2
Fe
3O4
Fe0
Figura 5.2. Composição das fases de ferro (%) obtida por Mössbauer à temperatura ambiente, para as
amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8 mL de etanol em diferentes temperaturas.
A Figura 5.2 mostra que nas análises Mössbauer após CVD a 600°C há formação de grande quantidade de magnetita (Fe3O4), 33%, na superfície da argila. Os espectros
sugerem também a presença de Fe+3 e Fe+2 dispersos ou na argila com 29 e 38% de área relativa, respectivamente. A 900° observa-se a redução deste ferro à Fe0 atingindo 6% de área relativa. É interessante notar que, especialmente nas amostras tratadas em temperaturas mais elevadas, 800-900°C, permanece após o tratamento uma grande quantidade de Fe+2. Esperava-se que este ferro fosse reduzido para Fe0 ou formasse carbeto de ferro. No entanto este ferro parece estar protegido, possivelmente no interior ou mesmo na estrutura das lamelas da vermiculita.
Difração de Raios X
A Figura 5.3 mostra os difratogramas de raios X para as amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8 mL etanol em diferentes temperaturas.
22
provavelmente ao fato da vermiculita ter sido originalmente esfoliada somente a 600-700°C. O tratamento a 900°C no CVD promove uma forte alteração na estrutura cristalina do material. O que pode ser comprovado visivelmente pelo aumento do volume de VE para quase o dobro, o que indica que a vermiculita continua a ser esfoliada. Pode-se observar também picos em 45 e 46° pós a etapa de redução, sugerindo a presença de Fe3O4 e Fe
metálico respectivamente. Não foi possível observar picos referentes à fase carbono.
0 10 20 30 40 50 60 70 80
0 200 400 600 800 1000 1200 1400 1600 1800 2000
In
te
n
si
d
a
d
e
Pura 900°
800°
700°
600° Fe0
Fe3O4
Figura 5.3. Difratogramas das amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8 mL de
etanol em diferentes temperaturas.
Termogravimetria
A Figura 5.4 mostra as análises termogravimétricas para as amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8 mL de etanol em diferentes temperaturas.
Observa-se na figura que as perdas de massa observadas em temperaturas em torno de 100°C devem estar relacionadas à perda de água superficial, e as perdas de massa em temperaturas mais elevadas devem estar relacionadas à oxidação de carbono, e foram utilizadas para estimar a quantidade de carbono depositado.
23
essas perdas sejam em temperaturas relativamente elevadas, ou seja, acima 500°C o que indica presença de carbono bem organizado que se oxida nesta temperatura.
0 200 400 600 800 1000
92 93 94 95 96 97 98 99 100 101 Ma ssa /% Temperatura/C° Pura 600° 700° 800° 900°
Figura 5.4. Termogravimetria para as amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8mL
de etanol em diferentes temperaturas.
Espectroscopia Raman
Os espectros Raman para as amostras VE-P e VE/Fe5% (600-900°C) estão
mostrados na Figura 5.5.
0 500 1000 1500 2000 2500
0 5000 10000 15000 20000 25000 30000 35000 40000 45000 50000 In te n si d a d e
/cm-1
900° 800° 700° 600° Pura D G
Figura 5.5. Espectros Raman para as amostras de vermiculita esfoliada pura e VE/Fe5% após CVD com 8mL
24
Estes materiais com diferentes formas de carbono foram caracterizados por espectroscopia Raman Figura 5.5. Os espectros Raman forma obtidos com laser 633 nm e mostraram a presença de largas bandas G em aproximadamente 1600 cm-1 relacionadas com a presença de camadas grafíticas e picos D em aproximadamente 1330 cm-1 relacionados a material desordenado ou com defeitos. A baixa proporção IG/ID das amostras VE/Fe5% (600, 800 e 900°C) sugere a presença de grande quantidade de carbono
amorfo ou defeitos na estrutura da vermiculita. Por outro lado, na amostra VE/Fe5%
(700°C), foi observado maior proporção IG/ID, sugerindo a formação de carbono mais grafitizado.
Microscopia Eletrônica de Varredura
25
Figura 5.6. Imagens de MEV da VE antes da hidrofobização (a) e depois do CVD com 8mL de etanol em
diferentes temperaturas (b-c 600°C, d-e 700°C e f-i 800°C).
(b)
(a)
(c)
(d)
(e)
(f)
26
Estudos de absorção/adsorção de óleo
Para avaliar o efeito da temperatura de obtenção dos materiais com capacidade de absorção/adsorção, foram realizados testes de absorção de óleo de motor para as amostras VE-P e com VE/Fe5% a (600-900°C).
A Figura 5.7 mostra que em temperaturas acima de 700°C é produzido um material com maior capacidade de absorção/adsorção para o óleo testado.
Por outro lado, a amostra obtida a 600°C teve sua capacidade de absorção/adsorção semelhantes à VE.
Estes resultados sugerem que não é apenas o teor de carbono que determina a eficiência da capacidade de absorção de óleo. Provavelmente, a estrutura de carbono deve também desempenhar um importante papel no processo de absorção do óleo. É possível prever que a presença de nanotubos de carbono e nanofilamentos devem favorecer a remoção de óleo, oferecendo uma superfície hidrofóbica extra para interagir com óleo. Além disso, os CNT criam uma estrutura hidrofóbica de “esponja”, que, por uma ação capilar remove grandes quantidades de óleo do meio.
VP 600°C 700°C 800°C 900°C
0,0 0,5 1,0 1,5 2,0
Ab
so
rça
o
d
e
o
le
o
go
leo
/gve
rm
iculita
Amostras Oleo de motor
Figura 5.7. Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas em diferentes temperaturas e
27
5.3. Efeito da Concentração de Etanol
Os materiais precursores foram submetidos ao processo CVD com diferentes quantidades etanol (4, 8,16 e 32mL) em temperatura de 600°C.
Espectroscopia Mössbauer
A Figura 5.8 mostra os espectros Mössbauer para as amostras de vermiculita esfoliada pura e após CVD com diferentes quantidades de etanol. Os parâmetros hiperfinos podem ser observados na Tabela 5.3.
90 95 100
90 95 100
90 95 100
90 95 100
-10 -5 0 5 10
90 95 100
Pura
4mL
T
ra
n
smi
ssa
o
re
la
ti
va
/u
.a
.
8mL
16mL
Velocidade/mms-1 32mL
28 Tabela 5.3. Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita esfoliada pura e após CVD com diferentes quantidades de etanol. Amostras Fases δ±0,05
(mm/s)
∆±0,05 (mm/s) *
BHF± (KOe) Área ±2 (%)
Pura Fe+3 Fe+2 0,36 1,24 0,94 2,28 - - 94 6 4mL Fe+3
Fe+2 0,37 1,09 0,89 2,49 - - 56 44 8mL Fe+3
Fe+2 0,37 1,08 0,89 2,48 - - 64 36 16mL Fe+3
Fe+2 0,36 1,08 0,90 2,47 - - 61 39 32mL Fe+3
Fe+2 0,36 1,09 0,89 2,51 - - 47 53
*Para sextetos considerar ∆ como deslocamento quadrupolar.
A composição das fases de ferro presente nos materiais obtidos com diferentes quantidades de etanol pode ser melhor visualizada na Figura 5.9 abaixo.
-5 0 5 10 15 20 25 30 35
0 10 20 30 40 50 60 70 80 90 100 F a se s d e F e rro %
Concentraçao de etanol % Fe+3
Fe+2
Figura 5.9. Composição das fases de ferro (%) obtida por Mössbauer à temperatura ambiente, para as
29
A Figura 5.9 mostra que a análise Mössbauer para a vermiculita antes do CVD apresenta um dupleto, referente à Fe2+ em silicatos, presente na estrutura da vermiculita (δ
1,24 mm s-1 e ∆ 2,28 mm s-1) com área relativa de 6%, e ainda um dupleto relacionado à Fe3+ que pode estar relacionado com o Fe3+ da estrutura da VE (δ 0,36 mm s-1e ∆ 0,94 mm
s-1), com área relativa de 94%. Após o CVD com diferentes quantidades de etanol a 600°C o Fe3+ é consumido com a formação e de uma fase de Fe2+ dispersa no material.
Difração de Raios X
A Figura 5.10 mostra os difratogramas de raios X para as amostras de vermiculita esfoliada pura e após CVD com diferentes quantidades de etanol.
30
0 10 20 30 40 50 60 70 80
0 200 400 600 800 1000 1200 1400 1600 1800 2000
In
te
n
si
d
a
d
e
2
Pura 4mL 8mL 16mL
32mL
Figura 5.10. Difratogramas das amostras de vermiculita esfoliada pura e após CVD com diferentes quantidades de etanol.
Termogravimetria
A Figura 5.11 mostra as análises termogravimétricas para as amostras de vermiculita pura e após CVD com diferentes quantidades de etanol.
As perdas de massa observadas em temperaturas em torno de 100°C devem estar relacionadas à perda de água superficial e as perdas de massa em temperaturas mais elevadas devem estar relacionadas à oxidação de carbono e foram utilizadas para estimar a quantidade de carbono depositado.
31
0 200 400 600 800 1000
92 93 94 95 96 97 98 99 100 101 Ma ssa /% Temperatura/°C 8mL 16mL Pura 4mL 32mL
Figura 5.11. Termogravimetria das amostras de vermiculita esfoliada pura e após CVD com diferentes
quantidades de etanol.
Espectroscopia Raman
Os espectros Raman para as amostras de vermiculita esfoliada pura e após CVD com diferentes quantidades de etanol estão mostrados na Figura 5.12.
0 500 1000 1500 2000 2500
0 2000 4000 6000 8000 10000 12000 14000 16000 18000 20000 In te n si d a d e
/cm-1
Pura 4mL 8mL 16mL 32mL D G
32
A Figura 5.12 mostra que as amostras após CVD apresentam um sinal em torno de 1600 cm-1 que pode ser atribuído aos modos TM (banda G) e um sinal em torno 1330 cm-1 possivelmente relacionado com a banda D. Estes modos vibracionais estariam relacionados com o estiramento C-C tangencial de material grafitizado e com a vibração de material de C desordenado, respectivamente.
Estudos de absorção/adsorção de óleo
Para avaliar o efeito da concentração de etanol na obtenção dos materiais na capacidade de absorção/adsorção foram realizados testes de absorção de óleo de motor para as amostras VE-P e com diferentes quantidades etanol (4, 8, 16 e 32mL) em temperatura de 600°C.
Como mostra a Figura 5.13, o CVD com etanol proporcionou um aumento da capacidade de absorção/adsorção de aproximadamente o dobro que a amostra de VE-P.
No entanto, todas as amostras apresentaram capacidade de adsorção semelhante, provavelmente devido à quantidade próxima de carbono, quantidade esta relativamente pequena de 2 a 6%.
VP 4mL 8mL 16mL 32mL
0,0 0,5 1,0 1,5 2,0
Ad
so
rça
o
d
e
o
le
o
go
leo
/gve
rm
iculita
Amostras Oleo de motor
Figura 5.13. Gráfico da absorção de óleo gÓleo/gvermiculita em amostras produzidas com etanol em diferentes
33
5.4
Efeito da Concentração de Ferro
O efeito da adição de ferro foi estudado para as amostras adicionando-se 1, 5 e 10% de ferro (VE/Fe 1, 5, 10%)durante o CVD com etanol.
Espectroscopia Mössbauer
As Figuras 5.14 e 5.16 mostram os espectros Mössbauer para as amostras de vermiculita esfoliada pura e de VE/Fe1, 5,10% após CVD com 8 e 16mL de etanol
respectivamente, a temperatura de 600°C. Os parâmetros hiperfinos podem ser observados nas Tabelas 5.4 e 5.5.
90 95 100
90 95 100
90 95 100
-10 -5 0 5 10
90 95 100
Pura
T
ra
n
smi
ssa
o
re
la
ti
va
/u
.a
.
Velocidade/mms-1 1%Fe
5%Fe
10%Fe
Figura 5.14. Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de vermiculita esfoliada
34 Tabela 5.4. Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em
temperatura de 600°C.
Amostras Fases δ±0,05
(mm/s)
∆±0,05 (mm/s) *
BHF± (KOe) Área ±2 (%)
Pura Fe+3 Fe+2 0,36 1,24 0,94 2,28 - - 94 6 1%Fe Fe3O4
Fe+3 Fe+2 0,26 0,66 0,35 1,10 0 0 0,86 2,49 490 460 - - 4 4 41 51 5%Fe Fe3O4
Fe+3 Fe+2 0,26 0,66 0,32 1,12 0 0 0,91 2,37 490 460 - - 16 17 29 38 10%Fe Fe3O4
Fe+3 Fe+2 Fe3C
0,26 0,66 0,32 1,11 0,17 0 0 0,86 2,47 0 490 460 - - 209 3 3 27 45 22
*Para sextetos considerar ∆ como deslocamento quadrupolar.
35
VE-P VE1% VE5% VE10%
0 20 40 60 80 100
F
a
se
s
d
e
f
e
rro
%
Concentraçao de ferro %
Fe3C
Fe3O4
Fe3+ Fe2+
Figura 5.15. Composição das fases de ferro (%) obtida por Mössbauer à temperatura ambiente, para as amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em temperatura de
600°C.
A Figura 5.15 mostra que após CVD com 1% de Fe há formação de magnetita (Fe3O4), 8%, na superfície da argila. Os espectros sugerem também a presença e Fe+3 e
36 90
95 100
90 95 100
90 95 100
-10 -5 0 5 10
90 95 100
Pura
T
ra
n
smi
ssa
o
re
la
ti
va
/u
.a
.
Velocidade/mms-1 1%Fe
5%Fe
10%Fe
Figura 5.16. Espectros Mössbauer obtidos a temperatura ambiente, para as amostras de vermiculita esfoliada
37 Tabela 5.5. Parâmetros hiperfinos Mössbauer obtidos a temperatura ambiente, para as
amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 16mL de etanol em
temperatura de 600°C.
Amostras Fases δ±0,05
(mm/s)
∆±0,05 (mm/s) *
BHF± (KOe) Área ±2 (%)
Pura Fe+3 Fe+2 0,36 1,24 0,94 2,28 - - 94 6 1%Fe Fe3O4
Fe+3 Fe+2 Fe3C
0,26 0,66 0,20 1,11 0,17 0 0 0,85 2,47 0 490 460 - - 208 3 5 24 44 24 5%Fe Fe3O4
Fe+3 Fe+2
Fe3C
0,25 0,65 0,54 1,12 0,18 0,01 0,01 0,99 2,74 -0,007 491 460 - - 209 14 24 26 18 18 10%Fe Fe3O4
Fe+3 Fe+2 Fe3C
0,24 0,67 0,34 1,09 0,16 0,01 0,01 0,82 2,45 0,06 488 456 - - 206 8 15 30 28 19
*Para sextetos considerar ∆ como deslocamento quadrupolar.
38
VE-P VE1% VE5% VE10%
0 20 40 60 80 100
F
a
se
s
d
e
f
e
rro
%
Concentraçao de ferro %
Fe3O4
Fe3
Fe+2 Fe3C
Figura 5.17. Composição das fases de ferro (%) obtida por Mössbauer à temperatura ambiente, para as amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 16mL de etanol em temperatura de
600°C.
A Figura 5.17 amostra que após CVD com 1% de Fe há formação de magnetita (Fe3O4), 8%, na superfície da argila. Os espectros sugerem também a presença de Fe+3 e
Fe+2 dispersos ou na argial com 24 e 44% de área relativa, respectivamente e ainda a
formação de 24% de carbeto de ferro. Na amostra após CVD com 5% de Fe é possível observar a formação de grande quantidade de magnetita, 38% na superfície da argila, e ainda a formação de 18% de carbeto de ferro. Já na amostra após CVD com 10% de Fe observa-se uma pequena variação na quantidade de carbeto atingindo 19% de área relativa. É interessante notar que, uma grande quantidade de Fe2+, esperava-se que este ferro fosse reduzido para carbeto de ferro. Porém este ferro parece estar protegido, possivelmente no interior ou mesmo na estrutura das lamelas da vermiculita.
Difração de Raios X
As Figura 4.18 e 4.19 mostram os difratogramas de raios X para as amostras de vermiculita esfoliada pura e de VE/Fe1, 5,10% após CVD a 600°C com (8 e 16mL) de etanol,
39
0 10 20 30 40 50 60 70 80
0 200 400 600 800 1000 1200 1400 In te n si d a d e Pura 1%Fe 5%Fe 10%Fe Fe
3O4
Figura 5.18. Difratogramas das amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 8mL
de etanol em temperatura de 600°C.
0 10 20 30 40 50 60 70 80
0 200 400 600 800 1000 1200 1400 In te n si d a d e 2 Pura 1%Fe 5%Fe 10%Fe
Fe3O4 Fe
3O4
Fe 3O4
Figura 5.19. Difratogramas das amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 16mL
de etanol em temperatura de 600°C.
As Figuras 4.18 e 4.19 mostram os digratogramas para a VE-P eVE/Fe1, 5,10%após
40
de difração após o tratamento se altera completamente, produzindo picos que sugerem a presença de flogopita entre outros picos não identificados. Isso se deve provavelmente ao fato da vermiculita ter sido originalmente esfoliada somente a 600-700°C. O tratamento com CVD promove uma alteração na estrutura cristalina do material. Outra alteração observada visualmente foi um aumento do volume da VE para quase o dobro. Isso indica um processo de esfoliação da VE. Não foi possível observar picos referentes ao carbeto por coincidirem com os do mineral em aproximadamente 35° e nem picos referentes à fase carbono. Pode-se observar também picos em 45° após a etapa de redução, sugerindo a presença de Fe3O4 em (VE/Fe5% CVD com 8mL de etanol) e (VE/Fe1, 5,10% CVD com
16mL de etanol).
Termogravimetria
As Figuras 5.20 e 5.21 mostram as análises termogravimétricas para as amostras de vermiculita esfoliada pura e VE/Fe1, 5,10% após CVD com 8 e 16mL de etanol
respectivamente, em temperatura de 600°C.
0 200 400 600 800 1000
85 90 95 100
Ma
ssa
/%
Temperatura/°C 10%Fe
1%Fe Pura
5%Fe
Figura 5.20. Termogravimetria obtidos a temperatura ambiente, para as amostras de vermiculita esfoliada
pura e VE/Fe1, 5,10% após CVD com 8mL de etanol em temperatura de 600°C.