ANDRÉ CORRÊA AMARAL
NANOESTRUTURAÇÃO DE FÁRMACOS
(ANTIFÚNGICOS E PEPTÍDEOS) NO TRATAMENTO DA
PARACOCCIDIOIDOMICOSE EXPERIMENTAL
Tese apresentada ao Programa de Pós-Graduação “Strictu Sensu” em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito para a obtenção do título de Doutor em Ciências Genômicas e Biotecnologia.
Orientadora: Dra. Maria Sueli Soares Felipe Co-orientador: Dr. Paulo Cesar de Morais
Amaral, André Corrêa.
Nanoestruturação de fármacos (antifúngicos e peptídeos) no tratamento da paracoccidioidomicose experimental. / André Corrêa Amaral.
Fevereiro de 2009. XIV, 106f.: il. 30cm
Tese (doutorado) – Universidade Católica de Brasília, 2009 Orientação: Dra. Maria Sueli Soares Felipe
Co-orientação: Dr. Paulo Cesar de Morais
1. Nanobiotecnologia. 2. Polímeros biodegradáveis. 3. Liberação de fármacos. I. Felipe, Maria Sueli Soares, orient. II. Doutora
DEDICATÓRIA
Dedico este trabalho a minha família, exemplos de dedicação e união.
Ao meu pai, Dorival, à minha querida mãe Maria Helena (in memorian) e às minhas irmãs Andréia e Camila que, apesar da distância, sempre me incentivaram a buscar o melhor para mim e me apoiaram em todos os momentos.
Aos meus avós Benjamim e Benta (in memorian) que foram exemplos de força e de luta na busca de seus ideais e que, acima de tudo, me ensinaram que independente das barreiras que a vida nos apresenta, devemos sempre ultrapassá-las com dignidade e honestidade.
Ao Esper que, acima de tudo, é um grande amigo, pelo constante incentivo e por me mostrar que a vida deve ser vivida como um todo. Por me fazer acreditar que podemos viver nossas vidas tal como fez Fernão Capelo Gaivota: voar mais longe e mais alto em busca de nossos ideais.
AGRADECIMENTOS
À Professora Dra. Maria Sueli Soares Felipe, uma professora no sentido real da palavra que se dedica à correta formação de todos os seus alunos. Obrigado pelos ensinamentos, pelos incentivos e por me mostrar o caminho de dedicação e seriedade no trabalho científico. Obrigado pelo apoio nos momentos de tristeza e, também, por todas as alegrias compartilhadas. Muito obrigado!
Ao Professor Dr. Paulo Cesar de Morais, meu co-orientador, agradeço os ensinamentos e as discussões durante a execução deste trabalho.
À Professora Dra. Anamélia Lorenzetti Bocca, obrigado pelas dicas, sugestões e participações neste trabalho. Agradeço também o incentivo e por partilhar momentos de alegria em situações difíceis.
Aos Professores Doutores Carlos Peleschi Taborda (USP/SP), Eliana Martins (Farmácia, UFG/GO), Luis Travassos (UNIFESP), Eliane Lima (Química, UFG/GO), Cláudio Tedesco (USP/SP), Ricardo Bentes (UNB), Zulmira Lacava (UNB), Carlos Bloch (Embrapa/Cenargen), Ricardo Titze (UNB), a oportunidade de desenvolver projetos em colaboração e por me receberem em seus laboratórios.
A todos os professores da pós-graduação do Curso de Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, os ensinamentos. À Professora Danielle Cordeiro pelas dicas e orientação no desenvolvimento da atividade de Teacher Assistance.
À Polyanna, Nathália e Keysiane as noites de estudo passadas em claro e, também, os momentos alegres e divertidos das manhãs seguintes.
Ao Fábio, secretário do Programa de Pós Graduação em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, sua presteza, eficiência e gentileza no atendimento.
À dona Fátima e dona Ivonildes, obrigado pelos primeiros ensinamentos de conduta no laboratório e pelas conversas descontraídas durante os experimentos.
Ao CNPq, à FAP-DF e à Universidade Católica de Brasília cujo apoio financeiro possibilitou a realização deste trabalho.
RESUMO
ABSTRACT
SUMÁRIO
Páginas
Lista de figuras...vi
Lista de tabelas...ix
Abreviaturas e definições...x
I – INTRODUÇÃO...1
1. Considerações gerais...1
2. Nanotecnologia...3
2.1. Sistemas de Liberação Sustentada de Fármacos………...3
2.2. Sistemas Poliméricos...5
2.2.1. Copolímero dos ácidos láctico e glicólico – PLGA...6
2.2.2. Biodegradação do PLGA...9
2.3. Preparação de sistemas poliméricos biodegradáveis...11
2.4. Nanopartículas de PLGA...13
3. Peptídeos antifúngicos e imunomoduladores……...14
3.1. Predição e identificação de peptídeos antimicrobianos in silico...16
3.2. Peptídeos imunomoduladores – P10...17
4. Infecções fúngicas…………...18
4.1. Tratamento atual para as infecções fúngicas...19
4.1.1. Anfotericina B...20
4.1.2. Preparações nanoestruturadas para a anfotericina B...22
4.2. Modelo experimental da paracoccidioidomicose.…...…...24
4.2.1. Formas clínicas da paracoccidioidomicose...25
4.2.2. Resposta imunológica durante a paracoccidioidomicose...26
4.2.3. Terapêutica para paracoccidioidomicose...27
II – JUSTIFICATIVA... ...28
III - OBJETIVOS...29
Objetivo geral...29
Objetivos específicos...29
IV – METODOLOGIA...30
V – RESULTADOS......42
Parte II - Peptídeos antimicrobianos e peptídeo imunomodulador P10………..…...52
Peptídeo antimicrobianos……….………....……53
Peptídeo imunomodulador P10 - PLGA-DMSA………..…..56
VI– DISCUSSÃO...60
Parte I - Anfotericina B -PLGA-DMSA...60
Parte II - Peptídeos antimicrobianos e peptídeo imunomodulador P10………...66
Peptídeo antimicrobianos……….………66
Peptídeo imunomodulador P10 - PLGA-DMSA………...68
VII – CONCLUSÕES...71
VIII – PERSPECTIVAS……….72
IX – REFERÊNCIAS BIBLIOGRÁFICAS...72
X – APÊNDICES...88
LISTA DE FIGURAS
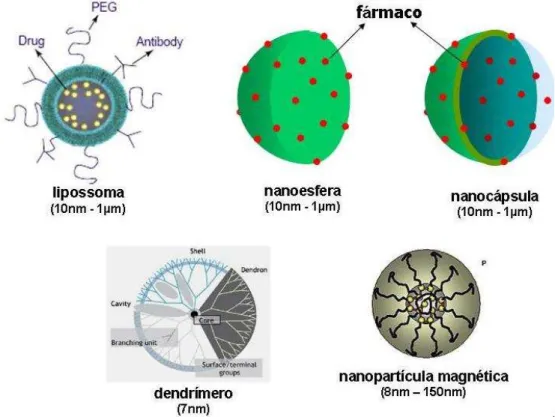
Figura 1: Esquemas representativos dos diferentes tipos de nanopartículas. Observar os diferentes tamanhos e suas respectivas áreas para conjugar princípios ativos e fármacos. Adaptado de Rawat et al., 2006.
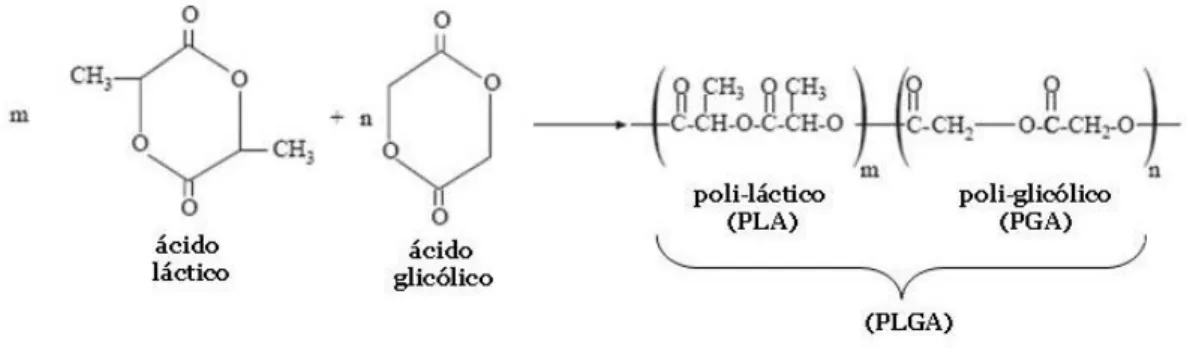
Figura 2: Estruturas químicas dos dímeros cíclicos do ácido láctico, do ácido glicólico e dos poliésteres PLA e PGA formando o copolímero PLGA. Adaptado de Commandeur et al., 2006.
Figura 3: Degradação dos copolímeros. (a) a erosão inicia no centro da matriz polimérica e toda ela é destruída; (b) a erosão tem início nas partes mais superficiais da matriz e as camadas sofrem degradação de fora para dentro. Adaptado de Hillery et al., 2001.
Figura 4: Esquema representativo de uma nanocápsula (a) e de uma nanoesfera (b). (Amaral AC e Felipe MSS, 2008)
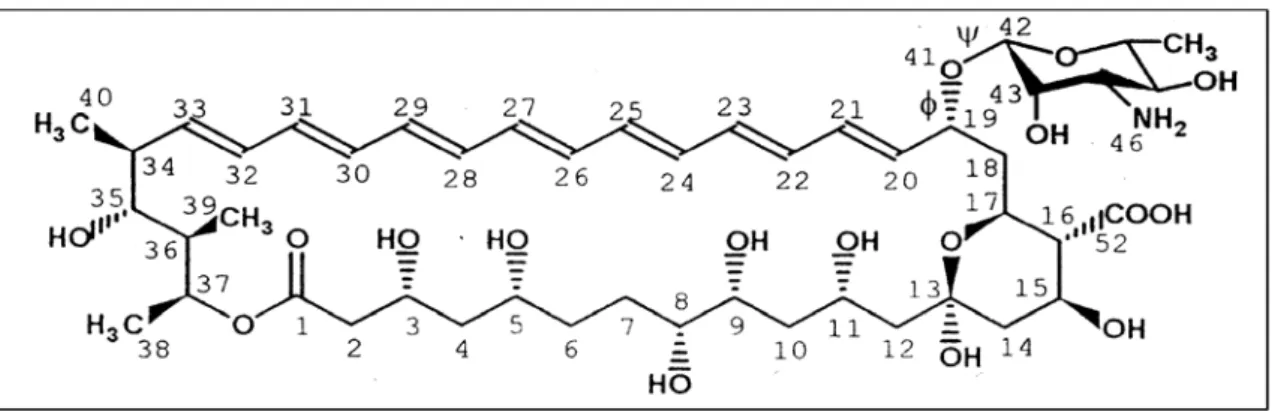
Figura 5: Estrutura química do fármaco anfotericina B. Adaptado de Carrillo-Muñoz et al., 2006.
Figura 6: Cronograma de tratamento para os camundongos infectados com P. brasiliensis por via endovenosa. Nano= anfotericina B em blenda polimérica de PLGA-DMSA; AmB= anfotericina B convencional, Fungizon®.
Figura 8: Distribuição média de tamanho detectado na suspensão de Nano-D-AMB. Nota-se a presença de duas populações distintas de partículas: uma com cerca de 200nm e a outra com cerca de 2µm, tratando-se de um sistema polimérico misto, com nanopartículas e micropartículas. (d.nm): diâmetro nanométrico.
Figura 9: Imagem capturada por microscopia óptica de luz de uma amostra de partículas da formulação Nano-D-AMB com aumento de 100x. Pode ser observada a presença de esferas de diversos tamanhos, com o maior deles com diâmetro aproximado de 6μm. Escala da imagem 1:10μm.
Figura 10: Recuperação da carga fúngica (CFU por grama de tecido pulmonar) dos camundongos infectados com o fungo P. brasiliensis isolado Pb18 e tratado com D-AMB (0.9mg/kg de anfotericina B pura, i.p., dose diária) e Nano-D-AMB (2.7mg/kg de anfotericina B pura encapsulada em blenda polimérica de PLGA-DMA, i.p., dose a cada 72h), comparada com o grupo controle infectado e tratado com PBS. n= 5 animais por cada ponto de avaliação. O experimento foi integralmente repetido por duas vezes e os resultados foram totalmente reprodutivos. *P<0.05 para D-AMB e Nano-D-AMB versus PBS, determinado pelo one-way ANOVA seguido pelo teste de Tukey. Nenhuma diferença significativa foi observada entre os grupos de tratamento D-AMB e Nano-D-AMB.
Figura 12: Aparência física de camundongos representativos dos grupos experimentais: controle não infectado e tratado com PBS; infectado e tratado com PBS; infectado e tratado com D-AMB (0.9mg/kg de anfotericina B pura, i.p., dose diária); infectado e tratado com Nano-D-AMB (2.7mg/kg de anfotericina B pura encapsulada em PLGA-DMSA, i.p., administrada a cada 72h). PBS e D-AMB apresentam sinais de estresse, tais como piloereção e hipotricose, o que não é observado nos animais do grupo tratado com Nano-D-AMB.
Figura 13: Cromatogramas dos peptídeos P1, P2, P3 e P4. No cromatograma do peptídeo P2, o maior pico corresponde ao peptídeo sintetizado de acordo com análise realizada em espectrômetro de massa MALDI-TOF/TOF. As amostras foram fracionadas em uma coluna C18 Vydac 218TP510 e equilibradas com água 0,1% TFA. A eluição ocorreu utilizando-se um gradiente linear de ACN (5-95%) com fluxo de 2,5mL/min. A cromatografia foi monitorada nos comprimentos de onda de 216nm e 280nm.
LISTA DE TABELAS
Tabela 1: Características dos polímeros biodegradáveis.
Tabela 2: Formulações nanoestruturadas para a anfotericina B.
Tabela 3: Custo aproximado (em US$) das principais drogas utilizadas no tratamento das infecções fúngicas invasivas. Valores referentes ao ano de 2006.
Tabela 4: Dados bioquímicos para investigar toxicidade renal (Ur e Cr) e hepática (AST e ALT) dos animais submetidos aos tratamentos com D-AMB e Nano-D-AMB. Ur: uréia, Cr: creatinina, AST: aspartato aminotransferase, ALT: alanina aminotransferase.
Tabela 5: Avaliação do peso corporal de acordo com cada grupo experimental nos dias 30 e 60 após o início dos tratamentos.
Tabela 6: Freqüência de MNPCE, MNNCE e PCE na medula óssea dos camundongos depois dos tratamentos. Ciclofosfamida foi usada como controle positive para genotoxicidade. MNEPC: Micronúcleos em Eritrócitos Policromáticos; MNENC: Micronúcleos em Eritrócitos Normocromáticos; %EPC: porcentagem de eritrócitos policromáticos.
Tabela 7: Teste de atividade antifúngica dos peptídeos selecionados a partir do transcriptoma do P. brasiliensis contra C. albicans isolado clínico e P. brasiliensis isolados Pb01 e Pb18, avaliado pelo MIC (Minimum Inhibitory Concentration).
LISTA DE ABREVIATURAS
AIDS: Síndrome da Imunodeficiência Adquirida (do Inglês, Acquired Imunodeficiency Syndrome)
ARG: aminoácido arginina
BHI: meio de cultura composto por uma infusão de cérebro e coração (do Inglês, Brain Heart Infusion)
ºC: Graus Celsius
CFU: unidades formadoras de colônia (do Inglês, Colony Forming Units) D-AMB: anfotericina B desoxicolato de sódio
Da: Daltons (unidade de medida) DMSA: ácido dimercaptosuccínico
DNA: ácido desoxirribonucléico (do Inglês, Desoxirribonucleic Acid) ELISA: Enzyme Linked Immune Sorbent Assay
g: grama (unidade de medida) gp43: glicoproteína de 43 kDa h: hora
HIS: aminoácido histidina
HPLC: Cromatografia Líquida de Alta Eficiência (do Inglês, High Performance Liquid Chromatography)
i.t.: intratraqueal i.v.: endovenosa IFN-γ: Interferon gama IL-4: Interleucina 4 IL-10: Interleucina 10 IL-12: Interleucina 12
KDa: quilodaltons (unidade de medida) Kg: quilograma (unidade de media)
mg: miligrama (unidade de medida) ml: mililitro (unidade de medida) min: minuto (unidade de medida) μg: micrograma (unidade de medida) μl: microlitro (unidade de medida)
µm: micrometro (unidade de medida)
Nano-D-AMB: anfotericina B em blenda polimérica de PLGA-DMSA nm: nanômetro
P10: peptídeo P10
Pb01: Paracoccidioides brasiliensis isolado 01 Pb18: Paracoccidioides brasiliensis isolado 18 Pb192: Paracoccidioides brasiliensis isolado 192
PBS: tampão fosfato (do Inglês, Phosphate Buffer Saline) PCM: paracoccidioidomicose
pH: potencial hidrogeniônico PLA: poli láctico
PLG: poli glicólico
PLGA: copolímero formado pelo poli(láctico-co-glicólico) PRO: aminoácido prolina
I. INTRODUÇÃO
1. Considerações gerais
Com o aumento no número de pacientes imunossuprimidos, tais como aqueles submetidos a transplantes de órgãos, à quimioterapia e também os acometidos pela aids, observa-se também um preocupante aumento dos casos de resistência dos microrganismos à terapia atual. Dentre elas, as doenças fúngicas requerem urgência no desenvolvimento de novos medicamentos, uma vez que os casos de fungos resistentes aos antifúngicos clássicos são relatados com freqüência nas diversas partes do mundo (Foubiester, 2003; Carrillo-Muñoz et al., 2006).
Este fato torna-se ainda mais agravado pela desaceleração no lançamento de novos medicamentos pela indústria farmacêutica observada nos últimos anos. Isto ocorre devido, principalmente, aos gastos envolvidos na pesquisa e desenvolvimento tecnológico até atingir o mercado, que podem chegar ao custo de US$ 800 milhões para cada um (Schmid E & Smith D, 2005). O sucesso terapêutico de um novo medicamento depende de processos inovadores envolvidos nas etapas do seu desenvolvimento, tais como síntese do composto, formulação e ensaios clínicos. Além do alto custo, do longo período de pesquisas, desde a investigação básica de bancada de uma nova molécula bioativa até os ensaios pré-clínicos e clínicos, o tempo necessário para sua aprovação pelos órgãos reguladores também pode ser muito longo (DiMasi & Grabowski, 2007). Dessa forma, estratégias adequadas para o desenvolvimento de novos medicamentos são necessárias no sentido de contornar estes gargalos. Dentre elas, consideram-se bastante promissoras a busca de novas formulações para os fármacos atualmente disponíveis usando a nanobiotecnologia e a identificação racional de moléculas bioativas nos bancos genômicos (Wills et al., 2000).
para agregar uma quantidade de droga acima da dose mínima necessária para alcançar a eficácia do tratamento, permitindo inclusive, diminuir o número de aplicações do fármaco. Estes sistemas, uma vez administrados ao paciente, liberam o princípio ativo de maneira gradual e lenta, quer de forma sistêmica ou em regiões específicas do corpo (Nahar et al., 2006; Okassa et al., 2007). Esta estratégia elimina a necessidade de serem realizados estudos demorados e de alto custo para aprovar um medicamento novo, uma vez que o uso do princípio ativo já conhecido poderá abreviar o tempo necessário para sua liberação no mercado.
O método tradicional de identificação de novas moléculas antimicrobianas que possam ser utilizadas como opção nos tratamentos terapêuticos é bastante trabalhoso e demorado. Normalmente, as etapas para a obtenção destas moléculas envolvem testes in vitro de extratos naturais contra uma variedade de microrganismos e, quando apresentam atividade antimicrobiana, eles são purificados para identificar a molécula bioativa presente (de Lucca e Walsh, 2000). Uma alternativa a este longo processo é a busca in silico de peptídeos antimicrobianos dentro de seqüências de proteínas ou nos bancos de dados genômicos usando programas computacionais que identificam as seqüências de aminoácidos com propriedades físico-químicas de moléculas bioativas já descritas na literatura (Doytchinova et al., 2004). Estas seqüências identificadas podem ainda ser modificadas antes de serem sintetizadas visando melhorar, ainda mais, a eficácia antimicrobiana.
2. Nanotecnologia
O termo nanotecnologia deriva da palavra grega “nano”, que significa algo de dimensão minimizada. Esta ciência tem como foco o desenvolvimento e a utilização de materiais, dispositivos e sistemas através do controle da matéria na escala nanométrica, ou seja, na bilionésima parte de um metro (10-9m) e a sua unidade de medida é o nanômetro (Hillery et al., 2001; Jain, 2008). A aplicação do conhecimento e dos materiais desenvolvidos por esta ciência em biologia recebe o termo nanobiotecnologia e, mais especificamente, na área da saúde, o termo nanomedicina (Moghini et al., 2005).
Recentemente, o uso da nanomedicina, termo usado para referir a aplicação da nanotecnologia nos organismos vivos, vem mostrando impactos positivos nos cuidados com a saúde em aplicações que variam desde o diagnóstico até o tratamento de doenças. Entretanto, uma maior prioridade é dada para o desenvolvimento de medicamentos, apesar de ainda serem poucas as opções disponíveis preparadas por meio desta tecnologia (Moghini et al., 2005; Jain, 2008). A grande maioria delas são formulações nanoestruturadas para os fármacos já existentes que, em função das propriedades da escala nanométrica, permitem a manipulação da sua farmacocinética, biodistribuição e mudanças na sua eficácia terapêutica (Caruthers et al., 2007). Para tanto, são desenvolvidos sistemas racionais para a liberação controlada de um fármaco, visando atingir órgãos e regiões específicas do organismo em doses pré-determinadas.
2.1. Sistemas de Liberação Sustentada de Fármacos
de modo a direcionar e entregar a droga no local onde se deseja que ocorra o tratamento (Nahar et al., 2006; Yu et al., 2007).
Podem também ser preparados sistemas de liberação sustentada de fármacos, os quais promovem uma liberação inicial do princípio ativo, disponibilizando uma dose terapêutica tão logo o sistema seja injetado no organismo. Após esta liberação inicial, ocorre uma liberação gradual do fármaco por um período previamente determinado durante a síntese do sistema (Hillery et al., 2001; Reis et al., 2006). Tais sistemas podem ser aplicados, principalmente, para preparar formulações visando reduzir o número de administrações do princípio ativo ou para aqueles que apresentam uma elevada toxicidade (Okassa et al., 2007). Deste modo, são reduzidas as quantidades do fármaco e até mesmo do número de aplicações necessárias para alcançar o seu efeito terapêutico.
Estudos indicam que estes sistemas podem trazer diversos benefícios visando melhorar a eficácia terapêutica de certos princípios ativos (Yarboro et al., 2007). Uma importante vantagem alcançada por esta tecnologia foi a liberação de modo sustentado da insulina por até três semanas. A sua incorporação em nanoformulações preparadas com polímeros biodegradáveis promoveu a sua liberação lenta à medida que o polímero era degradado por influência do pH do sangue (Takenaga et al., 2002; Fan et al., 2006). Outro benefício promovido pela utilização destes sistemas de liberação sustentada é a significativa redução dos efeitos tóxicos causados por fármacos quando preparados nas formulações clássicas. Um bom exemplo para isto é a conjugação do anti-tumoral Paclitaxel® em blendas poliméricas, que mesmo ao ser administrado em doses superiores a tolerável ele não apresentou toxicidade durante o tratamento do câncer de ovário em modelo animal (Vassileva et al., 2006).
2006). Dos materiais disponíveis, os polímeros biodegradáveis merecem destaque pela sua versatilidade, permitindo a preparação de blendas poliméricas contendo o fármaco e ligantes alvos-específicos (Duncan, 2006).
Figura 1: Esquemas representativos de tipos de nanopartículas. Observar os diferentes tamanhos e suas respectivas áreas para conjugar princípios ativos e fármacos. Adaptado de Rawat et al., 2006.
2.2. Sistemas Poliméricos
uso permite a síntese de moléculas orgânicas de alta massa molecular constituídos, em geral, por mais de 50 monômeros, que, ao se agregarem em um padrão regular, formam uma matriz ou reservatório onde o fármaco ficará inserido (Commandeur et al., 2006).
O uso de polímeros biodegradáveis permite a liberação do fármaco enquanto ocorre a dissolução gradual da matriz durante as aplicações in vivo (Hillery et al. 2001). Estes polímeros são degradados em moléculas que podem ser metabolizadas pelo organismo, participando como substrato das vias metabólicas. Durante a biodegradação de um sistema polimérico, o fármaco conjugado é liberado de acordo com uma cinética previamente determinada no momento da síntese da nanopartícula e desencadeada em determinadas condições, como ação enzimática, mecânica e alterações de pH (Commandeur et al., 2006; Vicent e Duncan, 2006).
Dentre os polímeros biodegradáveis, a combinação dos dímeros cíclicos dos ácidos láctico e glicólico, formando o poli(lático-co-glicólico) (PLGA), é uma das mais utilizadas para a preparação de sistemas de liberação sustentada de fármacos, sendo o seu uso liberado para aplicação em humanos (Jiang et al., 2005). Em função da sua versatilidade de manipulação, eles podem ser conjugados com princípios ativos para fins terapêuticos em quantidades suficientes para uma única dose ou para mais de uma dose (liberação sustentada), além de ser possível a sua funcionalização por meio de substâncias capazes de levar o fármaco diretamente para o órgão-alvo do tratamento (Saltzman, 2001; Duncan, 2006).
2.2.1. Copolímero dos ácidos láctico e glicólico - PLGA
pode ser processado para ser de qualquer tamanho e forma podendo encapsular diversos tipos de moléculas (Jiang et al., 2005; Mundargi et al., 2008).
O polímero PLA pode existir em duas formas ópticas: L-PLA, ativa estéreo-regular, que é semicristalina devido à regularidade da sua cadeia polimérica; e a mistura D,L-PLA, inativa racêmica, que devido a irregularidades na sua cadeia polimérica faz com que ele seja um polímero amorfo, tornando-o preferível para uso em sistemas sustentados por permitir a dispersão do fármaco na matriz polimérica (Jain, 2000; Hillery et al. 2001). O PGA é altamente cristalino devido à ausência dos grupos metila que aparecem no PLA (Figura 2). Uma vez que o PLA é mais hidrofóbico do que o PGA, os copolímeros de PLGA ricos em PLA são menos hidrofílicos, absorvem menos água e, conseqüentemente degradam mais devagar (Jain, 2000, Mundargi et al., 2008).
Figura 2: Estruturas químicas dos dímeros cíclicos do ácido láctico, do ácido glicólico e dos poliésteres PLA e PGA formando o copolímero PLGA. Adaptado de Commandeur et al., 2006.
2007). Na Tabela 1 estão apresentados os tempos de degradação de diferentes proporções de PLA:PGA em função do tempo e da sua temperatura de transição vítrea (Tg).
A temperatura de transição vítrea (Tg) é um importante fator que interfere na velocidade de degradação dos polímeros. Ela é a temperatura pela qual o polímero passa do estado cristalino para o estado amorfo. Quanto mais baixa for a Tg mais amorfo será o polímero e mais rápida será a sua degradação (Jain et al., 1998). A Tg do PLGA está acima da temperatura fisiológica de 37 ºC, em torno de 45 ºC para PLA:PGA de 50:50 (Tabela 1). A Tg diminui com a redução do contento de PLA na composição do PLGA e com a diminuição de seus pesos moleculares.
Tabela 1. Características dos polímeros biodegradáveis.
Tempo aproximado de degradação
(meses/dias) Polímero ou copolímero
(%)*
Cristalinidade (%)
Tg (ºC)
Meses Dias
PLA (100) 37 60-67 18-24 -
PGA (100) 50 36 2-4 -
PLGA 90:10 22 ~65 6,5 -
PLGA 80:20 8 ~65 - -
PLGA 70:30 0 58 - 18
PLGA 50:50 0 ~45 - 6
PLGA 30:70 0 ~65 - 18
*Os números indicam, respectivamente, a proporção dos monômeros de ácido láctico e glicólico no copolímero em percentual. Tg: temperatura de transição vítrea (passagem do estado cristalino para o amorfo). Adaptado de Saltzman, 2001.
mais elevadas de qualquer um dos dois monômeros (Hillery et al. 2001; Saltzman, 2001). Polímeros mais cristalinos são indicados para finalidades nas quais o polímero precisa ser degradado muito lentamente. Já os polímeros amorfos podem ser indicados para aplicações nas quais a perda rápida da massa é importante ou para sistemas de entrega de fármacos, em que a capacidade de dispersão e difusão do fármaco pela matriz é uma característica essencial (Saltzman, 2001).
2.2.2. Biodegradação do PLGA
A biodegradação é um termo utilizado para descrever a degradação dos sistemas poliméricos quando ocorridos in vivo. Embora os mecanismos de biodegradação ainda não estejam muito bem descritos, sabe-se que a clivagem da cadeia polimérica ocorre pela hidrólise das ligações éster (Saltzman, 2001; Italia et al., 2007).
Tanto in vitro quanto in vivo, a degradação do PLGA é favorecida por um ambiente aquoso, o qual facilita a interação da água com as ligações éster da cadeia polimérica. A degradação ocorre em uma taxa uniforme através da matriz de PLGA e é dependente da relação molar do PLA e PGA no copolímero, peso molecular e grau de cristalinidade do sistema polimérico (Jain, 2000; Hillery et al., 2001; Mittal et al., 2007). À medida que ocorre a biodegradação, aumenta o número de grupos carboxila terminais na cadeia de PLGA, os quais atuam como catalisadores do processo (Jain, 2000).
Geralmente a biodegradação ocorre em quatro grandes estágios: i) a hidratação do polímero causa instabilidade das estruturas primária e secundária; ii) a perda da resistência é causada pela ruptura das ligações éster no polímero; iii) ocorre a perda da integridade da massa resultando na formação de fragmentos poliméricos; iv) os pequenos fragmentos poliméricos são fagocitados pelas células ou totalmente degradados em ácido glicólico e láctico (Hillery et al., 2001).
hidrofilicidade dos sistemas (Hillery et al., 2001). Copolímeros ricos em PLA são mais estáveis contra a hidrólise do que polímeros ricos em PGA devido a presença do grupo metila (CH3) presente no PLA (Figura 2), o que confere uma alta hidrofobicidade,
provocando um atraso na entrada da água no sistema (Commandeur et al., 2006).
As características do sistema determinarão qual o tipo de biodegradação que ocorrerá, a qual está intimamente relacionada com as proporções de PLA e PGA usadas. De acordo com as propriedades destes polímeros, uma maior proporção de PLA resultará em um copolímero mais compacto, dificultando a entrada de água, promovendo a erosão do sistema da sua superfície para o interior. Por outro lado, se for utilizada uma maior quantidade de PGA e, conseqüentemente, formando um sistema amorfo, a água penetrará facilmente por toda a estrutura, rompendo com as ligações éster e culminando na sua destruição de dentro para fora (Hillery et al., 2001; Saltzman, 2001). Na Figura 3 estão esquematicamente representados os dois processos de biodegradação: (a) toda a área da matriz polimérica está sujeita às reações de hidrólise e o sistema sofre erosão das porções mais internas para as mais externas; (b) a biodegradação do polímero pode estar limitada à superfície do sistema exposta ao meio e tem início das camadas mais superficiais para as mais internas (Hillery et al., 2001).
Figura 3: Degradação dos copolímeros. (a) a erosão inicia no centro da matriz polimérica e toda ela é destruída; (b) a erosão tem início nas partes mais superficiais da matriz e as camadas sofrem degradação de fora para dentro. Adaptado de Hillery et al., 2001.
2.3. Preparação de micro e nanopartículas poliméricas biodegradáveis
Os sistemas poliméricos podem ser formados por reações de polimerização a partir de macromoléculas (oligômeros) ou na precipitação de polímeros pré-formados, como no caso do PLA e do PGA, originando nanopartículas ou micropartículas. O tamanho das nanopartículas varia de10 a 1000nm e o das micropartículas de 1 ate 250µm. As técnicas de evaporação do solvente são os métodos mais freqüentemente utilizados para preparar estas partículas (Mundargi et al., 2008). Aqui será dada ênfase aos métodos de preparação utilizando os polímeros pré-formados. Os métodos de polimerização podem ser classificados em emulsão e polimerização interfacial, e há dois tipos, orgânica e aquosa, e são dependentes da fase contínua.
2.3.1. Método da emulsificação e evaporação do solvente
e alta energia de homogeneização, em um meio de suspensão, tal como o clorofórmio ou acetato de etila. O polímero precipita na forma de nanoesferas nas quais o fármaco fica finamente espalhado na matriz polimérica. O solvente é subseqüentemente evaporado pelo aumento da temperatura sob pressão ou por agitação contínua. O tamanho das partículas formadas pode ser controlado ajustando o grau de agitação, o tipo e quantidade de agente dispersante, a temperatura e a viscosidade das fases orgânica e aquosa (Soppimath et al., 2001; Reis et al., 2006).
2.3.2. Remoção do solvente e deposição interfacial
A remoção do solvente e a deposição interfacial são métodos similares, que têm como princípio a emulsificação espontânea da fase orgânica contendo o polímero dissolvido em uma fase aquosa. O método da remoção do solvente forma nanoesferas ou nanocápsulas, enquanto a deposição interfacial forma apenas nanocápsulas (Reis et al., 2006).
Na técnica da remoção do solvente, o polímero pré-formado é dissolvido em um solvente, de polaridade intermediária miscível em água, que ocasiona a sua precipitação como nanoesferas. Esta fase é incorporada sob agitação em uma solução aquosa contendo um estabilizante como surfactante. A deposição do polímero na interface entre a água e o solvente orgânico, causada pela rápida difusão do solvente, leva à formação instantânea de uma suspensão coloidal contendo as nanopartículas. Para preparar nanocápsulas, pode ser adicionado um pequeno volume de óleo não tóxico na fase orgânica (Reis et al., 2006).
sob agitação, resultando na deposição dos polímeros na forma de nanopartículas de cerca de 230nm de tamanho. A deposição do polímero ocorre na interface entre a água e nanogotículas de benzol formando nanocápsulas, com uma parede polimérica em forma de cápsula (Soppimath et al., 2001; Reis et al., 2006).
2.3.3. Dupla emulsificação
Na primeira etapa ocorre a emulsificação da solução do polímero na fase aquosa, que contém o fármaco, a partir da dissolução dos copolímeros em um solvente orgânico (diclorometano, clorofórmio ou acetato etílico). Esta mistura é novamente emulsificada em uma solução aquosa para fazer uma emulsão de óleo em água. Nesta segunda etapa, o solvente é evaporado da solução promovendo a precipitação do polímero em nanopartículas com o fármaco espalhado pela matriz polimérica formada. O solvente orgânico é evaporado tanto pelo aumento da temperatura sob pressão ou através de agitação contínua (Hillery et al., 2001; Saltzman, 2001; Soppimath et al., 2001; Reis et al., 2006).
2.4. Nanopartículas de PLGA
Figura 4: Esquema representativo de uma nanocápsula (a) e de uma nanoesfera (b). (Amaral AC e Felipe MSS, 2008)
As nanocápsulas são sistemas vesiculares nos quais o fármaco está confinado em uma cavidade que consiste de um núcleo líquido circundado por uma membrana polimérica, podendo carrear moléculas sensíveis a ação do meio fisiológico. As nanoesferas possuem uma estrutura do tipo matriz onde o fármaco pode estar adsorvido na superfície da esfera ou incrustado na matriz polimérica (Couvreur et al., 2002; Reis et al., 2006).
3. Peptídeos antifúngicos e imunomoduladores
O problema do surgimento de mecanismos de resistência em microrganismos patogênicos aos medicamentos convencionais foi significativamente agravado na última década, demonstrando uma necessidade urgente para a busca de novos e eficientes medicamentos. Uma classe potencial de substâncias para serem usadas com esta finalidade são os peptídeos, antifúngicos ou imunomoduladores, que podem apresentar tanto uma atividade antimicrobiana quanto imunoprotetora (Hilpert et al., 2007).
mecanismo de ação destas moléculas na natureza seja diferente daquele que ocorre com o uso de antifúngicos não-naturais. Os insetos, por exemplo, raramente são afetados pelos mecanismos de resistência desenvolvidos pelos microrganismos contra seu potente sistema de defesa antimicrobiano (Haine et al., 2008).
Os peptídeos antimicrobianos apresentam seqüências e estruturas variadas. São geralmente anfipáticos, formados por cerca de 50 resíduos de aminoácidos, e pelo menos dois resíduos são de cargas positivas, tais como arginina e lisina (Mookherjee & Hancock, 2007). Eles podem ser classificados com base na presença de certos resíduos de aminoácidos como Pro, Trp, Arg e His (tais como as profeninas, indolicidinas e histatinas); pela estrutura predominantemente -folha e presença de pontes dissulfídicas intramoleculares que levam à formação de um anel heptapeptídico na região C-terminal (tais como as defensinas e protegrinas); e pela presença de peptídeos de estrutura α-hélice em região anfifílica (tais como as magaininas e cecropinas) (Mangoni et al., 2000; Kamysz et al., 2003).
Muitos dos peptídeos antifúngicos conhecidos foram identificados em diversos seres vivos, inclusive em fungos. São exemplos a aureobasidina e a micafungina, ambos com alta atividade antimicrobiana (de Lucca & Walsh, 2000; Barrett, 2002). Alguns deles podem apresentar tanto atividade antifúngica para ser usado no tratamento como é o caso do “Killer Peptide” (Polonelli et al., 2003; Travassos et al., 2004) quanto para uso como imunomodulador como é o caso do P10 (Taborda et al., 1998). Eles atuam, portanto, ou matando diretamente o patógeno, provocando a formação de poros na membrana e atacando alvos intracelulares ou pela modulação positiva do sistema imunológico do hospedeiro para inviabilizar a ação do patógeno (Hancock & Sahl, 2006).
Diversas são as técnicas empregadas para a identificação destes peptídeos. Muitos grupos de pesquisa desenham seqüências peptídicas com o propósito de mimetizar segmentos transmembrânicos de proteínas integrais de membranas plasmáticas, modificando alguns resíduos com o intuito de facilitar a sua solubilização em meio aquoso para sua aplicação e para aumentar a sua atividade antimicrobiana (Burrows et al., 2006). A predição de seqüências peptídicas em bancos de dados genômicos e a identificação de seqüências dentro de proteínas são técnicas empregadas com sucesso, as quais serão abordadas a seguir.
3.1. Predição e identificação de peptídeos antimicrobianos in silico
Os bancos de dados genômicos são uma fonte valiosa para identificar seqüências gênicas envolvidas na biosíntese de antibióticos (Bruijn et al., 2007). As análises in silico de seqüências de proteínas ou diretamente em bancos de dados genômicos, podem ser interessantes fontes para se fazer predições sobre peptídeos de interesse terapêutico (Lata et al., 2007).
cargas positivas), a busca destas similaridades in silico nestes bancos de dados é uma ferramenta capaz de abreviar a identificação e seleção de novos antibióticos (Doytchinova et al., 2004; Lata et al., 2007).
Com base nas seqüências de resíduos de aminoácidos obtidas por estas análises, é possível fazer modificações nas suas estruturas primárias para potencializar a sua atividade antimicrobiana. A substituição de resíduos de aminoácidos ou sua mudança de posição pode melhorar a sua ligação com a membrana ou alvos intracelulares do microrganismo (Lata et al., 2007). Para validar estas informações, as seqüências selecionadas são sintetizadas por síntese química e são realizados testes in vitro contra uma variedade de microrganismos para investigar o seu efeito antimicrobiano (Bruijn et al., 2007; Hilpert et al., 2007).
3.2. Peptídeos imunomoduladores - P10
Na categoria de peptídeos imunomoduladores está inserido o peptídeo P10 que é composto por 15 resíduos de aminoácidos e foi identificado na seqüência da glicoproteína gp43 do fungo Paracoccidioides brasiliensis, agente causador da Paracoccidioidomicose – PCM (Taborda et al., 1998). Esta glicoproteína é um componente exocelular secretado pelas células deste fungo quando na fase de levedura e é o principal antígeno para detectar esta micose (Puccia et al., 1986). Ela contém trechos específicos, os epítopos, que são reconhecidos pelos linfócitos T, que desencadeiam a produção de anticorpos para destruir o fungo (Taborda et al., 2004; Iwai et al., 2007).
gp43 completa, a qual induz uma resposta de produção de anticorpos do padrão Th2, o que não é eficiente contra o fungo e é acompanhada por uma imunossupressão e anergia em pacientes acometidos pela PCM (Taborda et al., 1998; Iwai et al., 2007). As características do padrão de resposta imunológica na PCM será melhor detalhada a seguir.
A resposta protetora em modelo experimental murino também foi observada com a utilização de peptídeos sintéticos preparados com base na seqüência do P10, denominado de M10 (Taborda et al., 2004). O M10 é uma construção sintética que agrega várias seqüências do P10 ligadas a uma molécula iniciadora, formando uma estrutura ramificada. Os resultados obtidos em relação a proliferação dos linfoblastos, que é um indicador da capacidade do hospedeiro responder ao estímulo, foram iguais quando se utilizou 1µg/50µL de M10 ou 20µg/50µL do P10, indicando que o M10 apresenta uma atividade 20 vezes superior ao P10 devido provavelmente à maior estabilidade da molécula M10. Isto evidencia fortemente a necessidade de se buscar novas alternativas de formulações para estes peptídeos buscando melhorar a sua estabilidade. Entretanto, embora a sua atividade imunoestimulatória tenha sido melhorada, a síntese do M10 é extremamente difícil de ser obtida (Taborda et al., 2004).
A utilização deste peptídeo para melhorar a terapia em sinergia com as drogas utilizadas no tratamento do modelo experimental murino da PCM, sugere a sua importância para melhorar a resposta ao tratamento e reduzir a duração da terapia (Marques et al., 2008). Entretanto, resta ainda a questão da instabilidade fisiológica destes peptídeos, pois eles são facilmente degradados pelas peptidases dificultando a sua utilização terapêutica. Deste modo, torna-se relevante desenvolver novas formulações para este peptídeo de modo a aumentar a sua estabilidade para aplicações in vivo.
4. Infecções Fúngicas
consideradas como a causa principal da morte destes pacientes (Wills et al., 2000; Carrillo-Muñoz et al., 2006; Cutler et al., 2007). Existem cerca de 50 mil espécies catalogadas de fungos e quase 300 delas são patogênicas e causam doenças em humanos, incluindo-se nestas cerca de uma dúzia como responsáveis por 90% de todas as infecções (Myc et al., 2001; Cesaro et al., 2007).
As micoses sistêmicas, caracterizadas pelo envolvimento de múltiplos órgãos, são as que contribuem de modo mais relevante para o aumento dos números de mortes em decorrência destas doenças (Chakrabarti, 2005). Os principais fungos causadores das micoses sistêmicas são Candida sp., Cryptococcus neoformans,Histoplasma capsulatum e Aspergillus sp. (Holzheimer e Dralle, 2002; Chen et al., 2007). Na América Latina, a Paracoccidioidomicose (PCM) é considerada como uma relevante micose sistêmica (Brummer et al., 1993, Coutinho et al., 2002).
As atuais linhas de tratamento disponíveis para estas micoses apresentam limitações devido ao desenvolvimento de mecanismos de resistência e baixa efetividade causados pelas drogas fungistáticas, como os azóis (itraconazol, fluconazol, cetoconazol), ou pelos sérios efeitos colaterais causados por drogas mais potentes como os polienos (anfotericina B) (Carrillo-Muñoz et al., 2006).
4.1. Tratamento das infecções fúngicas
Dos fármacos disponíveis para os tratamentos atualmente, os mais utilizados são os azóis (itraconazol, fluconazol e cetoconazol) e os polienos (anfotericina B) (Carrillo-Muñoz et al., 2006). O desenvolvimento de novos azóis chama atenção em particular devido ao seu amplo espectro de ação e à baixa toxicidade aos pacientes (Park et al., 2007), porém são relatados episódios de resistência a eles (Cesaro et al., 2007).
a) alterações da estrutura da enzima-alvo (14α-desmetilase), tornando o tratamento ineficaz; b) maior produção da enzima-alvo pelo fungo, tornando necessário o emprego de maior quantidade da droga; c) desenvolvimento de mecanismos de bombas de efluxo através do qual a droga é expulsa do meio intracelular; d) impermeabilização da membrana fúngica à droga; e) secreção de enzimas capazes de degradar a droga no meio extracelular (Ghannoum & Rice, 1999; Smith & Edlind, 2002).
Os polienos, embora não apresentem relatos de resistência, causam sérios efeitos colaterais no paciente. O seu mecanismo de ação ocorre pela interação direta com o ergosterol da membrana. Nesta classe de antifúngicos, merece destaque a anfotericina B, que é o fármaco de escolha para os casos mais graves das infecções fúngicas (Wills et al., 2000; Carrillo-Muñoz et al., 2006). A anfotericina B se liga a esse composto através de ligações hidrofóbicas formando poros aquosos (ou canais iônicos). Esses poros desencadeiam a liberação de componentes essenciais para a célula, acarretando a sua morte (Ghannoum & Rice, 1999).
4.1.1. Anfotericina B
A anfotericina B é um fármaco pertencente à classe dos antibióticos poliênicos e é produzida por culturas fermentativas de Strepetomyces nodosus. As propriedades fungicidas desta molécula foram identificadas em 1956 (Gold et al., 1956) e desde então,esta tem sido a droga de escolha para o tratamento da maioria das micoses sistêmicas (Lemke et al., 2005; Ruijgrok et al., 2006). Algumas características apresentadas por esta molécula tais como, amplo espectro antifúngico, potente atividade fungicida e raros episódios de resistência, contribuem para o sucesso clínico desta droga (Baginski et al., 2005).
colesterol é o tipo de esterol mais abundante, enquanto em fungos, amebas e alguns protozoários é o ergosterol (Ghannoum & Rice, 1999; Baginski et al., 2005). A estrutura química da anfotericina B favorece uma ligação preferencial pelo ergosterol em relação ao colesterol (Hsuchen & Feingold, 1973; Kotler-Brajtburg et al., 1974; Yilma et al., 2006), o que possibilita o seu uso em humanos, embora ainda apresenta problemas de efeitos colaterais indesejáveis. Ensaios de modelagem molecular demonstraram in silico, o surgimento de canais formados pela interação por pontes de hidrogênio de oito moléculas de anfotericina B com oito moléculas de ergosterol, através de seus grupos amino e carboxílicos (Baginski et al., 1997, Baginski et al., 2005; Lemke et al., 2005).
Figura 5: Estrutura química do fármaco anfotericina B. Adaptado de Carrillo-Muñoz et al., 2006.
filtragem glomerular. Devido ao grande número de membranas plasmáticas presentes nos túbulos renais, há um acúmulo de esteróis nos rins. Deste modo, ocorre uma forte interação da anfotericina B com essas membranas gerando a toxicidade (Atkinson & Bennett, 1978; Baley et al., 1990; Fukui et al., 2003). Como resultado deste distúrbio da função renal pode ocorrer o acúmulo de potássio no sangue (hipercalemia) que por sua vez, pode induzir quadros graves de arritmia cardíaca (Groot et al., 2008). Os níveis séricos elevados da droga contribuem para aumentar esses efeitos toxicológicos, pois quanto maior a quantidade de droga livre circulante, mais danos causará aos rins.
4.1.2. Preparações nanoestruturadas para a anfotericina B
Estratégias usando sistemas nanoestruturados são aplicadas visando reduzir os efeitos colaterais indesejáveis causados pelo tratamento com a anfotericina B. A formulação convencional e mais utilizada, por ser menos custosa, é a solubilizada com desoxicolato de sódio, que forma um sistema de micelas. A utilização de carreadores de natureza lipídica para este fármaco são as que apresentam os melhores resultados em termos de redução da toxicidade sem afetar o seu efeito terapêutico (Ng et al., 2003; Kleinberg, 2006).
Atualmente, três formulações lipídicas para a anfotericina B estão disponíveis para o uso clínico: Abelcet®, Ambisome® e Amphotec® (Tabela 2) (Kleinberg, 2006). Estas formulações são utilizadas como terapia de primeira linha em pacientes afetados pelas micoses sistêmicas cujas funções renais estejam comprometidas. Nestes pacientes, foi observada uma considerável redução dos efeitos nefrotóxicos (Bowden et al., 2002; Walsh et al., 2004; Alexander e Wingard, 2006).
elevados, inviabilizando totalmente o seu uso em pacientes que dependem dos sistemas de saúde pública em vários países.
Tabela 2. Formulações nanoestruturadas para a anfotericina B.
Produto Fabricante Tamanho Composição
Abelcet® Sequus Pharmaceuticals 1.6 – 11.1µm AMB Complexo Lipídico Ambisome® NeXstar Pharmaceuticals 45-80nm AMB Liposomal
Amphotec® The Liposome Company 115nm AMB Complexada Dispersão Coloidal
Os custos aproximados para o tratamento com as formulações lipídicas para a anfotericina B e a droga convencional Fungizon® estão apresentados na Tabela 3.
Observa-se que os valores para o tratamento com Fungizon® é muito menor do que aqueles para as drogas nanoestruturadas. Porém, é necessário considerar que a utilização desta droga convencional requer a internação do paciente para que sejam monitorados os efeitos colaterais causados por ela, o que encarece tremendamente o seu uso. Deste modo, as formulações nanoestruturadas apresentam além das vantagens de diminuir os efeitos colaterais, a diminuição dos gastos de tratamento pela redução do tempo de internação do paciente (Kleinberg, 2006).
Tabela 3: Custo aproximado (em US$) das principais drogas utilizadas no tratamento das infecções fúngicas invasivas. Valores referentes ao ano de 2006.
Droga Custo Médio do Produto Doses típicas Custo diário estimado para um paciente de
Por se tratarem de formulações nanoestruturadas desenvolvidas por laboratórios de P&D do exterior, amparadas pelas suas respectivas patentes, torna-se de alta relevância o desenvolvimento de formulações alternativas no País, com foco na obtenção de produtos de interesse por empresas de fármacos e medicamentos.
4.2. Modelo experimental da Paracoccidioidomicose (PCM)
A PCM é uma micose endêmica da América Latina ocorrendo predominantemente nas áreas rurais do Brasil, Venezuela e Colômbia, sendo o Brasil o país que apresenta a maior área endêmica no mundo, com 80% dos casos relatados (Brummer et al., 1993; Coutinho et al., 2002). Estima-se que cerca de 10 milhões de pessoas estejam infectadas pelo fungo Paracoccidioides brasiliensis, agente etiológico causador da PCM; destas cerca de 2% desenvolvem a doença. A taxa de mortalidade média anual no Brasil por PCM, no período de 1980-1995, foi de 1.45 mortes/milhão de habitantes (Coutinho et al., 2002), confirmando essa doença como um importante agravo de saúde no País. Esse número pode não corresponder ao total de casos, uma vez que a PCM não faz parte das patologias de notificação compulsória para o Ministério da Saúde. Além disto, quando não ocorre o óbito e o paciente consegue recuperar-se em tratamento, a conseqüência grave é a seqüela gerada pela fibrose pulmonar, resultante dos processos granulomatosos no pulmão característico desta doença, o que leva o indivíduo a ter uma atividade no trabalho extremamente limitada (Cock et al., 2000).
A infecção pode ocorrer pelo contato do fungo com ferimentos da pele, ou principalmente pela inalação de conídios, pequenas estruturas germinativas geradas na fase de micélio (Restrepo, 1985; McEwen et al., 1987). Em experimentos com animais infectados pela via respiratória, estes pequenos propágulos alcançam porções distais dos pulmões e, ao penetrarem o parênquima dos alvéolos pulmonares, ocorre a transição para a levedura, instalando a doença (Brummer et al., 1993; Cock et al., 2000).
4.2.1. Formas clínicas da Paracoccidioidomicose
As formas clínicas da PCM são classificadas em PCM-infecção e PCM-doença (Shikanai-Yasuda et al., 2006). Na PCM-infecção os indivíduos são infectados, mas não desenvolvem a doença, apresentando reação intradérmica específica positiva. Em muitos casos a confirmação se dá pela presença de células de P. brasiliensis dentro de lesões residuais (granulomas de pulmão) parcialmente calcificadas. A PCM-doença pode ocorrer nas formas juvenil ou crônica (Montenegro, 1986; Brummer et al., 1993; Marques, 2008). A forma juvenil (aguda ou subaguda) é a mais grave e atinge crianças e jovens. Caracteriza-se pelo rápido progresso da doença e pelo envolvimento do sistema reticuloendotelial (fígado, linfonodos, medula óssea e baço). Na forma juvenil, o pulmão é raramente afetado. Em biópsias dos tecidos envolvidos é comum a presença de muitas células de P. brasiliensis em multiplicação e a presença de granulomas é rara. Na forma adulta (crônica), a doença progride lentamente e pode levar meses ou anos para se estabelecer totalmente. As manifestações pulmonares são evidentes em 90% dos adultos doentes e, em 25% deles, os pulmões são os únicos órgãos afetados (unifocal). Em alguns casos, a lentidão para a manifestação da doença pode levar o paciente a procurar ajuda médica somente quando outros órgãos já estão comprometidos (multifocal) (Montenegro, 1986; Brummer et al., 1993).
relataram a formação do granuloma somente naqueles animais infectados com células viáveis. Quando os granulomas são compactos, ou seja, logo no início da sua formação, eles são capazes de impedir a multiplicação das células fúngicas. Porém, na medida em que eles vão se desintegrando, as células voltam a se multiplicar e ocorre a recidiva da doença (Brummer et al., 1993; Cock et al., 2000).
4.2.2. Resposta imunológica durante a Paracoccidioidomicose
A severidade da PCM está relacionada com o envolvimento do sistema imunológico do hospedeiro, que pode evoluir para a cura o para o agravamento do quadro da doença (de Camargo e de Franco, 2000; Calich et al., 2008). A supressão da resposta imunológica mediada pela produção de citocinas do tipo Th2 (interleucinas IL-4 e IL-10) é associada com a forma severa da PCM em humanos e em animais de experimentação (Oliveira et al., 2002).
Durante a invasão do P. brasiliensis nos tecidos, ocorre uma interação entre seus antígenos e o sistema imune do hospedeiro, o qual desencadeia uma resposta imunológica do tipo Th1 ou Th2. Normalmente, a maioria dos pacientes que apresentam a forma severa da PCM tende a apresentar uma resposta polarizada do tipo Th2, com produção das interleucinas IL-4, IL-5 e IL-10 (de Camargo e de Franco, 2000; Oliveira et al., 2002). Por outro lado, indivíduos que apresentam uma resposta polarizada do tipo Th1, com a produção de altos títulos de IFN- , a mais importante citocina protetora, tendem a curar a infecção por P. brasiliensis (Oliveira et al., 2002; Calich et al., 2008). A propensão para a persistência do fungo em tecidos infectados parece ser conseqüência da desregulação da imunidade celular com uma supressão da resposta Th1 e super expressão da resposta Th2.
grande quantidade de granulomas, o que pode estar relacionado também com a proteção do hospedeiro (de Camargo e de Franco, 2000).
O granuloma é uma importante estrutura capaz de conter a disseminação do fungo e está intimamente relacionado com a resposta imune do hospedeiro. Na histopatologia do granuloma são encontrados agregados nodulares de macrófagos circundados por linfócitos T e, freqüentemente, acompanhados por células epitelióides multinucleadas, que são macrófagos diferenciados pela influência das citocinas IL-2 e IFN- (de Camargo e de Franco, 2000; Arruda et al., 2004). Quando o hospedeiro apresenta uma resposta imune celular eficiente, os granulomas são compactos com poucos fungos. Do contrário, quando ocorre uma infecção disseminada, nota-se uma inflamação granulomatosa frouxa, exsudativa, com numerosos fungos (Borges-Walmsley et al., 2002).
4.2.3. Terapêutica para Paracoccidioidomicose
De acordo com o Consenso em Paracoccidioidomicose de 2006, o manejo terapêutico da PCM deve envolver exames para investigar o grau de acometimento do paciente pela doença e ser monitorado freqüentemente para avaliar a eficácia do tratamento (Shikanai-Yasuda et al., 2006). A escolha da droga a ser usada na PCM é feita de acordo com o estado do paciente e requer, além de um longo período de tratamento, o monitoramento para avaliar a eficácia e a tolerância ao antifúngico (Hahn et al., 2003). Os fármacos usados na terapêutica para a PCM são os das seguintes classes: Polienos (anfotericina B), Imidazólicos (itraconazol, fluconazol, ketoconazol) e Sulfas (sulfadiazina). Destes, os mais utilizados são o itraconazol e a anfotericina B (Brummer et al., 1993; Shikanai-Yasuda et al., 2006).
drogas menos tóxicas e mais fáceis de serem administradas, por exemplo, a combinação de sulfametoxazol/trimetropim (Yasuda, 2005; Shikanai-Yasuda et al., 2006).
Os cuidados envolvidos com o indivíduo portador da PCM não ficam restritos apenas aos agentes antifúngicos. Desde o momento do diagnóstico até a cura da doença, o paciente necessita de diversos cuidados médicos. Com o intuito de acompanhar a evolução do tratamento, são necessárias avaliações médicas em que são realizados exames laboratoriais e de imagem, tais como: raio X de tórax, ultrassonografia abdominal, hemograma completo, velocidade de hemossedimentação, provas bioquímicas hepáticas, eletroforese de proteínas, avaliação renal e metabólica. Após o diagnóstico de cura e interrupção do tratamento, o paciente deve retornar para consulta e acompanhamento ambulatorial uma vez ao ano, com exame clínico e sorológico, se necessário (Shikanai-Yasuda et al., 2006).
II. JUSTIFICATIVA
O desenvolvimento de novas terapias contra as micoses é uma necessidade para a saúde mundial, principalmente pelo crescente número de casos de resistência às drogas atuais e/ ou pelos graves efeitos colaterais dos fármacos disponíveis. Para reverter esta situação algumas estratégias estão sendo empregadas com sucesso. A conjugação dos medicamentos convencionais em nanoestruturas representa uma alternativa eficiente e segura, pois visa diminuir as suas concentrações e o número de aplicações no paciente, diminuindo por conseqüência os efeitos colaterais, sem afetar a eficiência do tratamento (Fukui et al., 2003; Kleinberg, 2006). A seleção de moléculas que apresentem atividade antifúngica é uma alternativa para o surgimento de novo tratamento, sendo os compostos de origem peptídica promissores, pois possuem naturalmente características antimicrobianas (Wills et al., 2000; Bowman, 2003).
escolhida para ser utilizada como modelo neste trabalho, visando o desenvolvimento de terapias antifúngicas alternativas. Além disto, o referido grupo desenvolveu recentemente o projeto do transcriptoma do agente etiológico da PCM, o Paracoccidioides brasiliensis (Felipe et al., 2003; Felipe et al., 2005), o que contribuiu fortemente para estudos de desenvolvimento de novas drogas e novos alvos terapêuticos (Amaral et al., 2005). Esta tese tem, portanto, como foco o desenvolvimento de novas estratégias terapêuticas para combater as infecções fúngicas.
III. OBJETIVOS Objetivo geral
Desenvolver novas alternativas para o tratamento das doenças fúngicas, utilizando a estratégia de nanoestruturação de fármacos convencionais e de peptídeos em sistemas poliméricos biodegradáveis; e realizar a identificação de novos peptídeos com propriedades antifúngicas potenciais, baseado nas seqüências protéicas depositadas nos bancos de dados dos projetos genoma/transcriptoma do P. brasiliensis e do genoma humano.
Objetivos específicos Parte I
Anfotericina B - PLGA-DMSA
a. Formular e preparar um sistema de liberação sustentada para a anfotericina B, em blenda polimérica dos ácidos láctico e glicólico (PLGA) funcionalizada com o ácido dimercaptossuccinico (DMSA);
b. Comparar a atividade terapêutica da formulação acima citada com o medicamento convencional Fungizon® no tratamento da PCM em modelo experimental murino; c. Investigar os efeitos colaterais toxicológicos resultantes da utilização no tratamento
Parte II
Peptídeos antimicrobianos e peptídeo imunomodulador P10
a. Identificar, selecionar e sintetizar peptídeos identificados em seqüências de proteínas expressas pelo patógeno P. brasiliensis isolado Pb01 (transcriptoma) e codificadas no genoma humano;
b. Investigar a atividade antifúngica in vitro dos peptídeos selecionados;
c. Formular e preparar sistemas de liberação sustentada com diferentes concentrações do peptídeo P10, em blenda polimérica de PLGA funcionalizada com o DMSA; d. Avaliar a eficácia da terapia do peptídeo P10 nanoestruturado combinado com a
droga sulfametoxazol/trimetropim no tratamento da PCM experimental murino;
e. Quantificar a produção de citocinas in situ (pulmão) dos animais infectados e submetidos à terapia combinada descrita acima.
IV. METODOLOGIA
Este tópico será subdividido em Parte I e Parte II. As metodologias comuns às duas partes (experimentos in vivo e preparação das nanopartículas) serão apresentadas em um único sub-tópico. O experimento denominado “Anfotericina B - PLGA-DMSA”foi realizado na Universidade de Brasília (UnB) e o denominado “Peptídeo P10 - PLGA-DMSA” foi realizado na Universidade de São Paulo (USP).
Experimentos in vivo 1. Infecção experimental 1.1. Animais
Anfotericina B - PLGA-DMSA
Peptídeo P10 - PLGA-DMSA
Foram utilizados camundongos machos da linhagem BALB/c, com média de idade entre 6 e 8 semanas. Os animais foram adquiridos do biotério de camundongos isogênicos do Departamento de Imunologia do Instituto de Ciências Biomédicas da Universidade de São Paulo - USP e mantidos no alojamento de animais de experimentação do Instituto de Ciências Biomédicas II.
Para os dois experimentos, os animais foram acomodados em gaiolas de polipropileno sob condições controladas de luminosidade com livre acesso a água e a comida. As técnicas utilizadas para infecção, manuseio durante os tratamentos e sacrifício dos animais foram seguidas de acordo com as normas éticas de manuseio de animais e aprovadas pelos Comitês de Ética da UnB e da USP.
1.2. Preparação do inóculo
Foi utilizado o isolado virulento Pb18 do fungo P. brasiliensis para ambas as infecções experimentais. A virulência do fungo é garantida pela manutenção mensal no laboratório de animais infectados com este isolado.
Anfotericina B - PLGA-DMSA
O isolado Pb18 foi cultivado em meio de cultura YPD (yeast 10g, dextrose 20g, peptona bacteriológica 20g, água destilada 1L) líquido a 36 ºC sob agitação (220rpm). A viabilidade celular foi determinada pelo corante verde-Janus 0.05% (Merck, Alemanha). Peptídeo P10 - PLGA-DMSA
O isolado Pb18 foi cultivado em meio de cultura líquido Mc Veigh & Morton (McVM) quimicamente definido, a 35 ºC sob agitação de 220 rpm (Restrepo & Arango, 1980). A viabilidade celular, entre 90 e 95%, foi determinada pelo uso do corante azul de Evans (Sigma, EUA).
centrifugado a 1000rpm durante 3 minutos. O fungo foi coletado e lavado duas vezes em solução salino-tamponada com fosfato (PBS; pH 7.4; NaCl 8g, KCl 0.2g, KH2PO4 0.122g,
Na2HPO4.7H2O 1.716g, água destilada 1L) estéril. Depois da última lavagem, o sedimento
foi ressuspendido em volume de 3mL de PBS e as células foram contadas com auxílio de câmara de Neubauer.
1.3. Infecção endovenosa Anfotericina B - PLGA-DMSA
Foi preparada uma suspensão de 3×107 células viáveis/mL do isolado Pb18 em PBS estéril (pH 7.4). Os animais foram previamente anestesiados com solução de éter e inoculados com 100µL (3×106 células) da suspensão de leveduras pela via endovenosa do
plexo venoso retro-orbital.
1.4. Infecção intratraqueal Peptídeo P10 - PLGA-DMSA
Foi preparada uma suspensão de 6×106 células viáveis/mL do isolado Pb18 em PBS estéril (pH 7.4). Os animais foram previamente anestesiados por via intraperitoneal com 200µL de solução contendo 80mg/kg de ketamina (União Química, Brasil) e 10mg/kg de xilazina (União Química, Brasil). Depois de dez minutos, quando os animais estavam insensíveis a dor, seus pescoços foram hiperextendidos e uma pequena incisão na pele do pescoço foi realizada para a exposição da traquéia e, com o auxílio de uma seringa de 1mL, 50µL da suspensão de leveduras (3×105 células) foram injetados. Esta quantidade 10 vezes menor do que a usada na UnB foi devido ao local da infecção, onde o fungo é injetado diretamente nos pulmões. As incisões foram imediatamente suturadas e os animais foram mantidos aquecidos até passar o efeito da anestesia.
Anfotericina B - PLGA-DMSA
Os camundongos infectados (n= 10 por grupo de tratamento) foram separados em grupos experimentais que receberam os seguintes tratamentos pela via intraperitoneal: (i) 100µL diários de PBS, (ii) 40µg/100µL diários de Fungizon®, (iii) 120µg/100µL a cada 3 dias de anfotericina B em blenda polimérica de PLGA-DMSA. O grupo controle composto de animais sadios, não infectados, recebeu 100µL diários de PBS. O experimento foi conduzido seguindo o desenho experimental da Figura 6.
O tratamento de todos os grupos foi iniciado 30 dias após os animais terem sido inoculados com o fungo Pb18 e duraram 30 e 60 dias. Nos dias 60 e 90 após o inóculo, metade do número de animais de cada grupo foi sacrificada em cada um destes pontos e foram realizadas análises para avaliar a evolução do tratamento.
Figura 6: Cronograma de tratamento para os camundongos infectados com P. brasiliensis por via endovenosa. Nano= anfotericina B em blenda polimérica de PLGA-DMSA; AmB= anfotericina B desoxicolato de sódio, Fungizon®.
Peptídeo P10 - PLGA-DMSA
sulfametoxazol/trimetropim; (iii) infectado e tratado com sulfametoxazol/trimetropim e blenda de PLGA vazia; (iv) infectado e tratado com 20µg/50µL de P10 livre em adjuvante de Freund; (v) infectado e tratado com 1µg/50µL de P10 em blenda de PLGA; (vi) infectado e tratado com 5µg/50µL de P10 em blenda de PLGA; (vii) infectado e tratado com 10µg/50µL de P10 em blenda de PLGA; (viii) infectado e tratado com 20µg/50µL de P10 em blenda de PLGA; (ix) infectado e tratado com 40µg/50µL de P10 em blenda de PLGA. Os grupos de (iii) a (ix) receberam a terapia combinada com o sulfametoxazol/trimetropim.
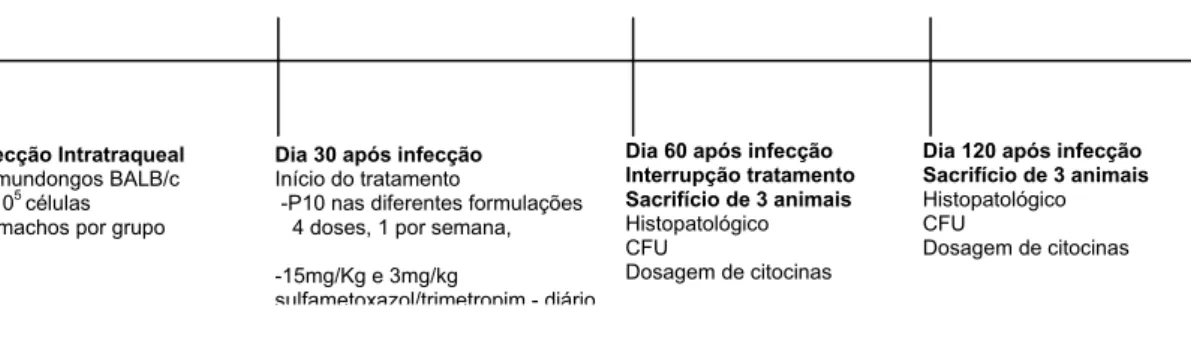
O regime de tratamento foi iniciado 30 dias depois da infecção e seguiu durante 30 dias, conforme esquematizado na Figura 7. Os animais dos grupos (ii) ao (ix) receberam injeções diárias de sulfametoxazol/trimetropim, 15mg/kg e 3mg/kg, respectivamente. Os animais dos grupos (iv) ao (ix) receberam o peptídeo conforme descrito acima, administrado quatro vezes, uma dose por semana; na primeira semana o peptídeo foi injetado no coxim plantar e as e ultimas doses foram administradas intraperitonealmente.
Figura 7: Esquema de tratamento para os camundongos infectados com P. brasiliensis por via intratraqueal. Os animais foram submetidos a terapia combinada do sulfametoxazol/trimetropim com o peptídeo P10 em diferentes formulações.
2.2. Agentes antifúngicos
2.2.1. Anfotericina B desoxicolato de sódio
As doses da droga anfotericina B desoxicolato de sódio, produto comercial Fungizon®, contendo 45% de anfotericina B pura (Bristol-Meyers Squibb, EUA) foram
Dia 30 após infecção Início do tratamento
-P10 nas diferentes formulações 4 doses, 1 por semana,
-15mg/Kg e 3mg/kg
sulfametoxazol/trimetropim - diário
Dia 60 após infecção Interrupção tratamento Sacrifício de 3 animais Histopatológico CFU
Dosagem de citocinas
Dia 120 após infecção Sacrifício de 3 animais Histopatológico CFU
Dosagem de citocinas Infecção Intratraqueal
preparadas diariamente no momento da aplicação partindo-se de uma solução estoque de 5mg/mL. Esta solução foi mantida a 4 ºC no escuro e no momento do uso foram preparadas alíquotas contendo 40µg de Fungizon® em 100µL de PBS (pH 7,4).
2.2.2. Anfotericina B - PLGA-DMSA
A formulação da anfotericina B em blenda polimérica do PLGA-DMSA contendo 120µg de anfotericina B desoxicolato de sódio (45% de anfotericina B pura) (Sigma, EUA) em 100µL de nanopartículas, foi preparada pela equipe do professor Dr. Cláudio Tedesco da USP/RP. Para tanto foram utilizados os polímeros pré-formados dos ácidos poliláctico (PLA, 15 a 75%) e poliglicólico (PGA, 15 a 75%) e o ácido dimercaptosuccinico (DMSA, 0.05M), todos comprados da Sigma (EUA).
Os polímeros pré-formados foram primeiro dissolvidos em diclorometano com 50mg de PLA e 50mg de PGA (proporção 50:50). A esta solução orgânica foi adicionado poli-vinil álcool (PVA, 1%) e 120mg de anfotericina B com o aditivo DMSA. O material foi submetido à agitação vigorosa (10000rpm) para obter a emulsificação inicial água-óleo. O solvente orgânico foi removido da solução sob agitação a temperatura ambiente e evaporação sob pressão reduzida. As nanopartículas foram centrifugadas (25 ºC, 5000rpm) em intervalos de 10 minutos e lavadas três vezes em água destilada e ressuspendidas em 1.0mL de PBS estéril e armazenadas a 4 ºC. Imediatamente antes do uso, o frasco contendo a dose a ser injetada nos animais foi agitado vigorosamente, durante dois minutos, em vórtex, para ressuspender as nanopartículas. Todos os procedimentos foram realizados em condições estéreis. O processo de preparação descrito e a sua utilização estão protegidos pelo depósito da patente no Instituto Nacional de Propriedade Intelectual (INPI, Brasil) sob registro PI # 0700446-0.
2.2.3. Peptídeo P10 - PLGA-DMSA
quantidades do peptídeo P10 descritas acima. O processo de preparação descrito e a sua utilização estão protegidos pelo depósito da patente no INPI sob registro (aguardando o número do PI).
2.3. Determinação do tamanho dos sistemas poliméricos 2.3.1. Espectroscopia de correlação fotônica
A análise do tamanho foi realizada, na suspensão total e no sobrenadante de amostras de Nano-D-AMB (Anfotericina B - PLGA-DMSA) por espectroscopia de correlação fotônica em equipamento ZetaSizer NanoSeries (Malvern Instruments, Reino Unido) do laboratório de Tecnologia Farmacêutica da Universidade Federal de Goiânia, GO. O princípio de funcionamento deste equipamento baseia-se na aplicação de um campo elétrico na suspensão, induzindo a movimentação das partículas em direção ao eletrodo de carga oposta. Isto promove a passagem das partículas por um detector de tamanho (Malvern, 2004).
2.3.2. Microscopia óptica
Foram capturadas imagens em microscópio de luz óptico na amostra total e no sobrenadante. Uma gota de cada amostra foi pingada em lâminas e cobertas por lamínulas e imediatamente observadas no microscópio.
3. Acompanhamento da evolução do tratamento