Tópicos Abordados Nesta Aula
Calorimetria
●
Capacidade Calorífica (Térmica)
●Calor específico
●
Transições de fase e o calor latente
●A propagação do calor
1)Condução
2)Radiação
3)Convecção
Calor – A energia em trânsito
Calor – A energia em trânsito
A lei zero da termodinâmica garante que, ao decorrer do tempo, a temperatura do corpo A tende a diminuir, e a temperatura do corpo B tende a aumentar, de modo que ao passar do tempo, ambos os
Calor – A energia em trânsito
Como o sistema está livre de influências externas (sistema isolado), podemos explicar que parte da energia interna contida em A foi
transferida para B. E que esta energia que se transfere do corpo A para o corpo B está relacionada a variação de temperatura entre os corpos.
Calor – A energia em trânsito
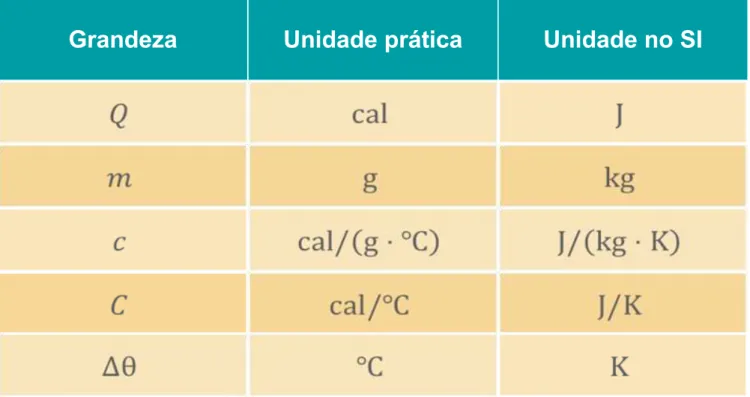
Unidade: A unidade convencional para a quantidade de calor Q é a
caloria (cal), ou seu múltiplo a quilocaloria (kcal).
A unidade usada no S.I. é a mesma utilizada para energia, ou seja,
joule (J).
Grandeza Unidade
prática Unidade no SI
De modo que podemos converter de uma para outra:
1 cal = 4,186 J
Capacidade Térmica (C)
Na discussão anterior dissemos que a quantidade de calor estava diretamente ligada à variação da temperatura
Q
∝Δ
T
Podemos escrever esta igualdade como
Q
=
C
Δ
T
,onde C é uma constante. Esta constante nos diz a intensidade com que cada corpo absorve, ou cede calor. Por isto, chamamos C de
capacidade térmica,
C
=
Q
Δ
T
..
Exemplo
1) Vamos supor que ao receber 2000 calorias (Q = 2000 cal), a
temperatura de um bloco metálico aumentou de 20°C para 420°C, a capacidade térmica deste material será?
C
=
Q
Δ
T
C
=
2000
(
420
−
20
)
C
=
5
cal
/
° C
Capacidade Térmica (C)
Dizemos então, que a capacidade térmica é uma propriedade que todo corpo possui que nos diz a facilidade (ou dificuldade) que o corpo tem em receber ou ceder calor.
Se Ti < Tf → ΔT>0, como
Q
=
C
Δ
T
Q
>
0
então,
,
.
Dizemos que o calor foi recebido.
,
Obs:
Se Ti > Tf → ΔT<0, como
Q
=
C
Δ
T
Q
<
0
então,
Dizemos que o calor foi cedido.
Troca de calor
Já vimos que dois ou mais corpos a temperaturas diferentes ao interagirem tendem a atingir a mesma temperatura. Quando isso ocorre, costuma-se dizer que esses corpos trocam calor.
Como calor é energia, o Princípio de Conservação de Energia
garante que a energia total envolvida nesse processo é constante.
Assim, se o sistema for isolado e houver apenas trocas de calor entre os seus constituintes, a soma algébrica das quantidades de calor cedidas (ΣQc) e recebidas (ΣQr) deve ser nula:
Essa é uma consequência imediata do Princípio da conservação de Energia.
Exemplo
2) Considere X e Y dois corpos homogêneos, constituídos por substâncias distintas, cujas massas correspondem, respectivamente, a 20 g e 10 g.
O gráfico abaixo mostra as variações da temperatura desses corpos em função do calor absorvido por eles durante um processo de aquecimento.
Determine as capacidades térmicas dos corpos X e Y.
R:
Cx = 10 cal/K
Exercícios Propostos
1) Qual é a capacidade térmica de um corpo que, ao receber 2,4 kcal, tem sua temperatura aumentada de 20°C para 60°C?
2) Um corpo tem sua temperatura aumentada em 120°C ao receber 1200 cal, calcule a capacidade térmica.
3) Calcule a capacidade térmica de um objeto de 120g que tem sua temperatura aumentada 35°C ao receber 2500cal.
R: 60 cal/°C
R: 10 cal/°C
Exercícios Propostos
4) Ao fornecer 300 calorias de calor para um corpo, verifica-se como consequência uma variação de temperatura igual a 50 ºC. Determine a capacidade térmica desse corpo.
5) Para aquecer 500 g de certa substância de 20 ºC para 70 ºC, foram necessárias 4.000 calorias. A capacidade térmica vale:
a) 8 cal/ ºC b) 80 cal/ ºC c) 90 cal/ ºC d) 95 cal/ ºC e) 120 cal/ ºC
R: 6 cal/°C
Calor específico (c)
Se dois objetos feitos de um mesmo material (por exemplo mármore) possuem massas diferentes, a maneira como estes corpos
absorvem calor também se diferem. Exemplo:
,
. .
1) Se para elevar um copo de água com 200g, de 20°C para 40°C
Calor específico (c)
Isto evidência o fato de que a capacidade térmica é diretamente proporcional a massa, ou seja, se eu dobro a massa, dobro a quantidade de calor necessária para variar 1°C.
Podemos dizer que
C
=
m c
onde esta constante de proporcionalidade c é chamada de calor específico.
O calor específico não se refere ao objeto, mas sim a facilidade (ou dificuldade) que aquele material possui para receber ou ceder
calor.
Calor específico (c)
Substituindo a equação anterior na fórmula da capacidade térmica, temos:
C
=
m c
Q
=
C
Δ
T
e
,
,
então,
Q
=
m c
Δ
T
Análise de unidade:
[
Q
]=[
m
][
c
][
T
]
[
c
]=
[
Q
]
[
m
][
T
]
=
Calor específico (c)
Grandeza Unidade prática Unidade no SI
Calor específico (c)
Substância Calor específico(cal/g°C) Chumbo 0,0305 Tungstênio 0,0321 Prata 0,0564 Cobre 0,0923 Alumínio 0,215 Latão 0,092 Granito 0,19 Vidro 0,20Gelo (-10°C) 0,530
Mercúrio 0,33
Etanol 0,058
Água do mar 0,93
Água doce 1,00
Exemplo
1) Um corpo de massa 200g é constituído por uma substância de calor específico 0,4 cal/g°C. Determine:
a) a quantidade de calor que o corpo deve receber para que sua temperatura varie de 5°C para 35°C;
b) que quantidade de calor deve ceder para que sua temperatura diminua 15°C;
c) a capacidade térmica do corpo.
R:
Exercícios Propostos
1) (Enem/2010) Em nosso cotidiano usamos as palavras "calor" e "temperatura" de forma diferente de como elas são usadas no meio
científico. Na linguagem corrente, calor é identificado como "algo quente" e temperatura mede "a quantidade de calor de um corpo". Esses significados, no entanto, não conseguem explicar diversas situações que podem ser
verificadas na prática.
Do ponto de vista científico, que situação prática mostra a limitação dos conceitos corriqueiros de calor e temperatura?
a) A temperatura da água pode ficar constante durante o tempo que estiver fervendo.
b) Uma mãe coloca a mão na água da banheira do bebê para verificar a temperatura da água.
c) A chama de um fogão pode ser usada para aumentar a temperatura da água em uma panela.
d) A água quente que está em uma caneca é passada para outra caneca a fim de diminuir a sua temperatura.
e) Um forno pode fornecer calor para uma vasilha de água que está em seu interior com menor temperatura do que a dele.
Exercícios Propostos
2) A temperatura de 100g de um líquido cujo calor específico é 0,5 cal/g°C sobre de -10°C até 30°C. Em quantos minutos será realizado esse
aquecimento com uma fonte que fornece 50 calorias por minuto?
3) Um corpo de massa 200g é aquecido por uma fonte de potência
constante e igual a 200 calorias por minuto. O gráfico mostra como varia, no tempo, a temperatura do corpo. Determine a capacidade térmica do corpo e o calor específico da substância que o constitui.
R: 40 min