Tópicos Abordados Nesta Aula
Calorimetria
●
Capacidade Calorífica (Térmica)
●Calor específico
●
Transições de fase e o calor latente
●A propagação do calor
1)Condução
2)Radiação
3)Convecção
Calor – A energia em trânsito
Calor – A energia em trânsito
A lei zero da termodinâmica garante que, ao decorrer do tempo, a temperatura do corpo A tende a diminuir, e a temperatura do corpo B tende a aumentar, de modo que ao passar do tempo, ambos os
Calor – A energia em trânsito
Como o sistema está livre de influências externas (sistema isolado), podemos explicar que parte da energia interna contida em A foi
transferida para B. E que esta energia que se transfere do corpo A para o corpo B está relacionada a variação de temperatura entre os corpos.
Calor – A energia em trânsito
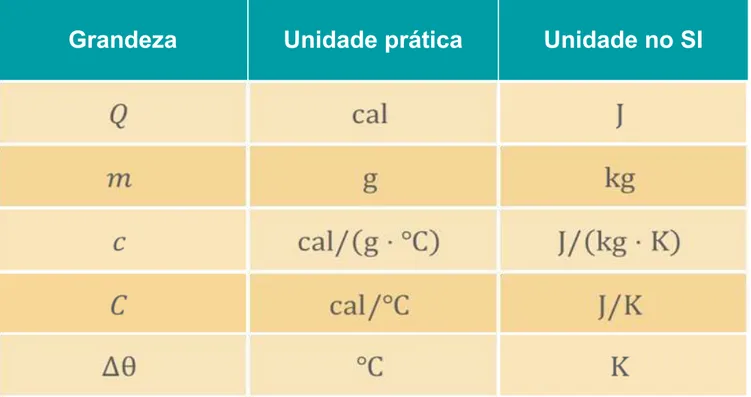
Unidade: A unidade convencional para a quantidade de calor Q é a
caloria (cal), ou seu múltiplo a quilocaloria (kcal).
A unidade usada no S.I. é a mesma utilizada para energia, ou seja,
joule (J).
Grandeza Unidade
prática Unidade no SI
De modo que podemos converter de uma para outra:
1 cal = 4,186 J
Capacidade Térmica (C)
Na discussão anterior dissemos que a quantidade de calor estava diretamente ligada à variação da temperatura
Q
∝Δ
T
Podemos escrever esta igualdade como
Q
=
C
Δ
T
,onde C é uma constante. Esta constante nos diz a intensidade com que cada corpo absorve, ou cede calor. Por isto, chamamos C de
capacidade térmica,
C
=
Q
Δ
T
..
Exemplo
1) Vamos supor que ao receber 2000 calorias (Q = 2000 cal), a
temperatura de um bloco metálico aumentou de 20°C para 420°C, a capacidade térmica deste material será?
C
=
Q
Δ
T
C
=
2000
(
420
−
20
)
C
=
5
cal
/
° C
Capacidade Térmica (C)
Dizemos então, que a capacidade térmica é uma propriedade que todo corpo possui que nos diz a facilidade (ou dificuldade) que o corpo tem em receber ou ceder calor.
Se Ti < Tf → ΔT>0, como
Q
=
C
Δ
T
Q
>
0
então,
,
.
Dizemos que o calor foi recebido. ,
Obs:
Se Ti > Tf → ΔT<0, como
Q
=
C
Δ
T
Q
<
0
então,
Troca de calor
Já vimos que dois ou mais corpos a temperaturas diferentes ao interagirem tendem a atingir a mesma temperatura. Quando isso ocorre, costuma-se dizer que esses corpos trocam calor.
Como calor é energia, o Princípio de Conservação de Energia
garante que a energia total envolvida nesse processo é constante.
Assim, se o sistema for isolado e houver apenas trocas de calor entre os seus constituintes, a soma algébrica das quantidades de calor cedidas (ΣQc) e recebidas (ΣQr) deve ser nula:
Essa é uma consequência imediata do Princípio da conservação de Energia.
Exemplo
2) Considere X e Y dois corpos homogêneos, constituídos por substâncias distintas, cujas massas correspondem, respectivamente, a 20 g e 10 g.
O gráfico abaixo mostra as variações da temperatura desses corpos em função do calor absorvido por eles durante um processo de aquecimento.
Determine as capacidades térmicas dos corpos X e Y.
R:
Exercícios Propostos
1) Qual é a capacidade térmica de um corpo que, ao receber 2,4 kcal, tem sua temperatura aumentada de 20°C para 60°C?
2) Um corpo tem sua temperatura aumentada em 120°C ao receber 1200 cal, calcule a capacidade térmica.
3) Calcule a capacidade térmica de um objeto de 120g que tem sua temperatura aumentada 35°C ao receber 2500cal.
R: 60 cal/°C
R: 10 cal/°C
Exercícios Propostos
4) Ao fornecer 300 calorias de calor para um corpo, verifica-se como consequência uma variação de temperatura igual a 50 ºC. Determine a capacidade térmica desse corpo.
5) Para aquecer 500 g de certa substância de 20 ºC para 70 ºC, foram necessárias 4.000 calorias. A capacidade térmica vale:
a) 8 cal/ ºC b) 80 cal/ ºC c) 90 cal/ ºC d) 95 cal/ ºC e) 120 cal/ ºC
R: 6 cal/°C
Calor específico (c)
Se dois objetos feitos de um mesmo material (por exemplo mármore) possuem massas diferentes, a maneira como estes corpos
absorvem calor também se diferem. Exemplo:
,
. .
1) Se para elevar um copo de água com 200g, de 20°C para 40°C
Calor específico (c)
Isto evidência o fato de que a capacidade térmica é diretamente proporcional a massa, ou seja, se eu dobro a massa, dobro a quantidade de calor necessária para variar 1°C.
Podemos dizer que
C
=
m c
onde esta constante de proporcionalidade c é chamada de calor específico.
O calor específico não se refere ao objeto, mas sim a facilidade (ou dificuldade) que aquele material possui para receber ou ceder
calor.
Calor específico (c)
Substituindo a equação anterior na fórmula da capacidade térmica, temos:
C
=
m c
Q
=
C
Δ
T
e
,
,
então,
Q
=m c
Δ
T
Análise de unidade:
[
Q
]=[
m
][
c
][
T
]
[
c
]=
[
Q
]
[
m
][
T
]
=
Calor específico (c)
Grandeza Unidade prática Unidade no SI
Calor específico (c)
Substância Calor específico(cal/g°C) Chumbo 0,0305 Tungstênio 0,0321 Prata 0,0564 Cobre 0,0923 Alumínio 0,215 Latão 0,092 Granito 0,19 Vidro 0,20Gelo (-10°C) 0,530
Mercúrio 0,33
Etanol 0,058
Água do mar 0,93
Água doce 1,00
Exemplo
1) Um corpo de massa 200g é constituído por uma substância de calor específico 0,4 cal/g°C. Determine:
a) a quantidade de calor que o corpo deve receber para que sua temperatura varie de 5°C para 35°C;
b) que quantidade de calor deve ceder para que sua temperatura diminua 15°C;
c) a capacidade térmica do corpo.
R:
Exercícios Propostos
1) (Enem/2010) Em nosso cotidiano usamos as palavras "calor" e "temperatura" de forma diferente de como elas são usadas no meio
científico. Na linguagem corrente, calor é identificado como "algo quente" e temperatura mede "a quantidade de calor de um corpo". Esses significados, no entanto, não conseguem explicar diversas situações que podem ser
verificadas na prática.
Do ponto de vista científico, que situação prática mostra a limitação dos conceitos corriqueiros de calor e temperatura?
a) A temperatura da água pode ficar constante durante o tempo que estiver fervendo.
b) Uma mãe coloca a mão na água da banheira do bebê para verificar a temperatura da água.
c) A chama de um fogão pode ser usada para aumentar a temperatura da água em uma panela.
d) A água quente que está em uma caneca é passada para outra caneca a fim de diminuir a sua temperatura.
e) Um forno pode fornecer calor para uma vasilha de água que está em seu interior com menor temperatura do que a dele.
Exercícios Propostos
2) A temperatura de 100g de um líquido cujo calor específico é 0,5 cal/g°C sobre de -10°C até 30°C. Em quantos minutos será realizado esse
aquecimento com uma fonte que fornece 50 calorias por minuto?
3) Um corpo de massa 200g é aquecido por uma fonte de potência
constante e igual a 200 calorias por minuto. O gráfico mostra como varia, no tempo, a temperatura do corpo. Determine a capacidade térmica do corpo e o calor específico da substância que o constitui.
R: 40 min
Calor de Transformação (Calor Latente)
Estados da matéria
Fases da matériaFase sólida Fase líquida Fase gasosa
• forma e volume bem definidos; • partículas próximas umas das
outras e ligadas por forças elétricas intensas;
• em virtude das fortes ligações, não há movimentação das partículas umas em relação às outras no interior do corpo (a movimentação de cada partícula deve-se à agitação térmica em torno de uma posição de equilíbrio).
• volume bem definido;
• a forma da massa líquida é a mesma do recipiente que a contém;
• partículas não tão próximas, mas ainda com atuação de forças entre elas;
• há movimentação das partículas no interior do líquido.
• volume e forma do recipiente que contém a massa gasosa;
• partículas praticamente livres umas das outras;
Transições de fase da matéria
Transições de fase da matéria
Transições de fase da matéria
Calor Latente (L)
Assim, quando um material muda de um estado para o outro, a quantidade de calor necessária para esta transição será
Q=L M ,
onde L é uma constante de proporcionalidade inerente a cada
processo que cada material poderá sofrer, chamada de calor latente.
Como podemos perceber, a quantidade de calor está relacionada com a quantidade de massa que irá sofrer esta transição de fase,
Q∝M .
A unidade de calor latente pode ser expressa como
[L]=[Q]
[m]= cal
g
[L]=kJ
(em unidades práticas)
Calor Latente (L)
Substância Ponto de Fusão (k) Lf (kJ/kg) Ponto de Ebulição (k) LE(kJ/kg)
Água 273,15 333,5 373,15 2257
Álcool Etílico 159 109 351 879
Bromo 266 67,4 332 369
Chumbo 600 24,7 2032 858
Cobre 1356 205 2839 4726
Dióxido de Carbono - - 194,6 573
Enxofre 388 38,5 717,75 287
Hélio - - 4,2 21
Nitrogênio 63 25,7 77,35 199
Ferro 1811 267,9 3134 6312,48
Exemplos
1) Que quantidade de calor é necessária para aquecer 1,5 kg de gelo, na pressão de 1 atm, de -20 0C até que toda água se
transforme em vapor de água?
(cg=0,49 cal/g0C, c
a=1,00 cal/g
0C, L
f=80 cal/g)
2) Um jarro de limonada está sobre uma mesa de piquenique, a 33 0C. Uma amostra de 0,24 kg desta limonada é derramada num vaso de espuma de plástico e a ela se funtam 2 cubos de gelo ( cada qula de 0,025 kg a 0 0C).
a) Admitindo que não haja perda de calor para o ambiente, qual a temperatura final da limona?
b)Qual seria a temperatura final se fossem 6 os cubos de gelo?
Exercícios Propostos
1) Um pedaço de gelo a 0 oC colocado em 200g de água a 30 oC, em
um recipiente de capacidade térmica desprezível, é isolado
térmicamente. O equilíbrio térmicose estabelece em 20 oC. O calor
latente de fusão do gelo é 80 cal/g e o calor específico da água é 1,0 cal/goC. A massa do pedaço de gelo usado no experimento é:
Exercícios Propostos
2) Uma colher de cobre de massa 75 g, é aquecida num forno laboratório, até atingir a temperatura T= 312oC. A colher é então
colocada em um béquer de vidro contendo 220 g de água. A
capacidade térmica efetiva do bérquer é 45 cal/K. A temperatura inicial da água e do bérquer é 12oC. Qual a temperatura final da
colher, do bérquer e da água? (cc= 0,0923 cal/g)
3) Que massa de água permanece no estado líquido depois que 50,2 kJ são transferidos na forma de calor a partir de 260 g de água inicialmente do ponto de congelamento?
Exercícios Propostos
4) Calcule a menor quantidade de energia, em joules, necessária para fundir 130 g de chumbo inicialmente a 15,0 oC.
5) Que massa de vapor a 100 oC deve ser misturada com 150 g de
gelo no ponto de fusão, em um recipiente isolado termicamente, para produzir água a 50 oC ?
6)
(Versão não-métrica) Quanto tempo um aquecedor de água de 2,0x105 Btu/h leva para elevar a temperatura de 40 galões de água de 70oF para 100oF?
(Versão métrica) Quanto tempo um aquecedor de água de 59 kW leva paraelevar a temperatura de 150 litros de água de 21 oC para 38 oC?