Departamento de Microbiologia e Imunologia
Diabetes tipo 1: o papel da IgM na função das células
β e a contribuição do locus IgH para a doença
Halyna Vovchko
Dissertação
MESTRADO EM ANÁLISES CLÍNICAS
2014
Departamento de Microbiologia e Imunologia
Diabetes tipo 1: o papel da IgM na função das células β e a
contribuição do locus IgH para a doença
Orientadores:
Halyna Vovchko
Mestrado em Análises Clínicas 2014
Professora Doutora Maria Manuela Beirão Catarino
Professora Catedrática Faculdade de Farmácia Universidade de Lisboa
Doutora Nádia Cristina Varela Da Silva Duarte
Investigadora
Instituto Gulbenkian de Ciência Oeiras, Portugal
O trabalho experimental foi realizado no laboratório Disease Genetics,
Nós nascemos ingénuos. Vivemos a vida para fazer perguntas. No entanto, morreremos mais ingénuos ainda ao pensar que achamos as respostas.
Em primeiro lugar, dedico este trabalho
à minha mãe e ao Andriy.
Dedico também à O.Y.Ivanchuk e L. M. Holosun,
que tiveram paciência para me ensinar.
À Irene Salgueiro, que acreditava em mim,
até quando mesmo eu não acreditei.
AGRADECIMENTOS
Ao Instituto Gulbenkian de Ciência, em Oeiras, na pessoa do seu Director Jonathan Howard por me ter permitido realizar o trabalho experimental nas instalações do IGC. Eu agradeço à Professora Doutora Maria Manuela Beirão Catarino pela oportunidade que me deu em trabalhar na área tão fascinante, como a imunologia; agradeço todo o seu apoio, simpatia e disponibilidade.
Agradeço ao Doutor Carlos Penha Gonçalves por me ter aceitado no seu grupo Disease Genetics no Instituto Gulbenkian de Ciência (IGC), pelo auxílio, partilha do seu conhecimento e grande simpatia.
Agradeço à Doutora Nádia Cristina Varela da Silva Duarte pelo apoio incondicional que me tem dado ao longo de todo o trabalho, pelo incentivo, paciência perante os erros de quem está na etapa de aprendizagem e pela sua grande simpatia.
Agradeço a todas as colegas do laboratório pelo óptimo ambiente de trabalho, que fez crescer a vontade de trabalhar e descobrir a ciência.
RESUMO
A diabetes tipo 1 (DT1) é uma doença de causa autoimune. A infiltração linfocitária do pâncreas contendo células T citotóxicas, T auxiliares (T helper, CD4+), macrófagos
e células B, que leva à inflamação local e destruição das células β produtoras de insulina, constitui o evento patológico particular de diabetes autoimune, denominado insulíte. No entanto, mecanismo fisiopatológico exacto da doença e os os eventos que levam à insulíte não estão totalmente esclarecidos.
Nos ilhéus infiltrados de doentes com diabetes tipo 1 e do ratinho diabético não obeso (Non obese diabetic - NOD), um modelo animal de diabetes auto-imune espontânea, encontram-se populações de células T CD8+ e T CD4+. Além da contribuição da
imu-nidade celular, as células B desempenham um papel importante na doença. Vários estudos confirmaram a importância das células B. A imunidade humoral pode contri-buir para patogénese através da acção dos auto-anticorpos (AAcs). Células B podem ainda contribuir para a doença pela apresentação aberrante de auto-antigénios (AAgs) às células T. Recentemente foi demonstrado que as células B podem secretar diversas citocinas.
A diabetes autoimune é uma doença multifactorial de etiologia complexa. Identificou-se uma panóplia de genes de susceptibilidade à DT1. Em particular, genes da região Major Histocompatibility Complex (MHC), ou no caso particular dos humanos, a região Humal Leucocyte Antigen (HLA), conferem cerca de 50% do risco total. O modelo actual da patogénese da DT1 demonstra que num indivíduo, a coincidência de pre-disposição genética, factores ambientais próprios e desregulação dos mecanismos de tolerância imunológicos, levam ao início da insulíte. Ao longo do desenvolvimento da inflamação causada pela insulíte, células β morrem sobretudo por apoptose. Com a progressão da insulíte, cerca de 80% das células β são destruídas. Neste estadio surge o quadro clínico de DT1.
O diagnóstico da DT1 baseia-se na sintomatologia convencional de diabetes mellitus, como polidipsia, poliúria, polifagia e hiperglicemia. Até à data não existe nenhum mé-todo que permita avaliar directamente os estadios da destruição das células β dentro dos ilhéus de Langerhans. No entanto, existem marcadores que mostram duma forma indirecta a presença do ataque autoimune no tecido. Estes marcadores são anticor-pos IgG contra a enzima descarboxilase do ácido glutâmico (Glutamic acid decaboxi-lase - GAD), insulina, e outros antigénios (Ags) importantes relaccionados com DT1.
Existe uma necessidade de definir marcadores da doença, que aparecem antes do aparecimento da insulíte, ou nos estadios iniciais da inflamação. Estudos prévios de-monstraram evidências para o papel das células B1a de ratinho NOD e do repertório de IgM autoreactivo, que estas células secretam, em estádios iniciais do processo auto-imune. O potencial autoreactivo das IgM no NOD, que surge sem imunização prévia, sugere que este repertório específico pode estar controlado ao nível genético.
Neste trabalho experimental colocámos a hipótese de que IgMs derivados de células B1a de NOD com reactividade para insulina poderiam induzir stress nas células β. Para testar esta hipótese foram estabelecidos ensaios in vitro, para medir stress oxi-dativo, produção de óxido nítrico e viabilidade em linhas celulares de células β. Os resultados demonstraram que há aumento de stress e diminuição de viabilidade nas linhas celulares em resposta a estímulos pro-inflamatórios de citocinas. Contudo a presença de IgM derivado de hibridomas establecidos a partir de células B1a do NOD não levou a alterações na produção de espécies de oxigénio reactivo (Reactive oxigen species - ROS), óxido nítrico (ON) ou viabilidade. Em estudos anteriores foi demons-trado que polimorfismos genéticos no locus da cadeia pesada da Imunoglobulina (IgH) humana, nomeadamente na região que codifica o IgM estão associados a susceptibi-lidade para a DT1 e níveis de IgM anti-GAD mais elevados. Na segunda parte deste trabalho foi testado se os níveis totais de IgM nos doentes com DT1 e familiares em primeiro grau estão sob o mesmo controlo genético que os níveis de IgM anti-GAD. Para tal, foram determinados os níveis de IgM total nestes dois grupos e efectuados testes de associação genética do locus IgH humano aos níveis de IgM totais do soro nos doentes com DT1, numa pequena população de 409 participantes (incluindo fa-miliares saudáveis).Observámos que apesar dos níveis de IgM serem significativa-mente mais elevados no grupo dos doentes comparativasignificativa-mente ao grupo dos familia-res, não estão sob controlo do locus IgH. Curiosamente, embora se observe correla-ção entre maior nível de IgM total e maior nível de IgM anti-GAD no grupo dos famili-ares esta correlação perde-se no grupo dos doentes. Assim, o aumento de IgM anti-GAD observado no grupo de doentes com DT1 é independente dos níveis totais de IgM .
ABSTRACT
Type 1 diabetes (T1D) is an autoimmune disease. The pancreatic infiltration contain-ing cytotoxic T cells, T helper cells, macrophages and B cells, leads to local inflamma-tion and β cell destrucinflamma-tion and constitutes a particular pathologic event in T1D, named insulitis. However, the exact pathological mechanisms that drive the disease and the events that lead to insulitis development are not fully understood.
Within the infiltrated islets of T1D patients and the non-obese diabetic (NOD) mouse, an animal model for spontaneous autoimmune diabetes, both lymphocytic populations are found, namely T CD8+ and T CD4+. Besides the contribution of cellular immunity, B cells play an important role in disease. Numerous studies confirmed the importance of B cells. The humoral immunity could contribute to the disease through auto-anti-bodies. On the other hand, B cells could also present aberrant auto-antigens to T cells. Recently, it was demonstrated, that B cells can secrete different types of cytokines.
Autoimmune diabetes is a multifactorial disease of a complex etiology. A great number of genes associated with T1D susceptibility were identified. Particularly, Major Histo-compatibility Complex (MHC) genes, or Human Leucocyte Antigen (HLA) genes in humans, confer around 50% of total risk for disease development.
The current model for T1D pathogenesis shows that, a coincidence of genetic suscep-tibility, environmental factors and break in the mechanisms of immunological toler-ance, leads to the beginning of insulitis. With the progression of insulitis, β cells die, mainly by apoptosis. In the stage of insulitis, when almost 80% of β cells are destroyed, overt diabetes appears.
The diagnosis for T1D is based on clinical signs and symptoms, including polydipsia, polyuria, polyphagia and hypeglycemia. Until now, no available methods exist for di-rect recognition of β cell destruction in the pancreatic islets of Langerhans. However, there are markers that indirectly correlate with the autoimmune process. These mark-ers are IgG antibodies present in the serum, namely IgG anti-GAD, anti-insulin, and also IgGs against other antigens related to T1D.
There is a growing requirement for disease markers,that appear before insulitis devel-opment, or in early inflammation stages. Previous studies showed evidences for the role of B1a lymphocytes of NOD mice together with the autoreactive IgM repertoire they produce, in the beginning of the autoimmune process. The auto-reactive potential of IgM from NOD mice, which appears before any previous immunization, suggests that this specific repertoire could be under genetic control.
In this experimental work we put forward the hypothesis that insulin-reactive IgM de-rived from NOD B1a could induce cell stress in β cells. To test our hypothesis, we established in vitro assays to determine oxidative stress, nitric oxide production and cell viability in β cell lines. The results demonstrated a rise in cell stress and a decrease in cell viability in cell lines in presence of pro-inflammatory cytokines. However, IgM obtained from hybridomas that were established from NOD B1a lymphocytes, didn’t affect reactive oxygen species (ROS) production, nitric oxide levels or cell viability.
Previously, it was demonstrated the association of genetic variability in the human heavy chain (IgH) locus, namely in the IgM coding region, to T1D susceptibility and higher levels of IgM anti-GAD. In the second part of this work, we tested whether the levels of total IgM in T1D patients and their relatives are under the same genetic con-trol as IgM anti-GAD. To achieve this aim, the total IgM levels were measured in T1D patients and their relatives. Genetic association tests of total IgM levels to variability in IgH locus were effectuated, in both experimental groups, with a total of 409 partici-pants. We observed that total IgM levels in patients were significantly higher compar-ing with relatives. Nevertheless, the total IgM levels were not under the IgH locus con-trol. Curiously, the significant correlation between total IgM and anti-GAD IgM levels in the relatives was not observed in the patients group. Thus, the rise in anti-GAD IgM in diabetic patients is independent of the total IgM level.
ÍNDICE GERAL
AGRADECIMENTOS ... IV RESUMO ... V ABSTRACT ... VII LISTA DE ABREVIATURAS... XII ÍNDICE DE FIGURAS ... XX ÍNDICE DE TABELAS ... XXI
I.
INTRODUÇÃO
... 21. SISTEMA IMUNOLÓGICO ... 2
1.1 SISTEMA IMUNOLÓGICO INATO ... 2
1.2 SISTEMA IMUNOLÓGICO ADAPTATIVO ... 3
1.3 TOLERÂNCIA IMUNOLÓGICA ... 6
2. PRODUÇÃO DA INSULINA E METABOLISMO DA GLUCOSE ... 9
2.1 ANATOMIA E FISIOLOGIA DO PÂNCREAS ... 9
2.2 A REGULAÇÃO HORMONAL DO METABOLISMO DA GLUCOSE ... 11
3. DIABETES MELLITUS ... 13
3.1 CLASSIFICAÇÃO E TERMINOLOGIA PARA GRUPO DE DOENÇAS DIABETES MELLITUS ... 13
3.2. CLASSIFICAÇÃO PORTUGUESA DE DIABETES MELLITUS ... 16
3.3 CRITÉRIOS PARA DIAGNÓSTICO DE DIABETES MELLITUS EM PORTUGAL ... 17
3.4 DIABETES TIPO 1... 18
3.5 PAPEL DAS CÉLULAS B NA DT1 ... 23
II.
OBJECTIVOS
... 29III.
MATERIAL
E
MÉTODOS
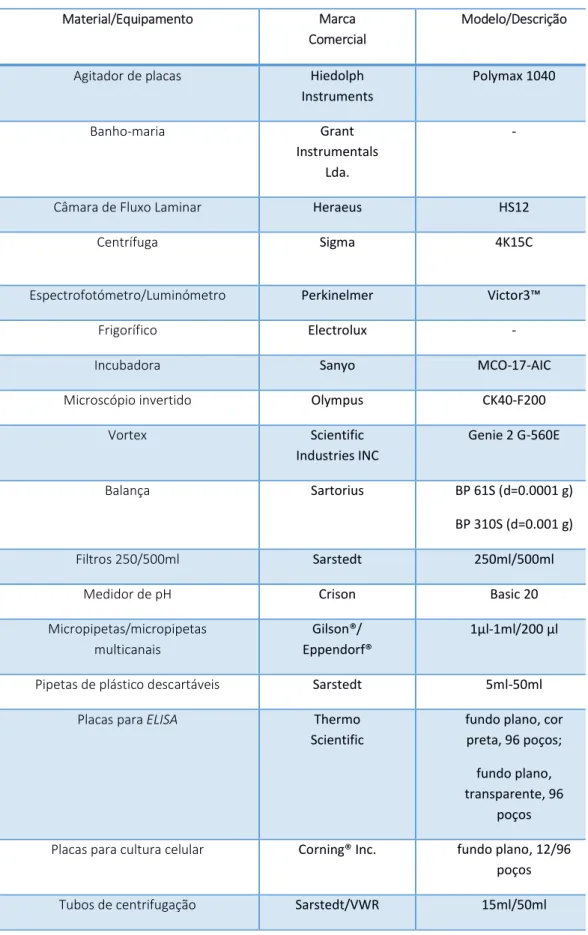
... 301. MATERIAL E EQUIPAMENTO ... 30
2. ORIGEM E CARACTERIZAÇÃO DOS ANTICORPOS MONOCLONAIS IGM ... 32
3. LINHAS CELULARESBRIN-BD11EINS1E ... 32
3.1 ORIGEM E CARACTERIZAÇÃO ... 32
3.2 FASES DO CRESCIMENTO DAS CÉLULAS EM CULTURA ... 33
3.3 PROCEDIMENTO LABORATORIAL PARA MANUTENÇÃO DAS CÉLULAS EM CULTURA ... 34
4. DOSEAMENTO DA INSULINA EM RESPOSTA AO ESTÍMULO DA GLUCOSE ... 35
4.1 ESTIMULAÇÃO DAS CÉLULAS Β COM GLUCOSE ... 35
4.2 DOSEAMENTO DA INSULINA POR ELISA ... 36
4.3 ENSAIO DE GSIS COM ANTICORPOS IGM MONOCLONAIS ... 37
5. DOSEAMENTO DE ROS ... 37
5.2 PROCEDIMENTO GERAL ... 38
5.3 PROCEDIMENTO ESPECÍFICO PARA DOSEAMENTO DE ROS NA PRESENÇA DE H2O2 NAS CÉLULAS BRIN-BD11 E INS1E ... 39
5.4 PROCEDIMENTO ESPECÍFICO PARA DOSEAMENTO DE ROS NO ENSAIO DE TITULAÇÃO DAS CITOCINAS PRO-INFLAMATÓRIAS NAS CÉLULAS INS1E ... 39
5.5 PROCEDIMENTO ESPECÍFICO PARA DOSEAMENTO DE ROS NA PRESENÇA DAS IGM MONOCLONAIS COM OU SEM CITOCINAS PRO-INFLAMATÓRIAS NAS CÉLULAS INS1E ... 40
5.6 PROCEDIMENTO ESPECÍFICO PARA DOSEAMENTO DE ROS NA PRESENÇA DAS IGM MONOCLONAIS, COM O CO-ESTÍMULO DAS CITOCINAS PRO-INFLAMATÓRIAS E DO COMPLEMENTO, NAS CÉLULAS INS1E ... 40
6. ANÁLISE DA VIABILIDADE CELULAR ... 41
6.1 FUNDAMENTO DO MÉTODO ... 41
6.2 PROCEDIMENTO GERAL ... 41
6.3 PROCEDIMENTO ESPECÍFICO PARA A ANÁLISE DA VIABILIDADE CELULAR NA PRESENÇA DE H2O2 NAS CÉLULAS BRIN-BD11 E INS1E ... 42
6.4 PROCEDIMENTO ESPECÍFICO PARA A ANÁLISE DA VIABILIDADE CELULAR NO ENSAIO DA TITULAÇÃO DAS CITOCINAS PRO-INFLAMATÓRIAS NAS CÉLULAS INS1E ... 42
6.5 PROCEDIMENTO ESPECÍFICO PARA A ANÁLISE DA VIABILIDADE CELULAR NA PRESENÇA DAS IGM MONOCLONAIS COM OU SEM CITOCINAS PRO-INFLAMATÓRIAS NAS CÉLULAS INS1E ... 43
6.6 PROCEDIMENTO ESPECÍFICO PARA A ANÁLISE DA VIABILIDADE CELULAR NA PRESENÇA DAS IGM MONOCLONAIS COM O CO-ESTÍMULO DAS CITOCINAS PRO-INFLAMATÓRIAS E DO COMPLEMENTO, NAS CÉLULAS INS1E ... 43
7. DOSEAMENTO DO NITRITO ... 44
7.1 FUNDAMENTO DO MÉTODO ... 44
7.2 PROCEDIMENTO LABORATORIAL ... 45
8. DOSEAMENTO DAS IGM TOTAIS DO SORO DOS DOENTES COM DIABETES TIPO 1 ... 46
8.1 CARACTERIZAÇÃO DA COORTE... 46
8.2 DESENHO EXPERIMENTAL ... 47
8.3 FUNDAMENTO DO MÉTODO ELISA UTILIZADO PARA DOSEAMENTO DAS IGM TOTAIS ... 48
8.4 PROCEDIMENTO LABORATORIAL PARA O DOSEAMENTO DAS IGM TOTAIS ... 48
8.5 NORMALIZAÇÃO DOS VALORES DE IGM TOTAIS OBTIDOS DEVIDO À VARIABILIDADE INTRA-ENSAIO ... 50
8.6 TESTES DA ASSOCIAÇÃO GENÉTICA ... 51
1. DESENVOLVIMENTO E OPTIMIZAÇÃO DOS BIOENSAIOS EM LINHAS CELULARES
DE RATOBRIN-BD11EINS1EE O EFEITO DE IGM NA FUNÇÃO CELULAR ... 54
1.1 AVALIAÇÃO DO CRESCIMENTO DAS CÉLULAS Β PROVENIENTES DAS LINHAS CELULARES INS1E E BRIN-BD11 ... 54
1.2 AVALIAÇÃO DA SECREÇÃO DA INSULINA APÓS O ESTÍMULO DA GLUCOSE NAS CÉLULAS BRIN-BD11 ... 56
1.3 O EFEITO DAS IGM MONOCLONAIS P1G1.12 E P2C1.2 NA SECREÇÃO DA INSULINA APÓS O ESTÍMULO DA GLUCOSE (GSIS) NAS CÉLULAS Β BRIN-BD11 ... 57
1.4 DETERMINAÇÃO DE ROS E DA VIABILIDADE EM LINHAS CELULARES BRIN-BD11 E INS1E APÓS O ESTÍMULO DE H2O2 ... 58
1.5 O EFEITO DA TITULAÇÃO DAS CITOCINAS PRÓ-INFLAMATÓRIAS NAS CÉLULAS INS1E, MEDIDO ATRAVÉS DOS ENSAIOS DE STRESS E VIABILIDADE CELULARES ... 61
1.6 O EFEITO DAS IGM MONOCLONAIS NA PRESENÇA DAS CITOCINAS PRO-INFLAMATÓRIAS NO STRESS E VIABILIDADE CELULARES NAS CÉLULAS INS1E ... 64
1.7 O EFEITO DAS IGM MONOCLONAIS EM CO-ESTÍMULO COM AS CITOCINAS PRO-INFLAMATÓRIAS E COMPLEMENTO NO STRESS E VIABILIDADE NAS CÉLULAS INS1E ... 68
2 QUANTIFICAÇÃO DAS IGM TOTAIS NO SORO DE DOENTES COM DIABETES TIPO 1 E ASSOCIAÇÃO GENÉTICA AO LOCUSIGH ... 72
2.1 COMPARAÇÃO DOS NÍVEIS DAS IGM TOTAIS NOS SOROS DOS DOENTES DIAGNOSTICADOS COM DT1 E NOS SEUS FAMILIARES EM PRIMEIRO GRAU ... 72
2.2 CORRELAÇÃO ENTRE AS IGM TOTAIS E AS IGM ANTI-GAD NOS DOENTES DIAGNOSTICADOS COM DT1. .. 73
2.3 QUANTITATIVE TRAIT LOCI ANALYSIS PARA IDENTIFICAR UMA POSSÍVEL ASSOCIAÇÃO DOS NÍVEIS DE IGM TOTAIS AO LOCUS IGH HUMANO. ... 74
IV.
DISCUSSÃO
... 76V.
CONCLUSÃO
... 80LISTA DE ABREVIATURAS
µM micro Molar
AAgs Auto-antigénios
Acetil-CoA Acetil coenzima A
ADA American Diabetes Association
Anticorpo (s) Ac (s)
Antigénio (s) Ag (s)
APC (s) Antigen presenting cell (s)
Auto-anticorpos AAcs
Auto-antigénios AAgs
Bcl-2 B-cell lymphoma 2
Bcl-xL B-cell lymphoma-extra large
BCR B cell receptor
BRIN-BD11 Rat pancreatic beta cell: RINm5F hybrid cell line
BSA Bovine serum albumin
CAM (s) Cell Adhesion Molecule (s)
CD Cluster of differentiation
CTLA-4 Cytotoxic T lymphocyte antigen-4
DC Dendritic cells
DCF dichlorofluorescein
DCF 2',7'-dichlorofluorescein
DGS Direcção Geral de Saúde
DNA Desoxyribonucleic acid
DT1 Diabetes tipo 1
DT2 Diabetes tipo 2
EC Enterochromaffin cells
EDTA Ethylenediamine tetra-acetic acid
ELISA Enzyme-linked immunosorbent assay
eNos Epithelial nitric oxide syntase
EPM Erro padrão da média (Standard error of mean - SEM)
FBS Fetal bovine serum
FO Folliclar B cells
FoxP3 Forkhead box P3
GAD Glutamic acid decarboxilase
GIP Glucose-dependent insulinotropic polypeptide
GLP-1 Glucagon-like peptide-1
GLUT (s) Glucose transporter (s)
GSIS Glucose stimulated insulin secretion
H2DCF 2',7'-dichlorofluorescein
H2DCFDA 2',7'-dichlorodihydrofluorescein diacetate
HbA1c Hemoglobina glicada A1c
HEPES 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid
HLA Human leucocyte antigen
HNF-1α Hepatyc nuclear factor 1α
HNF-4α Hepatyc nuclear factor 4α
HRP Horse radish peroxidase,
IA-2A Insulinoma-associated 2 auto antibodies
ICA Islet-cell auto-antibodies
IFN Interferon
IgG Imunoglobulina da classe G
IgH locus Immunoglobulin heavy chain locus
IgM Imunoglobulina da classe M
IL Interleukine
Imunoglobulinas Igs
iNos Inducible nitric oxide syntase
INS1E Insulinoma rat cells
KO Knock out
KRBH Krebs-ring bicarbonate hepes
LADA Latent autoimmune diabetes of the adult
LRR Leucin rich repeat
M Molar
MAPK Mitogen-activated protein kinase
MHC Major Histocompatibility Complex
mM mili Molar
MO Medula óssea
MODY Maturity-onset diabetes of the young
MTT 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide
MyD88 Myeloid differentiation primary response 88
NADH Nicotinamide adenine dinucleotide, reduced form
NEDD N-1-(naphthyl)ethylenediamine
NEDH New England Deaconess Hospital
NF-kB Nuclear factor kappa B
NLR Nod like receptors
nm nano metr
NOD mice Non-obese-diabetic mice
NOD.Scid NOD.Severe combined immunodeficiency
ON Óxido nítrico
PAMPs Pathogen associated molecular patterns
PBS Phsphate buffered saline
PRR (s) Pattern recognition receptor (s)
PTGO Prova de tolerância a glucose oral
PTPN-22 Protein tyrosine phosphatase, non-receptor type 22
QTL Quantitative trait locus
RE Retículo endoplasmático
RNA Ribonucleic acid
ROS Reactive oxygen species
rpm Rotações por minuto
RPMI Medium Roswell Park Memorial Institute Medium
SI Sistema imunitário
SNP (s) Single nucleotide polymorphism (s)
TCR T cell receptor
Th T helper
TIR Toll/Interleukin-1 receptor)
TLRs Toll like receptors
TMB 3,3',5,5'-tetramethylbenzidine
TNFα Tumor necrosis factor α
V/V Volume/volume
VNTR (s) Variable Nuleotide Tandem Repeat (s)
ÍNDICE DE FIGURAS
FIGURA 1–A LOCALIZAÇÃO DO PÂNCREAS NO CORPO HUMANO. ... 9
FIGURA 2–ESTRUTURA DO PÂNCREAS E DOS ILHÉUS DE LANGERHANS. ... 10
FIGURA 3–A REPRESENTAÇÃO ESQUEMÁTICA DO METABOLISMO DA GLUCOSE... 11
FIGURA 4-FASES DO CRESCIMENTO DAS CÉLULAS EM SUB-CULTURA. ... 34
FIGURA 5–APRESENTAÇÃO ESQUEMÁTICA DO MÉTODO ELISA“SANDWICH”. ... 36
FIGURA 6–DETECÇÃO DE ROS NA CÉLULA ATRAVÉS DA SONDA INTRAMOLECULAR H2DCFDA. ... 38
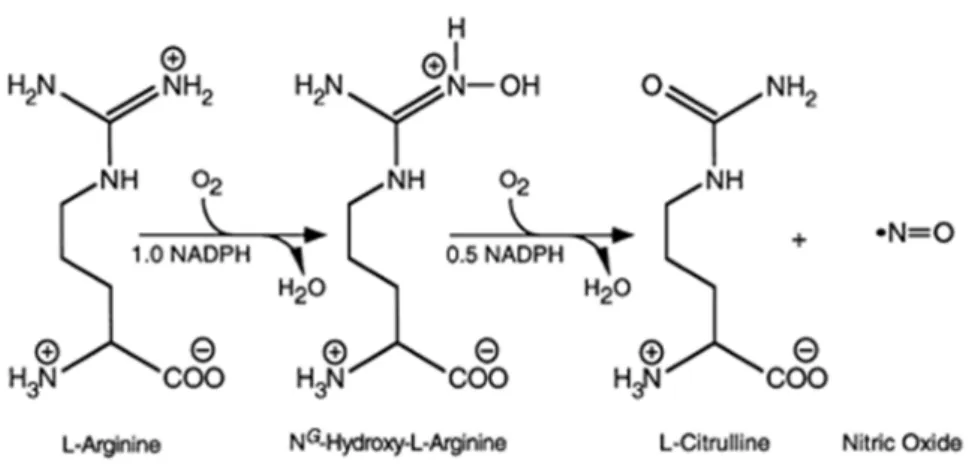
FIGURA 7–FORMAÇÃO DO COMPOSTO INSOLÚVEL FORMAZAN A PARTIR DA SONDA INTRAMOLECULAR MTT. 41 FIGURA 8–FORMAÇÃO DO ÓXIDO NÍTRICO E DA CITRULINA A PARTIR DA L-ARGININA, CATALIZADA PELAS SINTASES DE ÓXIDO NÍTRICO 89. ... 44
FIGURA 9–A REACÇÃO DE GRIESS PARA DETECTAR O NITRITO NA SOLUÇÃO AQUOSA. ... 45
FIGURA 10–O DESENHO EXPERIMENTAL REPRESENTATIVO DAS PLACAS DE ELISA NA EXPERIÊNCIA DE QUANTIFICAÇÃO DE IGM TOTAL DAS AMOSTRAS HUMANAS. ... 47
FIGURA 11-OS VALORES DE ABSORVÂNCIA PARA OS SOROS HUMANOS, PROVENIENTES DA PLACA Nº 1 DA SESSÃO Nº 1. ... 50
FIGURA 12–OS SNPS DO LOCUS IGH, QUE MAPEIAM REGIÃO DA CADEIA PESADA DAS IMUNOGLOBULINAS E QUE ESTÃO ASSOCIADOS A DT171. ... 52
FIGURA 13-CONTROLO DO CRESCIMENTO DAS CÉLULAS INS1E EM CULTURA. ... 54
FIGURA 14-CONTROLO DO CRESCIMENTO DAS CÉLULAS BRIN-BD11 EM CULTURA. ... 55
FIGURA 15–SECREÇÃO DA INSULINA MEDIDA APÓS O ESTÍMULO DA GLUCOSE (GSIS). ... 56
FIGURA 16–SECREÇÃO DA INSULINA APÓS O ESTÍMULO DA GLUCOSE (GSIS) NA PRESENÇA DOS ACS MONOCLONAIS IGM. ... 57
FIGURA 17–DOSEAMENTO DE ROS POR ENSAIO COM H2DCFDA APÓS 60 MIN OU 40 MIN DE INCUBAÇÃO COM A SONDA NAS CÉLULAS BRIN-BD11 E INS1E. ... 58
FIGURA 18–DOSEAMENTO DE ROS POR ENSAIO COM H2DCFDA APÓS 60 MIN OU 40 MIN DE INCUBAÇÃO COM A SONDA NAS CÉLULAS BRIN-BD11 E INS1E. ... 59
FIGURA 19–DETERMINAÇÃO DA VIABILIDADE CELULAR POR ENSAIO COM MTT APÓS O ESTÍMULO DE SAPONINAS E H2O2 NAS CÉLULAS BRIN-BD11 E INS1E. ... 60
FIGURA 20–A CURVA DE TITULAÇÃO DAS CITOCINAS PRO-INFLAMATÓRIAS E O SEU EFEITO NA SECREÇÃO DE ROS NAS CÉLULAS INS1E. ... 61
FIGURA 21–A CURVA DE TITULAÇÃO DAS CITOCINAS PRO-INFLAMATÓRIAS E O SEU EFEITO NA VIABILIDADE DAS CÉLULAS INS1E. ... 62
FIGURA 22–A CURVA DE TITULAÇÃO DAS CITOCINAS PRO-INFLAMATÓRIAS E O SEU EFEITO NA PRODUÇÃO DO NITRITO NAS CÉLULAS INS1E. ... 63
FIGURA 23–O EFEITO DAS IGM MONOCLONAIS SOZINHOS OU NA PRESENÇA DE CITOCINAS PRO -INFLAMATÓRIAS NA PRODUÇÃO DE ROS NAS CÉLULAS INS1E. ... 64
FIGURA 24–O EFEITO DAS IGM MONOCLONAIS SOZINHOS OU NA PRESENÇA DE CITOCINAS PRO -INFLAMATÓRIAS NA VIABILIDADE DAS CÉLULAS INS1E... 66
FIGURA 25–O EFEITO DAS IGM MONOCLONAIS SOZINHOS OU NA PRESENÇA DE CITOCINAS PRO -INFLAMATÓRIAS NA PRODUÇÃO DO NITRITO NAS CÉLULAS INS1E... 67
FIGURA 26–O EFEITO DAS IGM MONOCLONAIS NA PRESENÇA DE CITOCINAS PRO-INFLAMATÓRIAS E DO COMPLEMENTO NA PRODUÇÃO DE ROS NAS CÉLULAS INS1E. ... 68
FIGURA 27–O EFEITO DAS IGM MONOCLONAIS NA PRESENÇA DE CITOCINAS PRO-INFLAMATÓRIAS E DO COMPLEMENTO NA VIABILIDADE DAS CÉLULAS INS1E. ... 69
FIGURA 28–O EFEITO DAS IGM MONOCLONAIS NA PRESENÇA DE CITOCINAS E DO COMPLEMENTO NA PRODUÇÃO DO NITRITO NAS CÉLULAS INS1E. ... 70
FIGURA 29–COMPARAÇÃO DOS NÍVEIS DE IGM TOTAL NOS DOENTES COM DT1 E NOS FAMILIARES SAUDÁVEIS. ... 72
ÍNDICE DE TABELAS
TABELA 1–MATERIAL E EQUIPAMENTO UTILIZADO NO TRABALHO EXPERIMENTAL. ... 31
TABELA 2–O NÚMERO TOTAL DAS AMOSTRAS TESTADAS PARA QUANTIFICAR AS IGM SÉRICAS, DIVIDIDO EM
5 SESSÕES DE ELISA. ... 47 TABELA 3–OS VALORES DA MÉDIA E DESVIO-PADRÃO (DP) DE T2 PARA BRIN-BD11 E INS1E. ... 55
TABELA 4-QUANTITATIVE TRAIT LOCI ANALYSIS (QTL) PARA ASSOCIAÇÃO DOS NÍVEIS DE IGM TOTAIS AO LOCUS IGH HUMANO ... 74
Este trabalho foi escrito conforme a regra ortográfica antiga da língua portu-guesa.
I. INTRODUÇÃO
1. SISTEMA IMUNOLÓGICO
1.1 Sistema imunológico inato
O sistema imunológico (SI) humano divide-se em sistema imunológico inato e adaptativo. A forma inata do SI inclui as barreiras físicas, químicas e celulares, que constituem a primeira linha de defesa do corpo humano. A camada externa do epitélio da pele é um exemplo da barreira física; no cérebro, a barreira hemato-encefálica com junções de oclusão (tigh junctions) e selectividade específica das substâncias biológicas e químicas constitui a barreira celular; o pH ácido do estômago e da mucosa vaginal, as substâncias secretadas juntamente com o suor entre outros, são os exemplos da barreira química inata 1.
Quando um agente patogénico ultrapassa as primeiras barreiras inatas e invade o tecido, dá-se o início da resposta inflamatória. Ocorre a libertação dos agentes quimiotácticos, que causam a dilatação dos vasos sanguíneos e migração das células-mediadoras da reposta inflamatória. Os granulócitos penetram o foco da infecção, e destroem o agente invasor pela libertação dos grânulos tóxicos. Os resíduos do agente patogénico são fagocitados pelos macrófagos. Estes fagócitos são capazes de reconhecer as estruturas moleculares conservadas no agente invasor. As estruturas referidas designam-se por Padrões moleculares associados a patogénicos (Pathogen Associated Molecular Patterns - PAMPs). Lipopolissacáridos de bactérias Gram-negativas, peptidoglicano das bactérias Gram-positivas, flagelina, DNA microbiano e RNA viral, bem como componentes da parede dos fungos são exemplos dos PAMPs 2.
O reconhecimento dos PAMPs ocorre através dos receptores expressos no hospedeiro. Estes receptores têm o nome comum de Receptores de reconhecimento de padrões (Pattern Recognition Receptors - PRRs).
PRRs dividem-se em moléculas secretadas, citosólicas e transmembranares. As colectinas, os componentes do complemento, defensinas e proteínas surfactantes presentes no muco do tracto respiratório são PRRs secretadas. Algumas estruturas, como é o exemplo das defensinas, apresentam uma estrutura tridimensional,
conservada nos três reinos biológicos distintos, Fungi, Animalia e Plantae 2,3. Nod Like Receptors (NLRs) constituem uma família de proteínas secretadas no citosol. Os mais conhecidos nos mamíferos são Nod1 e Nod2. Curiosamente, as plantas produzem as estruturas semelhantes ao NLRs dos mamíferos 2.
Os PRRs transmembranares mais bem estudados são grupo de proteinas designados por receptores do tipo Toll (Toll Like Receptors - TLRs). TLRs são expressos nas células fagocíticas, nomeadamente nos macrófagos 1.Constituem uma família ampla
dos receptores com estrutura conservada, o domínio extracelular rico em leucinas (Leucin Rich Repeat - LRR) e domínio citoplasmático TIR (Toll/Interleukin-1 receptor)2. Através da proteína adaptadora do citosol, MyD88 (Myeloid differentiation
primary response 88), TLRs activam o factor de transcrição NF-kB (Nuclear Factor kappa B) e as cinases MAP (Mitogen-Activated Protein Kinases - MAPK), que por sua vez induzem a transcrição de genes da resposta pro-inflamatória 4. Alguns TLRs também são expressos em células do sistema adaptativo, nomeadamente em células T e B. Desse modo, TLRs são uma "ponte" que liga o sistema imunológico inato com o adaptativo5. Mais do que isso, receptores Toll 1, 2, 4, 5 e 6 reconhecem os PAMPs
provenientes das bactérias; TLR-3, -7, -8 especializam-se no reconhecimento de padrões de RNA viral e TLR-9 no reconhecimento de DNA viral 6. TLRs que reconhecem os ácidos nucleicos virais activam a expressão das citocinas da família Interferão I (IFN I), cuja acção consiste no bloqueio da replicação viral dentro da célula infectada do hospedeiro. Desse modo, a resposta inata via TLR pode conduzir a resposta adaptativa para o caminho de escolha mais apropriado 6.
1.2 Sistema imunológico adaptativo
No momento em que o SI inato não consegue combater a infecção local pelos processos inflamatórios, as células do sistema adaptativo entram em acção.
Fazem parte do SI adaptativo, células B e T. As células B pertencem ao sistema imu-nológico humoral. Actuam através da produção das glicoproteínas plasmáticas, de-signadas de imunoglobulinas (Igs). Existem cinco classes, ou isotopos das Igs, IgM, IgG, IgD, IgA e IgE, determinadas pelo uso da cadeia pesada. Após maturação na médula óssea, as células B são libertas para a corrente sanguínea na sua forma naïve. Células B naïve produzem apenas IgM, proteínas penta- ou hexaméricas sem grande especificidade antigénica e com polireactividade. Estas IgM têm forte capaci-dade de fixação do complemento e constituem o isotipo predominante dos chamados anticorpos naturais que são produzidos na ausência de estimulação exógena. Estes anticorpos são codificados pela linha germinal e desempenham importantes funções na homeostasia, imunorregulação e selecção do repertório 7. A hipermutação somá-tica na cadeia µ dá origem a outros isotipos das Igs, que em vez de ter a cadeia µ, vão ter uma das seguintes cadeias, α, γ, ε, δ e formar dímero IgA, monómeros IgG, IgE ou IgD respectivamente. Um clone linfocitário secreta apenas uma classe imuno-globulínica. O clone da célula B, que após o rearranjo da cadeia µ produz as Igs mais eficazes no combate ao Ag, procede para expansão clonal e pode ser “memorizado” pelo SI. As IgGs são as imunoglobulinas de memória, que permanecem no sangue por períodos mais longos de tempo, ao contrário das IgM, que desaparecem mais rapidamente do sangue. Assim sendo, IgGs de memória conferem a protecção no caso da reinfecção e constituem também o meio de diagnóstico de várias doenças infecciosas virais 8.
As células B que secretam Igs, actuam à distância. O receptor de antigénio das células B (B Cell Receptor - BCR) é constituído por Igs não secretadas que ficam na membrana celular. A ligação dos Ags ao BCR da célula B desencadeia uma cascata de sinais bioquímicos no interior das células B. Durante a ligação do Ag ao BCR e na presença de outros sinais co-estimuladores, a família de cinases de tirosina Src é activada e ocorre a formação do complexo sinalizador. Este complexo pode alterar a expressão dos genes, o estado metabólico da célula e o rearranjo do citoesqueleto 9. As células B no ambiente próprio podem também secretar as citocinas. Conforme o balanço entre as citocinas que secretam, podem induzir ou cessar a resposta inflamatória. As células B, ao produzirem IL-2, IL-6, IFN-γ e TNF-α podem estimular o sistema imunitário. Por outro lado, a libertação do TGF-β e IL-10 pode suprimir a resposta imune, alterando o balanço entre as subpopulações das células T helper, Th1 e Th2. As células B podem também induzir as células T reguladoras (Foxp3+) 10.
As células B que secretam citosinas, nomeadamente IL-10, TGF-β podem ter uma função regulatória, tal como existe a subpopulação das células T Foxp3+ reguladoras11.
Outra função importante das células B relaciona-se com a sua capacidade para processar Ags captados através do BCR e apresentação de partículas antigénicas através de moléculas de MHC. Esta função de apresentação antigénica é crucial na sua interacção com o outro grupo de células do sistema imunitário, as células T, na medida em que lhes permite activar e por sua vez serem activadas por estas mesmas células.
As células T pertencem à imunidade celular. Maturam no timo. No estado naïve, residem nos órgãos linfóides secundários, circulam no sangue e na linfa. Após o contacto com Ag, as células T dividem-se para duas grandes subpopulações, T CD4+ e T CD8+. Os Ags são apresentados as células T pelas células apresentadoras de antigénio, APCs. Todas as APCs profissionais (inclui células dendríticas, macrófagos e também as células B) expressam os péptidos do MHC, também designado como HLA em Humanos. Através do MHC de classe II (HLA II) são apresentados os epitopos de Ags exógenos (foreign) aos T CD4+. As restantes células expressam MHC classe I (HLA I) e apresentam epítopos endógenos aos T CD8+. A diversidade genómica da região HLA confere a extrema variabilidade dos paratopos formados no complexo imunológico {péptido HLA/T Cell Receptor da célula T}.
Ambas as subpopulações podem diferenciar-se em células de memória via expansão clonal.
T CD8+ são células com toxicidade directa, especializadas no combate a agressões intracelulares. Actuam através da secreção das citocinas tóxicas, lisozimas e granzimas e lisam as células infectadas ou malignas.
T CD4+ são células efectoras ou auxiliares (helper). Dependendo de factores ambientais, as células T helper podem diferenciar-se em pelo menos quatro subpopulações, que desempenham um papel importante na homeostasia da resposta imune. Quando diferenciadas em Th1 produzem citocinas pro-inflamatórias IFN-γ e IL-2 e estão mais envolvidas na resposta contra agressões intracelulares. Pelo contrário, quando diferenciadas em Th2 produzem citocinas IL-4, IL-5, IL-13 envolvidas na resposta a parasitas extracelulares. O balanço entre Th1/Th2 define o caminho celular e regula a diferenciação celular. Recentemente identificaram-se outras formas de células T helper, a Th17, caracterizada pela produção de citocinas
IL-17, IL-21 e IL-22 e envolvida na resposta a bactérias extracelulares ou fungos, e T reguladoras, caracterizadas pela expressão do factor de transcripção Fop3.As células T reguladoras actuam por forma a suprimir a acção de células efectoras regulando a resposta imunitária e desempenhando um papel crucial no controlo da autoimunidade12.
1.3 Tolerância imunológica
A regulação do SI é feita de maneira a manter o equilíbrio fino entre células com capacidade efectora, que vigiam possíveis agressões externas e internas (células tumorais), e os mecanismos da sua regulação. Como tal, o sistema imunitário adaptativo possui um certo grau de auto-reactividade, que está presente no organismo e que tem de ser limitado por forma a evitar agressões contra células funcionais do próprio organismo e outras partículas inócuas. Este princípio constitui um paradigma do SI denominado de tolerância imunológica, que se divide em central e periférica.
1.3.1 Tolerância imunológica central
Um dos mecanismos principais de tolerância central é o mecanismo da delecção clonal das células B e T nos órgãos linfóides onde estes se desenvolvem. As células B e T expressam os respectivos receptores BCR e TCR na superfície celular, e são apresentados aos Ags endógenos na médula óssea e no timo, respectivamente. Os clones linfocitários que expressam seus receptores com afinidade muito elevada ou muito baixa para os epítopos antigénicos do próprio, são eliminados por apoptose (selecção negativa). Por sua vez, o repertório das células com afinidade moderada/baixa são seleccionados para posterior diferenciação (selecção positiva). Sabe-se que, as células B auto-reactivas além da delecção clonal podem ser submetidos ao processo da edição do seu receptor BCR 13.
A edição do receptor nas célula B inicia-se com a exclusão alélica, um fenómeno em que os células B expressam um único tipo da cadeia da imunoglobulina, cadeia leve L ou a cadeia pesada H. A exclusão alélica ocorre ao nível do rearranjo genético do respectivo locus, sendo este processo altamente controlado pelos eventos
epigenéticos, tais como tempo de replicação e metilação do DNA, modificação das histonas, posicionamento do nucleossoma durante a replicação e condensação da cromatina (heterocromatina). Estes eventos celulares determinam o acesso aos loci e qual dos alelos vai ser processado em primeiro lugar. Por sua vez, o rearranjo da cadeia leve L ocorre via exclusão isotípica, quando é expresso um dos seus isotipos, κ ou λ. A edição do receptor acontece quando o rearranjo se inicia em estadios diferentes da maturação da célula B, ou quando a célula B tem os alelos codificantes para cadeia κ delectados 13.
Relativamente as células T, se existem ou não os mecanismos da tolerância central via edição do receptor TCR auto-reactivo, existem opiniões e estudos controversos 14–16. McGargill M.A. e co-autores demonstraram que, após a apresentação no timo dos Ags endógenos pelas células epiteliais às células T, as células T com afinidade para o próprio não foram conduzidos para a apoptose, mas sim, ocorreu a internalização do receptor e rearranjo do locus TCRα (cadeia α é constituinte do dímero αβ do receptor TCR). Este processo foi denominado de “edição do receptor”, como sendo o evento similar ao das células B 16.
1.3.2 Tolerância imunológica periférica
O repertório dos AAgs nos tecidos linfoides centrais não podem abranger toda a variedade das proteínas que existem na periferia. Além disso, algumas células com baixa auto-reactividade podem escapar aos mecanismos de tolerância central no timo e na medula óssea.
Tolerância periférica compreende os mecanismos de controlo da reactividade intrín-seca das células T maturas. Estes mecanismos incluem a ignorância dos complexos contendo Ag do próprio-MHC, a ausência de resposta funcional (anergia), delecção das células T periféricas devido a estimulação inapropriada ou supressão da resposta imunitária por intervenção de células T reguladoras.
Ignorância dos complexos péptido do próprio-MHC pela célula T contendo TCR po-tencialmente auto-reactivo para estes complexos, ocorre devido a separação espacial dos mesmos. As células T naïve migram pela corrente sanguínea para os órgãos linfoides secundários, através do gradiente de concentração, criado pelos ligandos específicos expressos nestes órgãos. As células APCs apresentam os complexos Ags-MHC as células T. Se as células T reconhecem os complexos apresentados,
ocorre a resposta imunológica celular. Caso contrário, as células T voltam para o san-gue. Deste modo, evita-se o contacto das células T com Ags do próprio, presentes em grande abundancia nos tecidos não linfóides.
As células dendríticas (dendritic cells - DC) são APCs. A sua função na apresentação de Ags às células T nos nódulos linfáticos está bem estabelecida. Existem evidências que sugerem a função tolerogénica das DCs, quando se encontram no seu estadio da maturação incompleta. O mecanismo da indução da tolerância em células T pelas DCs é por indução de anergia nas células T naïve auto-reactivas. Este processo ocorre nos nódulos linfáticos e baço, na ausência de processos inflamatórios. Pensa-se também, que a capacidade tolerogénica das DCs, aumenta nas condições de morte celular.
Apos activação completa das células T, e quando é necessário “desligar” a resposta imunológica, são activados os factores, que funcionam como indutores de anergia das células T. Um dos factores constitui a proteína de membrana cytotoxic T lymphocyte antigen-4 (CTLA-4), cuja expressão é induzida pelas DCs tolerogénicas.
CTLA-4 sendo um regulador negativo da resposta imune da própria célula T, previne a progressão do ciclo celular 17,18. A sua expressão constitutiva foi proposta como um dos mecanismos necessários para que as células T reguladoras que expressam Foxp3+ exerçam a sua função 18. Curiosamente, o ratinho KO para o gene ctla-4 desenvolve a autoimunidade 17.
As células T ligados aos complexos péptido Ag do próprio-MHC de forma crónica, podem ser delectados por apoptose, que é activada pela serie de eventos, nomeada-mente através do receptor Fas, uma via da morte mitocondrial dependente inactiva-ção das proteínas anti-apoptóticas Bcl-2 e Bcl-xL e da activainactiva-ção do factor Bim 19.
A desregulação dos mecanismos de tolerância está na origem das doenças autoimunes nas quais se insere a DT1.
2. PRODUÇÃO DA INSULINA E METABOLISMO DA
GLUCOSE
2.1 Anatomia e fisiologia do pâncreas
O pâncreas localiza-se no abdómen atrás do estômago (fig. 1) e desempenha duas funções principais, a endócrina e a exócrina. A secreção de enzimas tais como tripsina, amilase, peptidase e lipase pancreáticas, constitui a função exócrina do órgão. As enzimas digestivas juntamente com os sais biliares provenientes da bílis são libertados para o duodeno, onde ocorre a digestão de polímeros complexos contidos na alimentação. A secreção de hormonas, nomeadamente da insulina e glucagon é a função endócrina do pâncreas. A insulina e glucagon são importantes para a manutenção dos níveis de glucose no sangue 20.
Figura 1 – A localização do pâncreas no corpo humano.
Adaptado a partir de 26.
A estrutura do pâncreas mais detalhada está apresentada na figura 1. O órgão contém as estruturas específicas que desempenham o papel endócrino importante, os ilhéus de Langerhans. Os ilhéus apresentam os agregados celulares, cada um contendo cerca de três a quatro mil células. O pâncreas contém cerca de um milhão dessas estruturas, que representam apenas 1-1,5 % da massa total do órgão 21.
As células α dos ilhéus de Langerhans secretam maioritariamente glucagon, uma hormona de 29 aminoácidos importante na activação da gliconeogénese e que contraria a acção da insulina promovendo o aumento da glicémia. As células β constituem o tipo celular mais comum dos ilhéus. O seu produto principal é a hormona
insulina, composta por duas cadeias polipeptídicas com 51 aminoácidos necessária para a expressão de receptores para a glucose nos órgãos periféricos. Além da insulina, as células β secretam a hormona amilina, qua actua no mesmo sentido que a insulina e suprime a secreção do glucagon 22. As células δ secretam a somatostatina, que afecta a homeostasia da glucose de forma a inibir a libertação da insulina e glucagon. Parece que, esta hormona neuro endócrina actua através de subtipos distintos do próprio receptor 23. Nos ilhéus de Langerhans estão também presentes as células PP e células ε que secretam os polipéptidos pancreáticos e a substância grelina (ghrelin). Esta hormona pode actuar ao inibir secreção da insulina e da somatostatina e aumentar a libertação da glucagon (fig. 2) 24,25.
Figura 2 – Estrutura do pâncreas e dos ilhéus de Langerhans.
O pâncreas está dividido em três partes, a cabeça, o corpo e a cauda pancreáticos; os ductos interlobulares do calibre mais pequeno formam os ductos pancreáticos maiores, que se unem com o ducto biliar através da ampola do Vater. As células do ácino são as células secretoras de enzimas digestivas, que se libertam para os ductos e saem para o duodeno. Os ilhéus de Langerhans são constituídos pelas células α, β, e δ que secretam as hormonas endócrinas insulina, amilina, glucagon, somatostatina (Adaptado de 26,22).
2.2 A regulação hormonal do metabolismo da glucose
A Glucose é uma molécula pequena e polar, solúvel em água. Este monossacárido está envolvido em múltiplos caminhos metabólicos (fig. 3). A glucose é indispensável para o funcionamento dos neurónios, uma vez que este açúcar é uma das suas fontes energéticas principais. Em alternativa, os neurónios podem utilizar os corpos cetónicos a partir da acetil-CoA, no entanto, a manutenção dos níveis normais de glucose no sangue é vital 21,27.
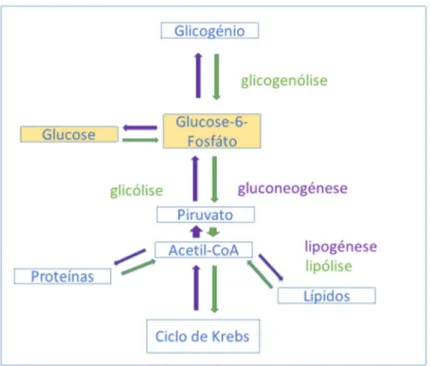
Figura 3 – A representação esquemática do metabolismo da glucose.
A glucose exógena é convertida à glucose-6-fosfato e pode ser reservada sob a forma do glicogénio no fígado e nos músculos, no caso em que os níveis de glucose no sangue estão nos parâmetros fisiológicos. Por outro lado, a glucose pode ser convertida em piruvato via glicólise. O piruvato é convertido em acetil-CoA que entra no ciclo de Krebs e é reduzido a água e CO2 com a obtenção de energia na forma de ATP. O acetil-CoA também pode ser
convertido em triglicéridos que são armazenados no tecido adiposo (lipogénese). Quando é necessário aumentar os níveis sanguíneos de glucose, a via de gliconeogénese pode ser ac-tivada. Durante a gliconeogénese, forma-se a glucose endógena a partir do piruvato e lactato. A glucose endógena ainda se produz a partir da degradação do glicogénio no fígado (glicoge-nólise). As reacções catabólicas estão representadas a verde e as anabólicas a violeta (Adap-tado a partir de 21).
A concentração da glucose sanguínea é atingida pelo balanço entre a glucose que entra na circulação e pela glucose que é removida. Do ponto de vista clássico, este balanço é mantido essencialmente pela acção antagonista da insulina e da glucagon. A glucose que entra na circulação sanguínea durante a refeição através da absorção
intestinal, constitui um dos estímulos principais para a secreção da insulina pelas células β do pâncreas. A insulina após ser libertada pela veia porta, actua no sentido da remoção da glucose do sangue. A hormona liga-se ao receptor da insulina, que sofre a auto fosforilação, o que induz a fosforilação subsequente de outras proteínas; estes eventos levam a maior expressão dos transportadores da glucose denominados GLUT (Glucose transporter) 28 promovendo a captação da glucose nos tecidos periféricos, nomeadamente, nos músculos esqueléticos, e também no fígado. Neste órgão promove a formação de glicogénio (glicogénese). Por outro lado, a secreção da insulina pelas células β tem efeito parâcrino nas células α, secretoras da glucagon, inibindo a sua acção catabólica, que consiste na estimulação da produção da glucose endógena no fígado via glicogenólise e gliconeogénese durante os períodos de jejum curtos ou mais prolongados.
Na última década descobriu-se que existem outras hormonas com papel na regulação do metabolismo da glucose, nomeadamente, a amilina e as incretinas.
A hormona neuro endócrina amilína é libertada pelas células β juntamente com a insulina. Amilina parece ter uma função de coordenação do eixo hormonal insulina-glucagon, evitando os aumentos bruscos de glucose no sangue. Os seus receptores, calcitonin-like receptors, situam-se nas regiões específicas do cérebro, caracterizados pela ausência da barreira hemato-encefálica. Amilina actua ao suprimir o efeito da glucagon após a refeição além de retardar o efeito de saciedade ao nível gástrico 22.
As incretinas constituem um grupo de hormonas secretadas pelas células endócrinas das criptas intestinais. As células entero-endócrinas, representadas pelas células D, L, K e EC (enterochromaffin cells) constituem menos de 1 % do epitélio intestinal e estão presentes desde o duodeno até ao recto 29. Glucagon-like peptide-1 (GLP-1) e Glucose-dependent insulinotropic polypeptide (GIP) representam umas das incretinas mais estudadas. GIP são secretadas pelas células K e GLP-1 pelas células L do intestino. Ambas se ligam aos receptores acoplados a proteína G e têm os seus receptores nos vários tecidos metabolicamente activos, nomeadamente, pâncreas, cérebro, coração, fígado e intestino. A secreção de GLP-1 aumenta após a ingestão de carbohidratos, gorduras e proteínas. GIP e GLP-1 parecem actuar por aumentar a libertação da insulina em resposta a hiperglicemia. Ambas as incretinas têm a função protectora e anti-apoptótica das células β. Por outro lado, podem inibir a secreção da glucagon nas células α, cujo mecanismo não está totalmente compreendido 30.
3. DIABETES MELLITUS
3.1 Classificação e terminologia para grupo de doenças
Diabe-tes mellitus
Segundo o comunicado recente da American Diabetes Association (ADA), Diabetes mellitus é um grupo de doenças metabólicas de etiologia complexa que resulta na secreção deficiente da insulina, na acção deficiente da insulina ou na combinação de ambas. A terminologia mais correcta a ser utilizada é “diabetes (mellitus) tipo 1” ou “diabetes (mellitus) tipo 2” em vez de “diabetes mellitus insulino-dependentes” ou “diabetes mellitus não insulino-dependentes”, para sublinhar a etiologia e não o tipo de terapia, e evitar a confusão na classificação 31.
3.1.1 Diabetes tipo 2
A diabetes tipo 2 (DT2) é a forma etiológica mais prevalente do grupo de doenças diabetes mellitus 31. DT2 é uma síndrome crónica, e relaciona-se com obesidade, tensão arterial alta e progressão para hiperglicémia. O aumento da massa gorda associa-se com o desenvolvimento da resistência à insulina nos músculos e no fígado, especialmente no caso em que o excesso da gordura deposita-se nestes órgãos. Inicialmente, o pâncreas vai tentar compensar o estado da resistência à insulina, ao produzir quantidades maiores da hormona. No entanto, com a progressão da diabetes, as células β pancreáticas vão falhar na sua função produtora. Estes eventos patológicos levam à resistência à insulina e ao quadro clínico de DT2. Adicionalmente, outros caminhos metabólicos relacionados com metabolismo da glucose (lipólise nos adipócitos, deficiência de incretinas nos intestinos, aumento de secreção da glucagon pelas células α pancreáticas, reabsorção da glucose pelos rins) contribuem para estabelecimento da hiperglicémia 32.
3.1.2 Diabetes tipo 1
duas formas: a autoimune com a presença de AAcs contra os Ags das células dos ilhéus de Langerhans, e a idiopática, quando a destruição celular não apresenta uma evidência clara dos processos autoimunes. A forma idiopática de DT1 não inclui a destruição das células β que resultou de uma causa de caracter não autoimune (outras doenças, como é o exemplo da fibrose cística; medicação) 31.
Curiosamente, os estudos recentes apontam para alguns aspectos de caracter autoimune, presentes na patogénese de DT1. Nomeadamente, a presença de AAcs contra as células β pancreáticas e as células T auto-reactivas são amplamente reconhecidos. Além disso, existem formas de diabetes que combinam as características de ambas as formas de diabetes, 1 e 2. O exemplo constitui diabetes autoimune latente nos adultos, ou LADA (latent autoimmune diabetes of the adult) 33.
3.1.3 Diabetes gestacional
Diabetes gestacional constitui uma das complicações mais comuns durante a gravidez, e está associado ao desenvolvimento de resistência à insulina e hiperinsulinémia.
A prevalência de diabetes gestacional varia bastante nos países diferentes do mundo, mas a tendência é acompanhar o aumento da prevalência de DT2.
As alterações hormonais durante a gravidez podem estar na base etiológica para o desenvolvimento de diabetes. Nomeadamente, as hormonas libertas pela placenta podem causar o efeito de resistência a insulina; adicionalmente, níveis mais elevados de estrogénio, progesterona e cortisol alteram o balanço entre insulina e glucose. Para compensar, o pâncreas secreta mais insulina. O órgão pode não libertar a quantidade de hormona suficiente, e não compensar a resistência a insulina nos tecidos periféricos. Neste caso, a mulher grávida desenvolve diabetes gestacional.
Os factores de risco mais comuns são idade mais avançada, obesidade, diabetes gestacional na gravidez anterior, DT2 nos familiares, hipertensão durante a gravidez34.
3.1.4 Mutações genéticas que afectam a função secretora das células β
a presença de mutações raras que afectam a função das células β ou a função da própria insulina, até a aquisição da doença como sendo secundária no decorrer das desordens primárias no organismo.
Neste grupo estão incluídas as mutações nos factores de transcrição hepatyc nuclear factor 1α (HNF-1α), hepatyc nuclear factor 4α (HNF-4α) e no gene da glucocinase, e que são herdadas de forma autossómica dominante 31.
HNF-1α é expresso no fígado, rins, intestino e nos ilhéus pancreáticos. A mutação no gene hnf-1α nos humanos está associada à função deficiente das células β do pâncreas com a consequência da secreção deficiente na insulina 35.
HNF-4α é o membro da superfamília de receptores das hormonas esteroides/tiroideias. Considera-se como um dos reguladores mais importantes da expressão do gene hnf-1α. A mutação no gene hnf-4α causa diabetes nos jovens 36.
A glucocinase tem como função a conversão da glucose à glucose-6-fosfato com a estimulação subsequente da secreção da insulina pelas células β do pâncreas 31. A mutação no gene da enzima causa um quadro clínico com hiperglicémia moderada, as complicações associadas a diabetes são raras.
As formas de diabetes causadas pelas mutações referidas normalmente ocorrem nas crianças e nos adolescentes e estão agrupados no denominado Maturity-onset diabetes of the young (MODY) 35,37.
O defeito no gene da glucocinase (MODY 2) e no gene hnf-1α (MODY 3) até a data são as formas mais frequentes no grupo das doenças classificados como MODY, facto confirmado pelos estudos em três países da Europa Central. A forma de diabetes MODY 3 apresenta o quadro clínico mais severo comparando com MODY237.
3.1.5 Mutações genéticas que afectam a acção da insulina
As mutações no gene do receptor da insulina causam duas síndromas nas crianças, a síndrome de Donohue e a síndroma de Rabson-Mendenhall 31.
A síndrome de Donohue (nome alternativo Leprechaunism) foi inicialmente descrita por Donohue e Uchida em 1954 em duas irmãs, filhas de pais consanguíneos. É uma desordem genética rara, herdada de forma autossómica recessiva, que se caracteriza
por malformação do feto, distúrbios endócrinos e resistência a insulina severa e normalmente, é letal 31,38,39.
A síndrome de Rabson-Mendenhall é também herdada de forma autossómica recessiva. As crianças morrem em idade precoce, no entanto quem sobrevive, apresenta defeitos ao nível da pele (acanthosis nigricans), malformação dos dentes, hirsutismo, hiperglicemia e cetoacidose constantes 40.
3.1.6 Doenças no pâncreas exócrino
As doenças do pâncreas exócrino tais como pancreatite, trauma, infecções, pancreatectomia e carcinoma podem danificar de forma extensiva o órgão e causar uma perda acentuada das células β. O mecanismo exacto, no entanto, não é totalmente explicado, porque a redução do número e da massa celular (das células β) pode não ser suficiente para desencadear o quadro de diabetes no caso da doença do pâncreas exócrino.
A diabetes mellitus pode surgir devido à produção excessiva de hormonas na presença de diversas endocrinopatias, que incluem acromegalia, síndrome de Cushing entre outros 31.
A diabetes ainda pode ser induzida por diversos químicos ou fármacos, como é o caso dos glucocorticoides 25.
3.2. Classificação portuguesa de diabetes mellitus
A Direcção Geral de Saúde (DGS) da República Portuguesa define quatro tipos clínicos da diabetes mellitus (DM) (Nº 002/2001, de 14/01/2011) que estão de acordo com a classificação proposta por ADA:
1. Diabetes tipo 1; 2. Diabetes tipo 2; 3. Diabetes gestacional;
4. Outros tipos de diabetes específicos que incluem 4.1 Defeitos genéticos da célula β;
4.2 Defeitos genéticos na acção da insulina; 4.3 Doenças do pâncreas exócrino;
4.4 Endocrinopatias;
4.5 Diabetes induzida por químicos ou fármacos 41.
3.3 Critérios para diagnóstico de diabetes mellitus em Portugal
Segundo à norma da DGS Nº 002/2001, de 14/01/2011, os critérios de diagnóstico de diabetes mellitus para a população em geral é feita com base nos seguintes parâmetros do plasma venoso:
1. Glicemia em jejum ≥ 126 mg/dl (ou ≥ 7,0 mmol/l); ou
2. Sintomas clássicos de descompensação (sede anormal e secura da boca; micção frequente; cansaço; fome constante; perda de peso súbita; feridas de cura lenta; infecções recorrentes; visão turva) mais glicemia ocasional ≥ 200 mg/dl (ou ≥ 11,1 mmol/l); ou
3. Glicemia ≥ 200 mg/dl (ou ≥ 11,1 mmol/l) as 2 horas, na prova de tolerância a glucose oral (PTGO) com 75g de glucose; ou
4. Hemoglobina glicada A1c (HbA1c) ≥ 6,5 %.
O diagnóstico de diabetes numa pessoa assintomática não deve ser feita com base num único valor de um dos parâmetros e deve ser confirmado numa segunda análise após uma a duas semanas.
É aconselhável utilizar um só parâmetro para o diagnóstico de diabetes. No entanto, se dois parâmetros estão a ser analisados simultaneamente, e um dos parâmetros é normal mas outro é indicativo da doença, o último deve ser repetido numa nova análise.
No que diz respeito à diabetes gestacional, o diagnóstico é feito com base nos parâmetros para o plasma venoso seguintes:
1. Glicemia em jejum na primeira consulta de gravidez ≥ 92 mg/dl e <126 mg/dl (ou ≥ 5,1 mmol/l e <7,0 mmol/l);
2. Se glicemia em jejum é <92 mg/dl, realiza-se PTOG com 75 g de glucose, às 24-48 semanas de gestação. A confirmação de um dos seguintes valores constitui o critério para diagnóstico:
às 0 horas, o nível de glicemia é ≥ 92 mg/dl (ou ≥ 5,1 mmol/l); à 1 hora, glicemia ≥ 180 mg/dl (ou ≥ 10,0 mmol/l);
3.4 Diabetes tipo 1
Segundo DGS, DT1 de causa autoimune caracteriza-se pela destruição específica das células β produtoras de insulina e insuficiência na produção desta hormona com consequente aumento dos níveis de glicémia. Manifesta-se pela tríade dos sinais e sintomas clássicos de diabetes, poliúria, polidipsia e polifagia. Além dos referidos, podem ocorrer em simultâneo cansaço e falta de energia, perda de peso súbita, visão turva, feridas de cura lenta e infecções recorrentes.
No decorrer dos processos autoimunes na DT1, ocorre a infiltração das células do sistema imunológico, nomeadamente das células T, que medeiam a destruição das células β. O fenómeno da infiltração linfocitária denomina-se de insulíte, que ao longo da sua progressão leva à redução da massa celular do órgão em cerca de 80 à 85%.
DT1 é uma doença metabólica multifactorial. O modelo actual da patogénese da DT1 demonstra que, o desenvolvimento da insulíte com a posterior redução do número das células produtoras de insulina é o resultado concomitante da predisposição genética e factores ambientais, que levam à quebra dos mecanismos da tolerância imunológica 42.
3.4.1 Epidemiologia
A percentagem de doentes com DT1 na população dos EUA para 2010 situava-se nos valores cerca de 0.5 %, 11.3% dos quais abrangia jovens até vinte anos. Na Europa Central, a Finlândia e a Suécia são os países com maior número de doentes com DT1.
A incidência de DT1 está a aumentar em todo o mundo. Nos EUA, a incidência duplicou nos últimos 20 anos. O mesmo cenário prevê-se para a Europa até 2020, especialmente nas crianças menores de cinco anos 42,43.
Segundo os dados da DGS, em Portugal a prevalência de DT1 nas crianças e jovens até dezanove anos, em 2013 constituía cerca de 0.16% contra 0.14% em 2010 na mesma faixa etária. Desde 2008, a taxa de prevalência de DT1 tem vindo a aumentar cerca de 0.01% na população jovem portuguesa (0-19 anos) 44.
ano, em média é de 17.8 nos jovens até catorze anos (0-14), e 15.01 nos jovens até dezanove anos (0-19). Embora os números variem em cada ano, verifica-se a tendência para o aumento da incidência de diabetes nos últimos 13 anos em Portugal44.
3.4.2 Factores genéticos da susceptibilidade
Os estudos de susceptibilidade genética para DT1 estão a decorrer há cerca de trinta e cinco anos. Verifica-se que vários loci estão associados a susceptibilidade para DT1. Já nos estudos iniciais, descobriu-se que certos polimorfismos dos genes localizados na região HLA conferem maior risco para a doença. Os genes da região HLA estão relacionados com a função imunológica. O seu produto, as proteínas da membrana são necessárias para a apresentação de Ags (exógenos e endógenos) às células do sistema imunológico (APCs)45. Existem outros genes que não são da região HLA, nomeadamente o gene da proinsulina, ptpn-22, ctla-4 e que conferem o maior risco para aparecimento de DT1 45. Curiosamente, o risco para a doença constitui um risco cumulativo dos genes de susceptibilidade. Em contrabalanço, existem os polimorfismos que conferem a protecção, como é o caso dos Variable Nuleotide Tandem Repeats (VNTRs) do gene da proinsulina. Neste caso particular, o risco mais baixo está associado a maior delecção das células T auto reactivas no timo, sendo este o mecanismo indispensável da tolerância central no SI 46.
Genes HLA
Os genes da região HLA localizam-se no cromossoma 6p21-31. Esta região do genoma humano é extremamente polimórfica. Os genes HLA dividem-se em genes HLA clássicos e não clássicos. Por sua vez, genes HLA clássicos estão agrupados em três classes.
HLA da classe I, nomeadamente A, B, C e HLA da classe II, tais como DR, DQ e DP codificam proteínas de estrutura similar; estas proteínas localizam-se na superfície celular e apresentam os péptidos antigénicos às células T. Na porção extramembranar das proteínas HLA classe I e II, dois domínios externos formam uma "groove" onde se liga o péptido antigénico. As proteínas HLA classe I ligam-se aos péptidos endógenos e são reconhecidos pelas células T CD8+; As proteínas HLA classe II ligam-se a péptidos exógenos que neste caso são reconhecidos pelas células T CD 4+. A especificidade da resposta imunológica determina-se pelas
interacções moleculares do complexo HLA/péptido/TCR 45.
Os polimorfismos da região HLA conferem cerca de 50% do risco genético para adquirir DT1 47. De entre todos os SNPs de susceptibilidade dentro da região referida, a combinação dos haplotipos DR3/DR4 nos caucasianos constitui o risco maior 45.
Genes não HLA
Outros genes que se localizam fora da região HLA foram identificados como genes de susceptibilidade. O gene na proinsulina no cromossoma 11p15 confere cerca de 10% de susceptibilidade para DT1 47. O gene da proinsulina contém VNTR 5. OS VNTR 5 curtos contendo aproximadamente 26-63 repetições (até 570 pares de bases) conferem o maior risco genético para DT1. Por outro lado, VNTR 5 mais longos com cerca de 140 - 200 repetições (até 2200 pares de bases) têm o efeito protector contra a doença. Verificou-se que, VNTR mais longos são expressos no timo e podem ter efeito de induzir maior tolerância central 48.
O gene ctla-4 localizado no cromossoma 2q33 está associado também à susceptibilidade para DT1, no entanto o seu papel na doença não está bem esclarecido 47.
Foram efectuados os ensaios clínicos nos doentes com artrite reumatoide, com administração do fármaco Abatacept. Este composto é uma proteína de fusão contendo a porção Fc da imunoglobulina e o domínio extracelular da proteína CTLA-4. Fc-CTLA-4 liga-se aos receptores CD80/CD86 nas células APCs e bloqueia a sua interacção com receptor CD28 expresso nas células T. Desse modo, são inibidas a proliferação das células T e a resposta das células B, o que leva ao cessar dos processos pro-inflamatórios 49. Quando aplicado no grupo dos diabéticos diagnosticados, foram evidenciados os efeitos benéficos, nomeadamente no aumento dos níveis do péptido C (liga as duas cadeias da insulina A e B na molécula da proinsulina; ao ser clivada, o péptido C é libertado; mede, de uma forma indireta a capacidade dos pâncreas em produzir insulina) e na redução da administração da insulina exógena. Embora estes ensaios tenham sido totalmente conclusivos, CTLA-4 pode ser importante na regulação da resposta imunológica e na indução de tolerância imunológica 50. Sabe-se também que, os polimorfismos no gene ctla-4 conferem uma maior predisposição para outras desordens autoimunes, incluindo adoença de Graves, a doença celíaca e a doença de Addison 47.
aumentam o risco para DT1 e além desta desordem, estão associados à artrite reumatoide, lúpus eritematoso, doença de Graves e granulomatose de Wegener (WG) 51,52. O produto do gene são proteínas da família tirosina fosfatase, expressas maioritariamente nas células T 52. O receptor das células T (TCR) contem as estruturas específicas com o resíduo de tirosina. Durante a apresentação dos Ags no contexto MHC, a tirosina é fosforilada desencadeando uma cascata de transdução do sinal. Esta cascata, mediada por cinases de tirosina da família Src, culmina na mobilização do cálcio e na activação da MAP kinase, que resulta na regulação transcripcional e rearranjos no citoesqueleto celulares 53. A alteração na sinalização via TCR nas células T determina o grau de resposta da célula ao Ag e pode afectar a selecção das células auto reactivas no timo, assim como a activação e diferençiação das células T efectoras (T helper e T cytotoxic). A sinalização via TCR é crítica para a diferenciação e activação de células T reguladores, importantes na manutenção da tolerância periférica 53.
3.4.3 Factores ambientais
O aumento acentuado da incidência de diabetes autoimunes nos países desenvolvidos, tais como EUA e a Finlândia preocupam e sugerem que, para além da componente genética, estão a aumentar factores externos de predisposição para DT1 e/ou a desaparecer os factores que diminuem o risco da doença 43,54. As infecções virais, pelo vírus Coxsackie em particular, parecem associados à indução da imunidade contra as células β através dos danos directos nas células e libertação dos Ags celulares e/ou por mimetização molecular 6,55.
Por outro lado, possíveis factores epigenéticos poderão contribuir para diabetes autoimunes. Num estudo recente avaliou-se os efeitos da metilação do DNA na DT1. Este mecanismo junto a modificação das histonas e RNA não codificantes contribui para os mecanismos epigenéticos mais importantes na regulação da transcrição génica 54. Tendo em conta que gémeos monozigóticos demonstram uma taxa de concordância de diabetes autoimune de 40%, os autores compararam os perfis para DNA metilado em células de gémeos concordantes e não concordantes para DT1 e concluíram que, existe uma diferença significativa entre os dois grupos. Embora o estudo apresente um número de participantes baixo e exista viés em relação género, os seus resultados indicam que os efeitos epigenéticos não devem ser desprezados e apontam para um possível desenvolvimento futuro de marcadores epigenéticos