Efeito dos Parâmetros Operacionais e
Configuracionais no Desempenho de uma Célula
de Combustível com Alimentação de Álcool
Dissertação de Mestrado
deCatarina de Sousa Moreira
Desenvolvida no âmbito da unidade curricular de Dissertação, em meio académico
Orientadora: Doutora Vânia Sofia Brochado de Oliveira Co-orientadora: Prof. Doutora Alexandra Maria Pinheiro da Silva Ferreira Rodrigues Pinto
Departamento de Engenharia Química
CEFT – Centro de Estudos de Fenómenos de Transporte
Agradecimentos
Em primeiro lugar, quero agradecer à minha co-orientadora, Professora Doutora Alexandra Pinto, bem como aos membros do Centro de Estudos de Fenómenos de Transporte (CEFT), pela oportunidade de desenvolver a minha tese de mestrado nesta área.
À minha orientadora, Doutora Vânia Oliveira, pela disponibilidade, orientação, dedicação e por todas as dúvidas esclarecidas e transmissão de conhecimento científico.
À Beatriz Arnold Braz, pelo auxílio na parte prática, transmitindo a sua experiência no manuseamento da célula de combustível, bem como nos métodos de análise dos resultados. Gostava, também, de agradecer aos membros do laboratório E206, pelo ambiente agradável de trabalho que se proporcionou.
Aos meus amigos, pelos momentos de descontração e pela preocupação em saber como o trabalho decorria, tendo sempre uma palavra de incentivo.
À minha família, pelo apoio, preocupação, carinho e por sempre reconhecerem o meu esforço, transmitindo palavras de encorajamento.
E por último, agradecer ao Diogo Silva, por ter partilhado com ele estes últimos meses de trabalho, podendo expressar o meu nervosismo e dúvidas, sabendo que da sua parte havia sempre uma palavra de calma e tentativa de solução. Obrigada pela paciência, sem dúvida que se tornou mais fácil.
Resumo
Atualmente, o consumo energético tem sido excessivo, surgindo a procura de tecnologias alternativas, de forma a não comprometer a necessidade energética do ser humano. Uma das tecnologias alternativas promissoras de produção de energia elétrica, com reduzido impacto ambiental, são as células de combustível.
Existem vários tipos de células de combustível, focando-se, o presente trabalho, nas células de combustível passivas com alimentação direta de álcool (DAFC). Estas células têm potencial para aplicações portáteis, com elevadas densidades energéticas e facilidade de manuseamento e armazenamento. Apesar dos diversos desenvolvimentos já alcançados para esta tecnologia, existem ainda diversos parâmetros a explorar, com vista a otimizar o seu desempenho.
Os objetivos da presente dissertação consistem no estudo da influência do tipo de combustível alimentado à DAFC, testando misturas de metanol e etanol e da configuração das placas coletoras do ânodo e do cátodo, por forma a otimizar o desempenho da célula de combustível. Com as condições ótimas encontradas, realizou-se ainda um teste de durabilidade à DAFC, avaliando o seu desempenho ao longo do tempo.
Os ensaios foram realizados usando uma DAFC passiva e os resultados foram analisados através das curvas de polarização, curvas de potência específica e espectroscopia de impedância eletroquímica (EIS).
Com estes estudos, conclui-se que uma solução de metanol alimentada ao ânodo é uma melhor opção, quando comparada com misturas de metanol e etanol, sendo que a adição deste último diminui o desempenho da célula de combustível. Em relação às placas coletoras testadas, verificou-se que uma placa de 121 furos com 3 mm de diâmetro é a melhor configuração, quer no ânodo quer no cátodo.
No presente trabalho, atingiu-se um máximo de desempenho traduzido num valor de potência específica de 9,2 mW/cm2, para uma concentração de metanol de 2 M, com uma placa de 121
furos no ânodo e no cátodo. Com a utilização de cargas de catalisadores mais baixas no ânodo e no cátodo, conseguiu-se uma redução do custo em 15 %.
O teste de durabilidade realizado à DAFC, com as condições ótimas encontradas, resultou num período ininterrupto de funcionamento da célula de 3 h a 4 h.
Palavras Chave: Célula de Combustível com alimentação Direta de Álcool, Mistura de Metanol
e Etanol, Configuração da Célula, Durabilidade, Espectroscopia de Impedância Eletroquímica, Otimização, Atravessamento de Combustível
Abstract
Nowadays, the energy consumption has been excessive, arising the search of alternative technologies in a way that the human energetic need is not compromised. In this context, fuel cells appear as a promising electric energy production technology, reducing the environmental impact.
There are several types of fuel cells and, in the present work, the focus will be on passive direct alcohol fuel cells (DAFC). These cells are promising for portable applications, mainly due to its high energy density and to the easy way of fuel handling and storage.
The objectives of the present dissertation were to study the influence of the type fuel fed to the DAFC, testing methanol and ethanol mixtures and the impact of the design of the anode and cathode current collector, on the fuel cell performance towards its optimization. In a final stage of the work, a durability test was performed under the optimal conditions selected, to evaluate the variation of cell performance over time.
The tests were conducted in a passive DAFC and the results were analysed through polarization and power density curves and electrochemical impedance spectroscopy (EIS). These studies allowed to conclude that as expected, a pure methanol solution fed to the anode is the best option, when compared to the use of methanol and ethanol mixtures, being the addition of this last alcohol the reason for a decrease of the fuel cell performance. Regarding the current collectors tested, the optimal configuration was a plate having 121 holes with a diameter of 3 mm, at both anode and cathode sides. A maximum power density of 9,2 mW/cm2 was achieved for a methanol concentration of 2 M employing this optimal
current collector design. With the use of lower catalyst loadings both at the anode and at the cathode it was achieved a cost reduction of 15 %.
The durability test performed to the DAFC, with the best conditions found, resulted in a cell working period of 3 to 4 hours.
Keywords: Direct Alcohol Fuel Cell, Methanol and Ethanol Mixture, Cell Configuration,
Declaração
Declaro, sob compromisso de honra, que este trabalho é original e que todas as contribuições não originais foram devidamente referenciadas com identificação da fonte.
Porto, 3 de julho de 2017
Índice
1 Introdução 1
1.1 Enquadramento da Tese ... 1 1.2 Objetivos da Tese ... 2 1.3 Organização da Tese ... 2
2 Contexto e Estado da Arte 4
2.1 Células de Combustível ... 4
2.1.1 Perspetiva Histórica 5
2.1.2 Tipos de Células de Combustível 6
2.2 Células de Combustível com alimentação Direta de Álcool (DAFCs) ... 7
2.2.1 Classificação quanto à forma de Alimentação 8 2.2.2 Princípio de Funcionamento 9 2.2.3 Constituintes da DAFC 10 2.2.4 Princípios Termodinâmicos 12
2.2.5 Combustíveis 13
2.2.5.1 Células de Combustível com alimentação Direta de Metanol (DMFCs) 14 2.2.5.2 Células de Combustível com alimentação Direta de Etanol (DEFCs) 16
2.2.5.3 Metanol vs Etanol 18
2.2.6 Ensaios de Impedância como Técnica de Diagnóstico 18
2.2.7 Aplicações 21
3 Instalação Experimental 23
3.1 Design da Célula de Combustível ... 23
3.1.1 Placas terminais/fecho e isoladoras 24 3.1.2 Placas e redes coletoras 25 3.1.3 Membrane electrode assembly 26
3.2 Equipamento ... 27 3.3 Procedimento Experimental ... 28
3.3.1 Procedimento experimental para obtenção de curvas de polarização e de potência 28 3.3.2 Procedimento experimental usado no teste de durabilidade 29
3.3.3 Procedimento experimental usado nos ensaios de EIS 29
4 Resultados Experimentais 30
4.1 Efeito da Adição de Etanol à DAFC ... 31
4.2 Efeito da Configuração das Placas Coletoras ... 36
4.2.1 Ânodo 37 4.2.2 Cátodo 39 4.2.3 Configuração Ótima 41 4.3 Teste de Durabilidade à DAFC ... 43
5 Conclusões 46 6 Sugestões de Trabalhos Futuros 47 Referências 48 Apêndice A: Efeito da Adição de Etanol à DAFC 51 A.1 Resultados obtidos para as concentrações das misturas de 2 M, 3 M e 7 M ... 51
A.2 Variação da concentração para uma solução de 100% metanol ... 58
Apêndice B: Efeito da Configuração das Placas Coletoras 59 B.1 Estudo da configuração do ânodo ... 59
B.2 Estudo da configuração do cátodo ... 66
B.3 Configuração ótima ... 76
Apêndice C: Resultados Experimentais 77 C.1 Ensaios de 100% metanol com placa de 36 furos no ânodo e no cátodo ... 77
C.2 Ensaios de adição de etanol à DAFC ... 79
C.3 Ensaios da configuração da placa coletora no ânodo ... 83
C.4 Ensaios da configuração da placa coletora no cátodo ... 87
Índice de Figuras
Figura 2.1 - Esquema de funcionamento geral de uma célula de combustível. ...4
Figura 2.2 - Curva de polarização de uma célula de combustível. ...5
Figura 2.3 – Esquema de uma curva de polarização típica de uma DAFC. ... 10
Figura 2.4 - Camadas constituintes da MEA de uma célula de combustível. ... 11
Figura 2.5 - Gráfico de Nyquist típico de uma DAFC. ... 20
Figura 2.6 - Circuito elétrico equivalente de uma DAFC passiva. ... 21
Figura 2.7 - Aplicações de DAFCs (Toshiba, Mobion, Yamaha). ... 22
Figura 3.1 - Representação das diferentes camadas que constituem uma DAFC passiva... 23
Figura 3.2 - DAFC passiva utilizada nos testes experimentais. ... 24
Figura 3.3 - Placas de fecho e isoladoras unidas: à esquerda as do ânodo e à direita as do cátodo. .... 24
Figura 3.4 - Placas coletoras testadas na DAFC. ... 25
Figura 3.5 - Redes metálicas testadas na DAFC. ... 25
Figura 3.6 - Membrana e camadas catalíticas integradas. ... 26
Figura 3.7 - Camadas difusoras: à esquerda a do ânodo (com MPL) e à direita a do cátodo. ... 27
Figura 3.8 - Estação de teste Zahner à esquerda e software Thales à direita. ... 27
Figura 4.1 – Circuito elétrico utilizado na técnica EIS. ... 30
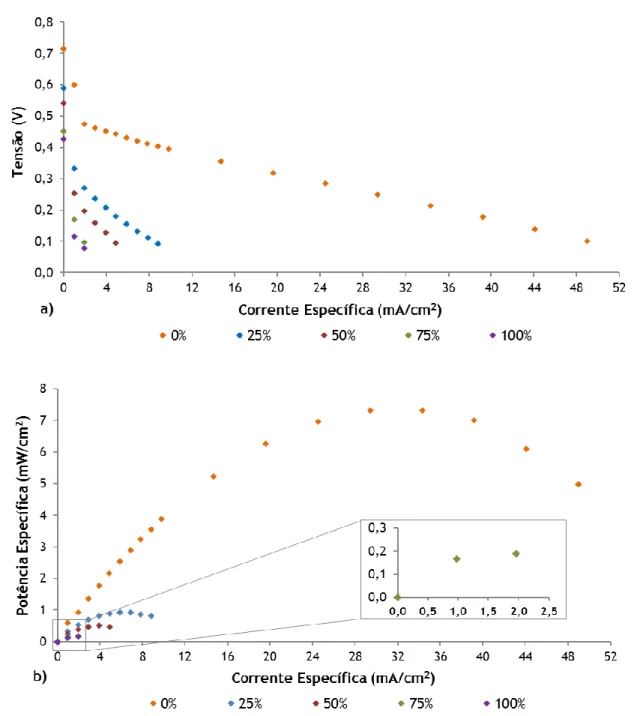
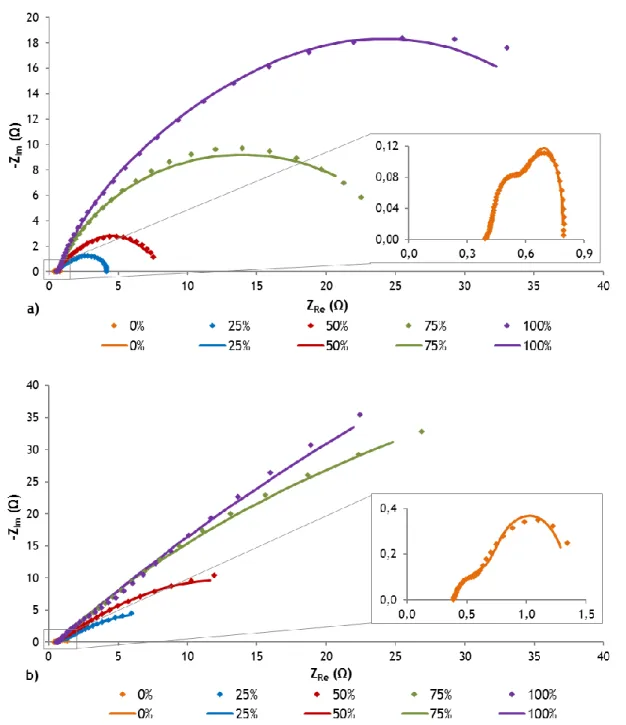
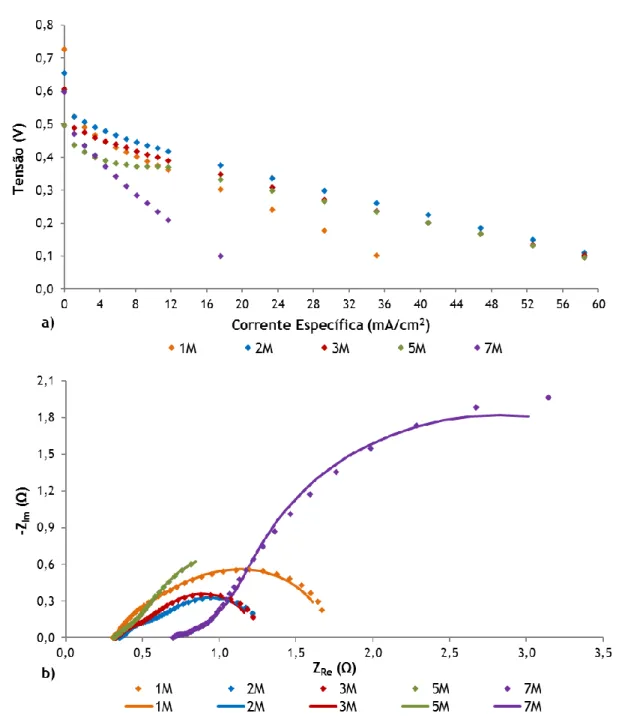
Figura 4.2 – Efeito da adição de etanol na a) tensão da célula e b) potência específica, para uma concentração da mistura de 5 M. ... 32
Figura 4.3 – Efeito da adição de etanol da técnica EIS operando à voltagem de a) 0,2 V e b) 0,4 V, para uma concentração da mistura de 5 M. ... 33
Figura 4.4 - Efeito da concentração de solução de metanol na a) tensão da célula e b) EIS a 0,4 V. ... 35
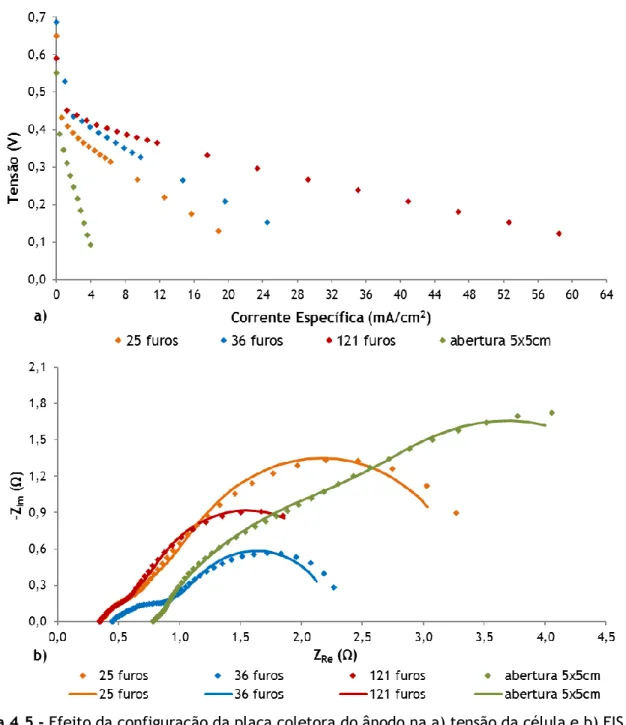
Figura 4.5 - Efeito da configuração da placa coletora do ânodo na a) tensão da célula e b) EIS a 0,4 V, para uma concentração de 3 M... 38
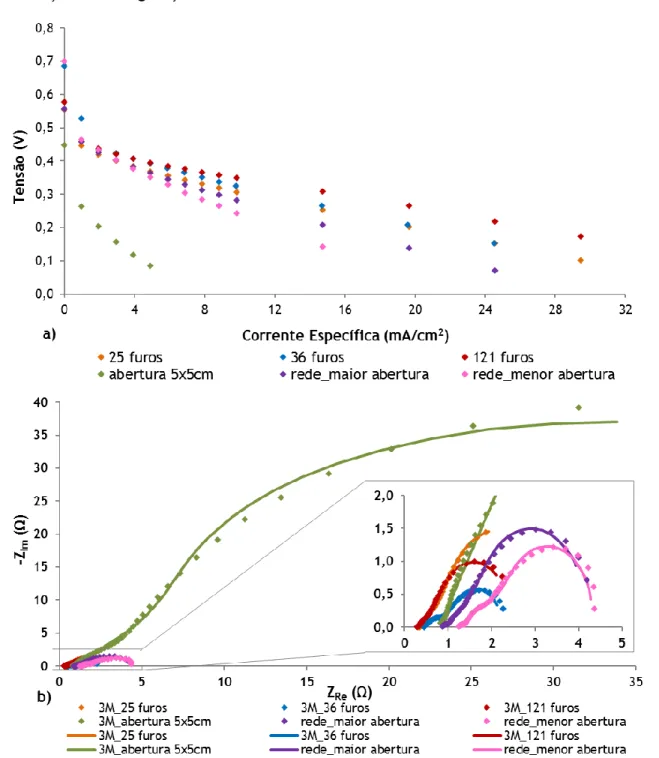
Figura 4.6 - Efeito da configuração da placa coletora do cátodo na a) tensão da célula e b) EIS a 0,4 V, para uma concentração de 3 M... 40
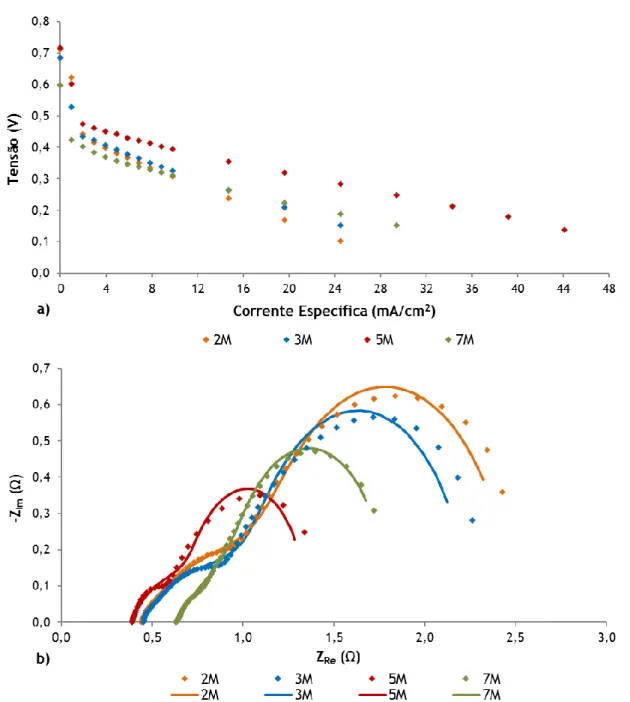
Figura 4.7 - Efeito da concentração de metanol na a) tensão da célula e b) EIS a 0,4 V, com a placa de 121 furos no ânodo e no cátodo. ... 42
Figura 4.8 – Tensão da célula em função do tempo. ... 44
Figura 4.9 – Espectro de impedância para 0,2 V e 0,4 V, no início e no fim do teste de durabilidade à DAFC. ... 44
Figura A.1 – Efeito da adição de etanol na a) tensão da célula e b) potência específica, para uma concentração da mistura de 2 M. ... 51 Figura A.2 – Efeito da adição de etanol através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração da mistura de 2 M. ... 52 Figura A.3 – Efeito da adição de etanol na a) tensão da célula e b) potência específica, para uma concentração da mistura de 3 M. ... 53 Figura A.4 – Efeito da adição de etanol através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração da mistura de 3 M. ... 54 Figura A.5 – Efeito da adição de etanol na a) tensão da célula e b) potência específica, para uma concentração da mistura de 7 M. ... 55 Figura A.6 – Efeito da adição de etanol através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração da mistura de 7 M. ... 56 Figura A.7 – Curvas de polarização das quatro concentrações testadas para uma solução de 100% metanol... 58 Figura A.8 – EIS operando à voltagem de 0,2 V para as quatro concentrações testadas, para uma solução de 100% metanol. ... 58 Figura B.1 – Curvas de potência para as diferentes configurações de placas coletoras do ânodo,
testadas para 3 M. ... 59 Figura B.2 – Efeito da placa coletora do ânodo através da técnica EIS operando com uma voltagem de 0,2 V, para uma concentração de 3 M. ... 59 Figura B.3 – Efeito da placa coletora anódica na a) tensão da célula e b) potência específica, para as concentrações de 1 M e 2 M. ... 60 Figura B.4 – Efeito da placa coletora do ânodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 1 M. ... 61 Figura B.5 – Efeito da placa coletora do ânodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 2 M. ... 62 Figura B.6 – Efeito da placa coletora do ânodo na a) tensão da célula e b) potência específica, para uma concentração de 5 M. ... 63 Figura B.7 – Efeito da placa coletora do ânodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 5 M. ... 64 Figura B.8 – Efeito da placa coletora do cátodo na a) tensão da célula e b) potência específica, para uma concentração de 1 M. ... 66 Figura B.9 – Efeito da placa coletora do cátodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 1 M. ... 67
Figura B.10 – Efeito da placa coletora do cátodo na a) tensão da célula e b) potência específica, para uma concentração de 2 M. ... 68 Figura B.11 – Efeito da placa coletora do cátodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 2 M. ... 69 Figura B.12 – Efeito da placa coletora do cátodo na potência específica, para uma concentração de 3 M. ... 70 Figura B.13 – Efeito da placa coletora do cátodo através da técnica EIS operando à voltagem de 0,2 V, para uma concentração de 3 M... 70 Figura B.14 – Efeito da placa coletora do cátodo na a) tensão da célula e b) potência específica, para uma concentração de 5 M. ... 71 Figura B.15 – Efeito da placa coletora do cátodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para uma concentração de 5 M. ... 72 Figura B.16 – Efeito da placa coletora do cátodo na a) tensão da célula e b) potência específica, para as concentrações de 7 M e 9 M. ... 73 Figura B.17 – Efeito da placa coletora do cátodo através da técnica EIS operando com uma voltagem de a) 0,2 V e b) 0,4 V, para as concentrações de 7 M e 9 M. ... 74 Figura B.18 – Curvas de potência específica para as diferentes concentrações, com a placa de 121 furos no ânodo e no cátodo. ... 76 Figura B.19 – EIS operando à voltagem de 0,2 V, para a placa de 121 furos no ânodo e no cátodo. ... 76
Índice de Tabelas
Tabela 2.1 – Tipos de células de combustível e principais características. ...7
Tabela 2.2 - Parâmetros termodinâmicos para duas DAFCs. ... 13
Tabela 3.1 - Características das placas e redes coletoras testadas. ... 26
Tabela 3.2 - Especificações das camadas de difusão. ... 27
Tabela 3.3 - Volumes pipetados de álcool para diferentes concentrações. ... 28
Tabela 4.1 – Resistências e potência específica máxima obtidas para as diferentes misturas de metanol e etanol, para uma concentração de 5M. ... 34
Tabela 4.2 – Resistências e potência específica máxima obtidas para as diferentes concentrações de solução de metanol... 36
Tabela 4.3 – Resistências e potência específica máxima obtidas para as diferentes configurações de placas coletoras no ânodo, para uma concentração de 3 M. ... 39
Tabela 4.4 – Resistências e potência específica máxima obtidas para as diferentes configurações de placas coletoras no cátodo, para uma concentração de 3 M. ... 41
Tabela 4.5 – Resistências e potência específica máxima obtidas para as diferentes concentrações de metanol, com a placa de 121 furos no ânodo e no cátodo. ... 43
Tabela 4.6 – Resistências obtidas no início e no fim do teste de durabilidade na DAFC. ... 45
Tabela A.1 – Resistências e potência específica máxima obtidas para as misturas de metanol e etanol, para as concentrações de 2 M, 3 M e 7 M. ... 57
Tabela B.1 – Resistências e potência específica máxima obtidas para as diferentes configurações de placas no ânodo, para 1 M, 2 M e 5 M. ... 65
Tabela B.2 – Resistências e potência específica máxima obtidas para as diferentes configurações de placas coletoras no cátodo, para 1 M, 2 M, 5 M, 7 M e 9 M. ... 75
Tabela C.1 – Resultados obtidos para as concentrações de metanol de 1 M, 2 M e 3 M, com a placa de 36 furos no ânodo e no cátodo. ... 77
Tabela C.2 – Resultados obtidos para as concentrações de metanol de 5 M e 7 M, com a placa de 36 furos no ânodo e no cátodo. ... 78
Tabela C.3 – Resultados obtidos para as diferentes percentagens volúmicas de etanol adicionadas ao ânodo, para uma concentração da mistura de 2 M. ... 79
Tabela C.4 – Resultados obtidos para as diferentes percentagens volúmicas de etanol adicionadas ao ânodo, para uma concentração da mistura de 3 M. ... 80
Tabela C.5 – Resultados obtidos para as diferentes percentagens volúmicas de etanol adicionadas ao ânodo, para uma concentração da mistura de 5 M. ... 81
Tabela C.6 – Resultados obtidos para as diferentes percentagens volúmicas de etanol adicionadas ao ânodo, para uma concentração da mistura de 7 M. ... 82 Tabela C.7 – Resultados obtidos para as concentrações de 1 M e 2 M, com a placa de 25 furos no ânodo. ... 83 Tabela C.8 – Resultados obtidos para as concentrações de 3 M e 5 M, com a placa de 25 furos no ânodo. ... 84 Tabela C.9 – Resultados obtidos para as concentrações de 1 M e 2 M, com a placa de 121 furos no ânodo. ... 85 Tabela C.10 – Resultados obtidos para as concentrações de 3 M e 5 M, com a placa de 121 furos no ânodo. ... 86 Tabela C.11 – Resultados obtidos para as concentrações de 1 M e 2 M, com a placa de abertura 5x5 cm no ânodo. ... 86 Tabela C.12 – Resultados obtidos para as concentrações de 3 M e 5 M, com a placa de abertura 5x5 cm no ânodo. ... 87 Tabela C.13 – Resultados obtidos para as concentrações de 1 M e 2 M, com a placa de 25 furos no cátodo. ... 87 Tabela C.14 – Resultados obtidos para as concentrações de 3 M e 5 M, com a placa de 25 furos no cátodo. ... 88 Tabela C.15 – Resultados obtidos para as concentrações de 1 M, 2 M e 3 M, com a placa de 121 furos no cátodo. ... 89 Tabela C.16 – Resultados obtidos para as concentrações de 5 M, 7 M e 9 M, com a placa de 121 furos no cátodo. ... 90 Tabela C.17 – Resultados obtidos para as concentrações de 1 M, 2 M e 3 M, com a placa de abertura 5x5 cm no cátodo. ... 90 Tabela C.18 – Resultados obtidos para as concentrações de 1 M, 2 M e 3 M, com a rede de maior abertura no cátodo. ... 91 Tabela C.19 – Resultados obtidos para as concentrações de 5 M e 7 M, com a rede de maior abertura no cátodo. ... 92 Tabela C.20 – Resultados obtidos para as concentrações de 1 M, 2 M e 3 M, com a rede de menor abertura no cátodo. ... 93 Tabela C.21 – Resultados obtidos para as concentrações de 5 M e 7 M, com a rede de menor abertura no cátodo. ... 93 Tabela C.22 – Resultados obtidos para as concentrações de 1 M, 2 M e 3 M, com a placa de 121 furos no ânodo e no cátodo. ... 94
Tabela C.23 – Resultados obtidos para as concentrações de 5 M e 7 M, com a placa de 121 furos no ânodo e no cátodo. ... 95
Notação e Glossário
Letras Gregas
Δ Variação
n Número de Eletrões
ø Diâmetro
η Eficiência Elétrica Total
ηrev Eficiência Termodinâmica
ηvoltagem Eficiência da Tensão
ηcombustível Eficiência de Combustível
Lista de Siglas
AC Corrente Alternada
AFC Célula de Combustível Alcalina
DAFC Célula de Combustível com alimentação Direta de Álcool DEFC Célula de Combustível com alimentação Direta de Etanol DMFC Célula de Combustível com alimentação Direta de Metanol EIS Espectroscopia de Impedância Eletroquímica
FC Célula de Combustível
FRA Analisador da Resposta de Frequência MCFC Célula de Combustível de Carbonato Fundido MEA Membrane Electrode Assembly
MFC Célula de Combustível Microbiana
MPL Camada Microporosa
PAFC Célula de Combustível de Ácido Fosfórico
PEMFC Célula de Combustível de Membrana de Permuta Protónica PTFE Politetrafluoroetileno
Nomenclatura
C Capacitância (F)
CPE Elemento de Fase
F Constante de Faraday (C/mol)
i Corrente Específica (mA/cm2)
Iálcool Corrente devido ao Atravessamento do Álcool (A)
Icélula Corrente da Célula (A)
L Indutância (H)
P Potência Específica (mW/cm2)
R Resistência (Ω)
T Temperatura (K)
V Tensão (V)
Vcélula Tensão da Célula (V)
W Elemento Warburg
Wmáximo Trabalho Máximo (W) Wreal Trabalho Elétrico Real (W)
Z Impedância (Ω)
ZIm Impedância Imaginária (Ω)
ZRe Impedância Real (Ω)
ΔE Potencial de Equilíbrio Termodinâmico (V) ΔG Variação da Energia Livre de Gibbs (J/mol) ΔH Variação da Entalpia da Reação (J/mol) ΔS Variação da Entropia J/(mol.K)
1 Introdução
1.1 Enquadramento da Tese
Nos dias de hoje, o recurso à energia elétrica é uma constante, tendo-se tornado uma necessidade básica para a humanidade.
A energia é obtida maioritariamente da exploração de combustíveis fósseis, apresentando uma alta eficiência energética e custos baixos, quando comparados com outras fontes. Contudo, estes recursos são considerados não renováveis e apresentam diversos impactos negativos para o meio ambiente, como o aquecimento global, a destruição da camada de ozono e a formação de chuvas ácidas, devido à emissão de gases poluentes resultantes do processo de combustão. Estes inconvenientes têm incentivado ao estudo de formas alternativas de produção de energia, de modo a permitir um desenvolvimento sustentável da sociedade.
As células de combustível (FCs) surgem como uma alternativa promissora à produção de energia, de uma forma eficiente, renovável e com baixas emissões de poluentes, uma vez que convertem a energia química de um combustível diretamente em energia elétrica (1).
Esta tecnologia pode ser implementada em diversas áreas, nomeadamente nos meios de transporte e em aplicações estacionárias e portáteis. As células de combustível têm ainda a capacidade de integrar instalações de produção de energia renováveis, que apresentem um problema de intermitência das suas fontes (como por exemplo a energia eólica), assegurando a produção de energia necessária através destas células quando a fonte renovável principal não se encontra disponível.
O combustível mais utilizado nas FCs é o hidrogénio (H2), ao qual se atribui um papel
energético alternativo à utilização desmedida de petróleo e gás natural. O hidrogénio molecular apresenta um elevado potencial energético, contudo não se encontra diretamente disponível na natureza, sendo produzido através de compostos que contêm o elemento hidrogénio na sua constituição. O principal problema deste combustível é o seu armazenamento, devido à sua baixa densidade volumétrica, o que constitui um grande desafio.
Como alternativa, surgem as células de combustível com alimentação direta de álcool (DAFCs), onde o combustível é um líquido e que oferecem elevada densidade energética. O recurso a álcoois facilita o armazenamento, manuseamento e distribuição do combustível, uma vez que este se encontra no estado líquido à temperatura e pressão ambiente (2).
No entanto, as DAFCsapresentam velocidades de oxidação baixas no ânodo, originando perdas de ativação e sobrepotenciais elevados. A membrana é permeável ao combustível e existe passagem do mesmo do ânodo para o cátodo, devido ao gradiente de concentração gerado entre ambos os lados, e que afeta negativamente o desempenho da célula (2).
Até há pouco tempo, o álcool mais utilizado era o metanol, que possui elevadas densidades energéticas, tendo sido realizados vários estudos que permitiram o desenvolvimento das células de combustível com alimentação direta de metanol (DMFCs). Contudo, este álcool é considerado tóxico, é não renovável e apresenta elevadas taxas de crossover através da membrana.
O etanol aparece como um álcool alternativo ao metanol, uma vez que pode ser produzido de forma renovável, apresenta menor toxicidade e um menor crossover, devido ao tamanho da sua molécula ser superior. Deste modo, como alternativa, surgem as células de combustível com alimentação direta de etanol (DEFCs).
Apesar dos vários desenvolvimentos nesta área das DAFCs, existem ainda diversos parâmetros, quer operacionais quer configuracionais, a explorar de modo a otimizar o desempenho destas FCs.
1.2 Objetivos da Tese
Os objetivos principais deste trabalho foram estudar a influência das condições operatórias (concentração de metanol e diferentes misturas de metanol e etanol) e dos parâmetros configuracionais (diferentes configurações das placas coletoras) no desempenho de uma célula de combustível de álcool, com vista à sua otimização e tentativa de redução de custos. Através da análise dos resultados experimentais, foram propostas novas soluções de desempenho e configuração, de modo a contribuir para o desenvolvimento de células de combustível mais eficientes.
Com as condições ótimas encontradas, foi realizado um teste de durabilidade à célula de combustível, por forma a avaliar o seu desempenho ao longo do tempo.
1.3 Organização da Tese
Esta dissertação encontra-se organizada em seis capítulos principais. O capítulo 1 apresenta uma perspetiva geral do tema, bem como os objetivos do trabalho.
O capítulo 2 é dedicado às células de combustível, apresentando uma perspetiva histórica e uma breve descrição dos diferentes tipos de células de combustível existentes. O foco é nas células de combustível passivas com alimentação direta de álcool, nomeadamente as de metanol e as de etanol, descrevendo o seu princípio de funcionamento, os seus constituintes,
os princípios termodinâmicos inerentes e a sua aplicabilidade. Neste capítulo é ainda apresentado o método de espectroscopia de impedância eletroquímica, como técnica de diagnóstico nas células de combustível.
O Capítulo 3 refere-se à parte experimental, onde se descreve os diferentes componentes da DAFC, a instalação utilizada e o procedimento experimental adotado nos diferentes testes. No Capítulo 4 são apresentados e discutidos os resultados das experiências efetuadas, com base nas curvas de polarização e potência e nos espectros de impedância.
No capítulo 5 apresentam-se as principais conclusões obtidas dos estudos realizados. Por fim, no capítulo 6 são apresentadas sugestões para trabalhos futuros.
2 Contexto e Estado da Arte
2.1 Células de Combustível
As células de combustível convertem a energia química de um combustível alimentado à célula diretamente em energia elétrica, emitindo quantidades desprezáveis de poluentes, o que torna esta tecnologia limpa e uma alternativa sustentável à produção de energia (1).
Diversos estudos têm sido realizados nesta área, de modo a tornar as FCs numa tecnologia de produção energética eficiente, com vista às suas diversas aplicações.
Uma célula de combustível é constituída por dois elétrodos, o ânodo e o cátodo, separados por um eletrólito (Figura 2.1). No ânodo, ocorre a oxidação do combustível alimentado, produzindo iões e eletrões. Os iões são transportados para o lado do cátodo através do eletrólito e os eletrões são conduzidos por um circuito elétrico externo, gerando corrente elétrica. Ao cátodo chegam também os eletrões, ocorrendo neste elétrodo a redução do oxidante alimentado (oxigénio), formando-se água (H2O) (3).
No processo global há, então, produção de energia elétrica, de acordo com o circuito externo de eletrões, e ainda água e calor (3).
Figura 2.1 - Esquema de funcionamento geral de uma célula de combustível (4).
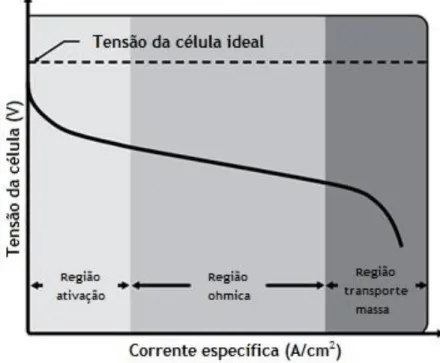
O desempenho de uma célula de combustível pode ser caracterizado através da sua curva de polarização, que representa a tensão (V) da FC em função da corrente específica (i). A intensidade de corrente é normalizada pela área ativa da célula (área aberta à entrada do combustível), permitindo a comparação entre células de diferentes dimensões.
Idealmente, com o aumento da intensidade da corrente, a tensão da célula deveria permanecer constante e igual ao valor de equilíbrio, conhecido pelos princípios termodinâmicos das respetivas reações. No entanto, ao longo da curva de polarização, a
tensão da célula vai decrescendo com o aumento da corrente, devido a perdas que vão ocorrendo ao longo do processo: perdas de ativação, ohmicas e massa (Figura 2.2). As perdas de ativação, ocorrem para baixas correntes específicas e estão relacionadas com a cinética das reações eletroquímicas; as perdas ohmicas estão associadas à resistência ao transporte de cargas; e as perdas de massa, que ocorrem para elevadas correntes específicas, são devido a limitações à difusão das diferentes espécies (5).
Figura 2.2 - Curva de polarização de uma célula de combustível.
2.1.1 Perspetiva Histórica
A descoberta da conversão da energia química em energia elétrica foi importante para a evolução de certas tecnologias, sendo considerada como um sonho para os cientistas há muito tempo atrás. No início do século XIX, os contributos de Alessandro Volta (com o princípio da bateria) e de Michael Faraday (com a formulação dos princípios de conversão eletroquímica, conhecidas como Leis de Faraday), permitiram desenvolver os princípios de funcionamento das células de combustível, por parte de Christian Friedrich Schönbein e William Robert Grove (1).
Em 1842, Grove apresentou o conceito de célula de combustível de hidrogénio, ao descobrir que se gerava corrente contínua entre dois elétrodos em contacto com hidrogénio e oxigénio, separadamente, mergulhados parcialmente numa solução de ácido sulfúrico (que desempenhava a função de eletrólito) (1,6).
Em 1893, Friedrich Wilhelm Ostwald, determinou experimentalmente a interconexão dos vários constituintes da FC, nomeadamente elétrodos, eletrólito, agentes oxidantes e redutores, aniões e catiões. Com alguns desenvolvimentos posteriores, em 1896, surgiu a
primeira célula de combustível com aplicações práticas, desenvolvida por William W. Jacques. Mond and Langer introduziram o carvão como fonte de hidrogénio para fornecimento às células de combustível, contrariando os argumentos de Grove, que defendia o hidrogénio puro como combustível (6).
No início do século XX, com o aumento do recurso à eletricidade, a obtenção de energia elétrica a partir da energia química ganhou importância. Contudo, as fontes energéticas convencionais continuavam abundantes e baratas (7). Nos anos seguintes, vários progressos
foram introduzidos nesta área, nomeadamente nos diferentes tipos de células de combustível, como alcalinas, de ácido fosfórico, entre outros; novos materiais para os constituintes da FC; e combinação de várias células, stacks; sempre com vista a aliar uma elevada eficiência e baixas emissões para a atmosfera (6).
Uma aplicação com sucesso das FCs foi na área espacial, com um dispositivo que assegurava a produção de eletricidade, calor e água para o sistema (7). Entre 1960 e 1965, com a utilização
de célula de combustível alcalina no programa espacial Apollo da NASA, deu-se início a uma nova era para as FCs.
Em 1990, o laboratório da NASA, em conjunto com a Universidade do Sul da Califórnia, desenvolveu uma célula com alimentação de metanol (6).
Atualmente, o conceito das FCs tem aplicações em diversas áreas e diferentes estudos continuam a ser realizadas, de modo a obter um elevado desempenho das células de combustível.
2.1.2 Tipos de Células de Combustível
As células de combustível são, usualmente, classificadas de acordo com o eletrólito que as constitui, com exceção das DAFCs, cuja designação é baseada no combustível alimentado (7).
As FCs também podem ser designadas de acordo com a sua temperatura de operação, havendo desta forma, as de baixa e alta temperatura.
Incluídas nas células de baixa temperatura, estão as Células de Combustível Alcalinas (AFCs), de Membrana de Permuta Protónica (PEMFCs), de Ácido Fosfórico (PAFCs), com alimentação Direta de Álcool (DAFCs) e Microbianas (MFCs).
No que diz respeito às FCs de elevada temperatura, com uma gama de operação entre 500 °C e 1000 °C, encontram-se as de Carbonato Fundido (MCFC) e as de Óxido Sólido (SOFC) (7).
Na Tabela 2.1, apresentam-se resumidamente os diferentes tipos de células, bem como as suas principais características.
Tabela 2.1 – Tipos de células de combustível e principais características (1,5,6,7).
Tipo de Célula de
Combustível Eletrólito Transportador de Cargas
Temperatura de Operação (ºC) Combustível Rendimento Elétrico (%) Alcalina (AFC) KOH OH - 60 - 200 H 2 puro 35 - 55 Membrana de Permuta Protónica (PEMFC)
Polímero sólido H+ 20 - 100 H2 puro
(tolera o CO2) 35 - 45 Ácido Fosfórico
(PAFC) Ácido fosfórico H
+ ≈200 H2 puro (tolera o CO2 e CO a ≈1%) 40 Alimentação Direta de Álcool (DAFC)
Polímero sólido H+ 20 - 100 Álcool
(tolera o CO2) 30 - 40 Microbiana (MFC) Polímero sólido H + 5 - 50 Compostos Orgânicos 20 - 30 Carbonato Fundido (MCFC) Carbonato de potássio e de lítio CO32- ≈650 H2, CO, CH4 (tolera o CO2) >50 Óxido Sólido (SOFC) Óxido sólido (ytria, zircónia) O2 - ≈1000 H2, CO, CH4 (tolera o CO2) >50
2.2 Células de Combustível com alimentação Direta de Álcool (DAFCs)
Nos últimos anos, a procura de alternativas sustentáveis à produção de energia tem sido cada vez maior. As células de combustível com alimentação direta de álcool representam uma robusta alternativa às baterias convencionais utilizadas em aplicações portáteis e em unidades auxiliares de produção de energia, uma vez que oferecem densidades energéticas superiores. Além disso, a utilização de um combustível líquido facilita o seu transporte, armazenamento e manuseamento, os principais problemas quando se opta por células de combustível que usam hidrogénio como combustível (PEMFCs).
Esta tecnologia assemelha-se estruturalmente às células de combustível PEM, tornando-se uma particularidade desse tipo de células (8).
Tal como as PEMFCs, as DAFCs utilizam, como eletrólito, uma membrana polimérica condutora de protões, o ião hidrogénio como transportador de carga e são consideradas células de baixa temperatura, uma vez que a sua temperatura de operação é inferior a 100 ºC. Esta tecnologia tem a possibilidade de atingir elevadas potências específicas e uma rápida resposta.
Ao cátodo pode ser alimentado ar atmosférico, uma vez que as DAFCs são tolerantes ao CO2
presente no ar. Neste elétrodo, o produto principal da reação é a água.
Em termos de custos, estas são dispendiosas, devido aos materiais utilizados, nomeadamente os metais nobres, como a platina e o ruténio, que são usados como catalisador e o polímero sólido que é utilizado como membrana (6).
Esta tecnologia é bastante promissora para implementação em sistemas portáteis, apesar de ainda possuir alguns problemas, como as lentas cinéticas das reações eletroquímicas e o atravessamento de combustível através da membrana, que necessitam de ser ultrapassados.
2.2.1 Classificação quanto à forma de Alimentação
Nas células de combustível com alimentação de álcool, o método de fornecimento do combustível e do oxidante aos dois compartimentos da célula, ânodo e cátodo, pode classificar a célula em ativa ou passiva.
No modo ativo, os reagentes são introduzidos no sistema com o auxílio de bombas ou ventiladores, enquanto que, num sistema passivo, a alimentação é realizada por difusão e convecção natural, onde o álcool é colocado num reservatório no ânodo e o cátodo se encontra aberto para o meio ambiente (9).
Comparando os dois modos de operação, normalmente, uma célula ativa apresenta um melhor desempenho, uma vez que permite operar a célula nas condições ótimas relativamente ao fluxo dos reagentes, no entanto, apresenta densidades energéticas inferiores, visto necessitar de um input de energia para os dispositivos auxiliares de fornecimento dos reagentes. Contudo, uma DAFC passiva possui uma estrutura mais simples e compacta, não necessitando de energia externa para funcionar, o que facilita a sua implementação em dispositivos portáteis. Em termos económicos, o modo ativo exige custos mais elevados, com base nos equipamentos auxiliares de fornecimento do combustível e do ar (9,10).
Existem também células que usam um dispositivo auxiliar para fornecer o combustível ao ânodo, mas que do lado do cátodo operam passivamente, sendo desta forma designadas por células semipassivas (11).
Uma vez que as DAFCs passivas se apresentam como a tecnologia ideal para substituir as baterias convencionais nos dispositivos portáteis, estas foram o alvo de estudo do presente trabalho e as subsecções e os capítulos seguintes são referentes a uma célula de combustível com alimentação direta e passiva de álcool.
2.2.2 Princípio de Funcionamento
Uma DAFC tem a capacidade de converter a energia química de um álcool diretamente em energia elétrica, através de processos eletroquímicos.
Uma solução aquosa de álcool é alimentada ao ânodo, ocorrendo a sua oxidação, após se difundir pela camada difusora e atingir a camada catalítica, convertendo-se em dióxido de carbono, protões e eletrões. O dióxido de carbono emerge sobre a forma de bolhas no ânodo e é removido com o fluxo de metanol que flui para o exterior, uma vez que a membrana é praticamente impermeável aos gases. No que diz respeito aos protões e aos eletrões, estes são transportados para o lado do cátodo, através da membrana e do circuito elétrico externo, respetivamente.
No cátodo, que se encontra aberto ao ar, o oxigénio, ao atingir a camada catalítica, sofre redução por combinação com os eletrões e protões, formando água. A água produzida tem tendência a difundir-se para o cátodo, no entanto, em algumas situações específicas, difunde-se também para o lado do ânodo, back diffusion (12).
A curva de polarização de uma DAFC permite caracterizar o seu desempenho, com base na tensão da célula em função da corrente específica. Uma célula ideal conseguiria suportar diferentes correntes, mantendo a tensão constante, tensão esta determinada pela termodinâmica. No entanto, numa FC real, a tensão diminui com o aumento da corrente, devido a perdas irreversíveis que ocorrem no decorrer do seu funcionamento: ativação, ohmicas e concentração e, neste caso específico, perdas por crossover (Figura 2.3).
Tal como se pode verificar na Figura 2.3, inicialmente, verifica-se uma queda de tensão da célula, que é justificado pelo atravessamento do álcool sem reagir através da membrana do ânodo para o cátodo. Este fenómeno é denominado de crossover e ocorre devido ao facto da membrana não ser totalmente impermeável ao combustível e devido ao gradiente de concentração que se gera entre os dois lados da célula. Existem também perdas por ativação, que se relacionam com a cinética das reações eletroquímicas, nomeadamente pelas cinéticas lentas de oxidação do álcool e redução do oxigénio. Outras perdas típicas são as ohmicas, associadas à resistência ao transporte de carga, particularmente eletrões e iões H+. Para além
das já referidas, tem-se ainda perdas de concentração, devido às resistências à transferência de massa.
As perdas de ativação têm um maior efeito na diminuição da eficiência da célula para altas tensões e baixas correntes específicas. Numa fase intermédia de operação, as perdas ohmicas são as predominantes, decrescendo a tensão da célula de forma praticamente linear. Para elevadas correntes específicas, as perdas de concentração são as perdas predominantes. Outra forma de avaliar o desempenho da FC é através da sua curva de potência específica, que representa a potência específica (P) em função da corrente específica.
Figura 2.3 – Esquema de uma curva de polarização típica de uma DAFC.
2.2.3 Constituintes da DAFC
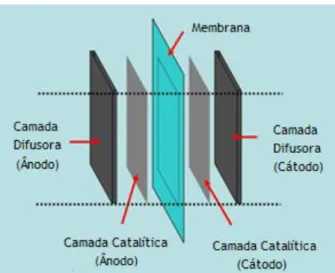
Uma célula de combustível com alimentação direta de álcool tem como componente central uma membrane electrode assembly (MEA), formada pelo conjunto membrana/elétrodos entre os dois lados da célula, o ânodo e o cátodo. A MEA apresenta no seu interior uma membrana polimérica, e de cada um dos seus lados, uma camada catalítica (onde ocorrem as reações) e uma camada difusora (que assegura a distribuição das diferentes espécies) (Figura 2.4). De ambos os lados da MEA encontram-se ainda placas coletoras, que asseguram a recolha e transporte dos eletrões (13).
Figura 2.4 - Camadas constituintes da MEA de uma célula de combustível.
Nas DAFCs, a membrana utilizada é do tipo PEM, uma membrana de permuta protónica, normalmente feita de Nafion. Esta membrana deve apresentar elevada condutividade aos protões; estabilidade química e mecânica; baixa permeabilidade ao combustível e reagentes gasosos; e ainda baixo custo. O principal problema da utilização destas membranas é o facto de deixarem atravessar, através dos seus poros, combustível e água, proporcionando perdas de combustível e inundação do cátodo da célula, o que leva a uma diminuição do seu desempenho. A solução pode passar por aumentar a espessura da membrana, o que, por sua vez, tem implicações no transporte dos iões. Estudos indicam que a melhor espessura é a intermédia, sendo as mais utilizadas as de Nafion 115 e 117 (12).
Nas superfícies das camadas catalíticas do ânodo e do cátodo ocorrem as devidas reações eletroquímicas, sendo necessário assegurar que os reagentes alcancem os centros ativos dos catalisadores. Tipicamente, o catalisador do ânodo é platina-ruténio (Pt-Ru) e do cátodo é platina (Pt), com cargas de catalisador de aproximadamente 4 mg/cm2.
No que diz respeito às camadas difusoras, estas desempenham um papel muito importante no funcionamento da célula. Estas devem assegurar: a distribuição dos reagentes até à área ativa do catalisador, a remoção dos produtos das reações, a condução dos eletrões e a remoção do calor produzido. Desta forma, as camadas difusoras devem ser porosas e apresentar propriedades condutoras elétricas e térmicas. Os materiais que costumam ser utilizados são compostos por fibras de carbono, nomeadamente papel de carbono e tecido de carbono. O tecido de carbono é mais poroso e menos tortuoso do que o papel de carbono, no entanto, a sua condutividade não é tão boa. No cátodo, a camada difusora, por vezes, é tratada com politetrafluoroetileno (PTFE), por forma a atribuir um caráter hidrofóbico ao material, de modo a remover a água em excesso e evitar o encharcamento do cátodo. Pelo contrário, no ânodo, a camada pode ser tratada com óxidos metálicos, por forma a assegurar as suas características hidrofílicas (14).
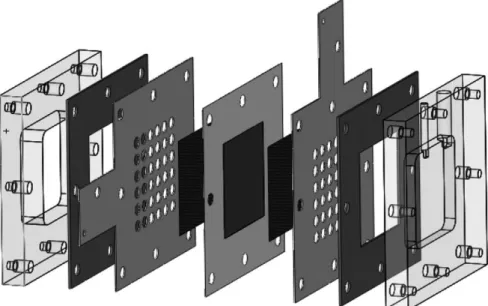
Junto a cada camada difusora, encontra-se uma placa coletora, que assegura a recolha e transporte dos eletrões, o transporte dos reagentes através dos canais de fluxo/furos e ainda a remoção dos produtos. As placas coletoras podem ter diferentes geometrias e devem ser feitas de materiais com elevada condutividade (tipicamente, aço inoxidável ou cobre banhado a ouro).
Um último componente da célula de combustível, é uma placa de acrílico, também designada de placa de fecho, colocada em cada extremidade da célula e que confere consistência estrutural às outras camadas. Uma vez que se trata de uma célula passiva, a placa anódica contém um reservatório para colocação do álcool, enquanto que a catódica apresenta-se aberta para o meio ambiente, por forma a permitir a entrada do oxigénio.
2.2.4 Princípios Termodinâmicos
Com base na termodinâmica, é possível especificar e quantificar a energia química que é transformada em elétrica, permitindo teoricamente estimar o potencial químico máximo que uma célula de combustível ideal conseguiria atingir.
O potencial de equilíbrio termodinâmico (∆E) de uma DAFC pode ser determinado da seguinte forma (15):
∆E = - ∆G
nF = -
∆H-T ∆S
nF (2.1)
onde ∆G corresponde à variação da energia livre de Gibbs, ∆H à variação da entalpia da reação, ∆S à variação de entropia do sistema, T à temperatura de operação, n ao número de eletrões envolvidos e F à constante de Faraday (96 485 C/mol).
Em termos de eficiência termodinâmica da célula de combustível, esta pode ser definida como a razão entre o trabalho elétrico máximo e a energia química total (Equação 2.2). Mesmo analisando para a condição ideal, tem-se em consideração que a eficiência não será 100%, uma vez que apenas a energia útil do sistema será participativa na transformação de energia, correspondendo à eficiência termodinâmica reversível da FC (ηrev).
ηrev = ∆G ∆H = -
n F∆E
∆H (2.2) Na Tabela 2.2, encontram-se os parâmetros termodinâmicos de duas células de combustível com alimentação direta de álcool, nomeadamente DMFC (célula de combustível com alimentação direta de metanol) e DEFC (célula de combustível com alimentação direta de etanol), para uma temperatura e pressão de 25 ºC e 1 atm, respetivamente.
Tabela 2.2 - Parâmetros termodinâmicos para duas DAFCs (16).
∆G (kJ/kg) ∆H (kJ/kg) n ∆E (V) ηrev
DMFC -704 -727 6 1,21 0,97 DEFC -1327 -1368 12 1,15 0,97
Relativamente à eficiência real, esta é inferior à eficiência reversível, devido às perdas de tensão e de combustível que ocorrem nestas células e mencionadas anteriormente. A eficiência correspondente à tensão (ηvoltagem) relaciona o trabalho elétrico real (Wreal) e o trabalho máximo possível (Wmáximo), que pode ser traduzido pela razão entre a tensão real de operação da célula (Vcélula) e a tensão máxima estimada pela termodinâmica:
ηvoltagem = WWreal máximo = - nFVcélula ∆G = - nFVcélula - nF∆E = Vcélula ∆E (2.3) A eficiência relativa ao combustível (ηcombustível), devido ao atravessamento de álcool para o cátodo, pode ser estimada do seguinte modo:
ηcombustível = Icélula
Icélula + Iálcool (2.4)
correspondendo Icélula à corrente da célula e Iálcool à corrente provocada pelo atravessamento do álcool.
Assim, a eficiência elétrica total de uma DAFC (η) será determinada pela combinação das três eficiências:
η= ηrev ηvoltagem ηcombustível (2.5)
2.2.5 Combustíveis
Em termos de combustível, o álcool mais explorado nas DAFCs tem sido o metanol. Contudo, diferentes álcoois têm surgido com potencial para serem utilizados nestas células, nomeadamente álcoois primários e poliálcoois, por apresentarem baixa toxicidade, baixa volatilidade e alguns terem a capacidade de serem produzidos de forma renovável. Como exemplos atrativos tem-se o etanol, o glicerol e o etilenoglicol (17).
Nesta secção serão abordados e comparados o metanol e o etanol, dois álcoois promissores, bem como as suas tecnologias associadas, DMFCs e DEFCs.
2.2.5.1 Células de Combustível com alimentação Direta de Metanol (DMFCs)
As células de combustível com alimentação direta de metanol geram eletricidade com base nas reações de oxidação do metanol e de redução do oxigénio, recorrendo a uma membrana polimérica como eletrólito.
No ânodo ocorre a reação de oxidação do metanol, que apresenta uma cinética lenta, traduzida pela seguinte reação:
CH3OH + H2O → CO2 + 6 H+ + 6 e- (2.6)
Esta reação produz dióxido de carbono e gera seis eletrões e seis iões H+. O CO2 gera-se sobre
a forma de bolhas, e estas devem ser eficazmente removidas, por forma a não impedir o transporte de metanol para a zona reacional. Os eletrões são transferidos através do circuito externo e os protões através da membrana, atingindo o cátodo, onde simultaneamente, ocorre a redução do oxigénio, segundo a seguinte reação:
O2 + 4 H+ + 4 e- → 2 H2O (2.7)
Com esta reação há a produção de água, cuja gestão é um aspeto importante. A água é fundamental para a hidratação da membrana, de modo a assegurar uma boa condução dos protões, para além de ser consumida na oxidação do metanol. Contudo, uma presença excessiva de água no cátodo provoca a sua inundação, diminuindo o seu desempenho. Essa elevada quantidade de água no cátodo deve-se à sua formação na reação de redução que ocorre no cátodo, e à água que atravessa a membrana do ânodo para o cátodo.
Quer no mecanismo de oxidação catalítica do metanol quer no mecanismo de redução catalítica do oxigénio, estão envolvidas duas fases. Quanto ao primeiro, inicialmente tem-se a adsorção e desidrogenação do metanol, seguidos da oxidação irreversível das espécies de CO em CO2 (cujo oxigénio fornecido resulta da dissociação da água). Relativamente à redução do
oxigénio, primeiro dá-se a protonação do O2 (que determina a velocidade da reação) e em
seguida, as espécies adsorvidas são reduzidas a água (18). As equações seguintes representam o
mecanismo de ambas as reações:
Pt + CH3OH → Pt-COads + 4 H+ + 4 e- (2.8) Pt-COads + H2O → Pt + CO2 + 2 H+ + 2 e- (2.9)
Pt + O2 + H+ + e- → Pt-O2Hads (2.10)
Pt-O2Hads + 3 H+ + 3 e- ⇌ Pt + 2 H2O (2.11)
Com vista a solucionar o problema da adsorção de espécies intermédias no catalisador, melhorando o comportamento eletrocatalítico dos elétrodos, têm sido estudados possíveis materiais secundários que se possam combinar com a platina, por forma a minimizar a reação
de envenenamento e melhorar a reação de oxidação principal. A adsorção de OH na superfície da platina (um passo para a remoção do CO adsorvido) requer um elevado potencial, limitando a utilização de catalisador de platina puro no ânodo. A associação do segundo metal modifica as propriedades eletrónicas, proporcionando um aumento da adsorção de OH- a sobrepotenciais menores, e uma diminuição da força de adsorção das espécies secundárias (19).
Vários materiais têm assim sido investigados para serem associados à platina na atividade catalítica do ânodo, entre os quais se encontram o Ru (Ruténio), Os (Ósmio), Sn (Estanho), W (Tungsténio), Mo (Molibdénio), Ni (Níquel) e Rh (Ródio) (19,20).
O catalisador binário Pt-Ru tem sido o mais empregue no ânodo das DMFCs e a sua atividade catalítica depende da composição, morfologia, tamanho da partícula e relação atómica entre a platina e o ruténio. Em termos de mecanismo, a adsorção de espécies contendo oxigénio ocorre então no Ru, promovendo a oxidação dos compostos intermediários, a potenciais inferiores (19). Com o catalisador bimetálico Pt-Ru no ânodo, o mecanismo passa a ser o
seguinte:
Pt + CH3OH → Pt-COads + 4 H+ + 4 e- (2.12) Ru + H2O → Ru-OHads + H+ + e- (2.13) Pt-COads + Ru-OHads → Pt + Ru + CO2 + H+ + e- (2.14)
No cátodo, geralmente, a reação é catalisada por platina pura. Neste elétrodo, para além da redução do oxigénio, ocorre a oxidação do metanol que atravessou a membrana do ânodo para o cátodo, competindo ambas pelos mesmos centros ativos. A ocorrência da oxidação do metanol neste elétrodo origina um potencial misto que reduz o desempenho do cátodo e, consequentemente, o global da célula. Uma solução poderia passar pelo desenvolvimento de catalisadores que fossem inativos à oxidação do metanol (20).
As DMFCs deparam-se com vários desafios, como o atravessamento de metanol através da membrana, a remoção dos produtos da reação e a inundação de água no cátodo, que comprometem o desempenho da célula. No entanto, diferentes estudos têm vindo a ser realizados por forma a otimizar o seu desempenho.
O efeito da concentração de metanol alimentado à DMFC foi alvo de estudo, sendo que para altas concentrações de metanol, elevadas potências específicas seriam esperadas. Contudo, essas concentrações acarretam um aumento do atravessamento do combustível através da membrana, devido à formação de um elevado gradiente de concentração em ambos os lados da célula, comprometendo o desempenho da mesma (20).
Narayanan et al.(21) estudou a relação entre a taxa de atravessamento de metanol com a
corrente específica e demonstrou que esse fenómeno diminui com o aumento da corrente, uma vez que ocorre uma maior oxidação de metanol para elevadas correntes. Observou, ainda, que a espessura da membrana tem um impacto significativo no atravessamento de metanol, sendo que um aumento da espessura reduz o fenómeno de crossover. Tal pode dever-se ao aumento da resistência à transferência de massa.
Wu et al.(22) estudou o efeito de usar uma alimentação de metanol puro ao ânodo da célula,
cuja densidade energética é mais alta quando comparado com metanol diluído. Os resultados revelaram que o desempenho para combustível puro é pior, devido a uma maior taxa de atravessamento de metanol e um menor volume de água na membrana, que poderá ser resultado do aumento da temperatura de funcionamento.
Clabriso et al.(23) testou o desempenho de uma DMFC passiva com diferentes configurações das
placas coletoras e observou que para uma área maior do furo da placa, o crescimento de bolhas de CO2 é facilitado, reduzindo o acesso do metanol à área ativa da célula (23). No
entanto, Chen et al.(24) concluiu que, para uma maior área aberta da placa coletora, o
desempenho da DMFC melhora, devido à facilidade no transporte de metanol e oxigénio, bem como da remoção de CO2 e água para o exterior da célula. Desta forma, o desempenho da
célula deve ser analisado tendo em conta os vários fenómenos que ocorrem na mesma, verificando-se que uma condição ótima pode resultar de um equilíbrio entre eles.
Jung et al.(25) verificou que o desempenho da célula aumenta com o aumento da temperatura
de funcionamento, uma vez que um aumento da temperatura é benéfico para a condutividade iónica da membrana de Nafion.
Vários estudos têm contribuído para um avanço da tecnologia DMFCs, apesar de ainda ser necessário dar uma continuidade às investigações, por forma a melhorar o seu desempenho. 2.2.5.2 Células de Combustível com alimentação Direta de Etanol (DEFCs)
Uma célula de combustível com alimentação direta de etanol produz energia elétrica através das reações de oxidação do etanol e de redução de oxigénio.
O etanol alimentado ao ânodo é oxidado, segundo a reação:
CH3CH2OH + 3 H2O → 2 CO2 + 12 H+ + 12 e- (2.15)
Da mesma forma que numa DMFC, os protões são transportados através da membrana polimérica, enquanto que os eletrões fluem através de um circuito elétrico externo. Os protões reagem com o oxigénio proveniente do ar, no cátodo, formando água:
A oxidação do etanol apresenta uma cinética lenta, com a transferência de 12 eletrões para a sua oxidação completa. Além disso, esta reação é bastante complexa, devido à dificuldade de quebrar a ligação C-C da molécula de etanol, o que origina a formação de espécies intermediárias, nomeadamente ácido acético e acetaldeído. Desta forma, o número de eletrões libertados é inferior aos 12 ‘teóricos’, diminuindo a capacidade do combustível na produção de energia elétrica (26).
O mecanismo de oxidação global do etanol pode ser traduzido pelas seguintes reações paralelas (27):
CH3CH2OH → [CH3CH2OH]ads → C1ads , C2ads → CO2 (oxidação total) (2.17)
CH3CH2OH → [CH3CH2OH]ads → CH3CHO → CH3COOH (oxidação parcial) (2.18) A formação de dióxido de carbono passa por dois intermediários adsorvidos, C1ads e C2ads,
com um e dois átomos de carbono, respetivamente. Com a utilização do catalisador de platina, a formação de produtos resultantes da oxidação parcial, acetaldeído (CH3CHO) e
ácido acético (CH3COOH), são favorecidos.
De facto, o catalisador normalmente usado no ânodo é platina suportada em carbono, cujo suporte lhe permite aumentar a área superficial. Contudo, a eficiência deste catalisador não é a ideal, devido à adsorção das espécies intermediárias nos centros ativos, e que provoca o seu envenenamento. Por forma a ultrapassar este problema, tem sido estudada a hipótese de adicionar um outro metal à platina, criando um catalisador bimetálico, que modifica a estrutura do catalisador e, consequentemente, o mecanismo de adsorção das espécies contendo oxigénio. Os catalisadores bimetálicos mais utilizados são Pt-Ru e Pt-Sn. Pode ainda ser adicionado um terceiro elemento, formando catalisadores trimetálicos, à base de Pt-Ru e à base de Pt-Sn, que aumentam a desidrogenação e a quebra das ligações durante o processo. Para além dos metais mencionados, existem outros que têm sido estudados, como é o caso do W, Pd, Rh, Re, Mo, Ti e Ce (27). Zhou et al. (28) mostrou que a atividade do catalisador com a
junção de Sn e Ru é melhor no desempenho da reação de oxidação do etanol do que com os restantes metais.
O catalisador geralmente usado no cátodo é à base de platina com suporte de carbono, sendo que deve apresentar uma elevada atividade para a redução do oxigénio, bem como uma tolerância ao etanol. O principal problema com a atividade do catalisador no cátodo é a competição da adsorção nos centros ativos, por parte do oxigénio e do etanol que atravessa a membrana. Mais uma vez, a solução pode ser a presença de um segundo metal, sendo o paládio (Pd) um elemento promissor (27).
Os principais desafios das DEFCs passivas consistem em contornar a cinética lenta de oxidação do etanol e o atravessamento de combustível através da membrana. Diversos estudos têm sido realizados, por forma a otimizar o desempenho da célula, sendo que muitos passam por alterar determinadas características dos componentes da célula, desde a membrana, às camadas catalíticas e de difusão.
2.2.5.3 Metanol vs Etanol
Como já mencionado, diversos progressos já foram conseguidos no desenvolvimento das DMFCs, devido ao seu fácil manuseamento, às suas elevadas densidades energéticas e ao baixo custo do metanol, uma vez que pode ser produzido através do gás natural, carvão e ainda biomassa. No entanto, este álcool é tóxico para os seres humanos, é muito volátil e inflamável e ainda é considerado um combustível não renovável.
Dos vários álcoois existentes, o etanol surge como um combustível alternativo e bastante promissor, uma vez que apresenta uma baixa toxicidade e pode ser considerado como renovável, já que pode ser produzido a partir da fermentação de matérias primas provenientes da agricultura, como a cana de açúcar (29).
Ambos os álcoois apresentam o problema de atravessamento através da membrana, contudo, este fenómeno é menos acentuado para o etanol, devido a este possuir uma molécula com uma maior estrutura, o que dificulta o seu atravessamento na membrana. Desta forma, uma menor presença das moléculas deste álcool no cátodo leva a que o desempenho deste elétrodo seja menos afetado (8).
No entanto, o desempenho global das DEFCs é menor do que as de metanol, pelo facto da reação eletroquímica de oxidação do etanol ser mais lenta, devido à dificuldade em quebrar a ligação carbono-carbono, resultando em sobrepotenciais anódicos mais elevados (30).
Com o intuito de aproveitar as vantagens de ambos os combustíveis, surge o conceito de célula de combustível com alimentação direta de misturas de ambos os álcoois, metanol e etanol. Estudos com misturas dos dois álcoois foram realizados por Wongyao et al.(30), e
demonstraram que o desempenho da célula diminui consideravelmente com o aumento da percentagem de etanol na mistura alimentada ao ânodo.
Misturas de metanol e etanol, com diferentes concentrações e diferentes percentagens volúmicas, serão alvo de estudo neste trabalho, a fim de otimizar o desempenho de uma DAFC.
2.2.6 Ensaios de Impedância como Técnica de Diagnóstico
A espectroscopia de impedância eletroquímica (EIS) é uma ferramenta de diagnóstico amplamente utilizada em estudos de sistemas eletroquímicos, uma vez que permite avaliar os
mecanismos de reação das reações com múltiplas etapas, e permitir identificar e separar os diferentes processos que ocorrem numa FC (18).
Este método tem vindo a ser aplicado à área das células de combustível tipo PEM, como diagnóstico do seu desempenho, uma vez que permite identificar e quantificar separadamente as contribuições individuais de cada componente e processo, particularmente, a identificação e quantificação das perdas de ativação, carga e transferência de massa (31). De
uma forma mais detalhada, a aplicação da EIS às células permite (32):
➢ fornecer informações microscópicas sobre o sistema da FC, auxiliando na sua otimização estrutural e na seleção das condições operatórias adequadas;
➢ obter os parâmetros eletroquímicos do sistema, através da modelação com um circuito equivalente adequado;
➢ diferenciar as contribuições individuais de cada componente, auxiliando na identificação de possíveis problemas com os mesmos;
➢ identificar os processos de transferência de carga e transporte de massa nas diferentes camadas.
A impedância (Z) de um sistema eletroquímico é definida segundo a seguinte equação:
Z(w) = ZRe + i ZIm (2.19)
onde ZRe e ZIm correspondem à parte real e imaginária, respetivamente.
Na técnica EIS, aplica-se à célula de combustível uma perturbação sinusoidal de corrente alternada (AC), através da imposição de uma baixa tensão ou corrente, com uma amplitude e gama de frequências conhecidas, e medindo as alterações nos valores da impedância. A impedância pode então ser medida através do modo potenciostático ou galvanostático. Para medir a impedância é necessário um analisador da resposta de frequência (FRA) e uma carga. A perturbação sinusoidal é gerada pelo FRA e aplicada à FC através da carga, cuja resposta é fornecida ao FRA, gerando assim os espectros de impedância.
A resposta à perturbação é então apresentada por um espectro de impedância, podendo ser representado através de um diagrama de Nyquist, que é o mais usual, com a parte imaginária da impedância em função da parte real; ou por um diagrama de Bode, onde a amplitude ou fase da impedância é representada em função da frequência (32).
Na Figura 2.5, encontra-se um gráfico de Nyquist típico de uma DAFC, com a identificação das três regiões correspondentes às principais resistências que afetam o sistema, nomeadamente ohmica, ativação e transferência de massa.