Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
ELV para os sistemas binários: água (1) + ácido acético (2) e ácido
propanóico (3) + ácido pentanóico (4) aplicando o teste de consistência
dos dados experimentais
ELV for binary systems: water (1) + acetic acid (2) and propanoic acid (3)
+ pentanoic acid (4) by applying the experimental data consistency test
DOI:10.34117/bjdv5n10-319
Recebimento dos originais: 10/09/2019 Aceitação para publicação: 25/10/2019
Marcelo da Silva Pedro
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: marcelopedrocz@hotmail.com
Gabriela Paupitz Mendes
Doutoranda em Engenharia Química pela Universidade de São Paulo, Campus São Paulo, Escola Politécnica da Universidade de São Paulo, Av. Prof. Lineu Prestes, Nº 580, CEP:
05508-000, São Paulo-SP, Brasil. E-mail: gpaupitz@usp.br
Juliene da Câmara Rocha
Doutoranda em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: juliene-cr@hotmail.com
Elton da Nóbrega Silva
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: eltonobrega@hotmail.com
Jonas Medeiros de Paiva
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: jonasmedeiroseq@gmail.com
Eduardo Augusto da Silva Diniz
Doutorando em Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970, Natal-RN,
Brasil.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Ronaldo dos Santos Falcão Filho
Doutorando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: ronaldo.falcao@ifrn.edu.br
José Cosme Cunha Gomes
Mestrando em Engenharia Química pela Universidade Federal do Rio Grande do Norte, Campus Central, Av. Senador Salgado Filho, Lagoa Nova, Nº 3000, CEP: 59078-970,
Natal-RN, Brasil.
E-mail: cosme1412@gmail.com
RESUMO
Dados experimentais foram usados para simulação de processos químicos e, nesse sentido, precisão e informações confiáveis sobre as propriedades dos compostos envolvidos no estudo são importantes para entender e prever os modelos. Neste trabalho, uma mistura binária isobárica de água e ácido acético (P = 2.6664 kPa e P = 26.664 kPa) foi analisado, bem como uma solução binário isotérmico de ácido propiônico e ácido pentanóico (T = 393,15 K e T = 413,15 K). A confiabilidade dos dados experimentais foi avaliada usando dois métodos: o teste das áreas e o dos desvios. Além disso, o foram previstos dados de equilíbrio líquido para o sistema.
Palavras-chave: Equilíbrio vapor-líquido, mistura binária, ácido acético e água.
ABSTRACT
Experimental data were used to simulate chemical processes and, in this sense, precision and reliable information about the properties of the compounds involved in the study are important to understand and predict the models. In this work, an isobaric binary mixture of water and acetic acid (P = 2.6664 kPa and P = 26.664 kPa) was analyzed, as well as an isothermal binary solution of propionic acid and pentanoic acid (T = 393.15 K and T = 413, 15 K). The reliability of the experimental data was evaluated using two methods: the area test and the deviation test. In addition, the net equilibrium data were predicted for the system.
Key-words: Vapor–liquid equilibrium, binary mixture, acetic acid and water.
1 INTRODUÇÃO
Muitos processos industriais envolvem o uso de ácidos carboxílicos, entre eles estão a produção de nylon, de determinados fármacos e plásticos biodegradáveis. Normalmente, estão presentes em sistemas aquosos ou como subprodutos de operações industriais, por representarem produtos estáveis do processo oxidativo (Clifford et al., 2005). Com mais de 65% de sua produção voltada para a obtenção de polímeros, o ácido acético e seus derivados são produtos químicos de elevada utilização e importância mundialmente. Para isto, dados precisos relativos às propriedades de misturas aquosas de ácido acético, bem como
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 relacionados ao equilíbrio de fases dessa mistura, são necessários (Román-Ramírez e Leeke, 2016).
O ácido propanóico é utilizado na indústria alimentícia para evitar o amarelecimento do pão, enquanto o ácido pentanóico é aplicado como sedativo e hipnótico. Ambos os ácidos desempenham papéis relevantes na indústria, sendo necessário conhecer suas propriedades termodinâmicas. Os modelos termodinâmicos têm o propósito de relacionar temperatura, pressão e composição de um sistema.
As equações de estado são recomendadas dada as suas vastas aplicabilidades para diferentes intervalos de pressão. No caso das misturas estudadas nesse trabalho, a dificuldade em predizer as frações líquidas e gasosas dessas misturas se dá por conta das interações moleculares (Román-Ramírez e Leeke, 2016).
A avaliação dos dados experimentais pode ser realizada através de diferentes métodos. Dois exemplos mostrados nesse artigo são: o teste das áreas e o dos desvios. Desse modo, é possível determinar a credibilidade dos ensaios realizados. Este trabalho tem por objetivo analisar a consistência dos dados de equilíbrio líquido vapor para um sistema binário de água e ácido acético em condição de pressão constante obtidos na literatura, bem como o de um sistema binário de ácido propanóico com ácido pentanóico, em condições isotérmicas.
2 MATERIAIS E MÉTODOS
2.1 TESTE DE CONSISTÊNCIA DAS ÁREAS
A equação de Gibbs-Duhem correlaciona três parâmetros: pressão, temperatura e composição. Dessa forma, é introduzida uma restrição na variação simultânea desses parâmetros para uma fase. Seguindo a manipulação da equação, o teste das áreas é relativamente simples e consiste em interrelacionar os coeficientes de atividade de todos os componentes de uma mistura (Azevedo et al., 1969).
Seja uma propriedade extensiva, dada pela Equação 1.
𝑀 = 𝑓(𝑛, 𝑇, 𝑃) (1)
Derivando a Equação 1, obtém-se:
𝑑𝑀 = (𝜕𝑀
𝜕𝑇)𝑛,𝑃𝑑𝑇 + ( 𝜕𝑀
𝜕𝑃)𝑛,𝑇𝑑𝑃 + ∑ 𝑚̅𝑖𝑑𝑛𝑖
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 Onde 𝑚̅𝑖 é a propriedade parcial molar de M e dada pela equação abaixo:
𝑚̅𝑖 = (𝜕𝑀 𝜕𝑛𝑖)𝑃,𝑇,𝑛
𝑖≠𝑗
(3)
Inserindo a Equação (3) em (2), a Equação (4) é encontrada, geral para qualquer propriedade extensiva M. 𝑑𝑀 = ∑ 𝑚̅𝑖𝑑𝑛𝑖 + ∑ 𝑛𝑖𝑑𝑚̅𝑖 (4) (𝜕𝑀 𝜕𝑇)𝑛,𝑃 𝑑𝑇 + (𝜕𝑀 𝜕𝑃)𝑛,𝑇 𝑑𝑃 − ∑ 𝑛𝑖𝑑𝑚̅𝑖 = 0
Aplicando a Equação (4) para a Energia livre de Gibbs (G), obtém-se:
(𝜕𝐺 𝜕𝑇)𝑛,𝑃 = − 𝑆 (5) (𝜕𝐺 𝜕𝑃)𝑛,𝑇 = 𝑉 (6) (𝜕𝑀 𝜕𝑛𝑖 ) 𝑃,𝑇 = 𝜇𝑖 (7)
Substituindo as relações apresentadas nas Equações 5, 6 e 7, a Equação de Gibbs-Duhem é encontrada (Equação 8).
𝑆𝑑𝑇 − 𝑉𝑑𝑃 + ∑ 𝑛𝑖𝑑𝜇𝑖 = 0 (8)
Transformando a Equação 8 em propriedade de excesso: 𝑆𝐸𝑥𝑐𝑑𝑇 − 𝑉𝐸𝑥𝑐𝑑𝑃 + ∑ 𝑥
𝑖𝑑𝜇𝑖𝐸𝑥𝑐 = 0 (9)
Em que:
𝜇𝑖𝐸𝑥𝑐 = 𝑅𝑇𝑙𝑛𝛾𝑖 (10)
Substituindo a Equação 10 em 9 e mantendo T e P constantes:
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 Integrando a Equação 11: ∫ 𝑔 𝐸 𝑅𝑇𝑑𝑥 = 1 0 ∫ ln (𝛾1 𝛾2) 𝑑𝑥 = 0 1 0 (12)
Para avaliar a confiabilidade de dados de equilíbrio de fases foi utilizada a Equação 12, que é chamado teste de consistência das áreas. Assumindo a fase vapor ideal e, assim, apenas os coeficientes de atividade são avaliados a partir dos dados experimentais de ELV, isto é, através da pressão, temperatura e composição disponíveis (Chiavone Filho, 2016).
Um gráfico de ln (𝛾1
𝛾2) vs 𝑥1 é gerado e o valor da área acima e abaixo da curva é dado
pela integral da curva do ponto x1 = 0 até o x1 = 1, ou seja, as duas áreas que aparecem no gráfico superior e inferior ao eixo das abcissas (ln (𝛾1
𝛾2) = 0).
O critério de consistência dos dados ELV baseia-se na razão entre a área menor e a área maior da curva acima e abaixo de ln (𝛾1
𝛾2) igual a zero, essa razão deve ser maior que 0,7.
A classificação mais detalhada sobre a definição dos dados se encontra na Tabela 01 (Chiavone Filho, 2016).
Tabela 01. Critérios de qualidade dos dados de ELV baseado no teste de consistência dos desvios* e da área (Chiavone Filho, 2016). Classe ∆T ou ∆P** (%) A/B Definição A <0,25 0,95-1,00 Dados precisos B 0,25-0,50 0,90-0,95 Bons dados C 0,50-1,00 0,80-0,90 Aplicáveis
D 1,00-2,00 0,70-0,80 Aplicáveis com precaução E >2,00 <0,70 Inaceitáveis
* O desvio absoluto médio em y deve ser menor que 0,01 para dados consistentes.
** Desvio relativo.
2.2 TESTE DE CONSISTÊNCIA DOS DESVIOS
O critério da isofugacidade do ELV é considerado para o teste de consistência dos desvios, de acordo com a Equação 13 (Chiavone Filho, 2016).
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 𝑥𝑖𝛾𝑖𝑃𝑖𝑠𝑎𝑡𝜑𝑖𝑠𝑎𝑡exp [𝑣𝑖 𝐿 𝑅𝑇(𝑃 − 𝑃𝑖 𝑠𝑎𝑡)] = 𝑦 𝑖𝜑̂𝑖𝑉𝑃 (13) Onde exp [𝑣𝑖 𝐿 𝑅𝑇(𝑃 − 𝑃𝑖 𝑠𝑎𝑡)] = 𝑃𝑜𝑦 𝑖 (14)
Para baixas pressões, 𝑃𝑜𝑦𝑖 = 1. A Equação 13 pode ser rearranjada, então:
𝛾𝑖 =
𝑦𝑖𝜑̂𝑖𝑉𝑃 𝑥𝑖𝑃𝑖𝑠𝑎𝑡𝜑𝑖𝑠𝑎𝑡
(15)
Os quais os valores de 𝑃𝑖𝑠𝑎𝑡 são dados pela equação de Antoine, juntamente com as respectivas constantes, como segue na Equação 16.
ln 𝑃𝑖𝑠𝑎𝑡(𝑚𝑚𝐻𝑔) = 𝐴 − 𝐵 𝑇(°𝐶) + 𝐶
(16)
Para minimizar a função objetivo (F.O.), foi realizado o ajuste dos dados experimentais. A função objetivo é definida como sendo a soma dos quadrados das diferenças entre os valores de temperatura ou pressão determinados pelo modelo e os obtidos experimentalmente (Chiavone Filho, 2016).
𝐹. 𝑂. = 𝑚𝑖𝑛. = ∑(𝛾𝑖 𝑒𝑥𝑝.(𝑃, 𝑇, 𝑥, 𝑦) − 𝛾 𝑖𝑐𝑎𝑙𝑐.(𝑎𝑖𝑗))2 𝛾𝑖𝑒𝑥𝑝. 𝑁 𝑖=1 (17)
2.3 PREDIÇÃO DO EQUILÍBRIO LÍQUIDO-VAPOR DE UM SISTEMA BINÁRIO Os métodos de predição existentes na literatura correlacionam os dados de pressão, temperatura e composição a partir das propriedades parciais molares. Dentre eles, os mais utilizados são o método UNIFAC, Hildebrand & Scatchard e ASOG. O método de Hildebrand & Scatchard é recomendado para substâncias apolares e a fase vapor é assumida como ideal (𝜑̂𝑖𝑉 = 1). O método UNIFAC, por sua vez, utiliza a contribuição de grupos funcionais para realizar a predição do coeficiente de atividade da molécula, sendo aplicável para uma maior quantidade de substâncias.
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 O método do UNIFAC não distingue configurações especiais tais como isômeros, múltiplos grupos funcionais próximos, estrutura com ressonância, ligações hidrogênio, entre outros. O intuito desse método é utilizar dados de equilíbrio líquido-vapor existentes para predizer o equilíbrio de fases para sistemas onde não há dados experimentais disponíveis. Este método é bastante recomendado na aplicação para o equilíbrio líquido-vapor de misturas não eletrolíticas. Além disso, o método pode estimar dados de equilíbrio líquido-vapor para diversas misturas.
2.4 TESTES DE CONSISTÊNCIA
Foi utilizado um programa para testes de consistência de dados de equilíbrio líquido-vapor de sistemas binários, o software Consist, (Othmer et al., 1952), Tabela A do Anexo, a fim de se verificar a confiabilidade dos mesmos. O resultado dos testes dos desvios foi obtido a partir de sua execução e a metodologia de cálculo, explicada anteriormente neste trabalho. Foi possível realizar o teste das áreas no Microsoft Excel®. As propriedades termodinâmicas dos componentes do sistema binário água (1) + ácido acético (2) utilizadas no software Consist estão presentes na Tabela 02. O parâmetro de solvatação da mistura é 2,5 (Fredenslund et al., 1977).
Tabela 02. Propriedades dos componentes do sistema binário (Poling et al., 2001); RD – raio médio de giração; ETA – parâmetro de associação; DMU – momento dipolo (Prausnitz et al., 1980) A, B e C – constantes de Antoine em mmHg e K [CERE Specs v5.63 (2010)].
Componente Tc (K) Pc (bar) Zc RD ETA DMU A B C
Água 647,14 220,6 0,344 0,615 1,7 1,8 8,071 1730 233,426
Ác. Acético 594,45 57,9 0,445 2,595 4,5 1,3 7,559 1644 233,524
Da mesma forma, o software Consist foi utilizado para avaliar a consistência dos dados de P-x-y do sistema binário ácido propanoico (3) + ácido pentanóico (4) (Clifford et al., 2005), Tabela B do Anexo. As propriedades termodinâmicasdos componentes utilizadas no software Consist estão presentes na Tabela 03. O parâmetro de solvatação da mistura é 4,5 (Fredenslund et al., 1977).
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Tabela 03. Propriedades dos componentes do sistema binário; RD – raio médio de giração; ETA – parâmetro de associação; DMU – momento dipolo (Clifford et al., 2005).
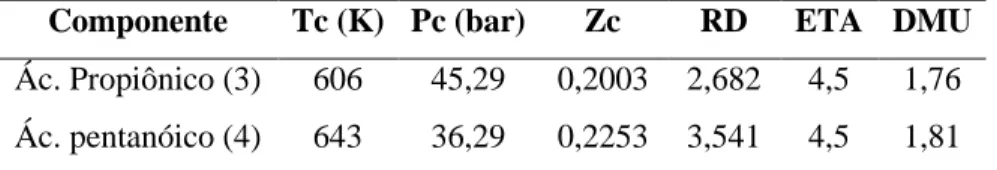
Componente Tc (K) Pc (bar) Zc RD ETA DMU Ác. Propiônico (3) 606 45,29 0,2003 2,682 4,5 1,76 Ác. pentanóico (4) 643 36,29 0,2253 3,541 4,5 1,81
2.5 PREDIÇÃO DO EQUILÍBRIO LÍQUIDO-VAPOR
A predição dos dados do ELV foi feita utilizando dois modelos: o modelo UNIFAC 1 coeficiente (medição de líquido saturado) combinado com a Equação do Virial (segundo coeficiente do virial estimado por Hayden e O’Connel). Foi utilizado o software Specs [CERE Specs v5.63 (2010)] para o sistema água (1) + ácido acético (2). As considerações referentes aos fenômenos de associação, dimerização e solvatação foram adicionadas ao programa para fins de cálculo.
3 RESULTADOS E DISCUSSÕES
Aos dados de ELV dos sistemas binários água (1) + ácido acético (2), isobárico a P=2,6664 kPa e P=26,664 kPa, e ácido propanoico (3) + ácido pentanóico (4), isotérmico a T=393,15 K e T=413,15 K, foram aplicados os testes de consistência dos desvios e da área.
3.1 TESTE DE CONSISTÊNCIA DAS ÁREAS
Isobárico a baixa pressão
Os valores de fugacidade e coeficiente de fugacidade foram obtidos pelo software Consist e são apresentados na Tabela 4.
Tabela 04. Resultados de fugacidade (f) e dos coeficientes de fugacidade ( ) para os componentes água (1) + ácido acético (2) a P=2,6664 kPa.
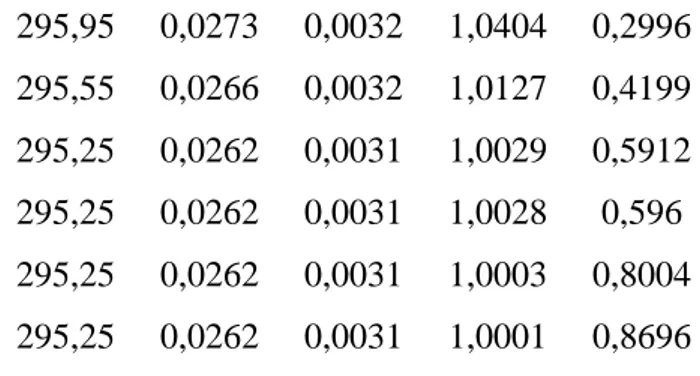
T (K) f1 f2 1 2 303,15 0,0418 0,0053 1,8044 0,1955 298,35 0,0315 0,0038 1,3612 0,177 297,35 0,0297 0,0036 1,2561 0,1828 296,85 0,0288 0,0035 1,1538 0,2044 296,25 0,0278 0,0033 1,0829 0,2408
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 295,95 0,0273 0,0032 1,0404 0,2996 295,55 0,0266 0,0032 1,0127 0,4199 295,25 0,0262 0,0031 1,0029 0,5912 295,25 0,0262 0,0031 1,0028 0,596 295,25 0,0262 0,0031 1,0003 0,8004 295,25 0,0262 0,0031 1,0001 0,8696
Para o sistema binário em questão, percebe-se que, mesmo a baixas pressões, não é possível realizar o equacionamento através da Lei de Raoult, visto que a fugacidade se encontra distante da unidade. Partindo desses dados, o teste das áreas foi realizado. Os dados da Tabela 05 foram utilizados para a construção do gráfico na Figura 1.
Tabela 05. Cálculo dos parâmetros do coeficiente de atividade da água (1) + do ácido acético (2) para o teste de consistência das áreas dos dados ELV isobáricos a P = 2,6664 kPa (Othmer et al., 1952).
T x1 1 2 ln ( 1/ 2) 303,15 0 - 0,970123 - 298,35 0,3002 1,415885 1,095837 0,25624 297,35 0,4576 1,272976 1,172709 0,08204 296,85 0,6392 1,156997 1,269007 -0,09241 296,25 0,7742 1,079915 1,56299 -0,36972 295,95 0,8588 1,041387 1,878143 -0,58973 295,55 0,928 1,024261 2,430117 -0,86397 295,25 0,9667 1,021516 2,876853 -1,03541 295,25 0,9674 1,019634 3,117588 -1,11762 295,25 0,9883 1,010417 3,192111 -1,15032 295,25 0,993 1,007961 3,161818 -1,14322
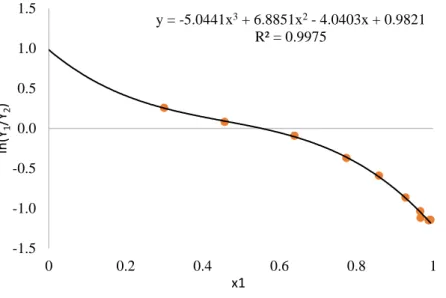
Assim, a Figura 01 mostra o gráfico de ln (𝛾1
𝛾2) vs. 𝑥1 para os dados de ELV isobáricos
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Figura 01. Curva ln (𝛾1
𝛾2) vs. 𝑥1 utilizados para o teste de consistência das áreas dos dados ELV isobáricos a P =
2,6664 kPa, Para o sistema água (1) + do ácido acético (2) (Othmer et al., 1952).
A partir da curva obtida pelo ajuste dos dados experimentais (Equação 23), a Equação 12 foi aplicada.
𝑦 = −5,0441𝑥3+ 6,8851𝑥2− 4,0403𝑥 + 0,9821 (23) A razão das áreas foi de 0,9797. De acordo com a Tabela 1, conclui-se que os dados são consistentes e é um resultado positivo, pois os dados de ELV coletados (Othmer et al., 1952) se mostram precisos e adequados para serem utilizados.
Isobárico a alta pressão
Seguindo o mesmo procedimento para os dados de ELV do sistema binário água (1) + ácido acético (2) a alta pressão (P = 26,664 kPa), o teste de consistência das áreas foi aplicado. A Equação 24 foi obtida a partir do ajuste dos dados experimentais (Anexo, Tabela A b)).
𝑦 = −6,2612𝑥3+ 8,0752𝑥2− 3,8633𝑥 + 0,7987 (24) Calcularam-se as áreas abaixo e acima da curva (Anexo, Figura A), conforme Equação 12, e a razão entre elas foi de 0,9616. Esse resultado mostra que os dados são consistentes (Tabela 1).
Isotérmico a baixa temperatura
y = -5.0441x3+ 6.8851x2- 4.0403x + 0.9821 R² = 0.9975 -1.5 -1.0 -0.5 0.0 0.5 1.0 1.5 0 0.2 0.4 0.6 0.8 1 ln (Y1 /Y2 ) x1
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 Para o sistema binário ácido propanoico (3) + ácido pentanóico (4), os dados ELV de P-x-y foram avaliados (Anexo, Tabela B). A Tabela 6 apresenta os dados do sistema a baixa temperatura (T = 393,15 K).
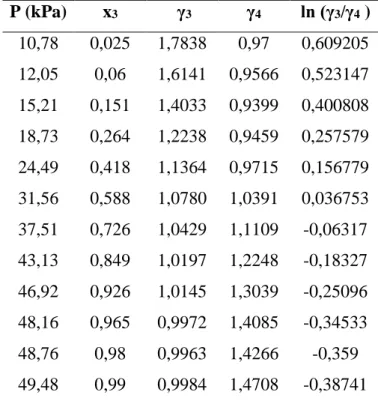
Tabela 06. Parâmetros os do coeficiente de atividade do ácido propanoico (3) e do ácido pentanóico (4) para o teste de consistência das áreas dos dados ELV isotérmicos a T=393,15 K (Clifford et al., 2005).
P (kPa) x3 γ3 γ4 ln (γ3/γ4 ) 10,78 0,025 1,7838 0,97 0,609205 12,05 0,06 1,6141 0,9566 0,523147 15,21 0,151 1,4033 0,9399 0,400808 18,73 0,264 1,2238 0,9459 0,257579 24,49 0,418 1,1364 0,9715 0,156779 31,56 0,588 1,0780 1,0391 0,036753 37,51 0,726 1,0429 1,1109 -0,06317 43,13 0,849 1,0197 1,2248 -0,18327 46,92 0,926 1,0145 1,3039 -0,25096 48,16 0,965 0,9972 1,4085 -0,34533 48,76 0,98 0,9963 1,4266 -0,359 49,48 0,99 0,9984 1,4708 -0,38741
Então, foi possível gerar o gráfico de ln ( 𝛾3
𝛾4 ) vs. 𝑥3 (Figura 2). y = -1.7827x3+ 2.8087x2- 2.0731x + 0.6504 R² = 0.999 -0.6 -0.4 -0.2 0 0.2 0.4 0.6 0.8 0 0.2 0.4 0.6 0.8 1 ln (y3 /y4 ) x3
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Figura 02. Para o sistema ácido propanoico (3) e do ácido pentanóico (4), o comportamento da curva ln (𝛾3
𝛾4) vs. 𝑥1 utilizados para o teste de consistência das áreas dos dados ELV isotérmicos a T = 393,15 K (Clifford et al., 2005).
A partir da curva obtida pelo ajuste dos dados experimentais (Equação 25), a Equação 12 foi aplicada.
𝑦 = −1,7827𝑥3+ 2,8087𝑥2− 2,0731𝑥 + 0,6504 (25) A razão das áreas obteve o valor de 0,3570. De acordo com a Tabela 1, determina-se que esses dados são inaceitáveis. Dessa forma, os dados ELV isotérmico não são precisos e não podem ser utilizados para obtenção de uma correlação que represente o comportamento desse sistema.
Isotérmico a alta temperatura
Seguindo o mesmo procedimento para os dados de ELV do sistema binário ácido propanóico (3) + ácido pentanóico (4) a alta temperatura (T=413,15 K), o teste de consistência das áreas foi aplicado. A Equação 26 foi obtida a partir do ajuste dos dados experimentais (Anexo, Tabela B b)).
𝑦 = −2,2063𝑥3+ 3,3792𝑥2− 2,1028𝑥 + 0,4611 (26) Calcularam-se as áreas abaixo e acima da curva (Anexo, Figura B), conforme Equação 12, e a razão entre elas foi de 0,8282. Esse resultado mostra que os dados são aplicáveis (Tabela 1).
3.2 TESTE DE CONSISTÊNCIA DOS DESVIOS
O desvio relativo ponto a ponto foi obtido entre os dados experimentais de pressão (P) e os dados estimados pelo software Consist. Da mesma forma, o desvio absoluto ponto a ponto foi obtido para os dados da fase vapor (y). Os resultados estão apresentados nas Tabelas de 07 a 10.
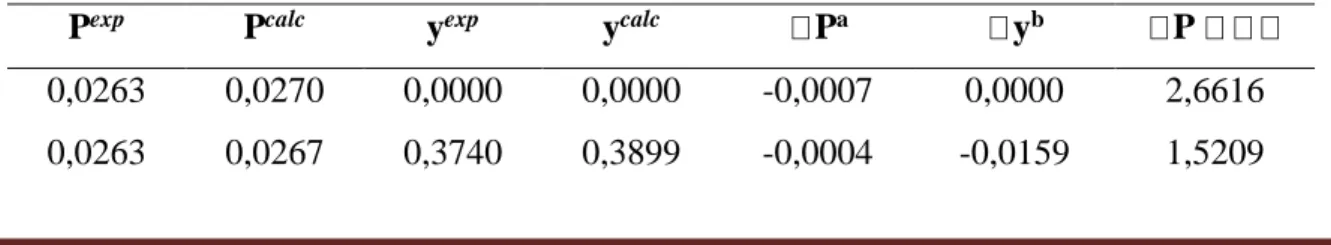
Tabela 07. Teste dos desvios para o sistema água (1) + ácido acético (2) a P = 2,6664 kPa.
Pexp Pcalc yexp ycalc Pa yb P
0,0263 0,0270 0,0000 0,0000 -0,0007 0,0000 2,6616 0,0263 0,0267 0,3740 0,3899 -0,0004 -0,0159 1,5209
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 0,0263 0,0264 0,5237 0,5226 -0,0001 0,0011 0,3802 0,0263 0,0263 0,7019 0,6756 0,0000 0,0263 0,0000 0,0263 0,0258 0,8161 0,8028 0,0005 0,0133 1,9011 0,0263 0,0257 0,8923 0,8908 0,0006 0,0015 2,2814 0,0263 0,0256 0,9493 0,9570 0,0007 -0,0077 2,6616 0,0263 0,0256 0,9809 0,9853 0,0007 -0,0044 2,6616 0,0263 0,0256 0,9799 0,9857 0,0007 -0,0058 2,6616 0,0263 0,0260 0,9945 0,9961 0,0003 -0,0016 2,6616 0,0263 0,0260 0,9970 0,9978 0,0003 -0,0008 2,6616
Desvio médio absoluto (DMA)c 0,0004 0,0073 -
Desvio médio relativo (DMR)d - - 1,9011 a ∆𝑦 𝑖 = 𝑦𝑖 𝑒𝑥𝑝 − 𝑦𝑖𝑐𝑎𝑙𝑐 b ∆𝑃 𝑖 = 𝑃𝑖 𝑒𝑥𝑝 − 𝑃𝑖𝑐𝑎𝑙𝑐 c 𝐷𝑀𝐴 = 1 𝑁𝑃∑ 𝑀𝑖 𝑒𝑥𝑝 − 𝑀𝑖𝑐𝑎𝑙𝑐 𝑁𝑃
1 , onde 𝑁𝑃 é o número de pontos experimentais e M representa P ou y.
d 𝐷𝑀𝑅 = 1
𝑁𝑃∑ |∆𝑃(%)|
𝑁𝑃
1
Tabela 08. Teste dos desvios para o sistema água (1) + ácido acético (2) a P=26,664 kPa.
Pexp Pcalc yexp ycalc Pa yb P
0,2618 0,2674 0 0 -0,0056 0,0000 2,1390 0,2618 0,2669 0,404 0,4371 -0,0051 -0,0331 1,9480 0,2618 0,266 0,573 0,5574 -0,0042 0,0156 1,6042 0,2618 0,2593 0,7337 0,6917 0,0025 0,0420 0,9549 0,2618 0,2563 0,8396 0,809 0,0055 0,0306 2,1000 0,2618 0,2539 0,8992 0,8913 0,0079 0,0079 3,0175 0,2618 0,2566 0,9493 0,9539 0,0052 -0,0046 1,9862 0,2618 0,2574 0,9779 0,9831 0,0044 -0,0052 1,6806 0,2618 0,262 1,0000 1,0000 -0,0002 0,0000 0,0763
Desvio médio absoluto (DMA)c 0,0044 0,0161 -
Desvio médio relativo (DMR)d - - 1,9385 a ∆𝑦
𝑖 = 𝑦𝑖 𝑒𝑥𝑝
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 b ∆𝑃 𝑖 = 𝑃𝑖 𝑒𝑥𝑝 − 𝑃𝑖𝑐𝑎𝑙𝑐 c 𝐷𝑀𝐴 = 1 𝑁𝑃∑ 𝑀𝑖 𝑒𝑥𝑝 − 𝑀𝑖𝑐𝑎𝑙𝑐 𝑁𝑃
1 , onde 𝑁𝑃 é o número de pontos experimentais e M representa P ou y.
d 𝐷𝑀𝑅 = 1
𝑁𝑃∑ |∆𝑃(%)|
𝑁𝑃
1
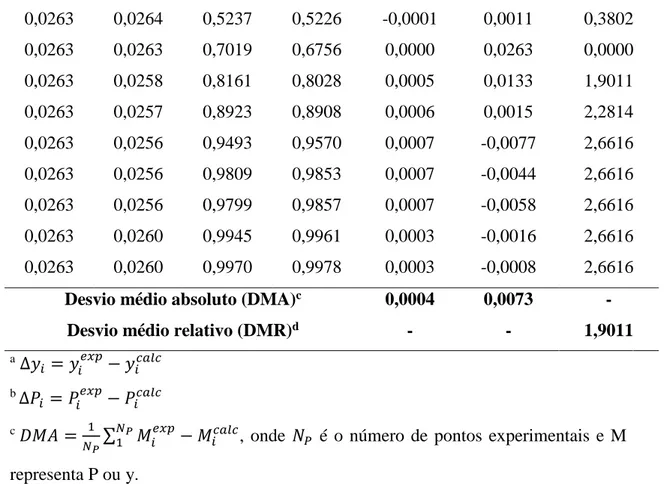
Tabela 9 – Teste dos desvios para o sistema ácido propanóico (3) + ácido pentanóico (4) a
T=393,15 K.
Pexp Pcalc yexp ycalc Pa yb P
0,1064 0,1064 0,0000 0,0000 0,0000 0,0000 0 0,1064 0,1137 0,1110 0,0899 -0,0073 0,0211 6,8609 0,1189 0,1244 0,2350 0,2041 -0,0055 0,0309 4,6257 0,1501 0,1533 0,4570 0,4366 -0,0032 0,0204 2,1319 0,1848 0,1905 0,6150 0,6218 -0,0057 -0,0068 3,0844 0,2417 0,2437 0,7610 0,7735 -0,0020 -0,0125 0,8274 0,3114 0,3067 0,8590 0,8728 0,0047 -0,0138 1,5093 0,3702 0,3620 0,9160 0,9266 0,0082 -0,0106 2,2150 0,4256 0,4162 0,9560 0,9634 0,0094 -0,0074 2,2086 0,4630 0,4534 0,9780 0,9830 0,0096 -0,0050 2,0734 0,4753 0,4712 0,9900 0,9921 0,0041 -0,0021 0,8626 0,4812 0,4786 0,9940 0,9955 0,0026 -0,0015 0,5403 0,4883 0,4845 0,9970 0,9978 0,0038 -0,0008 0,7782 0,4883 0,4883 1,0000 1,0000 0,0000 0,0000 0,0000
Desvio médio absoluto (DMA)c 0,0041 0,0062 -
Desvio médio relativo (DMR)d - - 1,9798 a ∆𝑦 𝑖 = 𝑦𝑖 𝑒𝑥𝑝− 𝑦 𝑖𝑐𝑎𝑙𝑐 b ∆𝑃 𝑖 = 𝑃𝑖 𝑒𝑥𝑝 − 𝑃𝑖𝑐𝑎𝑙𝑐 c 𝐷𝑀𝐴 = 1 𝑁𝑃∑ 𝑀𝑖 𝑒𝑥𝑝 − 𝑀𝑖𝑐𝑎𝑙𝑐 𝑁𝑃
1 , onde 𝑁𝑃 é o número de pontos experimentais e M representa P ou y.
d 𝐷𝑀𝑅 = 1
𝑁𝑃∑ |∆𝑃(%)|
𝑁𝑃
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
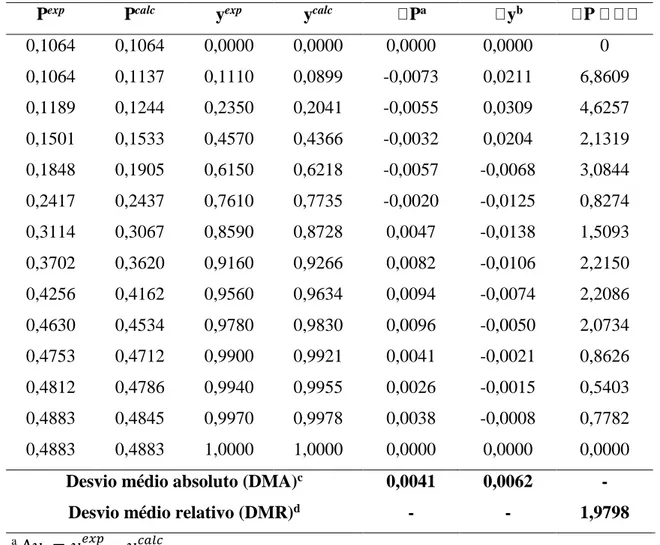
Tabela 10 – Teste dos desvios para o sistema ácido propanóico (3) + ácido pentanóico (4) a
T=413,15 K.
Pexp Pcalc yexp ycalc Pa yb P
0,2195 0,2195 0 0 0,0000 0,0000 0,0000 0,2195 0,2233 0,0290 0,0243 -0,0038 0,0047 1,7312 0,2304 0,2333 0,0930 0,0839 -0,0029 0,0091 1,2587 0,2697 0,2675 0,2550 0,2603 0,0022 -0,0053 0,8157 0,3044 0,3042 0,3820 0,4053 0,0002 -0,0233 0,0657 0,3790 0,3801 0,5680 0,6058 -0,0011 -0,0378 0,2902 0,4807 0,4800 0,7140 0,7572 0,0007 -0,0432 0,1456 0,5353 0,5360 0,7690 0,8128 -0,0007 -0,0438 0,1308 0,6503 0,6489 0,8610 0,8904 0,0014 -0,0294 0,2153 0,7789 0,7821 0,9300 0,9480 -0,0032 -0,0180 0,4108 0,8773 0,8737 0,9670 0,9751 0,0036 -0,0081 0,4103 0,9484 0,9502 0,9950 0,9963 -0,0018 -0,0013 0,1898 0,9643 0,9595 0,9980 0,9981 0,0048 -0,0001 0,4978
Desvio médio absoluto (DMA)c 0,0020 0,0156 -
Desvio médio relativo (DMR)d - - 0,4740 a ∆𝑦 𝑖 = 𝑦𝑖 𝑒𝑥𝑝 − 𝑦𝑖𝑐𝑎𝑙𝑐 b ∆𝑃 𝑖 = 𝑃𝑖 𝑒𝑥𝑝 − 𝑃𝑖𝑐𝑎𝑙𝑐 c 𝐷𝑀𝐴 = 1 𝑁𝑃∑ 𝑀𝑖 𝑒𝑥𝑝 − 𝑀𝑖𝑐𝑎𝑙𝑐 𝑁𝑃
1 , onde 𝑁𝑃 é o número de pontos experimentais e M representa P ou y.
d 𝐷𝑀𝑅 = 1
𝑁𝑃∑ |∆𝑃(%)|
𝑁𝑃
1
Para os dados se mostrarem consistentes o desvio absoluto médio deve ser menor que 0,01. Entretanto, para os valores da fase vapor a alta pressão e a alta temperatura, o desvio absoluto médio foi, respectivamente, 0,0161 e 0,0156. Além disso, ainda de acordo com a Tabela 1, o desvio médio relativo (DMR) deve ser menor do que 0,25% para os dados serem considerados precisos. Porém, como mostrado nas Tabelas 7-9, o DMR 1 e 2, indicando que os dados devem ser utilizados com precaução (classe D). No caso da Tabela 10, os dados foram considerados bons (classe B).
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 3.3 PREDIÇÃO DO EQUILÍBRIO LÍQUIDO-VAPOR
Para a predição dos dados de ELV do sistema isobárico água (1) + ácido acético (2) (Tabela A Anexo), plotaram-se os gráficos com os dados simulados pelos modelos e os dados experimentais obtidos na literatura, estabelecendo-se uma comparação entre eles.
Inicialmente, estudou-se uma abordagem gama-phi, onde a fase vapor foi descrita pela Equação do Virial (segundo coeficiente do virial por Hayden e O’Connel) e os coeficientes de atividade foram calculados pelo modelo UNIFAC 1 coeficiente, como apresentados nas Figuras 3 e 4.
Isobárico a baixa pressão
Figura 3 – Comparação dos dados simulados pelo modelo UNIFAC 1 coeficiente combinado com a Equação do Virial com os dados experimentais para o sistema isobárico água (1) + ácido acético (2), a 2,6664 kPa.
Diante do observado na Figura 3, duas hipóteses são levantadas: a primeira, questiona-se a reprequestiona-sentatividade do modelo uma vez que a uma pressão muito baixa o sistema água (1) + ácido acético (2) não apresenta o ponto de azeótropo; a segunda, observa-se a proximidade dos pontos oferecidos para a fase líquida e vapor.
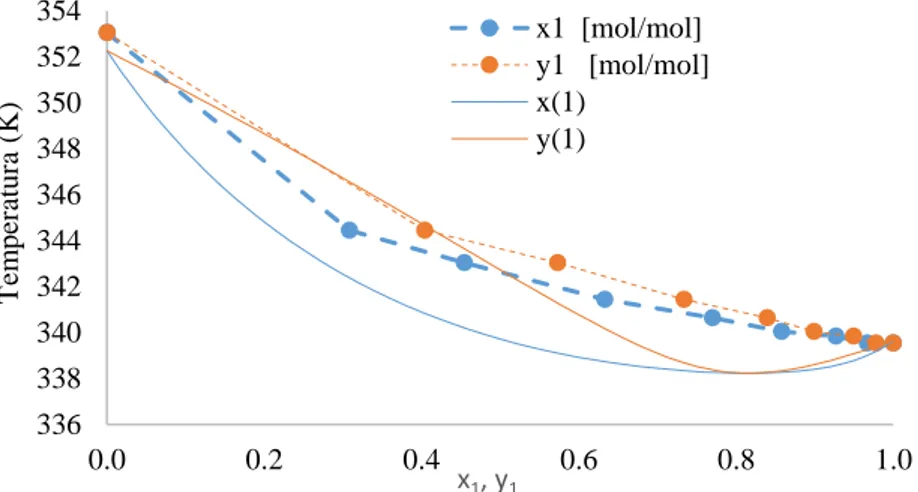
Isobárico a alta pressão
292 294 296 298 300 302 304 0 0.2 0.4 0.6 0.8 1 T em p er atu ra (K) x1, y1 x1 [mol/mol] y1 [mol/mol] x(1) y(1)
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Figura 4 – Comparação dos dados simulados pelo modelo UNIFAC 1 coeficiente combinado com a Equação do Virial com os dados experimentais para o sistema isobárico água (1) + ácido acético (2), a 26,664 kPa.
4 CONCLUSÕES
No presente trabalho foi realizada uma análise de consistência dos dados de equilíbrio líquido vapor para um sistema binário de água e ácido acético a pressão constante, bem como o de um sistema binário de ácido propanóico com ácido pentanóico, em condições isotérmicas.
Para o teste das áreas, o sistema binário água e ácido acético, em baixas e altas pressões, apresentaram dados experimentais consistentes, mostrando-se precisos e adequados para serem utilizados. Já o sistema ácido propanóico e ácido pentanóico, em baixas temperaturas, são dados inaceitáveis, não podendo ser utilizados para obtenção de uma correlação que represente o comportamento desse sistema. Enquanto os dados a altas temperaturas são aplicáveis.
Em relação ao método dos desvios, para que os dados se mostrem consistentes o desvio absoluto médio deve ser menor que 0,01. Para a fase vapor a alta pressão e a alta temperatura, o desvio absoluto médio foi superior a 0,01, indicando dados imprecisos.
A avalição da consistência dos dados experimentais é imprescindível para a obtenção e aplicação de correlações adequadas para a representação do comportamento dos sistemas termodinâmicos.
REFERÊNCIAS
AZEVEDO, E. J. S. G.; LICHTENTHALER, R. N; PRAUSNITZ, J. Molecular
thermodynamics of fluid-phase equilibria. 3ª Ed., 1969.
336 338 340 342 344 346 348 350 352 354 0.0 0.2 0.4 0.6 0.8 1.0 T em p er atu ra (K) x1, y1 x1 [mol/mol] y1 [mol/mol] x(1) y(1)
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761 CHIAVONE FILHO, O. Prática computacional da termodinâmica do equilíbrio. Universidade Federal do Rio Grande do Norte, 2016.
CLIFFORD, S. L.; RAMJUGERNATH D.; RAAL, J. D. Vapour–liquid equilibrium of
carboxylic acid systems: Propionic acid + valeric acid and isobutyric acid + valeric acid.
Fluid phase equilibria. 237, p. 88-89, 2005.
FREDENSLUND, A.; GMEHLING, J.; RASMUSSEN, P. Vapor-liquid equilibria using
UNIFAC – a group contribution method. Elsevier: Amsterdã, 1977.
OTHMER, D. F.; SILVIS, S. J.; SPIEL, A. Composition of vapors from boiling binary
solutions: pressure equilibrium still for studying water-acetic acid system. Industrial and
Engineering Chemistry, v. 44, n. 8, p. 1864-1872, 1952.
POLING, B.E.; PRAUSNITZ, J.M.; O'CONNELL, J.P. The property of gases and liquids. 5º Ed., McGraw-Hill, 2001.
PRAUSNITZ, J. M. et al. Computer Calculations for Multicomponent Vapor-Liquid and
Liquid-Liquid Equilibria. Prentice-Hall, Inc., Englewood Cliffs, N J, 1980.
Programa CONSIST, IVC-SEP – Phase Equilibria and Separation Processes (MAN 8111), MANUAL FOR CONSIST: PROGRAM FOR CONSISTENCY TESTING OF BINARY VLE-DATA, 1981.
Programa SPECS (program for phase equilibrium calculations; it has been developed in the
Center for Phase Equilibria and Separation Processes (IVC-SEP), Department of
Chemical Engineering, Technical University of Denmark). Manual de utilização versão 5.63, 2010.
ROMÁN-RAMÍREZ, L. A.; LEEKE, G. A. p-x Data of (Acetic acid + water) at T = (412.6,
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
ANEXO
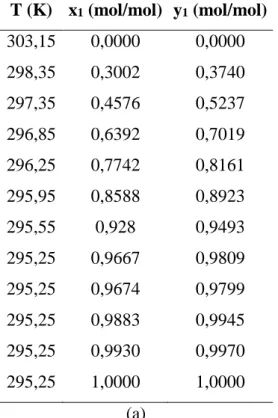
Tabela A – a) ELV para P=2,6664 kPa; b) ELV para P = 26,664 kPa (Othmer et al., 1952), sistema binário água (1) + ácido acético (2). T (K) x1 (mol/mol) y1 (mol/mol) 303,15 0,0000 0,0000 298,35 0,3002 0,3740 297,35 0,4576 0,5237 296,85 0,6392 0,7019 296,25 0,7742 0,8161 295,95 0,8588 0,8923 295,55 0,928 0,9493 295,25 0,9667 0,9809 295,25 0,9674 0,9799 295,25 0,9883 0,9945 295,25 0,9930 0,9970 295,25 1,0000 1,0000 (a) T (K) x1 (mol/mol) y1 (mol/mol) 353,05 0,0000 0,0000 344,45 0,3084 0,4040 343,05 0,4546 0,5730 341,45 0,6330 0,7337 340,65 0,7699 0,8396 340,05 0,8578 0,8992 339,85 0,9270 0,9493 339,55 0,9670 0,9779 339,55 1,0000 1,0000 (b)
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Tabela B – a) ELV para T = 393,15 K; b) ELV para T = 413,15 K (Clifford et al., 2005), sistema binário ácido propanoico (3) + ácido pentanóico (4).
P (kPa) x3 y3 γ3 γ4 Φ3 Φ4 10,78 0,025 0,111 1,7838 0,97 0,566 1,0266 12,05 0,06 0,235 1,6141 0,9566 0,5992 1,0393 15,21 0,151 0,457 1,4033 0,9399 0,6584 1,0538 18,73 0,264 0,615 1,2238 0,9459 0,7191 1,0595 24,49 0,418 0,761 1,1364 0,9715 0,7852 1,0574 31,56 0,588 0,859 1,0780 1,0391 0,8502 1,0494 37,51 0,726 0,916 1,0429 1,1109 0,9004 1,0405 43,13 0,849 0,956 1,0197 1,2248 0,9449 1,0313 46,92 0,926 0,978 1,0145 1,3039 0,9728 1,0249 48,16 0,965 0,99 0,9972 1,4085 0,987 1,0215 48,76 0,98 0,994 0,9963 1,4266 0,9924 1,0202 49,48 0,99 0,997 0,9984 1,4708 0,996 1,0193 (a) P (kPa) x3 y3 γ3 γ4 Φ3 Φ4 22,24 0,007 0,029 1,6590 1,0105 0,5709 1,0074 23,35 0,025 0,093 1,4976 1,0019 0,5912 1,0185 27,33 0,086 0,255 1,2959 1,0075 0,6358 1,0371 30,85 0,147 0,382 1,2088 1,0039 0,6733 1,0469 38,41 0,261 0,568 1,1549 1,0042 0,7294 1,0524 48,71 0,403 0,714 1,0971 1,0440 0,7886 1,0487 54,24 0,483 0,769 1,0592 1,0842 0,8194 1,0441 65,9 0,634 0,861 1,0299 1,1275 0,8742 1,0336 78,93 0,794 0,93 1,0042 1,2245 0,9296 1,0221 88,9 0,897 0,967 1,0012 1,3304 0,965 1,0149 96,1 0,986 0,995 0,9897 1,5322 0,9929 1,0094 97,72 0,993 0,998 0,996 1,5788 0,9966 1,0087 (b)
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Tabela C - Cálculo dos parâmetros do coeficiente de atividade do sistema água (1) + ácido acético (2) para o teste de consistência das áreas dos dados ELV isobáricos a P=26,664 kPa (Othmer et al., 1952).
T x1 1 2 ln ( 1/ 2) 353,05 0,0000 - 0,979013 - 344,45 0,3084 1,357013 1,126017 0,18660 343,05 0,4546 1,299737 1,130889 0,13916 341,45 0,6330 1,199728 1,223601 -0,01970 340,65 0,7699 1,108575 1,412564 -0,24233 340,05 0,8578 1,058287 1,778473 -0,51910 339,85 0,9270 1,019984 2,315686 -0,81992 339,55 0,9670 1,012622 2,921436 -1,05953 339,55 1,0000 0,998937 - -
Figura A – Para o sistema água (1) + ácido acético (2), o comportamento da curva ln (𝛾1
𝛾2) vs. 𝑥1 utilizados para
o teste de consistência das áreas dos dados ELV isobáricos a P = 26,664 kPa (Othmer et al., 1952)
y = -6.2612x3+ 8.0752x2- 3.8633x + 0.7987 R² = 0.9993 -1.2 -1.0 -0.8 -0.6 -0.4 -0.2 0.0 0.2 0.4 0.0 0.2 0.4 0.6 0.8 1.0 ln (Y 1/Y 2) x1
Braz. J. of Develop., Curitiba, v. 5, n. 10, p. 21761-21782 oct. 2019 ISSN 2525-8761
Tabela D – Parâmetros dos coeficientes de atividade do sistema ácido propanoico (3) + ácido pentanóico (4) para o teste de consistência das áreas dos dados ELV isotérmicos a T = 413,15 K (Clifford et al., 2005).
P (kPa) x3 γ3 γ4 ln(γ3/γ4 ) 22,24 0,007 1,6590 1,0105 0,49577 23,35 0,025 1,4976 1,0019 0,401966 27,33 0,086 1,2959 1,0075 0,251733 30,85 0,147 1,2088 1,0039 0,185736 38,41 0,261 1,1549 1,0042 0,139823 48,71 0,403 1,0971 1,0440 0,049611 54,24 0,483 1,0592 1,0842 -0,02333 65,9 0,634 1,0299 1,1275 -0,09054 78,93 0,794 1,0042 1,2245 -0,19834 88,9 0,897 1,0012 1,3304 -0,28428 96,1 0,986 0,9897 1,5322 -0,43706 97,72 0,993 0,996 1,5788 -0,46067
Figura B – Comportamento dos parâmetros utilizados para o teste de consistência das áreas dos dados ELV isotérmicos a T=413,15 K (Clifford et al., 2005).
y = -2.2063x3+ 3.3792x2- 2.1028x + 0.4611 R² = 0.9911 -0.6 -0.4 -0.2 0 0.2 0.4 0.6 0 0.2 0.4 0.6 0.8 1 ln (y 1/y 2) x1