UNIVERSIDADE FEDERAL DO CEARÁ
PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA (RENORBIO-UFC)
CONTROLE DA ANTRACNOSE PÓS-COLHEITA DO MAMÃO COM LEVEDURAS KILLER
JAQUELINE RABELO DE LIMA
CONTROLE DA ANTRACNOSE PÓS-COLHEITA DO MAMÃO COM LEVEDURAS KILLER
Tese apresentada ao programa de pós-graduação em Biotecnologia – RENORBIO, da Universidade Federal do Ceará como parte dos requisitos para obtenção do título de Doutor em Biotecnologia, Área de concentração: Biotecnologia Industrial. Orientador: Prof. Dra. Luciana Rocha Barros Gonçalves
Co-Orientador: Dr. Francisco Marto Pinto Viana
A Deus.
A Deus, pai maravilhoso, obrigada por todos os anjos que colocastes em minha vida, eles tem tornado a caminhada muito mais fácil e prazerosa, por sua luz e força sempre presentes em minha vida;
À minha mãe, Dona Francisca, mulher simples que sempre acreditou na educação como condição fundamental para uma vida melhor;
Aos amados esposo e filho, Clodovagner e Pedro Wagner, pelo amor, cumplicidade, compreensão, carinho, dedicação e, principalmente, por toda a paciência sempre;
As irmãs Nágila, Lídia, Jarinete, Jaquelene e Clarinha cada uma, ao seu modo, tem sua parcela de crédito por esse trabalho;
Ao pesquisador Dr. Francisco Marto Pinto Viana; muito mais que orientador, foi e sempre será um verdadeiro Mestre; Agradeço a Deus a oportunidade da convivência, do enorme aprendizado e, sobretudo da amizade.
A Professora Doutora Luciana Rocha Barros Gonçalves, obrigada por acreditar nesse trabalho, quanto ele ainda era um projeto, obrigada pela confiança e apoio ao longo de toda a jornada;
Aos irmãos do coração, Jonas Almada e Juliana Serio, desde nosso reencontro há quase duas décadas, tem sido um presente divino compartilhar sua amizade. Obrigada por tudo;
A querida amiga, Celli Muniz, corretora, redatora, editora, mas, principalmente companheira sempre.
A querida amiga Claisa pelo apoio, paciência e amizade;
A querida amiga Vanessa Pieniz, não só pelas noites e fins de semana no
laboratório, mas pelo ―conjunto da obra‖;
Aos pesquisadores do Laboratório de Fitopatologia da Embrapa, Dr. Freire, Dr. Emilson e Dr. Marlon, obrigada pelo incentivo e apoio;
Aos amigos do Laboratório de Fitopatologia da Embrapa Aldiel, Joilson, Samana, Gustavo, Glauber, Edite e Raiza, a convivência foi maravilhosa, obrigada;
Ao Professor José Tadeu de Oliveira e Darcy Mayra, pela parceria nos testes enzimáticos e, sobretudo pela disponibilidade e receptividade de sempre;
Ao senhor Severino Moacir, inestimável colaboração na doação dos frutos; À Fundação Cearense de Apoio a Pesquisa (FUNCAP) pelo apoio financeiro À Empresa Brasileira de pesquisa Agropecuária- EMBRAPA, onde este trabalho foi desenvolvido;
"Deus nos concede, a cada dia, uma página de vida nova no livro do tempo. Aquilo que colocarmos nela, corre por nossa conta."
Este trabalho objetivou isolar leveduras capazes de produzir e excretar a toxina killer a partir de frutos tropicais, para atuarem no controle biológico de fitopatogenos em pós-colheita. Inicialmente, foram isoladas 580 leveduras a partir de 87 amostras de frutos tropicais (mamão, caju, sapoti, murici, manga e acerola), dentre as quais 29 exibiram o fenótipo killer. Todas as cepas killer foram identificadas pelo sequenciamento da região D1/D2 do 28S rRNA, em que ficou demonstrada a presença de Candida aaseri, Wickerhamomyces anomalus, Pichia kluyveri, Meyerozyma guilliermondii, Kodamaea ohmeri. Cinco leveduras foram capazes de inibir em 100% a germinação de conídios em meio líquido e reduzir o crescimento micelial, em meio sólido de Colletotrichum gloeosporioides in vitro, com destaque para M. guilliermondii (cepa 443) que foi capaz de reduzir o crescimento micelial do fitopatogeno em 60% em meio sólido. As duas leveduras com melhores resultados in vitro foram testadas in vivo, contra C. gloeosporioides, agente da antracnose em pós-colheita de mamão e outros frutos tropicais, W. anomalus (cepa 422) e M. guilliermondii (cepa 443). Também foi investigada a ocorrência de micoparasitismo como mecanismo de ação do antagonista por meio de microscopia eletrônica de varredura – MEV e detecção das enzimas hidrolíticas,
quitinase e β-1-3 glucanase. Os resultados demonstraram que, quando aplicada simultaneamente ao fitopatógeno e incubadas em câmara úmida (95% U.R.) a 28 °C, as leveduras W. anomalus (cepa 422) e M. guilliermondii (cepa 443) foram capazes de reduzir a ocorrência da doença em 24,62%, 7,0% e 20,68%, respectivamente, até 06 dias após a inoculação. Verificou-se que o tempo de inoculação da levedura teve significativa influência sobre sua ação antagonista; a aplicação dos agentes com 24 ou 12 horas de antecedência em relação ao fitopatógeno resultou em redução de 30% e 13,75% para W. anomalus (cepa 422), em 40% e 35% para W. anomalus (cepa 440) e em, 41,17 e 31,35% para M. guilliermondii (cepa 443) respectivamente. A ocorrência de micoparasitismo foi confirmada através de eletromicrografias que evidenciaram a união das leveduras às hifas do C. gloeosporioides, provocando, em alguns casos, perda de turgidez e até ruptura dessas; tudo isso associado à
422), o tratamento que utilizou amido (2%) reduziu em 48,3% a ocorrência de doenças, já para M. guilliermondii, (cepa 443), os tratamentos mais eficientes no controle da doença foram os que utilizaram gelatina e cera líquida de carnaúba (2%) como veículos de aplicação, ambos foram capazes de reduzir em 50% a ocorrência de doenças em pós-colheita de mamões. Eletromicrograficas revelaram que todos os veículos de aplicação foram eficientes em permitir a fixação das leveduras na superfície do fruto. Leveduras killer podem atuar no biocontrole em pós-colheita de mamão e estes microrganismos atuam através de uma variedade de mecanismos de ação, o que potencializa seu efeito protetor e amplia sua eficiência de ação.
SUMÁRIO
1.0 Introdução... 14
2.0 Capítulo 1- Estado da Arte... 15
2.1 A cultura do mamão... 15
2.2 Doenças do mamão... 19
2.3 Controle biológico de doenças ... 22
2.4 Leveduras no controle biológico de fitopatógenos... 27
2.5 Mecanismos de ação envolvidos no controle biológico por levedura... 30
2.6 Leveduras killer... 32
2.7 Referências Bibliográficas... 34
3.0 Justificativa e Hipóteses………... 46
4.0 Objetivo Geral……….. 47
4.1 Objetivos Específicos………... 47
5.0 Capítulo 2- Isolation, identification and activity in vitro of killer yeasts against Colletotrichum gloeosporioides isolated from tropical fruits……… 48
6.0 Capítulo 3- Use of killer yeast in the management of postharvest papaya anthracnose... 72
7.0 Capítulo 4 - Efficiency of a yeast-based formulation for biocontrol of postharvest anthracnose of papayas ... 96
8.0 Conclusões finais... 115
9.0 Perspectivas Futuras... 116
1.0Introdução
O Brasil está entre os principais produtores de frutos tropicais do mundo; segundo dados da Food and Agriculture Organization - FAO, mais de 718.790 toneladas de frutos tropicas foram produzidos no país em 2009 (FAOSTAT, 2011). No entanto, o volume comercializado é significativamente inferior à produção, isto porque doenças na pré e na pós-colheita são responsáveis por perdas substanciais destas, que podem chegar a 30% da quantidade total produzida (TAVARES, 2004).
Agentes químicos têm sido extensivamente utilizados no controle das podridões de frutos na pré e pós-colheita (MANSO e NUNES, 2011), contudo, nos últimos anos, há uma tendência crescente quanto à restrição de qualquer tratamento químico em pós-colheita, em função dos riscos potenciais de contaminação química das frutas (JAMALIZADEH et al., 2008; ROBIGLIO et al., 2011). Nery-Silva et al. (2007) acrescentam que os mercados consumidores, externo e interno, estão cada vez mais exigentes, e características de aceitação do produto como aparência, aroma e sabor não são mais os únicos requisitos para se garantir a aceitação nesses mercados; segundo esses autores, atualmente, aspectos como ausência de podridões e baixo nível de resíduos de agrotóxicos, tanto aqueles aplicados na fase pré como em pós-colheita, são importantes, também, na avaliação da qualidade dos frutos.
Soma-se a isso, o declínio da eficiência dos principais princípios ativos utilizados, em decorrência do aumento de isolados resistentes envolvidos nas podridões (JANISIEWICZ E KORSTEN, 2002; LIMA, et al., 2011; PIMENTA et al., 2010) e implicações técnicas, em função da restrição de uso de produtos químicos, nos períodos próximo e logo após a colheita dos frutos (MOREIRA et al., 2008).
Nesse contexto, atenção especial vem sendo dada ao uso de produtos alternativos que apresentem efeito no controle de doenças pós-colheita, com menores riscos associados (MARI et al.,1999; KEFIALEWA e AYALEWB, 2008; SPADARO e GULLINO, 2004), esta demanda tem resultado em inúmeras pesquisas que buscam a identificação de novos agentes com uso potencial na pós-colheita de frutos, principalmente, agentes de biocontrole (HASHEM e ALAMRI 2009; CAO et al., 2009; KONG et al., 2010; JANISIEWICZ et al., 2010; ROSA-MAGRI et al., 2011; QIN et al., 2010; ZHANG et al., 2011; LI et al., 2011).
biocontrole, tais como, inocuidade, facilidade de manipulação e uso, baixo requerimento nutricional e ausência de produção de compostos tóxicos (ROSA-MAGRI et al., 2011 WANG et al., 2010; ROSA et al., 2010; COELHO et al., 2008; DRUVEFORS, 2004); além disso, algumas espécies de leveduras são capazes de produzir uma toxina glicoprotéica, a toxina killer, que pode ter efeito direto sobre as hifas de fitopatógenos, o que vem sendo comprovado por vários trabalhos científicos na última década (GOUVEIA, 2007; COELHO et al., 2007; HASHEM et al., 2009).
Embora um grande número de pesquisas estejam sendo conduzidas objetivando a identificação de agentes de biocontrole de frutas, a grande maioria das pesquisas concentram-se na prospecção de agentes com ação sobre fitopatógenos de maçãs, peras, morangos, uvas e citros, sendo os estudos para outros frutos ainda incipientes (JANISIEWICZ et al., 2010). Assim, estudos que visem a prospecção e a utilização de microrganismos antagonistas que possam ser empregados como agentes de biocontrole de doenças de frutos tropicais são fundamentais, dada a importância econômica desta atividade produtiva para o Brasil e, sobretudo para o Nordeste, região que produz a maior parte do mamão brasileiro.
2.0Capítulo 1 - Estado da Arte
2.1 A cultura do mamão
O mamoeiro (Carica papaya L.) é uma espécie herbácea perene, adaptada ao clima tropical, cujo centro de origem é, provavelmente, o noroeste da América do sul, vertente oriental dos Andes, ou, mais precisamente, a Bacia Amazônica Superior, onde apresenta diversidade genética máxima (SALOMÃO et al., 2007). É uma das fruteiras mais comuns em quase todos os países da América tropical, amplamente conhecido no Oriente já no início do século XVIII, sendo agora largamente cultivado na Índia, Sri Lanka, Arquipélago Malaio e em muitos outros países asiáticos, bem como, nos países da América do Sul, América Central e Antilhas, além da África tropical, Havaí e Austrália (TRINDADE et al., 2000).
Nessas condições apresenta ciclo semi-perene, com pico de produção entre três a cinco anos, sendo uma das poucas frutíferas com capacidade de produzir o ano inteiro (RAMOS et al., 2008)
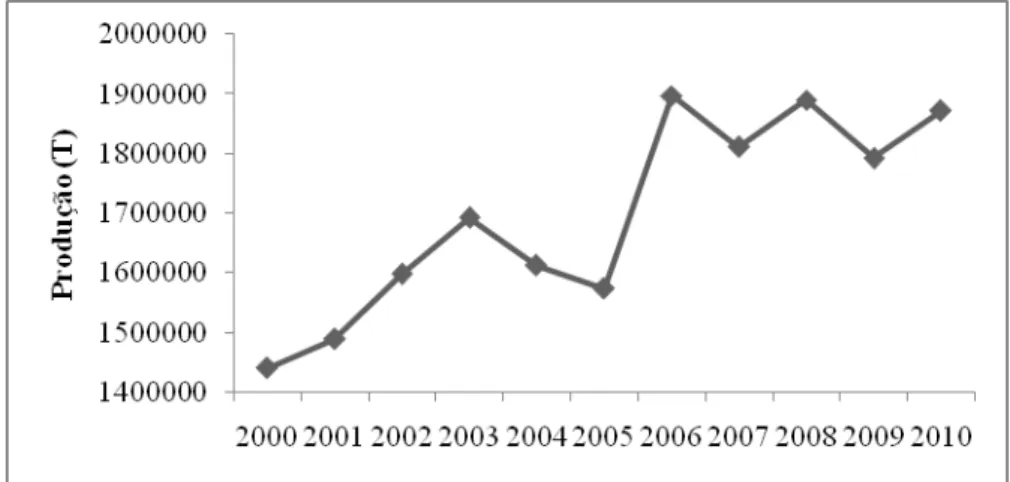
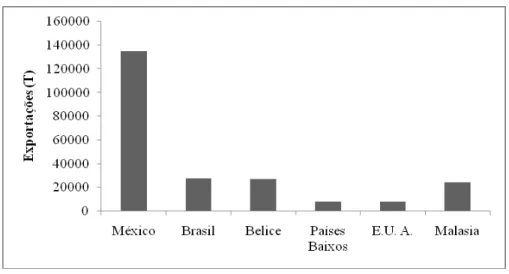
O Brasil é o segundo maior produtor mundial de mamão (Carica papaya L.), estando atrás apenas da Índia. Em 2010 foram produzidos 1.871,300 toneladas da frutas no país (Fig 2.1). Embora a produção tenha aumentado cerca de 30% na ultima década, esse aumento não tem sido regular, sendo evidenciada evolução de 2000 a 2003, com queda nos anos de 2004 e 2005 e novo aumento a partir de 2006; ano a partir do qual a produção praticamente se estabilizou em cerca de 1.800,000 toneladas (Fig 2.2). O país também é o segundo maior exportador do fruto, e exportou em 2009, 27.554 toneladas Fig. 2.3 (FAOSTAT, 2011).
Fig. 2.1- Principais países produtores de mamão em 2010, segundo dados do FAOSTAT.
Fig. 2.3- Principais países exportadores de mamão em 2009, segundo dados do FAOSTAT.
Tabela 2.1- Principais Estados produtores de mamão no Brasil entre 2006 e 2010
Fonte: IBGE (2011).
2.2 Doenças do mamão
O mamoeiro é susceptível a uma grande variedade de espécies de microrganismos patogênicos que podem atacar diferentes partes da planta, desde as raízes até as folhas e flores e o próprio fruto. A podridão-do-colo, a antracnose, a pinta-preta e as viroses são as principais doenças que acometem os mamões (SALOMÃO et al., 2007).
A antracnose, além de ser uma das doenças mais sérias do mamoeiro, pode atacar não só os frutos, mas, também, causar amarelecimento e danos aos pecíolos das folhas (GAYET et al., 1995). Esta doença ocorre em todas as regiões produtoras de mamão do mundo e, por causar importantes perdas pós-colheita, é um dos fatores limitantes à exportação de mamão (LIBERATO e TATAGIBA, 2001). Isto porque, ainda que os frutos colhidos não
Estados Produção (t)
2006 2007 2008 2009 2010
Bahia 914.679 863.828 902.525 891.236 910.131
Espírito Santo 752.503 646.273 630.124 550.057 613.734
Ceará 62.856 79.556 99.522 104.954 102.878
Rio Grande do Norte 40.179 89.203 106.064 104.106 86.249
Paraíba 28.697 28.027 28.906 27.776 29.507
Pará 16.700 16.040 16.052 14.120 15.267
Minas Gerais 13.782 15.633 18.036 19.876 30.056
Pernambuco 8.599 9.262 17.989 18.180 17.578
Sergipe 10.761 12.173 12.479 14.568 17.202
São Paulo 10.182 10.900 11.494 6.064 7.160
Outros 38.701 40.640 47.095 41.657 41.533
apresentem sintomas da doença, ela pode se manifestar nas fases de embalagem, transporte, amadurecimento e comercialização (OLIVEIRA et al., 2000).
A antracnose é causada pelo fungo Colletotrichum gloeosporioides (SERRA e SILVA, 2004; VIDA et al., 2006), e embora seja uma doença de grande importância na pós-colheita, a infecção geralmente se inicia no campo, permanecendo o patógeno quiescente até o inicio do amadurecimento do fruto, quando o micélio fúngico, se torna visível. O patógeno é favorecido por temperaturas em torno de 28 °C e umidade relativa do ar superior a 95% (SALOMÃO et al., 2007).
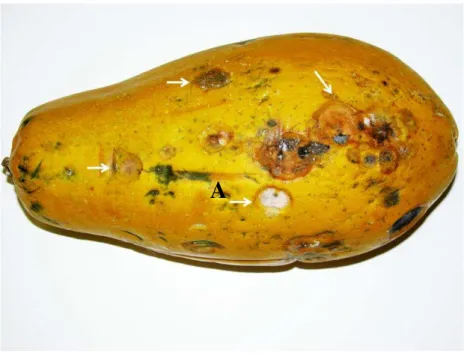
A antracnose é caracterizada pela ocorrência de lesões grandes e arredondadas, necróticas e de bordos ligeiramente elevados com o centro dos tecidos deprimidos, nos quais são produzidas massas de conídios alaranjados (Fig. 2.5). O patógeno penetra nos frutos ainda verdes que apresentam completa sanidade, permanecendo inativo até o seu amadurecimento, podendo, então, apresentar grande quantidade de lesões devido à colonização do tecido do hospedeiro (BAILEY e JEGER, 1992). Tais sintomas se manifestam em plantas de qualquer idade, sendo os danos mais evidentes nos frutos e manifestando-se, geralmente após a colheita, quando os frutos estão prontos para a comercialização (FERNANDES et al., 2002).
Figura 2.5- Mamão exibindo diversas lesões características de antracnose causada por C. gloeosporioides. Setas destacam lesões características da doença.
Dada sua importância para a cultura do mamão, frequentemente são utilizados fungicidas na pré- e na pós-colheita para o controle dessa doença. Contudo, o controle químico da antracnose requer aplicações frequentes de fungicidas, o que representa um risco a saúde humana e ambiental, além de possibilitar o desenvolvimento de patógenos resistentes (ONYEKA et al. 2006).
Além da antracnose C. gloeosporioides é também o agente causal da chamada
―mancha chocolate‖ que se caracteriza pela ocorrência de pequenas manchas superficiais de coloração marrom avermelhada (ANDRADE et al., 2007). As vezes, as lesões mostram-se deprimidas, podendo coalescer e ocupar parte da superfície do fruto (SALOMÃO et al., 2007) (Fig. 2.6). As diferenças entre a antracnose e da mancha-chocolate são atribuídos a diferentes raças fisiológicas do patógeno, porém, fatores ambientais ou, possivelmente, o estádio de maturação dos frutos levem a diferenças na expressão dos sintomas (OLIVEIRA e SANTOS FILHO, 2006).
Figura 2.6- Mamão exibindo lesão coalescida, característica da mancha chocolate, causada por C. gloeosporioides. Seta indica lesão característica da doença.
2.3 Controle biológico de doenças
O controle biológico de enfermidades de plantas vem sendo empregado pelo homem, enquanto agricultor, desde a antiguidade até os dias atuais. Entretanto, o uso de microrganismos para o biocontrole de enfermidades de plantas, uso este menos especulativo e de forma mais científica e direcionada, só teve início há algumas décadas (BASHAN, 1998).
O principal objetivo do controle biológico de doenças é reduzir perdas causadas por patógenos com menor impacto ambiental, menores risco para o homem, bem como, redução de custos em relação ao emprego de métodos químicos tradicionais (MORAES, 1992).
O termo controle biológico foi empregado pela primeira vez em 1919, por H. S. Smith, para designar o uso de inimigos naturais para o controle de insetos-praga. Posteriormente, essa expressão foi usada para designar todas as formas de controle que envolvessem métodos biológicos, alternativas aos produtos químicos (KAGIMURA et al.,
2011). O Controle biológico ou ―biocontrole‖ tem sido usado em diferentes campos da
biologia, mais notadamente na entomologia e na fitopatologia. Nesta última, o termo se aplica ao emprego de microrganismos antagonistas para a supressão de doenças, bem como, no de patógenos específicos para o controle de populações de plantas invasoras (PAL e GARDENER, 2006).
Cook & Baker (1983) definiram controle biológico como a redução da soma de inóculo ou atividades determinantes da doença provocada por um patógeno, realizada por um ou mais organismos que não o homem. Para Mariano et al. (2005), o controle biológico diz respeito ao controle de um patógeno por um antagonista, sendo o antagonista, definido como um agente biológico com potencial para interferir nos processos vitais dos fitopatógenos; definição corroborada por Tedesco (2009) que define controle biológico como o controle de um organismo por outro, sempre visando à redução do patógeno. Entretanto, a mais simples e direta definição de controle biológico, segundo Bettiol e Ghini (1995) e Fialho (2004), pode ser resumida como sendo o controle de um microrganismo por meio de outro organismo, sendo esta uma definição corrente entre fitopatologistas.
faça sua aplicação. Entretanto, uma maior atenção tem sido dada ao controle de fungos patogênicos, isso porque esses microrganismos são responsáveis pela maioria das doenças de plantas e, ainda, por serem mais facilmente controlados por outros microrganismos (MORAES, 1992).
Segundo Baker e Cook (1974), o controle biológico deve atuar em um contexto de equilíbrio biológico, sem o qual sua chance de sucesso será menor, isto porque, ao contrário do controle químico, o biológico não apresenta efeito imediato e espetacular (BETTIO e GHINI, 1995) e o nível de controle obtido com o método biológico, isoladamente, pode estar abaixo do necessário para que danos à produção não ocorram; assim a integração de medidas de controle pode ser uma estratégia interessante (BETTIOL E GHINI, 1995; KAGIMURA et al., 2011). A ação integrada de diferentes métodos visa manter, através de certas práticas um equilíbrio, de modo que o hospedeiro, na presença do patógeno, não sofra danos significativos, em função da ação controladora dos organismos não patogênicos do sistema (Júnior et al., 2000). Morandi e Bettiol (2009) acrescentaram que o uso dessa estratégia de controle pode ser acompanhado por práticas culturais para criar um ambiente favorável aos antagonistas, à resistência da planta hospedeira ou a ambos.
Os mecanismos das interações entre microrganismos patogênicos e antagonistas podem ser divididos em antibiose, competição, parasitismo, hipovirulência, predação e indução de defesa do hospedeiro. Apesar desta divisão, um microrganismo pode agir por meio de mais de um mecanismo, sendo esta uma característica desejável em um antagonista, pois, assim, a probabilidade de sucesso do controle será aumentada (BETTIOL e GHINI, 1995). Os mecanismos de biocontrole são as interações antagônicas por meio das quais os antagonistas ativamente expressam oposição aos patógenos e reduzem a ocorrência das doenças (MARIANO et al., 2005).
O desenvolvimento do controle biológico clássico começa com o isolamento de cepas que ocorrem, naturalmente, em associação com o vegetal-alvo, para obtenção de uma ou mais espécies possivelmente antagônicas. Esta etapa é seguida de experimentos de seleção de antagônicos, multiplicação desses agentes em laboratório e testes de biocontrole em campo (PIMENTA et al., 2009).
Embora já existam no mercado produtos para biocontrole de doenças, os quais oferecem como ingrediente ativo é um microrganismo, a maioria dos testes para o uso desses agentes ainda se concentra nos laboratórios de pesquisa (ROSA, 2009). Isto ocorre por que o processo de seleção, padronização e produção de agentes para biocontrole em substituição aos agentes químicos é dependente da disponibilidade e da efetividade dos agentes de controle (SILVA et al., 2008), além da necessidade de comprovação de inocuidade do agente biológicos utilizados (SUNDH e MELIN, 2011).
Poucos são os microrganismos com potencial antagônico que, selecionados in vitro, têm sucesso quando transferidos para o campo. Na pós-colheita, onde as condições de ambiente podem ser controladas a melhor opção para uso desse tipo de agentes (BASTIAANSE et al., 2010). Janisiewicz e Korsten (2002) enumeram como principias razões para maior efetividade desses agentes na pós-colheita a possibilidade de regulação dos parâmetros ambientais durante o armazenamento de frutas; a aplicação dos agentes limitada à fruta e o alto valor de varejo das frutas frescas, que podem justificar o custo potencialmente mais elevado dos tratamentos biológicos em comparação aos métodos químicos (JANISIEWICZ e KORSTEN, 2002).
A capacidade de um organismo atuar como agente de controle biológico de doenças deve-se a uma variedade de mecanismos de ação (FILHO et al., 2010 ) dentre esses a competição por espaço e nutrientes (WANG et al., 2010; ROSA et al., 2010), a indução de resistência (ARAUJO e MENESES, 2009; CHALFOUN et al., 2011), a antibiose (LOUSADA et al., 2009), a promoção de crescimento por outros microrganismos (ARAUJO e MENESES, 2009, CORREA et al., 2011), e a ocorrência de parasitismo (KUPPER et al., 2009).
Uma grande variedade de microrganismos tem sido avaliada como potenciais agentes de controle biológico, e um dos primeiros com ação comprovada em pós-colheita foi o Bacillus subtilis, bactéria que tem sido reportada em diferentes trabalhos de pesquisa como eficiente no biocontrole de uma ampla variedade de fitopatógenos (ARAUJO e MENESES, 2009, KUPPER et al., 2003, KUPPER et al., 2009).
tocante à espécie B. subtilis, a mesma mostra-se como excelente agente de biocontrole, podendo ser encontrado como PGPR (rizobactérias promotoras de crescimento de plantas) e bactérias epifíticas e endofíticas (GUPTA et al., 2000; ONGENA et al., 2007; FILHO et al., 2010).
Além de Bacillus subtilis, outras bactérias também tem sido reportadas como eficazes no controle biológico de patógenos, dentre as quais podemos citar os Estreptomicetos, empregados no controle de Scutellonema bradys em túberas de inhame (SOUSA, 2009), Bacillus cereus (CORRÊA et al., 2011), Bacillus subtilis e B. pumilus (NOGUEIRA et al., 2011), além daquelas do gênero Pseudomonas, especialmente as espécie P. putida e P. fluorescens, (CAMPOS et al., 2008).
O fungo Trichoderma spp. também tem sido amplamente usado como importante agente de biocontrole desde os anos 90 (LUCON et al, 2009; SILVA et al., 2008; MOHAMED e HAGGAG, 2006; FORTES et al., 2007). Martins-Corder e Melo, (1998), relacionaram sua ação antagonista a produção de metabólitos voláteis e não voláteis, hiperparasitismo, e competição por espaço, nutrientes e oxigênio, além de sua ação como promotor de crescimento.
Existem, ainda, relatos do emprego de Actinobactérias (FILHO et al.,2008), além de produtos registrados que utilizam como principio ativo leveduras ou ―organismos similares a leveduras‖. A tabela 2.2 apresenta um resumo dos principais produtos de biocontrole
Tabela 2.2- Inventário dos biopreservantes comercializados que tem como principio ativo leveduras ou fungos yeasts-like
Organismo Produto Nome da Companhia Aplicação Registro
Hemiascomycetes
Candida oleophila I-182 Aspire Ecogen US Pós-colheita de plantas e frutas Registrado como biopesticida no E.U.A. Withdrawna a
Candida oleophila cepa O Nexy BioNext, Belgica Lasaffre, França
Fungicida em pós-colheita de maçãs e peras
Registrado como biopesticida nos EUA em 2009 b
Em avaliação como biopesticida na EU
c
Candida sake CPA-1 Candifruit Sipcam-Inagra, Spain Fungicida de frutos Registrado como agente fortalecedor de plantas na Espanha
Metschnikowia Fructicola Shemer Agro Green, Israel Fungicida de frutos Registrado como biopesticida em Israel Outras leveduras ou fungos ―leveduras-like‖
Ampelomyces quisqualis M-10 AQ10 Ecogen, US Fungicida em vegetais e frutas Registrado como biopesticida no EUA Withdrawna a
Ampelomyces quisqualis M-10 AQ10 Intrachen, Itália Fungicida de uvas, legumes e frutas Registrado como biopesticida na EU em 2004
Aureobasidium pullulans BoniProtect BioProtect, Alemanha Fungicida em podridões de frutos Registrado como agente fortalecedor de plantas na Alemanha
Cryptococcus albidus YieldPlus Anchor Yeast, África do
Sul. Lallemand, França Fungicida de vegetais e frutas Registrado com biopesticida na África do Sul Pseudozyma flocculosa PF-A22 Sporodex Produtos vegetais, Canadá Fungicida de rosas e pepinos Registrado como biopesticida nos EUA
e no Canadá
a Estes dois produtos foram retirados em 2004, quando a empresa saiu do negócio e a taxa de manutenção não foi paga.
b Síntese de documentos que tratam das aprovações de biopesticidas específico nos EUA, por exemplo, para C. oleophilacepa O, estão disponíveis na página da Agência de
Proteção Ambiental dos EUA (EPA, EUA 2009). c Integralidade do processo apresentado foi confirmada em uma decisão, publicada em 2007 (UE 2007)
2.4 Leveduras no controle biológico de fitopatógenos
Dentre os microrganismos com ação potencial já comprovada como agente de biocontrole, as leveduras despontam como agentes ideais, em função, principalmente, de sua habilidade em colonizar a superfície de folhas e frutos (ROSA-MAGRI et al., 2011), alta taxa reprodutiva e baixo requerimento nutricional (DROBY e CHALUTZ, 1994), bem como, de sua reconhecida inocuidade, comprovada por centenas de anos de uso em fermentações industriais (COELHO et al., 2003; DRUVEFORS, 2004). Além disso, leveduras não produzem esporos ou micotoxinas como os fungos filamentosos (FAN e TIAN, 2000), são relativamente fáceis de cultivar e têm várias características que podem ser manipuladas para aumentar a eficácia de uso (PIMENTA et al., 2009).
Além de todas as características já apresentadas, uma se destaca em relação às demais, a inocuidade desses microrganismos quando comparados às bactérias. Leveduras do gênero Saccharomyces são classificadas pelo Food and Drug Administration (FDA) como
―Geralmente reconhecido como seguro‖ (GRAS), enquanto o gênero Pichia, um dos mais estudados como agente de biocontrole, foi reconhecido pela European Food Safety Autority (EFSA) como ―qualified presumption of safety (QSP)‖ (Walker, 2011). Além disso, leveduras são fáceis de manipular, tem baixo requerimento nutricional e são amplamente utilizadas em processos biotecnológicos (DRUVEFORS, 2004; Rosa, 2009).
Quando isoladas a partir do nicho do patógeno, as leveduras apresentam uma maior eficácia em sua ação como agente na prevenção de doenças em pós-colheita (ROSA-MAGRI et al, 2011, ROBIGLIO et al., 2011). O isolamento das leveduras a partir da superfície de ramos, folhas, flores e frutos, ou de estruturas internas da planta (endofíticos), ou do solo são fundamentais para evitar o risco associado à introdução de organismos exóticos e aumenta a chance de seleção de um organismo capaz de sobreviver nas condições ambientais da área de aplicação (PIMENTA et al., 2009).
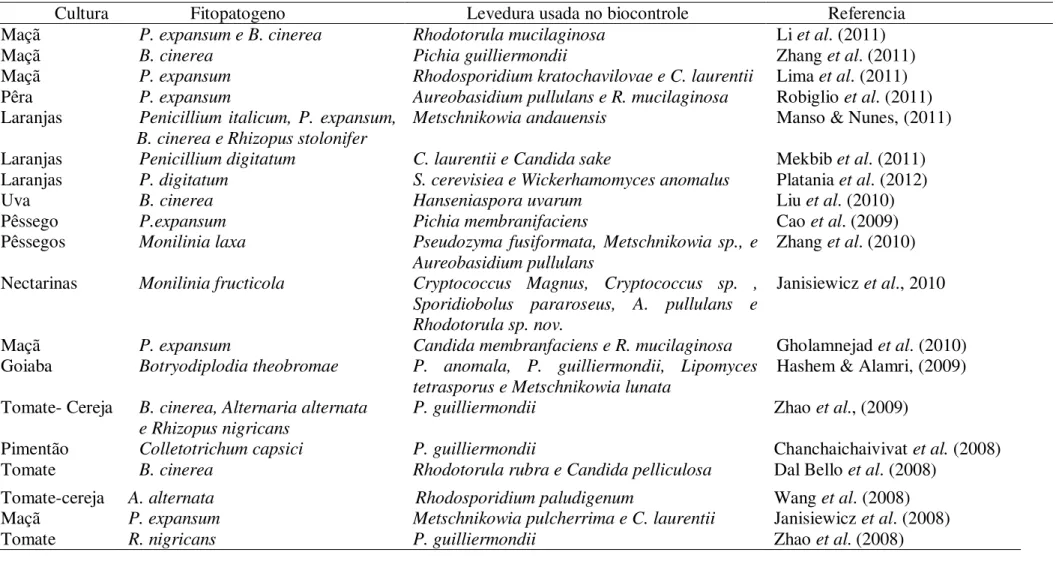
Tabela 2.3- Pesquisas recentes que descreveram a ação de leveduras sobre fitopatógenos em pós-colheita.
Cultura Fitopatogeno Levedura usada no biocontrole Referencia
Maçã P. expansum e B. cinerea Rhodotorula mucilaginosa Li et al. (2011)
Maçã B. cinerea Pichia guilliermondii Zhang et al. (2011)
Maçã P. expansum Rhodosporidium kratochavilovae e C. laurentii Lima et al. (2011) Pêra P. expansum Aureobasidium pullulans e R. mucilaginosa Robiglio et al. (2011) Laranjas Penicillium italicum, P. expansum,
B. cinerea e Rhizopus stolonifer
Metschnikowia andauensis Manso & Nunes, (2011)
Laranjas Penicillium digitatum C. laurentii e Candida sake Mekbib et al. (2011)
Laranjas P. digitatum S. cerevisiea e Wickerhamomyces anomalus Platania et al. (2012)
Uva B. cinerea Hanseniaspora uvarum Liu et al. (2010)
Pêssego P.expansum Pichia membranifaciens Cao et al. (2009)
Pêssegos Monilinia laxa Pseudozyma fusiformata, Metschnikowia sp., e Aureobasidium pullulans
Zhang et al. (2010) Nectarinas Monilinia fructicola Cryptococcus Magnus, Cryptococcus sp. ,
Sporidiobolus pararoseus, A. pullulans e Rhodotorula sp. nov.
Janisiewicz et al., 2010
Maçã P. expansum Candida membranfaciens e R. mucilaginosa Gholamnejad et al. (2010)
Goiaba Botryodiplodia theobromae P. anomala, P. guilliermondii, Lipomyces tetrasporus e Metschnikowia lunata
Hashem & Alamri, (2009) Tomate- Cereja B. cinerea, Alternaria alternata
e Rhizopus nigricans
P. guilliermondii Zhao et al., (2009)
Pimentão Colletotrichum capsici P. guilliermondii Chanchaichaivivat et al. (2008)
Tomate B. cinerea Rhodotorula rubra e Candida pelliculosa Dal Bello et al. (2008)
Tomate-cereja A. alternata Rhodosporidium paludigenum Wang et al. (2008)
Maçã P. expansum Metschnikowia pulcherrima e C. laurentii Janisiewicz et al. (2008)
Embora existam um grande número de trabalhos de bioprospecção de leveduras para controle biológico, poucos produtos comerciais à base de leveduras ou de ―yeasts-like‖
para biocontrole de podridões pós-colheita estão disponíveis no mercado, dentre os quais cita-se o Nexy®, cujo principio ativo é a levedura Candida oleophila ‗cepa O‘; e o Candifruit®, registrado na Espanha como fungicida para tratamento de frutos, cujo principio ativo é a levedura Candida sake ‗CPA-1‘ (SUNDH e MELIN, 2011).
Além da identificação do agente com ação sobre o fitopatógeno, a utilização prática de microrganismos no biocontrole exige a padronização de metodologias de aplicação, assim como formulações que incluam veículos capazes de manter a viabilidade do agente nas condições de uso, trabalhos como o desenvolvido por Kinay e Yildiz (2008) que avaliaram 11 formulações à base de Metschnikowia pulcherrima e Pichia guilliermondii para o controle do mofo-azul e do mofo-verde em citros, verificando que os melhores resultados foram obtidos com a utilização de alginato de sódio 1,5% e alginato de sódio 1,5% + sucrose a 1% + extrato de levedura a 1%, com redução de 40% para o mofo-verde e 50% para o mofo-azul, respectivamente. Mounir et al. (2007) avaliando a eficácia de formulações à base de levedura-like, Aureobasidium pullulans secas, contra Penicillium expansum em maçãs armazenadas a 5 e 25 °C observou elevada eficiência de controle, em escala piloto. Os autores relataram que o processo de secagem não interferiu na capacidade de sobrevivência da levedura-like na superfície no fungo, assim como não afetou sua eficácia de ação.
2.5 Mecanismos de ação envolvidos no controle biológico por levedura
O entendimento dos mecanismos de ação envolvidos na ação antagônica é fundamental para garantir a segurança de uso do agente de biocontrole. A compreensão desses mecanismos possibilita o desenvolvimento de protocolos adequados para a utilização de agentes antimicrobianos no controle biológico (MEKBIB et al., 2011). Além disso, Platania et al. (2012) destacam que a investigação dos mecanismo envolvidos na ação antagônica de leveduras, permite a identificação de todas as propriedades do microrganismo, possibilitando a seleção daqueles mais adequados e evitando, por exemplo, o desenvolvimento de fenômenos de resistência, o que tornaria o biocontrole mais eficaz (PLATANIA et al., 2012).
de resistência (NANTAWANIT et al., 2010; ZHAO et al., 2009), micoparasitismo (LONG et al., 2005), indução da produção de espécies reativas de oxigênio (MACARISIN et al., 2010) e produção de toxinas que atuam sobre a parede celular dos fitopatógenos, tais como a toxina killer (COELHO et al., 2003).
A habilidade das leveduras em consumir nutrientes da superfície de plantas associada à sua elevada taxa metabólica está diretamente relacionada ao principal mecanismo de ação envolvido na ação antagônica desses microrganismos, que é a competição por espaço e nutrientes, mecanismo que parece exercer função crucial sobre os outros mecanismos de ação envolvidos no biocontrole em pós-colheita de frutos (JAMALIZADEH et al., 2011). Zhang et al. (2010) relacionaram a atividade de Pseudozyma fusiformata, Metschnikowia sp. e Aureobasidium pullulans sobre o fitopatógeno Monilinia laxa, relatando a competição por espaço e nutrientes, como principal mecanismo de ação envolvido na ação antagônica, já que a utilização de cultura filtrada e autoclavadas não teve qualquer ação sobre o fitopatógeno. Avaliando a ação de Rhodotorula mucilaginosa sobre B. cinerea, Li et al. (2011) também descreveram a competição por espaço e nutrientes, dentre os mecanismos de ação verificados. Estudando a ação da levedura Torulaspora globosa sobre Colletotrichum sublineolum, agente causal da antracnose em sorgo, Rosa et al. (2010) não observaram nenhum outro mecanismo de ação, além da competição por espaço e nutrientes, uma vez que o isolado não foi capaz de produzir enzimas hidrolíticas, compostos sideróforos e nem compostos voláteis. Cryptococcus laurentii e Candida sake foram capazes de reduzir de 80 a 90% a incidência de mofo verde causado por P. digitatum em laranjas incubadas a 7 °C por um período de 30 dias, sendo a competição por espaço e nutrientes listada como um dos mecanismos de ação presentes (MEKBIB et al., 2011).
A excelente capacidade de colonizar a superfície de frutos também tem sido descrita como um dos mecanismos de ação das leveduras no controle biológico, este mecanismo tem sido comprovado por meio de observações microscópicas, ótica e eletrônica, que demonstram, não só a agressiva colonização das hifas por leveduras, mas, em alguns casos, a perda de turgidez e até danos físicos nessas hifas. A capacidade de parasitar as hifas do fitopatógeno, causando danos físicos, foi descrita por Chan e Tian (2005) que observaram uma ligação de Pichia membranefaciens às hifas de Monilinia fruticola. Esses autores relataram ainda acúmulo de matriz extracelular ao redor das hifas do fitopatógeno. Hashem e Alamri (2009) também verificaram forte ligação de Pichia anomala às hifas do fitopatógeno Botryodiplodia theobromae através de microscópio eletrônico de varredura, tendo, também relatado acúmulo de matriz extracelular, além de formação de regiões côncavas nas hifas. Zhang et al. (2011) evidenciaram forte aderência de Pichia guilliermondii às hifas e esporos de Botrytis cinerea por Pichia guilliermondii, sendo que cepas daquela mesma espécie de levedura já haviam sido descritas por Chanchaichaovivat et al. (2008) como capazes de colonizar hifas e esporos de Colletotrichum capsici.
Além disso, leveduras também podem atuar como ativadores de respostas defensivas pelas plantas e até por frutos e, desse modo, proteger a planta ou frutos contra o ataque de fitopatógenos. Zhao et al. (2009) avaliando a ação de Pichia guilliermondii em associação com tratamento térmico sobre Bacillus cinerea, Alternaria alternata e Rhizopus nigricans em tomate-cereja relataram um rápido aumento de H2O2 e a deposição de lignina no fruto, em paralelo ao aumento da produção de fenilalanina-amônia-liase (PAL) e β -1-3-glucana, eventos que, segundo os autores, estão associados com as respostas de defesa da planta. A indução de resistência também foi descrita por Li et al. (2011) como um dos mecanismos de ação envolvidos na ação de R. mucilaginosa sobre B. cinerea.
2.6 Leveduras killer
neutras seriam aquelas que não produzem toxinas, porém são imunes a elas (HIDALGO e FLORES, 1994).
A toxina killer é classificada, de acordo com seu espectro de ação, em K1, K2, K3 e assim por diante até K11 (IZGU et al., 1997). As toxinas killer de linhagens de Saccharomyces foram agrupadas em K1, K2 e K28, com base em suas características moleculares, nos determinantes genéticos e no modo de ação (SILVA, 1996).
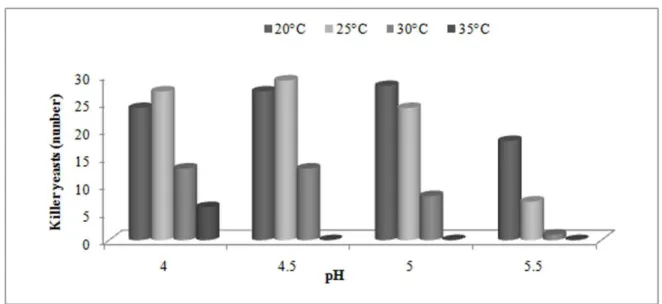
Todas as toxinas killer detectadas consistem de proteínas ácidas com ponto isoelétrico, aproximado, 4,0, tendo, a maioria massa molecular entre 10-20 kDa, exceto a toxina de K. lactis, constituída de três subunidades polipeptídicas (27,5; 30 e 99 kDa) (COELHO, 2007). A expressão do fenótipo ‗killer é influenciada por vários fatores
ambientais, sobretudo pelo pH do meio (WANG et al.,2007).
Nos últimos anos, várias pesquisas científicas têm evidenciado o potencial de uso de leveduras e de toxinas killer como antifúngicos possíveis de serem empregados no controle de fitopatógenos (EL-TARABILY e SIVASITHAMPARAM, 2006). Em trabalho pioneiro, WALKER et al. (1995) observaram que leveduras killer apresentavam grande potencial de controle de fungos filamentosos patogênicos, mostrando-se capazes de inibir fortemente, o crescimento micelial de Heterobasidion annosum, Rhizoctonia solani, Fusarium equiseti. Entre outros fungos, o que, segundo esses autores, demonstra uma clara indicação do potencial de uso desses microrganismos como controladores biológicos de fungos fitopatógenos.
Rosa (2009), avaliando a ação de leveduras isoladas de áreas agrícolas no controle biológico de fitopatógenos, verificou que as leveduras C. intermedia (2S02) e Rhodotorula mucilaginosa (2F32) apresentam a capacidade de controlar os fungos filamentosos por meio de competição por nutrientes do meio e pela produção de compostos antifúngicos, provavelmente, toxina killer. Santos e Marquina (2004) relataram a inibição de Botrytis cinerea CYC 20010 por P. membranifaciens CYC 1106, enquanto Marçal (2005) relatou um potencial efeito antagônico dos sobrenadantes das culturas de leveduras killer Y08-A e Y11- sobre o fungo Trichoderma spp.
competição por espaço e nutriente e produção de compostos antimicrobianos, como a toxina killer.
A ação da toxina killer sobre leveduras e outros fungos é dependente da ligação da
toxina a componentes da parece celular dos organismos alvo, especialmente β-glucanas (MARQUINA et al., 2002), o que garante sua segurança de uso por homens e outros animais.
Investigações de leveduras killer como produtores de toxinas que neutralizam as atividades dos microorganismos indesejados representam uma estratégia interessante para o controle e/ou eliminação de contaminantes indesejáveis (COMITINI e CIANI, 2011). Recentemente, Coelho et al., 2011 associaram a inibição da germinação de esporos de Penicillium expansum em meio liquido, à atividade killer de Candida guilliermondii. Os autores destacaram que, a presença de halos de inibição em ensaios de antibiose contra o fitopatógeno, associada à atividade killer das leveduras avaliadas, sugerem um mecanismo de ação associado ao caráter killer.
Estudos que objetivam a seleção e o isolamento de agentes capazes de atuar no biocontrole de fitopatogenos, tais como leveduras killer, têm sido amplamente executados nas últimas décadas. Contudo, esforços devem ser conduzidos para agregação de tecnologias que permitam a superação das principais barreiras à efetivação prática dessa estratégia de controle, como sua menor eficiência e espectro de ação quanto comparada aos agentes químicos tradicionalmente empregados. Também, devem ser conduzidos estudos toxicológicos e ambientais que sejam capazes de garantir a inocuidade de uso desses microrganismos ao homem e ao ambiente.
2.7Referências Bibliográficas
1. ANDRADE, E.M. et al. Caracterização Morfocultural e Molecular de Isolados de Colletotrichum gloeosporioides Patogênicos ao Mamoeiro. Fitopatologia Brasileira, v.32, n.1, p. 21-31, jun. 2007.
2. ARAUJO, F. F., MENEZES, D. Indução de resistência a doenças foliares em tomateiro por indutores biótico (Bacillus subtilis) e abiótico (Acibenzolar-S-Metil). Summa phytopathol, v. 35, n. 3, p. 169-172, jul. 2009.
3. BAILEY, J.A., JEGER, J.M. Colletotrichum: biology, pathology control. Oxford: British
4. BAKER, K.F., COOK, R.J. Biological control of plant pathogens. San Francisco, W. H. Freeman, 1974. 433p.
5. BASHAN, Y. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnology Advances, v.16, n.4, p. 729-770, 1998.
6. BASTIAANSE, H. et al. Integrated control of crown rot of banana with Candida oleophila strain O, calcium chloride and modified atmosphere packaging. Biological Control, v. 53, n. 1, p. 100-107, 2010.
7. BETTIOL, W., GHINI, R. Controle biológico In: FILHO, A. B.; KIMATI, H.; AMORIM, L. (Eds.). Manual de fitopatologia: princípios e conceitos. 3 ed. São Paulo: Agronômica Ceres, v. 1, cap. 36, p. 717-728, 1995.
8. CAO, S. et al. Effect of yeast antagonist in combination with methyl jasmonate treatment on postharvest anthracnose rot of loquat fruit. Biological Control, v. 50, n. 1, p.73-77, 2009. 9. CHALFOUN, N.R., CASTAGNARO, A.P., RICCI, J.C. D. Induced resistance activated by a culture filtrate derived from an avirulent pathogen as a mechanism of biological control of anthracnose in strawberry. Biological Control, v.58, n. 3, p. 319–329, 2011.
10.CHAN, Z., TIAN, S.P. Interaction of antagonistic yeasts against postharvest pathogens of apple fruit and possible mode of action. Postharvest Biology and Technology., v. 36, n.2, p. 25–223, 2005.
11.CHANCHAICHAOVIVAT, A., RUENWONGSA, P., PANIJPAN, B. Putative modes of action of Pichia guilliermondii strain R13 in controlling chili anthracnose after harvest. Biological Control, v. 47, n. 2, p. 207-215, 2008.
12.COELHO, A. R., HOFFMANN, F. L., HIROOKA, E. Y. Biocontrole de doenças pós-colheita de frutas por leveduras. Semina: Ciências Agrárias, Londrina, v. 24, n. 2, p. 337-358, 2008.
14.COELHO, A.R., HOFFMANN, F.L., HIROOKA, E.Y. Biocontrole de doenças pós-colheita de frutas por leveduras: perspectivas de aplicação e segurança alimentar. Semina: Ciências Agrárias, Londrina, v. 24, n. 2, p. 337-358, jul./dez. 2003.
15.COELHO, A.R., et al. Avaliação do potencial antagônico de leveduras, visando biocontrole de deterioração por Penicillium expansum. Semina: Ciências Agrárias, Londrina, v. 32, suplemento 1, p. 1879-1892, 2011.
16.COMITINI F., CIANI M. Kluyveromyces wickerhamii killer toxin: purification and activity towards Brettanomyces/Dekkera yeasts in grape must. FEMS Microbiol Lett., v. 316, p. 77-82, 2011.
17.COOK, R.J., BAKER, K.F. The nature and practice of biological control of plant pathogens. St. Paul: The American Phytopathology Society, 1983. 539p.
18.CORREA, É.B., GALVAO, J.A.H., BETTIOL, W. Controle biológico da podridão radicular e promoção de crescimento em pepino hidropônico com microrganismos de manguezais. Pesq. Agropec. Bras., v. 46, n. 2, p.130-136, 2011.
19.DAL BELLO, G. et al. Biocontrol of postharvest grey mould on tomato by yeasts. J. Phytopathology. v. 156, n. 5, p. 257–263, 2008.
20.DROBY, S., CHALUTZ, E. 1994. Mode of action of biocontrol agents for postharvest diseases. In: Wilson, C.L., Wisniewski, M.E. (Eds.), Biological Control of Postharvest Diseases of Fruits and Vegetables—Theory and Practice. CRC Press, Boca Raton, FL. 63-75. 21.DRUVEFORS, U. A. 2004. Yeast biocontrol of grain spoilage moulds. Mode of Action of Pichia anomala. Uppsala, 122p. Tese de Doutorado. Swedish University of Agricultural Sciences.
22.EL-TARABILY, K.A., SIVASITHAMPARAM, K. Potential of yeasts as biocontrol agents of soil-borne fungal plant pathogens and as plant growth promoters. Mycoscience, v. 47, n. 1, p. 25-35, 2006.
24.FAOSTAT Agricultural Statistics Database. Rome: World Agricultural Information Center. Disponível em: <http://faostat.fao.org/site/342/default.aspx > Acesso em: 21 jan. 2011.
25.FERNANDES, M. C. A.; SARTORI, A. S.; RIBEIRO, P. DE L. D. Adaptação patogênica de isolados de Colletotrichum gloeosporioides obtidos de frutos de jiloeiro, pimentão e berinjela. Summa Phytopathologica, Jaboticabal, v. 28, n. 4, p. 325-330, 2002.
26.FIALHO, M. B. 2004. Efeito in vitro de Saccharomyces cerevisiae sobre Guignardia citricarpa, agente causal da pinta preta dos citros. 2004. 60 f. Dissertação (Mestrado em Agronomia – Microbiologia Agrícola) – Escola Superior de agricultura Luiz de Queiroz, Piracicaba.
27.FILHO, R. L., FERRO, H.M., PINHO, R.S.C. Controle biológico mediado por Bacillus subtilis. Revista Trópica: Ciências Agrárias e Biológicas, v. 4, n. 2, p. 12- 20, 2010.
28.FILHO, R.C., ROMEIRO, R.S., GARCI, F.Q.O. Biocontrole de doenças de parte aérea do tomateiro por Nocardioides thermolilacinus. Tropical Plant Pathology, v. 33, n. 6, p. 457-460, 2008.
29.FORTES, F.O. et al. Promoção de enraizamento de microestacas de um clone de Eucalyptus sp. por Trichoderma spp. Rev. Árvore, v. 31, n. 2, p. 221-228, 2007.
30.GAYET, J.P. et al. Mamão para exportação: Procedimentos de colheita e pós-colheita. Ministério da Agricultura, do Abastecimento e da Reforma Agrária, Secretaria de Desenvolvimento Rural, Programa de Apoio à Produção e Exportação de Frutas, Hortaliças e Plantas Ornamentais. EMBRAPA. 1995. 38 p.
31.GHOLAMNEJAD, J., ETEBARIAN, H. R., SAHEBANI, N. Biological control of apple blue mold with Candida membranifaciens and Rhodotorula mucilaginosa. African Journal of Food Science, v. 4, n. 1, p. 01-07, 2010.
33.GUPTA, V.P. et al. Plant growth promoting Bacillus subtilis strain as potential inducer of systemic resistance in tomato against Fusarium wilt. Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz, v.107, n. 2, p. 145 154, 2000.
34.HASHEM, M., ALAMRI, S. The biocontrol of postharvest disease (Botryodiplodia theobromae) of guava (Psidium guajava L.) by the application of yeast strains. Postharvest Biology and Technology, v. 53, n. 3, p. 123-130, 2009.
35.HIDALGO, P., FLORES, M. Occurrence of the killer character in yeasts associated with Spanish wine production. Food Microbiology, v. 11, n. 2, p. 161-167, 1994.
36.IBGE. Área colhida, quantidade produzida, rendimento médio, variação de produção em relação ao ano anterior, participação no total da produção nacional e valor da produção de mamão, segundo a importância das unidade da federação produtoras. Disponível: http://www.sidra.ibge.gov.br/. Acesso em: 03/ 11/ 2011.
37.IZGU, F., ALTINBAY, D. YUCELIS, A. Identification and killer activity of yeasts contaminating starter cultures of Saccharomyces cerevisiae strains used in the Turkish baking industry. Food Microbiology, v.14, n. 2, p. 125-131, 1997.
38.JAMALIZADEH, M. et al. A review of mechanisms of action of biological control organisms against post-harvest fruit spoilage. EPPO Bulletin, v. 41, n. 1, p. 65–71, 2011. 39.JAMALIZADEH, M. et al. Biological control of gray mold on apple fruits by Bacillus licheniformis (EN74-1). Phytoparasitica, v. 36, n. 1, p. 23-29, 2008.
40.JANISIEWICZ, W. J., KURTZMAN, C. P. AND BUYER, J. S. Yeasts associated with nectarines and their potential for biological control of brown rot. Yeast, v. 27, n. 7, p.389– 398, 2010.
41.JANISIEWICZ, W. J. et al. Control of blue mold decay of apple during commercial controlled atmosphere storage with yeast antagonists and sodium bicarbonate. Postharvest Biology and Technology, v. 49, n. 3, p. 374–378, 2008.
43.JÚNIOR, A. G., SANTOS, A. F., AUER, C. G. Perspectivas do uso do controle biológico contra doenças florestais. Floresta, v. 30, p. 155-165, 2000.
44.KAGIMURA, F. Y. et al. Ação de fungicidas sobre o crescimento do fungo entomopatogênico Beauveria bassiana (Bals.) VUILL. Revista em Agronegócios e Meio Ambiente, v. 4, n. 2, p. 277-290, 2011.
45.KEFIALEWA, Y., AYALEWB, A. Postharvest biological control of anthracnose (Colletotrichum gloeosporioides) on mango (Mangifera indica). Postharvest Biol Technol., v. 50, n. 1, p. 8-10, 2008.
46.KINAY, P., YILDIZ, M. The shelf life and effectiveness of granular formulations of Metschnikowia pulcherrima and Pichia guilliermondii yeast isolates that control postharvest decay of citrus fruit. Biological Control, v. 45, n. 3, p. 433–440, 2008.
47.KONG, Q. et al. Biocontrol of Aspergillus flavus on peanut kernels by use of a strain of marine Bacillus megaterium. Int. J. Food Microbiol., v.139, n.1/2, p. 31-35, 2010.
48.KUPPER, K. C., BELLOTTE, J. A. M., GOES, A. Controle alternativo de Colletotrichum acutatum agente causal da queda prematura dos frutos cítricos. Rev. Bras. Frutic. Jaboticabal, v. 31, n. 4, p. 1004-1015, 2009.
49.KUPPER, K.C., GIMENES-FERNANDES, N., GOES, A. Controle biológico de Colletotrichum acutatum, agente causal da queda prematura dos frutos cítricos. Fitopatologia Brasileira, v. 28, n. 3, p. 251-257, 2003.
50.LI, R. et al. Biocontrol of postharvest gray and blue mold decay of apples with Rhodotorula mucilaginosa and possible mechanisms of action. Int. J. Food Microbiol., v.146, n. 2, p. 151-156, 2011.
52.LIMA, G. et al. Integrated control of blue mould using new fungicides and biocontrol yeasts lowers levels of fungicide residues and patulin contamination in apples. Postharvest Biol Technol., v. 60, n. 2, p. 164-172, 2011.
53.LIU, H. M. et al. Control of gray mold of grape by Hanseniaspora uvarum and its effects on postharvest quality parameters. Ann Microbiol., v. 60, n. 1, p. 31-35, 2010.
54.LONG, C.A., WU, Z., DENG, B.X. Biological control of Penicillium italicum of citrus and Botrytis cinerea of grape by strain 34-9 of Kloeckera apiculata. Eur Food Res Technol., v. 221, n. 1-2, p.197–201, 2005.
55.LUCON, C. M. M. et al. Bioprospecção de isolados de Trichoderma spp. para o controle de Rhizoctonia solani na produção de mudas de pepino. Pesq. agropec. bras., v. 44, n. 3, p. 225-232, 2009.
56.MACARISIN, D. et al. Superoxide anion and hydrogen peroxide in the yeast antagonist–
fruit interaction: A new role for reactive oxygen species in postharvest biocontrol? Postharvest Biology and Technology, v. 58, n. 3, p. 194–202, 2010.
57.MANSO, T E NUNES. Metschnikowia andauensis as a new biocontrol agent of fruit postharvest diseases. Postharvest Biology and Technology., v. 61, n.1, p. 64-71, 2011. 58.MARÇAL, V.V.M. Isolamento e Caracterização Morfogenética de Leveduras com Fenótipo Killer e seu Potencial no Antagonismo de Fitopatógenos. 2005. 10f. Dissertação de (Mestrado) - curso de Pós-Graduação, em Genética e Biologia Molecular da Universidade Estadual de Londrina, Londrina, 2005.
59.MARI, M. et al. Peracetic acid and clorine dioxide for postharvest of Monilinia laxa in stone fruits. Plant Disease, v. 83, n. 8, p. 773-776, 1999.
61.MARQUINA, D., SANTOS, A., PEINADO, J. M. Biology of killer yeasts. International Microbiology, v. 5, n. 2, p. 65-71, 2002.
62.MARTINS-CORDER, M.P.; MELO, I.S. Antagonismo in vitro de Trichoderma spp. A Verticillium dahliae Kleb. Scientia Agricola, Piracicaba, v. 55, n.1, p. 1-7, 1998.
63.MEKBIB, S. B., REGNIER, T. J.C., KORSTEN L. Efficacy and mode of action of yeast antagonists for control of Penicillium digitatum in oranges. Tropical Plant Pathology, v.36, n. 4, p. 233-240, 2011.
64.MOHAMED, H.A.L.A., HAGGAG, W.M. Biocontrol potential of salinity tolerant mutants of Trichoderma harzianum against Fusarium oxysporum. Brazilian Journal of Microbiology, v. 37, n. 2, p. 181-191, 2006.
65.MORAES, W. B. C. Controle alternativo de fitopatógenos. Pesquisa Agropecuária Brasileira, v. 27, p. 175-190, 1992.
66.MORANDI, M. A. B., BETTIOL, W. Controle biológico de doenças de plantas no Brasil. In: BETTIOL, W., MORANDI, M. A. B (Eds.). Biocontrole de doenças de plantas: uso e perspectivas. Jaguariúna: Embrapa Meio Ambiente, v. 1, cap. 1, p. 7-14, 2009.
67.MOREIRA, L. M. et al. Fungos antagonistas e efeito de produtos químicos no controle da podridão parda em pomar de pessegueiro. Summa phytopatólogica. Botucatu, v. 34, n. 3, p. 272-276, 2008.
68.MOUNIR, R. et al. Production, formulation and antagonistic activity of the biocontrol like-yeast Aureobasidium pullulans against Penicillium expansum. Biotechnology Letters, v. 29, n.4, p. 553-559, 2007.
69.NANTAWANIT, N. et al. Induction of defense response against Colletotrichum capsici in chili fruit by the yeast Pichia guilliermondii strain R13. Biological Control, 52: 145–152, 2010.
71.NOGUEIRA, D.R.S. et al. Eficiência de Bacillus subtilis e B. pumilus no controle de
Podosphaera xanthii em meloeiro. Revista Verde (Mossoró – RN – Brasil) v. 6, n. 3, p.125 –
130, 2011.
72.OLIVEIRA, A.A.R. et al. Mamão Produção: Aspectos Técnicos. Embrapa Mandioca Fruticultura. Cruz das Almas, BA. – Brasília: Embrapa Comunicação para Transferência de Tecnologia. Brasília. 2000.
73.ONGENA, M. et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants. Environmental Microbiology, v. 9, n. 4, p. 1084-1090, 2007.
74.ONYEKA, T.J. et al. 2006. Resistance in water yam (Dioscorea alata) cultivars in the French West Indies to anthracnose disease based on tissue culture- derived whole-plant assay. Plant Pathology, v. 55, n. 5, p. 671–678.
75.PAL, K. K.; GARDENER, B. M. Biological Control of Plant Pathogens. The Plant Health Instructor, v. 02, p. 1-25, 2006.
76.PIMENTA, R. S. et al. Utilization of Yeasts in Biological Control Programs. Yeast biotechnology: diversity and applications, v. I, p. 99-214, 2009.
77.PIMENTA, R. S. et al. Integrated control of Penicillium digitatum by the predacious yeast Saccharomycopsis crataegensis and sodium bicarbonate on oranges. Brazilian Journal Microbiology, v. 41, n. 2, p. 404–410, 2010.
78.PLATANIA, C. et al. Efficacy of killer yeasts in the biological control of Penicillium digitatum on Tarocco orange fruits (Citrus sinensis). Food Microbiology, v. 30, n.1, p. 219-225, 2012.
79.PUNJA, Z. K E, UTKHEDE, R. S. Using fungi and yeasts to manage vegetable crop diseases. Trends in Biotechnology, v. 21, n.9, p. 400-407, 2003.
81.RAMOS, N.F. et al. Presença dos vírus da mancha anelar e do amarelo letal em frutos de mamoeiro comercializados. Tropical plant pathology, v. 33, n. 6, p. 449-452, dec. 2008 . 82.ROBIGLIO, A. et al. Yeast biocontrol of fungal spoilage of pears stored at low temperature. International Journal of Food Microbiology, v. 147, n.3, p. 211-216, 2011. 83.ROSA, M. M. et al. Evaluation of the biological control by the yeast Torulaspora globosa against Colletotrichum sublineolum in sorghum. World Journal of Microbiology & Biotechnology , v. 26, n. 8, p. 1491-1502, 2010.
84.ROSA, MÁRCIA MARIA. Avaliação de leveduras isoladas de áreas agrícolas como agentes no controle biológico de fitopatógenos. 2009. 169 f. Tese de Doutorado (Doutor) - Curso de Pós-graduação em Ciências Biológicas - Microbiologia Aplicada, Universidade
Estadual Paulista ―Júlio De Mesquita Filho‖, Rio Claro, 2009.
85.ROSA-MAGRI, M. M., TAUK-TORNISIELO, S. M., CECCATO-ANTONINI, S. R. 2011. Bioprospection of yeasts as biocontrol agents against phytopathogenic molds. Brazilian Archives of Biology and Technology, v.54, n. 1, p. 1-5, 2011.
86.SALOMÃO, L.C.C. et al. Cultivo do mamoeiro. Viçosa: Editora UFV, 2007. 74 p. 87.SANTOS, A., MARQUINA, D. Killer toxin of Pichia membranifaciens and its possible use as a biocontrol agent against grey mould disease of grapevine. Microbiology, v.150, 2527–2534, aug. 2004.
88.SERRA, I. M. R. S., SILVA, G. S. Caracterização Morfofisiológica de Isolados de Colletotrichum gloeosporioides Agentes de Antracnose em Frutíferas no Maranhão. Summa Phytopathologica, v. 30, n.4, p. 475-480, 2004.
89.SILVA, G.A. The occurrence of killer sensitive, and neutral yeasts in Brazilian Riesling Italico grape must and the effect of neutral strains of killing behaviour. Applied Microbiology and Biotechnology, v. 46, n. 2, p.112-121, 1996.
91.SOUSA, C. S., SOARES, A. C. F., GARRIDO, M. S. LIMA, F. S. Estreptomicetos no controle de Scutellonema bradys em túberas de inhame. Ciência Agronômica Fortaleza, v. 40, n. 4, p. 486-491, 2009.
92.SPADARO, D., GARIBALDI, A., GULLINO, M. L. Control of Penicillium expansum and Botrytis cinerea on apple combining a biocontrol agent with hot water dipping and acibenzolar-S-methyl, baking soda, or ethanol application. Postharvest Biology and Technology, v. 33, n. 2, p. 141–151, aug, 2004.
93.SUNDH, I., MELIN, P. Safety and regulation of yeasts used for biocontrole or biopreservation in the food or feed chain. Antonie van Leeuwenhoek, v. 99, n. 1, p. 113–
119, nov. 2011.
94.TAVARES, G. M. AND SOUZA, P. E. Efeito de fungicidas no controle in vitro de Colletotrichum gloeosporioides, agente etiológico da antracnose do mamoeiro (carica papaya L.) Ciência e agrotecnologia, v. 29, n.1, p. 52-59, jan/fev. 2004.
95.TEDESCO, V. Panorama e perspectivas de uso de Trichoderma ssp no manejo de patogenos radiculares com ênfase na cultura da soja. 2009. 45 f. Monografia (Especialização) - Universidade Federal do Rio Grande do Sul, Porto Alegre, 2009.
96.TRINDADE, A. V., Mamão - Cultivo. 2. Mamão - Produção. I., org. II. Embrapa Mandioca Fruticultura (Cruz das Almas, BA). III. Série, 2000.
97.VIDA, J. B. et al. Colletotrichum gloeosporioides causando antracnose em frutos de pupunheira nos estados de Minas Gerais e Paraná. Summa Phytopathologica, v. 32, n.4, p. 384-385, set. 2006.
98.WALKER, G. M. Pichia anomala: cell physiology and biotechnology relative to other yeasts. Antonie Van Leeuwenhoek, v. 99, n.1, p. 25-34, aug. 2011.
100.WANG, X., CHI, Z., YUE, L., LI, J. Purification and Characterization of Killer Toxin from a Marine Yeast Pichia anomala YF07b Against the Pathogenic Yeast in Crab. Current Microbiology. v. 55, n.5, p. 396-401, 2007.
101.WANG, Y. F. et al. Biocontrol of Alternaria alternata on cherry tomato fruit by use of marine yeast Rhodosporidium paludigenum Fell & Tallman. International Journal of Food Microbiology, v. 123, n. 3, p. 234–239, abr. 2008.
102.WANG, Y. F. et al. Biocontrol of postharvest gray mold of cherry tomatoes with the marine yeast Rhodosporidium paludigenum. Biological Control, v. 53, n. 2, p.178–182, may. 2010.
103.ZHANG, D. et al. Selection and evaluation of new antagonists for their efficacy against postharvest brown rot of peaches. Postharvest Biology and Technology, v. 55, n. 3, p. 174-181, mar. 2010.
104.ZHANG, D. et al. Potential biocontrol activity of a strain of Pichia guilliermondii against grey mold of apples and its possible modes of action. Biological Control, v. 57, n. 3, p. 193-201, june. 2011.
105.ZHAO, Y. et al. Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit. Postharvest Biology and Technology, v. 49, n. 1, p. 113–120, jul. 2008.
3.0Justificativa e hipóteses
As podridões resultantes da atividade de fitopatógenos ocasionam grandes perdas para agroindústria, principalmente nas regiões tropicais, onde as condições climáticas são favoráveis ao desenvolvimento de microrganismos. Nessas condições, fungos se disseminam com facilidade e crescem vigorosamente, podendo causar elevadas perdas econômicas se medidas de controle não forem adotadas. Nas últimas décadas tem havido uma tendência crescente de restrição a tratamentos químicos em pós-colheita, notadamente com emprego de fungicidas, principal fator de contaminação química de frutas. Outrossim, some-se a isso, o declínio da eficiência dos principais princípios ativos para o controle de doenças pós-colheita, decorrente do aparecimento de isolados de fitopatógenos resistentes, envolvidos ou não nas podridões.
Esses fatores têm impulsionado a busca por alternativas menos danosas a saúde humana e menos agressivas ao ambiente, dentre as quais o controle biológico configura-se
como uma das mais promissoras. Nesse contexto, leveduras produtoras de toxinas ‗killer‘
isoladas a partir de frutos tropicais, portanto, adaptadas às condições climáticas da região nordeste brasileira, configurar-se-iam como agentes ideais de controle, em função de suas características gerais, tais como, histórico de utilização e conhecimento humano sobre o microrganismo, facilidade de cultivo e de manipulação, baixo custo de produção, além de esses microrganismos serem hábeis em produzir uma substância de comprovada ação sobre fitopatógenos e atóxica a plantas, animais e humanos.
De maneira a buscar soluções para o problema acima relatado, foi levantada a
seguinte hipótese de trabalho: Leveduras que expressam o fenótipo ‗killer‘ são eficientes no
controle da antracnose pós-colheita do mamão.
4.0Objetivos
4.1. Objetivo geral
Prospectar leveduras killer coletadas de frutas tropicais objetivando seu emprego no controle de antracnose causada por C. gloeosporioides em pós-colheita de mamão.
4.2. Objetivos específicos
Isolar leveduras produtoras de toxina killer a partir da microbiota natural presente em frutas tropicais;
Identificar os isolados de levedura killer obtidos por meio de biologia molecular e depositar as sequências em banco de genomas
Determinar o pH e a temperatura ótimos das leveduras killer selecionadas para expressão do fenótipo killer;
Avaliar o efeito in vivo e in vitro das leveduras killer selecionadas e identificadas sobre os principais fitopatógenos em pós-colheita de mamão.
Verificar a influência do tempo de inoculação sobre a ação antagônica das leveduras selecionadas.
Analisar o efeito das leveduras ‗killer‘ selecionadas sobre fungos patogênicos pós-colheita através de microscopia eletrônica de varredura;
Investigar os principais mecanismos de ação envolvidos na ação antagônica;
Elaborar e testar formulações à base das leveduras killer e agentes veiculadores capazes de influenciar, positivamente, a ação antagônica dos isolados.
5.0 Capítulo 2- Isolation, identification and activity in vitro of killer yeasts against Colletotrichum gloeosporioides isolated from tropical fruits.
Resumo
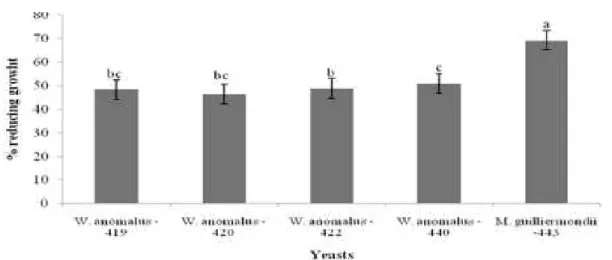
Um total de 580 cepas de leveduras, isoladas a partir de frutos tropicais, foram avaliados quanto à sua capacidade para produzir a toxina killer e atuar como agentes de biocontrole in vitro contra o fitopatogeno Colletotrichum gloeosporioides. Destas, 29 foram capazes de expressar o fenótipo killer, sendo em seguida avaliadas quanto à sua capacidade de controlar C. gloeosporioides in vitro. Todas as cepas killer foram identificadas pelo sequenciamento da região D1/D2 do 28S rRNA, em que ficou demonstrada a presença de Candida aaseri, Wickerhamomyces anomalus, Pichia kluyveri, Meyerozyma guilliermondii, Kodamaea ohmeri,. Cinco leveduras foram capazes de inibir em 100% a germinação de conídios em meio líquido e reduzir o crescimento micelial, em meio sólido de Colletotrichum gloeosporioides in vitro, com destaque para M. guilliermondii (cepa 443) que foi capaz de reduzir o crescimento micelial do fitopatogeno em 60% em meio sólido. Culturas filtradas e autoclavadas não apresentaram efeitos sobre o crescimento do patógeno. Estes resultados indicam o uso potencial de leveduras killer isoladas a partir de frutas tropicais como agentes de biocontrole de C. gloeosporioides em mamoeiro.
Isolation, identification and activity in vitro of killer yeasts against Colletotrichum gloeosporioides isolated from tropical fruits.
Jaqueline Rabelo de Limaa, Luciana Rocha Barros Gonçalves c, Luciana Rocha Brandãod, Carlos Augusto Rosad, Francisco Marto Pinto Vianab*
aPrograma de pós-graduação em Biotecnologia -RENORBIO – Universidade Estadual do Ceará.
Empresa Brasileira de Pesquisa Agropecuaria - EMBRAPA- Laboratório de Patologia Pós-colheita, Rua Dra. Sara Mesquita, 2270, Planalto do Pici, CEP 60511-110. Fortaleza-CE, Brasil.
b Empresa Brasileira de Pesquisa Agropecuaria - EMBRAPA Agroindústria Tropical- Laboratório de Patologia
Pós-colheita, Rua Dra. Sara Mesquita, 2270, Planalto do Pici, CEP 60511-110. Fortaleza-CE, Brasil.
c Departamento Engenharia Química- Universidade Federal do Ceará - UFC- Campus do PICI, CEP: 60455 –
760, Fortaleza-CE, Brasil.
dDepartamento de Microbiologia, ICB, CP 486, Universidade Federal de Minas Gerais, Belo Horizonte,
MG 31270-901, Brazil.
* Corresponding author at: EMBRAPA Agroindústria Tropical- Laboratório de patologia pós-colheita Rua Dra. Sara Mesquita, 2270, Planalto do Pici, CEP 60511-110. Fortaleza-CE, Brasil. Tel.: +55 085 3391 7264 - Fax: +55 085 33917222 - E-mail address: jaquerabelo@hotmail.com (Jaqueline Rabelo de Lima a).