UNIVERSIDADE FEDERAL DA PARAÍBA
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS
NATURAIS E SINTÉTICOS BIOATIVOS
HELOÍSA MARA BATISTA FERNANDES DE OLIVEIRA
AVALIAÇÃO DAS ATIVIDADES ANTIFÚNGICA, ANTIOXIDANTE E
CITOTÓXICA DOS MONOTERPENOS (R)-(+)-CITRONELAL,
(S)-(-)-CITRONELAL, 7-HIDROXICITRONELAL
JOÃO PESSOA – PB
HELOÍSA MARA BATISTA FERNANDES DE OLIVEIRA
AVALIAÇÃO DAS ATIVIDADES ANTIFÚNGICA, ANTIOXIDANTE E
CITOTÓXICA DOS MONOTERPENOS (R)-(+)-CITRONELAL,
(S)-(-)-CITRONELAL, 7-HIDROXICITRONELAL
Tese apresentada ao Programa de Pós-graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, como parte dos requisitos para a obtenção do título de DOUTOR EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS. Área de concentração: FARMACOLOGIA
Orientador: Prof. Dr. José Pinto de Siqueira Júnior
Co-Orientadora: Profª. Drª Edeltrudes de Oliveira Lima
JOÃO PESSOA – PB
Dedico esta conquista às pessoas mais importantes da minha vida:
A Mainha e Painho que sempre me
estimularam a dar este grande passo, com muita
sabedoria, discernimento, bom senso e dedicação.
Esteviveram ao meu lado me encorajando nas horas
difíceis e me aplaudindo nos momentos de glória.
Obrigada por serem corretos, de grande coração, fonte
de inspiração, apoio e ensino diário.
Ao meu esposo, Abrahão, pelo incentivo,
companheirismo e paciência, por ter me apoiado em
todas as minhas decisões, por ser “meu orientador particular”, quero dizer que é um prazer dividir minhas conquistas com você, nós que escolhemos construir
uma vida juntos. Com certeza sem ter você comigo, eu
não estaria concluindo este trabalho. Amo você.
Ao meu irmão, Héllisson e meu
sobrinho-irmão, Pedro Henrique, pelo sentimento de afeto e
carinho, cada sorriso dado foi fundamental para
fortalecer meus dias aqui. Vocês são meu alicerce e
Primeiramente agradeço a DEUS, por ter me dado a chance de encontrar pessoas especiais na minha caminhada, sem as quais certamente não teria dado conta desta missão que Ele me confiou. Quero agradecer pelos dons da coragem, força e determinação, por ser meu amparo e refúgio, pela proteção constante. Obrigada Senhor!
A minha família, saibam que esta vitória é NOSSA. Obrigada pelo amor incondicional! Que estas palavras sejam a expressão da minha gratidão por tudo que lhes devo. Amo muito vocês.
A minha nova família que me acolheu com tanto carinho, agradeço por todo o apoio, incentivo e motivação vinda de vocês foi fundamental.
Ao meu amado esposo, Abrahão Filho, obrigada por me estimular a crescer e seguir em frente sempre, cultivar o bem nos lugares onde passar, aprender grandes lições nos percalços da vida, por me fazer acreditar em dias melhores. Seu apoio foi fundamental para o desenvolvimento deste trabalho, ele é tão meu quanto seu.
Aos meus orientadores, Prof. José Pinto de Siqueira Júnior e Profª Edeltrudes de Oliveira Lima, pela oportunidade, orientação e confiança em desenvolver este trabalho e concluir uma etapa tão importante para o meu amadurecimento profissional. Com certeza levarei vocês na minha vida como exemplos de profissionais.
Aos professores Reinaldo Nóbrega de Almeida, Hilzeth de Luna Freire Pêssoa, Caliandra Maria Bezerra Luna Lima, Lindomar de Farias Belém, Bárbara Viviana de Oliveira Santos e Maria da Conceição Rodrigues Gonçalves por terem aceitado participar da banca de doutorado, contribuindo significativamente para o meu trabalho.
À equipe do Laboratório de Micologia e do BioGer, por toda a ajuda, pela partilha de conhecimentos e companheirismo durante todo este tempo.
A todos os meus amigos e companheiros de jornada, em especial Déborah, Carminha e Lázaro que nunca me negaram uma ajuda ou uma palavra de conforto. Com certeza, sem vocês do meu lado, esse doutorado não teria sido o mesmo.
À minha turma de pós-graduação, em especial: Diogo, Natália, Déborah, Susyanne, Ana Silvia, Analúcia, Thaisa, Dayseanne, Vivi, Gabi, Fábio, Rafaela, Isis, Hellane, que dividiram comigo alguns dos momentos mais especiais na minha vida, como os estudos durante as disciplinas e as comemorações após cada sucesso no doutorado. Com certeza vocês são excelentes pesquisadores e profissionais.
A minha turma de graduação pelos laços de amizade e incentivo profissional: Anny Paloma, Diogo, Fernanda, Flávia, Natália.
À Coordenação e aos funcionários do Programa de Pós-graduação em Produtos Naturais e Sintéticos Bioativos, pela competência, seriedade e apoio.
Há muito mais a quem agradecer... A todos aqueles que, embora não nomeados, me brindaram com seus inestimáveis apoios em distintos momentos, o meu reconhecido e carinhoso muito obrigada!
“
Mas os que esperam no Senhor, renovarão as suas
forças, subirão com asas como águias, correrão e não se
cansarão, caminharão e não se fatigarão
.”
RESUMO
Oliveira, H.M.B.F. Avaliação das atividades antifúngica, antioxidante e citotóxica dos monoterpenos (R)-(+)-citronelal, (S)-(-)-citronelal e 7-hidroxicitronelal. 2016. Tese (Doutorado em Produtos Naturais e Sintéticos Bioativos, área de concentração: Farmacologia) CCS/UFPB, João Pessoa.
As infecções graves causadas por fungos patogênicos oportunistas, tais como do gênero Candida, têm sido cada vez mais comuns em pacientes imunocomprometidos. A disseminação de fungos resistentes aos medicamentos é uma das mais graves ameaças para o sucesso do tratamento das doenças fúngicas, além disso, algumas drogas são muito tóxicas, dificultando a adesão a terapêutica. Nesse contexto, os monoterpenos têm se destacado por apresentarem diversas atividades farmacológicas tais como: fungicida e bactericida, além da atividade antioxidante, por serem capazes de reagir e inativar as diferentes espécies reativas produzidas durante um estresse oxidativo celular. Com base nisto, foram estudados os efeitos antifúngico, citotóxico e antioxidante dos monoterpenos (R)-(+)-citronelal (RC), (S)-(-)-citronelal (SC) e 7-hidroxicitronelal (7-OH). Para a análise do potencial antimicrobiano dos monoterpenos foi utilizado a análise in silico com o software Pass online. Para a realização dos estudos antifúngicos utilizou-se o teste de microdiluição com diferentes cepas fúngicas do gênero
Candida para avaliação da Concentração Inibitória Mínima (CIM). Além disso, determinou-se a Concentração Fungicida Mínima (CFM) por semeio em placas. Na realização dos estudos de atividade citotóxica e antioxidante utilizou-se hemácias humanas obtidas da unidade transfusional do Hospital Universitário Lauro Wanderley/UFPB. Para os estudos antioxidantes utilizou-se as técnicas com fenilhidrazina e peróxido de hidrogênio. O estudo in silico demonstrou que os monoterpenos RC, SC e 7-OH apresentaram uma maior probabilidade de serem ativos, expressa em porcentagem, frente aos microrganismos fúngicos. Os experimentos de atividade antifúngica revelaram que os monoterpenos RC e SC promoveram efeito antifúngico forte com CIM50 de 256 µg/mL para as cepas de Candida albicans e Candida tropicalis, bem como ação fungicida por apresentarem CFM50 512 µg/mL. O monoterpeno 7-OH apresentou forte efeito antifúngico tanto para as cepas de Candida albicans como para as cepas de Candida tropicalis, com CIM50 de256 µg/mL e CIM50 512 µg/mL, respectivamente, bem como ação fungicida com CFM50 de 512 µg/mL e 1024 µg/mL. Os monoterpenos RC, SC e 7-OH não demonstraram efeito oxidante frente a eritrócitos humanos. Além disso, os monoterpenos apresentaram efeito antioxidante frente a fenilhidrazina e ao peróxido de hidrogênio. A análise da citotoxicidade de RC, SC e 7-OH frente a eritrócitos revelou valores de hemólise abaixo de 25% para todos os tipos sanguíneos testados, na concentração de 256 µg/mL. Diante desses resultados, foi possível inferir que a estereoisomeria dos monoterpenos RC e SC não interferiu nas atividades testadas. Em conclusão, estes resultados sugerem que o RC, SC e 7-OH apresentam efeito antifúngico e antioxidante, com baixo efeito citotóxico.
ABSTRACT
Oliveira, H.M.B.F. Avaliação das atividades antifúngica, antioxidante e citotóxica dos monoterpenos (R)-(+)-citronelal, (S)-(-)-citronelal e 7-hidroxicitronelal. 2016. Tese (Doutorado em Produtos Naturais e Sintéticos Bioativos, área de concentração: Farmacologia) CCS/UFPB, João Pessoa.
Serious infections caused by opportunistic fungal pathogens such as Candida genus, have been increasingly common in immunocompromised patients. The spread of drug-resistant fungi is one of the most serious threats to the successful treatment of fungal diseases, in addition, some drugs are very toxic, hindering adherence to therapy. In this context, the monoterpenes have stood out for having various pharmacological activities such as fungicide and bactericide. It also stands out the antioxidant activity of these compounds by being able to react and inactivate the different reactive species produced during a cellular oxidative stress. Based on this, the antifungal, cytotoxic and antioxidant effect of the monoterpenes (R)-(+)-citronellal (RC), (S)-(-)-citronellal (SC) and 7-hydroxycitronellal (7-OH) were studied. For the analysis of the antimicrobial potential of monoterpenes was used with the in silico analysis software Pass online. For the realization of antifungal studies used the microdilution test with different fungal strains of Candida for evaluation of minimum inhibitory concentration (MIC). In addition, it was determined the Minimum Fungicidal Concentration (MFC) for seeding on plates. In carrying out cytotoxicity studies and antioxidant was used human red blood cells obtained from the transfusion unit of the University Hospital Lauro Wanderley/UFPB. For the antioxidant studies used the techniques with phenylhydrazine and hydrogen peroxide. The study showed that the in silico monoterpenes RC, SC and 7-OH were more likely to be active in percentage, compared to fungal microorganisms. The antifungal activity of experiments revealed that the RC and SC monoterpenes promoted strong antifungal effect with MIC50 of 256 µg/mL for strains of Candida albicans and Candida tropicalis and fungicidal action for presenting CFM50 512 µg/mL. The monoterpene 7-OH showed strong antifungal effect for both strains of Candida albicans and for
Candida tropicalis strains with MIC50 of 256 µg/mL and MIC50 512 µg/mL, respectively, and fungicidal action with CFM50 512 µg/mL and 1024 µg/mL. The monoterpenes RC, SC and 7-OH showed no oxidant opposite effect to human erythrocytes. Furthermore, the front monoterpenes had antioxidant effect against phenylhydrazine and hydrogen peroxide. RC analysis of cytotoxicity, SC and 7-OH front of haemolysis erythrocytes showed values below 25% for all blood types tested at a concentration of 256 µg/mL. Given these results, it was possible to infer that the stereoisomerism of RC and SC monoterpenes did not interfere in the tested activities. In conclusion, these results suggest that the RC, SC-OH and 7 show antifungal and antioxidant effect with low cytotoxic effect.
LISTA DE FIGURAS
Figura 1 – Estrutura química dos monoterpenos (A) (R)-(+)-citronelal, (B) (S)-(-)-citronelal e (C) 7-hidroxicitronelal... 21 Figura 2 – Estrutura química dos monoterpeno citronelal... 28
Antimicrobial analysis of three monoterpenes derived from citronellal: an in silico approach
Figura 1 – Predicted antimicrobial activities of the 7-hydroxycitronellal depicted through Pass online tool………... 46 Figura 2 – Predicted antimicrobial activities of the ( R ) - ( + ) - citronellal depicted through Pass online tool………... 47 Figura 3 – Predicted antimicrobial activities of the ( S ) - ( - ) - citronellal depicted through Pass online tool………... 47
Antioxidant and cytotoxic effects of (R)-(+)-citronellal
Figura 1 – Oxidant effect of the (R)-(+)-citronellal (RC) front human erythrocytes…... 67 Figura 2 – Antioxidant effect of the (R)-(+)-citronellal (RC) front human erythrocytes……… 68 Figura 3 –Antioxidant effect of the (R)-(+)-citronellal (RC) against hydrogen peroxide…….. 68 Figura 4–Hemolytic effect of the (R)-(+)-citronellal against erythrocytes serotype A……….. 70 Figura 5–Hemolytic effect of the (R)-(+)-citronellal against erythrocytes serotype B……….. 70 Figura 6–Hemolytic effect of the (R)-(+)-citronellal against erythrocytes serotype O……….. 71
Pharmacological and toxicological effects of (S)-(-)-citronellal
Figura 5–Hemolytic effect of the (S)-(-)-citronellal against erythrocytes serotype B..……….. 93 Figura 6–Hemolytic effect of the (S)-(-)-citronellal against erythrocytes serotype O….…….. 94
Antifungal effect of 7-hydroxycitronellal against Candida albicans strains
Figura 1 – Chemical Structure of the 7-hydroxycitronellal ………..…... 99
Bioprospecting of the antioxidant and toxicological effects of the 7-hydroxycitronellal
Figura 1 – Oxidant effect of the 7-hydroxycitronellal (7-OH) front human erythrocyte... 124
Figura 2 – Antioxidant effect of the 7-hydroxycitronellal (7-OH) front human erythrocyte…. 124 Figura 3 –Antioxidant effect of the 7-hydroxycitronellal (7-OH) against hydrogen peroxide.. 125 Figura 4– Hemolytic effect of the 7-hydroxycitronellal (7-OH) against erythrocytes serotype
A……… 126
Figura 5– Hemolytic effect of the 7-hydroxycitronellal (7-OH) against erythrocytes serotype
B……….... 127
Figura 6– Hemolytic effect of the 7-hydroxycitronellal (7-OH) against erythrocytes serotype
LISTA DE TABELAS
Antimicrobial effect of (R)-(+)-citronellal against Candida strains
Tabela 1 – Antifungal activity for determination of the MIC of the (R)-(+)-citronellal (RC)from
Candida albicans strains ………... 56 Tabela 2 – Antifungal activity for determination of the MFC of the (R)-(+)-citronellal (RC)from
Candida albicans strains ………..……… 56
Tabela 3 – Antifungal activity for determination of the MIC of the (R)-(+)-citronellal(RC) from
Candida tropicalis strains ……….. 57
Tabela 4– Antifungal activity for determination of the MFC of the (R)-(+)-citronellal(RC) from
Candida tropicalis strains ……….. 57
In vitro anti-Candida effect of (S)-(-)-citronellal
Tabela 1 – Antifungal activity for determination of the MIC of the (S)-(-)-citronellal (SC) from
Candida albicans strains ………... 79
Tabela 2 – Antifungal activity for determination of the MFC of the (S)-(-)-citronellal (SC) from
Candida albicans strains ………..……… 79
Tabela 3 – Antifungal activity for determination of the MIC of the (S)-(-)-citronellal (SC) from
Candida tropicalis strains ……….. 80
Tabela 4– Antifungal activity for determination of the MFC of the (S)-(-)-citronellal (SC) from
Candida tropicalis strains ……….. 80
Antifungal effect of 7-hydroxycitronellal against Candida albicans strains
Tabela 1 – Antifungal activity for determination of the MIC of the 7-hydroxycitronellal (7-OH)…... 102 Tabela 2 – Antifungal activity for determination of the MFC of the 7-hydroxycitronellal (7-OH)….... 103
Antifungal effect of 7-hydroxycitronellal against Candida tropicalis strains: in vitro approach
LISTA DE ABREVIATURAS E SIGLAS
ASD - Ágar Sabouraud dextrose
ATCC - American Type Culture Collection
CEP/FSM - Comitê de Ética em Pesquisa da Faculdade Santa Maria CFM - Concentração Fungicida Mínima
CIM - Concentração Inibitória Mínima CCS – Centro de Ciências da Saúde CFU – Unidades formadoras de colônias
DCF – Departamento de Ciências Farmacêuticas DMSO – Dimetilsulfóxido
E.P.M. – Erro padrão da média Hb- Hemoglobina
LM – Laboratório de Micologia MetHb – Metahemoglobina
MFC – Minimum Fungicide Concentration MIC – Minimum Inibitory Concentration
PASS – Previsão do Espectro de Atividade para Substâncias Pa- Probabilidade de ser ativo
Pi- Probabilidade de ser inativo PBS – Tampão fosfato salino
PgPNSB – Programa de Pós-graduação em produtos Naturais e Sintéticos Bioativos Ph – Phenylhydrazine
RNS – Reactive nitrogen species ROS- Reactive oxygen species RPM- Rotação por minuto RC – (R)-(+)-citronelal SC – (S)-(-)-citronelal
UFC – Units forming colonies
UFPB – Universidade Federal da Paraíba UV – Ultravioleta
SUMÁRIO
1 INTRODUÇÃO... 19
2 REFERENCIAL TEÓRICO... 23
2.1 Candidíase... 23
2.2 Tratamento das infecções por Candida... 24
2.3 Resistência aos antifúngicos... 26
2.4 Óleos essenciais... 27
2.5 2.6 Atividade antioxidante de terpenos………... Toxicidade dos monoterpenos...………... 29 31 3 OBJETIVOS... 33
3.1 Objetivo Geral... 33
3.2 Objetivos Específicos... 33
4 MATERIAL E MÉTODOS... 35
4.1 Local do trabalho... ... 35
4.2 Posicionamento Ético... 35
4.3 Ensaios de atividade antimicrobiana... 35
4.3.1 4.3.2 PASS online... Meios de cultura... 35 36 4.3.3 Cepas fúngicas... 36
4.3.4 Inóculo... 36
4.3.5 Obtenção da substância teste e do antifúngico padrão... 36
4.3.6 Determinação da concentração inibitória mínima (CIM)... 37
4.3.7 Determinação da concentração fungicida mínima (CFM)... 38
4.4 Ensaios da atividade antioxidante... 38
4.4.1 Eritrócitos humanos... 38
4.4.3 Avaliação do potencial oxidante e antioxidante dos monoterpenos frente ao peróxido de hidrogênio...
39
4.5 Ensaios de citotoxicidade... 39 4.5.1 Avaliação do potencial hemolítico dos monoterpenos em eritrócitos
humanos... 39 4.6 Análise estatística... 40 5 RESULTADOS E DISCUSSÃO... 42 5.1 Antimicrobial analysis of three monoterpenes derived from citronellal: an in silico
approach... 42 5.2 Antimicrobial effect of (R)-(+)-citronellal against Candida strains……... 51 5.3 Antioxidant and cytotoxic effects of (R)-(+)-citronellal...
61 5.4 In vitro anti-Candida effect of (S)-(-)-citronellal…... 74 5.5 Pharmacological and toxicological effects of (S)-(-)-citronellal... 84 5.6 Antifungal effect of 7-hydroxycitronellal against Candida albicans strains... 97 5.7 Antifungal effect of 7-hydroxycitronellal against Candida tropicalis strains: in vitro
approach………. 108
5.8 5.9
Bioprospecting of the antioxidant and toxicological effects of the 7-hydroxycitronellal... Discussão Geral……….
1 INTRODUÇÃO
As infecções graves causadas em sua maioria por fungos patogênicos oportunistas têm
sido cada vez mais comuns em pacientes, em especial os imunocomprometidos (KHAN et al.,
2010). Mais de 20 espécies de leveduras do gênero Candida já foram documentadas por
causarem infecções em humanos, dentre estas a mais comum foi a Candida albicans,
associada a 70-90% dos isolados de candidemia e candidíase invasiva. Esta espécie é
considerada um dos principais patógenos fúngicos oportunistas de seres humanos, causando
uma variedade de infecções em pacientes suscetíveis, que variam desde lesões mucosas até
candidíase sistêmica com risco de morte, em pacientes imunocomprometidos, tais como
pacientes com vírus da imunodeficiência humana (AIDS) e pacientes transplantados em
terapia imunossupressora (JIN et al., 2010; HA et al., 2011; BHATTACHARYA; KAUR,
2015). Sua incidência tem aumentado nas últimas décadas, pois a população em geral é mais
exposta a fatores que favorecem a infecção micótica (KAUFFMAN, 2006;
LÓPEZ-MARTÍNEZ, 2010).
As leveduras do gênero Candida geralmente crescem sobre as membranas da pele e
mucosas do hospedeiro, em seres humanos, sem causar qualquer infecção (isto é, como
comensais ou endossimbiontes de hospedeiros inofensivos); mas, o crescimento excessivo
desses fungos podem causar patogênese. Apenas quando as barreiras das mucosas são
interrompidas ou o sistema imunitário da pessoa esteja comprometido, as células fúngicas são
capazes de invadir o organismo vivo e causar doença. Os sintomas de candidíase variam
dependendo da parte do corpo que foi infectada (BHATTACHARYA; KAUR, 2015).
Os principais agentes antifúngicos utilizados para o tratamento da candidíase são os
azóis e polienos. Os azóis, como cetoconazol, miconazol, clotrimazol, fluconazol e
itraconazol, interagem com a citocromo P-450-dependente 14--desmetilase, e como
resultado inibem a síntese de ergosterol da membrana, a conseqüente depleção de ergosterol
altera a fluidez da membrana, interferindo na ação das enzimas associadas à membrana. Já os
polienos (nistatina e anfotericina B) atuam ligando-se a esteróis na membrana celular e
formando canais, permitindo que os íons de K+ e Mg++ saiam da célula (WISPELWEY,
PARSONS, 2006). Apesar da existência de antifúngicos potentes, cepas resistentes ou
disseminação de patógenos resistentes aos medicamentos é uma das mais graves ameaças para
o sucesso do tratamento das doenças microbianas (PRABUSEENIVASAN, JAYAKUMAR,
IGNACIMUTHU, 2006). Além disso, algumas drogas, como a anfotericina B, são muito
tóxicos, dificultando o seu tempo de uso terapêutico (SANGLARD; ODDS, 2002).
Diante da alta incidência da candidíase, aumento do número de indivíduos
imunocomprometidos, surgimento de cepas resistentes, toxicidade dos antifúngicos já
existentes, é de fundamental importância a busca por novos agentes antifúngicos mais
eficazes e menos tóxicos. Neste contexto, os produtos naturais têm se destacado como
excelentes alternativas para este propósito pois constituem uma importante fonte de novos
compostos biologicamente ativos (OLIVEIRA et al., 2006; PRABUSEENIVASAN,
JAYAKUMAR, IGNACIMUTHU, 2006), contendo uma série de substâncias que podem ser
usadas para o tratamento não só das infecções fúngicas mas também de diferentes doenças
infecciosas (SAAD, 2010).
Dentre todos os produtos naturais pode-se citar os monoterpenos, que são os principais
constituintes da maioria dos óleos essenciais, compreendendo uma série ampla de substâncias
que já apresentaram diversas atividades farmacológicas testadas e confirmadas tais como:
fungicida (CÄRDENAS-ORTEGA et al., 2005) e bactericida (CRISTANI et al., 2007).
Além do potencial antimicrobiano dos monoterpenos, destaca-se também os inúmeros
estudos que demonstram a atividade antioxidante destes compostos, ou seja, a capacidade de
reagir e inativar as diferentes espécies reativas produzidas durante um estresse oxidativo
celular (COSTA et al., 2012; SILVA et al., 2012).
Nexte contexto, destaca-se o monoterpeno citronelal, um produto do metabolismo
secundário das plantas, que pode ser isolado sob a forma de uma mistura não-racêmica dos
enantiômeros R e S, sintetizado na forma hidroxilada, e encontrado em mais de 50 óleos
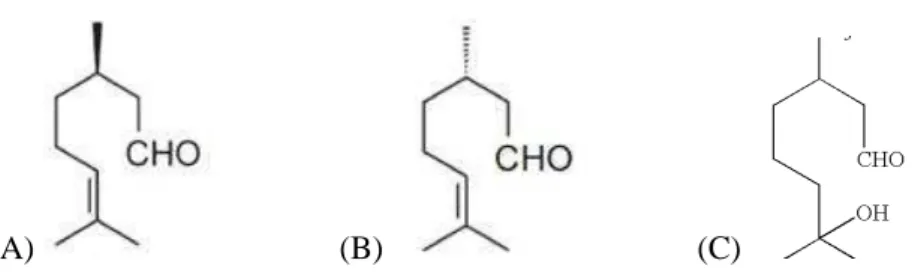
(A) (B) (C)
Figura 1 – estrutura química dos monoterpenos (A) (R)-(+)-citronelal (RC), (B) (S)-(-)-citronelal (SC) e (C) 7-hidroxicitronelal (7-OH).
Apesar dos óleos essenciais contendo citronelal serem bastante utilizados para
tratarem diferentes condições patológicas de populações disseminadas em todo o mundo,
como América do Sul e Ásia, as suas propriedades, em especial dos seus enantiômeros, ainda
são pouco estudadas (NERIO, 2010).
Com base nestas informações, esta pesquisa teve como principal objetivo avaliar o
potencial antifúngico e antioxidante dos enantiômeros (R)-(+)-citronelal (RC) e
(S)-(-)-citronelal, destacando a importância da isomeria das moléculas nas atividades testadas, bem
como do composto sintético inédito 7-hidroxicitronelal, além do estudo das suas propriedades
tóxicas, afim de se descobrir uma alternativa terapêutica para o combate dos danos oxidativos
celulares, causados pelas espécies reativas, e das infecções humanas causadas pelos fungos do
2 REFERENCIAL TEÓRICO
2.1 Candidíase
Os fungos são seres vivos eucarióticos, isto é, apresentam uma membrana nuclear
que envolve os cromossomos e o nucléolo (SIDRIM, ROCHA, 2004). Podem ser
unicelulares, como as leveduras; ou multicelulares como os fungos filamentosos e os
cogumelos (COMPERTZ et al., 2004). São organismos desprovidos de clorofila e celulose, o
que os torna incapazes de realizar fotossíntese, comportando-se, portanto, como seres
heterotróficos (MORAES, 2008). As paredes celulares dos fungos contêm um polissacarídeo
denominado quitina, além de uma membrana celular, cujo principal componente é o
ergosterol (BURTON, ENGELKIRK, 2005).
O interesse pelo estudo destes eucariotos tem sido motivado pela sua biologia única e
fascinante, seus muitos produtos úteis (incluindo vinho, queijo e antibióticos), a sua utilização
como base para a biologia experimental e sua importância como patógenos de animais e
vegetais. Podem interagir com plantas, animais ou seres humanos de várias maneiras,
estabelecendo relacionamentos simbióticos, latentes, comensais ou patogênicos (ROMANI,
2011).
Cerca de 1,5 milhões de diferentes espécies de fungos habitam a Terra, no entanto,
apenas cerca de 300 dessas espécies são conhecidas por causar infecções em humanos
(BHATTACHARYA; KAUR, 2015). Entre os mais importantes fungos oportunistas que
causam doenças em seres humanos, destacam-se as leveduras pertencentes ao gênero Candida
(MARTINS et al., 2011; PARRILHA et al., 2011). O gênero Candida existe normalmente
como comensal do trato gastrintestinal bem como do trato genital feminino em indivíduos
sadios, entretanto as espécies em questão são patógenas oportunistas, uma vez que possuem a
habilidade de causar infecções superficiais e sistêmicas (MICELI; DIAZ; LEE, 2011).
O gênero Candida pertence à família das Cryptococcaceae e as principais espécies que
causam infecções em humanos são: C. albicans, C. parapsilosis, C. glabrata, C. krusei e C.
infecções infantis, mas também infecções oportunistas em pacientes internados em unidades
de terapia intensiva principalmente para os adultos (CERVERA, 2012).
A candidíase é a patologia causada por fungos Candida spp., tendo como principal
agente Candida albicans, ela é a mais frequente infecção fúngica oportunista endógena, por
isso somente ocorre em tecidos de hospedeiros que apresentam comprometimento de seus
sistemas específicos ou inespecíficos de defesa, causando significante mortalidade e
morbidade (RUKAYADI et al., 2011; YANG et al., 2011; KOTHAVADE et al., 2010;
JAYATILAKE, 2011). Essas micoses podem ser divididas em dois grupos de acordo com a
localização (MORAES, 2008):
Candidíases superficiais, cujas lesões atingem os tecidos cutâneo, mucoso (orofarínge, intestino ou vagina), periungueais e unhas;
Candidíases profundas, que atingem os órgãos internos dos aparelhos e sistemas. A candidíase superficial é a forma mais comum e afeta principalmente a mucosa e a
pele, onde Candida vive como comensal. Já a candidíase disseminada é caracterizada pela
proliferação de fungos através dos tecidos e circulação sanguínea (JAYATILAKE, 2011).
Neste caso, o fungo pode se disseminar, geralmente do trato gastrointestinal ou de biofilmes
sobre dispositivos médicos, através da circulação sanguínea levando à invasão de órgãos
como o fígado ou nos rins (MAVOR, THEWES, HUBE, 2005). Infecções invasivas por
Candida albicans são uma importante causa de morbidade e mortalidade em pacientes
imunocomprometidos (RADOVANOVIC, MULLICK, GROS, 2011).
Atualmente leveduras não Candida albicans como C. glabrata, C. guilliermondii, C.
parapsilosis e outras espécies têm também apresentado importância na etiologia das infecções
fúngicas, devido a resistência aos antifúngicos (RUKAYADI et al., 2011; ASADZADEH et
al., 2008; YAYA et al., 2008).
2.2 Tratamento das infecções por Candida
A terapêutica para tratamento das micoses por Candida spp. ou outras espécies
fúngicas tem sido baseada na utilização de classes químicas diferentes dos antifúngicos, tal
como os polienos (anfotericina B) e azóis (fluconazol e cetoconazol), bem como
(SANGLARD; ODDS, 2002; SANGLARD, 2003; COLOMBO et al., 2006;
BHATTACHARYA; KAUR, 2015).
Os análogos da pirimidina, como a flucitosina agem impedindo a biossíntese de ácidos
nucléicos pela formação do antimetabólito tóxico 5-fluoracil, que age inibindo a timidilato
sintetase e consequentemente, a síntese de DNA (SANGLARD, 2003; MUKHERJEE et al.,
2005).
A caspofugina, membro das equinocandinas, apresenta ação fungicida contra as
leveduras do gênero Candida e ação moderada frente Aspergillus spp., além de pobre
atividade antifúngica contra Cryptococcus neoformans (SANGLARD; ODDS,2002;
KONTOYIANNIS; RUSSELL, 2002; MUKHERJEE et al., 2005). As equinocandinas, por
sua vez, interferem com a síntese da parede celular fúngica através da inibição não
competitiva da síntese de β-1,3-D-glicano, um componente integral da parede celular fúngica,
provocando um enfraquecimento da parede celular fúngica, lise e morte celular (KHAN et al.,
2010; CHANDRASEKAR, 2011).
Sanglard et al. (1998); Kontoyiannis; Russell, (2002) e Mukherjee et al. (2005) e
Chandrasekar, 2011) relataram que os antifúngicos azólicos (itraconazol, cetoconazol e
fluconazol) agem inibindo a enzima citocromo P450 14α-lanosterol-dimetilase causando a
inibição da síntese de ergosterol. Tais agentes têm sido utilizados para o tratamento de
infecções fúngicas superficiais e profundas (SANGLARD, 2003).
O uso do fluconazol tem sido voltado para micoses causadas por leveduras do gênero
Candida e Cryptococcus. Sendo este azólico menos eficaz contra a espécie Candida glabrata
e inativo para C. krusei e fungos filamentosos (KONTOYIANNIS; RUSSELL, 2002;
SANGLARD, 2003). Entretanto o itraconazol e o voriconazol apresentam ação antifúngica
contra alguns fungos filamentosos, a exemplo do Aspergillus spp. (SANGLARD, 2003).
Os polienos, a exemplo da anfotericina B, interagem com o ergosterol presente na
membrana dos fungos, causando formação de canais na membrana tendo como resultado a
despolarização e aumento da permeabilidade da mesma aos prótons e cátions monovalentes e
por conseguinte, saída do conteúdo citoplasmático pelos canais e morte celular
(SANGLARD; ODDS, 2002; MUKHERJEE et al., 2005; JOHNSON; EINSTEIN, 2007;
LANIADO-LABORÍN, CABRALES-VARGAS, 2009). A anfotericina B tem sido
2.3 Resistência aos antifúngicos
Apesar das diversas classes terapêuticas disponíveis, a terapia para infecções por
Candida tornou-se um desafio, pois o tratamento é difícil devido à natureza eucariótica das
células fúngicas, que são similares às células hospedeiras (ENDO et al., 2010;
BHATTACHARYA; KAUR, 2015). Existem poucos antifúngicos disponíveis para tratar
infecções fúngicas invasivas. Os azóis são geralmente fungistáticos, em vez de fungicidas, e
seu uso prolongado contribui para o desenvolvimento de resistência (KHAN et al., 2010). Os
polienos apesar de apresentarem baixos índices de resistência, são muito tóxicos. Formulações
lipídicas de anfotericina B são menos tóxicas que a anfotericina B convencional, mas
apresentam custo muito elevado (CHANDRASEKAR, 2011).
O surgimento de cepas resistentes aos antifúngicos convencionais têm aumentado a
realização de estudos de vigilância da resistência antimicrobiana de leveduras. Um exemplo é
um estudo publicado em 2008 por Yang e colaboradores, realizado com um total de 964
isolados de Candida coletados em Taiwan, onde observou-se que 17 cepas isoladas foram
resistentes a anfotericina B e, destas 16 cepas pertenciam a espécies de Candida não-albicans.
É bom ressaltar a questão da resistência in vitro versus in vivo em isolados de Candida
não-albicans, bem como da resistência inata e adquirida. Espécies como C. krusei apresenta
resistência intrínseca ao fluconazol, ao passo que outras espécies, como C. tropicalis e C.
glabrata têm apresentado crescente resistência adquirida (TAN et al., 2008).
Diversos mecanismos podem ser atribuídos ao processo de resistência fúngica, tais
como o aumento da regulação das bombas de efluxo, alteração da sequência de aminoácidos
da enzima citocromo P450 14α-lanosterol-dimetilase e alteração do perfil da membrana
(SANGLARD; ODDS, 2002).
De forma convencional, o tratamento da candidíase não tem se mostrado abrangente
em sua totalidade pelo surgimento de constantes barreiras ocasionadas, principalmente, pela
reduzida quantidade de agentes antimicóticos disponíveis para tratamento sistêmico, como
também a elevada toxicidade dos mesmos e o crescente aumento de espécies resistentes aos
A crescente preocupação com a resistência e com a toxicidade dos antifúngicos, fez
surgir importantes estudos relacionados com atividade antifúngica de produtos vegetais,
destacando-se entre eles os realizados por Yaya et al. (2011), Oliveira el al. (2011), Zapata et
al. (2010) e Coutinho et al. (2009), os quais testaram compostos derivados de produtos
naturais contra várias espécies fúngicas. A tendência atual nas pesquisas com produtos
naturais é a obtenção de princípios ativos contidos nas espécies vegetais para uma possível
aplicação no tratamento de infecções causadas por microrganismos, entre eles, os fungos.
Assim, a descoberta de plantas aromáticas com princípios ativos que apresentam
atividade antifúngica pode representar uma nova ferramenta à produção e ao uso de fármacos
no combate aos agentes infecciosos (KHAN, et al., 2012; MENDES, 2011; SILVA, et al.,
2009).
2.4 Óleos Essenciais
Os óleos essenciais, obtidos de plantas, são misturas complexas de substâncias
voláteis, geralmente odoríferas e líquidas. Seus constituintes variam desde hidrocarbonetos
terpênicos, álcoois simples e terpênicos, aldeídos, cetonas, fenóis, esteres até compostos com
enxofre. Quimicamente, a grande maioria dos óleos essenciais é constituída de derivados
fenilpropanoides ou terpenoides, sendo estes amplamente distribuídos na natureza (SPITZER,
2004), que por sua vez são empregados na indústria na produção de perfumes e cosméticos,
além de apresentarem efeitos farmacológicos (EDRIS, 2007).
Os terpenos são compostos químicos oriundos do metabolismo secundário das
espécies vegetais, constituindo uma rica fonte de compostos biologicamente ativos. São
conhecidos desde a antiguidade por possuir propriedades antifúngicas cuja utilização pode
representar um avanço contra os mecanismos de resistência que inativam antifúngicos padrões
(CASTRO, 2010; SAAD et al., 2010; TEMPONE et al., 2008).
Os compostos terpenoides têm sua origem biossintética das unidades do isopreno, que
por sua vez é originado a partir do ácido mevalônico (SPITZER, 2004). Os compostos
terpênicos são divididos, de acordo com o número de carbono (5 C) em suas moléculas, em
C); sesterpenos (25 C); triterpenos (30 C); tetraterpenos (40 C) e polisoprenóides (n C)
(SPITZER, 2004; BAKKALI et al., 2008).
Esta classe de metabólitos também se destaca pelas pesquisas científicas abordando os
terpenoides na forma de mistura racêmica ou de seus enantiômeros isolados, pois existe uma
estreita relação entra a atividade farmacológica e a enatiomeria das substâncias ativas. Essa
relação é atribuída à estereosseletividade dos receptores biológicos e das enzimas. Com os
avanços das técnicas de separação dos enantiômeros, houve a possibilidade de realização de
estudos farmacológicos destes isômeros isolados e da sua mistura racêmica (BIELORY;
LEONOV, 2008). Como exemplo destes estudos pode-se citar a pesquisa realizada por Sousa
et al. (2007), que demonstrou as atividades anticonvulsivante, sedativa e analgésica dos
enantiômeros do monoterpeno carvona.
Dentre tantos terpenoides estudados destaca-se o citronelal, um monoterpeno com
função aldeído (C10H18O), designado 3,7-Dimethyl-6-octenal, peso molecular de 154,3
g/mol e estrutura química demonstrada na figura 1. Ocorre naturalmente em óleos essenciais
de diversas plantas aromáticas da caatinga, como as do gênero Eucalyptus (ex.: Eucalyptus
citriodora). Outros gêneros também produzem o citronelal, muito embora em percentuais
variáveis, a exemplo, o gênero Melissa, Mentha, Allium, Cinnamomum, Cymbopogon
(QUINTANS-JÚNIOR, 2011, BRITO et al., 2012; CAVALCANTI et al., 2011; TOMAZ et
al., 2014).
Figura 2 – Estrutura química do monoterpeno citronelal.
Diversas plantas que produzem o citronelal em mistura racêmica são utilizadas em
todo mundo, principalmente na América do Sul, no tratamento de diversas doenças, em
São várias as atividades biológicas descritas para o citronelal (mistura racêmica), entre
as quais se destaca seu uso como repelente, uma revisão literária feita por Maia e Moore
(2011) demonstra que este monoterpeno aplicado de forma tópica é capaz de repelir insetos
durante 4 horas seguidas. Além disso este monoterpeno já revelou ação antimicrobiana
(SEIXAS et al., 2011; CAVALCANTI et al., 2011), alelopática (BRITO et al., 2012; TOMAZ
et al., 2014), antioxidante (SCHERER et al., 2009; ANDRADE et al., 2012) e herbicida
(BRITO et al., 2012). Além disso, a mistura racêmica do citronelal mostrou atividade
antifúngica contra cepas do gênero Candida spp., isoladas da cavidade oral (TRINDADE et
al., 2015).
Estudos com os derivados químicos do citronelal e citronelol, ambos isolados do óleo
de citronela, demonstraram boa atividade antimicrobiana na proteção de alimentos contra três
importantes bactérias patogênicas Listeria monocytogenes, Staphylococcus aureus e
Salmonella typhimurium (VICTÓRIA et al., 2012), comprovando assim o potencial
farmacológico dos monoterpenos contra diferentes espécies de micro-organismos patógenos
para o ser humano.
2.5 Atividade antioxidante de terpenos
A oxidação é um processo metabólico que leva à produção de energia necessária para
as atividades essenciais das células. Entretanto, o metabolismo do oxigênio nas células vivas
também leva à produção de radicais livres (STIEVEN et al., 2009).
Os radicais livres são átomos ou moléculas formadas continuamente durante os
processos metabólicos e que atuam como mediadores para a transferência de elétrons em
algumas reações bioquímicas, desse modo desempenhando funções relevantes ao
metabolismo humano (ALMEIDA, 2006; NEVES et al., 2009; ALVES et al., 2010;
FERNANDES, 2010).
A biossíntese fisiológica e contínua dos radicais livre pode aumentar substancialmente
como resultado de um desequilíbrio entre o ambiente intra e extracelular, resultando num
processo mais conhecido como estresse oxidativo, que é considerado um dos principais
fatores que desencadeiam várias doenças crônicas degenerativas, tais como: câncer, doenças
Isso ocorre porque quando são produzidos em excesso, estes radicais reagem com
DNA, RNA, proteínas e outras substâncias oxidáveis, promovendo danos que contribuirão
para o envelhecimento e estando fortemente relacionados a patologias tais como câncer e
doenças cardiovasculares (PEREIRA et al, 2009; BARREIROS et al, 2006; MELO et al,
2006).
Para combater estes danos celulares resultantes do estresse oxidativo, os organismos
vivos produzem vários sistemas não enzimáticos que agem por meio da inativação das reações
produzidas por radicais livres, os antioxidantes naturais (ALCANTARA et al., 2010). Estas
substâncias são capazes de prevenir os efeitos deletérios da oxidação, impedindo o início da
peroxidação lipídica, sequestrando radicais livres e/ou quelando íons metálicos (SILVA et al,
2012).
Estes compostos podem ser produzidos pelo corpo ou absorvidos a partir da dieta
(NUNES et al, 2005; RATMAN et al, 2006). Os antioxidantes sintéticos são obtidos de
suplementação alimentar e da adição aos alimentos, prática comum na indústria alimentícia
(PITARO et al, 2009). Já os antioxidantes naturais, obtidos da dieta, têm como principal fonte
as vitaminas (A, C e E), compostos fenólicos e carotenoides, contidos principalmente nas
frutas e vegetais (PEREIRA et al, 2009; RATMAN et al, 2006).
Devido à insegurança e limitações dos antioxidantes sintéticos, os antioxidantes
naturais, em especial, os isolados de plantas, estão recebendo maior atenção por poderem
oferecer uma alternativa interessante para minimizar o dano oxidativo causado pelos radicais
livres (ALMEIDA, 2006; NEVES et al., 2009; ALVES et al., 2010; FERNANDES, 2010;
GHASEMZADEH et al., 2010). Dentre os metabólitos secundários de plantas com atividade
antioxidante, destacam-se os flavonoides e os terpenoides (ROMANO et al, 2013; SILVA et
al, 2012).
Vários estudos já demonstraram o efeito antioxidante dos terpenoides, como o estudo
de Silva et al. (2012), que verificou a capacidade do monoterpneo (-)-α-terpineol de impedir a
formação do radical hidroxila e de impedir a peroxidação lipídica pelo radical AAPH e o
estudo de Costa et al.(2012), que avaliou a ação sequestradora de radicais livres de oxigênio
2.6 Toxicidade dos monoterpenos
É evidente a importância da avaliação do balanço entre a atividade farmacológica
versus toxicidade de uma determinada substância, como por exemplo um terpenoide, para
verificar sua aplicabilidade terapêutica.
A toxicidade de monoterpenos farmacologicamente ativos está bem estabelecida em
vários estudos, entre eles o geraniol e o citronelal na forma de mistura racêmica revelaram
significativo potencial citotóxico em células de mamíferos quando comparado a outros efeitos
parasitários (CARNEIRO et al., 2015). Segundo estudo de Lima (2011), o citral e o carvacrol
apresentaram ação tóxica mediante células de mamíferos (MDCKs).
Um dos modelos experimentais utilizados para avaliação da toxicidade in vitro é o
ensaio de citotoxicidade em eritrócitos. Esse teste é usado como método de triagem para
toxicidade de novas drogas a fim de estimar o dano que elas podem produzir in vivo
(SCHREIER et al., 1997; APARICIO et al., 2005). A avaliação da citotoxicidade de
constituintes tem como vantagens a redução dos efeitos sistêmicos, da variabilidade entre
experimentos, menor gasto de droga e tempo, redução dos testes em animais, além de permitir
estudos em células humanas (SPIELMANN et al., 2008).
A membrana eritrocitária é uma estrutura delicada que pode ser significativamente
alterada por interações com medicamentos. Vários estudos indicam que certos compostos
isolados de plantas, tais como polifenois, glicosídeos, saponinas e terpenoides podem causar
alterações nas membranas das células vermelhas do sangue e, posteriormente, produzir
hemólise (NG; LI; YEUNG, 1986; BADER et al., 1996; GRINBERG et al., 1997; ZHANG et
al., 1997; LEXIS, et al. 2006).
Diante da abordagem relatada anteriormente, torna-se relevante investigar as
propriedades farmacológicas (antifúngica e antioxidante) e toxicológicas do enantiomeros
RC, SC, bem como do derivado sintético hidroxilado inédito do citronelal, o 7-OH,
3 OBJETIVOS
3. 1 Geral
Avaliar as atividades antifúngica, antioxidante e citotóxica dos monoterpenos
(R)-(+)-citronelal, (S)-(-)-(R)-(+)-citronelal, 7-hidroxicitronelal.
3.2 Específicos
Avaliar in silico as propriedades antimicrobianas dos monoterpenos;
Determinar a Concentração Inibitória Mínima (CIM) dos monoterpenos frente a diferentes cepas do gênero Candida;
Determinar a Concentração Fungicida Mínima (CFM) dos monoterpenos frente a diferentes cepas do gênero Candida;
Analisar o potencial oxidante e antioxidante dos monoterpenos;
Verificar a capacidade dos monoterpenos em inibir a formação do radical hidroxila proveniente do peróxido de hidrogênio;
4 MATERIAL E MÉTODOS
4.1 Local da Pesquisa
Os ensaios laboratoriais referentes ao estudo da atividade antimicrobiana foram
realizados no Laboratório de Micologia do Departamento de Ciências Farmacêuticas (DCF),
Centro de Ciências da Saúde (CCS), Universidade Federal da Paraíba (UFPB). Já os ensaios
de atividade antioxidante e citotoxicidade foram realizados no Laboratório de Bioquímica, da
Unidade Acadêmica de Ciências Biológicas, Centro de Saúde e Tecnologia Rural,
Universidade Federal de Campina Grande, em colaboração com o Prof. Dr. Abrahão Alves de
Oliveira Filho.
4.2 Posicionamento Ético
Para realização deste trabalho foi levado em consideração os aspectos éticos e legais
da pesquisa envolvendo seres humanos, seguindo a resolução do Conselho Nacional de Saúde
(CNS), 466 de dezembro de 2012. O projeto foi aprovado pelo Comitê de Ética em Pesquisa
da Faculdade Santa Maria, Cajazeiras-PB, com o Protocolo CEP/FSM n° 1.256.762/15.
4.3 Ensaios da atividade antimicrobiana 4.3.1 PASS online
Previsão do espectro de atividade para substâncias (PASS) online (http://www.
way2drug.com/passonline) é um software projetado para avaliar o potencial biológico geral
de uma molécula orgânica in silico sobre o organismo humano. Ele fornece previsões
simultâneas de muitos tipos de atividades biológicas com base na estrutura dos compostos
orgânicos. O espectro de atividade biológica de um composto químico é o conjunto de
diferentes tipos de atividade biológica, que refletem os resultados de interação do composto
com várias entidades biológicas. Pass online dá várias facetas da ação biológica de um
composto, obtendo os índices Pa (probabilidade " de ser ativo") e Pi (probabilidade "de ser
inativo") estimando a categorização de um composto potencial em ser pertencente à subclasse
4.3.2 Meios de Cultura
Os meios de cultura utilizados nos ensaios de avaliação da atividade antifúngica foram
o meio sólido ágar Sabouraud dextrose (ASD) e o meio líquido caldo Sabouraud dextrose
(CSD), adquiridos da DifcoLaboratories, USA.
4.3.3 Cepas Fúngicas
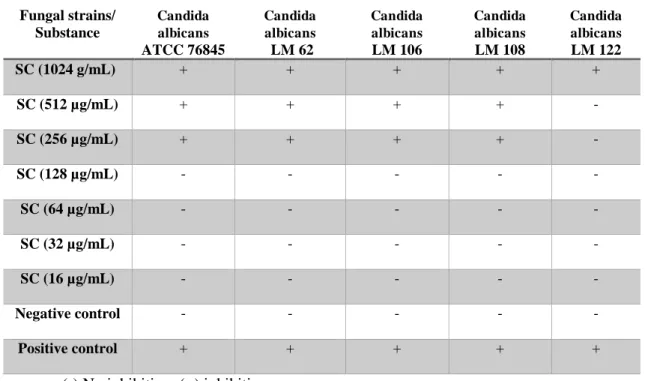
Para os ensaios de atividade antifúngica, foram utilizadas as cepas de Candida
albicans (ATCC 76845, LM 62, LM 106, LM 108, LM 122) e as cepas de Candida tropicalis
(ATCC 13803, LM 06, LM 14, LM 31, LM 36), que fazem parte da MICOTECA do
Laboratório de Micologia, Departamento de Ciências Farmacêuticas, Centro de Ciências da
Saúde da Universidade Federal da Paraíba.
Todas as cepas foram mantidas em ágar Sabouraud dextrose a uma temperatura de
4 °C. Foram utilizados para os ensaios repiques de 24 horas em ágar Sabouraud dextrose
incubados a 35 °C.
4.3.4 Inóculo
Para preparação do inóculo, culturas das espécies de Candida foram semeadas em ágar
Sabouraud dextrose e incubadas a 35 ºC/24-48 horas. Colônias desta cultura foram suspensas
em solução de NaCl 0,85% estéril e ajustadas de acordo com o padrão 0,5 de McFarland (1-5
x 106 UFC/mL) (CLEELAND; SQUIRES, 1991; HADACEK; GREGER, 2000).
4.3.5 Obtenção da substância teste e do antifúngico padrão
Os monoterpenos (R)-(+)-citronelal, (S)-(-)-citronelal, 7-hidroxicitronelal foram
adquiridos da Indústria Sigma-Aldrich® (São Paulo-SP). Para a realização dos ensaios
farmacológicos, as substâncias foram solubilizadas em DMSO e diluído em água destilada. A
concentração de DMSO utilizada foi inferior a 0,1% v/v. O antifúngico utilizado na execução
4.3.6 Determinação da Concentração Inibitória Mínima (CIM)
Os ensaios de atividade antifúngica foram realizados conforme os protocolos de
Cleeland e Squires (1991), Hadacek e Greger (2000) e CSLI (2008).
A determinação da CIM dos monoterpenos, bem como do antifúngico Nistatina sobre
cepas de Candida foram determinadas através da técnica da microdiluição em caldo.
Inicialmente, foram distribuídos 100 μL de caldo Sabouraud dextrose duplamente concentrado nos orifícios das placas de microdiluição. Em seguida, 100 μL da emulsão dos produtos, também duplamente concentrado, foram dispensados nas cavidades da primeira
linha da placa. E por meio de uma diluição seriada a uma razão de dois, obteve-se
concentrações de 1024 µg/mL até 2 µg/mL, de modo que na primeira linha da placa se
encontrava a maior concentração e na última, a menor concentração. Por fim, adicionou-se 10
µL do inóculo das espécies nas cavidades, onde cada coluna da placa referia-se a uma cepa
fúngica, especificamente.
Paralelamente, realizou-se o controle de viabilidade das cepas ensaiadas. E também o
controle de sensibilidade destas cepas frente à ação do antifúngico considerado padrão na
utilização clínica (nistatina 100 UI/mL). Para verificar a ausência de interferência nos
resultados pelo solvente utilizado na preparação da substância, no caso o DMSO,
adicionou-se nas cavidades com 100 µL do caldo duplamente concentrado, 100 µL do DMSO e 10 µL
da suspensão fúngica.
As placas foram assepticamente fechadas e incubadas a 35°C por 24 - 48 horas para
ser realizada a leitura. Define-se a CIM para os produtos testados como a menor concentração
capaz de produzir inibição visível sobre o crescimento fúngico verificado nos orifícios,
quando comparado com o crescimento controle. Os ensaios foram realizados em duplicata e o
resultado expresso pela média aritmética das CIM’s obtidas nos dois ensaios.
Sartoratto et al. (2004) propuseram uma classificação do potencial antimicrobiano para
produtos vegetais com base nos resultados da CIM, considerando como: forte poder
4.3.7 Determinação da Concentração Fungicida Mínima (CFM)
Após leitura da CIM, alíquotas de 20 µL do sobrenadante das cavidades onde foi
observada completa inibição do crescimento fúngico nas placas de microdiluição (CIM,
CIMx2, CIMx4), foram semeadas em placas de ágar Sabouraud dextrose. As placas foram
incubadas a 35° C por 24-48 horas. A CFM foi considerada como a menor concentração em
que o crescimento observado foi inferior a 3 colônias (aproximadamente 99 a 99,5 % de
atividade de morte). Os ensaios foram realizados em duplicata e o resultado expresso pela
média aritmética das CFM’s obtidas nos dois ensaios (ESPINEL-INGROFF et al., 2002).
4.4 Ensaios da atividade antioxidante
4.4.1 Eritrócitos humanos
Os eritrócitos humanos (A, B, O) foram oriundos de bolsas contendo concentrado de
eritrócitos que não seriam mais utilizados para transfusão. As bolsas foram obtidas na
Unidade Transfusional do Hospital Universitário Lauro Wanderley/UFPB. A manipulação e o
descarte dos eritrócitos foram realizados de acordo com as Normas de Segurança seguidas
pela referida unidade.
4.4.2 Avaliação do potencial oxidante e antioxidante dos monoterpenos em eritrócitos humanos
Para investigar o potencial oxidante dos monoterpenos foi preparada uma suspensão
de eritrócitos a 30% em PBS (11,35g NaH2PO4.2H2O; 24,36g Na2HPO4 e 7,18g NaCl para 1
L; pH 7,4) suplementado com glicose (200 mg/dL), pH 7,6. Em seguida, as amostras dos
monoterpenos em diferentes concentrações foram adicionadas a 2 mL da suspensão de
eritrócitos e incubados por um período de 1 hora sob agitação lenta e constante (100 rpm) a
22±2 °C. Em seguida as amostras foram centrifugadas a 2500 rpm durante 5 minutos e a
porcentagem de metahemoglobina (metHb) em relação a hemoglobina (Hb) total foi
quantificada por espectrofotometria em comprimento de onda de 630 nm e 540 nm,
para a fenilhidrazina (PH), um comprovado agente oxidante (WEFFORT-SANTOS et al.,
2008).
Para investigar o potencial antioxidante, após o período de incubação de 1h referente a
etapa descrita anteriormente, foi adicionado um 1 mmol/L do agente oxidante fenilhidrazina.
As suspensões foram aeradas e mantidas sob agitação lenta e constante (100 rpm) por mais 20
minutos a 22±2 °C. Decorrido este período, as amostras foram centrifugadas a 2500 rpm
durante 5 minutos, diluídas em tampão fosfato (9g Na2HPO4.12H2O, 5,7g KH2PO4 para 1 L) e
a porcentagem de metHb em relação a Hb total foi quantificada por espectrofotometria a 630
nm e 540 nm. Todos os experimentos foram realizados em triplicata.
4.4.3 Avaliação do potencial antioxidante dos monoterpenos frente ao peróxido de hidrogênio
Distribuiu-se 2 mL de tampão fosfato (9 g Na2HPO4.12H2O, 5,7 g KH2PO4 para 1 L)
em tubos de falcon, em seguida adicionou-se a solução de cada monoterpeno em diferentes
concentrações e, por último, foi acrescentado 0,6 mL de solução de peróxido de hidrogênio
(H2O2) 40 mM. Um grupo controle negativo foi feito apenas com a solução de tampão fosfato
e o controle positivo com o tampão fosfato, a solução de H2O2 40 mM e solução de ácido
ascórbico (vitamina C). Os experimentos foram realizados em triplicata e o resultado expresso
em % de atividade antioxidante em comparação ao grupo controle negativo (tampão + H2O2)
(GULÇIN, et al. 2010).
4.5 Ensaios de citotoxicidade
4.5.1 Avaliação do potencial hemolítico dos monoterpenos em eritrócitos humanos
Amostras de sangue humano A, B e O foram misturadas com NaCl 0,9 % na
proporção de 1:30 e centrifugadas a 2500 rpm durante 5 minutos para obtenção dos
eritrócitos. Este procedimento foi repetido por mais duas vezes e, o sedimento da última
monoterpenos em diferentes concentrações foram adicionadas à 2 mL da suspensão de
eritrócitos para um volume final de 2,5 mL. Uma suspensão de eritrócitos foi utilizada como
controle negativo (0 % de hemólise) e uma suspensão de eritrócitos acrescida de Triton X-100
a 1% como controle positivo (100 % de hemólise). Após isso, as amostras foram incubadas
por 1 hora à 22 ± 2 ºC sob agitação lenta e constante (100 rpm). Decorrido este tempo as
amostras foram centrifugadas a 2500 rpm durante 5 minutos e a hemólise quantificada por
espectrofotometria em comprimento de onda de 540 nm (RANGEL et al.,1997).
Todos os experimentos foram realizados em triplicata e expressos como a média mais
ou menos o erro padrão da média.
4.6 Análise Estatística
Os resultados obtidos nos experimentos tiveram seus valores expressos em média ±
erro padrão da média (e.p.m.) e analisados empregando-se o teste t de Student não pareado,
para análise de duas colunas. Os resultados foram considerados significativos quando p <
0,05. Para a análise dos dados utilizou-se o programa estatístico GraphPad Prisma versão
5.1 Antimicrobial analysis of three monoterpenes derived from citronellal:
an
in silicoapproach
Será submetido na Revista Cubana de Farmácia
Antimicrobial analysis of three monoterpenes derived from citronellal: an
in silico
approach
Heloísa M. B. F. de Oliveira1, Abrahão A. O. Filho2, José Pinto de Siqueira Júnior1,
Edeltrudes O. Lima1
1 Program in Natural Products and Synthetic Bioactive, Federal University of Paraiba, Paraiba-Brazil 2 Academic Unit Biological Sciences, Federal University of Campina Grande, Paraiba – Brazil
*Corresponding author: heloisambf@gmail.com
ABSTRACT
Monoterpenes are known to exhibit a variety of effects in different biological systems. In the
study, the (R)-(+)-citronellal, (S)-(-)-citronellal and 7-hydroxycitronellal were evaluated for
its antimicrobial effects. The PASS online program was used in the study for activities in
silico. In silico models are being applied for the evaluation of pharmacological and toxicity
of compound in metabolic environment of mammals. The analysis of possible antimicrobial
activity in silico citronellal derivatives of monoterpenes revealed that all the studied
compounds are more likely to have a significant antifungal effect.
1. INTRODUCTION
Representative of a class of secondary metabolites, the monoterpenes are
constituents of essencial oils present in species of aromatics herbs. It’s biosynthetic origin
derived from isoprênica units, which are composed by ten atoms of carbons (1). Despite
having a simple structure, these compounds have some biological activities (2,3,4,5).
Among the various monoterpenes studied can highlight the citronellal, which occurs
naturally in essential oils of various herbs of the caatinga, such as gender Eucalyptus (ex.:
Eucalyptus citriodora). Other genders also produce citronellal, although in percentage
variables, such as, gender Melissa, Mentha, Allium, Cinnamomum, Cymbopogon (6,7,8,9).
Several plants that produce citronellal are used worldwide, mainly in South
America, in treating various health conditions, including primarily the treatment of pain (10).
Also this monoterpene already revealed antimicrobial activity (7,11), allelopathic activity
(6,9), antioxidante activity (12,13) and herbicide activity (6).
Based on this information , aimed to analyze in silico the antimicrobial properties of
three monoterpenes derived from citronellal, (R)-(+)-citronellal (RC), (S)-(-)-citronellal (SC)
and 7-hydroxycitronellal (7-OH).
2. MATERIALS AND METHODS
2.1 PASS online
Prediction of Activity Spectra for Substances (PASS) online (http://www.way2drug.
com/passonline) is designed to evaluate the general biological potential of an organic
based on the structure of organic compounds. The biological activity spectrum of a chemical
compound is the set of different types of biological activity that reflect the results of the
compound’s interaction with various biological entities. PASS online gives various facets
of the biological action of a compound. Pa (probability "to be active") and Pi (probability "to
be inactive") estimates the categorization of potential compound is belonging to the sub-class
of active or inactive compounds respectively (14).
PASS gives hits based on the probability of new effects and mechanism of action
with required activity spectra among the compounds from in-house, old and commercial
databases. PASS online predicts the biological activity spectrum for the modified imprints
on the basis of its structural formula, along with different descriptors like antifungal,
antiviral, antihelmintic, antiprotozoal, etc., so it is possible to estimate if new compounds
have a particular effect (14).
3. RESULTS AND DISCUSSION
In silico models are being applied for the evaluation of pharmacology and toxicity of
compound in metabolic environment of mammals. Hence, several efficient statistical
machine learning methods have been used to develop in silico tools for the
prediction of pharmacological and toxicological hazards of molecular structure (15).
Computer-assisted prediction models, so-called predictive tools, play an essential role
are used to study both existing and hypothetical compounds, which are fast, reproducible
and are typically based on human bio- regulators (14,16).
The analysis of percentual value of “Pa” for antimicrobial activity in silico for
citronellal derivatives revealed that all the studied monoterpenes are more likely to have a
significant antifungal effect ( Pa 7-OH: 42,4%; Pa RC: 58%; Pa SC: 58%) (Figures 1,2,3).
Figure 2- Predicted antimicrobial activities of the ( R ) - ( + ) - citronellal depicted through Pass online tool.
Knowing that because there is a close relationship enters the pharmacological
activity and the enantiomeric of active substances due to stereo selectivity of biological
receptors and enzymes (17). We sought to compare the results between the isomers
(R)-(+)-citronellal and (S)-(-)-(R)-(+)-citronellal, analyzing the data can be seen that these compounds have
the same percentage of probability in relation to its possible pharmacological effects,
suggesting that in such cases the isomerism does not interfere with potential antimicrobial
effects presented by these monoterpenes.
4. CONCLUSION
In silico study of three monoterpenes derived from citronellal, (R)-(+)-citronellal,
(S)-(-)-citronellal and 7-hydroxycitronellal, demonstrated that these compounds have several
possible biological effects on the pathogenics microorganisms, in special fungi species,
besides the isomerism does not interfere in these activities.
REFERENCES
1- Las Heras B, Rodriguez B, Bosca L, Villar AM. Terpenoids: sources, structure elucidation
and therapeutic potential in inflammation. Current Topics in Medicinal Chemistry. 2003;
3(2): 171-185.
2- Bhalla Y, Gupta VK, Jaitak V. Anticancer activity of essential oils: a review. Journal of
the Science of Food and Agriculture. 2013; 93(15): 3643-3653.
3- Guimarães AG, Quintans JSS, Quintans-Júnior LJ. Monoterpenes with Analgesic
Activity-A Systematic Review. Phytotherapy Research. 2013; 27: 1-15, 2013.
4- Riella KR, Marinho RR, Santos JS, Pereira-Filho RN, Cardoso JC, Albuquerque-Junior
of the essential oil from Lippia gracilis, in rodents. Journal of Ethnopharmacology. 2012;
143: 656-663.
5- Santana MT, De Oliveira MG, Santana MF, De Sousa DP, Santana DG, Camargo EA, De
Oliveira AP, Almeida JR, Quintans LJ. Citronellal, a monoterpene present in Java citronella
oil, attenuates mechanical nociception response in mice. Pharmaceutical Biology, 2013;
51(9): 1144-1149.
6- Brito DV, Ootani MA, Ramos ACC, Sertão WC, Aguiar RWS. Effect of citronella oil,
eucalipto and citronellal compound of mycoflora and devolopment of maize plants. Journal of
Biotechonology and Biodiversity. 2012; 3:184-192.
7- Cavalcanti YM, Almeida LFD, Padilha WWN. Screening of essential oils antifungal
activity on Candida strains. Odontologia Clínica-Científica. 2011; 243-246.
8- Quintans-Júnior L. Antinociceptive action and redox properties of citronelal, an essential
oil present in lemongrass. Journal of Medicinal Food. 2011; 14(6): 630–639.
9- Tomaz MA, Costa A, Rodrigues WN, Pinheiro PF, Parreira PA, Rinaldo D. Chemical
Composition and Allelopathic Activity of the Eucalyptus Essential Oil. Biosc. J. 2014; 30:
475-483.
10- Lu YH, Zhang CW, Bucheli P, Wei DZ. Citrus flavonoids in fruit and traditional Chinese
medicinal food ingredients in China. Plant Foods for Human Nutrition. 2006; 61: 57–65.
11- Seixas TL, Castro HC, Santos GR, Cardoso DP. Controle fitopatológico do Fusarium
subglutinans pelo óleo essencial do capim-citronela (Cymbopogon nardus L.) e do composto
citronelal. Revista Brasileira de Plantas Medicinais. 2011; 13:523-526.
12- Scherer R, Wagner R, Duarte MCT, Godoy HT. Composição e atividades antioxidante e
antimicrobiana dos óleos essenciais de cravo-da-india, citronela e palmarosa. Rev. Bras.
Plant. Med.. 2009; 11(4):442-449.
13- Andrade MA, Cardoso MG, Batista LB, Mallet ACT, Machado SMF. Óleos essenciais de
Cymbopogon nardus, Cinnamomum zeylanicum e Zingiber officinale: composição, atividades
antioxidante e antibacteriana. Revista Ciência Agronômica. 2012; 43(2):399-408.
14- Srinivas N, Sandeep KS, Anusha Y, Devendra BN. In Vitro Cytotoxic Evaluation and
Detoxification of Monocrotaline (Mct) Alkaloid: An In Silico Approach. Int. Inv. J.
15- Marchant CA. Computational toxicology: a tool for all industries. WIREs Comp. Mol. Sci.
2012; 2: 424-434.
16- Angelo V, Max D, Markus AL. The Challenge of Predicting Drug Toxicity in silico. Bas.
Clin. P har . Tox. 2006; 99: 195–208.
17- Bielory L, Leonov A. Stereoconfiguration of antiallergic and immunologic drugs. Annals
5.2 Antimicrobial effect of (R)-(+)-citronellal against
Candidastrains
Será submetido na Latin American Journal of Pharmacy.