1.1. Receptores Nicotínicos de Acetilcolina (nAChRs)
O neurotransmissor acetilcolina (ACh) (Figura 1.1) exerce seus efeitos sobre os sistemas nervosos central (SNC) e periférico (SNP) através de dois tipos diferentes de receptores: os receptores muscarínicos e nicotínicos de ACh (mAChRs e nAChRs, respectivamente). Os mAChRs pertencem à família de receptores acoplados à proteína G, ao passo que os nAChRs são canais iônicos controlados por ligante (Jensen et al., 2005).
Os nAChRs estão envolvidos em uma ampla faixa de processos fisiológicos e patofisiológicos. Ocorrem na junção neuromuscular, onde são mediadores-chave no processo de contração da musculatura esquelética, e no SNC, onde estão envolvidos em vários processos relacionados às funções cognitivas, aprendizado e memória, controle motor e analgesia (Jensen et al., 2005).
Figura 1.1. Fórmula estrutural plana do neurotransmissor acetilcolina (ACh). 1.1.1. Estrutura e função dos nAChRs
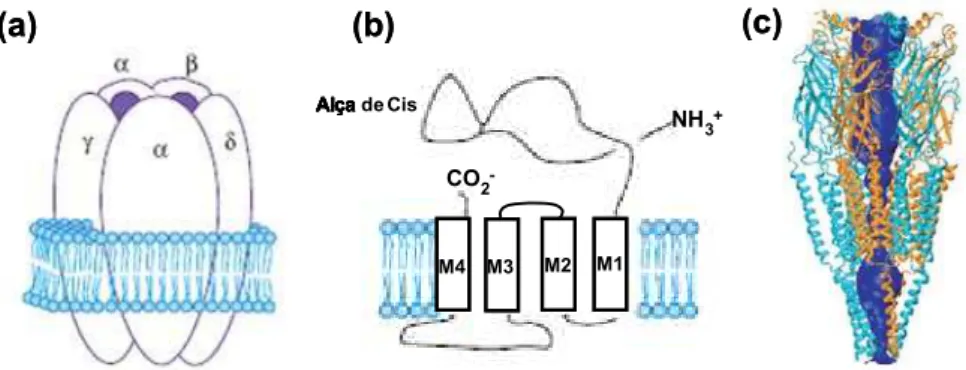
Os nAChRs são formados por cinco subunidades protéicas que delimitam um poro aquoso central, permitindo o influxo de cátions como Na+, K+ e Ca2+ (Figura 1.2a).
contêm resíduos conservados, muitos dos quais possuem cadeias laterais aromáticas (triptofano e tirosina), que, provavelmente, estabelecem interações π-catiônicas com agonistas (Figura 1.2b); o domínio do canal de α-hélices e um domínio citoplasmático consistindo substancialmente de α-hélices. Cada subunidade contribui com todos os três domínios estruturais (Figura 1.2c) (Sine e Engel, 2006).
As cadeias polipeptídicas das subunidades dos nAChRs contêm quatro segmentos hidrofóbicos transmembrânicos (M1-M4) (Figura 1.2b); evidências indicam que o segmento M2 é uma α-hélice e reveste internamente o poro catiônico. Os segmentos M3 e M4 são separados por uma grande alça intracelular, que possui sítios de fosforilação para Ser/Tre quinases (Figura 1.2b).
Figura 1.2. Receptor nicotínico de acetilcolina (nAChR). (a) Estrutura pentamérica do nAChR do tipo muscular, com destaque para os sítios de ligação para ACh e outros agonistas. (b) Estrutura de uma subunidade do nAChR. (c) Representação em fita do nAChR. As subunidades α são mostradas em laranja e as demais, em azul. Note os tipos de estrutura secundária dos domínios estruturais extracelular, do canal e citoplasmático, correspondendo aos terços superior, médio e inferior da figura, respectivamente. A superfície externa do poro é mostrada em azul escuro (Sine e Engel, 2006; Lester et al., 2004).
O nAChR do tipo muscular é formado por duas subunidades α1 e subunidades 1, , ( , no feto), sendo que a ACh se liga a sítios localizados nas interfaces α1- e α1- (Figura 1.3). Por outro lado, as 12 subunidades neuronais podem formar uma gama de subtipos de nAChRs com farmacologia, cinética de ativação e dessensibilização, e permeabilidade a cátions bastante diferentes (Figura 1.3). As subunidades α2-α6 e 2- 4 estão envolvidas na formação de nAChRs heteropentaméricos, com estequiometria (α)2( )3. A ACh e outros
(c)
M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
(b) (a) (c) M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
M1 M2 M3 M4
NH3+
CO2
-Alça de Cis
agonistas se ligam a sítios posicionados na interface entre as subunidades α e , portanto, a dois sítios de ligação. As subunidades α5 e 3 não participam na formação de sítios de ligação, por carecerem de resíduos de aminoácidos cruciais. Contudo, junto com pares de α
2-α6 e 2- 4, podem formar receptores complexos, sendo a quinta subunidade e tendo profundo impacto sobre a farmacologia, permeabilidade ao Ca2+ e cinética de dessensibilização (Figura 1.3). As subunidades α7, α8 e α9 formam receptores homopentaméricos, mais permeáveis ao Ca2+ e com velocidades de dessensibilização maiores do que aquelas paras os nAChRs do tipo muscular e neuronais. A subunidade α10 não é capaz de formar receptores homoméricos funcionais, mas pode formar um nAChR funcional junto com a subunidade α9, cuja estequiometria é desconhecida (Figura 1.3). Ademais, estudos in vitro demonstraram que a subunidade α7 é capaz de formar receptores heteropentaméricos com as subunidades 2 e 3, com propriedades farmacológicas e cinética de ativação e dessensibilização diferentes daquelas observadas para o receptor homomérico (Jensen et al., 2005; Palma et al., 1999; Khiroug et al., 2002).
Figura 1.3. Diversidade dos nAChRs neuronais humanos. Os vários subtipos heteroméricos e homoméricos dos nAChRs (Jensen et al., 2005).
modificar o equilíbrio entre as diferentes conformações do nAChR. Ademais, a cinética de transição de um estado para outro é determinada pela barreira de energia entre os dois estados e pode ser regulada por processos de fosforilação, como foi demonstrado para o nAChR do tipo muscular. Aqui, vale ressaltar que, enquanto a ativação do receptor é um processo transiente muito rápido (ocorre na escala de tempo de microssegundos a milissegundos), sua dessensibilização ocorre lentamente (na escala de tempo de milissegundos a segundos) (Jensen et al., 2005).
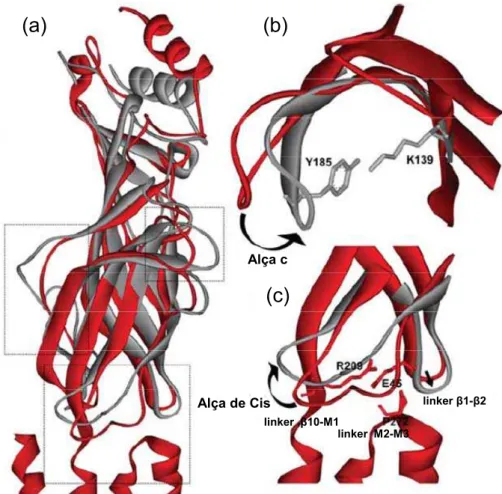
Os mecanismos bioquímicos de acoplamento funcional do nAChR, ou seja, de que forma a interação com um agonista desencadeia a abertura do canal, têm sido investigados e os maiores avanços emergiram de estudos mecanísticos com o nAChR do tipo muscular. Postula-se que a ligação do agonista faça com que a alça C mude sua conformação, inclinando-se em direção ao domínio do canal. Essa mudança conformacional aproxima os resíduos de tirosina (alça C) e lisina (folha 10), favorecendo a interação entre ambos e, ao mesmo tempo, enfraquecendo ou rompendo uma interação prévia entre esse resíduo de lisina e um resíduo de aspartato (folha 10). Recentemente foi proposto que a interação com o agonista também leva ao rompimento de uma ponte salina entre os resíduos de arginina (extremidade da folha 10) e glutamato (linker 1- 2). Em adição, acredita-se que tais alterações estruturais induzidas pela ligação do agonista podem se propagar através das folhas
Figura 1.4. Possíveis alterações estruturais induzidas pela interação agonista-receptor. (a) A conformação fechada do receptor (subunidade α do nAChR de Torpedo) é mostrada em vermelho e uma possível conformação ativa ou dessensibilizada é mostrada em cinza. As caixas indicam áreas que são expandidas em (b) e (c). (b) Com a ligação do agonista, a alça C se move em direção ao canal, aproximando os resíduos de tirosina (Y185) e lisina (K139), rompendo uma interação prévia entre K139 e um resíduo de aspartato (não mostrado). (c) O movimento do linker 1- 2 e do linker 10-M1
leva ao rompimento de uma ponte salina entre os resíduos de glutamato (E45) e arginina (R209), permitindo a possível isomerização do resíduo de prolina (P272). Em adição, a alça de Cis pode mudar de posição na presença do agonista (Gay e Yakel, 2007).
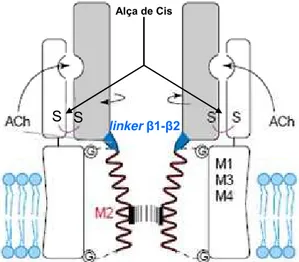
Tendo em vista que a barreira molecular à passagem de íons através do canal é um portão que consiste de um “anel de leucina” formado por interações hidrofóbicas entre as cadeias laterais volumosas de cinco resíduos de leucina (um para cada hélice M2) e um “anel de valina/isoleucina”, a rotação das hélices M2 enfraquece tais interações e move para fora do canal esses resíduos, substituindo-os por resíduos polares menores. Como resultado, o poro iônico se alarga em cerca de 3 Å, permitindo que cátions passem através do canal (Figura 1.5) (Jensen et al., 2005; Gay e Yakel, 2007).
(c)
Alça cAlça de Cis
linker β10-M1
linker M2-M3
linkerβ1-β2
(c)
Alça cAlça de Cis
linker β10-M1
linker M2-M3
Figura 1.5. Abertura do nAChR, mostrando apenas as duas subunidades α. A ligação do agonista provoca a rotação da região hachurada em torno do eixo que passa através das alças de Cis. O linker
1- 2 faz contato com o linker M2-M3 (a região não-helical é mostrada como uma série de linhas verticais) e a rotação torce a região M2, abrindo o canal. As hélices M2 contêm o portão do canal (Lester et al., 2004).
Ao passo que o mecanismo de abertura do canal do nAChR tem sido elucidado, muito pouco se sabe sobre os mecanismos de dessensibilização e novas pesquisas estão sendo feitas na área. Resultados indicam que as constantes cinéticas de dessensibilização dependem do estado conformacional do receptor e não da ocupação dos sítios agonistas, com a forma aberta se dessensibilizando mais rapidamente (Auerbach e Akk, 1998). Estudos estruturais têm revelado que as diferentes subunidades contribuem de modo diferente para a cinética de dessensibilização (Geniatullin et al., 2005). Por exemplo, diferentes segmentos do domínio extracelular da subunidade 2 controlam a velocidade de dessensibilização de formas distintas (Bohler et al., 2001).
1.1.2. Mecanismos de Ativação e Inibição
Um mecanismo mínimo e comumente aceito para a ativação dos nAChRs é dado por (Cash e Hess, 1980)
linkerβ1-β2
S S
linkerβ1-β2
S S
A + L AL1 AL2
IL1 IL2
AL2 K1
K1 Φ
K2
k12 k21 k34 k43
A + L AL1 AL2
IL1 IL2
AL2 K1
K1 Φ
K2
A representa a forma não dessensibilizada do receptor, AL1 e AL2 representam as conformações fechadas do canal, com uma e duas moléculas de ligante (agonista), respectivamente. AL2 é o receptor na conformação aberta, K1 é a constante de dissociação do ligante e Φ-1, a constante de equilíbrio de abertura do canal. A dessensibilização do receptor é inicialmente rápida (ms) (Hess et al., 1979; Sakmann et al., 1980) e, subseqüentemente, lenta (Sakmann et al., 1980; Walker et al., 1981). IL1e IL2 representam as formas dessensibilizadas do receptor com uma e duas moléculas de ligante, respectivamente; K2 é a constante de dissociação pertinente a essa forma. As demais constantes (k’s) são constantes cinéticas para a interconversção entre as formas A e I.
Os nAChRs são inibidos por uma variedade de substâncias químicas, por exemplo, toxinas naturais, anestésicos locais, drogas de abuso (como a cocaína), compostos clinicamente importantes (tranqüilizantes) e íons metálicos. Os mecanismos de inibição do nAChR têm sido amplamente investigados e existem evidências para mais de um sítio inibitório. Os mecanismos propostos se baseiam principalmente em medidas eletrofisiológicas e nos efeitos de tais inibidores sobre o tempo de vida da conformação aberta do canal determinado através da técnica de single-channel current-recording (Grewer e Hess, 1999).
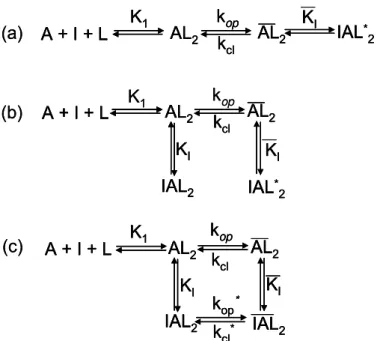
Vários mecanismos de inibição têm sido propostos para o nAChR. No mais simples deles, o inibidor interage com a forma aberta do canal e o bloqueia (Figura 1.6a). Uma variação desse mecanismo inclui a conversão de uma forma aberta do canal ligada ao inibidor para uma forma fechada bloqueada (Figura 1.6b).
entendimento dos mecanismos das reações mediadas pelo receptor. É possível que o receptor tenha sítios alostéricos atuantes tanto na conformação fechada quanto na aberta? Compostos poderiam se ligar a sítios alostéricos na conformação aberta do canal sem bloqueá-lo? O receptor é inibido quando um composto se liga com maior afinidade a um sítio alostérico na conformação aberta do que na fechada (Figura 1.6c)? É possível que um composto, que se liga com afinidade maior pela forma aberta do canal do que pela fechada, desloque inibidores sem inibir o receptor? Em outras palavras, tais compostos poderiam proteger o receptor contra a inibição por outros? (Hess et al., 2000).
Figura 1.6. Mecanismos de inibição propostos para o nAChR. O receptor A se liga ao neurotransmissor L (ou a qualquer outro agonista). A ligação de pelo menos duas moléculas do ligante ao receptor é necessária para a abertura do canal. A, AL e AL2 representam as conformações fechadas
do canal. AL2 representa a conformação aberta do canal que permite que cátions inorgânicos
atravessem a membrana celular e iniciem um sinal elétrico e a comunicação intercelular. K1 é a
constante de dissociação para o ligante L. kop e kcl são as constantes cinéticas de abertura e fechamento
do canal, respectivamente; -1 (= kop/ kcl) é a constante de equilíbrio de abertura do canal. As reações
mostradas ocorrem na região de tempo de microssegundos a milissegundos. (a) Mecanismo de inibição em que o composto se liga à forma aberta do canal e o bloqueia. (b) Mecanismo de inibição por bloqueio extendido. O inibidor se liga às formas aberta e fechada do canal, favorecendo as conformações não-condutoras do receptor IAL2 e IAL2*. KI e KI são as constantes de dissociação do
inibidor das formas fechada e aberta do canal, respectivamente. (c) Mecanismo de inibição cíclica, envolvendo um complexo do inibidor com a forma aberta do canal em que não há bloqueio do mesmo, ou seja, ainda há condução de íons. O mecanismo proposto baseia-se em informações obtidas por técnicas de cinética química rápida. A reação de dessensibilização do receptor e a ligação do inibidor à forma livre do receptor não são mostradas. O princípio da reversibilidade microscópica requer que KI / KI = -1/ I-1, em que I-1= kop*/kcl*. Portanto, compostos que se ligam a um sítio regulatório com
maior afinidade para a forma fechada do canal do que para a aberta deslocará o equilíbrio para a conformação fechada, inibindo o receptor. Compostos que se ligam com afinidade igual ou maior para a forma aberta do que para a forma fechada deslocam os inibidores dos sítios regulatórios sem inibir a atividade do receptor.
O terceiro mecanismo de inibição, o mecanismo de inibição cíclica, é particularmente importante porque sugere a descoberta de compostos que se ligam ao sítio inibitório do receptor sem induzir a subseqüente mudança conformacional que leva à forma inativa do mesmo. De fato, já foram descobertas moléculas de RNA que deslocam a cocaína de seu sítio de ligação no nAChR, mas não inibem a função do receptor. Em outras palavras, tais
A + I + L AL2 AL2 IAL*
2
K1 kop
kcl KI kop K1 IAL* 2 IAL2
A + I + L AL2 AL2
kcl KI KI
IAL2 K1
A + I + L AL2 AL2
kcl
KI KI
IAL2 kop
kop*
kcl* (a)
(b)
(c)
A + I + L AL2 AL2 IAL*
2
K1 kop
kcl
KI
A + I + L AL2 AL2 IAL*
2
K1 kop
kcl KI kop K1 IAL* 2 IAL2
A + I + L AL2 AL2
kcl KI KI IAL* 2 IAL2
A + I + L AL2 AL2
kcl KI KI
IAL2 K1
A + I + L AL2 AL2
kcl
KI KI
IAL2 kop
kop*
kcl* IAL2 K1
A + I + L AL2 AL2
kcl
KI KI
IAL2 kop
kop*
kcl* (a)
(b)
moléculas protegem o receptor contra a inibição pela cocaína, restabelecendo sua atividade (Hess et al., 2000).
Aqui nós selecionamos outra substância, a tacrina, um agente utilizado clinicamente no tratamento de indivíduos com doença de Alzheimer (DA) (Munoz-Ruiz et al., 2005) para estudar seus mecanismos de interação com um subtipo específico dos nAChRs neuronais, o
α3 4. Embora vários sistemas neuronais estejam afetados na DA, é de consenso geral que o número de neurônios colinérgicos bem como de nAChRs estão diminuídos nessa doença, resultando em uma grande redução da atividade colinérgica em regiões cruciais como neocórtex, hipocampo e vários núcleos talâmicos (Gotti e Clementi, 2004; Court et al., 2001). O comprometimento dessas regiões se reflete nos sinais clínicos da doença. Por exemplo, o déficit de memória está relacionado às lesões no hipocampo, enquanto aquelas nas regiões neocorticais resultam em dificuldades de memória e, também, de atenção (Kandel et al, 2000). O uso da tacrina no tratamento da doença de Alzheimer se baseia no fato de que tal composto inibe de forma reversível e não-competitiva a enzima acetilcolinesterase (AChE), responsável pela degradação da ACh em acetato e colina, na fenda sináptica, o que resultaria em um aumento na atividade colinégica central (Marquis, 1990).
O nAChR α3 4 é o principal subtipo encontrado nos gânglios do sistema nervoso autônomo (SNA); nAChRs contendo a subunidade α3 estão presentes em alta densidade no gânglio cervical superior, glândulas pineal e adrenais. Também foram descritos na substancia nigra, striatum, hipocampo, locus ceruleus, tracto habênulo-interpeduncular e cerebelo (Court et al., 2000).
arterial observada durante a analgesia (Tassonyi et al., 2002). Ao mesmo tempo, a inibição do nAChR α3 4 reduz os sinais da síndrome de abstinência provocada pela retirada de morfina e parece ser uma alternativa no tratamento da dependência de opióides (Taraschenko et al., 2005).
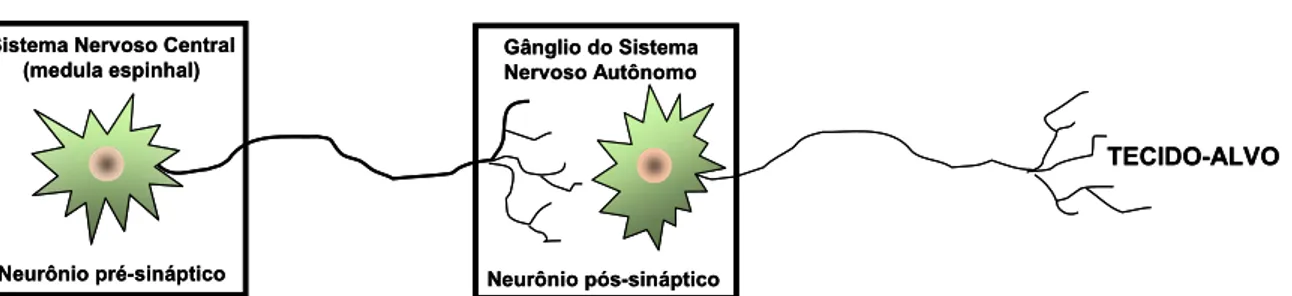
Figura 1.7. Controle da liberação de catecolaminas pelo nAChR α3β4. O corpo celular do neurônio
pré-sináptico localiza-se em um núcleo dentro do sistema nervoso central, mais especificamente, na medula espinhal. O corpo do neurônio pós-sináptico encontra-se em um gânglio perifericamente localizado, onde faz sinapse com a fibra pré-ganglionar. Após estimulação, o neurônio pré-ganglionar libera na fenda sináptica ACh. Esta se difunde até ao neurônio pós-ganglionar, onde se acopla ao nAChR α3 4, disparando um potencial de ação e, em última instância, a liberação de catecolaminas
(norepinefrina e epinefrina). A interação entre essas catecolaminas e seus receptores no tecido-alvo desencadeia uma resposta específica, como vasoconstrição periférica e aumento da pressão arterial. Se, por outro lado, o nAChR α3 4 for inibido por compostos tais como anestésicos e tacrina, a resposta
final é bloqueada e o efeito contrário é observado (vasodilatação periférica e hipotenção arterial).
1.2. Método de Whole-cell patch-clamp e de cell-flow
O método de voltage-clamp é uma das técnicas mais poderosas disponíveis para estudar os aspectos funcionais de canais iônicos. Foi desenvolvida por Kenneth Cole em 1949 e utilizada, na década de 50, por Alan Hodgkin e Andrew Huxley em uma série de experimentos, cujo objetivo era revelar os mecanismos do potencial de ação (Kandel et al., 2000).
O método é assim chamado, porque permite ao experimentador controlar ou fixar (to clamp, em inglês) o potencial ou voltagem de membrana em níveis predeterminados. Através de um microeletrodo colocado dentro da célula, o potencial de membrana (Vm) é medido (1) e eletronicamente comparado com aquele a ser mantido (comando de voltagem) (2). Quando qualquer variação no potencial de membrana é detectada (pela abertura de canais iônicos controlados por ligantes ou por voltagem), um amplificador, por feedback negativo, e com um
TECIDO-ALVO Sistema Nervoso Central
(medula espinhal)
Gânglio do Sistema Nervoso Autônomo
Neurônio pré-sináptico Neurônio pós-sináptico
TECIDO-ALVO Sistema Nervoso Central
(medula espinhal)
Gânglio do Sistema Nervoso Autônomo
segundo eletrodo, rapidamente injeta corrente oposta (3) para manter a voltagem de membrana no valor inicialmente fixado. A magnitude da corrente injetada necessária para manter o potencial de membrana constante é igual, mas oposta em sinal, à corrente de membrana e, portanto, uma medida acurada da mesma (4) (Figura 1.8) (Kandel et al., 2000).
Figura 1.8. Técnica de Voltage-clamp. Dois microeletrodos são colocados dentro da célula. Um eletrodo monitora o potencial de membrana (Vm) e o outro passa corrente através da membrana para
fixar Vm em um valor predeterminado (comando de voltagem). (Cole, 1968).
Embora o método de voltage-clamp tradicional (que emprega dois eletrodos intracelulares) ainda seja amplamente utilizado, sua aplicação se restringe a células, cujas dimensões permitem a introdução de dois eletrodos, ou seja, neurônio de lula e oócitos de
Xenopus, basicamente. A versão contemporânea mais comum desse método é a técnica de
patch-clamp, que pode ser aplicada virtualmente a qualquer célula e tem uma resolução alta o suficiente para medir correntes elétricas diminutas que fluem através de um único canal iônico (Hamill et al., 1981). Em termos muito simples, a técnica de patch-clamp é um caso especial de voltage-clamp que emprega apenas um eletrodo intracelular, que deve controlar a voltagem e medir a corrente (Jackson, 1997) (Figura 1.9). Foi utilizada, pela primeira vez, por Neher e
Um eletrodo interno, conectado ao amplificador de voltage-clamp, mede o potencial de membrana (Vm).
O amplificador de
voltage-clampcompara o potencial
de membrana com o potencial desejado (comando).
Quando Vmé diferente do potencial de comando, o amplificador de fixação injeta corrente dentro do axônio através de um segundo eletrodo. Esse arranjo de feedback faz com que o potencial de membrana seja o mesmo que o potencial de comando.
A corrente que flui para o axônio e, portanto, através da membrana, pode ser medida aqui. Medida de
corrente.
Amplificador de
voltage-clamp.
Comando de voltagem.
Medida de Vm.
Eletrodo de referência.
Eletrodo para injeção de corrente.
Solução salina.
Axônio.
Sakmann para resolver correntes através de nAChRs de membrana de músculo esquelético de rã (Neher e Sakmann, 1976).
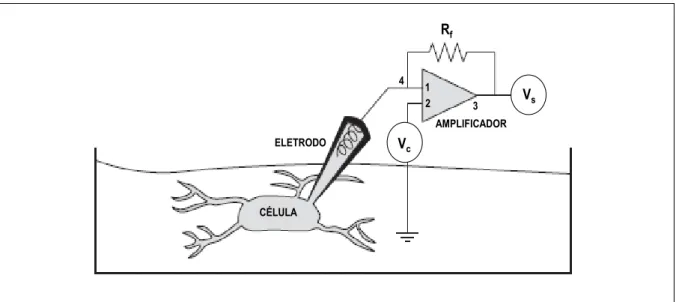
Figura 1.9. Técnica de patch-clamp. Os pontos 1 e 2 são sempre mantidos em um mesmo potencial elétrico. Na presença de uma diferença de potencial, a corrente flui através da membrana e, chegando ao ponto 4, faz com que o potencial no ponto 1 tenda a ficar diferente do potencial no ponto 2 (Vc é a
voltagem na qual a membrana deve ser mantida). Portanto, para manter esses dois pontos no mesmo potencial, o amplificador deve injetar uma corrente pelo ponto 3, que coloque ou retire cargas do ponto 4. A corrente injetada, que corresponde à corrente de membrana, quando passa pela resistência de feedback (Rf), gera a voltagem de saída (Vs) (Jackson, 1997).
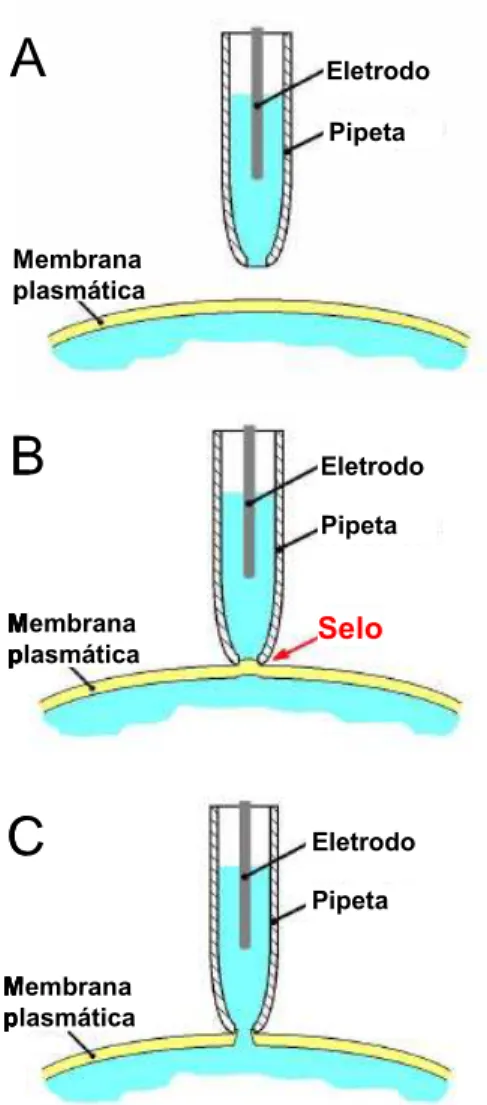
O método de patch-clamp consiste em, a partir de uma minúscula área da membrana celular (patch), fazer gravações de correntes que fluem através da mesma. Uma micropipeta de vidro, preenchida com uma solução eletrolítica adequada e com resistência variando entre 4 e 6 MΩ, é pressionada contra a membrana e se funde com ela , formando um selo (seal) de resistência e estabilidade mecânica extremamente altas. Refere-se a esse selo como sendo um
gigaseal (“gigaselo”; giga= 109). Posteriormente, o patch de membrana é rompido pela sucção com a pipeta ainda vedada à célula, fornecendo acesso ao interior da mesma (isto é, de toda/whole a célula/cell) (Hamill et al., 1981; Hille, 2001). Um selo de alta resistência é necessário por duas razões. Primeiro, quanto maior a resistência do selo, mais completo é o isolamento do patch de membrana em relação à solução externa. Segundo, uma alta
CÉLULA ELETRODO
AMPLIFICADOR Rf
Vs
1
2 3
4
Vc
CÉLULA ELETRODO
AMPLIFICADOR Rf
Vs
1
2 3
4
resistência diminui a corrente que poderia passar entre a pipeta e a membrana. Dessa forma, todos os íons que fluem, quando os canais iônicos se abrem, devem fluir para dentro da pipeta. A corrente elétrica resultante, embora pequena, pode ser medida com um amplificador ultra-sensível conectado à pipeta (veja Figura 1.9) (Neher e Sakmann, 1976). Ressalta-se que a corrente iônica, medida nessas condições, reflete a atividade de uma grande população de canais amostrados de uma célula inteira e, por isso, é denominada de corrente macroscópica. A figura abaixo (Figura 1.10) fornece um esquema dos passos relevantes no método de whole-cell patch-clamp.
Figura 1.10. Passos no Método de Whole-cell patch-clamp. (A) Aproximação da ponta da pipeta à célula. (B) Formação do selo, após aplicar uma pequena pressão negativa ao interior da pipeta. (C) Rompimento do patch de membrana e whole-cell, após uma forte sucção ao interior da pipeta.
A natureza transiente do sinal gerado (uma corrente iônica), quando um canal iônico interage com seu ligante, requer o uso de equipamentos experimentais que forneçam uma resolução temporal adequada para estudar passos relevantes na atividade do receptor. Enquanto a reação química do receptor com seu ligante entra muito rapidamente em equilíbrio e geralmente não é resolvida em estudos cinéticos, os processos de abertura e dessensibilização (passagem do receptor para um estado inativo não-condutor de íons) do canal iônico ocorrem em uma escala de tempo de μs a ms e s, respectivamente, podendo ser analisados para uma correta descrição da função do receptor. Nesse sentido, o sistema de aplicação do ligante desempenha um papel crucial no equipamento, porque deve ser garantido que a função do receptor esteja, de fato, sendo medida. Em outras palavras, a resolução temporal do sistema inteiro de gravação tem que ser maior do que a escala de tempo em que o processo sob investigação ocorre (Breitinger, 2001; Hess, 1993). Por exemplo, se o processo de dessensibilização ocorre na mesma escala de tempo de aplicação do ligante, a corrente medida reflete o comportamento de uma mistura de receptores ativos e inativos e processos rápidos serão perdidos, a menos que uma resolução temporal adequada do equipamento seja conseguida (Breitinger, 2001; Udgaonkar e Hess, 1986). Uma variedade de técnicas para aplicação rápida de ligante tem sido desenvolvida. A seguir, discutimos uma delas, o método de cell-flow, por ser aquela utilizada em nosso trabalho.
importante que, de alguma forma, as correntes medidas sejam corrigidas por causa do processo de dessensibilização que ocorre enquanto os receptores estão entrando em equilíbrio com seu ligante. Um método para isso foi desenvolvido no laboratório de George P. Hess (Udgaonkar e Hess, 1987) e é discutido mais adiante.
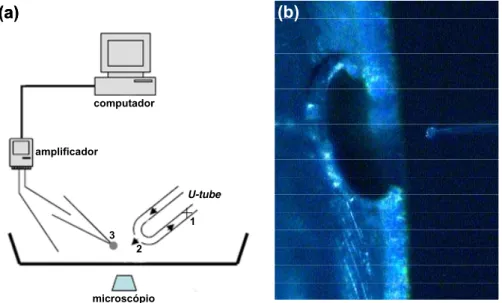
Figura 1.11. Modelo esquemático simplificado do equipamento utilizado no método de whole-cell patch-clamp, com destaque para o sistema de cell-flow e foto. (a)(1) válvula solenóide; (2) abertura do U-tube, cerca de 200 μm de diâmetro; (3) célula suspensa. O ligante é aplicado através da parte superior do tubo e retirado através da parte inferior. Antes do experimento a válvula está aberta e, uma vez que o influxo de ligante pelo U-tube é três vezes menor que sua saída, não ocorrerá liberação antes do determinado pelo equipamento, nem difusão para a solução externa. Para liberação, a válvula é fechada (conforme mostrado no esquema) e um fluxo laminar da solução contendo o ligante é liberado sobre a célula. (b) Foto, mostrando a aproximação da pipeta com a célula em configuração whole-cell
e o orifício do U-tube (aumento de 100X).
1.2.1. Instrumentação
A figura 1.12 é um diagrama esquemático da instrumentação utilizada neste trabalho. A seguir, segue-se uma descrição dos componentes do equipamento, segundo as especificações dos respectivos equipamentos:
i) Mesa anti-vibração (mod. Micro-g 63-561, Technical Manufacturing Corporation (TMC), Peabody, MA-USA): este equipamento garante estabilidade mecânica ao equipamento, impedindo que vibrações externas prejudiquem os registros experimentais. Constitui-se de um suporte metálico que possui quatro amortecedores pneumáticos que filtram o ruído mecânico
computador
amplificador
1 2
3
microscópio
U-tube
computador
amplificador
1 2
3
microscópio
U-tube
(a) (b)
computador
amplificador
1 2
3
microscópio
U-tube
computador
amplificador
1 2
3
microscópio
U-tube
externo. Sobre estes amortecedores, há uma chapa de aço inoxidável, sobre a qual fica o microscópio invertido.
ii) Microscópio invertido (Carl Zeiss Inc., Göttingen-Alemanha-mod. Axiovert 200): permite boa visualização das células e da pipeta ao mesmo tempo e é mecanicamente bastante estável. A ele foi acoplada uma câmera de vídeo digital (Nikon Corp., Tokyo-Japão-mod. DXM 1200F), que gera um sinal de vídeo para um monitor (Japan Victor Company (JVC) Corp., Yokohama-Japão-mod. TM-1700PN).
iii) Gaiola de Faraday: dada a baixa amplitude dos sinais de corrente registrados, é necessário, através de uma gaiola de Faraday, proteger o equipamento, mais especificamente, o pré-amplificador, contra interferências eletromagnéticas. O equipamento constitui-se de uma caixa de chapa fina de cobre com pequenos furos para ventilação.
iv) Micromanipulador (mod. Hydraulic Micromanipulator MHW-3, Narishige Co., Ltd., Tokyo-Japão): este equipamento permite movimentos em três eixos, por meio de controle remoto hidráulico. Foi utilizado para posicionar a ponta da pipeta próximo à membrana da célula, na faixa submicrométrica.
v) Computador: neste computador foi instalado o pacote de programas pCLAMP 8 (Axon Instruments Inc.; Foster City, CA-USA) que permite a geração dos sinais de estimulação e aquisição, armazenamento e processamento dos sinais medidos nas células.
vi) Conversor A/D e D/A (mod. Digidata 1322A, Axon Instruments Inc., Foster City, CA-USA): este instrumento consiste de conversores de sinais analógico/digital (A/D) e digital/analógico (D/A). O sinal é gerado no programa Clampex (que faz parte do pacote
computador. O Digidata 1322A pode adquirir à taxa de até 500 kHz, possui 32 canais de entrada A/D, 2 canais de saída D/A, 8 entradas digitais e 8 saídas digitais.
vii) pCLAMP 8®: O pCLAMP 8 (versão 8.1, Axon Instruments Inc., Foster City, CA-USA) é um pacote de programas para serem utilizados em experimentos eletrofisiológicos. Os programas utilizados neste trabalho foram:
Clampex: permite o controle de parâmetros experimentais, tais como a voltagem (fixação de voltagem) e a corrente (fixação de corrente), e da aquisição de sinais.
Clampfit: permite a análise e cálculos de parâmetros a partir dos sinais obtidos experimentalmente.
viii) Amplificador de patch-clamp (mod. 200B, Axon Instruments Inc., Foster City, CA-USA): foi utilizado para amplificar e filtrar os sinais adquiridos. É composto por dois módulos: um pré-amplificador (Headstage), e o amplificador propriamente dito, que permite a amplificação do sinal de saída de 0,5, 1, 2, 5, 10, 50, 100 e 500 vezes. Além disso, este equipamento dispõe de controladores para compensação de capacitância e resistência, e de seleção do ganho e do modo de operação (fixação de voltagem ou de corrente).
Figura 1.12. Diagrama esquemático da instrumentação. (1) câmera de vídeo digital; (2) mini-gaiola de Faraday e pré-amplificador/Headstage (dentro desta). No nosso equipamento, toda a aparelhagem apoiada na mesa anti-vibração está envolvida pela gaiola de Faraday; (3) microscópio invertido; (4) micromanipulador; (5) mesa anti-vibração; (6) monitor de vídeo; (7) osciloscópio digital; (8) amplificador de patch-clamp (Axopatch 200B); (9) trigger box; (10) conversor A/D D/A (Digidata 1322A); (11) computador. Setas tracejadas: Um sinal de comando (do tipo digital), para fechamento da válvula solenóide (não mostrada aqui), é gerado no computador e convertido para o tipo analógico pelo Digidata. Esse sinal, através do trigger box, chega à válvula que, então, se fecha. Um fluxo laminar de solução contendo o ligante é liberado sobre a célula. Com isso, canais operados por esse ligante se abrem e um sinal de corrente é gerado. Setas contínuas: Esse sinal de corrente é coletado e amplificado pelo Headstage e Axopatch 200B, respectivamente, e digitalizado pelo Digidata, para, então, ser enviado ao computador, que o armazenará para posterior análise.
1
2
3 4
5
6
7
8
9
10
11 1
2
3 4
5
6
7
8
9
10
11 1
2
3 4
5
6
7
8
9
10
2. Objetivos
Os objetivos do trabalho foram:
¾ Investigar e caracterizar, sob o enfoque cinético, a atividade farmacológica da tacrina sobre os nAChRs neuronais do subtipo α3 4. Em outras palavras, buscar respostas para as seguintes perguntas: -Qual é o tipo de atividade que a tacrina exerce sobre receptores nicotínicos? É um agonista, um modulador alostérico ou um antagonista? Se for um antagonista, é competitivo ou não-competitivo? Para responder a essas questões, lançamos mãos dos modelos cinéticos discutidos anteriormente.
CAPÍTULO 3. MATERIAIS E
3. Materiais e métodos 3.1. Células
A linhagem celular KXα3 4R2 foi gentilmente cedida pelo Professor Yingxian Xiao, da Escola de Medicina da Universidade de Georgetown, EUA, tendo sido bem caracterizada pelo mesmo. As células HEK 293 (human embryonic kidney) foram transfectadas com o vetor pcDNA3 contendo os fragmentos gênicos que codificam as subunidades α3 e 4 do nAChR de rato (Xiao et al., 1998). Abaixo é mostrada uma foto das células KXα3 4R2, utilizadas nesse trabalho para investigação dos nAChRs neuronais (Figura 3.1).
Figura 3.1. Foto das células KXα3β4R2. As células são mostradas nos aumentos de 100x (a) e 200x (b).
3.2. Cultura de células
As células KXα3 4R2 expressando o subtipo α3 4 dos nAChRs de rato cresceram no DMEM (Invitrogen), suplementado com 10% de soro fetal bovino (Cultilab, Campinas, Brasil), na presença de estreptomicina (100 μg/mL), penicilina (100 UI/mL) e 0,7 mg/mL de geneticina (Sigma) a 37 oC em uma atmosfera saturada com água contendo 5% de CO2. As culturas de células foram subcultivadas semanalmente, semeadas a 5 x 105 células/cultura em frascos e alimentadas três vezes durante esse período, substituindo o meio velho. Para os experimentos de patch-clamp, 2 x 104 células foram plaqueadas em placas de cultura de células de 35 mm. As medidas foram feitas utilizando as soluções intracelular e extracelular
(b)
(a)
(b)
especificadas a seguir, em pH 7,4, temperatura ambiente e em uma voltagem transmembrânica de -70 mV (Trujillo et al, 2006).
3.3. Soluções
•Solução-estoque de geneticina (Sigma): geneticina 70mg/mL.
•Solução-estoque de nicotina (Sigma): nicotina 100 mM.
•Solução-estoque de tacrina (Sigma): tacrina 100 mM.
•Solução-estoque de (+)-dizocilpina (MK-801) (Tocris): MK-801 100 mM.
•Solução intracelular: contendo (mM) KCl 140, MgCl2 2, CaCl2 1, EGTA 11, HEPES/KOH 25 (pH 7.4) (Krivoshein e Hess, 2004);
•Solução extracelular: contendo (mM) NaCl 145, KCl 3, MgCl2 2, glicose 10, HEPES/NaOH 25 (pH 7.4)(Krivoshein e Hess, 2004).
Os reagentes cujos fornecedores não foram especificados, foram comprados da USBiological.
3.4. Pipetas
3.5. Medidas de corrente iônica através do método de whole-cell patch-clamp
Para os experimentos de whole-cell current recording, as células KXα3 4R2 foram plaqueadas em uma densidade de 20-100 células/mm2 em placas de cultura de células de 35 mm. Os registros de corrente foram feitos em temperatura ambiente, em uma voltagem transmembrânica de -70 mV e pH 7,4. A solução na pipeta de gravação continha (em mM) KCl 140, MgCl2 2, CaCl2 1, EGTA 11, HEPES/KOH 25, pH 7,4. A solução de banho (extracelular) continha (em mM) NaCl 145, KCl 3, MgCl2 2, glicose 10, HEPES/NaOH 25, pH 7,4. As pipetas foram preparadas conforme colocado anteriormente. As medidas de corrente foram amplificadas utilizando um amplificador Axopatch 200B (Axon Instruments) e filtradas em 2 kHz através de um filtro Bessel passa-baixo de 40 pólos no amplificador. Os sinais filtrados foram digitalizados usando um Digidata 1322A e gravados pelo programa pCLAMP (Axon Instruments).
3.6. Aplicação rápida das soluções de ligante
ligante, bombeada para dentro do U-tube, fluía rapidamente sobre a célula, envolvendo-a, apenas durante o tempo de duração das medidas, isto é, 10-20 milissegundos. A válvula era então aberta novamente, resultando na redução da concentração do ligante na superfície da célula para zero dentro de 5-10 milissegundos. Dessa forma, soluções contendo nicotina, tacrina e/ou MK-801 foram aplicadas à célula em um fluxo laminar. As soluções de nicotina e tacrina ou MK-801 foram misturadas antes da coaplicação com nicotina.
Nos nossos experimentos, a taxa de fluxo das soluções, que emergiam do dispositivo de fluxo, contendo o ligante com ou sem inibidor, foi ajustada para ~ 1cm/s. As medidas de corrente foram realizadas em intervalos de 5 minutos, tempo suficiente para garantir que os receptores se ressensibilizassem completamente. A resolução temporal do método (10-50 ms) permite fazer medidas antes da maior dessensibilização dos receptores e determinar as propriedades que são relevantes para abertura e fechamento dos mesmos (Udgaonkar e Hess, 1987; Ulrich e Gameiro, 2001).
As gravações de whole-cell current recording de cinética rápida foram efetuadas, utilizando um amplificador Axopatch 200B (Axon Instruments, Foster City, CA). Os sinais foram obtidos através do programa pCLAMP (Axon Instruments) e os dados, analisados, usando o programa Microcal Origin (Northampton, MA) (Trujillo et al., 2006).
3.7. Análise dos dados
Esquema I.
A representa a forma ativa, não-dessensibilizada do receptor e L, o agonista. O número 2 sob-escrito indica o número de moléculas do agonista ligadas. AL2 é a forma aberta do canal e I denota o receptor inativo, dessensibilizado. K1 é a constante de dissociação do sítio do receptor que controla a abertura do mesmo e K2, a constante de dissociação do agonista do receptor dessensibilizado. k’s são as constantes cinéticas que descrevem o processo de dessensibilização do receptor e , a constante de equilíbrio de fechamento do canal.
A corrente iônica observada nos experimentos é uma medida da concentração de canais na forma aberta e foi corrigida por causa do processo de dessensibilização que ocorre enquanto o agonista se equilibra com os receptores na superfície da célula. Tal correção foi feita de acordo com a equação (eq. I)
IA= (eαΔT – 1) (Iobs)Δti + (Iobs)Δtn,
Em que IA representa a corrente máxima corrigida; α, a constante cinética de dessensibilização do receptor; (Iobs)Δti, a corrente observada durante o i-ésimo intervalo de tempo e (Iobs)Δtn, a corrente observada em um intervalo de tempo igual ou maior que aquele necessário para a corrente atingir seu valor máximo.
Curva dose-resposta. Para a indução de correntes iônicas pela nicotina, foram plotadas duas curvas dose-resposta. Os valores de EC50 (concentração efetiva de agonista que produz metade de sua resposta máxima) e nH foram calculados por regressão não-linear (usando a equação de Hill) e analisados pelo programa GhaphPad Prism (San Diego, California, USA). A determinação do valor de K1 foi feita segundo a equação (eq. II)
Σ
n i=1Σ
n i=1A
AL
AL
2AL
2IL
IL
2K1 K
1
φ
k12 k 21
K2
k34 k43
A
AL
AL
2AL
2IL
IL
2K1 K
1
φ
k12 k 21
K2
1 1
2
1 Φ+
⎥⎦ ⎤ ⎢⎣ ⎡ + = L K I I máx A
Imáx representa a corrente máxima obtida de uma célula quando todos os canais estão abertos; K1 é a constante de dissociação do agonista; L é a concentração do agonista; -1 é a constante de equilíbrio de abertura do canal e IA, os valores de corrente obtidos experimentalmente e corrigidos por causa da dessensibilização. Essa equação (eq. II) pode ser linearizada para (eq. III) 2 / 1 2 / 1 2 / 1 1 1⎟⎟ =Φ + Φ
⎠ ⎞ ⎜⎜ ⎝ ⎛ + L K I I A máx
Ensaios de inibição. No esquema 2, I representa o inibidor competitivo e I’, o inibidor não-competitivo. KI e KI’ representam as constantes de dissociação dos inibidores competitivo e não-competitivo, respectivamente. No mecanismo utilizado para os estudos de inibição, assumimos que existe apenas uma constante de dissociação para o inibidor não-competitivo, ou seja, ele se liga aos seus sítios, nas diferentes conformações do canal, com a mesma afinidade.
Esquema 2.
Curva dose-resposta na presença de um inibidor competitivo.
1 1
1
2
1 Φ+
⎥ ⎦ ⎤ ⎢ ⎣ ⎡ + ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + = I máx A K I L K I I KI’
AI
2AI
ALI
A
AL
AL
2AL
2I’A
I’AL
I’AL
2I’AL
2KI KI
KI K1 K1 K1 K1 KI’
KI’ K
I’
φ
K1 KI’AI
2AI
ALI
A
AL
AL
2AL
2I’A
I’AL
I’AL
2I’AL
2KI KI
KI K1 K1 K1 K1 KI’
KI’ K
I’
φ
AI
2AI
ALI
A
AL
AL
2AL
2I’A
I’AL
I’AL
2I’AL
2KI KI
KI K1 K1 K1 K1 KI’
KI’ K
I’
φ
I é a concentração do inibidor e KI, sua constante de inibição. As outras constante já foram definidas anteriormente. Essa equação pode ser linearizada, desde que a concentração de inibidor seja mantida constante e variem-se as concentrações (L) do agonista. A equação (eq. IV) assim obtida é dada abaixo:
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + Φ + Φ = ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + I A máx K I L K I I 1 1 1/2 1 1/2
2 / 1
Quando a concentração do agonista é mantida constante e variam-se as concentrações do inibidor, a equação IV pode ser rearranjada (eq. V) para estudar como as medidas de corrente variam em função da concentração do inibidor:
2 / 1 1 2 / 1 2 / 1 1 1
1 ⎟+ Φ
⎠ ⎞ ⎜ ⎝ ⎛ + Φ = ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + L K IK L K I I I A máx
A constante de inibição KI descreve a afinidade do inibidor pelo receptor e também pode ser estimada usando a relação (eq. VI)
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + = 50 50 1 EC L IC
KI ,
assumindo que inibidor e agonista se ligam ao mesmo sítio no receptor (Trujillo et al., 2006). Para isso, foi feito um gráfico de Hill a fim de determinar o valor de IC50.
Inibição não-competitiva (eq. VII)
Z L K I I A máx ⎟ ⎠ ⎞ ⎜ ⎝
⎛Φ + Φ
= ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛
− 1/2 1 1/2
2 / 1
1
em que
(
)(
)
2 1 1 AL I F K I
Z = − , quando o inibidor não-competitivo se liga a todas as formas
do receptor e Z = I KI +1, quando o inibidor não-competitivo se liga apenas à conformação fechada do canal.
2
AL
Inibição não-competitiva geral (eq. VIII) I I A A K I I
I = +
1
) (
I representa a concentração do onibidor não-competitivo e KI, a constante de inibição. IA e IA(I) são as medidas de corrente corrigidas em uma dada concentração de agonista (nicotina), na ausência e na presença do inibidor I, respectivamente.
Inibição competitiva (eq. IX)
⎥ ⎦ ⎤ ⎢ ⎣ ⎡ + + + = I A AL A I I A A K I F F F K I I I ) 2 ( 1 ) (
I representa a concentração do inibidor e KI, sua constante de inibição. FA e FAL são as frações de moléculas de receptor não-ligadas e ligadas a apenas uma molécula de agonista (nicotina), no equilíbrio, respectivamente:
1 1 2 1 2 1 + Φ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + Φ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = L K L K FA 1 1 2 2 1 1 + Φ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + Φ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = L K L K FAL
É digno de nota que, quando o termo FA
(
I KI)
<< (2FA+FAL), ou seja, em baixas concentrações de inibidor, a equação para inibidores competitivos se reduz àquela para inibidores não-competitivos.4.1. Dedução das Equações do Modelo Matemático para Cinética do Receptor a) Equação pertinente à dessensibilização do receptor
Conforme já mencionado, alguns receptores se dessensibilizam em um intervalo de tempo menor que aquele necessário para se equilibrarem com o agonista. Ou em outras palavras, o processo de dessensibilização ocorre mais rapidamente que o equilíbrio entre o agonista e os receptores. Conseqüentemente, o sinal de corrente observado (Iobs) não reflete a verdadeira quantidade de receptores que se tornaram ativos durante o equilíbrio e, por isso, tende a ser menor. Uma vez que estamos interessados em um valor de corrente que reflita a atividade de tal quantidade de canais, faz-se necessário corrigir o valor obtido experimentalmente.
Nos nossos experimentos, o decaimento da corrente induzida pelo agonista em função do tempo (Iobs(t)) é exponencial e descrito por uma única constante cinética de dessensibilização,
α:
Iobs(t) = IAe-αt,
em que Iobs(t) representa a corrente observada após determinado intervalo de tempo (nesse caso, o intervalo de tempo necessário para que a corrente atingisse seu valor máximo, ou seja, para que os receptores se equilibrassem com o agonista) e IA representa o valor de corrente inicial, isto é, sem dessensibilização dos receptores.
valor da corrente obtida. Para o primeiro intervalo de tempo (Δt1), a equação anterior pode ser rearranjada para
IA(Δt1) = Iobs(Δt1)eαΔt.
Para o segundo intervalo de tempo, Δt2, a corrente corrigida é dada por IA(Δt2) = Iobs(Δt2) eαΔt + IA(Δt1) – Iobs(Δt1).
Após n intervalos de tempo constantes, durante cada um dos quais, a Iobs é medida, a corrente corrigida é dada por
IA(tn) = (eαΔT – 1) (Iobs)Δti + (Iobs)Δtn,
em que (Iobs)Δti é a corrente observada durante o i-ésimo intervalo de tempo. IA(tn) se torna igual a IA quando o valor de tn é igual ou maior do que o tempo necessário para a corrente atingir seu valor máximo.
b) Fração de receptores na forma aberta
Considerando que cada receptor contenha dois sítios de ligação agonistas idênticos (caracterizados por uma única constante de dissociação - K1), que ambos os sítios precisam ser ocupados para que o canal se abra e que a concentração de neurotransmissor (ligante) é muito maior que a concentração desses sítios agonistas, a interação entre ambos pode ser representada pela seguinte equação de equilíbrio químico:
A + L ' AL + L ' AL2 ' AL2
em que A representa o receptor; L, o ligante; AL e AL2, formas fechadas intermediárias do receptor ocupadas por uma ou duas moléculas do ligante, respectivamente; AL2, a forma aberta do receptor; e φ, a constante de equilíbrio de fechamento dos canais .
A fração de receptores na forma aberta, (AL2)o será dada por: (AL2)o = AL2 / (A + AL + AL2 + AL2). Eq. i.
K1 K1 φ
Σ
i = 1Da equação de equilíbrio química dada acima, concluímos que: K1=[A][L]/[AL][AL]=[A][L]/K1, K1=[AL][L]/[AL2][AL]=K1[AL2]/[L] e
φ=[AL2]/[AL2][AL2]=[AL2]/ φ. A equação de equilíbrio químico ainda pode ser escrita como:
A+2L'AL2' AL2 ou A+L'AL+L'AL2,
de onde concluímos que:
K12=[A][L]2/[AL2][A]=K12[AL2]/[L]2 e K1φ=[AL][L]/[AL2]. Colocando todos os termos da equação i em função de [AL2], temos:
(AL2)o=([AL2]/φ)/(K12[AL2]/[L]2+2K1[AL2]/[L]+[AL2]+[AL2]/φ)= =[AL2]/φ)/(K12φ[AL2]+2K1[L]φ[AL2]+[L]2φ[AL2]+[L]2[AL2])/[L]2φ=
=([AL2]/φ)([L]2φ/[AL2](K12φ+2K1[L]φ+[L]2φ+[L]2)= =[L]2/{[L]2(1+φ)+2K1[L]φ+K12φ}
(AL2)o=[L]2{[L]2(1+φ)+2K1[L]φ+K12φ}-1. Eq. ii. c) Curva dose-resposta (gráfico não-linear)
Dada a equação
IA=IMRM(AL2)o, Eq. iii.
em que IA representa a corrente total; IM, a corrente produzida por 1 mol de canais abertos; e RM, a quantidade total de moléculas de receptores. Substitutindo a equação ii na equação iii, temos:
IA=IMRM[L]2{[L]2(1+φ)+2K1[L]φ+K12φ}-1. Quando (AL2)o=1, IA=IMRM=Imáx. Assim:
IA=Imáx[L]2{[L]2(1+φ)+2K1[L]φ+K12φ}-1=Imáx[L]2/{[L]2+[L]2φ+2K1[L]φ+K12φ}.
Multiplicando tanto o numerador quanto o denominador da equação pelo inverso
de [L]2, temos que
IA=Imáx/(1+φ+2K1φ/[L]+K12φ/[L]2)=Imáx/φ(1+2K1/[L]+K12/[L]2)+1 IA=Imáx/(K1/[L]+1)2φ+1. Eq. II.
d) Curva dose-resposta (gráfico linear) Linearizando a equação IV, temos:
(K1/[L]+1)2φ+1=Imáx/IA (Imáx/IA-1)1/2={(K1/[L]+1)2φ}1/2 (Imáx/IA-1)1/2=K1φ1/2/[L]+φ1/2. Eq. III. e) Curva dose-resposta na presença de um inibidor competitivo
Considerando a seguinte equação de equilíbrio químico, na presença de um inibidor competitivo
em que KI é a constante de dissociação de um inibidor competitivo (os demais termos já foram definidos anteriormente), a fração de receptores na forma aberta e na presença de um inibidor competitivo será dada por
(AL2)o = AL2 / (A + AL + AL2 + AI + AI2 + ALI+ AL2). Eq. iv. De acordo com a equação de equilíbrio químico dada acima, concluímos que
KI=[A][I]/[AI]→[AI]=[A][I]/KI→[AI]=[I]K12[AL2]/KI[L]2 KI=[AI][I]/[AI2]→[AI2]=[AI][I]/KI→[AI2]=[I]2K12[AL2]/KI2[L]2
A + L AL + L AL2 AL2
+ I
AI +
I
AI2
+ I
ALI + L
K1 K1
K1
KI K
I
KI
A + L AL + L AL2 AL2
+ I
AI +
I
AI2
+ I
ALI + L
K1 K1
K1
KI K
I
KI=[AL][I]/[ALI]→[ALI]=[AL][I]/KI→[ALI]=[I]K1[AL2]/KI[L]. Colocando todos os termos da equação iv em função de [AL2], temos:
(AL2)o=([AL2]/φ)/
(K12[AL2]/[L]2+2K1[AL2]/[L]+[AL2]+2[I]K12[AL2]/KI[L]2+[I]2K12[AL2]/KI2[L]2+ 2[I]K1[AL2]/KI[L]+ [AL2]/φ)=
=([AL2]/φ)/
{([AL2])((K12φKI2+2K1[L]φKI2+[L]2φKI2+2[I]K12φKI+[I]2K12φ+2[I]K1[L]φKI+[L]2KI2)/ [L]2φKI2)}.
(AL2)o=([L]2KI2)/
{[L]2KI2(1+φ)+K12φKI2+2K1[L]φKI2+2[I]K12φKI+[I]2K12φ+2[I]K1[L]φKI}. Eq. v. Substituindo a equação v na equação iii e considerando (AL2)o=1, temos:
IA=Imáx[L]2KI2/{[L]2KI2(1+φ)+K12φKI2+2K1[L]φKI2+2[I]K12φKI+[I]2K12φ+2[I]K1[L]φKI}. Multiplicando tanto o numerador quanto a denominador da equação pelo inverso de [L]2KI2 e colocando φ em evidência, temos que
IA=Imáx/{(K12/[L]2+2[I]K12/KI[L]2+2K1/[L]+[I]2K12/KI2[L]2+2[I]K1/KI[L]+1)φ}+1. O denominador da equação anterior (parte entre parênteses) é um produto notável da forma (a + b + c)2= a2 + 2ab + 2ac + b2 + 2bc + c2 e poder ser fatorado como
IA=Imáx/{(K1/[L]+[I]K1/KI[L]+1)2φ}+1. Fatorando ainda o denominador, chegamos a
IA=Imáx/[(K1/[L])(1+[I]/KI)+1]2φ+1. Eq. vi. Linearizando a equação vi,
ou
(Imáx/IA-1)1/2=φ1/2(1+K1/[L])+ [I]K1φ1/2/KI[L] Eq. V.
As equações IV e V representam duas formas diferentes de rearranjo da equação vi. A primeira serve para analisar como os valores de corrente variam em função da concentração do agonista, em uma concentração constante de inibidor. A segunda serve para verificar como os sinais de corrente mudam em função da concentração do inibidor, em uma concentração constante de agonista.
4.2. Ensaios de atividade
Figura 4.1. Efeito da nicotina sobre os nAChRs α3β4 expressos nas células KXα3β4R2. Medida da
corrente iônica induzida por 1 mM de nicotina. A medida foi realizada em pH 7,4, temperatura ambiente e Vm= -70 mV, utilizando o método de cell-flow e uma velocidade de fluxo da solução de
nicotina de ~1 cm/s para rápido equilíbrio dos receptores com o ligante. A corrente observada (linha preta) é uma medida do número de receptores na forma aberta na membrana celular e atinge um valor máximo. A fase de decaimento da corrente, indicativa da dessensibilização do receptor, revela dois processos: 98% da corrente decai com um coeficiente cinético de 9,47 s-1 e, 2%, com um coeficiente cinético de 0,08 s-1. Nenhuma corrente permanece após a completa dessensibilização do receptor. A linha vermelha, que se torna paralela ao eixo do tempo, representa a corrente corrigida por causa da dessensibilização que ocorre durante o intervalo de tempo necessário para a corrente atingir seu valor máximo, isto é, enquanto a nicotina se equilibra com os receptores na superfície da célula.
As células KXα3 4R2, que responderam à aplicação de nicotina 300 μM com indução de corrente, foram submetidas a pulsos de aplicação de tacrina nas concentrações de 100 pM, 1 nM, 10 nM, 100 nM, 1 μM, 100 μM e 1mM. Nenhuma corrente iônica foi observada com a aplicação de tacrina, demonstrando que essa droga por si só não é agonista do nAChR α3β4 (Figura 4.2).
Tempo (ms)
Co
rr
e
nt
e (p
A
)
Tempo (ms)
Co
rr
e
nt
e (p
A
Figura 4.2. Efeito da tacrina sobre os nAchRs α3β4 expressos nas células KXα3β4R2. A tacrina
sozinha não ativa o nAChR α3 4, ou seja, não é agonista desse receptor, como demonstrado pela
resposta da célula à nicotina 300 μM. As medidas de corrente foram feitas nas mesmas condições mencionadas anteriormente. Uma mesma célula foi submetida a pulsos de aplicação de tacrina nas concentrações de 1 μM (b), 10 μM (c), 100 μM (d) e 1 mM (e). Nenhuma corrente iônica foi detectada. Quando esta célula foi submetida a aplicação de nicotina 300 μM (a), um sinal de corrente foi gerado, indicando que a tacrina por si só não é agonista do nAChR α3 4. (f) representa um sinal de
corrente obtido com a aplicação de nicotina 300 μM, após a aplicação de tacrina nas referidas concentrações, indicando que a célula não morreu, nem estava dessensibilizada.
O tratamento das células KXα3 4R2 expressando o nAChR α3β4 com solução externa contendo o agonista nicotina resultou em correntes iônicas, cujas amplitudes dependiam da concentração de nicotina (Figura 4.3).
C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
(a) (b) (c) (d) (e) C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
(a) (b) (c) (d) (e) Tempo (ms) C o rren te ( p A ) (f) C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
(a) (b) (c) (d) (e) C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
(a) (b) (c) (d) (e) Tempo (ms) C o rren te ( p A ) C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
(a) (b) (c) (d) (e) C o rre n te (pA ) Co rr e n te (pA ) C o rre n te (pA ) Co rr en te (pA ) C o rren te (pA )
Tempo (ms) Tempo (ms) Tempo (ms)
Tempo (ms) Tempo (ms)
Figura 4.3. Concentração de canais abertos (nAChRs α3β4 nas célulasKXα3β4R2) em função da concentração de nicotina. As medidas representam dados coletados de uma mesma célula e foram realizadas em pH 7,4, temperatura ambiente e Vm= -70 mV, utilizando o método de cell-flow e uma
velocidade de fluxo da solução de nicotina de ~1 cm/s para rápido equilíbrio dos receptores com o ligante. Ao passo que a concentração de nicotina aumenta, ocorrem incrementos nos valores de corrente detectados. A partir da concentração de nicotina de 300 μM (concentração de nicotina para a qual a resposta é máxima), considerando o erro estatístico, o valor de corrente permanece praticamente constante.
constante de equilíbrio de abertura do canal e Imáx é a corrente máxima que pode ser obtida de uma célula quando todos os canais estão abertos.
Figura 4.4. Curvas dose-resposta para a nicotina obtidas a partir de medidas de corrente feitas nas células KXα3β4R2. (a) Medidas de corrente em função da concentração de nicotina. As medidas foram feitas em pH 7,4, temperatura ambiente, Vm= -70 mV e normalizadas para aquela obtida com
nicotina 300 μM. Foram feitas de 3-9 medidas em cada concentração de nicotina a partir de 10 células. O coeficiente de Hill foi 0,99 ± 0,18. O valor de EC50 determinado foi de 22 ± 4 μM (R2 = 0,99). (b)
Avaliação do experimento de cell-flow com diferentes concentrações de nicotina, utilizando a forma linear da equação II. Um gráfico linear forneceu uma inclinação de 11,03 ± 2,89 e um intercepto de 0,48 ± 0,14, com valores de 22,96 ± 0,21 μM e 4,33 ± 1,28 para K1 e -1, respectivamente.
Inibição do nAChR α3β4 pela tacrina. Conforme já mencionado, a tacrina sozinha não
ativa os nAChRs α3β4 nas células KXα3 4R2 como demonstrado por sua resposta à nicotina 300 μM. Ela, contudo, inibe correntes mediadas pela nicotina quando coaplicada com a mesma.
As células receberam pulsos de aplicação de nicotina 300 μM sozinha, seguidos da coaplicação da mesma com tacrina em diversas concentrações, e novamente foram submetidas à aplicação de nicotina 300 μM. A coaplicação diminuiu a corrente iônica ou até mesmo não resultou em nenhuma corrente iônica detectável, havendo recuperação da resposta, quando as células receberam nicotina sozinha novamente. Isso sugere que a tacrina inibe a atividade do receptor nicotínico, devendo os mecanismos de inibição ser investigados. A figura 4.5 mostra algumas medidas representativas da inibição do nAChR α3β4 pela tacrina.
(a) (b)
(a) (b)
-1
(a) (b)
(a) (b)
Figura 4.5. Medidas representativas da inibição do nAChR α3β4 nas células KXα3β4R2 pela tacrina. As medidas foram realizadas em pH 7,4, temperatura ambiente, Vm= -70 mV e em uma
mesma célula. (a) Resposta à nicotina 300 μM apenas. (b), (c) e (d). Respostas a coaplicação de nicotina 300 μM e tacrina nas concentrações de 1 μM, 10 μM e 100 μM, respectivamente. Observe que, quanto maior a concentração de tacrina, maior é a inibição de correntes induzidas por nicotina. A partir de 100 μM de tacrina, a inibição é completa. O sinal de corrente em (e) corresponde à recuperação da resposta com nicotina 300 μM, após a inibição pela tacrina nas referidas concentrações.
O gráfico de Hill para a tacrina é mostrado na figura 4.6a. O valor de IC50 para a inibição do nAChR α3 4 pela tacrina foi 13 ± 4 μM (R2 = 0,99) com um coeficiente de Hill de 1,85 ±
0,97. O valor de KI, calculado a partir de IC50 (equação VI), foi de 0,95 ± 0,41 μM.
A fim de investigar os mecanismos pelos quais a tacrina inibe os nAChRs α3β4 expressos nas células KXα3 4R2, medidas de correntes iônicas em uma concentração constante de nicotina (300 μM) e várias concentrações de tacrina foram realizadas e os dados, plotados em formas linear (para um inibidor competitivo) e não-linear (para um inibidor não-competitivo). O gráfico linear se aplicou melhor aos dados (R2=0,97 e uma inclinação de 0,048 ± 0,004), indicando um mecanismo de inibição competitiva. A constante de equilíbrio de abertura do canal (φ-1) foi de 17,5 ± 0,5, como calculada a partir do intercepto. Utilizando os valores de K1 e φ1/2 obtidos para nicotina apenas, o valor de KI (constante de inibição) para tacrina em uma concentração de nicotina de 300 μM, calculado a partir da inclinação da linha, foi de 0,77 ±
(a) (b) Cor ren te ( p A ) C o rr e n te ( p A )
Tempo (ms) Tempo (ms)
Cor ren te ( p A ) C o rr e n te ( p A ) C o rr e n te (p A ) C o rr e n te (p A )
Tempo (ms) Tempo (ms)
Tempo (ms)
(a) (b) (c)
(d) Tempo (ms) (e) C o rr e n te (p A ) Tempo (ms) (a) (b) Cor ren te ( p A ) C o rr e n te ( p A )
Tempo (ms) Tempo (ms)
Cor ren te ( p A ) C o rr e n te ( p A ) C o rr e n te (p A ) C o rr e n te (p A )
Tempo (ms) Tempo (ms)
Tempo (ms)
(a) (b) (c)
0,01 μM. Em contraste, para um inibidor não-competitivo, espera-se que um gráfico de (Imáx/IA-1)1/2 em função da concentração de inibidor seja não-linear. A simulação de um gráfico não-linear resultou em um R2 de0,27 (Figura 4.6b).
Figura 4.6. Inibição dos receptores nAChRs α3β4 pela tacrina. As medidas de corrente iônica foram
realizadas nas mesmas condições descritas anteriormente e em uma concentração constante de nicotina de 300 μM. (a) Valores de corrente obtidos com a aplicação de nicotina 300 μM em função da concentração de tacrina. As medidas de corrente foram normalizadas para aquela obtida com nicotina 300 μM e foram plotadas em valores percentuais. O coeficiente de Hill foi de 1,85 ± 0,97. O valor de IC50 foi 13 ± 4 μM (R2 = 0,99). (b) O gráfico foi plotado de acordo com a equação (Imáx/IA -
1)1/2=IK1φ1/2/KIL + φ1/2 (1 + K1/L), em que I é a concentração de tacrina; K1, a constante de dissociação
da nicotina; φ, a constante de equilíbrio de fechamento do canal; KI a constante de inibição da tacrina e
L, a concentracão de nicotina. O gráfico descrito por essa equação será linear para um inibidor competitivo e não-linear para um inibidor não-competitivo. Os dados obtidos experimentalmente seguem melhor um comportamento linear (R2 = 0,97 e inclinação de 0,048 ± 0,004 μM-1, KI igual a
0,77 ±0,01), indicando um mecanismo de inibição competitiva. A simulação de um gráfico não-linear forneceu um valor de R2 de 0,27.
Com o objetivo de confirmar o mecanismo pelo qual a tacrina inibe o nAChR α3 4 nas células KXα3 4R2, foram feitas medidas das taxas das correntes corrigidas obtidas na ausência (IA) e na presença do referido inibidor (IA(T)) ( equação VIII). Os resultados foram comparados com aqueles obtidos na presença do composto MK-801 (IA(MK)), reconhecidamente um inibidor não-competitivo dos nAChRs (Grewer e Hess, 1999). Uma relação linear existe entre IA/IA(I) e a concentração de um inibidor não-competitivo em uma ampla faixa de concentrações (ver figura 4.7c). No caso de um inibidor competitivo, entretanto, um gráfico de IA/IA(I) em função da concentração do inibidor é linear apenas em baixas concentrações do inibidor, quando o termo FA(I/KI) é pequeno comparado ao valor de de 2FA +
(a) (b)
(a) (b)