A CONCENTRAÇÃO DO LACTATO SANGÜÍNEO COMO PREDITOR DO NÚMERO DE LEUCÓCITOS CIRCULANTES EM RATOS WISTAR
Tese apresentada ao Programa de Pós-graduação Strictu Sensu em Educação Física da Universidade Católica de Brasília, como requisito para obtenção do Título de Mestre em Educação Física. Orientador: Prof. Dr. Cláudio Olavo de Almeida Córdova
CAETANO, Juliana Naves Neves
A concentração do lactato sangüíneo como preditor do número de leucócitos circulantes em ratos wistar/ Juliana Naves Neves Caetano. 2008.
65p.
Tese (Mestrado) Universidade Católica de Brasília, 2008. Orientador: Prof. Dr. Cláudio Olavo de Almeida Córdova
1. Exercício físico. 2. Leucócitos. 3. Lactato. I Córdova, Cláudio Olavo de Almeida, orient. II A concentração do lactato sangüíneo como preditor do número de leucócitos circulantes em ratos wistar.
Tese de autoria de Juliana Naves Neves Caetano, intitulada “A concentração do lactato sangüíneo como preditor do número de leucócitos circulantes em ratos wistar”, requisito parcial para obtenção do grau de Mestre em Educação Física, defendida e aprovada em 14.12.2007, pela banca examinadora constituída por:
_______________________________________ Prof. Dr. Cláudio Olavo de Almeida Córdova
Orientador
_______________________________________ Prof. Dr. Otávio de Toledo Nóbrega
_______________________________________ Prof. Dr. Francisco José Andriotti Prada
Agradeço:
À Deus, por me possibilitar a companhia de pessoas maravilhosas ao longo da vida: meu pai, minha mãe e irmãs. Ao meu orientador Dr. Cláudio Olavo Córdova pela confiança depositada, pelas ligações atendidas, dúvidas esclarecidas e obstáculos vencidos juntos.
Aos alunos da iniciação científica e ao Elias, indispensáveis ao desenvolvimento da pesquisa. Grandes amigos com os quais vivi momentos inesquecíveis.
A amiga e colega Juliana Carvalho, presente em todas as horas e que por este motivo compartilho com ela esta vitória. À Universidade Católica de Brasília por possibilitar as muitas horas de laboratório, biblioteca e aulas. Centro de excelência em pesquisa.
Aos funcionários da Secretaria do Mestrado em Educação Física, especialmente, Weslen, Cida e Sabrina. Sempre cordiais e prestativos.
Aos professores do programa, que foram além do conhecimento ministrado, sendo muitas vezes amigos. Aos professores da banca, que partilharam valiosos ensinamentos nos momentos finais deste trabalho. Ao professor Ricardo Jacó pela atenção, disponibilidade e por não me deixar esquecer alguns prazos...
Aos colegas do mestrado com os quais muito aprendi e dividi expectativas, frustrações, mas, sobretudo, alegrias.
“... Bom mesmo é ir à luta com determinação,
abraçar a vida e viver com paixão,
perder com classe e vencer com ousadia,
por que o mundo pertence a quem se atreve.
A vida é muito para ser insignificante.”
RESUMO
A concentração do lactato sangüíneo é apontada como um fator responsável pelos resultados divergentes no número celular após exercício. As dúvidas sobre as respostas imunitárias frente ao exercício ainda são muitas e identificar se existe alguma relação entre o lactato e a leucocitose é uma delas. Portanto, elaborou-se um delineamento experimental. Quatro grupos de ratos Wistar foram submetidos a diferentes intensidades de exercício de natação. Nossos resultados sugerem uma relação polinomial cúbica entre o número de leucócitos circulantes e a concentração do lactato sanguíneo (R2= 0,91). Linfócitos apresentaram distribuição similar a leucócitos. Monócitos (R2= 0,46) e neutrófilos (R2= 0,81) exibiram dados com comportamento contrário a concentração de lactato sanguíneo. Em conclusão os resultados sugerem que a concentração de lactato sanguíneo é um preditor do número de leucócitos circulantes em ratos Wistar.
ABSTRACT
The concentration of blood lactate is pointed as a factor responsible for divergent results in cellular number after exercising. The doubts about the immunity response in presence of exercising are still many and to identify if there is a relation between lactate and leukocytosis is one of them. Therefore, an experimental delineation was elaborated. Four groups of Wistar rats were submitted to different intensity of swimming exercises. Our results suggest a cubical polynomial relation between the number of circulating leukocytes and the concentration of sanguine lactate (R2=0,91). Lymphocytes presented a distribution similar to leukocytes. Monocytes (R2= 0,46) and neutrophils (R2= 0,81) had shown data with opposite behavior to concentration of blood lactate. In conclusion, the results suggest that the concentration of blood lactate is a predictor of the number of circulating leukocytes in Wistar rats.
LISTA DE FIGURAS
LISTA DE TABELAS
SUMÁRIO
1INTRODUÇÃO ...12
2OBJETIVO ...13
3JUSTIFICATIVA E RELEVÂNCIA ...14
4REVISÃO BIBLIOGRÁFICA ...15
4.1 Leucócitos e exercício ...15
4.2 Contagem diferencial de leucócitos no exercício...17
4.2.1 Neutrófilos...17
4.2.2 Monócitos...18
4.2.3 Células “Natural-Killer” ...18
4.3 Leucócitos no período de recuperação do exercício ...18
4.4 A leucocitose tardia...19
4.5 Exercício agudo e imunidade inata...21
4.5.1 Neutrófilos...21
4.5.2 Monócitos e macrófagos ...25
4.5.3 Células “Natural-Killer” ...26
4.6 Alterações na imunidade inata ...27
4.7 Intensidade do exercício e imunidade ...27
4.8 Exercício agudo e imunidade adquirida...28
4.9 Exercício agudo e linfócitos ...29
4.10 Número de células T e exercício ...30
4.11 Células B e exercício ...31
4.12 Respostas metabólicas ao exercício ...34
4.13 A energia celular ...35
4.14 Sistema glicolítico de formação de ATP...36
4.15 A formação do ácido lático...37
5MATERIAL E MÉTODO ...39
5.1 Animais...39
5.2 Adaptação dos animais ...39
5.3 Exercício físico ...40
5.4 Coleta do sangue...40
5.5 Dosagem do lactato sangüíneo ...41
5.6 Contagem de leucócitos ...41
5.6.1 Leucograma global...41
5.6.2 Leucograma diferencial...42
5.7 Análise estatística...42
6RESULTADOS...43
7DISCUSSÃO ...49
8CONCLUSÕES ...52
1 INTRODUÇÃO
Em 1893 foi publicado o primeiro trabalho relatando alterações em células sangüíneas após exercício físico (Nehlsen-Cannarella, Nieman, Jessen, 1991). Porém, o estudo da relação entre o exercício e a resposta imunitária teve impulso a partir da década de 70. Atualmente, o exercício aeróbio é apontado como forma não medicamentosa para reverter ou até mesmo restaurar funções imunitárias (Leandro, Nascimento, Castro, Duarte, Castro, 2002; Silva, Hashimoto,1999).
A duração e a intensidade do exercício são determinantes na resposta proliferativa de leucócitos (Oliveira, Rogatto, Luciano, 2002). Entretanto, ainda não é consenso qual o protocolo de exercício físico (intensidade, duração, freqüência e tipo) é o mais apropriado para a verificação de efeitos benéficos sobre a resposta imune (Leandro, Nascimento, Castro, Duarte, Castro, 2002). Outro aspecto é o momento da contagem leucócitos, momentos diferentes induzem a resultados diferentes pela alteração nas concentrações hormonais sangüíneas durante e após o exercício (Pedersen, Hoffman-Goetz, 2000). A concentração de lactato sangüíneo normalmente é utilizada como parâmetro fisiológico para a delimitação dos domínios da intensidade do exercício em modelo animal (Gobatto, Mello, Sibuya, Azevedo, Santos, Kokubun, 2001; Voltarelli, Gobatto, Mello, 2002).
2 OBJETIVO
Uma das formas de modular a resposta do sistema imunitário é através do exercício físico. Sessões agudas de exercício ou aqueles realizados cronicamente (treinamento) podem em decorrência da intensidade, duração, freqüência e do tipo de atividade, alterar diversas funções do sistema imunitário. Assim sendo, o objetivo deste estudo será:
1. Investigar a relação entre a concentração de lactato sanguíneo com o número global e diferencial de leucócitos em ratos, após sessão de natação, em diferentes intensidades do exercício.
3 JUSTIFICATIVA E RELEVÂNCIA
O estudo das alterações fisiológicas e a identificação de estratégias que minimizam ou revertem alterações negativas no sistema imunitário, principal responsável pela defesa do organismo contra doenças infecciosas, será de grande importância. Dentre as alterações encontradas quando o organismo é acometido por doenças, observamos a supressão do sistema imunitário que pode gerar aumento da morbidade e mortalidade em seres humanos, por uma maior incidência de infecções, doenças auto-imunes e câncer.
As células do sistema imunitário sofrem alterações na sua função com a prática do exercício físico (Costa Rosa, 2002). O exercício aeróbio atua como imunomodulador da resposta imunitária podendo recuperar algumas de suas funções comprometidas (Leandro, 2002). Os leucócitos possuem importantes funções na resposta imune inata e adaptativa, devido principalmente, a sua grande capacidade de adaptação a diferentes condições metabólicas. O estudo de estratégias que atenuem os efeitos nocivos sobre eles refletirá na condição física e saúde das pessoas.
4 REVISÃO BIBLIOGRÁFICA
O sistema imunitário é dividido em dois grandes ramos: o sistema inato e o adaptativo. O sistema inato caracteriza-se por responder aos estímulos de maneira não específica; é composto por neutrófilos eosinófilos, basófilos, monócitos, células natural killer e por fatores solúveis (sistema complemento, proteínas de fase aguda e enzimas). O sistema imune adaptativo caracteriza-se por responder ao antígeno de modo específico, apresentando memória; é composto pelos linfócitos T e B e por fatores humorais, as imunoglobulinas.
Apesar de o exercício ser genericamente classificado como um estímulo estressante torna-se mais adequado dividir a resposta ao exercício em dois componentes: resposta aguda e a adaptação crônica. A resposta aguda é a reação transitória ao estresse, são as alterações temporárias da resposta imunitária, causadas por uma única sessão de exercício. O estímulo crônico gera a resposta de adaptação crônica ao exercício, que torna o organismo hábil na tolerância ao estresse (Nehlsen, 1991).
4.1 Leucócitos e exercício
O comportamento dos leucócitos depende da intensidade, duração e do tipo de exercício. Gabriel (1992) observou um aumento significativo no número de leucócitos imediatamente após 1 minuto de exercício supra-máximo. Quando o exercício é muito intenso a exaustão pode ocorrer antes de ser atingido o pico da leucocitose (Miles et al, 2003). Allsop (1992) relatou o pico da leucocitose de 5 a 10 minutos após exercício supra-máximo. Em período curto de exercício (menos de 1 hora), a leucocitose é dependente principalmente da intensidade do exercício e não da sua duração (Gimenez et al 1986; McCartthy, Dale 1988). No exercício exaustivo curto geralmente conta-se um número dobrado de leucócitos (Bieger et al 1980; Field et al 1991). Durante o exercício submáximo de 45 minutos a principal mobilização de leucócitos ocorre após 15 minutos, com mudanças não significativas nos últimos 30 minutos (Gimenez et al 1986).
Nieman et al 1998; Robson et al 1999; Suzuki et al 2003). O maior aumento na circulação de leucócitos ocorre durante exercício de resistência prolongado e de 2 a 4 horas depois de exercício curto intenso, pela liberação de neutrófilos da medula óssea, algumas vezes chamada de “leucocitose atrasada”. Este termo é enganoso quando considerado o exercício prolongado. Entretanto, em exercícios prolongados a leucocitose atrasada irá ocorrer sobreposta à leucocitose inicial, com o pico ocorrendo aproximadamente 3 horas após o início do exercício. A leucocitose atrasada é quase exclusivamente o aumento na contagem de neutrófilos na circulação (Chinda et al 2003, McCarthy, Dale 1988, Suzuki et al 2003). Resumindo, a leucocitose que aparece imediatamente após curto período de exercício (menor que 1 hora) é devida principalmente ao aumento no número de neutrófilos e linfócitos circulantes. Embora o exercício prolongado (acima de 1 hora) inicialmente induza a similar neutrofilia e linfocitose, a leucocitose observada no final é exclusivamente devida a neutrofilia.
Exercício de alta intensidade (37 ± 19 minutos a 80% VO2 máx) produz um
aumento inicial da contagem de neutrófilos e linfócitos. Durante a recuperação imediata desse período há uma rápida remarginação de leucócitos pela queda da potência cardíaca. Durante o exercício ocorre a demarginação dos leucócitos aderidos nas paredes dos vasos para o sangue pelo aumento da potência cardíaca, aumento nos níveis de estresse e aumento nos níveis de catecolaminas (Robson, 1999). O principal aspecto no exercício que causa a demarginação de leucócitos é o aumento do débito cardíaco, por maior força mecânica ( Bieger, 1980; Foster, 1986). O estresse nas estruturas dos capilares promove a marginação de leucócitos nos pulmões e músculos esqueléticos, o aumento do fluxo sangüíneo nestes locais promove a abertura de vasos inativos ou fechados, que por sua vez, libertam sua reserva de leucócitos em sua circulação interior (Gleeson, Pyne, 2000). O grau dessa marginação celular dentro dos pulmões é desconhecido, mas monócitos e neutrófilos parecem ser substanciais na marginação pulmonar (Downey, Worthen, 1988). A grande marginação de leucócitos pulmonar pode ser a conseqüência dos seus tipos pequenos de capilares e a baixa pressão sangüínea pulmonar e, portanto, menor estresse quando comparado com a circulação sistêmica (Downey, Worthen, 1988).
aumenta o fluxo linfático contribuindo para o aumento de linfócitos na circulação provenientes da linfa, através do ducto torácico para dentro da veia subclávia esquerda na circulação sistêmica. A leucocitose produzida por infusão de adrenalina mostrou ser dependente do baço, medula óssea e circulação linfática em ratos (Iversen, 1994). Fatores hemodinâmicos são os principais responsáveis pela marginação de leucócitos durante o exercício, o aumento da concentração de catecolamina plasmática durante o exercício (Galbo, 1983) também é uma importante influência (Field, 1991). A leucocitose pode ser produzida pelo aumento da concentração de adrenalina (Iversen, 1994; Kappel, 1991; Tonnesen, 1987; Tvede, 1994), que aumentará a marginação via redução da aderência dos leucócitos no endotélio vascular (Boxer, 1980). Isto pode ser causado por uma auto-regulação de aderência da molécula na superfície de leucócitos e/ou células endoteliais. Existem relatos de que o exercício pode auto-regular a expressão de certas moléculas de adesão contribuindo para a marginação de leucócitos no exercício (Kurokawa, 1995; Nielsen & Lyberg, 2004). Assim, a alteração na molécula de adesão na superfície celular pode justificar a mobilização de subpopulações de leucócitos para a circulação induzidas pelo exercício. As razões da leucocitose no exercício estão ainda pouco claras. Isto tem sido associado com as respostas fisiológicas de fuga e luta, na intenção de preparar rapidamente o organismo para o perigo (McCarthy, Dale, 1988).
4.2 Contagem diferencial de leucócitos no exercício
4.2.1 Neutrófilos
produz a neutrofilia com maior porcentagem de segmentados maduros (Fehr, Grossman, 1979).
4.2.2 Monócitos
O exercício exaustivo produz um aumento de aproximadamente 90% (Bierger, 1980; Field, 1991) no número de monócitos circulantes. Alguns autores relataram que a monocitose induzida pelo exercício parece ser independente da intensidade deste exercício (Gabriel, 1992a).
4.2.3 Células “Natural-Killer”
Muitos trabalhos têm mostrado que o exercício produz significativo aumento das células NK na circulação (Gabriel, 1992b; Hoffman-Goetz, 1990; Nieman, 1994). A população destas células aumenta em 55% no período de 1 hora para exercícios com o consumo de 65% VO2 máx (Hoffman-Goetz, 1990) e aumentos consideráveis
no seu número, na porcentagem de 480%, tem sido mostrado por trabalhos com exercício exaustivo (Gabriel, 1991). A intensidade do exercício parece influenciar a mobilização de células NK (Gabriel, 1991; Nieman, 1994) e a infusão de catecolamina aumenta o número de células circulantes (Kappel, 1991; Nagao, 2000; Tvede, 1994). O exercício induz ao aumento nos níveis de catecolaminas na circulação podendo produzir alterações nas moléculas de adesão das células NK, produzindo mobilização dessas células para a circulação (Nagao, 2000; Robert et al, 2004).
4.3 Leucócitos no período de recuperação do exercício
período de recuperação do exercício de alta intensidade (Gabriel, 1992) é principalmente pela queda dos linfócitos, afinal, o pico dos granulócitos ocorre 15 minutos após o exercício. A razão de a leucocitose acontecer durante a recuperação do exercício intenso ainda deve ser pesquisada, mas McCarthy sugere a ação das catecolaminas ou outro fator relacionado ao estresse causado pelo exercício, como por exemplo, o lactato. Os níveis plasmáticos do lactato continuam a aumentar nos primeiros minutos após exercício intenso, assim como a leucocitose. Porém, ocorre queda nos níveis de lactato e no número de leucócitos na recuperação de exercício menos intenso (MacCarthy, 1992). Dados laboratoriais indicam falhas na aderência dos leucócitos com o aumento das concentrações de lactato in vitro (Blannin, 1995).
Mudanças no número de leucócitos após exercício prolongado pode acontecer devido a leucocitose tardia. Entretanto, quando a atividade é extremamente longa, o número de células pode se recuperar antes do término do exercício (Galun, 1987). A recuperação do número de leucócitos circulantes logo após o exercício é rápida, aproximadamente 20 minutos, depois ocorre um declínio lento que pode durar várias horas (MacCarthy, Dale, 1988). A primeira e rápida queda na circulação destas células ocorre pela rápida remarginação dos leucócitos pela queda nos níveis das catecolaminas e a segunda e mais lenta queda é justificada pelo reflexo de reajuste gradual do número de células no compartimento vascular (MacCarthy, Dale, 1988).
A marginação de leucócitos no exercício não é ao acaso, ela é composta geralmente de células maduras (Fehr, Grossman, 1979). Um possível sítio de marginação no período de exercício é o baço e sugere-se que o tempo maior de trânsito dentro do baço mostra para uma re-infusão de granulócitos, que pode contribuir para o maior tempo que esse tipo celular leva para equilibrar-se em comparação com os eritrócitos (Allsop, 1992) e pode também explicar porque o número de granulócitos continua a aumentar durante a recuperação do exercício muito intenso (Allsop, 1992; Gabriel, 1992).
4.4 A leucocitose tardia
uma neutrofilia poucas horas após (Fehr & Grossman, 1979; Tonnesen, 1987). A neutrofilia é predominantemente uma conseqüência do aumento da liberação de neutrófilos pela medula óssea (Allsop, 1992). Porém, alguns pesquisadores têm relatado que a causa principal da neutrofilia é a marginação celular (Nakagawa, 1998). O aumento da concentração do cortisol plasmático após um curto período de exercício é influenciado pela intensidade do exercício. Intensidades acima de 60% do VO2 máx aumentam os níveis de cortisol, enquanto exercício abaixo de 50% do
VO2 máx reduz as concentrações deste hormônio, melhorando sua eliminação e
suprimindo sua secreção. Entretanto, trabalhos sugerem que exercícios curtos não elevariam as concentrações do cortisol no plasma, a menos que, a intensidade deste exercício seja acima de 60-70% do VO2 máx (Gabriel, 1992). Não é novidade,
portanto, que para o exercício curto a intensidade e a duração sejam as maiores influências da leucocitose atrasada.
Eskola et al (1978) relatou o maior aumento na concentração do cortisol durante uma maratona. Isto porque, exercícios prolongados causam uma elevação na secreção do cortisol, assim a gliconeogênese é aumentada para a manutenção das concentrações de glicose sangüínea. Sobre a iniciação do exercício, sugere-se um tempo de atraso de 10 minutos para se observar o aumento na concentração do cortisol (MacCarthy, Dale, 1988). Embora o cortisol tenha seus níveis aumentados durante o exercício, o pico pode não ser alcançado até o final do exercício (Galbo, 1983). Esse atraso na secreção do cortisol e o tempo de atraso entre a elevação do cortisol e a liberação de neutrófilos são responsáveis pela leucocitose bifásica, observada em exercícios curtos. Assim, a finalização do exercício conduz a uma rápida marginação de leucócitos, como resultado tardio pela mobilização destas células da medula óssea. Como as novas células são liberadas pela medula, que detém 100 vezes mais neutrófilos que o sangue, isto causa uma alteração na circulação de neurófilos, devido à imaturidade da nova liberação celular (Nakagawa, 1998; Suzuki, 2003).
linfocitopenia é “intensidade-dependente” e aparece várias horas após o término do exercício intenso. A monocitose atrasada tem sido também observada 1,5 a 2 horas após 1 hora de exercício a 75% do VO2 máx (Pedersen, 1990). Esse atraso no
aumento do número de monócitos pode influenciar na função das células natural-killer.
Em resumo, exercício extenuante com duração de 1 hora produz uma leucocitose constituída principalmente de neutrófilos e linfócitos, com o pico da neutrofilia entre 2 e 3 horas após o exercício. Em exercícios mais prolongados esses eventos se sobrepõem. O mecanismo de uma leucocitose precoce é constituído primeiramente de leucócitos aderidos no endotélio para os vasos, enquanto a leucocitose tardia é causada pela elevação do cortisol no plasma, que mobiliza neutrófilos da medula óssea.
4.5 Exercício agudo e imunidade inata
A integridade imunitária depende dentre outros fatores, do número de células imunocompetentes e também das capacidades funcionais destas células.
4.5.1 Neutrófilos
Neutrófilos constituem 50-60% dos leucócitos circulantes no sangue e têm um importante papel na defesa não-específica contra uma grande variedade de microorganismos patogênicos. Realizam fagocitose, seguido de um ataque enzimático e digestão em vacúolo intracelular, utilizando enzimas hidrolíticas e espécies oxigênio-reativas (Bishop et al 2003). Desordens no funcionamento de neutrófilos e a neutropenia estão associados com infecções recorrentes e tem sido sugerido que o fraco ou reduzido funcionamento dos neutrófilos pode ser um importante fator de contribuição para o aumento de infecções em atletas (Pyne, 1994; Peake, 2002).
não é afetada pelo exercício agudo moderado (Ortega, 1993) ou intenso (Lewicki, 1987), embora Lewicki (1987) tenha observado uma diminuição dessa função durante exercício agudo em indivíduos treinados. A aderência dos neutrófilos em repouso foi relatada como sendo menor (Lewicki, 1987) ou inalterada (Ortega, 1993) em indivíduos treinados quando comparados com o controle. A quimiotaxia dos neurófilos pode ser aumentada pelo exercício agudo moderado (Ortega, 1993) ou inalterada por período de exercício exaustivo (Rodrigues et al 1991), ser maior (Ortega, 1993) ou indiferente (Hack, 1992) em indivíduos treinados versus não-treinados.
Para melhorar a eficiência de seu arsenal, neutrófilos geralmente englobam o patógeno, processo conhecido por fagocitose, pela extensão de pseudópodos de seu citoplasma. A fusão desses braços citoplasmáticos resulta em aprisionamento do microorganismo ao alcance do vacúolo intracelular, onde o neutrófilo pode iniciar seu ataque. A habilidade de englobar material estranho tem sido usada para avaliar a função do neutrófilo in vitro. Estudos observaram que a atividade fagocítica de neutrófilos é aumentada durante exercício agudo (Hack, 1992; Lewicki, 1987; Ortega, 1993), embora outros trabalhos não tenham reportado esses acontecimentos (Gabriel, 1992; Rodriguez, 1991).
A habilidade fagocítica dos granulócidos, principalmente neutrófilos, tem sido observada por aumentar em resposta a 2,5 horas de exercício a 75% do VO2 máx
(Nieman, 1998). Dados coletados antes e depois de uma maratona mostram uma mudança na atividade fagocítica dos neutrófilos, a capacidade de atração foi aumentada, enquanto a capacidade fagocítica foi reduzida (Chinda, 2003). Isto é consistente com dados laboratoriais que mostram um aumento na porcentagem de neutrófilos que são fagociticamente ativos seguintes ao exercício agudo (Blannin, 1996).O número de neutrófilos e a porcentagem destas células que são fagociticamente ativas é aumentada pelo exercício moderado (Blannin, 1996). Embora, neutrófilos fagociticamente ativos sejam um parâmetro para contribuir com o status imunitário, períodos prolongados de treinamento de resistência levam ao aumento de infecções oportunistas, pela diminuição dessa atividade em repouso (Costa Rosa, 2004).
induzida pelo exercício, afinal elevadas concentrações plasmáticas de elastase (Blannin, 1996) e mieloperoxidase (Suzuki, 2003) têm sido relatadas após vários protocolos de exercício, embora isto pudesse apenas refletir um elevado número de neutrófilos no sangue. Entretanto, neutrófilos imaturos liberados pela medula óssea sob influência do cortisol mostram aumento da degranulação espontânea (Hetherington, Quie, 1995). O exercício induz a degranulação devido a uma resposta inflamatória aguda do músculo e/ou pelo dano tecidual. Camus (1992) descreveu que concentrações plasmáticas de elastase e mieloperoxidase aumentam apenas em exercício com importante componente excêntrico. Dados experimentais não dão suporte à hipótese de que o dano tecidual é um pré-requisito para a degranulação do neutrófilo. Afinal, 30 minutos de bicicleta a 70% do VO2 máx, período improvável
para causar dano muscular, causou aumento da elastase (Blannin, 1996). Exercício agudo eleva significativamente os níveis plasmáticos de elastase (83,1 ± 12,0 comparado com 56,0 ± 9,2 µg/l para o repouso) e essa resposta foi reduzida para o treinameno (Blannin, 1996). A degranulação mensurada através da elastase liberada pelo neutrófilo em resposta a estimulação bacteriana, foi inalterada durante exercício, mas foi significamente suprimida 2,5 horas após o exercício (Blannin, 1996).
Robson (1999) observou diminuição da degranulação de neutrófilos durante exercício agudo prolongado. O treinamento diminuiu a liberação de elastase (por estímulo bacteriano) por volume de sangue no repouso e 2,5 horas pós-exercício em amostras sangüíneas. A redução da degranulação após exercício agudo pode ser pela desensibilização seguinte ao exercício, afinal, neutrófilos podem entrar em período refratário após ativação (Henson, 1981). É improvável que a depleção dos grânulos de neutrófilos, seja a explicação para a redução da degranulação observada, porque período agudo de exercício não parece afetar a quantidade de elastase total de neutrófilos (Bishop, 2003). Entretanto, o exercício agudo leva a degranulação espontânea, mas a habilidade do neutrófilo de degranulação quando é estimulado é diminuída por períodos de exercício agudo.
Outra habilidade dos neutrófilos está no período oxidativo, que tem sido relatado sofrer atenuações pelo exercício agudo (Hack et al 1992; Pyne 1994). Entretanto, Macha (1990) demonstrou que a geração do peróxido de hidrogênio (H2O2) por estimulação dos neutrófilos é diminuída durante exercício agudo. Este
hidrogênio por estimulação de neutrófilos durante exercício agudo. Esta ambigüidade pode ser a conseqüência da intensidade-efeito dependente da função do neutrófilo. Exercício em bicicleta a 50% do VO2 máx e 80% do VO2 máx está
associado com o aumento e a diminuição respectivamente, do período oxidativo de neutrófilos (Dziedziak, 1990). Entretanto, o período respiratório continua a diminuir nas horas seguintes ao exercício intenso, enquanto aumenta durante recuperação de exercício de intensidade moderada (Pyne, 1994). A intensidade de ambos pode ser o fator chave, trabalhos neste sentido mostram que o período de atividade oxidativa dos neutrófilos é significativamente menor durante corrida de maratona (Chinda, 2003; Suzuki, 2003). O mecanismo para esses efeitos pode ser pela ação da adrenalina que diminui o período respiratório dos neutrófilos in vitro (Tintinger 2001). Elevados níveis de interleucina (IL-6) seguinte ao exercício pode ser outro importante fator que regula o período oxidativo (Peakc, 2002), que pode ou não estar relacionado aos diferentes resultados encontrados para exercício de intensidade moderada ou alta.
Estudos mostram um aumento na produção do ânion superóxido 24 horas após exercício agudo (Hack, 1992) e o aumento do período oxidativo durante o exercício é diminuído 1 semana após uma prolongada corrida de resistência (Gabriel, 1994). Os efeitos do exercício agudo na atividade de neutrófilos in nature podem ocorrer em longo prazo. Neutrófilos de indivíduos treinados mostram possuir menor período oxidativo quando comparados com indivíduos não-treinados (Smith, 1990), embora Hack (1992) não tenha observado essa diferença. O efeito combinado do processo de degranulação e o período oxidativo resultam em um ambiente hostil para a destruição de microorganismos. A atividade microbicida é melhorada pelo exercício agudo (Rodriguez, 1991), porém em outros estudos ela permaneceu inalterada (Lewicki, 1987; Ortega, 1993).
ocorre porque a marginalização de neutrófilos parece ser seletiva para células maduras (Fehr, Grossman, 1979). É questionável porque células demarginadas por infusão de adrenalina demostram alguma capacidade funcional. Infusão de hidrocortisona induz desproporcional liberação de neutrófilos imaturos e maduros da medula óssea, produzindo um aumento na proporção de neutrófilos (Hetherington, Quie, 1985). Isto poderia explicar o aumento na porcentagem de neutrófilos imaturos na circulação após exercício intenso (Suzuki, 2003) e pode contribuir para mudanças nas funções dos neutrófilos durante a recuperação.
4.5.2 Monócitos e macrófagos
Monócitos, assim como neutrófilos, também realizam a fagocitose e matam patógenos por mecanismos similares. Ainda, monócitos, macrófagos e células dendrídicas atuam também como células apresentadoras de antígenos. Exercício exaustivo de curto período, insulina e dexametasona reduzem a atividade fagocítica de monócitos (Bieger, 1980). Ao contrário, a capacidade fagocítica dos monócitos parece aumentar após 2,5 horas de exercício a 75% do VO2 máx (Niemann, 1998).
Quanto a sua capacidade oxidativa, parece não ser afetada pelo exercício agudo. Já os macrófagos, sofrem modificações funcionais de acordo com a intensidade do exercício. Exercício agudo moderado melhora a capacidade de aderência, quimiotaxia, fagocitose e atividade microbicida de macrófagos. Ao contrário, exercício agudo exaustivo parece não ter efeito sobre suas funções. As mudanças funcionais em monócitos e macrófagos após exercício agudo ocorrem por ação do cortisol (Forner, 1995).
inflamação possuem fundamental papel na defesa do organismo. Estudo mostrou que após 90 minutos de bicicleta a 65% do VO2 máx, a 34ºC (calor), a expressão de
TLRs 1, 2 e 4 de monócitos foi substancialmente diminuída, com pequena ou nenhuma recuperação 2 horas após o final do exercício (Lancaster, 2005).
4.5.3 Células “Natural-Killer”
A ativação das células NK não requer a combinação antígeno-MHC II. Células NK trabalham na linha de frente na defesa do organismo, antes de uma resposta específica elaborada pelas células B e T. Os efeitos do exercício intenso na função das NK são bifásicos com um aumento inicial resultante de uma supressão atrasada (Kappel, 1991; Pedersen, 1991; Nieman, 1993). Muitos autores demonstram aumento na atividade citolítica das NK ao final do exercício moderado ou intenso (Pedersen, 1988; Roberts, 2004), que pode ser em parte devido ao aumento na população de células NK, produzido pelo exercício (Roberts, 2004). O exercício intenso é apontado como atenuador da atividade citolítica de células NK (Kappel, 1991; McFarlin, 2004; Pedersen, 1991). Um suposto mecanismo para a redução atrasada nas funções de NK é um elevado nível de prostaglandinas liberadas pelo considerável número de monócitos observados 1,5 a 2 horas após exercício intenso. Este efeito não foi observado in vitro, uma vez que os monócitos foram removidos da cultura (Pedersen, 1991). Entretanto, a infusão de adrenalina recria concentrações plasmáticas similares àquelas observadas após 1 hora de exercício a 75% do VO2
máx, também induzindo uma monocitose atrasada, supressão da atividade da NK com 2 horas de atraso e eliminação de monócitos (Kappel, 1991). Isto mostra que a adrenalina pode ser em longo prazo um fator influenciador na imunidade, embora sua vida média plasmática seja curta.
diminuição de sua produção in vitro por linfócitos tem são descritas após exercício intenso (Shephard,1994).
4.6 Alterações na imunidade inata
Os hormônios do estresse adrenalina e cortisol estão envolvidos em inúmeras mudanças na imunidade inata. Estão envolvidos na produção de leucocitose pela demarginação e liberação de células da medula óssea, pela mudança no número de células circulantes. Estas mudanças na população celular podem introduzir na circulação células com diferentes capacidades funcionais. Entretanto, esses hormônios, em especial o cortisol, regulam a função inata celular. Exercício de intensidade moderada, que é frequentemente associado com melhora na função imune celular, aumenta a liberação do cortisol e diminui sua secreção. Ao contrário, exercício intenso e exaustivo deprime a função imune inata celular, associado ao aumento na secreção do cortisol. Estudos in vitro ajudaram a explicar a influência do exercício intenso nas mudanças das funções dos leucócitos, afinal, menores concentrações fisiológicas de cortisol demonstram melhorar suas funções, mas concentrações muito altas desse hormônio estão tipicamente associadas a imunossupressão (Dufaux, Order 1989; Dufaux, 1991).
Inúmeras pesquisas têm descrito um aumento da IL-6 seguinte ao exercício. Relacionam o aumento da IL-6 no músculo exercitado durante prolongado exercício concêntrico em músculos extensores do joelho (Steensberg, 2000). Afinal, a infusão de IL-6 aumenta a concentração do cortisol, da IL-1 e da IL-10 (Steensberg, 2003). No pós-exercício o aumento da IL-6 pode relacionar-se a mudanças imunitárias induzidas pelo exercício, por exemplo, elevados níveis de IL-6 circulante, liberada da contração muscular, durante prolongado exercício tem sido associada na alteração do equilíbrio entre linfócitos T-auxiliar 1 e T-auxiliar 2 seguinte ao exercício (Steensberg, 2003) e a mudanças na função dos neutrófilos (Suzuki, 2003).
4.7 Intensidade do exercício e imunidade
da intensidade. O exercício agudo altera os níveis do cortisol, mas a secreção desse hormônio é influenciada pela intensidade e duração do exercício (Blannin, 1996). Exercício moderado, acima de 50% do VO2 máx reduz as concentrações do cortisol,
melhorando sua eliminação e reprimindo sua secreção, porém, o exercício intenso (acima de 60% do VO2 máx) aumenta os níveis do cortisol (Galbo, 1983). Em
períodos de exercício suficientemente prolongado, de intensidade moderada, ocorre aumento do cortisol pelo aumento da gliconeogênese para a manutenção da concentração da glicose sangüínea.
A intensidade e a duração do exercício contribuem para o estresse metabólico e essa influência pode causar depleção, porque evidências sugerem que o músculo esquelético pode liberar IL-6 quando estimulado (Steensberg, 2000). A IL-6 é conhecida por suas ações imunitárias (Steensberg, 2003), fatores como a intensidade e duração do exercício podem influenciar a demanda metabólica, afetando a função imunitária.
4.8 Exercício agudo e imunidade adquirida
Imunidade adquirida, adaptativa ou específica é aquela responsável para o combate de infecções, prevenção da colonização de patógenos e destruição de microorganismos invasores. Ela é ativada após o fracasso da função inata e iniciada pela apresentação do antígeno (proteínas e outros componentes que induzem a resposta pelo anticorpo) ou antígenos presentes em células de linfócitos T-auxiliar (CD4+). Células CD4+ formam a parte chave da mediação celular na resposta imune, porque elas orquestram e dirigem a resposta subseqüente. Células CD4+ podem ainda ser classificadas em Tipo I e Tipo II de acordo com a citocina que elas produzem e liberam. Células Tipo I desempenham um importante papel na defesa contra patógenos intracelular, por exemplo, vírus; através da liberação da citocina, Interferon- (INT-y) e Interleucina-2 (IL-2), estimulando a ativação de células efetoras (CD4+ e T-citotóxica, células supressoras CD8+ com receptores específicos para os antígenos que disparam a resposta inicial).
humoral (produção de anticorpos e outros fatores solúveis que circulam no sangue e em outros fluidos corpóreos). Então, citocinas liberadas de células Tipo II podem ativar linfócitos B, conduzindo a proliferação e diferenciação em células de memória e células plasmáticas, embora alguns antígenos possam ativar células B independentemente de células CD4+. Células plasmáticas são capazes de secretar uma grande quantidade de imunoglobulinas ou anticorpos específicos para o antígeno que iniciou a resposta (Reid et al, 2001). A imunoglobulina ligada ao antígeno-alvo forma o complexo antígeno-anticorpo e ambos, tanto imunoglobulina quanto anticorpo circulam nos líquidos corpóreos (Carpenter et al, 2004). Células CD8+ também podem ser classificadas em Tipo I e Tipo II de acordo com seu perfil citotóxico.
4.9 Exercício agudo e linfócitos
Exercício agudo promove mudança bifásica no número de linfócitos circulantes (DuBose et al, 2003). Aumento no número de linfócitos (linfocitose) é observado durante e imediatamente após exercício, com o número de células caindo abaixo dos níveis pré-exercício durante um breve período de recuperação (linfocitopenia), a seguir de forma constante, retornando a valores de repouso. Estas mudanças são proporcionais à intensidade e duração do exercício. Corrida a 80% do VO2 máx resulta em aumento de 70% no número de linfócitos imediatamente após
exercício, com queda de 45% abaixo dos valores de repouso 1 hora após o exercício; permanecendo acentuadamente abaixo dos níveis pré-exercício até 3,5 horas depois de finalizada a atividade. Ao contrário, exercício a 50% do VO2 máx
tem maior efeito na contagem de linfócitos circulantes (Nieman, 1994). Igualmente, a mudança no número de linfócitos observada para exercícios intermitentes é dependente da intensidade. Corridas de repetição estão associadas a uma resposta bifásica (Gray, 1993), enquanto exercício intermitente moderado demonstra mudança de menor magnitude nos números de linfócitos circulantes (Nieman, 1999). A recuperação insuficiente de um exercício prolongado pode exagerar a resposta bifásica: o aumento da linfocitose foi observado na resposta para um período de exercício em bicicleta a 75% do VO2 máx, com apenas 3 horas de recuperação
células B e células NK, embora este último subgrupo seja considerado parte do sistema inato, devido a sua habilidade para respostas espontâneas (Lancaster, 2005).
4.10 Número de células T e exercício
A concentração de células T (CD3+) de linfócitos em reposta ao exercício agudo, também tem uma resposta bifásica, com aumento acentuado no número de células T (Potteiger et al, 2001). Este aumento é evidente durante e imediatamente após o exercício e quedas significativas no número de células durante a recuperação (Nieman, 1994); isto é evidente para o exercício intenso de curta e prolongada duração. Por exemplo, um aumento de 58% no número de células T foi observado após 30 minutos de corrida de 2 horas a 65% do VO2 máx e os números
caíram para 42% abaixo dos valores de repouso 2 horas após o exercício (Shek, 1995). Esta resposta é frequentemente relatada para o exercício intenso, porque para o exercício moderado houve poucas mudanças no número de células T (Nieman, 1994). Existem muitas similaridades entre a resposta na circulação de células T e a população total de linfócitos, mostrando não ser novidade, já que células T constituem cerca de 70% dos linfócitos do sangue periférico (Green, Rowbottom, 2003).
células T, sugerindo que a queda na razão CD4+ / CD8+ pode ser vista no pós-exercício pela supressão de células T. Portanto, uma pequena proporção de células NK também expressa CD8+ e o relativo aumento número de células NK em resposta ao exercício é maior que a de células CD8+. Deve-se, portanto, ter cuidado ao interpretar mudanças na razão CD4+ / CD8+ quando na presença de células não-T, que também expressam CD8 e não farão parte da contagem (Ibfelt, 2002).
A resposta bifásica no número de células circulantes e nos subsistemas de células T ocorre durante e após exercício agudo e intenso (Fabbri et al, 2003). Respostas de células-T tipo I são estimuladas pela IL-12, enquanto a IL-6 induzem respostas das células tipo II, pela estimulação na produção de IL-4. No exercício extenuante ocorreu aumento na circulação plasmática de ambas as citocinas, provavelmente pela intensidade da atividade que pode afetar o equilíbrio de células T tipo I e tipo II. Este dado foi confirmado por Steensberg (2001) que observou uma diminuição de 50% na porcentagem de células T CD4+ e T CD8+, imediatamente após 2,5 horas de corrida em esteira a 75% do VO2 máx comparado com valores de
repouso.
4.11 Células B e exercício
As células B representam de 5-15% dos linfócitos circulantes. Algumas mudanças na concentração dessas células após exercício agudo são menores quando comparadas com outras subpopulações de células T. Afinal, apesar de significativas mudanças na concentração de células T circulantes, o número de células B não se modifica significativamente dos valores de repouso em resposta a 45 minutos de corrida em esteira a 80% do VO2 máx (Nieman, 1994). Neste estudo a
contagem de células B foi maior imediatamente no pós-exercício e menor 2 horas após-exercício. Parecem ser necessárias altas intensidades de exercício para produzir mudanças significativas no número de células na circulação, afinal, significativos aumentos foram observados imediatamente após máximo teste de exaustão em esteira (Fry, 1992) e após extenuante protocolo de exercício de resistência (Miles, 2003).
inúmeros mecanismos tenham sido propostos. O aumento inicial do número de linfócitos circulantes ocorre provavelmente pela marginalização de linfócitos presos ao endotélio vascular em órgãos como pulmões, baço, músculos e fígado. Esse mecanismo pode ser causado por fatores mecânicos como efeito do débito cardíaco e ainda, o estresse relacionado a uma melhora no fluxo sangüíneo. O exercício induz à mudança na expressão de moléculas de adesão das células (MAC), particularmente, as famílias da integrina e selectina. Essas moléculas estão envolvidas na aderência dos linfócitos na parede dos vasos, fixação de células circulantes através de proteínas específicas nas células vasculares endoteliais.
Alterações na concentração de hormônios do estresse parecem desempenhar importante papel na redistribuição de linfócitos circulantes associado ao exercício. Aumento nos níveis de catecolaminas (adrenalina e noradrenalina) e cortisol são dependentes da intensidade do exercício, com uma intensidade crítica em aproximadamente 60% do VO2 máx necessário para sua liberação. Em exercício de
alta intensidade, aumento na concentração de catecolaminas ocorre muito rapidamente (em minutos) e rapidamente retornam a valores de repouso após o exercício e assim, desde já, alguns efeitos celulares aparecem rapidamente. Ao contrário, aumento nos níveis do cortisol plasmático ocorre após um tempo e se mantém elevado acima dos valores de repouso por algum tempo após finalizado o exercício. A ação do cortisol também é atrasada, porque esse mecanismo de ação envolve uma complexa interação “ligante-receptor” com sítios de glicocorticóides do núcleo de células alvo.
exercício e a exposição às catecolaminas (Shephard, 2003). Grande quantidade desses receptores é encontrada na superfície de células NK, exceto na CD8+ e nas células B e menos ainda, na CD4+.
O mecanismo exato da influência do cortisol no número de linfócitos circulantes ainda é pouco claro, mas parece ter efeito na circulação e concentração de linfócitos (Starkie et al, 2001). Administração intravenosa de doses de cortisol promoveu linfocitopenia e migração de linfócitos para os tecidos (Cupp, Fauci, 1982; Tonnensen, 1987). O papel do cortisol parece ser importante durante a recuperação do exercício. Elevações nos níveis de adrenalina e cortisol estão também associadas com a supressão de células T tipo I, com o cortisol adicionalmente estimulando na produção de células T tipo II. Portanto, elevações desses hormônios, estimulados pelo exercício podem ser a causa principal de quedas significativas de subpopulações de células Tipo I após o exercício (Steensberg, 2001), isto é comprovado no estudo de Steensberg (2002) que correlacionou níveis de adrenalina plasmática e a porcentagem de produção de IL-2 pelas células T CD8+. Bloqueadores - adrenérgicos demonstram pequena influência na supressão de células T-citotóxicas induzida pelo exercício (Starkie, 2001). Entretanto, significativas relações têm sido encontradas entre os níveis de cortisol plasmático e células tipo I e tipo II (Ibfelt, 2002; Steensberg, 2001).
A apoptose de linfócitos (morte programada) é outro mecanismo a ser considerado na distribuição de linfócitos circulantes após o exercício. Imediatamente após uma exaustiva corrida a 80% do VO2 máx foi observado um aumento de 50%
de apoptose celular (Mooren, 2002), que pode se relacionar com uma significativa linfocitopenia observada 1 hora após o exercício. A porcentagem de células apoptóticas e linfócitos não diferem de valores basais para um exercício de 50% do VO2 máx e tempo de 30 minutos. Outro mecanismo a ser considerado é o aumento
4.12 Respostas metabólicas ao exercício
Estudos envolvendo exercício têm sido realizados com ratos, sendo o lactato sangüíneo usado para determinação da intensidade de esforço. Um estudo constatou que ratos sedentários, durante exercício de natação com sobrecarga fixa, apresentam máxima fase estável de lactato, definida como a mais alta concentração de lactato durante o exercício onde a entrada do substrato na corrente sangüínea iguala-se à remoção, com sobrecargas de 5 e 6% do peso corporal, à concentração sangüínea de lactato de 5,5 mMol/l (Gobatto, 2002) . Existe também nesses animais coincidência entre a máxima fase estável de lactato e o limiar anaeróbio, definido como a carga de trabalho na qual o lactato começa a se acumular desproporcionalmente no sangue durante exercícios com cargas progressivas (Voltarelli, 2002). Tais achados nos permitem avaliar mais precisamente a intensidade do exercício de natação relacionada às modificações sofridas pelo sistema imunitário.
O exercício físico promove também o aumento da glicose circulante provavelmente pela liberação de catecolaminas, de ACTH, glucagon, cortisol e GH, que são hormônios atuantes durante o esforço físico na promoção de uma maior disponibilidade de glicose à musculatura ativa (Ronsen, 2001; Cersosimo, 1987); hormônios que também influenciam o sistema imunitário (Khan, 1986; Maisel, 2003). O controle da disponibilidade dos substratos energéticos no exercício é determinado em grande parte por ajustes hormonais, principalmente a diminuição da insulina e aumento do glucagon e das catecolaminas (Afonso et al, 2003). A diminuição da insulinemia contribui para aumentar o efeito dos hormônios contra-reguladores sobre o fígado, favorecendo a produção de glicose, aumentando a mobilização dos triglicerídeos do tecido adiposo e muscular e do glicogênio muscular (Wasserman, 1986; Marliss, 2000). Admite-se que a diminuição da insulina associada ao aumento do glucagon aumente a produção hepática de glicose e a ação combinada de insulina e catecolaminas favoreça a mobilização dos lipídeos do tecido adiposo (Wasserman, 1986).
principalmente em exercícios físicos mais prolongados, sendo sua participação dependente do estado nutricional, de treinamento, intensidade e duração do exercício (Martin, 1996).
A secreção de hormônios glicocorticóides também é estimulada no exercício, sendo sua liberação dependente da quantidade de ACTH liberada pela hipófise anterior. No exercício físico, o cortisol estimula a produção de glicose pelo fígado ativando a gliconeogênese e diminui a sua utilização, acentuando a liberação de glucagon pelas ilhotas pancreáticas. Em uma sessão de exercício agudo, as concentrações de cortisol aumentam durante a sessão e mantêm-se elevadas após o término da mesma, sendo a secreção desse hormônio mais relacionada a uma resposta aguda (Kraemer, 1998).
4.13 A energia celular
A energia das ligações moleculares dos alimentos é liberada quimicamente no interior celular e em seguida é armazenada sob a forma de um composto altamente energético denominado adenosina trifosfato (ATP).
O ATP é gerado através de 3 sistemas energéticos: o sistema ATP-CP, sistema glicolítico e sistema oxidativo. No sistema ATP-CP, o Pi é separado da
creatina fosfato através da ação da creatina quinase. O Pi pode então se combinar
4.14 Sistema glicolítico de formação de ATP
A glicose representa aproximadamente 99% de todos os açucares circulantes no sangue e é originária da digestão de carboidratos e da degradação do glicogênio hepático. O glicogênio é sintetizado a partir da glicose por um processo chamado glicogênese e é armazenado no fígado ou no músculo até que seja solicitado. Então, o glicogênio é quebrado em glicose-1-fosfato através do processo da glicogenólise (Wilmore, Costill, 2001)
Antes da glicose ou do glicogênio poder ser utilizados para gerar energia, eles devem ser convertidos num composto denominado glicose-6-fosfato. A conversão de uma molécula de glicose exige uma molécula de ATP. Na conversão do glicogênio, a glicose-6-fosfato é formada a partir da glicose-1-fosfato sem o gasto energético do ATP. A glicólise tem seu início quando a glicose-6-fosfato é formada (Guyton, 1993).
A glicólise, então, produz ácido pirúvico. Esse processo não exige oxigênio, mas o seu uso determina o destino do ácido pirúvico formado pela glicólise. Sistema glicolítico ou glicólise anaeróbia é o processo que acontece sem a presença do oxigênio, neste caso o ácido pirúvico é convertido em ácido lático. Na presença do oxigênio o ácido pirúvico se transforma num composto denominado acetil coenzima A (acetil-CoA) que é parte do sistema oxidativo de formação do ATP. A glicólise que é muito mais complexa que o sistema ATP-CP, exige 12 reações enzimáticas para a degradação do glicogênio em ácido lático. Todas essas enzimas atuam no interior do citoplasma celular. O ganho desse processo é de 3 moles de ATP formados por cada mol de glicogênio degradado. Se a glicose for utilizada no lugar do glicogênio, o ganho é de apenas 2 moles de ATP porque 1 mol é utilizado par a conversão de glicose em glicose-6-fosfato. Esse sistema energético não produz grandes quantidades de ATP. Apesar dessa limitação, as ações combinadas dos sistemas glicolítico e ATP-CP permitem que os músculos gerem força mesmo quando o suprimento de oxigênio é limitado. Esses dois sistemas predominam durante os minutos iniciais do exercício de alta intensidade (Wilmore, Costill, 2001).
musculares inibe ainda mais a degradação do glicogênio, uma vez que compromete a função da enzima glicolítica. Além disso, o ácido lático reduz a capacidade de ligação com o cálcio das fibras e por essa razão, ele pode impedir a contração muscular (Wilmore, Costill, 2001).
4.15 A formação do ácido lático
A Lei de Ação de Massas define que, quando os produtos finais de uma reação química se acumulam no meio de reação, a velocidade da reação se aproxima de zero. Os 2 produtos finais das reações glicolíticas são o ácido pirúvico e átomos de hidrogênio, sob as formas de NADH e H+. O acúmulo de quantidade excessiva deles interrompe o processo glicolítico e impede a formação de mais ATP. Felizmente, quando sua quantidade começa a se exceder, esses produtos finais reagem entre si, formando o ácido lático. Assim, em condições anaeróbias, a maior parte do ácido pirúvico é indubitavelmente convertida em ácido lático, que se difunde prontamente das células para os líquidos extracelulares e até mesmo para os líquidos intracelulares de outras células menos ativas (Weltman, 1995).
4.16 Ácido lático e lactato
O ácido lático e o lactato não são a mesma substância. O ácido lático é um ácido com a fórmula química C3H6O3. Lactato é qualquer sal derivado do ácido
5 MATERIAL E MÉTODO
5.1 Animais
Foram utilizados 40 ratos machos, adultos, da linhagem Wistar, pesando até 300 gramas, provenientes da BIOAGRI (Planaltina, DF). Ficaram no biotério do Departamento de Educação Física da Universidade Católica de Brasília. Alimentados com ração balanceada padrão para roedores da marca Labina (Purina, São Paulo, SP)) e água ad libitum, foram mantidos em caixas coletivas (3 por caixa) de polipropileno cobertos com grade metálica, a temperatura ambiente de 22 ± 2º C, 55 ± 10% de umidade e com ciclo claro/escuro de 12 horas (estantes climatizadas). Os ratos foram distribuídos em 4 grupos de 10 animais da seguinte forma:
• Grupo Controle
• Grupo com 0% de carga
• Grupo com 5% de carga
• Grupo com 50% de carga PROCEDIMENTOS
Grupo Controle
Não foi submetido a qualquer intervenção que envolvesse exercício físico ou aclimatação na água.
5.2 Adaptação dos animais
• Adaptação ao ambiente: os ratos forma submetidos a duas semanas de adaptação ao biotério, sendo manipulados 2 vezes/semana para higienização das caixas e abastecimento de comida e água.
• Adaptação à água: aconteceram em 3 dias, após a adaptação ao biotério, para os grupos de 0%, 5%, e 50%, com a finalidade de minimizar os efeitos estressantes da água. A temperatura foi de 31 ± 1ºC por ser considerada termicamente neutra em relação à temperatura corporal do rato. Os animais dos grupos de 5% e de 50% fizeram a adaptação com suas respectivas cargas.
Dia 1: permanência de 15 minutos, a altura de 15 cm de água. Dia 2: 15 minutos de atividade, com nível de água de 30 cm. Dia 3: 15 minutos de natação a 45 cm de água.
- Animais do grupo G50: os animais foram expostos a 15 cm, 30 cm e 45 cm de água no 1º, 2º e 3º dia respectivamente, em aparato de vidro. Realizaram 50 saltos, em séries de 10 saltos com intervalo de 1 minuto para descanso entre as séries.
5.3 Exercício físico
• Única sessão de natação com duração de 30 minutos para os grupos 0% e 5% e 10 sessões de 10 saltos para os animais do grupo de 50% de carga.
• Os animais do grupo de 0% nadaram livres de carga, os do grupo de 5%, tiveram esta porcentagem do seu peso corporal acoplados ao tórax para realizar o exercício. Os ratos do grupo de 50% realizaram os saltos em aparato de vidro com 50% do seu peso corporal acoplados ao tórax.
• Os animais dos grupos de 0% e 5% de carga nadaram em tanques individuais (com capacidade de 100 litros) com nível de 45 cm de água por 30 minutos.
• Os animais do grupo de 50% saltaram em aparato de vidro (10 séries de 10 saltos com 1 minuto de intervalo entre cada série) que possuia as seguintes medidas 20 cm x 20 cm x 45 cm de profundidade, o nível de água foi de 150% o comprimento do corpo do animal (considerando da ponta do focinho até a raiz caudal).
5.4 Coleta do sangue
• Um pequeno corte com bisturi na extremidade da cauda forneceu o sangue para a coleta. A cauda foi enxuta e a primeira gota de sangue desprezada.
• 60µl de sangue foram depositados em Eppendorf heparinizado, imediatamente após o exercício (tempo zero) e nos tempos de 15, 30, 60 e 120 minutos.
• 25µl de sangue para determinação da concentração de lactato e glicose, 20µl para a contagem global de leucócitos, uma gota para realização da técnica do esfregaço para a contagem celular diferencial.
5.5 Dosagem do lactato sangüíneo
• 25µl de sangue pipetados e depositados em eppendorfs contendo 50µl de fluoreto de sódio a 1% serviu para determinação da concentração de lactato sanguíneo. O material foi congelado a menos 20ºC para posterior determinação das concentrações em analisador bioquímico (YSI Model 2700 SELECT, Yellow Springs, OH, USA).
5.6 Contagem de leucócitos
5.6.1 Leucograma global
• 20µl de sangue foram diluídos em eppendorf contendo líquido de turk (líquido hemolisante), na proporção de 1:20 ( 0,4 ml de líquido diluente para 20µl de sangue), produzindo uma solução homogeneizada para que houvesse hemólise dos eritrócitos.
• Câmara de Neubauer improved, lavada com água destilada e seca foi utilizada para a contagem celular. O preenchimento com pipeta semi-automática ocorreu em um único tempo, para que não extravasasse ou faltasse líquido, evitando assim, interferência na distribuição ao acaso das células no retículo.
• Foi calculado o número de células por milímetro cúbico de sangue através da seguinte fórmula:
No Céls /mm3 = Q1 + Q2 + Q3 + Q4 x 10 x 20 4
(Sendo Q = número de células por quadrante da câmara de Neubauer)
5.6.2 Leucograma diferencial
• Técnica do esfregaço para contagem diferencial de leucócitos (neutrófilos, linfócito, eosinófilos e monócito) que possibilitou encontrar a freqüência relativa de cada célula.
• O sangue foi homogeneizado antes da realização do esfregaço para que as células ficassem distribuídas adequadamente na lâmina.
• A técnica consiste em depositar sobre uma lâmina de vidro uma pequena gota de sangue. Com uma segunda lâmina inclinada em ângulo de aproximadamente 45º, realiza-se o deslizamento sobre a primeira.
• Os esfregaços foram fixados com metanol e corados pelo método May Grünwald-Giemsa, que apresentam afinidades por estruturas celulares citoplasmáticas e nucleares (Silva, 1999)
• Foram contadas 100 células por lâmina, em campos ópticos distribuídos aleatoriamente e diferenciando-se as células. Foi utilizado o microscópio óptico comum com auxílio da objetiva de imersão (aumento de 1000 vezes).
5.7 Análise estatística
6 RESULTADOS
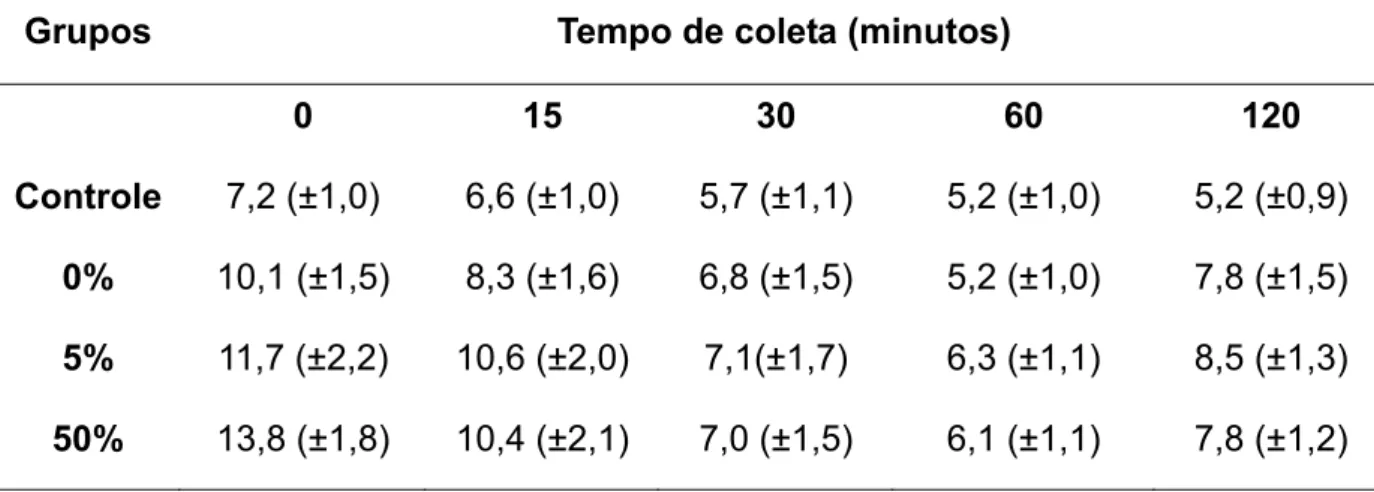
Resultados da analise de variância (SPLIT-PLOT) revelaram que os animais que nadaram com carga de 0% e 5% não apresentaram diferenças significativas sobre a concentração de lactato sanguineo (P > 0,05). Por outro lado o teste de comparação múltipla de Bonferroni revelou diferenças significativas (P < 0,001) entre os demais grupos (Tabela 1). Os resultados também indicaram efeitos significativos de interação entre os fatores grupo versus tempo de coleta (Greenhaouse-Geisser, P < 0,001).
Tabela 1: Médias e Intervalos de confiança da concentração de lactato sangüíneo.
Grupos X I.C de 95%
Controle 0% 5% 50%
1,6 2,4 2,5 4,7
(1,3 - 1,9) (2,1 - 2,7) (2,2 - 2,8) (4,4 - 5,0) I.C - Intervalo de Confiança.
Tabela 2: Médias e desvios padrões sobre a concentração de lactato sangüíneo durante os pós-testes.
Grupos Tempo de Coleta (minutos)
0 15 30 60 120 Controle 1,7 (±0,3) 1,6 (±0,3) 1,6 (±0,5) 1,5 (±0,3) 1,5 (±0,3)
0% 2,7 (±0,5) 3,3 (±0,9) 2,1 (±0,6) 1,6 (±0,2) 1,9 (±0,8) 5% 3,1 (±0,9) 3,6 (±1,0) 2,1 (±0,3) 1,7 (±0,3) 1,9 (±0,5) 50% 10,3 (±1,4) 6,5 (±1,1) 2,5 (±0,4) 1,8 (±0,5) 1,7 (±0,1)
Tabela 3: Variâncias explicadas (R2) segundo modelos de regressão linear entre a concentração de lactato sangüíneo e leucócitos (global e diferencial).
MODELOS CÉLULAS
Leucócitos Linfócitos Neutrófilos Monócitos
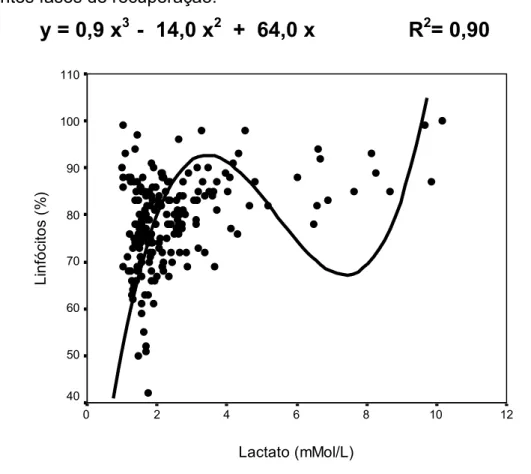
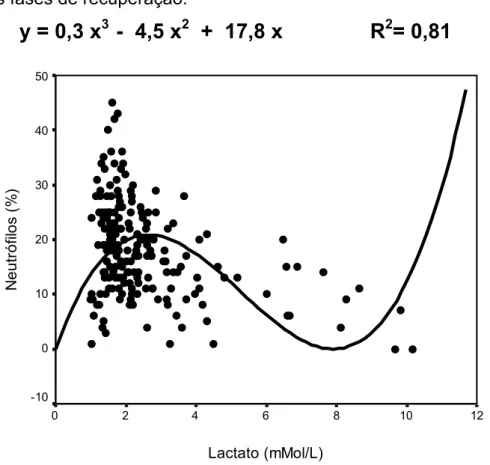
Cúbico 0,91 0,90 0,81 0,46
Linear Simples 0,77 0,66 0,43 0,26
Quadrático 0,89 0,86 0,74 0,41
Leucócitos
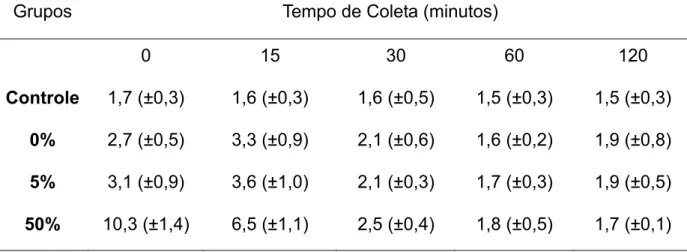
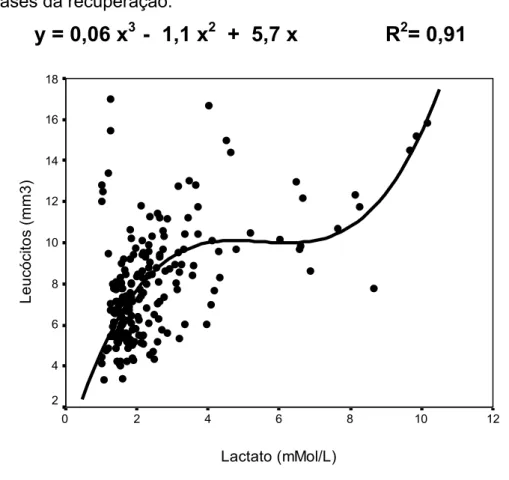
O número de leucocitos aumentou imediatamente após o exercício de natação para os grupos de 0% (~39%), 5% (~62%) e 50% de carga (~91%) em relação ao grupo controle (Tabela 4 e Figura 1).
Tabela 4: Médias e desvios padrões sobre o número de leucócitos (mm3) durante os pós-testes.
Grupos Tempo de coleta (minutos)
0 15 30 60 120 Controle 7,2 (±1,0) 6,6 (±1,0) 5,7 (±1,1) 5,2 (±1,0) 5,2 (±0,9)
0% 10,1 (±1,5) 8,3 (±1,6) 6,8 (±1,5) 5,2 (±1,0) 7,8 (±1,5) 5% 11,7 (±2,2) 10,6 (±2,0) 7,1(±1,7) 6,3 (±1,1) 8,5 (±1,3) 50% 13,8 (±1,8) 10,4 (±2,1) 7,0 (±1,5) 6,1 (±1,1) 7,8 (±1,2)
Figura 1: Número de leucócitos versus concentração de lactato sangüíneo em diferentes fases da recuperação.
y = 0,06 x
3- 1,1 x
2+ 5,7 x R
2= 0,91
Lactato (mMol/L) 12 10 8 6 4 2 0 Leuc ó c it os ( m m 3) 18 16 14 12 10 8 6 4 2 Monócitos
Observou-se uma queda no número de monócitos para todos os grupos que se exercitaram sobre as diferentes fases da recuperação em relação ao controle. Os menores valores foram verificados após 30 minutos de exercício para o grupo de 0% (
↓
64%), 15 minutos para o grupo de 5% (↓
72%) e 60 minutos para o grupo de 50% de carga (↓
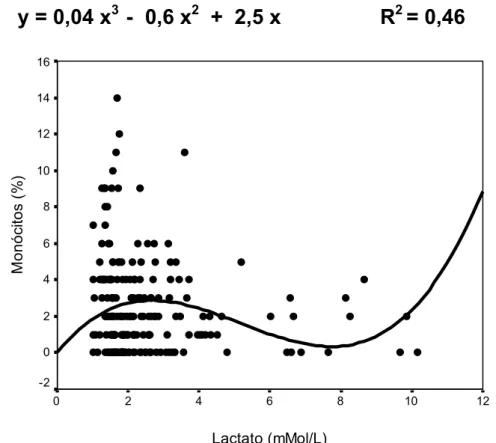
98%) conforme Tabela 4. Para todos os grupos que realizaram exercício, as distribuições destas células sugerem uma relação inversa com a concentração de lactato sangüíneo (R2= 0,46).Tabela 5: Médias e desvios padrões sobre a porcentagem de monócitos durante os pós-testes.
Grupos Tempo de Coleta (minutos)
0 15 30 60 120
5% 1,8 (±0,92) 1,3 (±1,06) 2,1(±1,29) 1,90 (±2,13) 1,30 (±1,16) 50% 2,5 (±1,51) 1,1 (±1,49) 2,2 (±1,93) 0,1 (±0,32) 0,3 (±0,67)
Figura 2: Porcentagem de monócitos versus concentração de lactato sangüíneo em diferentes fases da recuperação.
y = 0,04 x
3- 0,6 x
2+ 2,5 x R
2= 0,46
Lactato (mMol/L)
12 10
8 6
4 2
0
M
onóc
it
os
(
%
)
16
14
12
10
8
6
4
2
0 -2
Linfócitos
Tabela 6: Médias e desvios padrões sobre a porcentagem diferencial de linfócitos sangüíneosdurante os pós-testes.
Grupos Tempo de Coleta (minutos)
0 15 30 60 120
Controle 80,0 (±7,04) 75,0 (±8,97) 70,8 (±13,46) 69,1 (±12,41) 69,5 (±7,71) 0% 82,6 (±5,44) 80,2 (±7,32) 81,4 (±5,91) 73,8 (±7,0) 76,1 (±8,02) 5% 81,1 (±5,76) 84,5 (±7,23) 79,4 (±6,54) 75,0 (±6,2) 79,4 (±7,89) 50% 89,5 (±12,90) 87,8 (±6,48) 82,4 (±6,31) 78,9 (±9,05) 76,7 (±12,5)
Figura 3: Porcentagem de linfócitos versus concentração de lactato sangüíneo em diferentes fases de recuperação.
y = 0,9 x
3- 14,0 x
2+ 64,0 x R
2= 0,90
Lactato (mMol/L)
12 10
8 6
4 2
0
Li
nfó
c
it
o
s
(
%
)
110
100
90
80
70
60
50
40
Neutrófilos
os monócitos, a distribuição dos neutrófilos foi inversa à concentração do lactato sanguíneo (R2= 0,82).
Tabela 7: Médias e desvios padrões sobre a porcentagem de neutrófilos durante os pós-testes.
Grupos Tempo de Coleta (minutos)
0 15 30 60 120 Controle 16,3 (±5,33) 19,6 (±7,62) 23,1 (±10,0) 23,8 (±7,87) 23,6 (±10,5)
0% 13,6 (±5,25) 15,70 (±7,93) 16,3 (±5,5) 23,1 (±7,2) 21,4 (±7,4) 5% 16,7 (±5,6) 13,8 (±7,07) 18,2 (±5,88) 21,8 (±6,76) 18,8 (±7,67) 50% 6,6 (±3,66) 10,5 (±6,06) 15,7 (±7,29) 20,9 (±9,12) 22,7 (±12,13)
Figura 4: Porcentagem de neutrófilos versus concentração de lactato sangüíneo em diferentes fases de recuperação.
y = 0,3 x
3- 4,5 x
2+ 17,8 x R
2= 0,81
Lactato (mMol/L)
12 10
8 6
4 2
0
N
e
u
tró
fi
lo
s
(%
)
50
40
30
20
10
0
7 DISCUSSÃO
Neste trabalho investigamos o número e tipo de leucócitos após exercício físico agudo de natação, bem como, a relação destas variáveis com as concentrações de lactato sangüíneo. O principal resultado deste trabalho sugere que o número de leucócitos apresenta uma relação curvilínea, melhor descrita segundo o modelo polinomial cúbico (R2=0,91). Os maiores valores verificados sobre o número de leucócitos aconteceram imediatamente após o exercício e foi proporcional a concentração do lactato sanguíneo, justificado pela forte relação entre eles. O aumento ocorreu na proporção de 39%, 62% e 91% para os grupos que se exercitaram com 0%, 5% e 50% de carga, respectivamente. Um novo pico no número de leucócitos circulantes foi verificado com 2 horas de recuperação do exercício, conhecido na literatura como leucocitose tardia ou atrasada (Gabriel et al 1992; Fehr, 1979; Allsop, 1992;Costa Rosa, 2002). Embora nossa investigação tenha se limitado a distribuição de leucócitos circulantes, é provável que as concentrações de lactato sanguíneo, verificados na fase de recuperação, estejam relacionadas com função destas células frente às diferentes demandas teciduais decorrentes do exercício.
Talvez essa abrupta queda esteja relacionada à resposta imediata do sistema imunitário junto ao processo inflamatório agudo muscular e/ou dano tecidual, já que alguns estudos observaram um aumento na atividade fagocítica de neutrófilos durante o exercício agudo (Hack, 1992; Lewicki, 1987; Ortega, 1993).
Monócitos distribuíram-se de maneira similar aos neutrófilos na circulação sanguínea. Embora finalizado o estresse orgânico produzido pelo exercício, o número destas células diminuiu para todos os grupos no período de recuperação, em relação ao grupo controle. A maior queda verificou-se para o grupo 50% de carga, na proporção de 98% com 1 hora de recuperação. Portanto, os resultados obtidos para monócitos também contrariam achados na literatura (Field, 1991; Bierger, 1980). Sabe-se que o exercício intenso aumenta os níveis de cortisol sangüíneo (Galbo,1983) e concentrações muito altas desse hormônio estão associadas a imunossupressão (Dufaux,Order, 1989; Dufaux, 1991). Na luz destes achados, é provável que as maiores quedas ocorridas no número de monócitos/neutrófilos para os grupos exercitados 50% de carga por influencia das elevadas concentrações de cortisol sanguíneo. Adicionalmente, diferenças metodológicas podem estar refletindo a divergência de resultados. Por exemplo, grande parte dos trabalhos utilizou delineamentos de medidas repetidas, ou seja, cada participante é seu próprio controle. Nestas condições, medidas dentre grupos, também constatamos um aumento em até 130% (grupo 50% carga).
Conforme citação anterior, nossos resultados sugerem a ocorrência da leucocitose tardia - componente bifásico. Embora as concentrações do lactato sangüíneo tenham praticamente retornado aos valores basais com 2 horas de recuperação, aconteceu um novo pico no número de leucócitos. Sendo assim, sugere-se que este aumento celular independe da concentração do lactato sangüíneo. Segundo Galbo (1993) e Suzuki (2003) o cortisol possui secreção lenta que começa cerca de 10 minutos após o início do exercício com os maiores níveis sangüíneo após o término da prática. Portanto, é provável que a liberação tardia do cortisol tenha reduzido a aderência de leucócitos no endotélio vascular (Pyne, 1994) e induzindo a leucocitose bifásica (MacCathy, Dale, 1988). De fato, em nossa investigação não constatamos este comportamento para o grupo controle.
8 CONCLUSÕES
Com os resultados obtidos neste trabalho podemos concluir:
• Existe uma forte relação entre o número de leucócitos circulantes após exercício agudo e a concentração de lactato sangüíneo. Observamos que linfócitos tiveram sua distribuição sangüínea relacionada diretamente à concentração do lactato e monócitos e neutrófilos uma distribuição inversa.
• A leucocitose atrasada independe da concentração do lactato, uma vez que, ela aconteceu quando o lactato expressava suas menores concentrações.
• O modelo de regressão polinomial cúbico é o que melhor explica a relação entre os leucócitos e suas subpopulações com a concentração do lactato sangüíneo.