ENSAIOS CINÉTICOS PARA PREVISÃO E PREVENÇÃO
DE DRENAGEM ÁCIDA: ESTUDO DE CASO DAS INDÚSTRIAS
FUNDAÇÃO UNIVERSIDADE FEDERAL DE OURO PRETO
Reitor
João Luiz Martins
Vice-Reitor
Antenor Barbosa Júnior
Pró-Reitor de Pesquisa e Pós-Graduação
Tanus Jorge Nagem
ESCOLA DE MINAS
Diretor
José Geraldo Arantes de Azevedo Brito
Vice-Diretor
Wilson Trigueiro de Sousa
DEPARTAMENTO DE GEOLOGIA
Chefe
iv
CONTRIBUIÇÕES ÀS CIÊNCIAS DA TERRA – VOL. 28
TESE DE DOUTORADO
Nº 049
ENSAIOS CINÉTICOS PARA PREVISÃO E PREVENÇÃO
DE DRENAGEM ÁCIDA: ESTUDO DE CASO DAS INDÚSTRIAS
NUCLEARES DO BRASIL (INB), CALDAS, MG
Adriana Trópia de Abreu
Orientador
Jorge Carvalho de Lena
Co-orientador
Adilson do Lago Leite
Tese apresentada ao Programa de Pós-Graduação em Evolução Crustal e Recursos Naturais do Departamento de Geologia da Escola de Minas da Universidade Federal de Ouro Preto
como requisito parcial à obtenção do Título de Doutor em Ciência Naturais, Área de Concentração: Geologia Ambiental e Conservação de Recursos Naturais
OURO PRETO
vi
Departamento de Geologia - http://www.degeo.ufop.br/
Programa de Pós-Graduação em Evolução Crustal e Recursos Naturais Campus Morro do Cruzeiro s/n - Bauxita
35.400-000 Ouro Preto, Minas Gerais
Tel. (31) 3559-1600, Fax: (31) 3559-1606 e-mail: pgrad@degeo.ufop.br
Os direitos de tradução e reprodução reservados.
Nenhuma parte desta publicação poderá ser gravada, armazenada em sistemas eletrônicos, fotocopiada ou reproduzida por meios mecânicos ou eletrônicos ou utilizada sem a observância das normas de direito autoral.
ISSN 85-230-0108-6
Depósito Legal na Biblioteca Nacional Edição 1ª
Catalogação elaborada pela Biblioteca Prof. Luciano Jacques de Moraes do
Sistema de Bibliotecas e Informação - SISBIN - Universidade Federal de Ouro Preto
Catalogação:
sisbin@sisbin.ufop.br
A162e Abreu, Adriana Trópia de.
Ensaios cinéticos para previsão e prevenção de drenagem ácida [manuscrito] : estudo de caso das Indústrias Nucleares do Brasil (INB), Caldas, MG / Adriana Trópia de Abreu - 2012
xxviii, 245 f.: il. color.; grafs.; tabs.; mapas. (Contribuições às Ciências da Terra, v.28, n. 49) ISSN: 85-230-0108-6
Orientador: Prof. Dr. Jorge Carvalho de Lena. Coorientador: Prof. Dr. Adilson do Lago Leite.
Tese (Doutorado) – Universidade Federal de Ouro Preto. Escola de Minas. Departamento de Geologia. Programa de Pós-graduação em Evolução Crustal e Recursos Naturais.
Área de concentração: Geologia Ambiental e Conservação de Recursos Naturais. 1. Minas - Drenagem - Teses. 2. Lixiviação - Teses. 3. Extrator Soxhlet - Teses. 4. Urânio - Minas e mineração - Teses. I. Universidade Federal de Ouro Preto. II. Título
Dedico este trabalho a duas Marias:
Minha mãe, Ana Maria,
pela sua presença na minha vida,
um exemplo de dedicação, disciplina e doçura.
Minha tia, Maria José (Zezé), que me mostrou
o trabalho de uma pesquisadora quando eu
ainda nem sabia os significados das palavras pesquisa,
iniciação científica, mestrado e doutorado.
Me ensinaram que é preciso ter força, raça e gana.
Quem traz no corpo a marca.
Grande é a minha lista de agradecimentos, o que me torna uma pessoa de sorte. Agradeço a todas as pessoas que de alguma forma me ajudaram durante a execução deste trabalho. Gratidão eterna a Deus pelas oportunidades e por ter conhecido tantas pessoas especiais.
Agradeço aos meus pais, Ana e Gilberto (sempre presente), aos meus irmãos, André e Raquel, ao meu sobrinho Giuliano, e aos queridos agregados, Ricardo e Alessandra, que sempre me apoiaram e me deram condições para chegar até aqui sem medir esforços, pelo amor, carinho e união. Aos tios, tias, primos e primas, à vovó Edwiges (sempre presente), por tudo que fizeram por mim.
Agradeço, em especial, ao meu orientador Prof. Jorge Lena pela orientação, dedicação, confiança e envolvimento em todas as etapas deste trabalho. Ao Prof. Hermínio Nalini pelo apoio e incentivo. Ao meu co-orientador professor Adilson Leite pela credibilidade.
À UFOP, DEGEO e LGqA pela oportunidade e estrutura. Ao CNPq pelo financiamento do projeto, à CAPES pela concessão da bolsa e à Fundação Gorceix pelas bolsas de iniciação científica.
À INB pelo apoio no trabalho de campo e pelas determinações de acidez e alcalinidade nas amostras de campo (Laboratório de Desenvolvimento de Processos). Ao José Luciano (INB) pela ajuda nas coletas de campo e ao Luiz Antônio (LA Teixeira&Filhos) por ter cedido a lama vermelha.
Aos queridos bolsistas Marcela, Carla, Efigênia, Juliana e Edgar, pelos trabalhos de laboratório. Sem vocês seria impossível concluir este trabalho! Em especial, à Efigênia que me ajudou desde a primeira coluna, em todas as etapas, sempre com muita responsabilidade, dedicação e bom humor. Que bom que a gente se encontrou...
Aos funcionários e estagiários do LGqA, Celso, Vandir, Leo Teixeira, Leo Brandão, Gilberto e Júlio César, pelas inúmeras ajudas e pela paciência exigida numa convivência diária. Em especial, ao amigo Celso, pela participação direta e dedicação em várias análises químicas.
À Aline Kelly, que sempre esteve presente, nos altos e baixos, ajudando e clareando as idéias, sobretudo no que se refere ao planejamento experimental e ICP. À Louise pelo incentivo e ajudas, principalmente no ICP. Duas grandes amigas e parceiras desta caminhada e da vida. À Adivane pela amizade e incentivo. Aos amigos de vida e bancada, Wellington, Viviane, Jéssica, Margô, Geraldinho, Christiane, Sílvia Medírcio, Fernanda Costa, Fernanda Ataíde, Fellipe Chagas, Quênia. Ao Cristiano Sampaio pela paciência, incentivo, apoio e troca de idéias em diversos momentos desta jornada.
AGRADECIMENTOS ... ix
LISTA DE FIGURAS ... xv
LISTA DE TABELAS ... xviii
LISTA DE ABREVIATURAS ... xxiii
RESUMO ... xxv
ABSTRACT ... xxvii
CAPÍTULO 1. INTRODUÇÃO ... 01
1.1. Considerações Gerais ... 01
1.2. Objetivo... 04
CAPÍTULO 2. DRENAGEM ÁCIDA ... 05
2.1. Considerações Iniciais ... 05
2.2. DAM em Minas de Urânio ... 06
2.3. Minerais associados à DAM ... 07
2.4. Mecanismos de Oxidação da Pirita ... 07
2.5. Aspectos Microbiológicos da DAM ... 10
2.6. Reações de Neutralização ... 12
2.7. Minerais secundários associados à DAM ... 14
2.8. Métodos de controle e tratamento da DAM ... 16
2.8.1. Previsão da DAM ... 17
2.8.1.1. Métodos Estáticos para Previsão da DAM ... 18
2.8.1.2. Métodos Cinéticos para Previsão da DAM ... 18
2.8.2. Prevenção da DAM ... 21
2.8.2.1. Sistemas de Coberturas para Prevenção da DAM ... 23
2.8.2.2. Lama Vermelha como aditivo alcalino na Prevenção da DAM ... 26
2.8.3. Remediação da DAM ... 28
CAPÍTULO 3. OBJETO DE ESTUDO ... 31
3.1. Considerações Iniciais ... 31
3.2. Localização e Vias de Acesso ... 31
3.3. Aspectos Físicos, Climáticos e Hidrológicos... 32
3.4. A Mina Osamu Utsumi ... 32
3.5. Sistema de Disposição de Estéreis ... 36
3.6. Bota-Fora 4 (BF4) ... 37
3.7. Geologia ... 38
CAPÍTULO 4. MATERIAIS E MÉTODOS ... 41
xii
4.2.2. Amostras de Estéril ... 42
4.2.3. Amostras de Rocha... 45
4.3. Análises Químicas das Amostras de Águas ... 45
4.4. Caracterização das Amostras ... 45
4.4.1. Caracterização Física das Amostras de Estéril ... 45
4.4.2. Caracterização Físico-Química das Amostras de Estéril ... 46
4.4.3. Caracterização Química das Amostras de Estéril e de Rocha ... 46
4.4.4. Caracterização Mineralógica das Amostras de Estéril e de Rocha ... 47
4.5. Ensaios Cinéticos ... 48
4.5.1. Ensaios Cinéticos para Previsão da DAM ... 48
4.5.1.1. Coluna de Lixiviação ... 48
4.5.1.2. Extrator Soxhlet ... 51
4.5.2. Ensaios Cinéticos para Prevenção da DAM ... 53
4.5.2.1. Ensaios de Coberturas Alcalinas ... 53
4.5.2.2. Planejamento Experimental aplicado a Ensaios de Coberturas Alcalinas . 58 4.6. Determinação Analítica de Metais e Metalóides ... 60
4.6.1. Varredura Espectral para determinação de metais e metalóides nos lixiviados ... 61
4.6.2. Curva de Calibração para determinação de metais e metalóides nos lixiviados ... 63
CAPÍTULO 5. RESULTADOS E DISCUSSÃO ... 67
5.1. Considerações Iniciais ... 67
5.2. Análises das Amostras de Águas ... 67
5.2.1. Propriedades Físico-Químicas ... 67
5.2.2. Alcalinidade, Acidez e Cloreto ... 68
5.2.3. Determinação de Elementos Maiores e Traços ... 69
5.3. Caracterizações de Amostras de Estéril e de Rocha ... 71
5.3.1. Caracterizações Física e Físico-Química da Amostra de Estéril ... 71
5.3.2. Caracterização Química de Amostras de Estéril e de Rocha ... 74
5.3.3. Caracterização Mineralógica de Amostras de Estéril e de Rocha ... 81
5.4. Ensaios Cinéticos para Previsão da DAM ... 85
5.4.1. Coluna de Lixiviação... 85
5.4.2. Extrator Soxhlet ... 93
5.5. Ensaios Cinéticos para Prevenção da DAM ... 104
5.5.1. Ensaios com Coberturas Alcalinas ... 104
5.5.2. Planejamento Experimental aplicado a Ensaios de Coberturas Alcalinas ... 119
ANEXO I – Dados de Amostragem ... 153
ANEXO II – Distribuição Granulométrica do Estéril do BF4 ... 154
ANEXO III – Análise Mineralógica - DRX ... 155
ANEXO IV– Projeto da Coluna de Acrílico (CA)... 157
ANEXO V – Caracterização Química das Amostras de Estéril e de Rocha ... 158
ANEXO VI – Dados dos Ensaios das Colunas de Lixiviação ... 160
ANEXO VII – Dados dos Ensaios de Extratores Soxhlet... 169
ANEXO VIII– Dados dos Ensaios das Colunas de Coberturas Alcalinas ... 177
ANEXO IX – Dados dos Ensaios de Planejamento Experimental ... 198
ANEXO X– Artigo publicado na Revista Brasileira de Ciência do Solo (RBCS) ... 215
ANEXO XI– Artigo submetido na Revista da Escola de Minas (REM) ... 233
Figura 2.1- Caminho dos metais da área mineralizada até o destino final ... 05
Figura 2.2- Modelo para oxidação da pirita... 09
Figura 2.3- Comparação das constantes de taxa de reação de oxidação da pirita em função do pH ... 09
Figura 2.4- Comparação dos mecanismos de oxidação biológica em sulfeto de ferro ... 12
Figura 2.5- Esquema dos métodos de controle e tratamento da DAM ... 17
Figura 2.6- Esquema de funcionamento do extrator Soxhlet ... 21
Figura 3.1- Localização da Mina Osamu Utsumi no Planalto Poços de Caldas... 31
Figura 3.2- Detalhes geográficos do Planalto Poços de Caldas e localização da Mina Osamu Utsumi ... 33
Figura 3.3- Arranjo físico da Mina Osamu Utsumi - INB (antigo Complexo Mínero Industrial de Poços de Caldas) ... 34
Figura 3.4- Vista parcial dos taludes do bota-fora 4 ... 38
Figura 4.1- Fluxograma representando a metodologia utilizada ... 41
Figura 4.2- Coleta e filtração de amostra de água da bacia de captação BNF ... 42
Figura 4.3- Amostragem de amostra de estéril no BF4 ... 43
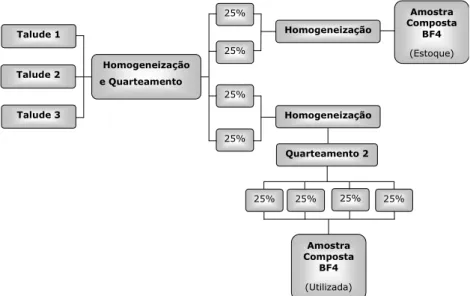
Figura 4.4- Desagregação, homogeneização e quarteamento da amostra de estéril do BF4 ... 44
Figura 4.5- Fluxograma do procedimento utilizado para obtenção da amostra composta de cada talude ... 44
Figura 4.6- Fluxograma do procedimento utilizado para o quarteamento da amostra composta de cada talude. ... 44
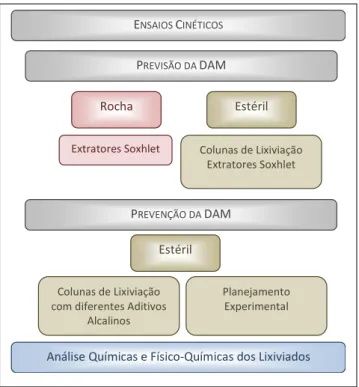
Figura 4.7- Fluxograma dos ensaios cinéticos utilizados para previsão e prevenção da DAM .. 48
Figura 4.8- Coluna de acrílico (CA) usada em ensaio cinético (2008) ... 49
Figura 4.9- Coluna de vidro (C1) usada nos ensaios cinéticos (2010) ... 51
Figura 4.10- Ensaio de Extrator Soxhlet com amostra de rocha e de estéril ... 53
Figura 4.11- Colunas testes para sistemas de coberturas (CT1 e CT2). ... 55
Figura 4.12- Colunas com coberturas (COB2, COB3 e COB4), coluna com estéril (C1) e colunas com estéril e sistemas de coberturas (C2, C3 e C4) ... 56
Figura 4.13- Diagrama esquemático do ensaio de coberturas alcalinas ... 58
Figura 4.14- Colunas E2, E3, E8 e E11 referente à 2ª etapa do planejamento experimental ... 60
Figura 4.15- Varredura espectral para linha de S (166,669 nm) ... 62
Figura 4.16- Varredura espectral para linha de S (180,731 nm) ... 62
Figura 5.1- Distribuição granulométrica da amostra de estéril coletada no BF4 ... 71
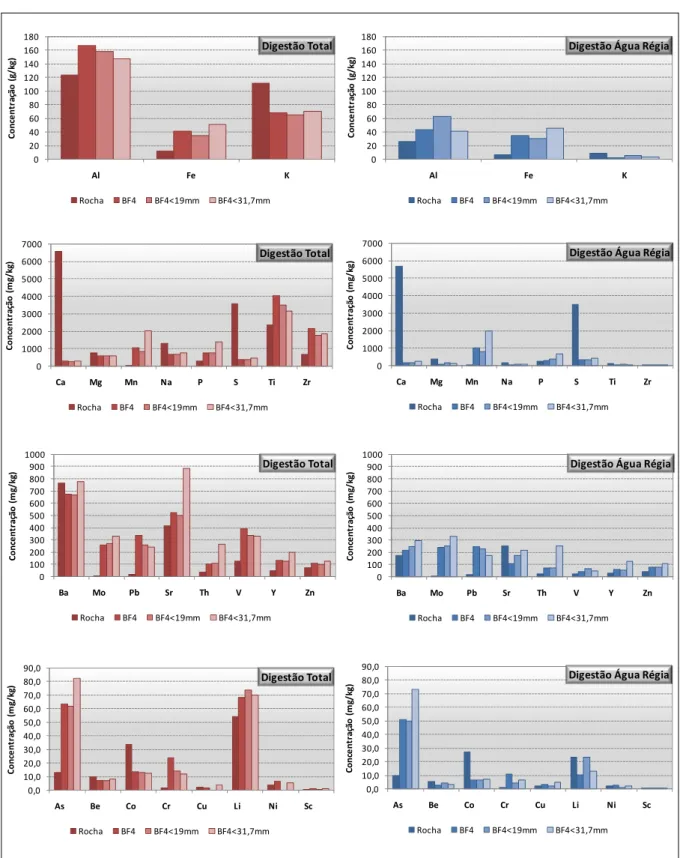
Figura 5.2- Concentrações de Al, Fe, K, Ca, Mg, Mn, Na, P, S, Ti e Zr nas frações granulométricas do estéril provenientes das digestões total e com água régia. ... 75
xvi
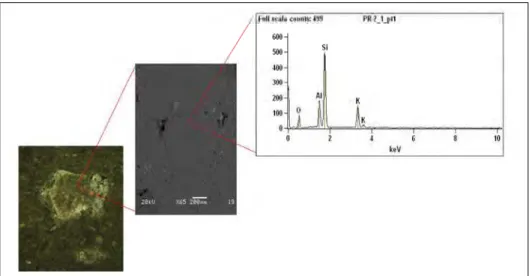
Figura 5.6- Imagem do fragmento de rocha PR1 e o espectro obtido no MEV/MDS ... 83
Figura 5.7- Imagem do fragmento de rocha PR2 e o espectro obtido no MEV/MDS ... 83
Figura 5.8- Imagem do fragmento de rocha PR3 e o espectro obtido no MEV/MDS ... 83
Figura 5.9- Imagem do fragmento de rocha PR4 e o espectro obtido no MEV/MDS ... 84
Figura 5.10- Variações de pH, Eh, condutividade elétrica, STD, acidez e alcalinidade ao longo do tempo na coluna CA ... 86
Figura 5.11- Variações dos elementos maiores nas águas lixiviadas ao longo do tempo na coluna CA ... 87
Figura 5.12- Variações dos elementos traços nas águas lixiviadas ao longo do tempo na coluna CA ... 88
Figura 5.13- Variações de pH, Eh, condutividade elétrica e STD longo do tempo na coluna C1... ... 89
Figura 5.14- Variações de pH, Eh, condutividade elétrica e STD ao longo do tempo obtidas na metodologia I do extrator soxhlet. ... 93
Figura 5.15- Concentrações dos elementos maiores e traços ao longo do tempo obtidas na metodologia I do extrator soxhlet. ... 94
Figura 5.16- Temperaturas observadas na rocha após o término de cada ciclo e temperaturas obtidas ao longo de um ciclo na metodologia I do extrator Soxhlet.. ... 96
Figura 5.17- Variações de pH, Eh, condutividade elétrica e STD ao longo do tempo obtidas na metodologia II do extrator soxhlet. ... 97
Figura 5.18- Concentrações dos elementos maiores e traços ao longo do tempo obtidas na metodologia II do extrator soxhlet... 98
Figura 5.19- Variações de pH, Eh, condutividade elétrica e STD ao longo do tempo obtidas no extrator soxhlet com estéril. ... 99
Figura 5.20- Concentrações de elementos maiores e traços obtidas ao longo do tempo no extrator Soxhlet com estéril. ... 100
Figura 5.21- Concentrações de elementos maiores e traços na amostra de rocha antes e após os ensaios com extratores Soxhlet.. ... 102
Figura 5.22- Concentrações de elementos maiores e traços na amostra de estéril < 31,7 mm antes e após o ensaio em coluna de lixiviação.. ... 103
Figura 5.23- Concentrações de elementos maiores e traços na amostra de estéril < 19 mm antes e após os ensaios com extrator Soxhlet e em coluna de lixivação... ... 103
Figura 5.24- Variações de pH e condutividade elétrica ao longo do tempo obtidas nas colunas testes para ensaio de coberturas alcalinas (CT1 e CT2)... ... 106
Figura 5.25- Variações de pH, Eh, condutividade elétrica, STD e temperatura ao longo do tempo obtidas nas colunas do ensaio de coberturas alcalinas ... 110
Figura 5.26- Variações de alcalinidade e sulfato ao longo do tempo obtidas nas colunas do ensaio de coberturas alcalinas ... 111
Figura 5.29- Concentrações de elementos traços (Ba, Zr, Fe, U, Mo e V) ao longo do tempo obtidas nas colunas do ensaio de coberturas alcalinas ... 116
Figura 5.30- Concentrações de elementos traços (Be, Li, As, Cd, Co, Cu, Ni e Sc) ao longo do tempo obtidas nas colunas do ensaio de coberturas alcalinas ... 117
Figura 5.31- Variação do pH ao longo do tempo nos ensaios do planejamento experimental . 120
Figura 5.32- Diagrama de Pareto para pH com 30 dias de ensaio ... 123
Figura 5.33- Superfície de Resposta em função da concentração de lama vermelha e altura da cobertura para pH com 30 dias de ensaio ... 124
Figura 5.34- Curva de contorno em função da concentração de lama vermelha e altura da cobertura para pH com 30 dias de ensaio ... 125
Figura 5.35- Variação da condutividade elétrica ao longo do tempo nos ensaios de planejamento experimental ... 126
Figura 5.36- Diagrama de Pareto para condutividade elétrica com 20 dias de ensaio ... 128
Figura 5.37- Superfície de Resposta em função da concentração de lama vermelha e altura da cobertura para a condutividade elétrica com 20 dias de ensaio ... 129
Figura 5.38- Curva de contorno em função da concentração de lama vermelha e altura da cobertura para a condutividade elétrica com 20 dias de ensaio ... 130
Figura 5.39- Variação do Eh ao longo do tempo nos ensaios do planejamento experimental . 131
Figura 5.40- Diagrama de Pareto para Eh com 28 dias de ensaio ... 133
Figura 5.41- Superfície de Resposta em função da concentração de lama vermelha e altura da cobertura para Eh com 28 dias de ensaio ... 134
Figura 5.42- Curva de contorno em função da concentração de lama vermelha e altura da cobertura para Eh com 28 dias de ensaio ... 135
Figura 5.43- Variações das concentrações de Na, K Ca, Mg, Si e S nos lixiviados ao longo do tempo nos ensaios do planejamento experimental ... 136
Figura 5.44- Variações das concentrações de Al, Mn, Zn, Sr, Y e Monos lixiviados ao longo do tempo nos ensaios do planejamento experimental ... 137
Figura 5.45- Variações das concentrações de Fe, Zr, Ba, Cu, Be e Linos lixiviados ao longo do tempo nos ensaios do planejamento experimental ... 139
xviii
Tabela 2.1- Experimentos com colunas de lixiviação encontrados na literatura e suas principais
características ... 20
Tabela 2.2- Classificação das coberturas secas de acordo com o papel que exercem para efeito de inibição da DAM ... 24
Tabela 3.1- Quantidades de minério, estéril e rejeito produzidas em 20 anos de operação do CIPC ... 35
Tabela 3.2- Características dos bota-foras do CIPC ... 36
Tabela 4.1- Classificação granulométrica de acordo com a terminologia de Wentworth ... 46
Tabela 4.2- Denominação e composição das colunas teste com sistemas de coberturas ... 56
Tabela 4.3- Denominação e composição das colunas com sistemas de coberturas ... 57
Tabela 4.4- Níveis das variáveis usadas no planejamento experimental DCCR ... 59
Tabela 4.5- Matriz do planejamento experimental e ordem de execução dos ensaios... 59
Tabela 4.6- Condições operacionais do ICP OES com configuração radial ... 60
Tabela 4.7- Curva de calibração usada para determinação de elementos traços e maiores por ICP OES em amostras de águas e lixiviados ... 64
Tabela 4.8- Limites de detecção e quantificação dos elementos analisados ... 65
Tabela 5.1- Parâmetros físico-químicos das amostras de água medidos in situ. ... 68
Tabela 5.2- Resultados das determinações de Alcalinidade, Acidez e Cloreto ... 69
Tabela 5.3- Concentração de elementos maiores menores e traços nas amostras de água do BNF e córrego Consulta obtidas por ICP OES ... 70
Tabela 5.4- Propriedades físicas da amostra de estéril do BF4 ... 72
Tabela 5.5- Propriedades físico-químicas da amostra de estéril do BF4 ... 72
Tabela 5.6-
Massa específica, área superficial específica e capacidade de troca catiônica
de diferentes minerais
... 73Tabela 5.7- Concentrações de enxofre e urânio em amostras de estéril e rocha ... 79
Tabela 5.8- Resultados obtidos para Materiais de Referência Certificado (MRC) ... 80
Tabela 5.9- Concentrações de elementos maiores e traços nas amostras de águas e dos lixiviados da coluna C1 ... 90
Tabela 5.10- Composição química do resíduo sólido obtido após ensaio em extrator Soxhlet com rocha (metodologia I) ... 95
Tabela 5.11- Valores de limites de quantificação do ICP OES utilizados na metodologia II do extrator Soxhlet com rocha... 98
Tabela 5.12- Valores de limites de quantificação do ICP OES utilizados no ensaio de extrator Soxhlet com estéril ... 101
Tabela 5.13- Denominação do material (estéril e rocha) após os ensaios cinéticos para previsão da DAM ... 101
Tabela 5.14- Composição química dos agentes alcalinos usados nos sistemas de coberturas .. 104
ICP OES nos lixiviados das colunas testes para ensaio de coberturas alcalinas ... 107
Tabela 5.17- Concentrações máximas e mínimas dos elementos traços (µg/L) obtidas por ICP OES nos lixiviados das colunas testes para ensaio de coberturas alcalinas ... 107
Tabela 5.18- Denominação das colunas e coberturas utilizadas no ensaio de coberturas alcalinas ... 108
Tabela 5.19- Matriz do planejamento experimental DCCR ... 119
Tabela 5.20- Resultado para a variação de pH nos ensaios do planejamento experimental ... 121
Tabela 5.21- Equações de primeira ordem para o pH em diferentes tempos de ensaio ... 122
Tabela 5.22- Equação de primeira ordem para o pH em 30 dias de ensaio após ajuste do modelo ... 123
Tabela 5.23- Análise da variância para o pH com 30 dias de ensaio após ajuste do modelo. .. 123
Tabela 5.24- Resultado para a variação de condutividade elétrica nos ensaios do planejamento experimental ... 127
Tabela 5.25- Equações de primeira ordem para a condutividade elétrica em diferentes tempos de ensaio ... 127
Tabela 5.26- Análise da variância para a condutividade elétrica com 20 dias de ensaio. ... 129
Tabela 5.27- Resultado para a variação do potencial redox (Eh) nos ensaios do planejamento experimental ... 132
Tabela 5.28- Equações de primeira ordem para o potencial redox (Eh) em diferentes tempos de ensaio ... 132
Tabela 5.29- Equação de primeira ordem para o Eh em 28 dias de ensaio após ajuste do modelo ... 133
Tabela 5.30- Análise da variância para o potencial redox com 28 dias de ensaio. ... 134
Tabela I.1- Quantidade das amostras coletadase localização dos pontos amostrados na mina Osamu Utsumi ... 153
Tabela II.1- Distribuição granulométrica da amostra de estéril coletada no BF4 ... 154
Tabela V.1- Concentrações dos elementos maiores e traços obtidas por ICP OES para as frações granulométricas de estéril nas digestões total e com água régia ... 158
Tabela V.2- Concentrações dos elementos maiores e traços obtidas por ICP OES para as amostras de rocha e de estéril nas digestões total e com água régia ... 159
Tabela VI.1- Parâmetros físico-químicos e volumes influentes e efluentes na coluna de lixiviação de acrílico (CA) ... 160
Tabela VI.2- Parâmetros físico-químicos das águas deionizadas utilizadas na coluna de lixiviação de acrílico (CA) ... 161
Tabela VI.3- Valores de Alcalinidade, Acidez e Sulfato obtidos no ensaio de coluna de lixiviação de acrílico (CA) ... 161
Tabela VI.4- Concentrações dos elementos maiores e traços obtidos por ICP OES para as amostras do ensaio de coluna de lixiviação de acrílico (CA) ... 162
xx
Tabela VI.7- Parâmetros físico-químicos e volumes efluentes na coluna de lixiviação de vidro (C1) ... 165
Tabela VI.8- Parâmetros físico-químicos e volumes efluentes na coluna de lixiviação de vidro (C1) ... 166
Tabela VI.9- Concentrações dos elementos maiores e traços obtidos por ICP OES para as amostras do ensaio de coluna de lixiviação de vidro (CA) ... 167
Tabela VI.10- Concentrações dos elementos maiores e traços obtidos por ICP OES para as amostras do ensaio de coluna de lixiviação de vidro (CA) ... 168
Tabela VII.1- Parâmetros físico-químicos obtidos na metodologia I do extrator Soxhlet
com amostra de rocha ... 169
Tabela VII.2- Concentrações dos elementos maiores e traços obtidos por ICP OES na
metodologia I do extrator Soxhlet com amostra de rocha ... 170
Tabela VII.3- Parâmetros físico-químicos obtidos na metodologia II do extrator Soxhlet com amostra de rocha ... 171
Tabela VII.4- Concentrações dos elementos maiores e traços obtidos por ICP OES na
metodologia II do extrator Soxhlet com amostra de rocha ... 172
Tabela VII.5- Concentrações dos elementos maiores e traços obtidos por ICP OES na
metodologia II do extrator Soxhlet com amostra de rocha ... 173
Tabela VII.6- Parâmetros físico-químicos obtidos no ensaio com extrator Soxhlet com
amostra de estéril ... 174
Tabela VII.7- Concentrações dos elementos maiores e traços obtidos por ICP OES no
ensaio com extrator Soxhlet com amostra de estéril ... 175
Tabela VII.8- Concentrações dos elementos maiores e traços obtidos por ICP OES no
ensaio com extrator Soxhlet com amostra de estéril ... 176
Tabela VIII.1- Parâmetros físico-químicos obtidos nas colunas testes para ensaio de
coberturas alcalinas ... 177
Tabela VIII.2- Concentrações dos elementos maiores e traços obtidos por ICP OES nas
colunas testes para ensaio de coberturas alcalinas ... 178
Tabela VIII.3- Parâmetros físico-químicos obtidos na coluna C2 no ensaio com sistemas de coberturas alcalinas ... 179
Tabela VIII.4- Parâmetros físico-químicos obtidos na coluna C3 no ensaio com sistemas de coberturas alcalinas ... 180
Tabela VIII.5- Parâmetros físico-químicos obtidos na coluna C4 no ensaio com sistemas de coberturas alcalinas ... 181
Tabela VIII.6- Parâmetros físico-químicos obtidos na coluna COB2 no ensaio com sistemas de coberturas alcalinas ... 182
Tabela VIII.7- Parâmetros físico-químicos obtidos na coluna COB3 no ensaio com sistemas de coberturas alcalinas ... 183
Tabela VIII.8- Parâmetros físico-químicos obtidos na coluna COB4 no ensaio com sistemas de coberturas alcalinas ... 184
Tabela VIII.11- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna C2 do ensaio com sistemas de coberturas alcalinas ... 187
Tabela VIII.12- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna C3 do ensaio com sistemas de coberturas alcalinas ... 188
Tabela VIII.13- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna C3 do ensaio com sistemas de coberturas alcalinas ... 189
Tabela VIII.14- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna C4 do ensaio com sistemas de coberturas alcalinas ... 190
Tabela VIII.15- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna C4 do ensaio com sistemas de coberturas alcalinas ... 191
Tabela VIII.16- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB2 do ensaio com sistemas de coberturas alcalinas ... 192
Tabela VIII.17- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB2 do ensaio com sistemas de coberturas alcalinas ... 193
Tabela VIII.18- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB3 do ensaio com sistemas de coberturas alcalinas ... 194
Tabela VIII.19- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB3 do ensaio com sistemas de coberturas alcalinas ... 195
Tabela VIII.20- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB3 do ensaio com sistemas de coberturas alcalinas ... 196
Tabela VIII.21- Concentrações dos elementos maiores e traços obtidos por ICP OESna coluna COB3 do ensaio com sistemas de coberturas alcalinas ... 197
Tabela XIX.1- Parâmetros físico-químicos obtidos nos ensaios E1 e E2 do planejamento experimental ... 198
Tabela IX.2- Parâmetros físico-químicos obtidos nos ensaios E3 e E4 do planejamento
experimental ... 199
Tabela IX.3- Parâmetros físico-químicos obtidos nos ensaios E5 e E6 do planejamento
experimental ... 200
Tabela IX.4- Parâmetros físico-químicos obtidos nos ensaios E7 e E8 do planejamento
experimental ... 201
Tabela IX.5- Parâmetros físico-químicos obtidos nos ensaios E9 e E10 do planejamento
experimental ... 202
Tabela IX.6- Parâmetros físico-químicos obtidos nos ensaios E11 e nas amostras de branco do planejamento experimental ... 203
Tabela IX.7- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E1 do planejamento experimental ... 204
Tabela IX.8- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E2 do planejamento experimental ... 205
Tabela IX.9- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E3 do planejamento experimental ... 206
xxii
Tabela IX.12- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E6 do planejamento experimental ... 209
Tabela IX.13- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E7 do planejamento experimental ... 210
Tabela IX.14- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E8 do planejamento experimental ... 211
Tabela IX.15- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E9 do planejamento experimental ... 212
Tabela IX.16- Concentrações dos elementos maiores e traços obtidas por ICP OES no ensaio E10 do planejamento experimental ... 213
DAR – Drenagem Ácida de Rocha DAM – Drenagem Ácida de Mina
ICOLD – International Commission on Large Dams
CONAMA – Conselho Nacional do Meio Ambiente UTM – Unidade de Tratamento de Minério
INB – Indústrias Nucleares do Brasil
ASTM – American Society for testing and Materials
CNEN – Comissão Nacional de Energia Nuclear
CIPC – Complexo Mínero Industrial de Poços de Caldas
IBAMA – Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis ABNT – Associação Brasileira de Normas Técnicas
PRAD – Plano de Recuperação de Área Degradada BNF – Bacia Nestor Figueiredo
BF4 – Bota Fora 4 CC – Córrego Consulta
MEV - EDS – Microscópio Eletrônico de Varredura e Sistema de Energia Dispersiva (Energy Dispersive X-Ray Detector)
DRX – Difratometria de Raios – X
ICP OES – Inductivily Coupled Plasma Optical Emission Scpectrometry
PPC – Perda por Calcinação LD – Limite de Detecção LQ – Limite de Quantificação VC – Valor Certificado VO – Valor Obtido
TR – Taxa de Recuperação (%) SQ – Soma Quadrática
GL – Grau de Liberdade MQ – Média Quadrática
DCCR – Delineamento Composto Central Rotacional BCR – Community Bureau of Reference
LKSD2 – Certified Reference Material Lake Sediment (China)
GBW07311 - Certified Reference Material Stream Sediment (Canadá)
A drenagem ácida de mina é o resultado do processo de oxidação de rochas que contêm minerais sulfetados. Este processo ocorre quando o material sulfetado é exposto a condições atmosféricas. Nestas condições, sucessivas reações de oxidação dos sulfetos levam à formação de águas ácidas. Isto é agravado quando as rochas existentes no local não têm capacidade de neutralizar o ácido formado. A condição de baixo pH da água drenada acelera o processo de solubilização de materiais sólidos (rochas, solos e sedimentos) e favorece a lixiviação de metais e metalóides tornando-os disponíveis no ambiente podendo comprometer a qualidade dtornando-os curstornando-os d’águas adjacentes. Este quadro é muito comum em minas abandonadas onde o material retirado fica exposto como é o caso da mina Osamu Utsumi em Caldas, MG. Trata-se do primeiro complexo mínero-industrial de urânio instalado no Brasil. Este complexo foi inaugurado em 1982 e atualmente está em fase de desativação sob o controle da INB (Indústrias Nucleares do Brasil).
Os métodos de controle e tratamento da DAM podem ser divididos em três vias de ação: previsão, prevenção e remediação. Nos métodos de predição ou previsão são utilizados diferentes procedimentos de ensaios estáticos e cinéticos para avaliar a capacidade ou a probabilidade de determinado material gerar ácido e bases sob determinadas condições. Quando a DAM já se encontra instalada, normalmente, são aplicados métodos de prevenção e/ou remediação. Nas metodologias de prevenção tenta-se encontrar maneiras de prevenir a sua geração ou mesmo diminuir a quantidade de ácido gerada. Na remediação são aplicadas técnicas de contenção e/ou tratamento das águas ácidas geradas.
O objetivo desse trabalho foi avaliar e comparar diferentes tipos de ensaios cinéticos para previsão e prevenção da geração ácida de amostras de estéril e de rocha da mina Osamu Utsumi. Os ensaios para previsão da DAM foram realizados em colunas de lixiviação e extratores Soxhlet. Já nos ensaios para prevenção da DAM foram estudados e avaliados sistemas de coberturas secas alcalinas contendo como agentes de neutralização a lama vermelha, o calcário e a cal. Além disso, foi realizado um planejamento experimental aplicado ao ensaio de cobertura alcalina utilizando a lama vermelha no sistema de cobertura. Os lixiviados obtidos nos ensaios foram analisados para parâmetros físico-químicos (pH, Eh, condutividade elétrica e temperatura) e metais e metalóides por ICP OES. Para entender os resultados obtidos nos ensaios cinéticos foi realizada, inicialmente, uma caracterização detalhada (física, química e mineralógica) das amostras de estéril e rocha.
xxvi
Duas metodologias de ensaio cinético com extrator Soxhlet foram aplicadas a rocha: sem troca da água (ES1) e com troca diária da água (ES2). Na prática, o efluente mais concentrado gerado na primeira metodologia (ES1), poderia refletir o que ocorre na cava da mina, por exemplo. Neste ensaio foi observado uma diminuição do pH ao longo do ensaio, e como esperado, um aumento das concentrações da maioria dos elementos avaliados com o tempo. Exceções foram observadas para Ba e Fe. Já na segunda metodologia (ES2), foi observado um aumento significativo do pH, que é comparável a resultados de ensaios em colunas. No entanto, avaliação dos elementos traços eluídos ficou comprometida e grande parte deles apresentou resultados abaixo do limite de quantificação da técnica utilizada.
Os sistemas de coberturas alcalinas avaliados apresentaram uma eficiência satisfatória quanto à capacidade de neutralização. As misturas realizadas com estéril do BF4 e aditivos alcalinos (cal, calcário e lama vermelha) foram suficientes para gerar águas com pH básico durante o tempo avaliado. Apesar da cobertura com calcário gerar um pH básico, esta condição não foi suficiente para neutralizar a acidez do estéril presente dentro da coluna. Assim, a cal e a lama vermelha possuíram um maior potencial neutralizador. No entanto, estes agentes neutralizantes ofereceram o inconveniente de introduzir material solúvel no lixiviado. Neste ensaio, considerando os parâmetros avaliados, foi demonstrado que o uso de mistura de lama vermelha com estéril poderia ser uma alternativa viável para o controle de geração de DAM associada à reciclagem de resíduos industriais alcalinos.
No planejamento experimental aplicado ao ensaio de coberturas alcalinas com lama vermelha foi possível construir uma superfície de resposta que indicou a faixa ótima de pH em função das variáveis estudadas (concentração de lama vermelha e altura da cobertura). Além disso, este estudo tem importância na visualização da robustez do experimento. Isto possibilita alteração de cada uma das variáveis para uma mesma resposta de pH. Também foram construídas superfícies de respostas para a condutividade elétrica e Eh. Para estes parâmetros não foi obtida uma faixa ótima. Os resultados obtidos na análise das superfícies destas respostas mostram que os valores mínimos da faixa ótima de pH parecem apresentar melhores condições para controle de DAM.
The Acid Mine Drainage is the result of the oxidation of sulfide bearing rocks. This process occurs when this material is exposed to atmospheric conditions. Under these conditions, successive oxidation reactions yield sulfuric acid generating acid waters. This problem becomes more serious when the surrounding rocks are not able to neutralize the acid. The low pH condition of the drained water accelerates the solubilization process of solid materials (rocks, soils and sediments) and favors the metal and metalloid leaching making them available to the environment impairing the hydrical system quality. This is a quite common situation at abandoned mines where the material is exposed as at Osamu Utsumi mine at Caldas MG. It is the first industrial mining complex of uranium established in Brazil. It started operating in 1982 and nowadays is being closed and it is under the INB (Indústrias Nucleares do Brasil) administration.
The AMD control and treatment methods can be divided in three courses of action: prediction, prevention and remediation. In the prediction methods different static and kinetic test procedures are used to assess the capacity of a given material to generate acids and bases under specific conditions. When the AMD is already in course, prevention and or remediation methods are applied. In the prevention methodologies the goal is to find ways to prevent its generation or even to minimize the generated amount of acid. In the remediation methodology containment and/or treatment techniques of the acid waters are used.
The goal of this work was to assess and compare different kinds of kinetic tests for prevention and prevision of acid generation of waste rock from the Osamu Utsumi mine. The tests for the AMD prevision were carried out using leaching columns and Soxhlet extractors. For the AMD prevention tests it was studied and assessed dry alkaline covers containing red mud, limestone and lime as neutralizing agents. In addition to that it was used and experimental factor planning applied to the alkaline cover with red mud. The obtained leachate were analyzed for the physical chemical parameters (pH, Eh, electrical conductivity and temperature), metals and metalloids by ICP OES. In order to understand the results obtained from these tests a detailed characterization (physical, chemical and mineralogical) of the rock and waste rock was carried out.
xxviii
effluent generated in the first methodology (ES1) could reflect what occurs in the mine trench for example. In this test lowering of pH was observed, and as expected, the concentration of the majority of the assessed elements raised with time. Exceptions were observed for Ba and Fe. In the second methodology (ES2) a significant raise of pH was observed. This test is comparable for test columns. However, the assessment of the eluted trace elements was not achieved and part of them showed results which were below the quantification limit of the analytical technique.
The alkaline cover system presented a satisfactory efficiency regarding the neutralization capacity. The mixture with waste rock from BF4 and alkaline additives (lime, limestone and red mud) were sufficient to generate water with basic pH during the time of assessment. In spite of the limestone cover generating basic pH, this condition was not sufficient to neutralize the waste rock acidity in the column. Therefore lime and red mud presented a higher neutralizing potential. However these neutralizing agents show the inconvenient of introducing soluble material in the leachate. In this test, considering the assessed parameters, it was demonstrated that the use of the mixture of red mud and waste rock could be a feasible alternative for the control of the AMD generation associated to the recycling of alkaline industrial tailings.
In the factor experimental planning used in the test if alkaline covers with red mud it was possible to build a response surface that indicated the optimum pH range as function of the studied variables (concentration of the red mud and height of the cover). Besides, this study is important to visualize the robustness of the experiment. This makes it possible the alteration of each of the variables for the same pH answer. Response surfaces for electrical conductivity and Eh were also obtained, which lead to a optimum range for these parameters. These results show that the minimum values for the optimum pH range seem to present the best conditions for the control of the AMD.
CAPÍTULO 1
INTRODUÇÃO
1.1 – CONSIDERAÇÕES INICIAIS
A ocorrência natural de minerais sulfetados em rochas pode levar à formação de Drenagem Ácida de Rochas (DAR). Com a exposição desses minerais a condições atmosféricas e mediação de bactérias ocorre a oxidação dos sulfetos com a formação de ácido sulfúrico. A elevação de acidez do meio acelera a dissolução de metais e metalóides associados a tais minerais podendo ocorrer degradação da qualidade dos recursos hídricos superficiais e subterrâneos. Esse quadro é agravado quando as rochas existentes no local não possuem potencial de neutralização suficiente (U.S. EPA 1994, Blowes 2003).
O processo de geração ácida é significativamente acelerado quando tais rochas estão presentes em áreas de empreendimentos como mineração, construção de barragens e rodovias. Isto ocorre com o aumento da exposição do material sulfetado devido à remoção do mesmo. No caso da mineração, nos vários depósitos decorrentes dos processos de extração mineral, tais como rejeitos do beneficiamento, depósitos de estéreis, cava da mina e vias de acesso, a geração de ácido é denominada Drenagem Ácida de Mina (DAM) (Salomons 1995, Blowes 2003).
O problema da DAM já é bastante conhecido mundialmente em minerações de carvão, onde normalmente o mesmo se associa à oxidação da pirita (FeS2). Atualmente têm crescido estudos de geração ácida proveniente de minerações de metais (cobre, chumbo, zinco, níquel, etc), metais preciosos (ouro, prata e elementos do grupo da platina), depósitos de urânio e depósitos de diamante, devido ao fato destes estarem também associados a depósitos sulfetados (Blowes 2003).
A DAM proveniente destes ambientes contém metais e metalóides dissolvidos (As, Cd, Cu, Ni, Pb,Zn, Al, Cr, Mn, Mg, etc), em composições e concentrações que dependem de condições geológicas específicas. As variadas combinações de acidez e íons dissolvidos fazem com que cada efluente de mineração seja único e, portanto, o tratamento adequado varie em cada caso (Fungaro & Izidoro 2006).
Atualmente, processos de contenção e remediação têm sido aplicados para atender as normas ambientais vigentes. No entanto, por muitos anos, a DAM gerada em ambientes de mineração foi descartada diretamente em recursos hídricos. Além disso, no controle da emissão de efluentes e para águas naturais muitos elementos ainda não são monitorados já que as normas ambientais prevêem valores máximos permitidos apenas para determinados elementos químicos (CONAMA 2005).
Uma vez descartados em ambientes lóticos (córregos e rios) a dispersão de elementos químicos pode ocorrer ao longo de centenas de quilômetros (Brake et al. 2001, Concas et al. 2006). Nestes ambientes, vários processos químicos e físicos podem levar, direta ou indiretamente, à atenuação de poluentes. Os principais processos químicos são advecção, diluição, dispersão e sedimentação. Processos químicos incluem reações, precipitação, co-precipitação e adsorção em sedimentos de fundo ou partículas em suspensão. O aumento do pH causa adsorção dos elementos químicos dissolvidos nas várias fases sólidas da coluna d’água. Tais fases sólidas incluem minerais de argilas, quartzo, feldspatos e sólidos orgânicos. Esses componentes estão geralmente recobertos com hidróxidos de manganês, óxidos de ferro e por substâncias orgânicas. Tal revestimento é o principal responsável pelos processos de adsorção. A adsorção de metais e metalóides na superfície dos componentes sólidos é controlada principalmente pelos valores de pH. Normalmente, essa adsorção aumenta de zero para perto de 100% se o pH aumenta de uma a duas unidades. Dessa forma, uma pequena mudança no pH da água provoca um aumento acentuado na concentração do metal dissolvido (Salomons 1995, Lee & Kim 2007).
Devido à grande capacidade de adsorção de espécies orgânicas e inorgânicas por superfícies minerais, os sedimentos podem ser considerados reservatórios de contaminantes e dependendo das condições do meio podem funcionar tanto como fonte quanto destino final de substâncias poluentes. Por sua participação direta no ciclo biogeoquímico de vários elementos, a contaminação dos sedimentos afeta, direta ou indiretamente, os vários compartimentos da cadeia alimentar de diversas espécies animais, muitas delas consumidas pelo homem. Assim, a determinação de metais e metalóides nos sedimentos permite avaliar a contaminação que a água está sujeita (Gray 1997, Calmano et al., 1996, Sieguel 2002, Moncur et al. 2006).
Diversas técnicas têm sido desenvolvidas para controlar ou minimizar os efeitos da DAM. Nos métodos de predição ou previsão são utilizados diferentes procedimentos para avaliar a capacidade ou a probabilidade de determinado material gerar ácido e bases sob determinadas condições. Tais procedimentos podem ser laboratoriais ou de campo. Os testes de laboratório para a previsão de DAM englobam métodos estáticos e cinéticos. Os métodos estáticos levam em consideração principalmente o Balanço Ácido-Base (do inglês: Acid-Base Accounting - ABA), envolvendo a avaliação dos potenciais de geração de ácido e base de um determinado material e comparando estes potenciais. Os métodos cinéticos, por sua vez, tentam incorporar a dinâmica dos elementos físicos, químicos e biológicos, tornando a previsão mais próxima da realidade da mina. Equipamentos como colunas de lixiviação, células de umidade e extratores Soxhlet são aplicados nestes métodos. Também, dentro da previsão, são utilizados modelos geoquímicos onde são utilizados os dados obtidos nos testes cinéticos e informações de regime hídrico local. Os resultados podem ajudar na previsão do montante de ácido gerado e do tempo que este processo ainda pode durar (Evangelou 1995, Salomons 1995, Blowes et al. 2003).
Quando a DAM já se encontra instalada, normalmente, são aplicados métodos de prevenção e/ou remediação. Nas metodologias de prevenção tenta-se encontrar maneiras de prevenir a sua geração ou mesmo diminuir a quantidade de ácido gerada. A prevenção pode ter caráter químico, bacteriológico ou físico. Na remediação são aplicadas técnicas de contenção e/ou tratamento que podem ser classificadas como ativas ou passivas, de acordo com a existência ou não da necessidade de se introduzir energia no sistema para inicializar e continuar o processo (Blowes 2003, Johnson & Hallberg 2005, Akcil & Koldas 2006).
Na UFOP vários estudos têm sido desenvolvidos na tentativa de entender e minimizar os impactos gerados pela drenagem ácida na mina Osamu Utsumi. Dentre eles, destacam-se Rodrigues (2001) que estudou os aspectos hidroquímicos e hidrogeológicos do bota fora BF 4, Fagundes (2005) que fez o balanço hídrico do bota-fora BF 4, Tedeschi (2005) que avaliou a hidrogeoquímica e a hidrologia do reservatório na cava da mina, Caponi (2005) que realizou a digitalização de mapas e tratamento de dados meteorológicos para o balanço hídrico do bota-fora BF 4, Roeser (2006) e Murta (2006) que realizaram ensaios de colunas para a avaliação de remediação de drenagem ácida e Leite (2010) que avaliou a utilização de testes estáticos para avaliação de drenagem ácida no estéril do bota-fora BF 4.
1.2- OBJETIVO
Dentro do contexto descrito acima, o presente trabalho pretende dar continuidade aos estudos iniciados na UTM-INB na tentativa de contribuir para o entendimento do problema e diminuir os altos custos que hoje envolvem o tratamento da drenagem ácida existente. Para isso, foram desenvolvidos métodos cinéticos para a avaliação do potencial de geração ácida e também alternativa de prevenção de drenagem ácida, utilizando amostras de rochas e das pilhas de estéril do BF4 da mina Osamu Utsumi.
Para atingir o objetivo proposto acima, o trabalho foi realizado em 4 etapas. A primeira etapa consistiu na amostragem, preparo e caracterização detalhada (física, química e mineralógica) do estéril proveniente do BF4 e da rocha da cava da mina Osamu Utsumi. Desta forma, buscou-se quantificar a distribuição dos elementos maiores, menores e traços associados a esses materiais e, também os minerais presentes.
Na segunda parte, diferentes metodologias de ensaios cinéticos foram desenvolvidas com amostras de estéril do BF 4 e de rocha da cava da mina. Nesses ensaios foram utilizados colunas de lixiviação e extratores Soxhlet para previsão da geração ácida. As amostras de água lixiviada foram monitoradas nas quais foram medidos parâmetros químicos e físico-químicos, como pH, Eh, temperatura, condutividade elétrica, sólidos totais dissolvidos, acidez, alcalinidade, sulfato, além de elementos maiores e traços.
A terceira parte teve por objetivo investigar em escala laboratorial uma alternativa de prevenção de drenagem ácida gerada pelo estéril do BF4. Foram realizados ensaios de lixiviação em colunas com diferentes tipos de cobertura secas alcalinas tais como cal hidratada, calcário e lama vermelha sob condições controladas. A água lixiviada foi controlada para parâmetros físico-químicos e concentração de elementos maiores e traços.
CAPÍTULO 2
DRENAGEM ÁCIDA DE MINA
2.1 – CONSIDERAÇÕES INICIAIS
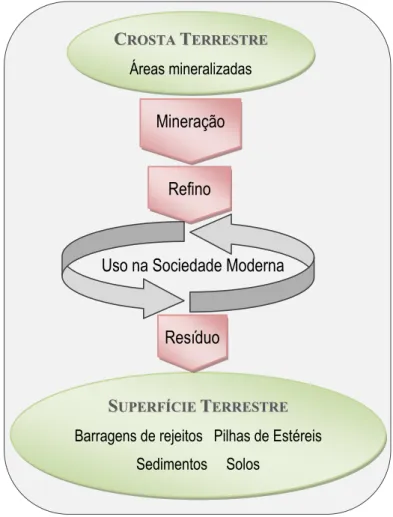
As atividades de mineração envolvem etapas de extração, processamento e beneficiamento e representam fontes de metais para o ambiente, pois cada uma dessas etapas está relacionada com geração de resíduos. Os resíduos gerados podem ser classificados de estéril e rejeito. O estéril é considerado o material com teores de minério abaixo do interesse econômico da mineradora. Este material é descartado ainda na fase de lavra e geralmente disposto em pilhas ou bota-foras. O rejeito trata-se do material proveniente das atividades de beneficiamento mineral e tem como destino final as pilhas ou as barragens de rejeito. Dessa forma, o processo de erosão da pilha de estéril ou o descarte direto de rejeitos nos rios resultam na introdução de metais e metalóides na forma de material particulado nos sistemas aquáticos (Figura 2.1) (Salomons 1995, Blowes et al. 2003, Fagundes 2005).
Figura 2.1 - Caminho dos metais da área mineralizada até o destino final como poluentes nos solos e sedimentos e estocados nas barragens de rejeitos. (Salomons 1995).
C
C
RROOSSTTAAT
T
EERRRREESSTTRREEÁreas mineralizadas
S
S
UUPPEERRFFÍÍCCIIEET
T
EERRRREESSTTRREEBarragens de rejeitos Pilhas de Estéreis Sedimentos Solos
Mineração
Refino
Uso na Sociedade Moderna
Os rejeitos e estéreis depositados nesses ambientes, dependendo da natureza da rocha, podem conter elevadas concentrações de metais que são dispersos tanto em solução como na forma de particulado. Quando esses depósitos contêm sulfetos em contato com oxigênio resulta na drenagem ácida de mina (DAM). Geralmente, em função dessa acidez, metais e metalóides como alumínio, arsênio, cádmio, cobalto, cobre, mercúrio, níquel, chumbo e zinco são liberados em quantidades significantemente maiores. Além disso, os rejeitos e estéreis apresentam uma elevada heterogeneidade quanto ao tamanho de partículas. A disposição em pilhas é caracterizada por grande difusão de oxigênio e alta permeabilidade que, quando associada à presença de minerais sulfetados, favorecem a formação de DAM (Salomons 1995, Blowes et al. 2003, Fagundes 2005).
Geralmente, a escavação se dá em lavras subterrâneas ou em lavras a céu aberto. No entanto, o garimpo também tem sido usado para extração mineral. O garimpo envolve escavação de sedimentos de rios e posterior separação dos minerais valiosos por gravidade, flotação seletiva ou extração química. Como conseqüência dessas atividades tem-se a exposição de minerais sulfetados que antes estavam isolados do ar atmosférico. Além disso, normalmente, em todo o processo de mineração grandes quantidades de resíduos são geradas, por exemplo, a produção de 1 t de Cu requer escavação e processamento de 100 t de rocha (Blowes et al. 2003).
2.2 – DAM EM MINAS DE URÂNIO
Atualmente os maiores produtores de urânio no mundo são Canadá e Austrália. O urânio produzido é usado principalmente como fonte de energia e armamento (Blowes et al. 2003).No Brasil, segundo dados da INB (Indústrias Nucleares do Brasil),atualmente, há uma única mina de extração de urânio em atividade no país, a mina de Caetité, na cidade de Lagoa Real, na Bahia. Uma nova mina, em Santa Quitéria, no Ceará, deve entrar em operação nos próximos anos. A produção de urânio é voltada, basicamente, para a geração de energia (99%), o restante é usado na medicina e agricultura (INB 2011).
No município de Caldas, em MG, foi instalado o primeiro complexo mínero-industrial de urânio no Brasil. A unidade foi inaugurada em 1982 e, atualmente está em fase de descomissionamento e fechamento sob o controle da INB (Indústrias Nucleares do Brasil). A lavra em Caldas foi feita a céu aberto, o que permitia um melhor aproveitamento do minério de urânio. As reservas de U3O8 nesta jazida foram estimadas em 4.500 toneladas. A sua complexa constituição mineralógica, de características únicas, obrigou desenvolvimento de processo original na extração do urânio e elementos associados (INB 2011).
dispersão de espécies químicas que possam causar danos ao meio ambiente. As espécies químicas incluem metais pesados, ânions tóxicos e radionuclídeos naturais, que podem estar na forma de óxidos e sais, em suspensão, em solução ou na forma gasosa como o radônio. Além disso, os depósitos de urânio estão normalmente associados a sulfetos que são potenciais geradores de DAM (Fernandes et al. 1995, Fernandes & Franklin 2001, Cipriani 2002, Fernandes et al. 2008).
2.3 – MINERAIS ASSOCIADOS À DAM
Os principais minerais sulfetados associados à geração de drenagem ácida de mina (DAM) são a pirita (FeS2), a marcassita (FeS2) e a pirrotita (Fe1-xS, onde 0<x<0,2), porém outros minerais sulfetados são passíveis de sofrer oxidação e gerar drenagem ácida, tais como: calcopirita (CuFeS2), calcocita (Cu2S), millerita (NiS), arsenopirita (FeAsS) e cinábrio (HgS) (U.S. EPA 1994).
Geralmente, na natureza, as ocorrências de pirita estão associadas a depósitos de carvão e minérios metálicos incluindo zinco, cobre, urânio, ouro, prata e outros. Com ocorrência menos comum, devido a sua instabilidade, também é encontrada a marcassita. Pirita e marcassita são minerais polimorfos, ou seja, apresentam mesma composição química e diferentes estruturas cristalinas. A pirita tem estrutura cristalina isométrica e a marcassita é otorrômbica (Evangelou 1995).
Dependendo do ambiente de formação a pirita pode variar significativamente sua morfologia e tamanho de grão. A pirita pode apresentar diferentes formas, tais como: grãos maciços euhedricos, framboidais e poliframboidais; e cristais octaédricos e piritoédricos. Quanto ao tamanho, foi relatada a existência de grãos variando de 5 m a 400 m. A forma de pirita mais reativa é a framboidal, devido a sua extensa área superficial e alta porosidade (Evangelou 1995).
2.4 – MECANISMOS DE OXIDAÇÃO DA PIRITA
As equações que representam as reações de oxidação da pirita através da exposição ao oxigênio atmosférico e água estão apresentadas a seguir:
FeS2 + 7/2 O2 + H2O Fe2+ + 2 SO42- + 2H+ (1) Fe2+ + 1/4 O2 + H+ Fe3+ + 1/2 H2O (2) Fe3+ + 3 H2O Fe(OH)3 + 3 H+ (3) FeS2 + 15/4 O2 + 7/2H2O Fe(OH)3+ 2SO42- + 4H+ (4) Na equação (1) a pirita é oxidada pelo oxigênio atmosférico produzindo sulfato, íon ferroso (Fe2+) e íons H+ em solução. Posteriormente, conforme as equações (2) e (3), o íon ferroso (Fe2+) pode ser oxidado a íon férrico (Fe3+) que, por sua vez, sofre hidrólise produzindo hidróxido férrico e mais íons H+. A equação (4) representa a reação global e resulta na liberação de 4 mol de íons H+ para cada mol de pirita oxidada (Stumm & Morgan 1981, Blowes et al. 2003).
O precipitado de hidróxido férrico [Fe(OH)3] formado por hidrólise do íon férrico (Fe3+) é um material amorfo de coloração marrom-alaranjado, também conhecido por yellow-boy. A precipitação deste hidróxido é favorecida pelo aumento do pH da água ácida (maior do que 4,5). Assim, o yellow-boy é característico de cursos d’água em pontos onde a DAM entra em contato com águas neutras. Por outro lado, quando há acúmulo de acidez e o pH diminui a valores menores do que 3,5 a reação de hidrólise fica limitada e a concentração de íon férrico (Fe3+) em solução aumenta. Nessas condições, os íons férricos (Fe3+) passam a atuar como agente oxidante e agem diretamente na pirita gerando mais acidez e íons ferrosos (Fe2+) na solução como mostra a equação (5). Como conseqüência, a oxidação da pirita ocorrerá mesmo não havendo mais oferta de oxigênio (Evangelou 1995).
FeS2 + 14 Fe3+ + 8 H2O 15 Fe2+ + 2 SO42+ +16 H+ (5) Os íons ferrosos (Fe2+) resultantes da oxidação direta da pirita pelo íon férrico (Fe3+) podem ser oxidados pelo oxigênio que passa a ter um papel indireto na oxidação conforme equação (2), formando um ciclo de geração ácida. Para valores de pH próximos de 3, a taxa de oxidação do Fe2+ a Fe3+ é extremamente lenta. No entanto, nestas condições, tal reação é catalisada por bactérias como
Thiobacillus ferrooxidans que podem acelerar a taxa de reação numa ordem de 106 (Evangelou 1995).
ferroso (b), pois a oxidação da pirita pelo oxigênio (a) não é mais tão significativa. O precipitado de hidróxido férrico depositado funciona como um reservatório de Fe3+ (d). Se a regeneração do Fe3+ pela reação b for interrompida, a concentração deste íon diminui em solução. Caso ocorra dissolução do hidróxido de ferro, o Fe3+ será liberado novamente para oxidar a pirita (Stumm & Morgan 1981).
Figura 2.2 - Modelo para oxidação da pirita (modificado de Stumm & Morgan 1981).
Quanto à cinética das reações de oxidação da pirita, um estudo realizado por Nordstrom (1982) revelou que a baixos valores de pH (menores do que 4,5) a pirita é oxidada por Fe3+ (equação 5) muito mais rapidamente do que pelo O2 (equação 1) e ainda mais rapidamente do que a oxidação de Fe2+ por O2 (equação2). Por essa razão, esta última reação expressa pela equação (2) é conhecida como a reação limitante do processo. A figura 2.3 descreve a variação da constante de taxa de reação (k) em função do pH para as equações 1, 2 e 5.
Figura 2.3 - Comparação das constantes de taxa de reação em função do pH. Para a equação 5, oxidação da pirita pelo Fe3+; equação 2, oxidação de Fe2+ por O2; e equação 1, oxidação da pirita por O2 (Nordstrom 1982).
Equaçã o 5
Equaç ão 2
Equaç ão 1
pH log k (1/dia )
FeS2(s) + O2 SO42- + Fe2+
Fe2+ + S2
2-+ O2 (a’)
+ O2 + FeS
2(s)
Fe3+ Fe(OH)3(s) (a)
(c) (b)
(d)
L
L
EENNTTAAR
Através do gráfico é possível observar também um aumento na velocidade específica (ou taxa de reação) da equação (2) em valores de pH neutro e alcalino. Nestas condições dois fatos podem ser levantados: ocorre uma diminuição da concentração de Fe3+ devido à precipitação de hidróxido férrico e a participação das bactérias é muito pequena. Com isto, alguns pesquisadores sugerem que em condições de pH neutro o O2 é o principal oxidante da pirita (Evangelou 1995, Singer & Stumm 1970). No entanto, outros estudos mostraram que o Fe3+ também pode ser um efetivo agente oxidante em soluções com pH próximo da neutralidade, embora esta reação não seja duradoura na ausência de O2. A presença de O2 é necessária para que ocorra a oxidação de Fe2+ a Fe3+ (Moses et al. 1987, Luther 1987).
De acordo com Luther (1987) uma maior taxa de velocidade da oxidação da pirita pelo Fe3+ pode estar relacionada com o fato do Fe3+ atacar quimicamente a superfície da pirita diferente do O2. Na oxidação pelo O2 ocorre uma adsorção pela superfície da pirita caracterizando um processo físico (Goldhaber 1983, McKibben & Barnes 1986). Além disso, a maior taxa de oxidação para o Fe3+ se deve a uma transferência de elétrons mais efetiva. Essas diferenças de ligação podem ser explicadas por um modelo baseado na Teoria do Orbital Molecular de Fronteira proposto por Luther (1987) que é consistente com dados experimentais obtidos por McKibben & Barnes (1986), Moses et al. (1987) e Wiersma & Rimstidt (1984).
Há na literatura uma grande variedade de fórmulas empíricas descrevendo a taxa de dissolução da pirita [R (mol.m-2.s-1)] em soluções contendo oxigênio dissolvido e Fe3+. Esta variedade se deve a vários fatores, como as diferenças nas preparações das amostras; diferentes razões de área superficial e volume; e a presença de impurezas na pirita ou na solução (Blowes et. al 2003). Os estudos conduzidos para esse fim mostraram que, independente do mecanismo considerado, a alta energia de ativação observada está relacionada com transferência de elétrons na superfície da pirita (Garrels & Thompson 1960, Mathews & Robins 1972, 1974, McKibben & Barnes 1986, Williamson & Rimstidt 1994 e Holmes & Crundwell 2000).
2.5 – ASPECTOS MICROBIOLÓGICOS DA DAM
tolerantes em condições ambientais rigorosas (elevada acidez, alta concentração de metais, etc) (Blowes et al. 2003).
Os gêneros Thiobacillus, Acidithiobacillus e Leptospirillum contêm numerosas espécies que podem utilizar vários compostos de enxofre como substrato. Este grupo é responsável pela oxidação de sulfetos em ambientes com disponibilidade de oxigênio e fonte abundante de enxofre, agindo como catalisador das reações de oxidação (Blowes et al. 2003).
A bactéria da espécie Acidithiobacillus ferrooxidans (antigamente chamada de Thiobacillus
ferrooxidans) é a principal responsável pela catálise de reações nos processos de produção da DAM.
Trata-se de uma bactéria capaz de utilizar o íon ferroso (Fe2+), enxofre (S0) ou minerais sulfetados como fonte de energia para a sua atividade metabólica. Mais especificamente, estas bactérias atuam no processo de geração de DAM como catalisadoras da reação representada pela equação 2. Elas obtêm energia na conversão de íon ferroso (Fe2+) a íon férrico (Fe3+) e tem sua atuação otimizada em valores de pH menores do que 3,5 (Blowes et al. 2003, Evangelou 1995).
Outra bactéria também conhecida em ambientes com presença de DAM é a Acidithiobacillus
thiooxidans, antigamente conhecida como Thiobacillus thiooxidans. Esta bactéria catalisa a oxidação
de enxofre (S0), tiossulfato (S2O32-) e tetrationato (S4O62-) a ácido sulfúrico, mas não tem capacidade de oxidar o íon ferroso (Fe2+) (Blowes et al. 2003).
Tanto a A. ferrooxidans como a A. thiooxidans são acidófilas e podem tolerar valores de pH na faixa de 1,5 a 6,0. No entanto, têm um ótimo crescimento em valores de pH entre 2,0 e 2,5 e em temperaturas entre 15oC e 35oC (Blowes et al. 2003).
A bactéria Leptospirillum ferroxidans ocorre em ambientes semelhantes a A. ferrooxidans, mas é mais tolerante a valores extremos de temperatura e pH. É metabolicamente semelhante a A.
ferrooxidans, mas morfologicamente diferente e apresenta uma maior atividade em valores de pH de
1,5 a 2,1. Esta bactéria não tem a capacidade de oxidar compostos de enxofre, preferindo a oxidação seletiva do íon ferroso (Fe2+) (Blowes et al. 2003).
Outras bactérias também participam da geração de DAM, como por exemplo, as várias espécies do gênero Thiobacillus, que oxidam compostos de enxofre em valores de pH próximos da neutralidade. Dentre elas podemos citar a mesófila Thiobacillus thioparus com pH ótimo na faixa de 6,0 a 8,0 e pode oxidar minerais sulfetados, tiossulfato (S2O32-) além de outras espécies de enxofre (H2S, S0, S4O62-) (Blowes et al. 2003).
sulfetado onde a bactéria age diretamente na superfície do mineral e a solubilização do mineral ocorre através de reações diretas de oxidação enzimática. Por essa via a oxidação dos compostos de enxofre a sulfato se dá sem a produção de compostos intermediários. Já o mecanismo indireto não requer contato físico e, portanto as bactérias não atuam na superfície do mineral. Neste caso, elas participam como catalisadores das reações de oxidação que ocorrem próximas a superfície do mineral. Os produtos dessas reações agem na superfície do mineral promovendo a oxidação de Fe2+ e enxofre dissolvidos que foram previamente gerados por processos oxidativos químicos. Então, esses compostos presentes na superfície do mineral são biologicamente oxidados a íon férrico (Fe3+) e sulfato (Blowes et al.
2003, Sand et al. 2001, Evagelou 1995).
As etapas dos mecanismos na oxidação biológica de minerais sulfetados vêm sendo extensivamente estudada devido à sua grande importância, principalmente para ensaios de biolixiviação e na prevenção da DAM (Sand et al. 2001; Tributsch & Bennett 1981a, b; Tributsch 2001; Banfield & Welch 2000; Edwards et al. 2000).
Figura 2.4 - Comparação dos mecanismos de oxidação biológica em sulfeto de ferro; mecanismos direto e indireto (Sand et al. 2001).
2.6 – REAÇÕES DE NEUTRALIZAÇÃO
Acidez e alcalinidade da água são importantes parâmetros no que diz respeito à produção e controle da DAM. A alcalinidade pode ser definida como a capacidade da água em neutralizar ácidos, sendo uma conseqüência direta, principalmente, da presença ou ausência dos íons hidroxila (OH-), carbonato (CO32-) e bicarbonato (HCO3-). A principal fonte de espécies provenientes do dióxido de carbono que são responsáveis pela alcalinidade natural da água está relacionada à com a dissolução do dióxido de carbono atmosférico. A alcalinidade também pode ser influenciada pela presença de boratos (BO42-), fosfatos (PO42-) e silicatos (SiO42-) (Hem 1985).
M
MEECCAANNIISSMMOO
D
DIIRREETTOO
M
MEECCAANNIISSMMOO
I
INNDDIIRREETTOO
O2
CO2
CO2
O2
Fe3+
SO4
2-Fe3+
SO4
2-Fe2+
Sulfeto