Donwstream Processing – Recuperação e Purificação de
Produtos Biotecnológicos
21.1 – Introdução
Neste capítulo serão descritas as operações unitárias típicas, que sucedem o cultivo microbiano com a finalidade de purificar o produto. A
diversidade e crescente importância apresentada pelos produtos
biotecnológicos incentivou o desenvolvimento de vários processos de purificação, bem como estimulou a introdução de modificações genéticas no desenvolvimento do microrganismo, com o objetivo de aumentar a resolução na purificação, integrando totalmente as etapas de desenvolvimento do processo.
Os produtos da indústria biotecnológica são altamente diversificados (ácidos orgânicos, antibióticos, polissacarídeos, hormônios, aminoácidos, peptídeos e proteínas), bem como sua localização em relação à célula. Como resultado dessa diversidade, não há processos de purificação de aplicação geral. Entretanto, o processo pode ser dividido em quatro etapas principais: separação de células e seus fragmentos do meio de cultivo (clarificação); concentração e/ou purificação de baixa resolução, a qual compreende a separação da molécula alvo, por exemplo uma proteína, em relação a moléculas com características físico-químicas significativamente diferentes (água, íons, pigmentos, ácidos nucléicos, polissacarídeos e lipídeos); purifi-cação de alta resolução, a qual compreende a separação de classes de moléculas com algumas características físico-químicas semelhantes, como por exemplo proteínas; e, finalmente, operações para acondicionamento final do produto. Além disso, para produtos associados às células, é necessário efetuar o rompimento celular, processo que é efetuado sobre o adensado de células obtido após a clarificação do meio de cultivo.
A efetivação de cada etapa não necessariamente compreende a aplicação de uma única operação unitária. Por exemplo, após uma precipitação por adição de um sal, é necessária uma diálise para ajuste da força iônica a valores adequados a uma cromatografia de troca iônica. Por outro lado, há produtos (ácidos orgânicos, enzimas industriais) cuja aplicação não requer elevado grau de pureza, de modo que operações cromatográficas não são necessárias. Todavia, a redução do número de etapas é de fundamental importância na viabilidade do processo. Por exemplo, se a cada operação unitária o rendimento em produto for de 90%, a aplicação de nove operações levará a um rendimento final de cerca de 40%.
21.2 – Clarificação
A separação de células suspensas de um meio de cultivo é frequentemente a primeira operação unitária do processo de purificação. O meio resultante, isento de células, é denominado clarificado ou filtrado. Serão descrito as aqui algumas operações unitárias de clarificação viáveis em escala industrial: filtração convencional, filtração tangencial e centrifugação.
A Figura 21.1 apresenta a faixa de dimensão da partícula a ser removida e a respectiva operaçao unitária adequada.
21.2.1 – Filtração
A filtração convencional aplica-se à clarificação de grandes volumes de suspensões diluídas de células, da ordem de milhares de litros, produtos extracelulares e situações nas quais a assepsia não é necessária.
A suspensão, sob pressão, é perpendicularmente direcionada a um meio filtrante. A fração volumétrica que atravessa o meio filtrante é denominada filtrado, e da contínua deposição das células sobre o meio filtrante, resulta a formação de um torta de filtração.
onde:
z= velocidade do líquido (m/s) K = permeabilidade do leito (m2)
∆P = diferença de pressão atravéés do leito (N/m2) l = espessura do leito (m)
µ = viscosidade do líquido (kg/m.s)
l/K = resistência do leito de filtracão
A velocidade do líquido que permeia o meio filtrante pode ser determinada pela eq. 21.2:
(21.2) onde:
A = área de filtração (m2)
V = volume de filtrado (L) t = tempo de filtração (s)
21.2.2 - Centrifugação
Células em suspensão em um meio líquido sofrem sedimentação por ação da força da gravidade, processo denominado sedimentação. A centrifugação compreende a aceleração dessa sedimentação, por ação de um campo gravitacional centrífugo.
Suspensões de células que não podem ser tratadas com auxiliares de filtração (por exemplo, quando o produto está associado às células), ou nas quais a assepsia deve ser preservada, podem ser clarificadas através da centrifugação.
Da centrifugação resultam suspensões mais concentradas em relação à original, enquanto que a filtração dá origem a uma torta relativamente seca, o que constitui vantagem desta última operação unitária em relação à centrifugação.
A centrifugação baseia-se na diferença de densidade entre a célula (ρc) e
o meio líquido (ρ), na viscosidade do meio líquido (µ), na força motriz [dada
pelo produto entre o quadrado da rotação angular (ω -rad/s) e a distância
radial desde o centro da centrífuga até a célula (r)] e no diâmetro da partícula,
d, de acordo com a eq. 21.7, onde vc, representa a velocidade da célula
no campo centrífugo.2
(21.7)
A razão entre a força motriz, ω2r, e a aceleração padrão da gravidade, g,
representa um múltiplo desta última e é dada pela eq. 21.8. FC representa,
portanto, o incremento da força da ação da gravidade na sedimentação forçada em um campo centrífugo.
(21.8)
O valor da variável FC deve ser mencionado na caracterização de uma
centrifugação, juntamente com o tempo adotado para se obter um determinado grau de clarificação. Por exemplo, para a centrifugação de leveduras, valores da ordem de 3.000 x g e alguns minutos são suficientes à completa sedimentação
das células.
Na clarificação de suspensões microbianas, é comum a utilização de centrífugas tubulares e centrífugas de discos (Fig. 21.3). As primeiras podem operar sob refrigeração e com valores de FC bastante elevados, da ordem de
13.000 a 17.000 x g, embora sua capacidade seja limitada a algumas dezenas de litros e a operação seja descontínua. As centrífugas de discos, embora operem sob valores menores de FC, de 5.000 a 15.000 x g permitem
processamento contínuo de até 200 m3/h. A inclusão dos discos aumenta a área
Um critério qualitativo simples pode ser utilizado no projeto da operação de centrifugação em escala industrial. Baseia-se na manutenção do valor do produto entre FC (eq. 21.8) e o tempo (t)2.
Manter o valor do produto FCt significa operar a centrífuga industrial sob
valor de FC e tempo, tal que o produto entre as mesmas não seja alterado. Por
exemplo, se 3.000 x g durante cinco minutos são suficientes para a obtenção de
um sedimento compacto e um sobrenadante de turbidez aceitável, 1.500 x g
durante dez minutos, na centrífuga industrial, deverão resultar um sobrenadante e um sedimento de mesmas características em relação àquele obtido em laboratório.
A clarificação de suspensões de leveduras por centrifugação é eficientemente realizada, enquanto que para bactérias a reduzida dimensão das partículas exige valores de FC significativamente maiores e, portanto, recomenda-se uma
21.2.3 - Filtração tangencial
Filtração tangencial é o termo empregado para definir os processos de microfiltração nos quais o fluido de alimentação escoa tangencialmente à superfície do meio filtrante. Nesses processos a tensão de cisalhamento do fluido minimiza o acúmulo de células e seus fragmentos na superfície das membranas.' ^'
O desempenho de uma filtração tangencial é, em geral, caracterizado por duas variáveis: fluxo de filtrado e coeficiente de retenção de sólidos em suspen-são ou solutos. O fluxo de filtrado (J) varia de 50 a 100 L/h.m2 e é definido pela
equação 21.9:
J = Qf/A
onde: Qf = vazão de filtrado (L/h)
A = área da membrana (m2)
A determinação do coeficiente de retenção de solutos ou sólidos R é dada pela eq. 21.10.
R = 1 – (Cf/Cr)
onde: Cf = concentração de solutos ou sólidos no filtrado
Cr.= concentração de solutos ou sólidos no retido
O fluxo de filtrado e o coeficiente de retenção de solutos ou sólidos são influenciados pelos fenômenos de concentração de polarização (formação de um gradiente de concentração de células ou solutos próximos à superfície da membrana) e "fouling" (bloqueio ou estreitamento dos poros da membrana resultante da deposição de solutos no interior do meio filtrante). O fenômeno do "fouling" não é reversível com uma simples alteração das condições de operação do processo, como por exemplo o aumento da uelocidade tangencial, da pressão ou a uariação do pH. No caso da concentração de polarização, essas alterações no processo podem resolver o problema. Os efeitos da concentração de polarização e do "fouling" podem ser minimizados, quando se conduz a filtração a uma velocidade de escoamento da suspensão (y) da ordem de 0,2 a 0,5 m/s para filtros de placas, de 2 a 5 m/s para filtros tubulares e a uma pressão de transmembrana (PTM) na faixa de 100 a 500kPa.
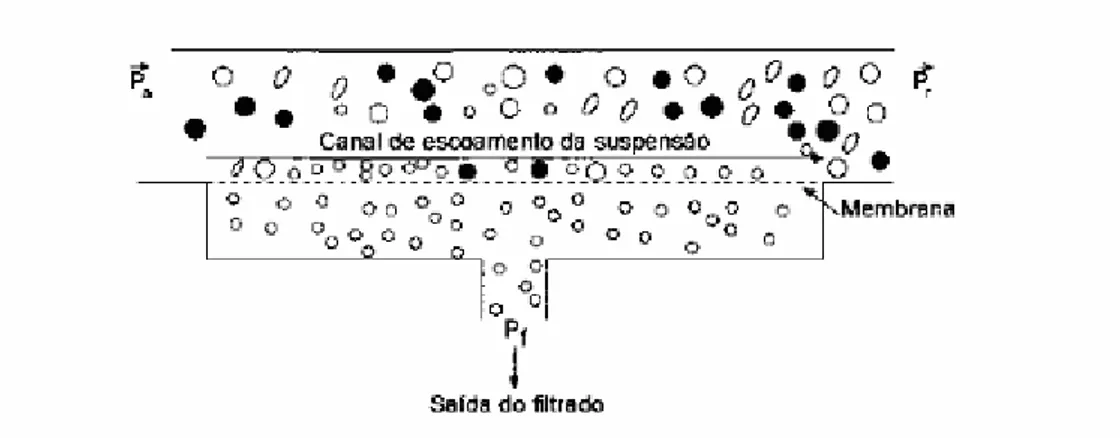
A velocidade de escoamento da suspensão, ve, e a pressão de
transmembrana são definidas pelas eqs. 21.11 e 21.12 e representadas pela Figura 21.4.
ve = Ɵa/At (21.11)
onde: Ɵa = vazão de alimentação do meio (m3/h)
At = área da seção transversal do canal de escoamento da suspensão
(m2)
PTM = [(Pa + Pr)/2] - Pf (21.12)
onde: Pa = pressão de alimentação (N/m2)
Pr = pressão do retido (N/m2)
Figura 21.4 Esquema de uma filtração tangencial.
Os fenômenos de "fouling" e concentração de polarização aumentam a resistência à passagem do fluxo de filtrado pela membrana, que então é representada pela eq. 21.13.
J = P T M / [ µ(Rm +Rcp +Rf)] (21.13)
onde: µ = viscosidade do fluido de alimentação
Rm = resistência da membrana
Rcp = resistência devido à concentração de polarização
Rf = resistência devido ao "fouling"
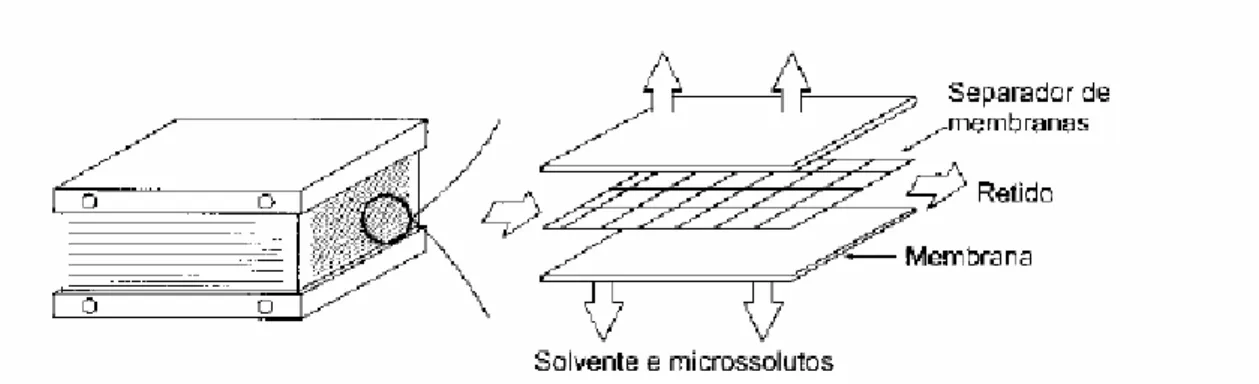
Uma grande variedade de membranas e equipamentos para filtração tangencial está disponível no mercado. A escolha da membrana e do filtro mais adequado vai depender do material a ser filtrado e do processo global de purificação. As membranas são fabricadas, em geral, na forma de tubos constituídos por fibras ocas ou tubos paralelos concêntricos (Fig. 21.5) ou de placas (Fig. 21.6). Os filtros com membranas do tipo fibras ocas, assim como os do tipo placa e quadro, possuem uma elevada área filtrante por unidade de volume do filtro, porém são bastante suscetíveis a entupimentos. Os filtros com membranas de tubos paralelos concêntricos, possuem pequena área filtrante por unidade de volume, porém podem ser operados em regime turbulento e são de limpeza fácil.
Figura 21.6 - Filtro tipo placa e quadro
As variáveis de um processo de filtração são as mesmas em qualquer escala. Portanto, a partir de estudos realizados em laboratório, obtém-se a velocidade tangencial de alimentação, a pressão de transmembrana e a capacidade de filtração (J). Após definidas essas condições de trabalho, poderá ser feita a ampliação de escala em função do volume a ser processado. O processo de filtração tangencial pode ser conduzido utilizando-se um ou mais filtros. No caso de utilizando-ser utilizado somente um filtro, é necessário instalar um sistema de recirculação quando se desejar um retido mais concentrado. Para os sistemas constituídos por mais de um filtro, o sistema pode ser configurado em série ou em paralelo.
21.3 - Rompimento de células microbianas
Produtos associados às células requerem o rompimento ou a permeabilização destas através de operações conduzidas sobre o adensado obtido após a clarificação.3, 10, 11, 12 O rompimento para a recuperação de
produtos termolábeis ou sujeitos a ação de proteases deve ser conduzido rapidamente e em baixas temperaturas.
Os métodos de rompimento celular podem ser classificados como: mecânicos (homogeneizador de alta pressão, moinho de bolas, ultrassom), não mecânicos (choque osmótico, congelamento e descongelamento, secagem); químicos (álcalis, solventes, detergentes e ácidos) e enzimáticos (lise enzimática ou inibição da síntese da parede celular).11
Para se definir o processo de rompimento a ser empregado, alguns fatores são levados em consideração, como: rendimento, especificidade, necessidade de controle de temperatura, custo da operação unitária e capital investido.10
21.3.1 - Métodos enzimáticos
Métodos enzimáticos de rompimento de células são adequados para a recuperação de biomoléculas sensíveis à tensão de cisalhamento ou pressão de trabalho geradas pelos métodos mecânicos. As enzimas são capazes de hidrolisar paredes celulares de células microbianas. Quando uma certa quantidade de parede é removida, a pressão osmótica interna rompe a membrana citoplasmática, permitindo que o conteúdo intracelular seja liberado para o meio externo. As paredes celulares de leveduras são muito diferentes das bactérias, e portanto, os sistemas líticos são específicos para cada grupo particular de microrganismo. As paredes celulares de leveduras possuem duas camadas principais (Fig. 21.7), sendo uma camada externa do complexo proteína-manana e uma interna de glucana. O sistema enzimático para o rompimento de leveduras é composto, portanto, de diferentes enzimas como glucanases, proteases e mananases. Elas atuam sinergisticamente na lise da parede celular, mas somente duas delas são essenciais para o rompimento completo da célula: uma protease para degradar a camada externa de proteína-manana e uma glucanase para degradar a camada interna de glucana.
A composição das paredes celulares das bactérias varia com o fato de elas serem gram-positivas ou gram- negativas. Nas bactérias gram-positivas os peptidioglicanos estão em maior proporção na parede e estão associados com ácidos teicóicos e polïssacarídeos. As bactérias gram-negativas têm uma parede celular de dupla camada, composta por peptidioglicano, proteínas, fosfolipídeos, lipoproteínas e lipopolissacarídeos. As principais enzimas
bacteriolíticas são: glicosidases, acetilmuramilalanina amidases,
endopeptidases e proteases.
Algumas vantagens desse tipo de rompimento são: facilidade no controle do pH e temperatura, baixo investimento de capital e alta especificidade para degradação da parede celular. As principais desvantagens são: o alto custo das enzimas e a variação da eficiência da lise enzimática com o estado fisiológico do microrganismo.1,3,8,70
21.3.2 - Métodos mecânicos
danificar proteínas. Nesse tipo de rompimento as células maiores rompem-se mais facilmente, assim como pressões mais elevadas aumentam a eficiência de rompimento. Pressões de 5.000 a 20.000 psi e velocidades de alimentação na faixa de 180 a 280 m/s são comumente utilizadas para o rompimento celular. O processo conduzido a pressões elevadas proporciona altos rendimentos de recuperação, com somente uma etapa do processo. No entanto, rompimentos em múltiplas etapas podem ser utilizados para aumentar o rendimento do processo.8,10
Vários fatores operacionais afetam o desempenho de um homogeneizador de alta pressão: pressão de operação, temperatura, fase de crescimento do microrganismo, condições de cultivo, tipo de célula e concentração celular.3,12
Um modelo matemático de primeira ordem (eq. 21.14), representa a variação da eficiência desse processo de rompimento em função do número de passagens (n) através da válvula do homogeneizador e da pressão (∆P),
fixadas as condições de operação como temperatura e tipo de célula.
log [Rm / (Rm – R)] = k (∆P)a n (21.14)
onde: Rm = concentração máxima de proteína disponível para ser liberada
(g/L)
R = concentração de proteína liberada (g/L)
k = constante de velocidade que depende da temperatura, da
concentração e do tipo de célula (I /min)
a = constante que é função do tipo de célula e das condições de crescimento (varia de 0,86 a 2,9).3,12
Na ampliação de escala do processo de rompimento celular em homogeneizador de alta pressão, alguns parâmetros devem permanecer constantes: velocidade de alimentação, pressão e temperatura de operação, número de passagens através da válvula do homogeneizador, viscosidade e concentração celular da alimentação.
21.4 - Precipitação
A precipitação de produtos microbianos em meios aquosos é um dos método mais tradicionais de concentração e purificação.
Proteínas precipitadas têm sua estrutura tridimensional modificada. Trata-se, portanto, de método agressivo para essas moléculas, pois sua função bioquímica depende da estrutura. A aplicação desse método somente é viável, portanto, quando a adequada conformação da proteína é recuperada após a precipitação.
À precipitação de proteínas em altas concentrações salinas dá-se o nome de "salting-out". A adição de sais a concentrações de 1,5 a 3,0 M reduz a disponibilidade de água, devido a hidratação dos íons adicionados. Em conseqüência, reduz-se a disponibilidade de moléculas de água que circundam as zonas hidrófobas da superfície da proteína, criando-se condições para a precipitação, a qual ocorre principalmente por interação entre zonas hidrófobas de moléculas de proteína.
Uma descrição quantitativa clássica do "salting-out" é dada pelo modelo de COHN 14 (eq. 21.15), no qual o parâmetro ( 3 é uma constante que
representa a solubilidade da proteína em um sistema com força iônica zero, e é função do tipo da proteína, pH e temperatura, com valor mínimo no ponto isoelétrico. O parâmetro KS é chamado constante de "salting-out" e é função
do tipo de agente de precipitação e da proteína, sendo independente do valor do pH e da temperatura.
l o g S =β- KS ( I ) ( 2 1 . 1 5 )
onde: S = solubilidade da proteína (M) I = força iônica do meio (M)
β = constante que representa a solubilidade da proteína quando I é zero (M)
KS = constante de'salting-out"
Misturas de diferentes proteínas não obedecem a essa equação, já que a solubilidade de uma determinada proteína é reduzida pelas demais moléculas. Ocorre então a co-precipitação, ou seja, a agregação de diferentes proteínas.
Os sais mais adequados são aqueles que apresentam elevada solubilidade, aumentam a tensão superficial do solvente, resultando menor nível de hidratação das zonas hidrófobas e, portanto, aumentam a probabilidade de interação entre estas zonas. São os sais mais empregados: citrato de sódio, sulfato de sódio e sulfato de amônio.
Vários solventes orgânicos miscíveis em água, particularmente os álcoois e a acetona, promovem a precipitação de proteínas. O principal efeito é a redução da atividade da água pela diminuição da constante dielétrica do meio (Fig. 2 1 . 9 ) .
As conseqüências da redução da constante dielétrica podem ser descritas da seguinte forma: imobilização parcial das moléculas de água através da hidratação do grupo polar (hidroxila) do solvente orgânico, com simultâneo deslocamento das moléculas de água das zonas hidrofílicas e, conseqüentemente, redução da densidade da camada de hidratação e da parcela de solubilidade conferida por estas zonas.
O solvente afasta a camada de hidratação que se localiza próxima às zonas hidrófobas e passa a circundá-las, devido à maior solubilidade destas em meio ao solvente. Esse tipo de interação do solvente com as zonas hidrófobas internas causa alteração irreversível da conformação da proteína. A redução da temperatura até valores da ordem de 0°C ou menores, minimiza esse efeito, pois a flexibilidade da molécula é menor, o que reduz a capacidade de penetração do solvente. Entretanto, em temperaturas altas, a molécula protéica possui uma flexibilidade natural e permite o contato do solvente com os resíduos internos hidrófobos da proteína, causando desnaturação.
A precipitação da enzima amitoglicosidase produzida por Aspergillus awamori em cultivo submerso, por ação de etanol (60%v/v) promoveu aumento
de 67% da atividade específica (razão entre a atividade enzimática e a concentração de proteína total), o que significa que houve real purificação da enzima. Recuperação de 100% da atividade enzimática foi obtida quando a temperatura foi controlada em 5°C. 1,5
Uma vantagem significativa do uso de solventes é a redução da densidade do meio líquido, o que favorece a sedimentação do precipitado, podendo-se eliminar inclusive a necessidade do uso de uma centrífuga.
Na precipitação por ação de solventes, o parâmetro crítico na ampliação de escala do processo é o controle da transferência de calor. Perdas no rendimento e na qualidade final do produto são freqüentemente verificadas. O processo contínuo, em reatores do tipo CSTR ou de fluxo pistonado, pode apresentar vantagens no controle desses parâmetros, resultando um fracionamento mais preciso e redução de perdas por desnaturação.
Já na precipitação por "salting-out", as características do precipitado são o fator fundamental para a adequada ampliação de escala do processo. Nesse caso, manter constante a potência transmitida por unidade de volume durante a agitação e o tempo do processo, é recomendável. O objetivo é não modificar a tensão de cisalhamento imposta, de modo a obter agregados de precipitados de densidade e tamanho constantes.
21.5 - Ultrafiltração
A ultrafiltração consiste no transporte de soluções através de membranas com poros de diâmetros de 0,001 a 0,1 µm, sob pressão de transmembrana de 100 a 500 kPa e fluxo de filtrado de 10 a 200 L/hm2, e são usadas para
concentrar macromoléculas como proteínas ou polissacarídeos. Nesse processo, a água e outras moléculas pequenas (menores que os diâmetros dos poros) passam pela membrana, enquanto que moléculas com tamanhos superiores ao diâmetro nominal de corte do poro da membrana ("cut-off") ficam retidas. "Diâmetro nominal de corte" é a melhor forma de expressar o tamanho do poro de uma membrana de ultrafiltração. Ele é definido corno a massa molecular mínima de uma molécula globular que é retida pela membrana.
Os tamanhos dos poros das membranas de ultrafiltração não são uniformes e apresentam uma distribuiçãu normal ao redor do tamanho médio do poro. A faixa dessa distribuição varia de acordo com o método de fabricação da membrana e, também, entre fabricantes. Por isto, o "cut-off" da membrana a ser utilizada deve ser 20% menor que a massa molecular da proteína alvo.5
Concentrar proteínas por ultrafiltraçào tem várias vantagens, a saber: separar bioprodutos de caldos fermentados diluídos, promover a concentração de compostos a baixa temperatura e pressão, possibilitar a retirada de sais e outras moléculas pequenas e manter constante o pH do meio.
A ultrafiltração pode também ser aplicada para a purificação de proteínas de acordo com o tamanho das moléculas. Apesar de ser um método atrativo de purificação, na prática a resolução da técnica é baixa. Isso ocorre porque a distribuição do tamanho dos poros não é uniforme, as moléculas lineares passam mais facilmente pela membrana que as globulares e a concentração de polarização e o "fouling" reduzem o "cut-off" da membrana.:1
21.6 - Extração em sistemas de duas fases aquosas
A extração de biomoléculas em sistemas de duas fases líquidas imiscíveis, constituídas de uma fase aquosa e um solvente, é utilizada há cerca de 60 anos na purificação de antibióticos e ácidos orgânicos.
Proteínas, altamente sensíveis à desnaturação, podem ser purificadas em sistemas constituídos por duas fases aquosas imiscíveis (SDFA), em decorrência de uma partição diferenciada da molécula alvo e impurezas entre as fases líquidas. O elevado teor de água, 75 a 80% em massa, garante a manutenção das propriedades biológicas das proteínas. Em 1956, ALBERTSSON17 propos o uso do SDFA para a purificação de proteínas e
partículas de células. Desde então, a extração em SDFA tem sido aplicada à purificação de produtos obtidos em células animais, vegetais e microbianas, na separação de vírus, organelas e ácidos nucléicos.
Nos sistemas de duas fases aquosas, molécula alvo e impurezas são separadas, como resultado de suas diferentes solubilidades nas fases líquidas. São fatores decisivos as propriedades superficiais das proteínas, como carga elétrica e hidrofobicidade, além da massa molecular.
Embora sejam intervalos de tempo bastante reduzidos, a separação das fases usualmente é acelerada através do uso de centrífugas.
A configuração física geral é a de uma fase estacionária (matriz) empacotada em uma coluna, através da qual a fase móvel é bombeada. A fase estacionária é constituída por um polímero, que se apresenta em partículas esféricas de aproximadamente 100 µm, embebidas em solvente, o qual constitui a maior parte desta fase (aproximadamente 90%), portanto denominada gel.
Um cromatograma é um gráfico que representa a concentração das moléculas no eluente que sai da coluna, medida em termos de absorbância por exemplo, em função do tempo ou do volume de eluente que passou pela coluna. O volume que passa pela coluna até o instante de saída de uma certa molécula (instante este representado por uma curva ou pico no cromatograma) é o volume de retenção, V, específico daquela molécula. Alternativamente ao volume de retenção, utiliza-se o tempo de retenção, tr, representado nas Figuras
27.11 e 21.12.
Na Figura 21.12 representam-se algumas grandezas utilizadas na avaliação do desempenho de processos cromatográficos. A concentração das moléculas A, B e C é determinada mediante a comparação do valor da área embaixo das respectivas curvas, com uma curva de calibração obtida com a molécula pura.
A eficiência da purificação pode ser avaliada em função do grau de
separação das moléculas, o qual é denominado resolução
cromatográfica, RS. Na separação de duas moléculas, A e B, RS é
determinado pelos valores dos tempos de retenção e pela grandeza Wb
Para valores de RS < 1 as moléculas são incompletamente
separadas; valores de RS iguais a 1, as curvas se tocam nas bases
(situação das moléculas A e B na Fig. 21.12); e para valores de Rs > 1 as duas moléculas encontram-se totalmente separadas, situação representada na Figura 21.12 para as moléculas B e C.
A seguir, descrevem-se os processos cromatográficos industrialmente mais utilizados, quais sejam, a gel filtração, baseada na separação de moléculas em função do volume efetivo em solução, e a troca icmica, baseada na adsorção das moléculas sobre o leito cromatogràfico. Processos como a interação hidrofóbica (baseada na adsorção de zonas hidrófobas de proteínas sobre hidrocarbonetos covalentemente ligados ao leito cromatográfico) e a cromatografia de afinidade-' (baseada em interaçôes
genéricas entre determinados resíduos de aminoácidos e ligantes associados à matriz ou, interações bioquímicas específicas) vêm ganhando cada vez mais uso e, portanto, também devem ser considerados no desenvolvimento de um processo de purificação.
21.7.1 - Gel filtração
As diferentes biomoléculas são inicialmente retidas nos poros de uma matriz de porosidade definida, em função de seu Volume efetivo na solução. Moléculas cujo volume efetivo excede o volume do poro, são expulsas da
co-luna no chamado Volume espacial, Vt, o qual representa o volume de eluente
presente nos interstícios da matriz. Em contrapartida, moléculas pequenas em relação ao volume dos poros, penetram nos mesmos e em seguida são arrastadas pelo eluente, o qual é uma solução tampão adequada à manutenção da estabilidade da molécula alvo. Em decorrência desse comportamento, a ordem de recuperação seletiva das moléculas no fluxo eluente tem início com as maiores moléculas, prosseguindo em direção às menores. As diferentes moléculas sio, portanto, excluídas do leito em função de seu tamanho ou volurne efetivo.
Condições que resultem exclusão da proteína de interesse e retenção das impurezas (ou vice-versa), são as mais apropriadas. Essas situações pressupõem diferenças significativas entre o volume efetivo da molécula alvo e impurezas, o que nem sempre ocorre, resultando na prática a necessidade de coleta de frações volumétricas específicas.
Há vários modelos na literatura que descrevem o mecanismo de separa-ção na gel filtrasepara-ção em funsepara-ção das dimensões dos poros do gel e tamanho do soluto.
As matrizes para gel filtração de alta resolução são constituídas de polímeros vinílicos hidrofílicos ou agarose com elevada proporção de ligações cruzadas, em partículas de 5 a 50 µm. Aumentos de resolução e reduções do tempo de separação são obtidos com o uso de pequenas partículas.
proteínas. É um processo de separação baseado na afinidade que componentes de uma amostra têm com os sítios iônicos em uma matriz sólida. A fase estacionária, eletricamente carregada, tem a capacidade de reter solutos que estão na fase móvel e apresentam cargas de sinais opostos. Para ocorrer a adsorção dos íons da fase móvel na estacionária, controlam-se fatores como pH e força iônica. Dependendo do grupo trocador ligado covalentemente à matriz, os trocadores iônicos são classificados em aniônicos e catiônicos. Os trocadores aniônicos trocam ânions e apresentam, portanto, grupos iônicos positivos ligados à matriz, enquanto que os trocadores catiônicos, inversamente, trocam cátions e apresentam grupos iônicos negativos ligados à matriz.
Após serem adsorvidos à matriz, os solutos podem ser
subseqüentemente eluídos por deslocamento com outros íons, com a mesma carga da proteína adsorvida, porém com maior força de interação com a fase estacionária. Os diferentes graus de afinidade eletrostática entre o trocador e os íons da fase móvel regem esse tipo de cromatografia.
Esse método tem uma aplicabilidade muito ampla, pois considera-se que todas as proteínas são eletricamente carregadas quando expostas a um determinado pH. Mesmo proteínas com pontos isoelétricos idênticos podem ser separadas de uma mistura, pois o sítio de anexação da proteína à matriz de troca iônica é determinado pela carga superficial da proteína e a sua proximidade de outras cargas e não pela sua carga global.3 É comum
encontrar condições de adsorção da proteína alvo à matriz, enquanto a maioria das impurezas são eluídas.23,24
A matriz de um trocador é constituída de um material poroso, natural ou sintético, inerte, insolúvel em água e em solventes orgânicos, apresentando ligações covalentes a grupos trocadores iônicos. Quanto ao material que as formam, as matrizes são classificadas em inorgânicas e orgânicas, podendo ser naturais ou sintéticas. Em geral as resinas orgânicas são mais eficientes, altamente polimerizadas, com ligações cruzadas e amplamente utilizadas.
A capacidade total de um trocador é medida pela quantidade de grupos carregados na fase móvel, que podem ser trocados por unidade de volume ou massa de matriz. A capacidade ou massa de proteína adsorvida depende do número e do tamanho dos poros da resina. Para uma determinada proteína, a capacidade de adsorção da matriz sólida pode ser determinada somente após ensaios laboratoriais. Poros maiores tornam os sítios carregados mais acessíveis que poros menores, pois facilitam a difusão de proteínas. Nesse caso, o tamanho do poro é normalmente descrito pelo seu limite de exclusão, isto é, a maior proteína globular (medida em daltons) que pode ser absorvida pelo poro."'
Os tipos de grupos ligados à matriz classificam os trocadores iônicos em fortes, médios e fracos. Os trocadores iônicos fortes são aqueles completamente ionizados em grande faixa de pH. Os trocadores iônicos fracos e médios são aqueles em que o grau de dissociação e a capacidade são influenciados pelo pH. Por outro lado, não há diferença se uma resina de troca iônica é fraca ou forte em termos de disponibilidade de cargas. É importante notar que os termos "fraco" e "forte" não se referem à afinidade de ligação da proteína à resina e nem à estabilidade da matriz; eles se referem somente à extensão da dissociação no sentido clássico da química ácido-base.
todas as proteínas remanescentes na coluna e na sua regeneração através da incorporação do íon original.10
Na ampliação de escala de um processo cromatográfico aumenta-se o volume da coluna. Em geral o seu comprimento permanece constante, de tal forma que o aumento do volume do processo implica no aumento do diâmetro da coluna. A velocidade superficial da fase líquida (vazão dividida pela área da seção da coluna) deve ser a mesma nas duas escalas. O grau de resolução cromatográfica e o rendimento do processo são definidos nas colunas de pequena escala. Se todas as outras variáveis são mantidas constantes, o desempenho do processo, em escala ampliada, deverá ser muito próximo àquele obtido em escala de laboratório.
21.8 - Tratamentos finais
O grau de pureza necessário de um produto biotecnológico depende de sua aplicação final. A simples secagem de microrganismos cultivados para produção de proteína celular é suficiente para sua comercialização. Caldos enzimáticos impuros, ou parcialmente purificados, podem ser utilizados como catalisadores em conversões químicas industriais como, por exemplo, na produção de xarope de frutose utilizando a enzima glicose isomerase. No entanto, uma purificação final é necessária para grande parte dos produtos biotecnológicos, especialmente aqueles de uso farmacêutico. Nesse caso os produtos devem estar puros, secos, cristalinos ou amorfos. Para tanto, devem ser submetidos a alguns tratamentos finais como a cristalização ou a liofilização.2
A liofilização é o processo de remoção de um solvente, tipicamente a água, de uma solução por sublimação. Nesse processo o material é congelado e em seguida submetido a baixa pressão para sublimação da água livre. Durante o congelamento, a água transforma-se em gelo, num variado, porém alto grau de pureza e, os solutos são concentrados. Como resultado as propriedades físico-químicas (pH, força iônica, viscosidade, ponto de congelamento, tensão superficial e interfacial) da fase não congelada alteram-se significativamente. Os materiais liofilizados são aprealteram-sentados na forma de pó e as atividades biológicas se mantêm estáveis por muito mais tempo, quando comparada com a conservação em solução aquosa. Por esse motivo, muitas proteínas comerciais estão disponíveis na forma liofilizada. Porém, se a liofilização não for adequadamente planejada pode ocorrer desnaturação de enzimas. Embora seja uma técnica amplamente empregada na conservação de muitos materiais, em sua maioria biológicos, há uma série de fatores envolvidos na liofilização, que devem ser manipulados de forma a obter-se um material de boa qualidade.
que não haverá garantia da inativação de proteases e, ainda, será necessário remover o sal imediatamente antes da reutilização da proteína.2 Outra opção
para a estabilização de proteínas é mantê-las em glicerol, sorbitol ou sacarose na concentração de aproximadamente 50% e estocar a -50°C. Caso a amostra congele, as proteínas serão protegidas dos danos causados pelos cristais de gelo formados.24
21.9 - Rotinas analíticas
A porcentagem de recuperação e o grau de purificação da molécula alvo devem ser monitorados em cada etapa do processo de purificação.
Rotinas que levam à quantificação de uma certa proteína, associadas a volumes, viabilizam a determinação de balanços de massa e, portanto, das porcentagens recuperadas em cada etapa do processo. Uma quantificação indireta é obtida com relativa facilidade, quando a molécula considerada apresenta atividade biológica específica, como por exemplo, atividade enzimática ou antigênica.
A atividade enzimática é por definição a velocidade inicial da reação específica catalisada pela enzima, determinada em condições padronizadas de pH, temperatura, força iônica e concentração do substrato; portanto, condições reprodutíveis. Define-se uma unidade de atividade enzimática como sendo a quantidade de produto liberado ou substrato consumido (µmol) em um minuto nas condições do ensaio. Dessa forma, em cada etapa do processo, determina-se a capacidade biológica da molécula considerada (unidades de atividade enzimática) a qual, associada aos volumes envolvidos, permite determinar a porcentagem recuperada.
O exemplo que segue representa um balanço de atividade enzimática realizado em um processo de extração em sistema de duas fases aquosas, muito embora os princípios adotados neste exemplo, apliquem-se a qualquer outro método de purificação.
Impurezas de massa molecular, significativamente distintas em relação à massa molecular da molécula alvo, podem ser eliminadas por gelfiltração ou ultrafiltração. A massa molecular pode ser estimada de duas formas: através de uma curva de calibração com moléculas de massas moleculares conhecidas no sistema de gel filtração acima mencionado (são variáveis desta curva, a massa molecular das moléculas e o volume de eluição de cada uma delas); injetando-se no gel de eletroforeinjetando-se moléculas de massa molecular conhecida juntamente com as frações obtidas na gel filtração.
Grandes diferenças entre a solubilidade da molécula alvo e impurezas, são um indicativo de que métodos como a extração em sistemas de duas fases aquosas ou precipitação devem ser explorados. Uma forma simples de avaliar a solubilidade de proteínas é submetê-las à precipitação com (NH4)2S04. As
proteínas que demandarem menor concentração do sal para precipitarem totalmente, são as de menor solubilidade. Assim, é possível ordenar as moléculas fracionadas na gel filtração preparativa em uma ordem de solubilidade.
A cromatografia de troca iônica é das mais utilizadas, devido ao elevado poder de resolução e capacidade de processamento. A opção por esta cromatografia obviamente deve considerar a capacidade de adsorção das moléculas sobre uma determinada resina catiônica ou aniônica. Essa capacidade é determinada através de curvas de titulação eletroforética.
em relação ao anodo. As proteínas, por apresentarem caráter anfotérico, terão carga positiva sob valores de pH abaixo de seu ponto isoelétrico e carga negativa sob valores de pH acima do ponto isoelétrico. Dessa forma, onde quer que as proteínas estejam em relação ao gradiente de pH, elas migrarão em direção ao seu ponto isoelétrico em conformidade com sua carga. Proteínas com mobilidades eletroforéticas, isto é, distâncias percorridas, muito diferentes na região de valores de pH abaixo do pI provavelmente sofrerão separação eficiente em uma resina trocadora de cátions.27
21.10 - O processo integrado de purificação
Conforme mencionou-se no início deste capítulo, as etapas iniciais do pro-cesso de purificação compreendem as operações unitárias, destinadas à remoção de células e seus fragmentos e concentração da molécula alvo. A determinação das características do produto e das principais impurezas é fundamental no sucesso da seleção das operações subseqüentes de purificação propriamente dita, uma vez que o fracionamento está baseado nas propriedades físico-químicas das moléculas envolvidas (Tab. 21.2).
Alguns critérios norteiam a escolha das operações de clarificação e homogeneização. Grandes volumes de suspensões de leveduras são eficientemente clarificados por centrifugação, enquanto que para volumes moderados de suspensões bacterianas uma comparação entre a
centrifugação e a filtração tangencial merece ser efetuada.
Microrganismos filamentosos, por outro lado, são clarificados através de filtração convencional, devido à reduzida velocidade de sedimentação destes organismos de baixa densidade.
Por exemplo, um peptídeo humano de ação diurética e hipotensiva, de apenas 2 kda, foi modificado pela introdução da seqüência relativa a uma proteína natural de E, coli, a tioredoxina de 11.700 kDa, e uma seqüência de 6 histidinas em seu gene estrutural, constituindo uma molécula de fusão. A primeira modificação teve por objetivo aumentar o nível de produção intracelular do peptídeo e protegê-lo da ação de proteases; a segunda modificação destina-se a tornar a molécula passível de purificação em processo cromatográfico por afinidade com íons níquel imobilizados na matriz. A molécula foi totalmente purificada unicamente através desse processo, aplicado à fase solúvel das células rompidas.
Após a purificação, foi necessária uma hidrólise efetuada por enzima específica sobre sítio introduzido para este fim (sítio de clivagem), a fim de se obter o peptídeo somente.
A adsorção em leito expandido tem sido cada vez mais adotada, pois possibilita a redução do número de etapas, uma vez que a captura de proteínas se dá a partir de meios que contêm partículas, procedimento que viabiliza a clarificação de uma suspensão ou de um homogeneizado de células e a purificação da molécula alvo em uma única operação. Além disso, a redução do tempo de processamento diminui a possibilidade de hidrólise da molécula alvo por ação de proteases, normalmente presentes quando se trata de produtos intracelulares.
A caracterização prévia do produto e impurezas, descrita no item 21.9, é fundamental à seleção das operações de purificação, pois do reduzido número destas operações dependem o custo do processo e o rendimento do produto.
Além da caracterização das moléculas, também devem ser consideradas características inerentes às operações. Por exemplo, na gel filtração ocorre diluição significativa, isto é, a concentração das moléculas nas frações coletadas é menor que a concentração no meio injetado na coluna. Por essa razão, a gel filtração é empregada na última etapa de um processo de purificação, pois do contrário, acarretaria aumento do volume de meio a ser tratado ao longo do processo. Ao final do processo, pode-se empregar a ultrafiltração para ajuste da concentração. A cromatografia de troca iônica, ao contrário da gel filtração, promove o aumento da concentração das moléculas.