UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Avaliação da expressão da
metaloproteinase de matriz-9 e da
molécula de adesão caderina-E nos
mastocitomas caninos
Dissertação de Mestrado em Medicina Veterinária
Cátia Isabel Ferreira de Sousa
Orientadora: Professora Doutora Justina Maria Prada Oliveira
Co-orientadora: Professora Doutora Isabel Cristina Ribeiro Pires
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Avaliação da expressão da
metaloproteinase de matriz-9 e da
molécula de adesão caderina-E nos
mastocitomas caninos
Dissertação de Mestrado em Medicina Veterinária
Cátia Isabel Ferreira de Sousa
Orientadora: Professora Doutora Justina Maria Prada Oliveira Co-orientadora: Professora Doutora Isabel Cristina Ribeiro PiresComposição do Júri:
______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________
Esta dissertação de mestrado é dedicada aos meus pais, Joaquim Coelho e Carolina Sousa
i
AGRADECIMENTOS
À Universidade de Trás-Os-Montes e Alto Douro (UTAD), na pessoa do Magnífico Reitor, Professor Doutor Carlos Sequeira, pela possibilidade de elaborar esta dissertação de mestrado.
À Professora Doutora Justina Oliveira, por ter aceitado a orientação do presente trabalho, por todos os conhecimentos transmitidos, por toda a disponibilidade e paciência demonstradas e principalmente pela oportunidade para desenvolver este estudo.
À Professora Doutora Isabel Pires, também pelos conhecimentos transmitidos e pela disponibilidade que sempre demostrou ao longo da execução deste trabalho.
Num tom mais pessoal, gostaria de agradecer aos meus pais por todo o apoio que sempre me concederam, pela paciência e por todos os sacrifícios que fizeram ao longo da vida em meu benefício. Agradeço também à minha restante família, principalmente aos
meus avós e padrinhos, por todo o apoio que sempre me deram.
À Marta Cunha, por toda a ajuda preciosa prestada na elaboração desta dissertação e pelo apoio e motivação que sempre me transmitiu.
À Filipa Alegria, Francisca Oliveira, Luzia Gomes, Marta Rebelo, Mariana
Gonçalves, João Esteves, José Carlos Almeida, João Morais, Alexandre Triguinho, Romano, Luiza Cavalcanti, André Vieira, Renato Martins e Érica Veiga pela amizade
que estimo, pela ajuda que nunca recusaram prestar, pela boa disposição e pelos bons momentos que me proporcionaram durante o curso.
À Catarina Mendes, Filipa Calejo, Joana Fernandes, Juliana Melo, Sandra
Regada, Teresa Carvalho, Paulo Carvalho, Tiago Marcelino e Hélder Craveiro por,
durante cinco meses, terem feito de cada dia um dia recheado de boa disposição. Agradeço o companheirismo e a aprendizagem que proporcionaram.
ii
RESUMO
O mastocitoma canino encontra-se entre as neoplasias cutâneas mais frequentes no cão. Apresenta um comportamento biológico significativamente variável podendo tanto comportar-se como um tumor benigno como crescer e metastizar. Têm sido desenvolvidos métodos para vaticinar o comportamento biológico deste tumor. Esses métodos estão assentes em critérios da gradação histológica. No entanto, outros métodos têm sido testados como potenciais marcadores de prognóstico na tentativa de prever com maior fiabilidade o comportamento desta neoplasia. Estes métodos incluem marcadores de proliferação celular (AgNORs, PCNA e Ki-67) e marcadores de expressão do gene supressor tumoral como p53.
As metaloproteinases de matriz (MMP) são um importante grupo de enzimas proteolíticas responsáveis pela degradação da matriz extracelular. A sua expressão é encontrada tanto na renovação fisiológica da matriz extracelular como em processos patológicos como é o caso da invasão tumoral e desenvolvimento de metástases. A MMP-9 é um dos membros desta família que se encontra mais bem estudada a nível tumoral, tanto em medicina veterinária como em medicina humana, e tem sido associada à capacidade invasiva de neoplasias.
A caderina-E é uma molécula de adesão celular com um importante papel na morfogénese e manutenção da arquitetura tecidular normal. A diminuição da sua expressão em diversas neoplasias tem vindo a ser associada a um tumor fenotipicamente mais agressivo.
A expressão da MMP-9 e da caderina-E está descrita nos mastocitomas caninos. No entanto, não existem estudos que revelem associação entre elas.
Neste estudo, com o objetivo de avaliar a possível existência da referida associação, foram utilizadas 30 neoplasias, classificadas como mastocitomas de diferentes graus e pertencentes ao arquivo do Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto-Douro. As amostras foram submetidas à técnica de imunohistoquímica com os anticorpos anti-MMP-9 e anti-caderina-E. A imunomarcação da MMP-9 foi avaliada apenas quanto à extensão de marcação em <25% dos mastócitos marcados, 25-50% dos mastócitos marcados e >50% dos mastócitos marcados. A imunomarcação da caderina-E foi avaliada quanto à extensão de marcação em <25% das células marcadas, 25-50% das células marcadas e >50% das células marcadas, e quanto à intensidade de marcação em fraca, moderada e forte.
A intensidade de marcação da caderina-E revelou associação com o grau histológico do tumor (p=0,034), assim como a extensão de marcação da MMP-9 (p=0,039). Pelo
iii
contrário, a extensão de marcação da caderina-E não revelou qualquer associação com o grau histológico do mastocitoma (p=0,552). Ao comparar a extensão de marcação da MMP-9 com a intensidade de marcação da caderina-E não foi encontrada uma associação estatisticamente significativa (p=0,270). O mesmo se verificou na associação entre a extensão de marcação da MMP-9 e a extensão de marcação da caderina-E (p=0,627).
Este estudo sugere o envolvimento da MMP-9 na progressão e malignidade de mastocitomas cutâneos caninos, assim como o envolvimento da caderina-E na manutenção da integridade tecidular atuando como um agente supressor tumoral.
iv
ABSTRACT
Mast cell tumours are among the most common cutaneous tumours in the dog. Its biological behaviour is significantly variable, as it can be benign or malignant. Various methods have been developed to predict said behaviour. These methods are based in histological grading criteria. However, other techniques have been tested as potential prognostic markers in an attempt to improve the prediction of the behaviour of this neoplasia. These techniques include cell proliferation markers (AgNORs, PCNA e Ki-67) and markers of the expression of tumour suppressor genes, such as p53.
The matrix metalloproteinases (MMPs) are an important group of proteolytic enzymes responsible for the degrading of the extracellular matrix. Their expression is found both in the physiological renovation of the extracellular matrix and in pathological situations, such as tumour invasion and development of metastasis. MMP-9 is one of the best studied members of this family, both in veterinary and human pathology, and has been associated to a tumour’s invasive ability.
E-Cadherin is an adhesion molecule with an important role in morphogenesis and maintenance of normal tissue architecture. A decrease in its expression in various tumours has been linked to a phenotypically more aggressive tumour.
The expression of MMP-9 and E-Cadherin is described in canine mast cell tumours. However, there are no studies demonstrating an association between them.
In this study, with the objective of evaluating the possible existence of said association, we used 30 tumours from the archive of the Laboratory of Histology and Pathological Anatomy of the University of Trás-os-Montes and Alto Douro, diagnosed as mast cell tumours of different grades. The samples were submitted to the immunohistochemistry technique with the antibodies anti-MMP-9 and anti-E-Cadherin. The immunostaining of the MMP-9 was evaluated regarding only its extent in <25% of stained mast cells, 25-50% of stained mast cells and >50% of stained mast cells. The immunostaining of the E-Cadherin was evaluated regarding its extent in <25% of stained cells, 25-50% of stained cells and >50% of stained cells, and concerning its intensity in weak, moderate or strong.
The intensity of staining of the E-Cadherin demonstrated an association with the histological grade of the tumour (p=0,034), as well as with the extent of the staining of the MMP-9 (p=0,039). On the contrary, the extent of the staining of the E-Cadherin didn’t reveal any association with the histological grade of the mast cell tumours (p=0,552).
v
Comparing the extent of the MMP-9 staining with the intensity of the E-Cadherin staining, we didn’t find any statistical significant association between them (p=0,270). The same occurred when evaluating the association between the extent of the MMP-9 staining with the extent of the E-Cadherin staining (p=0,627).
This study suggests the participation of MMP-9 in the progression and malignancy of canine mast cell tumours, as well as the contribution of E-Cadherin in maintenance of tissue integrity, acting as a tumour suppressor agent.
vi
ÍNDICE GERAL
CAPÍTULO I - INTRODUÇÃO E OBJETIVOS ... 1
CAPÍTULO II – ESTADO DA ARTE ... 2
1. MASTOCITOMA CANINO ... 2
1.1. Epidemiologia... 2
1.2. Etiologia e patogenia ... 3
1.3. Caraterísticas macroscópicas ... 3
1.3.1. Localização ... 3
1.4. Fator de prognóstico histopatológico: grau histológico ... 4
2. MOLÉCULAS AVALIADAS NESTE ESTUDO ... 9
2.1. Metaloproteinases de matriz ... 9
2.1.1. Metaloproteinase de matriz-9...12
2.2. Caderinas ...14
2.2.1. Caderina-E ...15
2.2.1.1. A caderina-E e os mastocitomas cutâneos caninos ...17
CAPÍTULO III – MATERIAL E MÉTODOS ...18
1. MATERIAL ...18 2. MÉTODOS ...19 2.1. Técnica de Imunohistoquímica ...19 2.2. Avaliação da marcação ...21 2.3. Análise estatística ...22 CAPÍTULO IV – RESULTADOS ...23 1. METALOPROTEINASE DE MATRIZ-9 ...23 2. CADERINA-E ...25
3. ASSOCIAÇÃO ENTRE A EXPRESSÃO DA MMP-9 E DA CADERINA-E...28
CAPÍTULO V – DISCUSSÃO ...30
1. AVALIAÇÃO DA IMUNORREATIVIDADE PARA A MMP-9 ...30
2. AVALIAÇÃO DA IMUNORREATIVIDADE PARA A CADERINA-E ...30
3. ASSOCIAÇÃO ENTRE A EXPRESSÃO DA MMP-9 E DA CADERINA-E...31
4. A MMP-9 E A CADERINA-E COMO INDICADORES DE PROGNÓSTICO ...32
CAPÍTULO VI – CONCLUSÃO ...34
vii
ÍNDICE DE FIGURAS
Figura 1. Aspeto macroscópico de um nódulo diagnosticado como mastocitoma cutâneo
canino de localização torácica ... 4
Figura 2. Aspeto macroscópico de um nódulo diagnosticado como mastocitoma cutâneo canino localizado no membro posterior direito de um Shar-Pei ... 4
Figura 3. Aspeto macroscópico de um nódulo ulcerado e diagnosticado como mastocitoma cutâneo canino localizado no pescoço ... 4
Figura 4. Aspeto microscópico de um mastocitoma cutâneo canino de grau 1. ... 5
Figura 5. Aspeto microscópico de um mastocitoma cutâneo canino de grau 2 ... 6
Figura 6. Aspeto microscópico de um mastocitoma cutâneo canino de grau 3 ... 7
Figura 7. Visão global da produção, ativação e inibição da MMP-9. ...13
Figura 8. Extensão de marcação para a MMP-9 em tumores de diferentes graus histológicos. ...24
Figura 9. Extensão de marcação para a MMP-9 de menos de 25% dos mastócitos num mastocitoma cutâneo canino ...24
Figura 10. Extensão de marcação para a MMP-9 de mais de 50% dos mastócitos num mastocitoma cutâneo canino de grau 3 ...25
Figura 11. Extensão de marcação para a caderina-E em tumores de diferentes graus histológicos. ...26
Figura 12. Intensidade de marcação para a caderina-E em tumores de diferentes graus histológicos. ...27
Figura 13. Expressão de marcação da caderina-E. Intensidade de marcação forte num mastocitoma cutâneo canino de grau 1 ...27
Figura 14. Expressão de marcação da caderina-E. Intensidade de marcação fraca num mastocitoma cutâneo canino de grau 3 ...28
viii
ÍNDICE DE TABELAS
Tabela 1. Família das MMPs ...10
Tabela 2. Família das caderinas ...14
Tabela 3. Critérios de classificação histopatológica dos mastocitomas cutâneos caninos ....19
Tabela 4. Anticorpos utilizados na técnica de IHQ ...20
Tabela 5. Avaliação da marcação da MMP-9 ...21
Tabela 6. Avaliação da marcação da caderina-E...21
Tabela 7. Avaliação da imunorreatividade para a MMP-9. ...23
Tabela 8. Avaliação da imunorreatividade para a caderina-E. ...26
Tabela 9. Frequências absolutas da associação entre a extensão de imunorreatividade de caderina-E e a extensão de imunorreatividade de MMP-9 nos MCTs estudados. ...29
Tabela 10. Frequências absolutas da associação entre a intensidade de imunorreatividade de caderina-E e a extensão de imunorreatividade de MMP-9 nos MCTs estudados ...29
ix
LISTAGEM DE SIGLAS E ABREVIATURAS AgNOR - Regiões organizadoras nucleolares cma – Campo de maior ampliação
DAB – Tetrahidrocloreto-3,3’-diaminobenzidina HE – Hematoxilina e Eosina
IHQ – Imunohistoquímica
LHAP-UTAD – Laboratório de Histologia e Anatomia Patológica da Universidade de
Trás-os-Montes e Alto Douro
MCT – Mastocitoma MEC – Matriz extracelular
MMP – Metaloproteinase de Matriz PBS – Tampão de fosfato salino
PCNA - Antigénio proliferativo celular nuclear
TIMP – Inibidor tecidular da metaloproteinase de matriz UTAD – Universidade de Trás-os-Montes e Alto Douro µm – micrómetro
INTRODUÇÃO E OBJETIVOS
1
CAPÍTULO I - INTRODUÇÃO E OBJETIVOS
O mastocitoma canino encontra-se entre as neoplasias cutâneas mais frequentes nesta espécie. Dada a sua frequência é importante otimizar tanto o seu diagnóstico como o estabelecimento de um prognóstico fiável. O diagnóstico desta neoplasia através de citologia ou histopatologia é relativamente simples, mas formar um prognóstico preciso é mais desafiante.
Dada a associação da MMP-9 com a agressividade tumoral e a sua comprovada intervenção na capacidade invasiva de um tumor, bem como a descrição da caderina-E na literatura como uma molécula de adesão celular com um papel importante na invasão tumoral, os objetivos deste estudo foram:
Avaliação da expressão da MMP-9 em mastocitomas cutâneos caninos; Avaliação da expressão da caderina-E em mastocitomas cutâneos caninos; Avaliação da expressão da MMP-9 e da caderina-E em relação ao grau
histológico do tumor;
Avaliação de uma possível associação entre a expressão da MMP-9 e da caderina-E.
ESTADO DA ARTE
2
CAPÍTULO II – ESTADO DA ARTE
1. MASTOCITOMA CANINO
O mastocitoma (MCT) canino encontra-se entre as neoplasias mais comuns no cão, representando 10-15% da totalidade dos tumores cutâneos nesta espécie (Gross, et al., 2005) e cerca de 11-27% de todos os tumores caninos malignos (Thamm e Vail, 2001; Preziosi, et al., 2007; Thamm e Vail, 2007).
O seu comportamento biológico é bastante imprevisível (especialmente em mastocitomas de grau 2), variando desde massas benignas solitárias cuja excisão cirúrgica completa é curativa, até massas malignas com metástases fatais (Patnaik, et al., 1984; Zemke, et al., 2002; Misdorp, 2004; Kiupel, et al., 2011).
1.1. Epidemiologia
Vários estudos revelam que não existe predisposição de género, sendo machos e fêmeas igualmente afetados (Govier, 2003; Misdorp, 2004; Thamm e Vail, 2007; Monteiro, et
al., 2011).
A média de idades dos animais afetados varia consoante os estudos consultados, sendo de 7,8 anos (Monteiro, et al., 2011), 8,5 anos (Strefezzi Rde, et al., 2003) ou de 9 anos (Thamm e Vail, 2001; Govier, 2003; Misdorp, 2004). Todavia, também estão descritos casos raros em animais jovens: um Pastor Alemão com 7 semanas (Cole, 1990) e um Jack Russel Terrier de 3 semanas (Davis, et al., 1992). Nos cães de raça Shar-pei parece haver uma incidência maior em animais jovens com menos de 2 anos (Miller, 1995).
Qualquer raça pode ser afetada por esta neoplasia. No entanto, estudos apontam para a existência de uma maior predisposição em Boxer, Beagle, Boston Terrier, Bulldog, Labrador Retriever, Golden Retriever e Schnauzer (Patnaik, et al., 1984; Thamm e Vail, 2001; Misdorp, 2004). O Boxer representa a raça com maior prevalência, desenvolvendo MCTs de baixo grau (grau 1) e de grau intermédio (grau 2) que possuem um prognóstico mais favorável (Bostock, 1973; Thamm e Vail, 2007).
ESTADO DA ARTE
3
1.2. Etiologia e patogenia
A etiologia do MCT é desconhecida, assim como a razão para a sua alta incidência na população canina. Estão documentados casos raros de desenvolvimento de MCTs em locais de inflamação crónica e irritação cutânea e existem estudos que consideram um possível envolvimento vírico, não havendo, no entanto, evidência epidemiológica de transmissão horizontal do tumor (Thamm e Vail, 2007). A expressão de uma fragilidade cromossómica foi investigada nos Boxers, contudo, os resultados do estudo foram interpretados como um aumento da incidência desta neoplasia relacionado com a idade e não com uma fragilidade cromossómica (Stone, et al., 1991).
1.3. Caraterísticas macroscópicas
As lesões solitárias são a forma de apresentação típica do MCT, sendo que alguns cães desenvolvem metástases cutâneas “satélite” (Murphy, et al., 2006; Thamm e Vail, 2007). Um fenómeno, denominado Sinal de Darier, pode ser observado nos cães e está relacionado com a manipulação mecânica do tumor (Govier, 2003). Este sinal ocorre quando há palpação dos MCTs ou trauma da massa tumoral e é causado pela libertação de histamina, heparina e outros mediadores vasoativos dos mastócitos, o que leva ao desenvolvimento de edema local e inflamação (London e Seguin, 2003). Foi provado que mastócitos normais são atraídos ao local do tumor, o que pode promover o crescimento tumoral através da libertação de citocinas inflamatórias (Conti, et al., 2007).
1.3.1. Localização
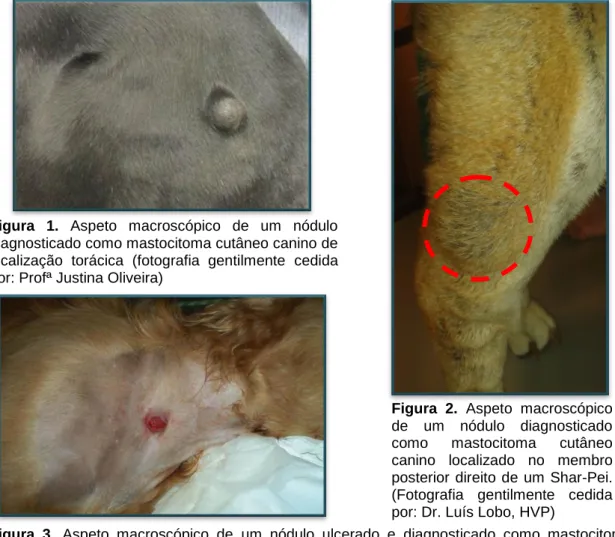
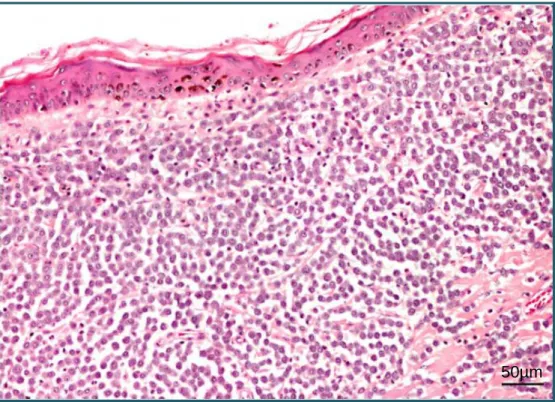
A nível cutâneo, os valores médios de distribuição variam consoante o autor consultado, sendo, em termos globais, o tórax (figura 1) e o abdómen os locais com maior prevalência de ocorrência de MCTs. Esta prevalência varia entre 45,5% (Jaffe, et al., 2000) e 37,7% (Ginn, et al., 2000). A localização nos membros (figura 2) apresenta prevalências que variam entre 36,4% (Jaffe, et al., 2000) e 35,8% (Ginn, et al., 2000). Outras localizações incluem a cabeça e o pescoço (figura 3) com prevalência de 8,3% (Jaffe, et al., 2000) e 11,3% (Ginn, et al., 2000) e a zona inguinal e perianal com prevalência de 6,6% (Jaffe, et al., 2000) e 15,1% (Ginn, et al., 2000).
Os MCTs podem também apresentar uma forma visceral primária, que se pode desenvolver em órgãos como fígado, baço e intestino (Misdorp, 2004). No cão, a forma visceral é quase sempre precedida por uma lesão cutânea primária indiferenciada (Thamm e Vail, 2007).
ESTADO DA ARTE
4
Ginn e colaboradores (2000) verificaram que MCTs provenientes da região inguinal, prepucial, escrotal e perineal apresentavam um comportamento biológico mais agressivo, sendo tumores fracamente diferenciados. Monteiro e colaboradores (2011) verificaram que não existe qualquer relação entre o local do tumor, a sua recorrência e probabilidade de metastização do mesmo.
1.4. Fator de prognóstico histopatológico: grau histológico
A gradação histológica tem sido a ferramenta principal do patologista para prever o potencial comportamento biológico dos MCTs e é comumente utilizada para determinar o prognóstico e terapêutica dos mesmos (Patnaik, et al., 1984; Preziosi, et al., 2007; Kiupel, et
al., 2011).
Patnaik e colaboradores (1984) propuseram uma classificação dos MCTs em 3 graus, tendo por base características citológicas combinadas com a espessura do tumor, que se supõe ter origem na derme superficial, expandindo-se em profundidade para o tecido
Figura 1. Aspeto macroscópico de um nódulo
diagnosticado como mastocitoma cutâneo canino de localização torácica (fotografia gentilmente cedida por: Profª Justina Oliveira)
Figura 2. Aspeto macroscópico
de um nódulo diagnosticado como mastocitoma cutâneo canino localizado no membro posterior direito de um Shar-Pei. (Fotografia gentilmente cedida por: Dr. Luís Lobo, HVP)
Figura 3. Aspeto macroscópico de um nódulo ulcerado e diagnosticado como mastocitoma
ESTADO DA ARTE
5
subcutâneo. O grau de infiltração nos tecidos e o índice mitótico são as características fundamentais desta classificação (Preziosi, et al., 2007).
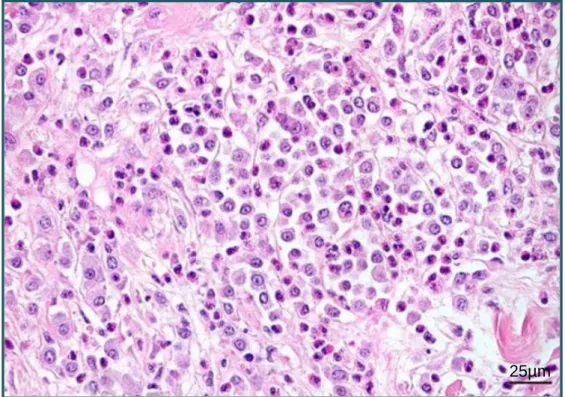
No grau 1 (figura 4) encontram-se os MCTs bem diferenciados, pequenos, bem circunscritos, não encapsulados e de prognóstico favorável. As lesões em tumores deste grau estão confinadas à derme e espaços interfoliculares. A epiderme apresenta-se intacta e as células estão organizadas em cordões e em toalha laxa e lembram os mastócitos granulados normais, com bordos celulares discretos e grânulos citoplasmáticos basófilos. Os núcleos são pequenos, de forma redonda a oval, com nucléolos indistinguíveis. As figuras mitóticas são raras ou inexistentes (Patnaik, et al., 1984; Gross, et al., 2005).
No grau 2 (figura 5) encontram-se os MCTs de diferenciação intermédia e de prognóstico reservado. São tumores de maiores dimensões, mais profundos, estendendo-se pela derme profunda e pelo tecido subcutâneo, e menos circunscritos que os de grau 1. As células neoplásicas são maiores, evidenciando um maior grau de pleomorfismo e granulação mais dispersa do que as células dos tumores de grau 1. Os núcleos encontram-se moderadamente aumentados de tamanho, apreencontram-sentando-encontram-se uniformes e vesiculares, com nucléolos evidentes e pequenos. O citoplasma é moderado e variavelmente granular,
Figura 4. Aspeto microscópico de um mastocitoma cutâneo canino de grau 1.
As células tumorais ocupam a derme superficial. HE. Estalão=50µm. (Fotografia gentilmente cedida por: Profª Justina Oliveira)
ESTADO DA ARTE
6
sendo que a atividade mitótica varia de ausente a baixa (Patnaik, et al., 1984; Gross, et al., 2005).
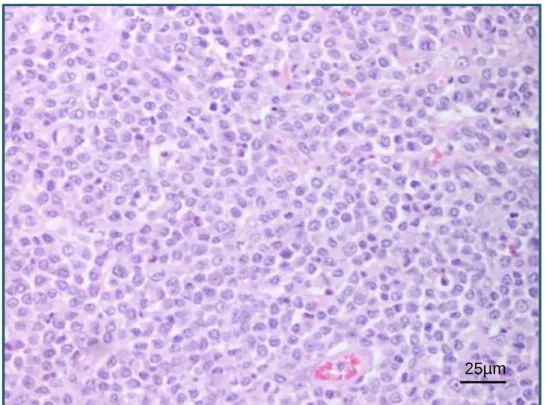
No grau 3 (figura 6) encontram-se os MCTs de grandes dimensões, fracamente circunscritos e diferenciados, infiltrando-se profundamente no tecido subcutâneo. Apresentam mau prognóstico. É comum encontrar-se características secundárias como necrose e ulceração. As células tumorais são redondas, poligonais ou pleomórficas, organizadas em cordões sólidos e ninhos. Células binucleadas são comuns. As margens celulares são indistinguíveis e os núcleos são grandes, redondos a ovais e com nucléolos proeminentes. A atividade mitótica é moderada a alta, podendo existir mitoses atípicas (Patnaik, et al., 1984; Gross, et al., 2005).
Figura 5. Aspeto microscópico de um mastocitoma cutâneo canino de grau 2. HE. Estalão=25µm.
(Fotografia gentilmente cedida por: Profª Justina Oliveira)
ESTADO DA ARTE
7
Patnaik e colaboradores (1984) concluíram que o tempo de sobrevida de cães com tumores bem diferenciados (grau 1) é duas vezes superior ao tempo de sobrevida de cães com tumores de diferenciação intermédia (grau 2) e seis vezes maior que os que possuem tumores fracamente diferenciados (grau 3).
Apesar do grau histológico estar significativamente relacionado com o prognóstico do tumor (Patnaik, et al., 1984), a ambiguidade na classificação dos MCTs de grau intermédio e a marcada variação entre observadores, com menos de 50% de concordância entre patologistas em alguns estudos, levou a que o corrente sistema de gradação histológica de Patnaik e colaboradores fosse questionado (Strefezzi Rde, et al., 2003; Northrup, et al., 2005).
Mais recentemente, Kiupel e colaboradores (2011), perante esta significativa variação entre observadores no que toca à classificação dos MCTs em grau 2, propuseram um novo modelo de classificação, considerando apenas dois graus – alto grau e baixo grau. Este novo modelo baseia-se apenas em critérios microscópicos, como o número de figuras mitóticas em combinação com a cariomegalia, células multinucleadas (3 ou mais núcleos) ou núcleos bizarros (Kiupel, et al., 2011).
Figura 6. Aspeto microscópico de um mastocitoma cutâneo canino de grau 3. HE. Estalão=25µm.
(Fotografia gentilmente cedida por: Profª Justina Oliveira) 25µm
ESTADO DA ARTE
8
Assim, um MCT de alto grau caracteriza-se por possuir uma ou mais das seguintes características: cariomegalia, pelo menos 7 figuras mitóticas, 3 células multinucleadas e 3 núcleos bizarros em 10 campos de maior ampliação (cma) (Kiupel, et al., 2011).
Mackowiak e colaboradores (2012) não verificaram diferenças estatisticamente significativas quanto ao desenvolvimento do tumor, progressão, recorrência e taxa de mortalidade quando compararam MCTs de grau 1 e grau 2. No entanto, quando estes foram comparados com os MCTs de grau 3, foram encontradas diferenças estatisticamente significativas entre os grupos. Estes resultados apoiam a classificação de Kiupel e colaboradores (2011) com o objetivo de minimizar a variação entre patologistas na classificação destes tumores e poder proporcionar um prognóstico mais preciso.
Além da classificação dos MCTs pelos critérios da gradação histológica, outros métodos têm sido testados como potenciais marcadores de prognóstico na tentativa de prever com maior fiabilidade o comportamento desta neoplasia em termos de recorrência, metástases e tempo de sobrevida do animal. Estes métodos incluem marcadores de proliferação celular (AgNORs, PCNA e Ki-67) e marcadores de expressão do gene supressor tumoral como p53 (Bostock, et al., 1989; Ayl, et al., 1992; Simoes, et al., 1994; Ginn, et al., 2000; Jaffe, et al., 2000; Scase, et al., 2006; Webster, et al., 2007). Nenhum destes métodos é capaz de determinar o prognóstico desta neoplasia com maior fiabilidade do que o grau histológico. No entanto, utilizados em conjunto podem ajudar a compreender melhor o comportamento biológico do tumor (Jaffe, et al., 2000).
O grau histológico é o fator de prognóstico mais consistente, preditivo do tempo de sobrevida e do tempo de recorrência, mas não prevê o comportamento biológico de cada neoplasia (Patnaik, et al., 1984; Thamm e Vail, 2001; Gross, et al., 2005).
A classificação proposta por Patnaik (1984) ainda é considerada a mais completa e a mais frequentemente utilizada para prever o comportamento do mastocitoma cutâneo canino, sendo um importante indicador de prognóstico (Simoes, et al., 1994).
ESTADO DA ARTE
9
2. MOLÉCULAS AVALIADAS NESTE ESTUDO 2.1. Metaloproteinases de matriz
A degradação e a renovação controlada da matriz extracelular (MEC) são funções de elevada importância em diversos processos biológicos como o desenvolvimento embrionário (Cohen, et al., 2006; Demir-Weusten, et al., 2007), a remodelação do endométrio (Salamonsen, 1994), a ovulação (Hulboy, et al., 1997), a angiogénese (Chang e Werb, 2001), a cicatrização de feridas (Gill e Parks, 2008), entre outros. Por outro lado, a degradação não controlada da MEC e a angiogénese são fatores-chave para o crescimento e a progressão de um tumor (MacDougall e Matrisian, 1995; Stetler-Stevenson, 1996), pois permitem que células neoplásicas invadam e formem metastases noutros tecidos (Stetler-Stevenson, 1996).
As metaloproteinases de matriz (MMPs) são um importante grupo de enzimas proteolíticas extracelulares, dependentes do zinco e do cálcio, e secretadas por diversos tipos de células (DeClerck, 2000).
As MMPs estão envolvidas na renovação fisiológica da MEC, como se observa na cicatrização de feridas, angiogénese e reabsorção óssea, assim como em processos patológicos, como a invasão e metastases tumorais (Loukopoulos, et al., 2003) e a artrite reumatoide (Hegemann, et al., 2003). São também capazes de regular múltiplas funções celulares, incluindo o crescimento celular, a apoptose e a resposta imune pela clivagem de precursores de fatores de crescimento e de outras moléculas de adesão celular (Chiarugi, et
al., 2000; Bjorklund e Koivunen, 2005).
Pensa-se que, quando produzidas por células neoplásicas, estas proteases sejam responsáveis pela degradação acelerada da MEC, uma vez que são capazes de degradar os componentes da membrana a pH fisiológico, estando assim associadas à invasão tumoral e metástases (Iwata, et al., 1996; Stetler-Stevenson, 1996).
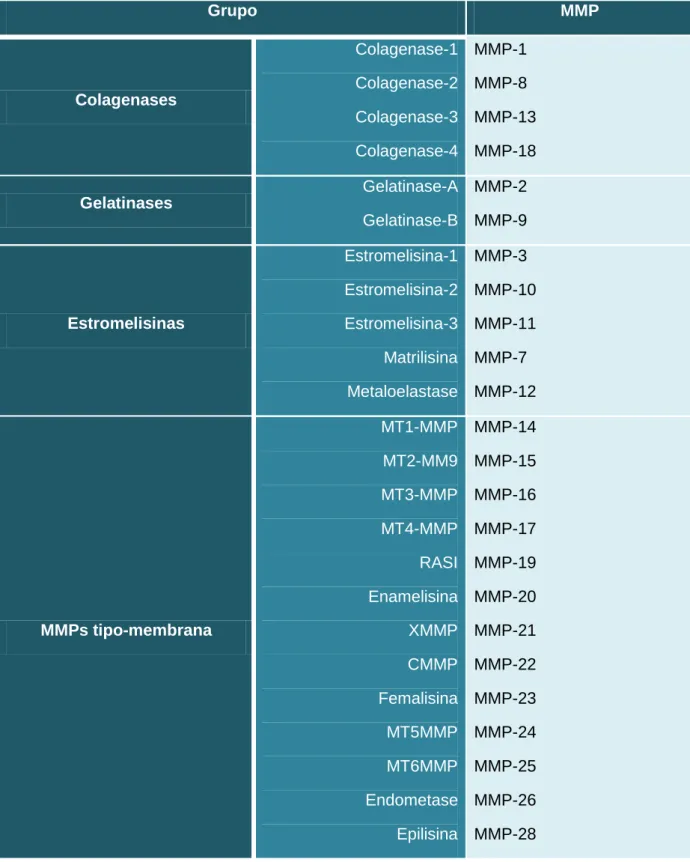
A família das MMPs é composta por mais de 20 endopeptidases classificadas em quatro grupos (tabela 1) consoante a especificidade de substrato e as características do seu domínio (DeClerck, 2000; Lynch e Matrisian, 2002; Bjorklund e Koivunen, 2005).
ESTADO DA ARTE
10
Tabela 1. Família das MMPs. Adaptado de Lynch e Matrisian, 2002.
Grupo MMP Colagenases Colagenase-1 Colagenase-2 Colagenase-3 Colagenase-4 MMP-1 MMP-8 MMP-13 MMP-18 Gelatinases Gelatinase-A Gelatinase-B MMP-2 MMP-9 Estromelisinas Estromelisina-1 Estromelisina-2 Estromelisina-3 Matrilisina Metaloelastase MMP-3 MMP-10 MMP-11 MMP-7 MMP-12 MMPs tipo-membrana MT1-MMP MT2-MM9 MT3-MMP MT4-MMP RASI Enamelisina XMMP CMMP Femalisina MT5MMP MT6MMP Endometase Epilisina MMP-14 MMP-15 MMP-16 MMP-17 MMP-19 MMP-20 MMP-21 MMP-22 MMP-23 MMP-24 MMP-25 MMP-26 MMP-28
As MMPs apresentam especificidades de substrato distintas mas coletivamente são capazes de degradar todos os componentes da matriz extracelular (Ala-aho e Kahari, 2005). Os substratos das MMPs são, em primeiro lugar, as proteínas insolúveis da MEC, que incluem colagénio intersticial e da membrana basal, proteínas e glicoproteinas como a
ESTADO DA ARTE
11
fibronectina, laminina, vitronectina, tenascina e elastina, assim como proteoglicanos (DeClerck, 2000).
Alguns estudos sugerem que as gelatinases ou colagenases tipo IV (incluem MMP-2 ou gelatinase-A e MMP-9 ou gelatinase-B), capazes de degradar colagénio tipo IV (Olson, et
al., 1998), o maior constituinte da membrana basal, estão intimamente relacionadas com o
potencial metastático dos tumores (Monteagudo, et al., 1990; MacDougall e Matrisian, 1995).
A maioria das MMPs é expressa pela ação de fatores de crescimento, como o fator de crescimento do endotélio vascular, citocinas, hormonas, agentes químicos, stresse físico e transformação celular oncogénica (Wang e Keiser, 1998; Szabo, 2004). Para além das células tumorais, os fibroblastos, as células mioepiteliais, as células endoteliais, os condrócitos, os osteoblastos, bem como as células inflamatórias (macrófagos, mastócitos, neutrófilos polimorfonucleares, eosinófilos e células-T) também expressam MMPs nas áreas adjacentes ao tumor (DeClerck, 2000). Estas observações sugerem que as células tumorais estimulam a expressão de MMPs no ambiente envolvente para promover a degradação proteolítica da MEC (DeClerck, 2000). O efeito estimulador do estroma tumoral pode ser mediado por fatores diretamente produzidos pelas células tumorais ou pode ser o resultado da reação inflamatória que muitas vezes acompanha o estabelecimento de um tumor maligno (DeClerck, 2000).
Em medicina veterinária, o papel das MMPs tem vindo a ser avaliado em meningite-arterite canina (Schwartz, et al., 2010), doença valvular crónica (Aupperle, et al., 2009), artrite (Muir, et al., 2007) e neoplasias (Loukopoulos, et al., 2003; Takagi, et al., 2005), incluindo tumores oronasais (Nakaichi, et al., 2007), tumores de mama (Kawai, et al., 2006; Aresu, et al., 2011) e mastocitomas (Giantin, et al., 2012). Nestes processos neoplásicos, a invasão e metástases foram relacionadas com a degradação da MEC pelas MMPs (Giantin,
et al., 2012).
Em medicina humana, um aumento da concentração de MMPs, gelatinases em particular, tem vindo a ser observada e associada a invasão, metástases e mau prognóstico em vários tumores, como o carcinoma do pulmão (Kawano, et al., 1997), da mama (Davies,
et al., 1993; Dalberg, et al., 2000), neuroblastoma (Sugiura, et al., 1998), melanoma (Walker
e Woolley, 1999; Hofmann, et al., 2005) e condrossarcoma (Sakamoto, et al., 1999).
As MMPs têm assim o potencial de criar um ambiente que sustenta o início e o crescimento de tumores primários, promovem a angiogénese e a neovascularização tumoral
ESTADO DA ARTE
12
e permitem a rutura da arquitetura tecidular local e a penetração nas barreiras do tecido conjuntivo para possibilitar a invasão das células neoplásicas e a disseminação por metastização (Szabo, 2004).
2.1.1. Metaloproteinase de matriz-9
Dentro da família das MMPs, o grupo das gelatinases ou colagenases tipo IV, que inclui a MMP-2 (gelatinase-A) e a MMP-9 (gelatinase-B), é o grupo mais frequentemente estudado. Estas têm demonstrado um papel central em diversas condições fisiológicas e patológicas que envolvem a degradação da MEC (Nagel, et al., 2004).
Como todas as MMPs, a MMP-9 é produzida como zimogéneo inativo (pró-MMP), sendo ativada por clivagem proteica para se tornar uma enzima proteolítica (Stetler-Stevenson, 1990), permitindo a degradação do colagénio tipo IV e V, gelatina, elastina e fibronectina (Fang, et al., 1999). As gelatinases têm sido associadas ao potencial metastático de tumores devido a esta capacidade para degradar o colagénio tipo IV da membrana basal (Monteagudo, et al., 1990; MacDougall e Matrisian, 1995).
Para evitar a proteólise excessiva e dano tecidular, a atividade proteolítica das MMPs é regulada por inibidores endógenos específicos de MMPs, os Inibidores Tecidulares das Metaloproteinases de Matriz (TIMPs) (Giantin, et al., 2012).
O inibidor tecidular da metaloproteinase de matriz-1 (TIMP-1) é considerado o principal regulador da atividade da pró-MMP-9 (MacDougall e Matrisian, 1995; Lambert, et
al., 2004) e é expresso por uma grande variedade de células como os fibroblastos, células
epiteliais e endoteliais, osteoblastos, condrócitos, células do músculo liso e células tumorais (Lambert, et al., 2004).
ESTADO DA ARTE
13
Em circunstâncias fisiológicas, o equilíbrio entre as MMPs e os seus inibidores naturais é um fator crucial na regulação da degradação da MEC e na manutenção da homeostase da matriz extracelular das proteínas (Aupperle, et al., 2009). Uma desregulação deste equilíbrio provoca uma degradação excessiva da MEC podendo levar à invasão de tecidos por células tumorais e desenvolvimento de metástases (Lambert, et al., 2004).
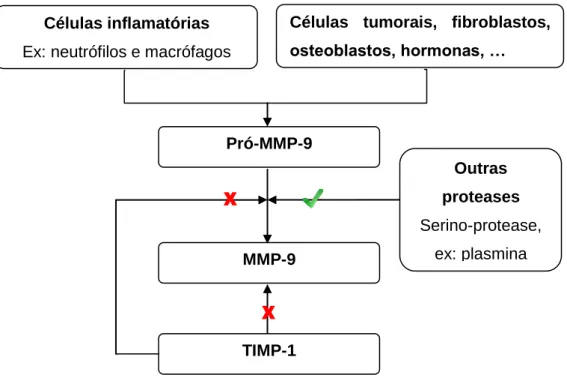
Foi sugerido que as MMP-2 e MMP-9 têm um papel importante na evolução dos mastocitomas caninos e a sua presença parece diretamente relacionada com o comportamento maligno destes tumores (Leibman, et al., 2000). Giantin e colaboradores (2012), com o objetivo de melhor perceber o papel da degradação da MEC no desenvolvimento e progressão de MCTs, avaliaram a expressão das MMPs (2 e MMP-9) e de TIMP nesta neoplasia.
Os resultados deste estudo sugeriram que a MMP-9, mais que a MMP-2, é um fator chave na degradação da MEC em MCTs e consequentemente na progressão e malignidade dos mesmos. Verificaram que a MMP-9 estava presente em todos os tumores, localizando-se no citoplasma dos mastócitos, e que aprelocalizando-sentava uma expressão mais intensa nos mastocitomas de grau 3 e menos intensa nos mastocitomas de grau 1. Quanto aos TIMPs, verificaram que variavam em sentido oposto da expressão da MMP-9, ou seja, um MCT de grau 3 apresentava menor expressão de TIMP-1 que um MCT de grau 2 e grau 1. Pelo
Células inflamatórias
Ex: neutrófilos e macrófagos
Células tumorais, fibroblastos, osteoblastos, hormonas, … Pró-MMP-9 Outras proteases Serino-protease, ex: plasmina MMP-9 TIMP-1
Figura 7. Visão global da produção, ativação e inibição da MMP-9.
MMP-9 – Metaloproteinase de matriz-9
TIMP-1 – Inibidor Tecidular da Metaloproteinase de Matriz-1 - Inibição - Ativação
ESTADO DA ARTE
14
contrário, havia um progressivo aumento da expressão da MMP-9 com o aumento do grau histológico do tumor (expressão mais intensa em MCTs de grau 3) (Giantin, et al., 2012).
A produção de MMP-9 está assim relacionada com o comportamento biológico do tumor: um tecido neoplásico produz mais MMP-9 que um tecido não neoplásico e um tumor maligno produz significativamente mais MMP-9 que um benigno (Leibman, et al., 2000; Loukopoulos, et al., 2003). O mesmo se verifica para outros tipos de tumor, como o tumor mamário na cadela (Hirayama, et al., 2002; Kawai, et al., 2006; Aresu, et al., 2011).
2.2. Caderinas
A interação intercelular constitui um processo essencial para a formação de tecidos e órgãos num organismo multicelular. A formação de adesões intercelulares firmes e compactas impede o livre movimento celular, essencial para evitar a motilidade e capacidade de invasão das células tumorais (Perez-Moreno, et al., 2003).
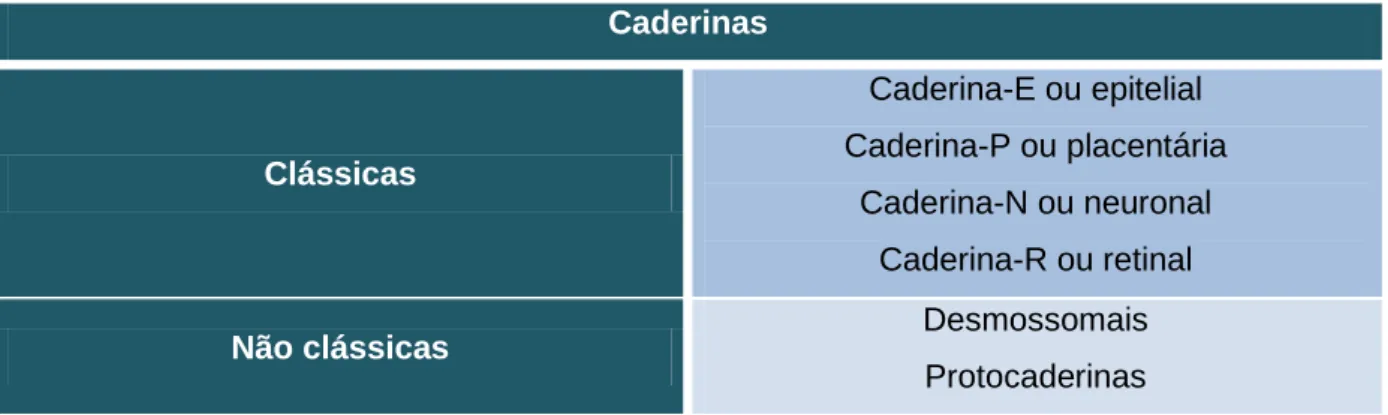
A família das caderinas (tabela 2) é maioritariamente composta por caderinas clássicas, que são as proteínas de maior importância no estabelecimento da adesão intercelular (Perez-Moreno, et al., 2003; Gumbiner, 2005), e pelas caderinas não clássicas, que incluem as caderinas desmossomais e as protocaderinas, estando estas últimas implicadas na plasticidade neuronal (Offermanns e Rosenthal, 2008; Paredes, et al., 2012).
Tabela 2. Família das caderinas. Adaptado de Offermanns e Rosenthal, 2008
Caderinas Clássicas Caderina-E ou epitelial Caderina-P ou placentária Caderina-N ou neuronal Caderina-R ou retinal
Não clássicas Desmossomais
Protocaderinas
As caderinas são glicoproteínas transmembranares dependentes do cálcio, que promovem a junção intercelular através de ligações homofílicas, desempenhando um papel de elevada importância na morfogénese e manutenção da arquitetura tecidular normal (Takeichi, 1995; Berx e Van Roy, 2001; Patel, et al., 2003).
Sendo as suas ligações homofílicas, uma célula que expresse uma caderina em particular (caderina-N, por exemplo) irá aderir preferencialmente a outra célula que expressa a mesma caderina. Adicionalmente, uma caderina pertencente à família das caderinas clássicas não estabelece ligações com caderinas pertencentes às caderinas não clássicas.
ESTADO DA ARTE
15
As ligações homofílicas fornecem um mecanismo simples, através do qual as células geneticamente idênticas formam camadas de células e de tecidos homogéneos (Patel, et al., 2003).
De uma forma geral, estas moléculas de adesão celular possuem um domínio extracelular que interage com outras moléculas de caderina em células adjacentes e um domínio intracelular que interage com proteínas denominadas cateninas (α, β e γ) que fazem a ligação das caderinas com o citoesqueleto da célula (Ozawa e Kemler, 1992) e medeiam mecanismos de transdução que controlam eventos celulares, como a polaridade celular, diferenciação, crescimento e migração (Mareel e Leroy, 2003; Mackowiak, et al., 2012). Acontecimentos que levem à rutura do complexo caderina-catenina-citoesqueleto levam à destabilização da adesão intercelular e à reorganização do citoesqueleto de actina (Mareel e Leroy, 2003).
2.2.1. Caderina-E
Os membros da família das caderinas mais bem estudados são a caderina-E ou epitelial e a caderina-P ou placentária (Nose e Takeichi, 1986) e pertencem à subfamília das caderinas clássicas, juntamente com a caderina-N ou neuronal e a caderina-R ou retinal (Nollet, et al., 2000).
A caderina-E é o membro da família das caderinas mais fortemente envolvido na adesão celular epitelial e é encontrada em quase todos os tecidos epiteliais humanos e animais, enquanto que a caderina-P é somente encontrada na camada basal do epitélio estratificado (Nose e Takeichi, 1986; Horiguchi, et al., 1994).
Além de ser expressa em células epiteliais, a caderina-E é também encontrada em células não epiteliais como células de Langerhans (Jakob, et al., 1999), timócitos (Munro, et
al., 1996), eritroblastos e normoblastos na medula óssea (Armeanu, et al., 1995) e
mastócitos (Tegoshi, et al., 2000).
A caderina-E é descrita na literatura como uma proteína de adesão celular com um papel importante na invasão tumoral, podendo a sua expressão levar a um atraso no crescimento das células tumorais (Berx, et al., 1995). Investigadores que utilizaram culturas com linhas celulares tumorais demonstraram que um restabelecimento da funcionalidade das caderinas, forçando a expressão de caderina-E, por exemplo, resultou numa reversão de células epiteliais tumorais com fenótipo invasivo em células com fenótipo benigno (Vleminckx, et al., 1991; Birchmeier e Behrens, 1994).
ESTADO DA ARTE
16
Uma vez que a maioria das neoplasias que afetam os humanos e os animais são de origem epitelial, a caderina-E tem sido amplamente estudada em relação ao seu papel na génese tumoral (Matos, et al., 2006; Gama, et al., 2008; Mackowiak, et al., 2012).
Vários estudos em medicina humana e em medicina veterinária têm demonstrado que a expressão de caderina-E encontra-se alterada durante a progressão tumoral e que quanto maior a agressividade da neoplasia menor é a sua expressão (Handschuh, et al., 1999; Menke, et al., 2001; Al Moustafa, et al., 2002; Matos, et al., 2006; De Matos, et al., 2007; Gama, et al., 2008; Aresu, et al., 2010; Singhai, et al., 2011; Mackowiak, et al., 2012).
Pelo contrário, no histiocitoma cutâneo canino, uma diminuição da intensidade de expressão da caderina-E parece estar associada à regressão espontânea da neoplasia (Pires, et al., 2009).
Múltiplos mecanismos têm sido apontados como causa para a diminuição ou perda total da funcionalidade da caderina-E durante a génese tumoral: digestão por proteases (Steinhusen, et al., 2001), regressão transcricional do gene da caderina-E (Yap, et al., 2007), endocitose (Fujita, et al., 2002), mutação ou deleção do gene que codifica a caderina-E (Saito, et al., 2001) e metilação do promotor da caderina-caderina-E (Yoshiura, et al., 1995). Mutações no gene da caderina-E provocam múltiplas alterações na morfologia e comportamento da célula, o que pode estar relacionado com o padrão de crescimento marcadamente disperso e o alto potencial metastático de alguns tipos de neoplasias (Handschuh, et al., 1999; Van Aken, et al., 2001).
Nos tumores mamários caninos, a diminuição da expressão de caderina-E está relacionada com um maior tamanho do tumor, ulceração, desenvolvimento de metástases nos gânglios linfáticos, necrose e crescimento infiltrativo (Matos, et al., 2006; Gama, et al., 2008).
De uma forma geral, uma diminuição da expressão de caderina-E leva frequentemente a uma desorganização tecidular, alteração na diferenciação celular, aumento do grau de invasão de células tumorais e malignidade em neoplasias epiteliais tanto no Homem como nos animais (Behrens, et al., 1989; Gooding, et al., 2004).
ESTADO DA ARTE
17
2.2.1.1. A caderina-E e os mastocitomas cutâneos caninos
Ramos-Vara e colaboradores (2011) vieram comprovar que a expressão de caderina-E não ocorre apenas nos histiocitomas cutâneos caninos (Baines, et al., 2008; Pires, et al., 2009) mas também noutros tumores de células redondas, como mastocitomas, sarcomas histiocíticos e linfomas epiteliotrópicos.
Um estudo recente em MCTs revelou uma correlação entre a diminuição da expressão de caderina-E e o aumento do grau de agressividade do respetivo tumor. Estes resultados foram acompanhados por uma reduzida coloração da membrana plasmática e diminuição da expressão de caderina-E no citoplasma e/ou núcleo quando a neoplasia apresentava um fenótipo mais agressivo (Mackowiak, et al., 2012).
MATERIAL E MÉTODOS
18
CAPÍTULO III – MATERIAL E MÉTODOS
1. MATERIAL
Neste estudo foram utilizadas 30 amostras de neoplasias provenientes de 30 animais e classificadas como mastocitomas de diferentes graus de malignidade por dois patologistas independentes segundo os critérios definidos por Patnaik e colaboradores (1984). Das 30 amostras de MCT submetidas a estudo, 9 pertenciam ao grau 1, 11 ao grau 2 e 10 ao grau 3. Os critérios de classificação estão sumariados na tabela 3.
O único tratamento utilizado foi a excisão cirúrgica do tumor, não tendo sido utilizada terapia adjuvante.
As amostras utilizadas pertencem ao arquivo do Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro (LHAP-UTAD) e foram proveniente de várias clínicas e hospitais da região norte do país.
MATERIAL E MÉTODOS
19
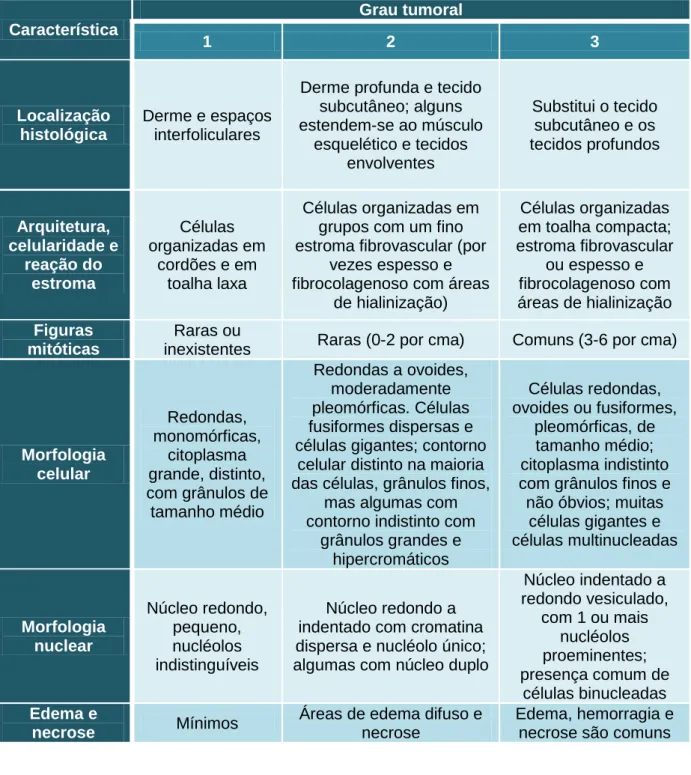
Tabela 3. Critérios de classificação histopatológica dos mastocitomas cutâneos caninos. Adaptado de
Patnaik et al., 1984. Característica Grau tumoral 1 2 3 Localização histológica Derme e espaços interfoliculares
Derme profunda e tecido subcutâneo; alguns estendem-se ao músculo esquelético e tecidos envolventes Substitui o tecido subcutâneo e os tecidos profundos Arquitetura, celularidade e reação do estroma Células organizadas em cordões e em toalha laxa Células organizadas em grupos com um fino estroma fibrovascular (por
vezes espesso e fibrocolagenoso com áreas
de hialinização) Células organizadas em toalha compacta; estroma fibrovascular ou espesso e fibrocolagenoso com áreas de hialinização Figuras mitóticas Raras ou
inexistentes Raras (0-2 por cma) Comuns (3-6 por cma)
Morfologia celular Redondas, monomórficas, citoplasma grande, distinto, com grânulos de tamanho médio Redondas a ovoides, moderadamente pleomórficas. Células fusiformes dispersas e células gigantes; contorno
celular distinto na maioria das células, grânulos finos,
mas algumas com contorno indistinto com
grânulos grandes e hipercromáticos Células redondas, ovoides ou fusiformes, pleomórficas, de tamanho médio; citoplasma indistinto com grânulos finos e não óbvios; muitas
células gigantes e células multinucleadas Morfologia nuclear Núcleo redondo, pequeno, nucléolos indistinguíveis Núcleo redondo a indentado com cromatina dispersa e nucléolo único; algumas com núcleo duplo
Núcleo indentado a redondo vesiculado, com 1 ou mais nucléolos proeminentes; presença comum de células binucleadas Edema e necrose Mínimos
Áreas de edema difuso e necrose
Edema, hemorragia e necrose são comuns
2. MÉTODOS
2.1. Técnica de Imunohistoquímica
Foi aplicado neste estudo o método indireto de imunohistoquímica (IHQ) de streptavidina-biotina peroxidase, usando-se como cromogéneo a solução de 3,3’ – diaminobenzidina (DAB).
Foram utilizados cortes de 3µm em lâminas revestidas com solução de Silane (3-Aminopropyltriethoxysilane, Sigma®). Após a desparafinação em xilol durante 10 minutos,
MATERIAL E MÉTODOS
20
procedeu-se à hidratação das lâminas, utilizando-se uma série de álcoois de concentração decrescente, passando-se no final as lâminas por água destilada.
Posteriormente realizou-se a recuperação antigénica através do tratamento térmico em micro-ondas, fazendo 3 ciclos de 5 minutos, em tampão citrato a pH 6,0±0,2, seguindo-se um arrefecimento gradual à temperatura ambiente durante 20 minutos. Após arrefecimento, colocaram-se as lâminas em tampão de fosfato salino (PBS) 0,1 M a pH 7,4.
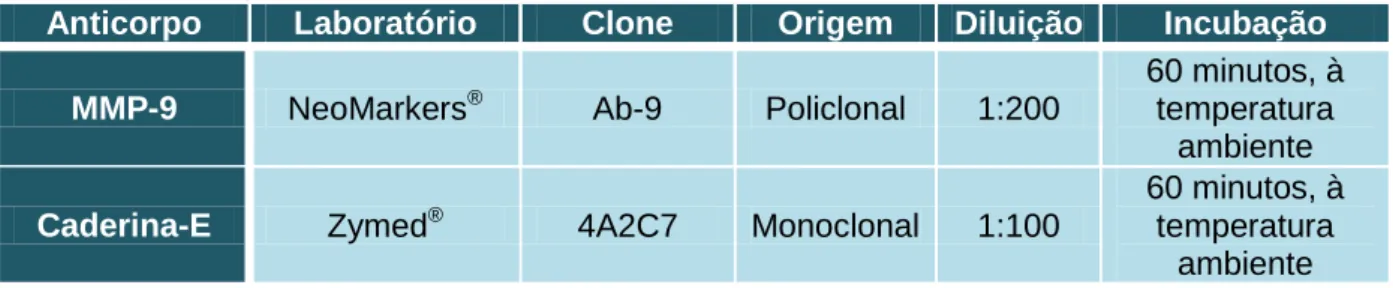
Inativaram-se as peroxidases endógenas pela colocação das lâminas em peróxido de hidrogénio a 3%, durante 30 minutos. Colocaram-se as lâminas na câmara húmida horizontal em contato com PBS durante 5 minutos. Depois retirou-se o excesso de PBS e procedeu-se à incubação com soro primário polivalente durante 5 minutos (Large volume Ultra V Block® da Thermo Fisher Scientific, LabVision Corporation, Fremont, CA, USA), de forma a ocupar todos os locais que pudessem promover ligações inespecíficas no tecido. De seguida, incubaram-se as lâminas com o anticorpo policlonal anti-MMP-9 (tabela 4) em câmara húmida horizontal durante 60 minutos e com o anticorpo monoclonal anti-caderina-E (tabela 4) também em câmara húmida horizontal durante 60 minutos.
Após a lavagem com PBS, procedeu-se à incubação com soro de ligação biotinilado (incluído no kit Ultra V Block® da Thermo Fisher Scientific, LabVision Corporation, Fremont, CA, USA), durante 10 minutos, à temperatura ambiente e em câmara húmida. Seguidamente lavaram-se novamente as lâminas com PBS (5 minutos) e incubaram-se as mesmas com peroxidase (Ultra V Block® da Thermo Fisher Scientific, LabVision Corporation, Fremont, CA, USA), durante 10 minutos, à temperatura ambiente, em câmara húmida. As lâminas foram lavadas novamente com PBS durante 5 minutos.
A revelação das lâminas foi realizada com tetrahidrocloreto-3,3’-diaminobenzidina (DAB), deixando atuar durante 5 minutos.
Depois de lavadas em água corrente, as lâminas foram contrastadas com hematoxilina de Gill, durante 30 segundos. Procedeu-se à desidratação dos cortes em álcoois de concentração crescente e posteriormente à sua colocação em xilol.
Por fim, efetuou-se a montagem com Entellan®.
Tabela 4. Anticorpos utilizados na técnica de IHQ
Anticorpo Laboratório Clone Origem Diluição Incubação MMP-9 NeoMarkers® Ab-9 Policlonal 1:200
60 minutos, à temperatura
ambiente
Caderina-E Zymed® 4A2C7 Monoclonal 1:100
60 minutos, à temperatura
MATERIAL E MÉTODOS
21
2.2. Avaliação da marcação
A expressão de marcação da MMP-9 foi avaliada ao microscópio ótico através da estimativa da percentagem de mastócitos positivos (extensão de marcação), tendo esta sido expressa em (tabela 5): 1 – <25% de mastócitos marcados; 2 – 25-50% de mastócitos marcados e 3 – >50% de mastócitos marcados.
Tabela 5. Avaliação da marcação da MMP-9
Grupos Extensão da marcação
1 <25% de mastócitos marcados
2 25-50% de mastócitos marcados
3 >50% de mastócitos marcados
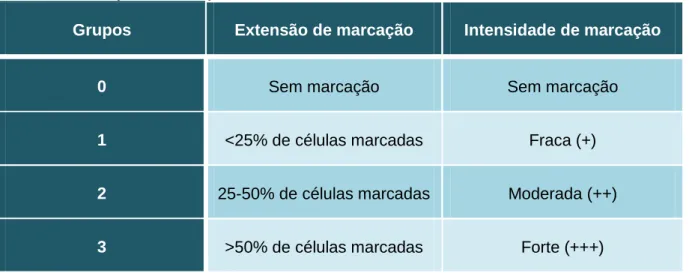
A expressão de marcação da caderina-E foi também avaliada ao microscópio ótico através da estimativa da percentagem de células positivas (extensão de marcação) e da intensidade de marcação das células neoplásicas.
A extensão de marcação foi expressa em (tabela 6): 0 – sem marcação; 1 – <25% de células marcadas; 2 – 25-50% de células marcadas; 3 – >50% de células marcadas.
A intensidade de marcação foi expressa em (tabela 6): 0 – sem marcação; 1 (+) – fraca; 2 (++) – moderada e 3 (+++) – forte.
Tabela 6. Avaliação da marcação da caderina-E
Grupos Extensão de marcação Intensidade de marcação
0 Sem marcação Sem marcação
1 <25% de células marcadas Fraca (+)
2 25-50% de células marcadas Moderada (++)
MATERIAL E MÉTODOS
22
2.3. Análise estatística
A associação entre os graus histológicos das neoplasias e a expressão (extensão e intensidade) de marcação da caderina-E foi investigada utilizando o teste de Qui-Quadrado de Pearson (χ2), com recurso ao programa SPSS Statistics® (versão 17.0) para Microsoft Windows® 7. A associação entre os graus histológicos e a extensão de marcação da MMP-9 foi também investigada recorrendo ao mesmo programa, assim como a avaliação da possível associação entre a expressão de MMP-9 e de caderina-E nos MCTs.
RESULTADOS
23
CAPÍTULO IV – RESULTADOS
1. METALOPROTEINASE DE MATRIZ-9
No caso da MMP-9 a marcação ocorreu no citoplasma das células tumorais, com padrão difuso ou granular.
A avaliação imunohistoquímica da extensão de marcação da MMP-9 nas 30 amostras analisadas encontra-se destacada na tabela 7. Cerca de 63% das neoplasias (n=19) apresentaram uma marcação de menos de 25% dos mastócitos para a MMP-9 e só 6,7% dos casos (n=2) mostraram uma percentagem de marcação de mais de 50% dos mastócitos.
Na sua maioria, os tumores de grau 1 apresentaram uma extensão de marcação para a MMP-9 de menos de 25% dos mastócitos (figura 8 e 9), enquanto que grande parte dos tumores de grau 3 apresentaram uma extensão de marcação de 25 a 50% dos mastócitos para a MMP-9 (figura 8). A figura 10 ilustra uma extensão de marcação de mais de 50% dos mastócitos pertencente a um mastocitoma canino de grau 3. As diferenças verificadas entre os graus histológicos foram estatisticamente significativas (p=0,039).
Tabela 7. Avaliação da imunorreatividade para a MMP-9.
MMP-9 Grau Total p 1 2 3 Extensão 1 n % 6 66,7% 10 90,9% 3 30,0% 19 63,3% 0,039 2 n % 3 33,3% 1 9,1% 5 50,0% 9 30,0% 3 n % 0 ,0% 0 ,0% 2 20,0% 2 6,7% % 100,0% 100,0% 100,0% 100,0%
RESULTADOS
24
Figura 8. Extensão de marcação para a MMP-9 em tumores de diferentes graus histológicos.
Figura 9. Extensão de marcação para a MMP-9 de menos de 25% dos mastócitos num mastocitoma
cutâneo canino. Estalão=30µm 0 1 2 3 4 5 6 7 8 9 10
Grau 1 Grau 2 Grau 3
<25% 25-50% >50%
RESULTADOS
25
Figura 10. Extensão de marcação para a MMP-9 de mais de 50% dos mastócitos num mastocitoma cutâneo canino de grau 3. Estalão=30µm
2. CADERINA-E
A imunorreatividade para a caderina-E foi de localização membranar, verificando-se a nível das uniões célula-a-célula na epiderme, no folículo piloso e nas glândulas anexas, estruturas que constituíram o controlo positivo interno. A intensidade de marcação das células tumorais foi avaliada comparativamente a este controlo. Observou-se ainda marcação citoplasmática ou mista.
Em 69,5% das neoplasias analisados (n=21) foi observada imunorreatividade para a caderina-E de mais de 50% das células. Em 23,8% dos casos (n=7), só 25% a 50% das células apresentaram marcação (tabela 8). Na figura 11 estão ilustrados os resultados obtidos na análise da extensão de marcação da caderina-E.
Em algumas células, a reatividade não foi homogénea em toda a membrana citoplasmática, existindo focalmente maior intensidade de marcação para a caderina-E.
No estudo comparativo entre os diferentes graus histológicos verificou-se não existirem diferenças estatisticamente significativas na extensão de células marcadas para a caderina-E (p=0,552) (tabela 8). No entanto, estas diferenças foram estatisticamente significativas para a intensidade de marcação (p=0,034) (tabela 8).
RESULTADOS
26
Tabela 8. Avaliação da imunorreatividade para a caderina-E.
Caderina-E Grau Total p 1 2 3 Extensão 0 n % 0 ,0% 0 ,0% 1 10,0% 1 3,3% 0,552 1 n % 0 ,0% 0 ,0% 1 10,0% 1 3,3% 2 n % 3 33,3% 2 18,2% 2 20,0% 7 23,8% 3 n % 6 66,7% 9 81,8% 6 60,0% 21 69,5% Intensidade 0 n % 0 ,0% 0 ,0% 1 100,0% 1 100,0% 0,034 1 n % 1 7,7% 4 30,8% 8 61,5% 13 100,0% 2 n % 4 50,0% 4 50,0% 0 ,0% 8 100,0% 3 n % 4 50,0% 3 37,5% 1 12,5% 8 100,0%
Figura 11. Extensão de marcação para a caderina-E em tumores de diferentes graus histológicos.
0 1 2 3 4 5 6 7 8 9
Grau 1 Grau 2 Grau 3
0 <25% 25-50% >50%
RESULTADOS
27
Regra geral, os mastocitomas de grau 1 apresentaram uma intensidade de marcação forte para a caderina-E (figura 12 e 13) e os mastocitomas de grau 3 apresentaram uma marcação fraca para a caderina-E (figura 12 e 14).
Figura 12. Intensidade de marcação para a caderina-E em tumores de diferentes graus histológicos.
Figura 13. Expressão de marcação da caderina-E. Intensidade de marcação forte num mastocitoma
cutâneo canino de grau 1. Estalão =30µm 0 1 2 3 4 5 6 7 8
Grau 1 Grau 2 Grau 3
Sem marcação Fraca
Moderada Forte
RESULTADOS
28
Figura 14. Expressão de marcação da caderina-E. Intensidade de marcação fraca num mastocitoma
cutâneo canino de grau 3. Estalão =30µm
3. ASSOCIAÇÃO ENTRE A EXPRESSÃO DA MMP-9 E DA CADERINA-E
Todas as neoplasias analisadas marcaram quer para a MMP-9 quer para a caderina-E. A avaliação da associação entre a imunomarcação da MMP-9 e a extensão de marcação da caderina-E encontra-se descrita na tabela 9.
Em 14 tumores ocorreu uma marcação da MMP-9 em menos de 25% dos mastócitos enquanto que a marcação de caderina-E ocorreu em mais de 50% das células. Em 2 dos 30 tumores ocorreu uma marcação de mais de 50% das células tanto para a caderina-E como para a MMP-9. Estes resultados não foram estatisticamente significativos (p=0,627).
RESULTADOS
29
Tabela 9. Frequências absolutas da associação entre a extensão de imunorreatividade de caderina-E
e a extensão de imunorreatividade de MMP-9 nos MCTs estudados.
Expressão MMP-9 de Caderina-E 1 2 3 p 0 0 1 0 0,627 1 1 0 0 2 4 3 0 3 14 5 2 TOTAL 19 9 2
Fazendo a associação entre a intensidade de marcação da caderina-E e a extensão de marcação da MMP-9, verificou-se que, tal como na associação anterior, os resultados não foram estatisticamente significativos (p=0,270) (tabela 10).
Em 6 das 30 neoplasias ocorreu uma marcação intensa para a caderina-E e marcação em menos de 25% dos mastócitos para a MMP-9. A marcação da MMP-9 em mais de 50% dos mastócitos ocorreu apenas em 2 neoplasias, tendo estas apresentado uma intensidade de marcação fraca para a caderina-E (grupo 1).
Tabela 10. Frequências absolutas da associação entre a intensidade de imunorreatividade de
caderina-E e a extensão de imunorreatividade de MMP-9 nos MCTs estudados
Intensidade MMP-9 de Caderina-E 1 2 3 p 0 0 1 0 0,270 1 6 5 2 2 7 1 0 3 6 2 0 TOTAL 19 9 2
DISCUSSÃO
30
CAPÍTULO V – DISCUSSÃO
1. AVALIAÇÃO DA IMUNORREATIVIDADE PARA A MMP-9
A degradação da matriz extracelular e a angiogénese têm sido apontadas como fatores-chave no crescimento e progressão de tumores (MacDougall e Matrisian, 1995; Stetler-Stevenson, 1996; Kawai, et al., 2006; Giantin, et al., 2012). A degradação da matriz e consequente invasão de uma neoplasia depende da proteólise extracelular, o que é mediada em grande medida por MMPs produzidas por células neoplásicas (Giantin, et al., 2012).
Neste estudo, a marcação da MMP-9 ocorreu no citoplasma das células tumorais, tal como no estudo de Giantin e colaboradores (2012) e observou-se que MCTs de grau 3 apresentaram uma extensão de marcação para a MMP-9 superior aos MCTs de grau 1 e 2.
A marcação para a MMP-9 ocorreu em todas as neoplasias analisadas, sendo que mais de 50% dos MCTs de grau 1 apresentaram marcação para a MMP-9 em menos de 25% dos mastócitos. Nenhum dos MCTs pertencentes ao grau 1 e 2 apresentaram marcação de mais de 50% dos mastócitos. Estes resultados vão ao encontro dos resultados obtidos por Giantin e colaboradores (2012), os quais também encontraram diferenças estatisticamente significativas entre os diferentes graus histológicos (p<0,05).
Estes dados estão também de acordo com o estudo de Loukopoulos e colaboradores (2003) que correlaciona a produção de gelatinases com o comportamento biológico da neoplasia: tumores produzem mais MMP-9 que tecidos não neoplásicos e tumores malignos produzem significativamente mais MMP-9 que tumores benignos (Kawai, et al., 2006; Nakaichi, et al., 2007; Aresu, et al., 2011).
2. AVALIAÇÃO DA IMUNORREATIVIDADE PARA A CADERINA-E
A caderina-E tem vindo a ser descrita na literatura como uma proteína de adesão celular com um papel importante na invasão tumoral, podendo a sua ativação levar a um atraso no crescimento das células tumorais (Berx, et al., 1995).
Aponta-se que a diminuição de expressão da caderina-E seja um acontecimento crucial na perda de adesão celular, dotando as células tumorais de capacidade invasiva e levando ao crescimento tumoral e formação de metástases (Gama, et al., 2008; Mackowiak, et al., 2012).
DISCUSSÃO
31
Mackowiak e colaboradores (2012) observaram uma intensidade de marcação para a caderina-E reduzida na membrana plasmática das células neoplásicas e diminuição da expressão da mesma no citoplasma e/ou núcleo quando a neoplasia apresentava um fenótipo mais agressivo.
Neste estudo verificou-se a marcação da membrana plasmática e do citoplasma. Regra geral, os MCTs de grau 3 apresentaram uma menor extensão de marcação para a caderina-E que os mastocitomas de grau 1 e 2, não sendo, no entanto, os resultados encontrados estatisticamente significativos (p>0,05). Os mastocitomas de grau 3 apresentam um comportamento mais agressivo do que os mastocitomas de grau 1 e, tal como em outras neoplasias, como os tumores de mama na cadela (De Matos, et al., 2007; Gama, et al., 2008), os adenocarcinomas colorretais caninos (Aresu, et al., 2010), e os tumores pancreáticos humanos (Menke, et al., 2001), a diminuição da expressão da caderina-E está associada a um aumento da agressividade do tumor.
Averiguou-se também uma correlação inversa entre a intensidade de marcação e o grau histológico tumoral, ou seja, os tumores de grau 3 apresentaram uma intensidade de marcação para a caderina–E inferior aos tumores de grau 1 e de grau 2. Estes resultados estão de acordo com os resultados obtidos por Mackowiak e colaboradores (2012), sugerindo que a caderina-E desempenha um papel de relevo no comportamento biológico da neoplasia.
Ainda no que concerne à intensidade de marcação para a caderina-E verificou-se que os MCTs de grau 1 e 2 apresentaram intensidades de marcação semelhantes, o que parece apoiar o modelo de classificação em apenas dois graus (alto grau e baixo grau) de Kiupel e colaboradores (2011), tal como o estudo de Mackowiak e colaboradores (2012).
3. ASSOCIAÇÃO ENTRE A EXPRESSÃO DA MMP-9 E DA CADERINA-E
A MMP-9 é uma enzima proteolítica envolvida na renovação fisiológica da matriz extracelular (Salamonsen, 1994; Hulboy, et al., 1997; Madlener, et al., 1998), assim como em processos patológicos, como a invasão e metastases tumorais (Loukopoulos, et al., 2003).
Inicialmente, a degradação do tecido conjuntivo envolvente foi considerado o passo necessário para permitir que células malignas invadam o tecido localmente ou que adquiram acesso à corrente linfática e/ou sanguínea e levem ao aparecimento de metástases (Liotta, 1986).
DISCUSSÃO
32
A caderina-E é uma glicoproteína transmembranar envolvida na junção intercelular da maioria dos tecidos epiteliais humanos e animais, sendo encontrada também em mastócitos normais (Tegoshi, et al., 2000).
Pensa-se que a expressão decrescente de caderina-E seja um acontecimento crucial na perda de adesão celular (Salahshor, et al., 2008; Elston, et al., 2009; Knirsh, et al., 2009) e consequente progressão e crescimento de tumores malignos (Menke, et al., 2001; Nowak,
et al., 2008).
Estudos recentes relativos à expressão da MMP-9 em MCTs revelaram um aumento da expressão desta enzima em MCTs de grau 3, enquanto que MCTs de grau 1 e 2 apresentaram uma menor expressão de MMP-9 (Giantin, et al., 2012). Quanto à caderina-E, Mackowiak e colaboradores (2012) observaram que MCTs de grau 3 apresentavam uma menor expressão de caderina-E quando comparados com MCTs de grau 1.
De acordo com estes estudos seria de esperar uma associação entre a imunorreatividade da MMP-9 e da caderina-E. No entanto, no nosso estudo não foram observadas diferenças estatisticamente significativas entre a extensão de marcação da MMP-9 e a intensidade e extensão de marcação da caderina-E.
4. A MMP-9 E A CADERINA-E COMO INDICADORES DE PROGNÓSTICO
O papel da caderina-E e da MMP-9 na génese tumoral tem vindo a ser amplamente estudado tanto em medicina veterinária como em medicina humana (Handschuh, et al., 1999; Menke, et al., 2001; Loukopoulos, et al., 2003; Takagi, et al., 2005; Kawai, et al., 2006; Matos, et al., 2006; De Matos, et al., 2007; Nakaichi, et al., 2007; Gama, et al., 2008; Pires,
et al., 2009; Aresu, et al., 2010; Aresu, et al., 2011; Singhai, et al., 2011; Giantin, et al., 2012;
Mackowiak, et al., 2012).
A expressão da MMP-9 tem sido avaliada como um critério de malignidade em diferentes neoplasias em animais, como o tumor mamário canino, por métodos de zimografia e de imunohistoquímica (Hirayama, et al., 2002; Kawai, et al., 2006). Nestes estudos, a síntese de MMP-9 por células neoplásicas desempenhou um papel importante no comportamento agressivo do tumor, incluindo a destruição do tecido mamário e a invasão dos tecidos envolventes (Hirayama, et al., 2002; Kawai, et al., 2006).
Também no osteossarcoma canino, a atividade da MMP-9 foi investigada e os mesmos resultados foram encontrados, estando a MMP-9 relacionada com a malignidade da neoplasia (Lana, et al., 2000).