UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Estudos preliminares em tenca (Tinca tinca)
Avaliação do crescimento e comportamento alimentar
Dissertação de Mestrado Engenharia Zootécnica
Fábio Miguel Ribeiro Leite
Orientador: Professor Doutor Paulo Rema
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Estudos preliminares em tenca (Tinca tinca)
Avaliação do crescimento e comportamento alimentar
Dissertação de Mestrado Engenharia Zootécnica
Fábio Miguel Ribeiro Leite
Orientador: Professor Doutor Paulo Rema
Composição do Júri:
_____________________________________________________
_____________________________________________________
_____________________________________________________
_____________________________________________________
iii
DECLARAÇÃO
O autor declara que:
(1) todo o conteúdo das páginas seguintes é de autoria própria, decorrendo do estudo, investigação e trabalho do autor;
(2) quaisquer materiais utilizados para produção deste trabalho não colocam em causa direitos de Propriedade Intelectual de terceiras entidades ou sujeitos e, finalmente, que
(3) este trabalho não foi previamente submetido como elemento de avaliação nesta ou em outra instituição de ensino/formação.
UTAD, Outubro 2016
iv
AGRADECIMENTOS
Aos meus pais, irmã e aos meus avós por todo o apoio que me deram durante todo o percurso, e por todos os sacrifícios que fizeram e continuam a fazer para que eu pudesse seguir o caminho académico que escolhi.
Ao Professor Doutor Paulo Rema por toda a ajuda que tive, pela disponibilidade e por me ter permitido escolher e seguir este projeto mesmo com as dificuldades existentes. À Sara Bastos e António pela ajuda, disponibilidade e pelos ensinamentos que me ofereceram sempre que precisei. A conclusão do trabalho não teria sido possível sem a ajuda deles.
Ao Afonso Campos, Fernanda Bernardo, Inês Neves, João Faria, Mafalda Mourão, Marco Amaral, Pedro Cunha, Pedro Rodrigues, Raúl Oliveira, Ricardo Sousa, Rita Fortuna, Rita Santos, Sara Oliveira e Susana Barros, a família que conheci na faculdade, que me mostraram que a faculdade é mais do que estudos e trabalho e que um percurso académico sem verdadeiros amigos a caminhar ao nosso lado não vale a pena ser vivido. Desejo-vos um futuro recheado de sucessos a todos os níveis e tenho a certeza que os laços criados entre nós perdurarão por muitos anos para além daqueles passados na faculdade.
Ao Christophe Silva, Diogo Campos, Inês Francisco, João Aguiar, Maria Sá Gomes e Ricardo Reis e todos os outros que me acolheram na UTAD, e permitiram que os meus dois anos fossem muito mais fáceis.
À Ana Ribeiro, Cláudia Barbosa, Diogo Afonso, Gonçalo Azevedo, Mariana Magalhães, Margarida Branco, Tânia Ferreira e Sara Santos, por estarem entre os amigos que posso contar há mais tempo e por toda a amizade que sempre me ofereceram e que estes laços continuem por muitos mais anos.
v
RESUMO
O aumento contínuo da produção em aquacultura global está a levar a uma escassez dos recursos utilizados para a sua manutenção, entre os quais a farinha de peixe. É então necessário a procura de novas alternativas como fontes de proteína. A tenca surge como uma espécie importante para investigação, devido ao seu grande potencial para prosperar na aquacultura.
O objetivo deste trabalho é contribuir para o estudo relacionado com a utilização de ingredientes alternativos, ricos em proteína, que possam ser utilizados na formulação de dietas para a alimentação da tenca de forma a tornar a sua produção mais sustentável e eficiente.
Foram utilizadas 3 dietas experimentais para juvenis de tenca, formuladas de modo a respeitar as exigências nutricionais. Foi utilizada uma dieta controlo (CTRL) que continha farinha de peixe como principal fonte de proteína. As dietas experimentais (T1, T2 e T3) diferiram na sua composição em relação à dieta de referência (CTRL) devido à inclusão de uma mistura, em partes iguais, de 2 algas (Spirullina e Chlorella) e uma farinha de inseto (Tenebrio molitor). Essa mistura de ingredientes substituiu parcialmente a incorporação de farinha de peixe na dieta T1 em cerca de 50% enquanto na dieta T2, a percentagem de substituição da farinha de peixe aumentou para os 70% e, finalmente, na dieta T3 chegou aos 90% de substituição. Foram utilizados doze grupos homogéneos (peso médio inicial: 4,4g), distribuídos aleatoriamente por doze tanques de vidro, constituindo assim, triplicados de cada tratamento. Os peixes foram alimentados com as dietas experimentais durante 90 dias.
No final do ensaio foram avaliados os parâmetros do crescimento e da sua eficiência alimentar. Após a análise dos resultados, foram observadas diferenças significativas (P< 0,05) para o crescimento e eficiência do alimento entre a dieta CTRL e as dietas T1,T2 e T3. Os resultados apresentados pelas restantes dietas apesar de serem significativamente inferiores, não retiram a possibilidade de serem utilizadas como fontes alternativas de proteína animal, usadas em simultâneo, em tencas.
vi Os resultados obtidos revelaram-se francamente promissores sendo que subsiste a necessidade de mais investigação nesta área através da afinação e calibração dos níveis de inclusão destes ingredientes para obtenção de performances mais consentâneas com esta espécie extremamente delicada.
Palavras-chave:
vii
ABSTRACT
The continuous increase of production in global aquaculture is leading to a shortage of resources used in its maintenance, fishmeal being one of them. It is then necessary to search for new alternatives as sources of protein. Tench emerges as an important species for research due to its great potential to thrive in aquaculture.
The objective of this work is to contribute to the study related to the use of alternative ingredients rich in protein, which can be used in the formulation of diets for feeding tench in order to make their production more sustainable and efficient.
We used three experimental diets for juvenile tench, formulated to meet their nutritional requirements. A control diet (ctrl) was used, containing fish meal as the primary protein source. Experimental diets (T1, T2 and T3) differed in composition when compared to the reference diet (CTRL) due to the inclusion of a mixture of equal parts of 2 algae (Spirullina and Chlorella) and an insect meal (Tenebrio molitor). This mixture of ingredients partially replaced fishmeal incorporation by about 50% in the diet T1 while in the diet T2, the replacement of fishmeal increased to 70% and finally, the diet T3 reached a replacement of 90%. Twelve homogeneous groups were used (average initial weight: 4,4g), randomly distributed by twelve glass tanks, thus forming triplicates for each treatment. The fish were fed the experimental diets during 90 days.
At the end of the trial we evaluated the growth and feed efficiency parameters. After analyzing the results, significant differences were observed (P <0.05) for growth and feed efficiency between the diet CTRL and T1, T2 and T3 diets.
Although the results presented by the other diets were significantly lower, it doesn’t withdraw from the possibility of being used as alternative sources of animal protein, when used simultaneously in tench.
The results have proved promising but there is a need for further research in this area through the tuning and calibration of inclusion levels of these ingredients to obtain more consistent performances with this very delicate species.
Keywords:
viii
ÍNDICE
1 INTRODUÇÃO... 10
1.1 Introdução Geral... 10
1.2 Aquacultura: Situação Mundial e Consumo Pescado... 10
1.3 Aquacultura em Portugal... 11
1.3.1 Consumo em Portugal... 13
1.4 Alimentação em peixes – Necessidades e Perspetivas... 15
1.4.1 Utilização de algas como fonte de proteína... 16
1.4.2 Insetos na alimentação animal………... 18
1.5 A Tenca (Tinca tinca)... 19
1.5.1 Distribuição Global…………... 19
1.5.2 Ciclo de Vida………... 20
1.5.3 Hábitos Alimentares……….. 20
1.6 Produção de tenca em aquacultura………... 21
2 MATERIAL E MÉTODOS ... 25
2.1 Dietas experimentais ... 25
2.2 Ensaio de crescimento ... 27
2.3 Análise proximal das dietas... 28
2.4 Determinações ... 29 2.5 Análise estatística ... 29 3 RESULTADOS... 30 3.1 Parâmetros do crescimento e da eficiência alimentar... 30
4 DISCUSSÃO………... 35
5 CONCLUSÃO………. 38
ix
ÍNDICE DE FIGURAS
Imagem 1 - Distribuição global de Tinca tinca. Mapa de GBIF (Global Biodiversity Information Facility, 2014)………. 20
ÍNDICE DE TABELAS
Tabela 1 - Produção Mundial em 2013 (Fonte: EUROSTAT (para pescado EU-28), FAO (para países extra-EU e aquacultura EU)……….. 11 Tabela 2 - Produção das espécies mais produzidas em Portugal em toneladas (Dados: FishstatJ)………. 12 Tabela 3 - Produção (ton) de tenca em regime de aquacultura (Dados: FishstatJ)……. 21 Tabela 4 - Composição em ingredientes das dietas experimentais (CTRL, T1, T2 e T3)……….. 25 Tabela 5 - Composição das dietas experimentais (CTRL, T1, T2 e T3)……… 26 Tabela 6 - Parâmetros do crescimento e eficiência alimentar……… 30 Tabela 7 - Comprimentos (cm) médios iniciais e finais das tencas após 90 dias de ensaio……….. 33 Tabela 8 - Comparação de TCE e TCA de T.tinca obtidos em ensaios de crescimento em condições controladas………... 36
ÍNDICE DE GRÁFICOS
Gráficos 1 - Evolução da Produção Total da Aquacultura em Portugal (Dados:
FishstatJ)………. 12 Gráfico 2 - Consumo per capita de pescado nos países da União Europeia em 2010. Inclui-se ainda a Islândia e o Japão (FAO, 2011)………... 13 Gráfico 3 - Produção aquícola dos países da União Europeia (Fonte: EU, 2014)……. 14 Gráfico 4 - Despesa, por habitação, em produtos derivados da pesca e da aquacultura nos países da União Europeia e percentagem de variação em 2012/2013 (Fonte:
EUROSTAT)……….. 15 Gráfico 5 - Evolução da produção total de tenca (Dados FishstatJ)………... 22 Gráfico 6 - Evolução da temperatura e do oxigénio dissolvido ao longo do ensaio….. 28 Gráfico 7 - Evolução do peso médio corporal das tencas ao longo dos 90 dias de
ensaio……….. 31 Gráfico 8 - Evolução da Taxa de Conversão Alimentar………. 32 Gráfico 9 - Evolução do Comprimento das tencas (90 dias; cm)………... 33
10
1. INTRODUÇÃO
1.1.Introdução Geral
Desde do passado que a pesca é uma das maiores fontes de alimento, de emprego e de benefícios económicos para a sociedade. A produtividade oceânica aparentava ser ilimitada contudo, com a evolução do conhecimento, surgiu a consciência de que os recursos marinhos não eram infinitos e que necessitavam de ser propriamente geridos. Isto se a sua contribuição para a nutrição, economia e bem-estar da população mundial se queria manter (FAO, 2010).
Apesar da conscientização, devido ao enorme crescimento da população, pesca não regularizada usando técnicas ilegais e abusivas, as capturas têm sido cada vez mais reduzidas com as reservas naturais de peixe a atingirem taxas alarmantes. Nos últimos anos houve uma modernização e desenvolvimento do sector, contudo isso não diminuiu a exploração dos recursos, dado que a procura por alimento de elevado valor biológico continua a aumentar.
Perante esta situação, os membros da FAO expressaram a necessidade de um maior desenvolvimento da aquacultura numa tentativa de se conseguir produzir mais e de forma mais eficiente, dado que a população continua a crescer mas as capturas de peixe a diminuir (FAO, 2011).
1.2. Aquacultura: Situação Mundial e Consumo Pescado
A aquacultura é o setor da produção animal que apresenta um maior crescimento global contribuindo já com mais de 50% do pescado consumido a nível mundial como é possível verificar na tabela 1 (FAO,2012).
11 Tabela 1: Produção Mundial em 2013(toneladas) (Fonte: EUROSTAT (para pescado EU-28),
FAO (para países extra-EU e aquacultura EU).
O crescimento verificado nos últimos anos procura responder ao aumento mundial da procura e consumo de pescado per capita, principalmente nos países em desenvolvimento, com destaque para a Ásia. Os países da União Europeia surgem logo após os principais produtores Asiáticos todavia, como a sua produção é insuficiente para o consumo doméstico, as suas necessidades são cobertas através da importação, sendo a UE a maior negociante em produtos derivados da pesca e aquacultura (EUMOFA, 2015). A contribuição da aquacultura continuará a aumentar dadas às limitações dos níveis de captura de peixe selvagem associada ao aumento da população mundial e a uma crescente confiança do consumidor no peixe de aquacultura. Cada vez mais a aquacultura é praticada de uma forma correta, responsável e sustentável garantindo elevados padrões de segurança alimentar (Valente et al., 2015).
1.3. Aquacultura em Portugal
Apesar de reduzida, a produção aquícola portuguesa tem evoluído nos últimos anos com destaque para o rodovalho como sendo a espécie de peixe mais produzida (Tabela 2). A sua produção evoluiu de 214 toneladas, em 2005, para mais de 3500 toneladas em 2014.
12 Tabela 2: Produção das espécies mais produzidas em Portugal em toneladas (Dados: FishstatJ
(FAO 2011-2017))
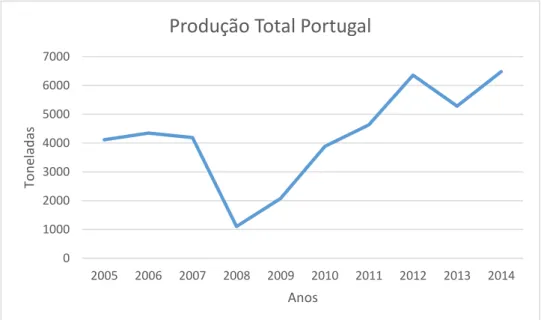
Gráfico 1: Evolução da Produção Total da Aquacultura em Portugal (Dados: FishstatJ
(FAO 2011-2017))
Como podemos constatar no Gráfico 1 tem havido evolução dos valores desde 2005, Portugal tem vindo a crescer como produtor contudo, em 2008, sofreu grande baixa de produção. Desde essa altura o crescimento tem sido constante e prevê-se que a produção continue a aumentar, apoiando-se no programa do Fundo Europeu dos Assuntos Marítimos e das Pescas (FEAMP) – 2014/2020, que tem como objetivo incentivar uma aquacultura ambientalmente sustentável, inovadora e competitiva. Contudo, para essa
Peixe/Ano 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 Rodovalho 214 185 167 351,3 1276 2423,5 3196,7 4406,2 2353,09 3587,88 Pargo 1519 1623 1930 442,1 524 422 269 894,9 1426,88 1602,14 Truta Arco-íris 843 942 892 293 246 950 1112,7 478,6 773,7 751,07 Robalo 1530 1584 1192 4,3 17 75 52 531,3 575,33 454,72 Solha 11 9 8 13 14 13,4 3,6 44,9 154,05 83,91 Total 4117 4343 4189 1103,7 2077 3883,9 4634 6355,9 5283,05 6479,72 0 1000 2000 3000 4000 5000 6000 7000 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 To n elad as Anos
13 idealização acontecer, Portugal deve apostar, quer na diferenciação, quer no aumento da produção (Valente et al., 2015).
1.3.1. Consumo em Portugal
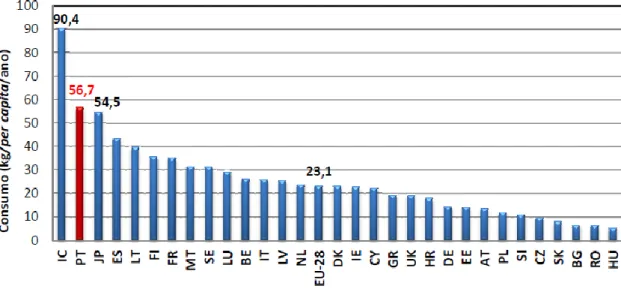
Portugal surge como o maior consumidor de pescado da União Europeia e um dos maiores do mundo, com 57 kg/per capita /ano, sendo a média europeia de 23 kg (Gráfico 2).
Gráfico 2: Consumo per capita de pescado nos países da União Europeia em 2010. Inclui-se
ainda a Islândia e o Japão (FAO, 2011).
Códigos usados para os vários países: BE – Bélgica, BG – Bulgária, CZ – República Checa, DK – Dinamarca, DE – Alemanha, EE – Estónia, ES – Espanha, FR – França, GR – Grécia, HR – Croácia, IC – Islândia, IE – Irlanda, IT – Itália, JP – Japão, CY – Chipre, LV – Letónia, LT – Lituânia, LU – Luxemburgo, HU – Hungria, MT – Malta, NL – Holanda, AT – Áustria, PL – Polónia, PT – Portugal, RO – Roménia, SI – Eslovénia, FI – Finlândia, SE – Suécia, UK – Reino Unido.
Apesar da sua posição de destaque como consumidor a sua classificação em termos de produção é bastante modesta em relação aos restantes países da EU como podemos verificar no Gráfico 3.
14 Gráfico 3: Produção aquícola dos países da União Europeia (Fonte: EU, 2014).
A disponibilidade de pescado para consumo tem vindo a diminuir nos últimos anos conduzindo a uma perda de consumo de 8,7 g/per capita (INE,2014). O elevado consumo nacional é essencialmente suportado pelas pescas sendo que o peso da aquacultura portuguesa no fornecimento de pescado para consumo interno é ainda muito baixo.
Para cobrir as suas necessidades Portugal importa cerca de 2/3 do pescado que consome o que, economicamente, representa um desequilíbrio na balança financeira do país (Valente et al., 2015).
15 Gráfico 4: Despesa, por habitação, em produtos derivados da pesca e da aquacultura nos países
da União Europeia e percentagem de variação em 2012/2013 (Fonte: EUMOFA, 2015)
Portugal aparece destacado no nível de despesa em produtos derivados da pesca e aquacultura (Gráfico 4). O consumo elevado aliado à necessidade de importação faz com que a vontade política em apostar na aquacultura nacional seja grande. Existem, contudo, vários problemas que condicionam este desenvolvimento. Mapeamento e identificação de zonas adequadas à atividade, regulamentação de seguros, acesso ao financiamento, entre outras situações, que bloqueiam o crescimento sustentado e sustentável da atividade a nível nacional (Valente et al., 2015).
1.4. Alimentação em peixes – Necessidades e Perspetivas
Em geral, os custos da alimentação em aquacultura representam a despesa mais elevada de toda a exploração, podendo chegar aos 70% (Metts et al., 2007; Thompson et
16 al., 2008). Um dos constituintes mais importantes na alimentação dos peixes, com custo elevado na formulação das dietas comerciais, é a proteína da dieta. A farinha de peixe é, seguramente, o ingrediente de origem proteica mais utilizado no mundo para o fabrico de alimento composto para peixes. De facto, a farinha de peixe fornece, entre outros, proteína de alta qualidade e elevado valor biológico, ácidos gordos essenciais, com palatabilidade elevada que promove performance de crescimento ótima (Gomes et al., 1995). Estas características fazem com que a sua exploração e utilização tenha sido levada ao limite nas últimas décadas (FAO, 2012). De um modo geral, os peixes necessitam entre 25-55% de proteína nas suas dietas, dependendo da espécie e fase biológica (NRC, 1993) o que faz com que uma grande percentagem da exploração mundial de peixe tenha como destino final a transformação em farinha de peixe ou óleo de peixe.
O aumento do custo do ingrediente, a diminuição das reservas naturais de peixe e o aumento da procura e do excesso de pesca das espécies selvagens são algumas das razões que estão na origem do aumento do número de estudos relacionados com a utilização de fontes de proteína alternativa observado nas últimas décadas. Fontes de proteína alternativas como plantas, algas, bactérias, insetos ou produtos secundários de outros animais têm sido estudadas com o objetivo de analisar a viabilidade do seu uso em substituição integral ou parcial da farinha de peixe (Ayadi et al, 2012).
Entre outras vantagens, estas novas alternativas à farinha de peixe apresentam menores custos associados e maior facilidade da sua obtenção. O principal objetivo é conseguir que a utilização destas fontes de proteína consiga atingir as performances (taxa de crescimento, sobrevivência ou o ganho de peso) observadas com as fontes proteicas tradicionais. Um aspeto muito importante de qualquer ingrediente é o seu valor nutricional que, dependendo do caso, pode ser complementado utilizando uma mistura de várias fontes proteicas (Ayadi et al, 2012). Neste estudo testamos algumas potenciais alternativas de fontes proteicas à farinha de peixe na alimentação da tenca.
1.4.1. Utilização de algas como fonte de proteína
As possíveis fontes alternativas de proteína a utilizar na dieta dos peixes devem satisfazer as necessidades mais importantes dos animais, seja em proteína, seja em ácidos gordos, entre outras. Uma das limitações na utilização de fontes de proteína vegetal na
17 alimentação dos peixes é que, de um modo geral, elas são deficientes em alguns aminoácidos essenciais como a lisina, metionina, treonina e triptofano (Mai et al. 2006; Li et al., 2009). Numerosas algas aparentam ser uma alternativa promissora uma vez que elas contêm todos os aminoácidos essenciais podendo ser utilizadas como substituto parcial da farinha de peixe (Dawczynski et al., 2007; Lupatsch, 2009).
As algas possuem um valor nutricional elevado devido aos seus teores proteicos e ao seu conteúdo em minerais, além disso são fontes naturais de vitaminas e de ácidos gordos da família ómega-3, que apresentam benefícios tanto na alimentação humana como na animal (Norziah et al, 2000; Khotimchenko et al., 2002).
Já foram realizados vários estudos utilizando macroalgas como componente do alimento em formulação de dietas para corvinas (Pseudosciaena crocea; Asino et al. 2011), robalo (Dicentrarchus labrax; Valente et al., 2006), truta arco-íris (Oncorhynchus
mykiss; Soler-Vila et al., 2009), carpa (Cyprinus carpio; Diler et al., 2007), bacalhau do
atlântico (Gadus morhua; Walker et al., 2009) e tainha (Chelon labrows; Davies et al., 1997). Vários destes estudos demostraram que as macroalgas podem ser incluídas na dieta com sucesso, sem efeitos nocivos na performance e com alterações benéficas na composição corporal, em particular no perfil em ácidos gordos (Ergün et al., 2008; Güroy et al., 2012).
Algas com coloração verde e vermelha são as que, geralmente, possuem maior teor em proteína e são, atualmente, aquelas que apresentam maior potencial como ingredientes alternativos, possuindo bom conteúdo nutricional sendo passíveis de serem utilizadas em alimentos para peixes (Valente et al., 2006). O preço dos alimentos comerciais é elevado para os produtores de menor dimensão e, por isso, as farinhas de algas podem representar uma maneira mais rentável de incluir os aminoácidos essenciais nas dietas dos peixes (Swain et al., 2011).
As microalgas têm emergido como uma alternativa nutritiva natural nos últimos anos para novos compostos bioativos que podem ser utilizados como ingredientes em alimentos para animais (Reyes-Becerril et al., 2013; Christaki et al., 2011; Guedes et al., 2011). Devido às suas ricas propriedades nutricionais, as microalgas apresentam diversos usos na aquacultura. Para além do seu valor nutritivo, elas contêm componentes indutores de estimulação imunológica nos peixes e em outros animais (Amar et al., 2004; Guzman et al., 2003; Morris et al., 2007; Ortuno et al., 2000; Puangkaew et al., 2004). Estudos recentes sobre a importância destas algas na aquacultura focam-se no seu efeito no
18 crescimento e na retenção de nutrientes (Kumar., 2011). Entre as espécies existentes de microalgas, Arthrospira spp., Chlorella spp. e Scendesmus spp. são as mais usadas em alimento para peixes, particularmente como suplemento ou misturadas com outras fontes de proteína da dieta (S. Velasquez et al., 2015).
1.4.2. Insetos na alimentação animal
Hoje em dia, as farinhas de insetos têm um mercado semelhante ao da farinha de peixe. Elas são usadas como alimento na aquacultura, na produção de gado e na indústria dos animais domésticos. As necessidades crescentes em farinha de peixe conjugadas com o seu preço elevado e aumento da produção em regime de aquacultura, rapidamente levaram ao desenvolvimento de estudos científicos relacionados com a utilização de proteína de insetos em aquacultura (Van Huis et al., 2013).
Estudos relacionados com análise nutricional dos insetos revelaram que a maioria das espécies possui proteína em grande quantidade e de qualidade elevada (Ladrón de Guevara et al., 1995; Ramos – Elorduy et al., 1981; 1982; 1984; 1997).
Estudos previamente realizados avaliaram o teor em proteína bruta (PB) de várias espécies de insetos. Vinte espécies foram identificadas com valores de PB semelhantes aos da farinha de peixe e outras 28 com valores semelhantes ou superiores à proteína da soja. Os valores mais elevados foram obtidos nos coleópteros Metamasius spinolae (69,1%) e Rhantus atricolor (71,1%), nos dípteros Drosophila melanogaster (70.1%),
Boopedon flaviventris (76.0%), Melanoplus mexicanus (77.1%) e Sphenarium histrio
(74.8%) da ordem dos Orthoptera (Ramos-Elorduy et al.,1998).
Nos diferentes estudos realizados, de um modo geral, verificou-se que taxas de substituição da farinha de peixe superiores a 30% originaram um decréscimo no crescimento dependendo da espécie do peixe ou dos insetos utilizados (Barroso et al., 2014).
Na avaliação do potencial da utilização da proteína de inseto é necessário ter em conta outras vantagens como, por exemplo, os benefícios ambientais. De facto, os insetos criados para este fim podem ser alimentados com os desperdícios da alimentação humana tendo, assim, um papel importante na reutilização de materiais na biosfera terrestre
19 (Katayama et al., 2008). A grande diversidade de espécies existentes em ecossistemas diferentes, cada uma com a sua própria dieta e com diferentes fases de desenvolvimento (larva, pupa e ninfa), permite a existência de um sistema de criação sustentável e que possa ser usado com diferentes objetivos (Barroso et al., 2014).
1.5. A Tenca (Tinca tinca)
A tenca (Tinca tinca) é um peixe europeu de água doce. Pertence à Classe
Actinopterygii, Ordem Cypriniformes, Família Cyprinidae e ao Género Tinca. O seu
nome comum é tenca podendo, também, ser utilizado o nome Tinca vulgaris em alguma literatura.
As tencas apresentam uma grande resistência a diferentes condições ambientais tendo, contudo, preferência por águas calmas e quentes típicas dos lagos ou viveiros. Estes peixes procuram as zonas de pouca profundidade onde a água apresenta temperatura mais elevada associada à existência de vegetação aquática densa que favorece o seu processo reprodutivo (Nordstrom, 2011).
1.5.1. Distribuição Global
Os peixes da espécie T. tinca encontram-se bem disseminados pelo continente Europeu de onde são originários. A sua introdução abrange a América do Norte, América do Sul, África, Austrália e Ásia (Alas et al. 2009). Como é possível observar na Figura 1, a distribuição é global, centralizada na Europa.
20 Figura 1: Distribuição global de Tinca tinca. Mapa de GBIF (Global Biodiversity Information
Facility, 2014)
1.5.2. Ciclo de Vida
A vida de uma tenca pode-se prolongar até aos 10 anos. Conseguem atingir 45 cm de comprimento e 1,3 kg de peso (Wydoski, Whitney, 2003), contudo, o seu crescimento é lento (Erguden, Goksu, 2011). O seu crescimento em comprimento domina as primeiras fases da sua vida, sendo o ganho de peso o dominante nas fases posteriores (Benzer et al., 2009). T.tinca é altamente resistente devido à sua pele firme e à superfície mucosa que cobre o seu corpo (Benzer et al., 2010).
Os machos atingem a maturidade sexual entre os 2 e os 3 anos enquanto as fêmeas maturam entre os 3 e os 7 anos de idade (Macri et al. 2011). Na Europa a época de desova ocorre de Maio até Agosto. As tencas acumulam-se em zonas de pouca profundidade e água quente onde depositam os ovos em plantas aquáticas (Wydoski, Whitney, 2003). A temperatura da água para o processo de reprodução pode variar entre os 20.0 e os 31.6 ºC (Nordstrom, 2011).
1.5.3. Hábitos alimentares
As tencas são peixes de hábitos alimentares omnívoros (Gray, Dauble, 2001) que apresentam uma dieta bastante variada. Verifica-se uma tendência para se deslocarem para zonas onde existe uma grande quantidade de macrófitas (Alas et al., 2009). Nas fases
21 iniciais de vida alimentam-se de itens de pequeno tamanho tal como algas e organismos microscópicos. Com o avançar da idade e aumento de peso evoluem para presas de tamanho superior tais como insetos aquáticos e outros invertebrados como caracóis e amêijoas (Wydoski, Whitney, 2003).
As tencas são capazes de se alimentar de diferentes formas de vida dependendo da disponibilidade regional mas, geralmente, centram a sua alimentação em organismos bentónicos dando preferência a crustáceos (Alas et al., 2009).
1.6. Produção de tenca em aquacultura
A produção total de tenca, em regime de aquacultura, na Europa foi de aproximadamente 1520 toneladas em 2013. A produção distribui-se por 13 países diferentes sendo que os principais produtores são a França, a Polónia, a República Checa e a Alemanha (Tabela 3).
Segundo os registos de 2013 o maior produtor é a França com uma produção estimada em 900 toneladas, seguindo-se a Polónia com 200 toneladas e a República Checa e Alemanha com cerca de 150 toneladas. A Espanha surge em 6º lugar com uma produção de 20,3 toneladas. País/Ano 2010 2011 2012 2013 2014 França 900 900 500 900 900 Rep. Checa 215 180 166 156,3 151 Alemanha 161 156 146 Rússia 14 18 25 27 30 Espanha 40,7 56,5 4,4 20,3 23,19 Itália 4,2 15,8 15 15 15 Lituânia 9,8 1,71 4,5 11,12 12,95 Letónia 11,1 5,8 7 14,1 10,58 Áustria 5 9 7 12 8,4 Reino Unido 11,9 4,9 11,9 4 5 Bulgária 0 0 0,55 1,91 3,46 Hungria 4 8 6 2 2 Polónia 200 200 200 Total 1215,7 1399,71 1108,35 1519,73 1307,58
Tabela 3: Produção (ton) de tenca em regime de aquacultura (Dados: FishstatJ (FAO
22 No gráfico 5 pode ser consultada a evolução da produção total de tenca em termos mundiais.
Gráfico 5: Evolução da produção total de tenca (Dados FishstatJ (FAO 2011-2017))
Após um registo elevado no ano de 2000 a produção de tenca baixou de modo significativo muito devido ao abaixamento da produção francesa. Todavia, nos últimos anos, tem-se assistido a uma retoma com valores mais elevados devido ao número crescente de produtores e à otimização do sistema de registo que permite a obtenção de valores cada vez mais precisos, fundamentais para o controlo da produção.
A tenca (Tinca tinca) é considerada uma espécie com potencial elevado para a aquacultura (Steffens, 1995; Kamler et al., 2006; Wang et al., 2006; Wolnicki et al., 2006).
A espécie possuí um histórico de criação em lagos que data da Idade Média. Atualmente, é considerada uma espécie promissora para produção intensiva e tem, cada vez mais, atraído a atenção de investigadores e de produtores. A sua produção é habitualmente realizada em tanques de terra com utilização de sistemas de produção extensivos ou semi-extensivos onde o controlo e a gestão dos animais são relativamente complicados. Além disso, as produções são imprevisíveis podendo atingir valores elevados de mortalidade ou taxas de crescimento muito baixas. Um dos maiores
0 200 400 600 800 1000 1200 1400 1600 1800 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 To n elad as Anos
23 obstáculos para o aumento substancial da produção de tencas relaciona-se com a dificuldade de obtenção de juvenis para abastecimento nos ponds exteriores ou em sistemas de águas abertas (Wolnicki et al., 2006; Celada et al., 2009; Garcıa et al., 2010).
Atenção especial tem sido dada na procura de técnicas eficazes para a criação de tencas em condições de produção controladas focando-se, especialmente, nos aspetos relacionados com a alimentação. Na verdade, a informação relacionada com a alimentação das tencas é escassa e, por isso, são utilizadas, com muita frequência, formulações comerciais para outras espécies. Segundo vários autores, a utilização de alimento comercial não específico para a espécie estará na origem de resultados pouco favoráveis na performance produtiva com redução do crescimento (Quiros & Alvarino, 1998; Wolnicki & Myszkowski, 1998; Quiros et al., 2003; Mares et al., 2007), aumento da taxa de mortalidade (Quiros & Alvarino, 1998; Quiros et al., 2003; Rennert et al., 2003; Celada et al., 2009) e casos de deformações morfológicas (Rennert et al., 2003; Kamler et al., 2006; Wolnicki et al., 2006; Myszkowski et al., 2010). Estas observações são a provável resposta ao uso de um alimento inadequado para a espécie. Nesse sentido devem ser realizados mais esforços de investigação de modo a desenvolver uma dieta específica para as tencas que preencha as suas necessidades nutricionais permitindo, assim, alcançar melhores resultados produtivos.
Apesar de ainda não ter sido afinada a denominada “dieta ideal”, há cada vez mais estudos que procuram encontrar as formulações mais indicadas para a espécie e para as suas diferentes fases de crescimento.
Foi determinado que, a partir dos 5 meses de idade, um valor de 8,5% de lípidos e um teor médio de 50% de proteína na dieta são os mais indicados (Sáez-Royuela et al., 2015). Já o uso de dietas com teor de proteína inferior a 35% não é recomendado (N. De Pedro et al., 2001). Apesar dos valores acima referidos para peixes com idades superiores a 5 meses, no caso de animais mais jovens, entre os 50 dias e os 3 meses, os melhores resultados de crescimento foram obtidos utilizando teores proteicos de 57% e 15% de lípidos (Cileček et al., 2011).
O alimento vivo é utilizado normalmente na fase inicial da vida desta espécie. Aparentemente quanto maior for o período de alimentação com alimento vivo, melhores são as taxas de crescimento obtidas. As fórmulas de alimento comercial utilizadas em
24 larvas de tenca parece ser insuficiente para a obtenção de boas performances quando utilizado exclusivamente durante o início da alimentação exógena. Em sistemas de criação intensiva de T.tinca é recomendado que só após um período mínimo de 5 dias de alimentação com alimento vivo se possa iniciar a introdução de alimento comercial ( Wolnicki, 1996).
O objetivo deste trabalho é contribuir para o estudo relacionado com a utilização de ingredientes alternativos, ricos em proteína, que possam ser utilizados na formulação de dietas para a alimentação da tenca de forma a tornar a sua produção mais sustentável e eficiente.
25
2. Materiais e métodos
2.1. Dietas experimentais
Neste ensaio que a seguir se descreve foram utilizadas três dietas experimentais (tabela 4), para tencas (Tinca tinca) formuladas de modo a respeitar as suas exigências nutricionais conhecidas. As dietas isoenergéticas e isoprotéicas apresentaram valores médios de 52% de proteína, 14% de lípidos e 19 kJ g-1 de energia. Foi utilizada uma dieta controlo (CTRL) que continha farinha de peixe como principal fonte de proteína.
Ingredientes (%) CTRL T1 T2 T3 Farinha de peixe LT 70 40,0 20,0 10,0 Farinha de peixe 60 20,0 10,0 5,0 Concentrado proteico (CPSP 90) 5,0 5,0 5,0 5,0 Spirullina 7,0 11,0 15,0 Chlorella 7,0 11,0 15,0 Farinha de Tenebrio 7,0 11,0 15,0
Concentrado proteico de ervilha 5,0 5,3 7,0 8,2
Gluten de trigo 6,2 11,4 10,5 10,2
Farinha de trigo 14,0 11,3 12,2 10,7
Oleo de peixe 8,0 8,8 9,0 9,3
Vitaminas & Minerais (Premix) 1,0 1,0 1,0 1,0
Vitamina E (Lutavit E50) 0,1 0,1 0,1 0,1
Lecitina de soja 0,5 0,5 0,5 0,5
Mix de Macroalgas 5,0 5,0 5,0
Antioxidante 0,2 0,2 0,2 0,2
Propionato de sódio 0,1 0,1 0,1 0,1
MCP(Modified Citrus Pectin) 2,0
L-Histidina 0,2 0,4 L-Lisina 0,5 0,9 L-Treonina 0,2 L-Triptofano 0,1 DL-Metionina 0,3 0,6 1,0 L-Taurina 0,1 0,2 0,2
Tabela 4: Composição em ingredientes das dietas experimentais (CTRL, T1, T2 e T3)
As dietas experimentais (T1, T2 e T3) diferiram na sua composição em relação à dieta de referência (CTRL) devido à inclusão de uma mistura, em partes iguais, de 2 algas
26 (Spirullina e Chlorella) e uma farinha de inseto (Tenebrio molitor). Essa mistura de ingredientes substituiu parcialmente a incorporação de farinha de peixe na dieta T1 em cerca de 50% enquanto na dieta T2, a percentagem de substituição da farinha de peixe aumentou para os 70% e, finalmente, na dieta T3 chegou aos 90% de substituição. Existiu, portanto, uma substituição parcial progressiva da farinha de peixe da dieta.
As dietas que incorporaram níveis crescentes da mistura de algas e farinha de inseto foram ajustadas em relação aos seus aminoácidos essenciais limitantes.
Composição Proximal CTRL T1 T2 T3 % % % % Material seca (MS), % 94.78 94.29 94.46 94.52 Proteína bruta, % MS 52.35 52.36 52.40 52.37 Gordura bruta, %MS 14.46 14.49 14.49 14.51 Cinzas, % MS 14.87 9.56 7.09 5.15 Energia bruta, kJ/g MS 19.35 19.37 19.56 19.32 Fósforo, % MS 2.12 1.44 1.14 1.27
Tabela 5: Composição das dietas experimentais (CTRL, T1, T2 e T3).
Consultando a Tabela 5 verifica-se que as dietas se apresentaram isoenergéticas e isoprotéicas, tal como se pretendia no delineamento experimental, com valores médios de 52% de proteína, 14% de lípidos e 19 kJ g-1 de energia, de acordo com os valores disponíveis na bibliografia relacionados com as necessidades nutricionais da tenca.
As dietas foram produzidas pela SPAROS Lda., sendo que o método de fabrico envolveu a prévia moagem dos ingredientes, num moínho de martelo micropulverizador (Hosokawa Alpine, modelo SH1, Alemanha), que foram seguidamente colocados num misturador de 90 litros de dupla hélice. Nesta fase não foram adicionados os óleos. As misturas foram extrudidas (15 milímetros), utilizando para o efeito uma extrusora (escala piloto) de dupla rosca (diâmetro: 55,5 milímetros) Clextral BC45 (Clextral, França) a uma temperatura que oscilou entre os 105-110ºC.
Posteriormente, os lotes de alimentos extrudidos foram secos num forno de convecção (OP-750 UF, LTE Scientifics, Reino Unido), a 60ºC durante 2 h.
Após o arrefecimento dos pellets, foram incorporados os óleos, em condições de revestimento a vácuo (coating), num misturador de vácuo (PG-10VCLAB, Dinnisen,
27 Países Baixos). Ao longo do ensaio as dietas permaneceram armazenadas à temperatura ambiente, tendo sido retirada uma amostra de cada dieta para posterior análise.
2.2. Ensaio de Crescimento
Os juvenis de tencas (Tinca tinca) utilizados neste ensaio de crescimento foram adquiridos a uma empresa nacional que fez a importação direta de Israel. O ensaio decorreu nas instalações da Universidade de Trás os Montes e Alto Douro e realizou-se sob a supervisão de cientistas treinados e acreditados pela Direção Geral de Alimentação e Veterinária (DGAV), de acordo com a Federação das Associações Europeias de Ciência Animal de Laboratório (FELASA), seguindo as recomendações da categoria C e na sequência da Diretiva Europeia 2010/63/UE do Parlamento Europeu e do Conselho da União Europeia relativa à proteção dos animais utilizados para fins científicos.
No início do ensaio foram constituídos 12 grupos homogéneos de trinta peixes que apresentavam um peso médio individual de 4,8 ± 0,3g. Para além do peso, foi medido o comprimento inicial de 15 peixes, obtendo-se uma média de 6,97 ± 0,5 cm. Os grupos de peixes foram divididos, de modo aleatório, por doze aquários (100 L capacidade), constituindo triplicados de cada tratamento. No decorrer da experiência, os parâmetros da água foram mantidos dentro de valores apropriados para a espécie (temperatura: 23,9 ± 1,4ºC; oxigénio dissolvido: 6,9 ± 0,3 mg/L e pH: 6,8 ± 0,1) através da utilização de um sistema de recirculação de água em regime semi-fechado. As quatro dietas experimentais foram atribuídas aleatoriamente pelos doze tanques sendo que o alimento foi fornecido manualmente até à saciedade aparente, duas vezes por dia (10:00h e 15:00h), durante os 90 dias de duração do ensaio. Os animais foram submetidos a um fotoperíodo de16 horas de luz e 8 horas de obscuridade.
28 Evolução dos parâmetros da água
Gráfico 6: Evolução da temperatura e do oxigénio dissolvido ao longo do ensaio.
No início do ensaio foram recolhidos quinze peixes para a medição corporal e pesagem individual. Efetuaram-se pesagens de grupo mensais para avaliar o crescimento dos peixes e para contabilização do alimento que foi ingerido. Além de pesados, após os 90 dias, foi medido o comprimento de 6 peixes por tanque. No final do ensaio, os peixes permaneceram em jejum durante 24 horas antes de serem sujeitos à pesagem final.
2.3. Análise proximal das dietas
As amostras das dietas foram analisadas quanto ao teor de cinzas, durante 6h a 550 °C, proteína bruta (N × 6.25, em analisador Leco N, Modelo FP-528, Corporação Leco, St. Joseph, EUA), gordura bruta (extração com éter de petróleo, Soxtherm, Gerhardt, Alemanha), energia bruta (bomba calorimétrica adiabática, Werke C2000, IKA, Alemanha), matéria seca (forno de micro-ondas) e fósforo (espectrofotometria de UV).
0 5 10 15 20 25 30
2-Apr 20-Apr 8-May 26-May 13-Jun 1-Jul 19-Jul 6-Aug Temperatura (ºC) Oxigénio Dissolvido (mg/L)
29
2.4. Determinações
Na avaliação dos parâmetros do crescimento e de eficiência alimentar foi utilizado o ganho de peso (GP), a taxa de crescimento específico (TCE), o índice de crescimento médio diário (ICMD), a taxa de conversão alimentar (TCA), a eficiência alimentar (EA) e a ingestão voluntária de alimento (IVA). A taxa de mortalidade (TM) também foi avaliada durante o período experimental. Sendo PMI e PMF o peso médio do inicial e o peso médio do final do peixe, respetivamente, aplicaram-se as seguintes fórmulas:
GP (% PMI / dia) = ganho de peso * 100 / PMI * nº dias
TCE = 100* (LN (PMF) -LN (PMI)) / nº dias;
ICMD = 100 * PMF (g) 1/3 – PMI (g) 1/3) / nº dias;
TCA = ingestão voluntária de alimento (g) / ganho de peso (g);
EA = ganho de peso (g) / ingestão voluntária de alimento (g);
IVA = ingestão voluntária de alimento / ((Peso de grupo inicial + Peso de grupo final) / 2) % / nº dias;
TM = (nº de animais mortos/ nº inicial de animais) * 100
2.5. Análise Estatística
Para avaliar as diferenças entre os grupos alimentados com as diferentes dietas experimentais, os dados foram sujeitos a uma análise de variância simples (ANOVA). No caso da existência de diferenças significativas (P ≤ 0.05), foi utilizado o teste de Tukey para avaliação das diferenças entre médias.
30
3. Resultados
3.1. Parâmetros do crescimento e eficiência alimentar
É possível observar os valores obtidos para o desempenho do crescimento e da eficiência alimentar dos peixes alimentados com as dietas experimentais (tabela 6 e nos gráficos 7, 8 e 9). O peso médio inicial (PMI) foi o parâmetro em que não foram encontradas diferenças estatisticamente significativas (P>0,05). Em todos os restantes parâmetros avaliados foram observadas diferenças significativas (P<0,05).
CTRL T1 T2 T3 PMI(g) 4,80 ± 0,07 4,84 ± 0,1 4,82 ± 0,1 4,87 ± 0,07 PMF(g) 15,58a ± 0,7 12,77b ± 0,6 12,03b ± 0,4 12,78b ± 0,7 GP(%PMI/dia) 2,50a ± 0,3 1,80b ± 0.1 1,65b ± 0,1 1,81b ± 0,2 TCE (%/dia) 1,31a± 0,1 1,08b ± 0,5 1,02b ± 0,6 1,07b ± 0,7 TCA 1,73a ± 0,1 2,46b ± 0,1 2,73b ± 0,1 2,45b ± 0,2 IVA(%PMD/dia) 2,03a± 0,6 2,46b± 0,1 2,60b ± 0,3 2,43b ± 0,1
Tabela 6: Parâmetros do crescimento e eficiência alimentar
Valores são médias e desvio padrão (n=3). Em cada linha, valores com expoente diferente representam valores significativamente diferentes (P<0,05).
PMI – Peso Médio Inicial PMF – Peso Médio Final GP – Ganho Peso
TCE – Taxa de Crescimento Específico TCA – Taxa de Conversão Alimentar IVA – Ingestão Voluntária de Alimento
As tencas iniciaram o ensaio com um peso médio inicial de 4,8g. Entre os pesos dos grupos iniciais não foram observadas diferenças significativas (P>0,05). Após 90 dias de alimentação os pesos médios dos animais triplicaram (dieta CTRL) atingindo valores médios de 15,6g enquanto que os peixes alimentados com as restantes dietas experimentais mais do que duplicaram o seu peso inicial apresentando valores que oscilaram entre 12,03 e 12,78g. Significa, portanto, que o peso médio final dos peixes foi diferente com diferenças estatisticamente significativas (P<0,05) entre a dieta controlo e os restantes tratamentos experimentais (T1, T2 e T3) que se apresentaram
31 significativamente inferiores para este parâmetro. No gráfico 7 é possível observar a evolução do peso médio dos peixes durante os 90 dias do ensaio.
Gráfico 7: Evolução do peso médio corporal das tencas ao longo dos 90 dias de ensaio.
Acompanhando a tendência observada no peso final o ganho de peso médio, expresso em %/dia, revelou que os peixes alimentados com a dieta CTRL foram aqueles que mais cresceram (2,5%/dia) enquanto que, com as outras dietas, se distanciaram de modo significativo (P<0,05) apresentando valores mais baixos e idênticos entre si. Outro parâmetro avaliado associado ao ganho de peso foi a taxa de crescimento específica. Neste parâmetro a tendência foi idêntica à observada nos parâmetros anteriores com a dieta controlo a apresentar os valores mais favoráveis e significativamente diferentes (P<0,05) das restantes dietas experimentais.
No que respeita à eficiência alimentar, a taxa de conversão do alimento variou entre 1,7 e 2,7 com o valor mais baixo a ser observado na dieta controlo que foi significativamente inferior ao observado nos restantes tratamentos. O pior índice foi obtido nos peixes alimentados com a dieta T2 (2,73) sendo que o valor obtido não foi significativamente diferente dos obtidos com os tratamentos T1 e T3.
No gráfico 8 seguinte pode ser analisada a diferença observada entre as várias dietas experimentais. 0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0
Dia 0 Dia 30 Dia 60 Dia 90
Pes o Mé d io Co rp o ral ( g) CTRL T1 T2 T3
32 Gráfico 8: Evolução da Taxa de Conversão Alimentar.
A ingestão voluntária, calculada em função da percentagem de alimento ingerido em relação ao peso vivo do peixe, apresentou valores consentâneos com os parâmetros da eficiência alimentar e, nesse particular, a maior ingestão de alimento verificou-se nos peixes alimentados com a dieta T2 (2,6%) sem, contudo, terem sido observadas diferenças significativas em relação às dietas T1 e T3. Qualquer uma destas dietas (T1 a T3) apresentou valores significativamente diferentes (P<0,05) em relação à dieta de controlo (CTRL) cujo valor foi mais baixo e rondou os 2,03%.
No gráfico 9 e tabela 7 apresentam-se os comprimentos médios obtidos pelas tencas durante o ensaio.
0,00 0,50 1,00 1,50 2,00 2,50 3,00
Dia 30 Dia 60 Dia 90
Tax a d e Co n ve rs ão A lime n tar CTRL T1 T2 T3
33 Gráfico 9: Evolução do Comprimento das tencas (90 dias; cm)
Como é possível observar no gráfico 9, os peixes alimentados com a dieta CTRL foram aqueles que registaram maior crescimento, em termos de comprimento, tendo atingido uma média de 9,96 cm que se distanciou significativamente das observadas nos outros tratamentos. Os peixes desta dieta aumentaram o seu tamanho em cerca de 2,99 cm após 90 dias de ensaio. A média do comprimento inicial, retirada numa amostra de 15 indivíduos, foi de 6,97 cm (tabela 7). Das seguintes dietas experimentais a T1 foi a que registou maiores crescimentos, seguido da T3 e, por fim, a T2. Significa que o comprimento final não apresentou diferenças estatisticamente significativas entre as dietas T1 a T3 (P<0,05) mas em qualquer uma delas o comprimento final foi significativamente inferior em relação ao controlo.
Tabela 7: Comprimentos (cm) médios iniciais e finais das tencas após 90 dias de
ensaio.
CTRL T1 T2 T3
CMI 6,97 ± 0,07 6,97 ± 0,1 6,97 ± 0,1 6,97 ± 0,07
CMF 9,96a ± 0,3 9,51b ± 0,3 9,30b ± 0,3 9,41b ± 0,3
Diferença 2,99 2,54 2,33 2,44
Valores são médias e desvio padrão (n=3). Em cada linha, valores com expoente diferente representam valores significativamente diferentes (P<0,05).
1,5 1,7 1,9 2,1 2,3 2,5 2,7 2,9 3,1 CTRL T1 T2 T3 Comprimento tencas (cm)
34
CMI – Comprimento médio inicial (cm); CMF – Comprimento médio final (cm)
Durante o ensaio, além dos parâmetros avaliados foi registada a ocorrência de mortalidade. Apenas foi registada a ocorrência de 2 animais mortos em todos os grupos significando que a taxa de mortalidade foi desprezível.
35
4. Discussão
Todas as dietas usadas neste estudo resultaram em taxas de sobrevivência próximas ou iguais a 100%. Valores de sobrevivência elevada em peixes ciprinídeos juvenis é uma ocorrência normal quando alimentados com dietas experimentais em vários tipos de ensaios de crescimento descritos na bibliografia como é referido nos trabalhos em Vimba vimba (Wolnicki, 1996), Chondrostoma nasus (Wolnicki, Myszkowski, 1999);
Carassius carassius (Myszkowski et al., 2002), Barbus barbus, (Wolnicki et al., 2003a)
e Eupallasella perenurus (Kaminski et al., 2005) para citar alguns. No entanto, essa regra não se aplica nos ensaios realizados com juvenis de T.tinca. Em vários ensaios em que foram usadas dietas secas formuladas para salmonídeos e espécies marinhas as perdas foram relativamente elevadas (Quirós, Alvariño,1998; Quirós et al., 2003; Rennert et al., 2003).
Maioria dos ensaios de crescimento realizados com tencas juvenis em meio intensivo demonstra taxas de crescimento específicas (TCE, % /dia) entre os 0,70 e 1,98, sendo maiores quando as dietas secas são suplementadas com alimento natural (García et al., 2010). Neste estudo, as tencas alimentadas unicamente com as dietas T1, T2 ou T3 apresentaram valores de TCE entre 1,02 e 1,08 significando que as dietas experimentais utilizadas se mostraram adequadas para o crescimento da espécie.
Existe pouca informação acerca da taxa de conversão alimentar (TCA) em tencas juvenis. Na criação intensiva de juvenis com 3 meses alimentados com alimento comercial de truta, durante 450 dias, Rennert et al. (2003) registaram valores de TCA entre 1,75 e 3,56. Por sua vez, Marés et al. (2007) testaram 3 dietas secas em juvenis de 7 meses, durante 63 dias, atingindo TCA entre 1,84 e 3,53. No ensaio de 70 dias que realizámos com tencas juvenis os valores obtidos com as dietas T1, T2 e T3 apresentam valores semelhantes que variaram entre 2,45 e 2,73. Estes valores apresentam-se mais favoráveis em relação aos referidos nos exemplos anteriores e distanciam-se daqueles que foram observados por Cilecek et al. (2011) o que reflete uma excelente utilização alimentar e digestiva das dietas que foram utilizadas neste estudo. Na tabela 8 podem ser consultados valores relativos a este parâmetro de eficiência alimentar obtidos em vários trabalhos científicos realizados por diversos autores.
36 Tabela 8: Comparação de TCE e TCA de T.tinca obtidos em ensaios de crescimento em
condições controladas.
Dietas T (ºC) TCE TCA Fonte
Karpico 23ºC 1,25 2,3 Marés et al. (2007)
Asta 2 1,49 1,84
L05/CH 0,83 3,53
A,B,C 26 1,37-1,95 Cilécek et al. (2011)
Krytal 24 2,01 Wolnicki and
Carp Starter 1,75 Myszkowski (1998a)
Futura 28 2,55 Kamler et al. (2006)
Perla Plus 28 2,06 Wolnicki et al. (2005) Nutrisa 24,5 1,38 Quirós, Alvariño (1998) Carp Starter 28 1,4 Wolnicki et al. (2003b)
Dibaq 22 0,61 Quirós et al. (2003)
Nutrisa -0,07
CTRL 24 1,31 1,73 Ensaio atual
T1 1,08 2,46
T2 1,02 2,73
T3 1,07 2,45
Karpico – Alimento Carpa comum; Asta – alimento piloto; L05/CH – Formulado por Marés et al. (2007); A – 45% Proteína, 10% Gordura; B – 52% / 13%; C – 57% / 15%; Krytal – Alimento Truta; Carp Starter – Alimento Ciprinídeos; Futura – Alimento Carpa; Perla Plus – Alimento Peixes Marinhos; Nutrisa – Alimento Truta; Dibaq – Alimento Perca. TCE – Taxa de Crescimento Específico; TCA: Taxa de Conversão Alimentar.
Contudo, comparar todos os resultados apresentados na tabela 8 com as taxas de crescimento de outros ciprinídeos juvenis alimentados exclusivamente com dieta seca (Cyprinus carpio; Charlon et al., 1986, C. Carassius; Myszkowski et al., 2002, E.
Perenurus; Wolnicki et al., 2004) leva à conclusão que o crescimento de T.tinca é
excecionalmente lento, mesmo quando suplementado com alimento natural (Quirós and Alvariño., 1998; Wolnicki et al., 2003b). Esse crescimento lento estará, muito possivelmente, relacionado com as características biológicas e genéticas da espécie e não com a qualidade e tipologia das dietas utilizadas.
Em relação à substituição de farinha de peixe por uma mistura de outras fontes de proteína (farinha de inseto e microalgas (Chlorella e Spirullina)), é preciso ter em atenção que peixes juvenis possuem necessidades mais elevadas de nutrientes, principalmente ácidos gordos e aminoácidos essenciais, apresentando maior sensibilidade a deficiências nutritivas quando comparados com peixes de idade mais avançada (Yu, 2008).
37 Existe pouca informação sobre a utilização de farinhas alternativas de outros animais inteiros em peixes ciprinídeos. Beg et al. (2016) realizaram um ensaio com a carpa indiana para avaliação do potencial da farinha de minhoca como substituto parcial ou total da farinha de peixe. Os seus resultados concluíram que 50% de substituição na dieta podia ser usado como uma alternativa para obtenção de melhores performances nas carpas indianas. Ng et al. (2001) demonstraram que as larvas do inseto Tenebrio molitor, tanto usadas como alimento vivo ou como ingrediente na dieta, apresentaram potencial como fonte de proteína para o peixe-gato Africano. A sua incorporação na dieta até 40% não reduziu significativamente as performances de crescimento nem aumentou a taxa de conversão alimentar. Também a farinha de minhoca obtida de E.foetida, foi usada para substituir 25 e 50% da farinha de peixe em dietas de truta arco-íris, com obtenção de crescimentos mais elevados comparativamente à dieta controlo (Velasquez et al., 1991). A mesma farinha quando usada em carpas rohu obteve melhores performances quando esta foi integrada na dieta em 40%, sendo a maior fonte de proteína da dieta (Mohanta et al., 2016).
Melhorias no crescimento dos peixes quando a alga Spirulina foi integrada na dieta foram observadas em vários estudos (Nakazoe et al., 1986; Mustafa et al., 1994). Investigações detalhadas sobre a utilização de microalgas nas dietas para peixes foram desenvolvidas em Israel, onde foi observado que as performances foram melhores em dietas enriquecidas com estas microalgas (Sandbank, Hepher, 1978). Nandeesha et al. (2001) testaram o uso de spirulina em carpas indianas com resultados indicando que este ingrediente pode ser explorado como fonte de proteína em carpas.
Badwy et al. (2008) realizou um estudo com tilápia do Nilo (Oreochromis
niloticus), utilizando Chlorella spp. em dietas com níveis de substituição até 50%. Os
resultados não demonstraram qualquer efeito adverso nas taxas de crescimento e na eficiência alimentar.
Neste estudo houve uma inclusão de uma mistura de farinha de inseto (tenebrio meal) e algas (chlorella e spirulina) a níveis crescentes de substituição. 7, 11 e 15% foram os níveis de incorporação da mistura nas dietas T1, T2 e T3, respetivamente, que substituíram, aproximadamente, cerca de 30, 50 e 80% da farinha de peixe. A dieta controlo foi a que originou melhores resultados, tendo a farinha de peixe como principal fonte de proteína de origem animal. Os resultados apresentados pelas restantes dietas apesarem de serem significativamente inferiores não retiram, contudo, a possibilidade de
38 serem utilizadas como fontes alternativas de proteína animal, usadas em simultâneo, em tencas. Na verdade, apesar de valores mais baixos, a diferença da performance, em termos numéricos, indica que o deficit de crescimento pode ser compensatório em relação ao custo da farinha de peixe. Para reforçar esta ideia podemos referir que o peso médio final das tencas alimentadas com farinha de peixe como o único ingrediente proteico de origem animal rondou os 15g enquanto as tencas alimentadas com estas misturas alternativas rondaram os 12g. Este aspeto requer investigação mais aprofundada para avaliar até que ponto o custo verificado em termos de crescimento poderá compensar em termos de custos e sustentabilidade do processo. É possível supor que um diferente balanceamento entre os diferentes ingredientes usados nas dietas T1, T2 e T3 poderia levar a resultados ainda mais promissores.
Alguns resultados menos positivos observados por vários autores podem basear-se no facto da tenca basear-ser um peixe bastante tímido e algo basear-sensível às condições de produção em sistemas semi-intensivo e intensivo. A falta de esconderijo nos tanques também pode levar a distúrbios de comportamento e stress. As tencas tendem a aglomerar-se em grupos densos no fundo dos tanques (Rennert et al., 2003). Segundo o mesmo autor, elas não reagiam prontamente à oferta do alimento como os outros peixes; em vez disso afastavam-se, frequentemente, do alimento quando este era oferecido. A timidez e a sua sensibilidade ao stress diminuem a ingestão de alimento e, consequentemente, a alterações da taxa de conversão alimentar (Wolnicki and Myszkowski., 1998; Rennert et al.,2003).
5. Conclusão
O objetivo principal deste estudo foi avaliar a utilização de novos ingredientes alternativos, ricos em proteína, que possam ser utilizados na formulação de dietas para a alimentação da tenca de forma a tornar a sua produção mais sustentável e eficiente. Foi, como referido, testada a inclusão de farinha de inseto e duas algas - chlorella, e spirulina nas dietas em por substituição quase total da farinha de peixe. Os resultados obtidos revelaram-se francamente promissores sendo que subsiste a necessidade de mais investigação nesta área através da afinação e calibração dos níveis de inclusão destes
39 ingredientes para obtenção de performances mais consentâneas com esta espécie extremamente delicada.
Este estudo preliminar pode constituir um contributo na área ao adicionar informação nova com resultados que envolvem a utilização de uma espécie pouco abordada neste tipo de ensaios e que se apresenta com potencial para a diversificação de espécies de água doce produzidas no nosso país.
Finalmente, uma nota para o facto de os peixes alimentados com as dietas que continham alga apresentarem uma forte pigmentação em relação aos peixes da dieta controlo. Esta observação está a ser avaliada de modo mais aprofundado e será, certamente mais um motivo de estudo na área.
40
6. Bibliografia
Alas, A., Altindag, A., Yilmaz, M., Kirpik, M.A., Ak, A. (2009). Feeding Habits of Tench (Tinca tinca L., 1758) in Beysehir Lake (Turkey). Turkish Journal of Fisheries and Aquatic Sciences. 10: 187-194.
Amar EC, Kiron V, Satoh S, Watanabe T (2004) Enhancement of innate immunity in carotenoids from natural products. Fish Shellfish Immun 16:527–537.
Asino H, Ai Q, Mai K (2011) Evaluation of Enteromorpha prolifera as a feed component in large yellow croaker (Pseudosciaena crocea, Richardson, 1846) diets. Aquacult Res 42:525–533 Ayadi, F. Y., Rosentrater, K. a, & Muthukumarappan, K. (2012). Alternative protein sources for aquaculture feeds. Journal of Aquacultre Feed Science and Nutrition. http://doi.org/10.3923/joafsnu.2012.1.26
Badwy TM, Ibrahim EM, Zeinhom NM (2008). Partial replacement of fishmeal with dried microalga (Chlorella spp. and Scenedesmus spp.) in Nile tilapia (Oreochromis niloticus) diets. 8th International Symposium on Tilapia in Aquaculture 2008, Cairo, Egypt, pp 801– 811.
Barroso, F. G., de Haro, C., Sánchez-Muros, M. J., Venegas, E., Martínez-Sánchez, A., & Pérez-Bañón, C. (2014). The potential of various insect species for use as food for fish. Aquaculture, 422-423, 193–201. http://doi.org/10.1016/j.aquaculture.2013.12.024
Beg, M.M., B Mandal, S Moulick., (2016). Potential of earthworm meal as a replacement of fish meal for Indian major carps. In: International Journal of Fisheries and Aquatic Studies 2016; 4(3): 357-361.
Benzer, S. S., Gul, A., Mehmet Yilmaz. (2009). Growth properties of Tench (Tinca tinca L., 1758) living in Hirfanh Reservoir (Kirsehir, Turkey). Iranian Journal of Fisheries Sciences. 8(2): 219-224.
Benzer, S. S., Gul, A., Yilmaz, M. (2010). Growth properties of tench (Tinca tinca L., 1758) living in Kapulukaya Dam Lake, Turkey. Kastamonu Education Journal. 18(3): 839-849.
Celada J.D., Aguilera A., Garcıa V., Carral J.M., Saez- Royuela M., Gonzalez R. & Gonzalez A. (2009) Rearing juvenile tench (Tinca tinca L.) under controlled conditions using Artemia nauplii as supplement to a dry diet. Aquaculture International 17, 565–570.
Charlon N., Durante H., Escaffre A.-M. and Bergot P. (1986). Alimentation artificielle des larves de carpe (Cyprinus carpio L.). Aquaculture 54: 83– 88.
Christaki E, Florou-Paneri P, Bonos E (2011). Microalgae: a novel ingredient in nutrition. Int J Food Sci Nutr 62:794–799.
Cileček, M., Baranek, V., Vitek, T., kopp, R., Mareš, J. (2011): Production eff ect of diff erent
commercial feeds on juvenile tench (Tinca tinca L.) under the intensive rearing conditions.
Acta univ. agric. et silvic. Mendel. Brun., LIX, No. 6, pp. 93–98.
Davies SJ, BrownMT, CamilleriM(1997) Preliminary assessment of the seaweed Porphyra purpurea in artificial diets for thick-lipped grey mullet (Chelon labrosus). Aquaculture 152:249–258
Dawczynski C, Schubert R, Jahreis G (2007) Amino acids, fatty acids, and dietary fibre in edible seaweed products. Food Chem 103:891– 899.
41 Diler I, Tekinay AA, Gliroy D, Gliroy BK, SoyutllrkM (2007) Effects of Ulva rigida on the
growth, feed intake and body composition of common carp, Cyprinus carpio L. J Biol Sci 7:305–308
Erguden, S. A., Goksu, M. Z. L. (2011). The Reproductive Biology of the Tench Tinca tinca (L. 1758) in Seyhan Reservoir (Adana, Turkey). Journal of Animal and Veterinary Advances. 10(8): 1041-1044.
Ergün S, Soyutürk M, Güroy B, Güroy D, Merrifield D (2008) Influence of Ulva meal on growth, feed utilization, and body composition of juvenile Nile tilapia (Oreochromis niloticus) at two levels of dietary lipid. Aquacult Int 17:355–361
EU - EUROPEAN UNION. (2014). Facts and figures on the Common Fisheries Policy. Basic statistical data. 2014 Ed. ISSN 1830-9119.
EUMOFA - EUROPEAN MARKET OBSERVATORY FOR FISHERIES AND
AQUACULTURE. (2014). The EU fish market.
http://ec.europa.eu/fisheries/marketobservatory/documents/10157/bf18cf2c-1b33-440d-8870-e05b2644b58b
FAO (2011). Aquaculture development. 5. Use of wild fish as feed in aquaculture. FAO Technical Guidelines for Responsible Fisheries. No. 5, Suppl. 5. Rome, FAO. 79p.
FAO (Food & Agriculture Organisation). (2012). The State of World Fisheries and Aquaculture 2012. Sofia. http://doi.org/10.5860/CHOICE.50-5350
FAO (2011-2017). Fisheries and aquaculture software. FishStatJ - software for fishery statistical time series. In: FAO Fisheries and Aquaculture Department [online]. Rome. Updated 21 July 2016.
FAO. (2014). The state of world fisheries and aquaculture. Food and Agriculture Oraganization of the United Nations (Vol. 2014). http://doi.org/92-5-105177-1
FAO. The State of World Fisheries and Aquaculture (2010). Rome, FAO. 2010. 197p.
Garcıa V., Celada J.D., Carral J.M., Saez-Royuela M., Gonzalez R. & Gonzalez A. (2010) Decapsulated Artemia cysts: A suitable dietary supplement for juvenile tench (Tinca tinca L.). Journal of Applied Ichthyology 22, 57–65.
Global Biodiversity Information Facility (GBIF). (2014). Available: http://www.gbif.org/species/2362524. (August 2014).
Gomes, E. F., Rema, P. and Kaushik, S. J., (1995). Replacement of fish-meal by plant-proteins in the diet of rainbow trout (Oncorhynchus mykiss)-digestibility and growth performance. Aquaculture, 130, pp. 177-186
Gray, R. H., Dauble, D. D. (2001). Some Life History Characteristics of Cyprinids in the Hanford Reach Mid-Columbus River. Northwest Science. 75(2): 122-137.
Guedes AC, Amaro HM, Malcata FX (2011) Microalgae as sources of high added-value compound sea brief review of recent work. Biotechnol Progr 27:597 – 613.
Güroy B, Ergün S, Merrifield DL, Güroy D (2012) Effect of autoclaved Ulva meal on growth performance, nutrient utilization and fatty acid profile of rainbow trout, Oncorhynchus mykiss. Aquac Int 21:605– 615
Guzman S, Gato A, Lamela M, Freire-Garabal M, Calleja JM (2003) Anti-inflammatory and immunomodulatory activities of polysaccharide from Chlorella stigmatophora and Phaeodactylum tricomutum. Phytother Res 17:665–670.