The Role of the Amygdala in Trace Fear Conditioning
Andreia Judite Marques da CruzResumo
A auto‐preservação é um comportamento conservado evolutivamente que não depende de aprendizagem. No entanto, verifica‐se que a maioria dos animais têm a capacidade de aprender que alguns estímulos ambientais podem informar da presença de perigo. Esta informação uma vez adquirida pode ser usada no futuro.
O condicionamento Pavloviano de medo é um tipo de aprendizagem associativa onde um animal aprende a associar um estimulo neutro, geralmente uma luz ou um som (estímulo condicional – EC) a um estímulo aversívo, geralmente um choque ligeiro (estímulo incondicional ‐ EI). Após a associação, o EC apresentado sozinho tem a capacidade de despoletar respostas de medo especificas. No estudo dos mecanismos neurais da memória, este tipo de condicionamento de medo é uma das ferramentas mais usadas, uma vez que experiências aversivas são aprendidas rapidamente e relembradas por muito tempo. Este paradigma é também muito usado porque os circuitos neurais envolvidos estão já bastante bem descritos. Grande parte dos trabalhos feitos sobre memória, que usam condicionamento Pavloviano de medo, usam um tipo particular de paradigma em que estímulo condicional e o estímulo incondicional se sobrepõe no tempo e co‐terminam. Este procedimento tem o nome de delay fear conditioning. Décadas de literatura sobre este assunto apontam para a amígdala, uma estrutura neural multi‐nucleada situada no lobo temporal, como sendo crucial para este tipo de aprendizagem. A atenção recaiu sobre a amígdala quando foi demonstrado que o sindroma de Kluver‐Bucy, caracterizado pela ausência de medo em macacos que tinham sido sujeitos a ressecção do lobo temporal, podia ser explicada por lesões restritas a esta estrutura.
A amígdala é composta por vários núcleos que projectam para diversas zonas do cérebro, colocando‐a numa posição única para receber informação sobre os estímulos
que informam do perigo, e controlar a resposta apropriada. Alguns destes núcleos têm sido apontados como mais importantes para o condicionamento do medo. O núcleo lateral é considerado o local de associação entre estímulos, pelo menos no que diz respeito a estímulos condicionais auditivos, porque recebe informação do som pelo tálamo e pelo córtex auditivos, ao mesmo tempo que recebe informação sobre o choque de diversas áreas sensoriais. Já foi demonstrado que células individuais do núcleo lateral respondem a ambos os estímulos. O núcleo central é considerado o centro de controlo das respostas de medo despoletadas pelo EC.
Foi demonstrado que é necessária plasticidade na amígdala para que se possa efectuar a associação dos estímulos. Um possível mecanismo é a plasticidade sináptica descrita como um fortalecer da ligação sináptica em dois neurónios que são activados ao mesmo tempo. No entanto, verifica‐se que os animais também são capazes de aprender quando os estímulos estão separados no tempo mas são correlacionados. Para estudar este tipo de associação é usado um paradigma semelhante ao anterior, mas onde o som e o choque são separados por um intervalo de tempo. A este protocolo dá‐se o nome de trace fear conditioning. Como a amígdala tem um papel tão importante quando o som e choque se sobrepõe é geralmente aceite que tenha um papel semelhante quando há um intervalo de tempo entre os dois. No entanto, não é do nosso conhecimento que este facto tenha alguma vez sido devidamente demonstrado. Por outro lado, independentemente da contribuição da amígdala, é necessário que outras estruturas cerebrais sejam recrutadas para manter a actividade enquanto o som termina e o choque não começa, e depois passar essa informação para a amígdala para que seja integrada. A região mediana do córtex pré‐frontal e o hipocampo são duas estruturas que têm sido apontadas como sendo as possíveis responsáveis por manter a memória do som durante o tempo que separa os estímulos. Mais, parece que o seu envolvimento está dependente da duração do intervalo de tempo entre som e choque. Este laboratório está interessado em estudar este circuito neural e averiguar como a amígdala, hipocampo e córtex pré‐frontal estão envolvidos em trace fear conditioning. Este trabalho tem por objectivo estudar o envolvimento da amígdala neste tipo de condicionamento, usando dois protocolos que apenas diferem no tempo que separa o som do choque, num protocolo o intervalo é de 5 segundos e no outro 40 segundos.
A espécie Rattus norvegicus foi usada como modelo para comparar o a expressão de medo em grupos com a amígdala intacta com outros onde a mesma foi
temporariamente inactivada, imediatamente antes da sessão de condicionamento. Os animais passaram por uma cirurgia onde foram implantadas cronicamente canulas por cima da amígdala. Estas permitem a infusão de drogas, ou de soro fisiológico no caso dos animais controlo, apenas na estrutura alvo. A droga usada para inactivar reversivelmente a amígdala foi o muscimol. Esta droga impede que os neurónios disparem potenciais de acção, silenciando a estrutura. A infusão da droga foi feita antes da sessão de treino para permitir estudar o envolvimento da amígdala apenas na fase de aprendizagem. Um dia depois da sessão de condicionamento, em que cada animal é exposto a apenas um emparelhamento de som e choque, é feito um teste ao medo ao som apresentado sozinho. Este teste é feito numa caixa diferente da do condicionamento, para garantir que se está a testar a reacção apenas ao som sem confundir com qualquer efeito gerado pelo contexto de treino que os animais também aprendem a recear. Para averiguar se o medo ao contexto também depende de actividade neural na amígdala, quarenta e oito horas depois da sessão de treino os animais foram colocados na caixa em que receberam o condicionamento, tendo sido medida a resposta comportamental. A resposta comportamental usada para medir a expressão do medo foi o freezing. Um episódio de freezing é caracterizado pela total ausência de movimento por parte do animal, à excepção do movimento respiratório, e é uma resposta inata que os ratos apresentam quando estão numa situação de perigo e não têm possibilidade de fuga.
Os dados obtidos não permitam tratamento estatístico, mas sugerem uma forte dependência de actividade neural na amígdala para condicionamento de medo quando os dois estímulos estão temporalmente separados. Mais, este envolvimento da amígdala parece ser independente da duração do intervalo tempo entre som e choque. Verificámos que, em ambos os protocolos, os animais com a amígdala inactivada apresentavam um nível de resposta de medo ao som bastante mais baixo do que os animais controlo. Verificámos ainda que nos animais controlo o nível de resposta de medo ao som era mais elevado do que a medida de ansiedade geral (aferida pelo comportamento de freezing do animal antes do primeiro som de teste ser apresentado). Isto sugere que de facto é o som que despoleta a resposta condicionada, e que tal não se deve a um estado geral de ansiedade do animal. Quanto ao medo ao contexto os resultados são ambíguos, não permitindo qualquer tipo de conclusão em relação ao envolvimento da amígdala. No protocolo com um intervalo de tempo curto entre som e
choque os animais controlo apresentam medo ao contexto, enquanto os animais que tiveram a amígdala inactivada durante o treino não demonstram qualquer reacção adversa ao contexto. No entanto, no protocolo com o intervalo de tempo de 40 segundos não só nenhum dos grupos não demonstra elevada reacção de medo ao contexto, como as medidas de cada grupo são bastante aproximadas.
Este trabalho foi uma contribuição importante para se demonstrar que de facto a amígdala é uma estrutura vital em mais do que um tipo de aprendizagem baseada em estímulos aversivos. Para mais, é uma das peças essenciais para se perceber como funciona o circuito que determina a aprendizagem da associação de estímulos separados no tempo.
Palavras Chave: amígdala, condicionamento Pavloviano do medo, inactivação, aprendizagem
Abstract
Pavlovian fear conditioning is one of the most used behavioral paradigms to study the neural mechanisms of learning and memory, because fear learning is fast and long lasting. This is a type of associative learning in which a neutral stimulus, such as a tone (conditioned stimulus – CS) becomes associated with an aversive one, such as a foot shock (unconditioned stimulus ‐US). After the association, the CS comes to elicit species specific fear responses when presented alone. Much of the work done in this area uses a protocol in which the tone and the shock overlap in time, co‐terminating. The amygdala, a neural structure in the temporal lobe, is often considered crucial for this type of learning. Because it has never been properly demonstrated that this structure plays a similar role when both stimuli are separated in time, a trace fear conditioning protocol, where the presentation of the tone precedes shock delivery by several seconds, is going to be used to try to answer this question. The rat Rattus norvegicus is going to be used as a model to compare levels of freezing to the tone CS, between animals with intact amygdala and animals with reversible muscimol inactivation of the structure before training. Although the data was not sufficient to allow for statistical analysis, our data strongly suggests that activity in the amygdala is indeed necessary for fear conditioning with both short and long trace intervals. Key words: amygdala, trace fear conditioning, inactivation, learning
Introduction
Fear learning
To survive in nature an animal has to be able to perceive threats from environmental cues. Responses to natural predators are usually innate, but the animals are also capable to learn from other cues that are predictive of threat, and use that information in the future (Kim & Jung, 2006). Fear is a very useful paradigm to address all sorts of questions. Fendt and Fanselow, (1999) summarized that fear driven behavior is a great model to study how emotions can influence behavioral outputs. Also, understanding the neuroanatomy and the neurochemical basis of fear and anxiety is
central for understanding how to address a cure for such type of disorders and phobias. The authors also state that because mechanisms of learning and memory are an important field of neuroscience research, and fearful experiences are rapidly learned and long remembered, fear conditioning offers an excellent paradigm for studying such a mechanism in a laboratory environment.
In the laboratory, this learning ability is studied using a particular form of associative learning, is called fear conditioning (Pavlov, 1927). In this paradigm an otherwise neutral conditioned stimulus (CS), like a tone or a light, is paired with an aversive unconditioned stimulus (US), usually a foot‐shock. After the association the animals learn to fear the CS alone, exhibiting species‐specific fear responses that characteristically would be elicited by the threatening stimulus. These are called conditioned or learned responses because they were not elicited by the CS before its association with the US, and may include behavioral, autonomic and endocrine responses such as freezing or escaping, changes in blood pressure and heart rate, or the release of specific stress hormones (LeDoux, 2000). Pavlovian fear conditioning is therefore a type of learning that involves the knowledge that some environmental stimuli predict aversive events, and this form of learning, in an evolutionary perspective, promotes survival in the face of present and future threats (Maren, 2001). It is important to keep in mind that these fear responses are neither new nor learned, and what conditioning is doing is to place innate answers under the control of new stimuli (Rogan & LeDoux, 1996).
Neural circuits on delay fear conditioning
The neural circuits of fear conditioning are well described (Fendt & Fanselow, 1999; LeDoux, 2000). Most of the work that has been done to unravel this neural circuitry is based in a paradigm called delay fear conditioning. In this type of protocol the CS and the US overlap in time usually co‐terminating. But what if the stimuli have a time gap between them, how can an animal learn the association? To address this question there is another paradigm of pavlovian fear conditioning that is called trace fear conditioning because there is a trace period between the end of the CS and the onset of the US. In this case, other structures of the brain must be recruited to sustain the activity
during the trace period. Our laboratory is interested in characterize the neural circuit necessary for trace fear conditioning.
The anatomy of the fear circuit
The amygdalaA large body of literature points to the amygdala, an almond shaped structure located deep in the temporal lobe, to be critical for fear learning (for a review see Fendt & Fanselow, 1999; LeDoux, 2000; Maren, 2001).
The earliest evidence of the importance of this structure came in 1888, when Brown and Schaffer reported that large lesions on the temporal lobe of monkeys were responsible for big changes in behavior. Later on Kluver and Bucy (1937) further described this changes: loss of fear, meaning that animals that were shy and fearful would immediately approach and contact their caregivers after resection of the temporal lobe, also they would eat novel food that they would otherwise avoid. It is in 1956 that the amygdala is directly involved in the study of fear, on the work by Weiskrantz showing that the loss of fear on the Kluver‐Bucy syndrome is explained by amygdala damage.
A wealth of studies reveals that the lateral nucleus of the amygdala is the site for the association between CS and US (Romanski et al, 1993; Fanselow & Kim, 1994; Fanselow & LeDoux, 1999; Maren, 2005; Kim & Jung, 2006; but see Cahill et al, 1999).
The amygdala is composed of several nuclei some of them subdivided in sub‐ nuclei, that distinguish from each other by cytoarchitectonics, histochemistry, connections and projections they make (Pitkänen, 2000; Sah et al, 2003). The most relevant for fear conditioning are the lateral (LA) and basal (B) nuclei, sometimes referred to as baso‐lateral amygdala (BLA), and the central nucleus (CE) (LeDoux, 2003). In an anatomic perspective the amygdala receives input from the thalamus, hippocampus and cerebral cortex (Pitkänen, 2000; Sah et al, 2003). The amygdala, not only receives input from most sensory areas, but also sends output projections spread throughout the brain, placing it in a unique position to learn about cues that are predictive of threat and control the animal’s response in the face of it. Extensive work has been done in order to understand the connections between the amygdaloid nuclei
(Pitkänen, 2000). The author describes how the LA projects to the CE, a nucleus that is considered to be the mediator of the expression of fear responses elicited by the CS (LeDoux, 2000). Lesions of this particular nucleus have been shown to block freezing responses to conditioned fear (Amorapanth et al, 2000; Killcross et al, 1997). Furthermore, electric stimulation of CE neurons elicits behavioral responses very similar to those evoked by stimuli paired with shock, and lesions on structures efferent to the CE produce selective deficits in fear responses (Maren, 2001). In the last decades a large number of studies using a variety of different approaches suggest that the amygdala is crucial for the expression of learned fear responses: total or partial lesions of the amygdala, as well as reversible inactivation, impairs fear learning and expression of conditional fear responses, even a year and a half after original training (Fanselow & Gale, 2003, but see Kim & Jung, 2006 for a review on other lesion and inactivation studies). Electric or chemical stimulation of specific nuclei or afferent pathways to the amygdala were shown to elicit conditioned fear‐like responses. For example stimulation of the amygdala on rats interrupts appetitive behaviors and induces freezing (Weingarten & White, 1978). Also, stimulation of the amygdala after training causes impairment on the learned association (Gold et al., 1975; McDonough & Kesner, 1971 in Kim & Jung, 2006). If this is in fact such a crucial structure for fear conditioning, then the pathways that transmit information about the CS and the US must converge it. Inputs to the amygdala Romanski and LeDoux (1992) showed that auditory inputs arrive in the LA from two independent routes: one direct input coming from the auditory thalamus, and one indirect arriving from the auditory cortex. Furthermore, they have shown that each pathway is sufficient for auditory CS to reach the amygdala, as lesions to only one of the pathways were not sufficient to disrupt fear learning to the tone. If these pathways are redundant or if they serve different purposes is still a matter of much discussion: the model generally accepted is that the thalamic pathway information reaches the amygdala via projection from the medial division of medial geniculate nucleus (MGm) (Kimura et al, 2003), in a faster but less accurate fashion, producing a more rapid but generalized response to threats. The cortical pathway however indirect is much more precise, as reflected by the tonotopic finely tuned organization of its main input region,
the ventral division of medial geniculate nucleus (MGv)(Kimura et al, 2003), would give a slower but more accurate information to the amygdala. The result would be that the thalamic input results in a fast response to any given acoustic stimuli resulting in generalized fear, whereas the cortical input is engaged in auditory discrimination, giving more detailed information about which are the real threatening stimuli (Rogan & LeDoux, 1996). If this is in fact the case, then discriminative fear learning to a given tone should be dependent on the cortical route alone. However work from this laboratory (Antunes & Moita, 2009) studying the contributions of the MGm and the MGv on generalized versus discriminative learning, reached the conclusion that indeed both pathways alone are sufficient for the acquisition of generalized fear (this apparent redundancy can be easily explained by the biological relevance of self preservation), whereas in the case of discriminative learning they found that the direct pathway is also necessary, stating that some kind of cooperation between both circuits is needed for discriminative auditory fear learning.
Less is known about the pathways by which the US reaches the amygdala. However, somatosensory areas in the thalamus and cerebral cortex that project to the amygdala, receive stimuli, including nociceptive ones (LeDoux, 2000), and also it has been shown that cells in the LA respond to both acoustic and nociceptive stimulation either in anesthetized rats (Romanski et al, 1993) as in freely behaving ones (Blair & LeDoux, 2000). This evidence places the LA as a good candidate for CS‐US convergence to occur. Outputs of the amygdala The generally accepted model of fear conditioning states that LA gets input from auditory thalamic and cortical afferents, receiving also nociceptive stimuli from somatosensory thalamic and cortical areas. The LA then sends inputs to the CE, the main output nucleus of the amygdala, which would act as a mediator of fear responses (LeDoux, 2000). However, it has been recently suggested that the CE may be an important locus for fear conditioning acquisition and not only for its expression, as this nucleus also receives both direct auditory thalamic input and nociceptive brainstem inputs, and because has been demonstrated that lesion or inactivation of this nucleus before training affects learning, and this would not be expected if the CE only played a
role in the expression of fear. Furthermore, LA neurons do not project directly to CE output neurons that are located in the medial sector of the CE nucleus (CeM) (reviewed by Paré et al, 2004). In this review the authors propose discuss the literature available and propose a revised model in which activated neurons of the LA connect with CeM neurons via intercalated cells, pointing out also that because CeM could be a place for convergence of thalamic CS and US input, it can act as a locus of association on some aspects of fear conditioning. Although the circuitry that controls the output of the amygdale remains unclear, it is widely accepted that amygdala, in particular LA, is a crucial site for fear conditioning.
Synaptic plasticity in amygdala and fear learning
Hebbian plasticiy
The basis of fear conditioning is associative learning. It is generally believed that the neural mechanism underlying associative learning is synaptic plasticity. In 1949 Hebb proposed that if two interconnected neurons fire at the same time the synapses between the become and stay stronger, known as the “fire together, wire together” rule. This is called associative or Hebbian synaptic plasticity, and is a possible neural mechanism underlying the formation and long‐term memory storage of the association between the tone and shock in classical conditioning. Thus, for hebbian plasticity to take place individual neurons have to detect and record CS and US simultaneous activity (Blair et al, 2001). Long‐term potentiation (LTP), a form of long lasting synaptic plasticity, is considered as a possible cellular mechanism underlying learning and memory that was discovered by Bliss and Lomo (1973) in the hippocampus, as a form of strengthened synaptic transmission resulting from high‐frequency stimulation of the structure’s afferents. LTP has been shown to occur in the amygdala, both in vitro and in vivo, either by direct stimulation of amygdalar nucleus or by stimulating their afferent pathways (reviewed by Blair et al, 2001; Chapman & Chattarji, 2000; Kim & Jung, 2006). LTP fits the Hebbian model by two key properties: it is associative in certain synapses, where co‐activation of weak and strong inputs onto the same cell results in the strengthening of the weak inputs, and is synapse specific, meaning that only activated synapses are strengthened (Blair et al, 2001).Evidence from other studies
Electrophysiological recording studies also support the amygdala as the site for fear conditioning. Some authors have shown that fear conditioning increases auditory‐ evoked responses in lateral amygdala neurons (Quirk et al, 1995; Rogan et al, 1997) that are not due to an increase in amygdala excitability resulting from the US. This was shown because auditory CS responsiveness was only observed when CS and US were previously paired. But, because there was no evidence from the previous work that the responses were not generalized to any auditory stimuli after conditioning, Collins and Paré (2000) designed a task using cats, showing that responses in the amygdala are really specific to the conditioned tone, and not generalized to any given tone. In a recent study, Herry and colleagues (2008) recorded neurons in the amygdala of mice that underwent a discriminative protocol of auditory fear conditioning. Those mice learned to fear a CS+ previously paired with shock, showing increasing levels of freezing to it
when compared to an unpaired CS‐ tone. Also they found specific neurons firing only
when the CS+ was present.
Several pharmacological manipulations on the amygdala have revealed numerous details of molecular dependent events that mediate the acquisition of fear associations and the long‐term maintenance of those memories (reviewed by Rodrigues et al, 2004). The type of drug and the time point in which it is applied on the protocol, allows the study of different molecular mechanisms that are important in every different step of the learning process. For example, it was shown that inhibiting mRNA syntheses impairs fear memory consolidation, without disrupting immediate short‐term memory acquisition of the fearful association (Bailey et al, 1999).
Other work provides evidence that synaptic plasticity in the amygdala is necessary for fear conditioning to occur (for a short review see Fanselow & LeDoux, 1999). Blair and others (2005) showed that plasticity in the amygdala is indeed necessary for fear learning, and that plasticity is the mechanism by which the CS gains the representation of the emotional properties of the aversive US. They came to the conclusion that neural activity (that was blocked in this experiment by muscimol injections to the lateral nucleus of the amygala) and synaptic plasticity (blocked by injection of ifenprodil, an NR2B receptor antagonist) were necessary for the acquisition of conditioned freezing to a tone CS. Moreover, they found that US evoked reflex
responses were not dependent on plasticity, but were attenuated when muscimol was injected to the amygdala demonstrating that neural activity is necessary in the amygdala for the emotional responses to the aversive value of the US.
Making use of modern genetic and molecular tools Rumpel and colleagues (2005) were able to show not only that plasticity in the amygdala is necessary for fear learning but also how synaptic strengthening during associative LTP is dependent on the learning driven increase of a specific glutamate receptors (GluR1 receptor) on the postsynaptic cell. Different constructs with GluR1 receptor acted as plasticity tags or plasticity blockers, permitting the conclusion that indeed conditioning increases GluR1 receptor incorporation on active synapses, and that blocking this receptor disrupts both short and long term memory of the conditioning experience as measured by freezing response to a tone CS. Moreover they were able to establish that disabling plasticity in as little as 20% of lateral amygdala neurons is sufficient to diminish fear learning.
Jin‐Hee Han and others (2007) explore further the mechanism of synaptic plasticity dependence of memory formation on the LA, as they show that neurons recruited for that memory formation depend on the state of activity of CREB (transcription factor adenosine 3’, 5’ monophosphate response element binding protein) in the cell. Also they demonstrated that injection of a CREB vector in transgenic CREB deficient mice that show impairment in memory formation is sufficient to rescue fear memory formation assessed by freezing levels to a tone CS.
A final piece of evidence that plasticity in the lateral amygdala is needed to encode the memory trace after fear conditioning: work from the same laboratory (Jin‐ Hee Han et al, 2009) using a clever designed paradigm combining genetics, molecular tools and pharmacology showed how a selective ablation of neurons that overexpress CREB, (that they have found in the previous work to be present in neurons activated by auditory fear memory), was able to erase a fear memory.
Bridging the gap on trace fear conditioning
If Hebbian plasticity operates in a time frame of milliseconds (Blair et al, 2001) meaning that an overlap between stimuli is needed for the association to take place, it is puzzling how animals can learn that a given environmental cue predicts a thereat. There must be other brain structures that sustain activity during the trace period.Working memory
The term working memory is used to define a limited system that stores short‐ term memory of an information or event, allowing its processing and integration to be performed latter by a different system (Baddeley, 2003). This means that somewhere in the brain there is a structure dedicated to keep information for sometime and then decide if its integration is needed. The prefrontal cortex has been showed to be necessary to associate stimuli separated in time (Fuster et al, 2000). Studies demonstrated that lesion to this structure impair trace fear conditioning without having any effect on conditioning of overlapping stimuli (Morgan & LeDoux, 1995; Kronforst‐ Collins & Disterhoft, 1998; McLaughlin et al. 2002). It also has been pointed out as a place for memory storage in trace fear conditioning (Runyan et al, 2004). The hypothesis is that this structure might be sustaining the activity from the tone and the relaying that information to the amygdala when the US happens.
Episodic Memory
Episodic memory is a representation of a temporally discrete event, characterized by the association of a learning episode to a unique context (Buckner & Barch, 1999). In the literature it is widely undisputed that the hippocampus is a major player on context fear conditioning (Philips & LeDoux, 1992). More, McEchron et al, (1998) showed that lesion on this structure impairs context fear learning and disrupts conditioning to an auditory stimulus when a trace interval is present. Misane and co‐ workers (2005) showed that plasticity in the hippocampus is necessary for auditory trace fear conditioning. They were even able to determine the time span of the trace interval in which this structure is necessary. Other work suggests that the hippocampus is also necessary for the consolidation or the expression of conditioned fear with a trace interval, without having an effect on delay fear conditioning (Quinn et al, 2002). Also, synaptic plasticity in this structure is necessary to acquire fear to a context CS (Huerta et al, 2000), and electrophysiological recordings revealed that neurons in the hippocampus sustain activity during the trace interval in a conditioning protocol (McEchron et al, 2003). In context fear conditioning a series of visuospatial, olfactory and tactile cues
form the contextual CS get associated with the US, and this learning relies on both the amygdala and the hippocampus (Fanselow & Kim, 1994; LeDoux, 2000; Philips & LeDoux, 1992; Maren & Hobin, 2007), thus, during the trace period, the hippocampus might be needed to sustain a general representation of the conditioning episode, in which the tone participates, making the bridge for the association with the US.
Objective
This laboratory is interested in understanding the role of the amygdala, the hippocampus and of the prefrontal cortex on the acquisition of fear conditioning when the two stimuli are separated in time, making use of a reversible inactivation protocol.
As shown above, evidence supporting the amygdala as a crucial structure involved in delay fear conditioning is plenty. For this reason it has been generally accepted that it should have a similar role in associative learning of fear when stimuli are separated in time as in trace fear conditioning. However this has never been properly tested. Some lesion studies performed by this laboratory support the amygdala as an important place for fear learning in trace fear conditioning (pers. com.). Also data from this laboratory shows that the involvement of the different structures depends on the temporal gap (Guimarais et al. 2009). We want to investigate if the amygdala is involved, and if so, if this involvement is dependent on the temporal gap. Because lesion studies do not allow for a rigorous pinpointing of the role of the structure (if the animal is tested with a lesion we cannot say if the amygdala was important in the acquisition or expression of conditioned fear), we are proposing to investigate the role of this structure in acquisition of trace fear conditioning using temporary muscimol inactivation. Muscimol is a GABAA agonist that binds to the neurotransmitter GABA
receptor, causing inhibition of action potentials on the site where is injected, silencing the structure. Because muscimol washes off quickly, freezing to the CSs can be accessed with intact structures. This means that if the infusion is pre‐training we can access the role of the amygdala in the acquisition of conditioned fear, whereas if the infusion is done prior to testing we can access its role in the expression of learned fear.
To test our hypotheses we accessed the effect of muscimol inactivation in the amygdala, on the acquisition of conditioned fear to a tone in two similar protocols that only differ on the trace period: a short interval (5 seconds) and a longer interval (40
seconds). Since we believe that the recruitment of the mPFC and the hippocampus depend on the trace interval, the time for the trace intervals was chosen following an important work with mice (Misane et al, 2005), in which the authors found the time span in which the hippocampus is necessary for trace fear conditioning. They found that below 15 seconds hippocampus inactivation had no effect on the acquisition of conditioned fear, and that after 45 seconds there was no association of the stimuli. Our hypotheses is that the amygdala in necessary no matter the time gap between stimuli but we need to test its involvement in both trace intervals to be able to integrate the results with the work done with the other structures.
Methods
Subjects:
We used experimentally naive, outbreed, male albino Sprague Dawley rats, weighing between 300 and 500g, obtained from a commercial supplier (Harlan, U.K). After arrival the animals were single housed in clear Plexiglas cages with filtered tops, stored in a self‐ventilated rack (Techniplast) maintained in a 12 hr light/dark cycle, in which the lights are on at 8:00 A.M., and with ad libitum access to food and water. All surgical and behavioral procedures were performed during the light phase of the cycle.
The Instituto Gulbenkian de Ciência follows the European Guidelines. The use of vertebrate animals in research in Portugal complies with the European Directive 86/609/EEC of the European Council.
Apparatus:
Freezing levels to the tone have to be accessed in a way that no confounding effect might come from the context. For this we had two different environments, boxes A and B. Animals were also assigned to the boxes in a counterbalanced way, so some animals were trained in A and tone tested in B, and vice‐versa. The boxes are placed inside a sound‐attenuating cubicle (model H10‐24A, Coulbourn Instruments). During training and context test sessions, the boxes have a shock floor of metal bars (model H10‐11R‐TC‐SF, Coulbourn Instruments). During tone test sessions the floors are covered with a painted acrylic plate. Although the boxes are located in the same
procedure room they consist of two separate environments: Box A is a conditioning chamber (model H10‐11R‐TC, Coulbourn Instruments), with the ceiling and all four‐side walls made of clear Plexiglas. The sound attenuating box in which is placed in has the walls, floor and ceiling painted in white. The small house light inside the chamber is located on the middle top of the left wall, and the sound speaker for presentation of the tone is placed outside the chamber behind the right wall. Box B is the same model of conditioning chamber as box A, with front and back walls and ceiling made of clear Plexiglas, but the two sidewalls are made of polished sheet metal. The sound‐attenuating box is painted black all around. The house light is placed on the top‐back corner of the right wall, and the sound speaker behind the left wall.
The two chambers are also cleaned with two different detergents in order to give different odorant cues.
The CS is a 5 Khz, 20 seconds duration tone, produced by a sound generator (RM1, Tucker Davies Technologies) delivered through a horn tweeter (model TL16H8OHM, VISATON).
The US is a 1.5 mA shock with 1.5 seconds of duration, delivered trough a precision programmable shocker (model H13‐16, Coulbourn Instruments).
The rats’ behavior is recorder with video cameras mounted on the ceiling of each chamber, for later scoring. Video data is stored in DVD.
Surgery:
Rats were anesthetized with sodium pentobarbital (65mg/Kg, i.p.) and injected with atropine (0.04 mg/Kg, i.p.) to prevent airway obstruction. Supplemental injections were administered if and as needed. After shaving the animal’s head is placed in a stereotaxic instrument with non‐puncture ear bars to secure the head. After scalp incision and retraction the bregma was used as a reference point in order to measure the coordinates were the amygdala should be. Two burr holes (one in each hemisphere) were drilled to place the cannulas (PlasticOne). Coordinates with reference to bregma were measured according to Paxinos and Watson (1998) rat brain atlas: ‐3.3 mm posterior to bregma, ± 5.3 mm lateral to bregma and 8.0 mm ventral. After implantation, the cannullas are secured with dental cement that also covers the extent of the hound. After surgery, rats received an injection of buprenorphine (0.01 mg/Kg), intended to minimize the pain, and are kept warm and under observation until recovery from
anesthesia. The animals then returned to their home cages and recover from surgery for 7 to 10 days, before subsequent behavioral procedure. Behavioral procedures: All animals are subjected to six procedure phases: Days 1 and 2: handling The experimenter handles the rats in order for them to get used to the infusion procedure. During this phase dummy caps are replaced. Day 3: habituation
The animals are exposed to both training and tone test boxes, for 15 minutes each. At this time no stimuli are presented. Exposure to each box is separated for at least 5 hours.
Day 4: trace fear conditioning
AS our goal is to assess the involvement of the amygdala with short and long trace intervals between stimuli, animals were divided in two groups: one for a protocol with a 5 seconds trace interval, another for a protocol with 40 seconds trace interval. Both protocols were equal in procedures except for the trace interval.
Before the training session animals receive a 0.3 µl infusion to the amygdala, delivered by an infusion pump (model 55‐2226, Harvard Apparatus), at a rate of 0.250 µl/min. Control animals receive saline infusions, while experimental subjects receive muscimol. After 20 minutes, time in which the muscimol should have been effective in inactivating the structure, animals are placed in the conditioning box. They are allowed to explore the box freely for 10 minutes, after which they receive a 5Khz 20 seconds tone. Following the trace period (5 seconds for one group and 40 seconds for the other) a 1.5mA, 1.5 seconds duration foot‐shock is delivered by the metal bars floor. The animals stay in the conditioning box for an additional period of 180 seconds, after which they return to their home cages.
Day 5: tone test
24 hours after training, subjects undergo a tone test session. These were performed in a box different form the training one, in order to minimize possible confounding effects between freezing to the tone and to the context. After 180 seconds habituation period in which the rats can explore the chamber without stimuli, the animal receives 3 CS tones with 20 seconds duration presented with no shock. The
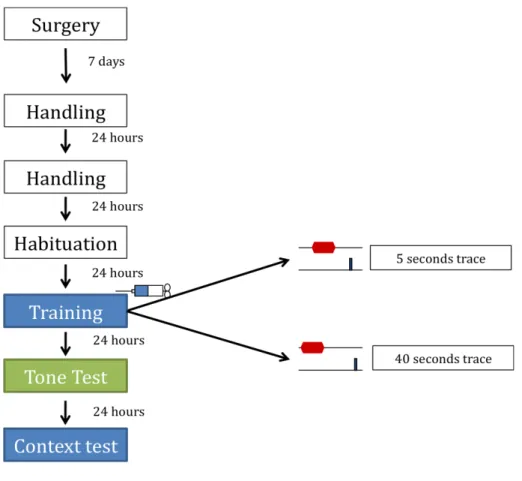
average inter trial interval is 180 seconds. At the end of the session, the animals return to their home cages. Day 6: context test 48 hours after conditioning, the levels of freezing to the context are accessed, by placing the animals in the same box where they received the pairing of tone and shock. The exposure lasts 5 minutes. The rats return to their home cages after the session. Conditioned freezing levels for both tone and context were accessed, 24 hr and 48 hr after training, in a counterbalanced fashion between animals, meaning that some were tested first to the fear of the tone and then context and others the other way around Thus, for some animals the context test is on day 5 and the tone test on day 6. Figure 1 represents the experimental design.
Fig. 1 ‐ Experimental design. The colors represent different boxes. On the habituation day the animals get exposed to both training and tone test boxes. The infusion of either saline or muscimol is performed only before training. The training protocol only differs on the extent of the trace period.
Experimental groups:
Cronical cannulas were placed bilaterally above the amygdala of 38 rats. The animals were then randomly assigned to the two trace protocols (5 seconds and 40 seconds). In each protocol rats were randomly divided in control and test groups, which received different treatments (saline or muscimol infusion, respectively). Three animals died after surgery.
The 5 seconds protocol group had a total of 17 rats, 7 of them had muscimol infusions prior to training and 10 controls. After observation of the histology 5 control and 2 test rats were discarded due to misplacement of the cannulas, denoted by lack of fluorescence on the amygdala. An additional 3 rats (2 from the control group and one test rat) were excluded from the analysis because they showed lesions on the amygdala. The final composition of the groups for this protocol was 3 control (vehicle, n=3) rats and 4 rats (muscimol, n=4) with correct inactivation of the amygdala.
On the 40 seconds protocol group, a total of 18 rats were tested, 9 for the test group and 9 controls. 3 rats were discarded because baseline levels of anxiety, measured by freezing on the test chamber before any presentation of the CS, were higher than the average plus two times the standard error of the mean, a measure that we thought would be enough to find outliers. On this exclusion two rats belonged to the control group and one to the test group. One rat of each group was discarded due to misplacement of the cannulas, and 6 (3 controls and 3 test rats) were excluded due to lesion on the target structure. The final composition of the groups for this protocol was 3 control rats (vehicle, n=3) and 4 rats (muscimol, n=4) with correct inactivation of the amygdala. Histology: To make sure the infusions were done in the correct place, after the conclusion of the behavioral procedures control and test animals were deeply anesthetized with an overdose of sodium pentobarbital, after which they received a 0.3 µl infusion of fluorescent muscimol. After death of the rats, their brains were removed and stored in refrigerator in a 30% sucrose/paraformaldeide fixing solution until they sank (usually 2 to 4 days). When the brains are properly fixed, 40 µm thick coronal slices covering the whole extent of the amygdala were cut on a cryostat. The slices were examined on a stereoscope with fluorescent light to judge the extension of the inactivation.
Data analysis:
Freezing was used as a measure of conditioned fear. An episode of freezing is defined has a period were the animal has total absence of movement, except for respiratory function related movements (Blanchard & Blanchard, 1969; Blanchard & Blanchard, 1972). Freezing to the tone and context test was recorded on disc for posterior manual score by the experimenter.
During tone test session two measures of freezing were scored: baseline freezing (gives us a measure of the overall anxiety level of the animal unrelated to the CS), scored for a period of 20 seconds before the onset of the first CS alone presentation, and freezing to the tone CS for each of the three presentations of the 20 seconds CS.
For the index of conditioned fear to the context, freezing measures were taken at every other 30 seconds period of the 5 minutes test.
Freezing:
A quick final word about the chosen index of conditioned fear: freezing. It was first described by Blanchard and Blanchard, (1969; 1972), and it is a defensive behavior in which the animal chooses to suppress any movement, except respiratory movements. This is a usual response to threat when escape routes are inexistent. Not only this is a very easy measure to take, because it needs only direct observation of the animal’s behavior, also it has been shown that it is a reliable and sensitive measure when compared with instrumental measures like conditioned suppression. These other measures have to be compared with baseline performance of the animals. Freezing has been shown to have no baseline levels in control rats that never received shocks (Bouton & Bolles, 1980; Fendt & Fanselow, 1999).
Results
The number of animals that reached the appropriate criteria for analysis was low. Because of this no statistical analyses was performed, therefore we can only offer a description and discussion of the effects observed.
Some of the animals were discarded from the analysis due to inefficient inactivation. Others had lesions on the structure due to incorrect placement of the
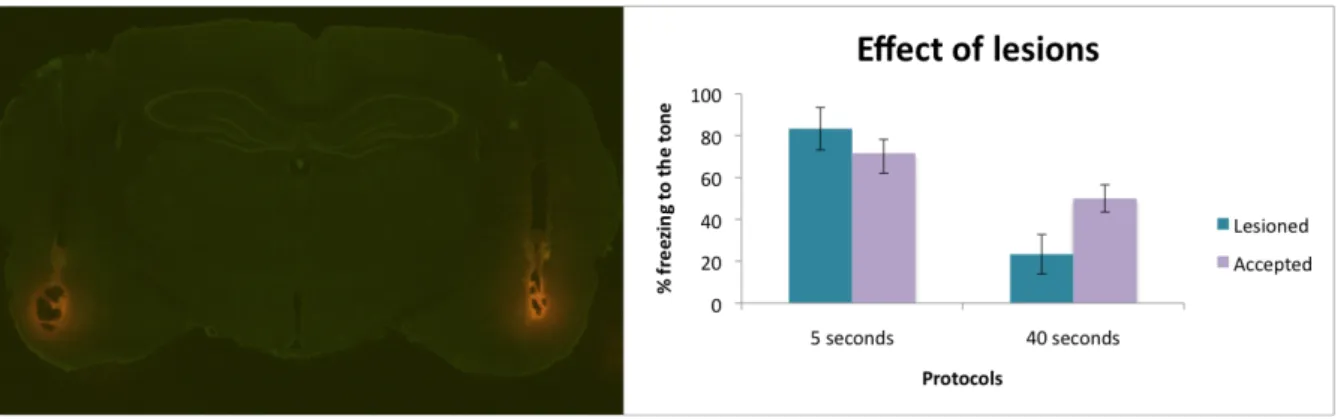
cannulas that penetrated deeper than expected, causing the lesion (Fig 2). Others had lesions in the amygdala even though the cannulas were in the correct place, which we believe may be due to the pressure of the injection. We excluded animals with lesions no matter the extent following work from this laboratory (Guimarais, unpublished data) showing that even small lesions have an effect on fear conditioning. This was consistent with findings of other studies (reviewed in Maren, 2005) that found that small lesions to different amygdalar nuclei were sufficient to disrupt acquisition and expression of conditioned fear. We found an effect of the lesion on control rats, as they freeze less to the tone CS than rats with no lesion. This effect was stronger on the rats from the 40 seconds trace protocol. This might be explained because of different extent of lesions or because the protocol with a shorter trace interval is stronger. In the 5 seconds protocol, the rat excluded showed expected freezing results, but we observed that he had only a unilateral lesion on the amygdala and therefore he was able to learn to fear the tone. Nevertheless, in the interest of consistency we excluded from the analysis all the lesioned animals. Three additional rats were excluded from the results due to high pre‐ CS levels of freezing. We excluded these rats because if they displayed such high anxiety levels before the conditioned stimulus was presented, we were unable to assure that the freezing during the tone presentations is really a measure of learned fear and not an overall state of fear by a more nervous animal.
Fig. 2‐ Effect of lesion on the tone evoked freezing levels in control rats. The left image is an example of a brain slice of an animal showing a bilateral lesion on the amygdala. On the right we compare tone evoked freezing levels of rats with lesions and rats that were accepted for the analyses.
Our aim was to access if the amygdala is implicated in the acquisition of fear when stimuli are separated in time. For that we compared the levels of freezing to a tone CS, one or two days (see methods) after the animals were subjected to one tone‐shock pairing. We accessed fear‐elicited behavior between rats with intact and inactive structures at the time of training, for two different trace intervals. Figure 3 shows on the left an example of a successful bilateral targeting of the amygdala, and on the right an amplification of the inactivated amygdala. Fig. 3 ‐ The left image is an example of a photograph of a section of a rat’s brain showing correct bilateral targeting of the amygdala. Both control and test rats were injected with 0,3 µl of fluorescent muscimol (orange staining) to the structure before death, to allow the determination of correct infusions. The picture on the right is an amplification of another rat’s brain slice, showing the amygdala correctly infused with the drug.
To measure fear resulting from the association of tone and shock, animals were exposed to three CS alone trials performed in a neutral context (i.e. a box different from the one they were trained as explained in the methods section), 24 or 48 hours after conditioning (because of the counterbalanced test design‐ see methods). Due to the reduced number of animals that gathered all the conditions to be accepted for analyses, no statistic analysis was performed. Nevertheless, consistent with our hypotheses, in both trace protocols, animals trained after muscimol infusions (i.e. with silenced amygdala) showed lower levels of freezing to the acoustic CS, strongly suggesting that activity in the amygdala is indeed necessary to associate the CS and US no matter the time gap between them (Fig. 3).
During the tone test session, for both protocols, the control group showed low freezing levels before the tone CS was presented, indicating that control animals had low
levels of anxiety. However, these animals showed robust freezing during the presentation of the tones, indicating that they were able to learn to associate both stimuli, and fear the tone even in the absence of shock. In the test animals the measures of baseline anxiety and fear of the tone seem very similar. This suggests that the presence of the tone does not change the behavior of the rats on the test box. In both protocols test animals displayed less freezing to the tone then control animals. This result suggests a strong effect of amygdala inactivation on trace fear conditioning. Animals that had the structure inactivated during training were unable to acquire a fear memory. Fig. 3 – Muscimol inactivation of the amygdala disrupts fear learning in a trace fear conditioning paradigm. pre‐CS represents the percent baseline anxiety, measured in a 20 second period before the presentation of the first CS. CS is the percentage of the amount of time spent freezing during a 20 second presentation of the tone CS, averaged across 3 CS alone trials. Columns denote averages of each group and bars represent the standard error of the mean.
As explained above (methods) we used different boxes to measure fear to the tone and to the context. This assures that in the tone test the behavioral measure is due to fear to the discrete stimulus. However we were also interested in understanding how the context of conditioning might be relevant for this paradigm, and if fear to that context is dependent on the amygdala. We expected to find relevant differences between control and test animals by measuring changes in behavior in the conditioning context.
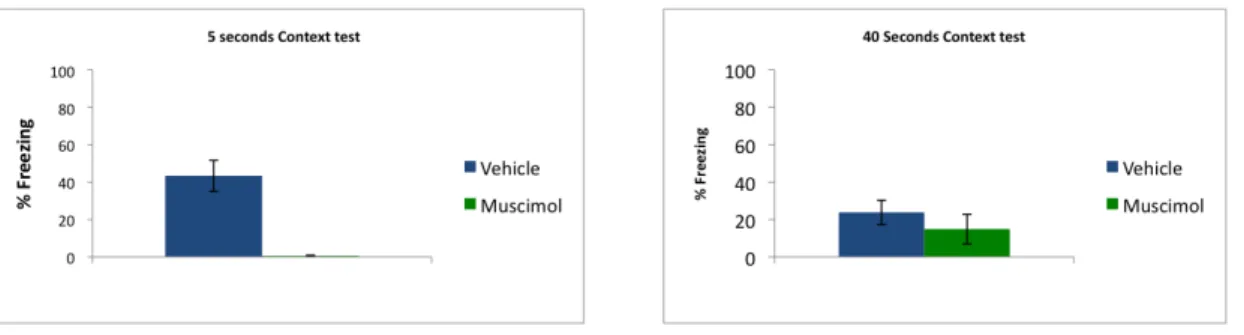
We had ambiguous results. Figure 4 compares the percentage of fear to the context, in both protocols, between control and test groups. In the 5 second protocol
there seems to be an effect of the lack of activity in the amygdala on the acquisition of fear to the context, as control rats show higher levels of freezing when exposed to the box were they were trained, with no other stimuli. But in the 40 seconds protocol, the difference is not clear, and both groups show very similar, and rather low levels of freezing to the context.
Fig. 4 – Percentage of fear to the conditioning chamber (context conditioned fear) measured by freezing. There is no clear effect of amygdala inactivation on this essay. Columns denote averages of each group and bars represent the standard error of the mean.
Discussion
Amygdala inactivation
This work intended to investigate the role of the amygdala on trace fear conditioning. Our results suggest that this structure is indeed necessary for this type of learning.
As explain above (methods section), the tone test session, performed 24 or 48 hours after conditioning, was performed in a neutral box. This assures that we are testing freezing specifically evoked by the tone CS and no confounding effect comes for the fear to the multimodal stimuli evoked by the context. Control animals in both protocols froze less before CS than when the tone was present. This suggests that this tone evoked response is in fact due to associative fear of the tone, more, this is supported by the lack of difference when comparing baseline freezing and tone evoked response in test animals, suggesting that they fail to make the association. Our results show that animals with amygdala inactivation show considerable less freezing to the CS than control animals in either protocol, suggesting that they did not learn that the tone
predicted threat. This indicates that learning about the predictive properties of the CS depends on the proper activity in the amygdala, irrespective of the presence of a temporal gap between stimuli. Our results are in agreement with decades of literature resulting from studies that pinpoint the amygdala has playing a crucial role in numerous types of aversively motivated learning. Not only it is needed for the association, but also for the expression of conditioned fear and storage of the fear memory (Fendt & Fanselow, 1999; LeDoux, 2000; Maren, 2005; Blair et al, 2005; Han et al, 2007). More, the levels of freezing displayed by muscimol infused animals are similar to those displayed by animals that received explicitly unpaired tones and shocks, and thus are unable to associate them, found in previous observations by this laboratory (Guimarais, unpublished data), supporting further the idea that in fact activity in the amygdala is necessary for association of stimuli on trace fear conditioning. Also, our levels of fear response in control animals are in agreement to the levels obtained in the cited study, by animals that received strong training with multiple pairings of stimuli. This not only comes to support our data as evidence that the amygdala is important for our paradigm, as it shows that one single pairing of tone and shock is sufficient to form a strong association between stimuli.
When the animals were tested for fear responses to the context the results were not so clear. Although context fear conditioning seems to be dependent on the hippocampus, it has been stated that the association also takes place in the amygdala (Phillips & LeDoux, 1992; Fanselow & Kim, 1994; Maren & Hobbin, 2007). If this is the case then we expected that animals with inactive amygdala were unable to form an association between the shock and the context, represented by the lack of freezing when exposed to the context box. In the 5 seconds protocol we observe this effect, as muscimol infused animals show virtually no freezing to the context. Control animals display considerably higher levels of freezing, showing that they were able to learn to fear the context in which they received the shock. However, in the 40 seconds protocol, there is no clear difference in both treatments. One possibility is that this is the result of a bias due to a low sample size. Furthermore, when looking at the raw data we observe that it is just one of the muscimol animals that displays abnormally high levels of freezing to the context, and that this only happens towards the end of the test session, which might reflect that what we classified as freezing could be resting. Increasing the sample size is needed to clarify this point. One observation harder to explain is the
difference in freezing observed between control animals of both protocols: 40 seconds control group shows a relatively low freezing level when compared to the 5 seconds control group. In theory we would expect otherwise. Delay conditioning studies show that animals that receive paired tones and shocks freeze less to the context then animals that receive unpaired training. This is explained by the fact that context CS cues are the only relevant stimuli when the tone means nothing for the fear association (Anagnostaras et al., 2001). When there is a trace interval separating the stimuli the task of association gets harder as the interval increase. In a longer trace interval we expect that the surrounding visuospatial cues would be more salient than in a shorter trace interval, because they would compete with the tone for the attention of the animal. This would also explain why test subjects in the 40 seconds protocol freeze less to the tone when compared with the 5 seconds test group: in the longer trace the tone shares its salience with the environment, so when presented alone, although it elicits freezing, it does not show such a severe effect than when the tone is the stronger stimulus, as in small trace intervals. But when we compare levels of freezing to the context alone between control animals we fail to see the predicted effect: animals in the shorter trace protocol freeze more to the context than their 40 seconds counterparts for which the environment should represent a stronger conditioned stimulus. We have no explanation for this, except the fact that our sample size is low, which is particularly relevant as we found that single trial conditioning does not yield reliable context fear.
A final concern goes to our chosen measure of conditioned fear, freezing. It is easy to measure and it has been shown to be quite reliable when compared with instrumental measures (Bouton & Bolles, 1980; Fendt & Fanselow, 1999). However, freezing is hard to score when we do not have a measure of the baseline activity. Therefore it would be interesting to repeat this kind of experiments using a different measure of fear, such as conditioned suppression, in which the animal stops the behavior that gathers him appetitive stimuli such as food or water, when an aversive stimulus is present. This might be a more sensitive measure of conditioned fear, yielding a less ambiguous answer to some aspects of trace fear conditioning.
Concluding Remarks
We have shown evidence that the amygdala is necessary for trace fear conditioning independently of the time span that separate stimuli. This work is part of bigger project that aims to understand how are the amygdala, mPFC and hippocampus working together to bridge the temporal gap on this trace paradigm. We have shown elsewhere (Guimarais et al. 2009), that activity in the mPFC during conditioning is necessary to acquire the association between stimuli. This was found true for both protocols. Inactivation of this structure during the training phase impaired fear learning. The same work revealed that the hippocampus is only recruited when the time gap is longer, as inactivation of this structure, at the time of learning, showed no significative influence on subsequent behavior when the trace interval is small. That is to say that the hippocampus is probably only needed when the animal needs to recur to the representation of the whole episode in which it was shock, in order to be able to associate the stimuli. The mPFC is probably responsible for keeping an immediate short‐ term memory of the tone and subsequently relay that information to the amygdala (in the short trace protocol). In the longer trace protocol the mPFC might be relaying the information directly to the amygdala or via the hippocampus. Regardless of the input to the amygdala that sustains activity during the trace interval, either the mPFC and/or the hippocampus, we conclude that the amygdala is always necessary.