330 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020
10.26843/rencima.v11i6.2551 eISSN 2179-426X Recebido em 08/10/2019 / Aceito em 22/09/2020 / Publicado em 01/10/2020
Ensino de Química – algumas aulas práticas utilizando materiais
alternativos
Chemical Teaching – some practical classes using alternative materials
Ana Maria Sá Durazzini
IFSULDEMINAS – Campus Pouso Alegre/Licencianda em Química/ anadurazzini@gmail.com
https://orcid.org/0000-0002-3642-2833
Carlos Henrique Marquezini Machado
IFSULDEMINAS – Campus Pouso Alegre/Licenciando em Química/ carlosmarquezini@gmail.com
https://orcid.org/0000-0003-0024-9773
Ana Carolina Pereira
IFSULDEMINAS – Campus Pouso Alegre/Licenciada em Química, Doutora em Ciências pela UNIFRAN e Pós-doutora pela Faculdade de Ciências Farmacêuticas de Ribeirão
Preto- USP-RP/ carolanacarolinapereira48@gmail.com
https://orcid.org/0000-0001-9650-3005
Maria Cristiane Lima
IFSULDEMINAS – Campus Pouso Alegre/Licencianda em Química/
Cristiane_limaa17@gmail.com https://orcid.org/0000-0002-3642-2833
Ana Maria Pereira
IFSULDEMINAS – Campus Pouso Alegre/Licencianda em Química/
anamariapereira028@gmail.com
331 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Claudiani Alves Pelegrini Peres
IFSULDEMINAS – Campus Pouso Alegre/Licencianda em Química/
claudiani.alves.267@gmail.com
https://orcid.org/0000-0002-7017-6680
Resumo
A disciplina de Química muitas vezes é vista como algo amedrontador e impossível de criar empatia para os estudantes em geral dado o seu conteúdo um tanto quanto complexo. Haja vista este problema há uma busca pela desmistificação da referida disciplina em relação aos estudantes e até mesmo alguns docentes, utilizando para isso artefatos como atividades lúdicas e aulas práticas e experimentais. O objetivo deste estudo foi a realização de quatro aulas práticas, ministradas por discentes do 5º período do curso de Licenciatura em Química, dentro da disciplina de Práticas Pedagógicas I, no Instituto Federal de Educação, Ciência e Tecnologia do Sul de Minas (IFSULDEMINAS) - Campus Pouso Alegre, para comprovar que o ensino da química pode ser realizado com algumas práticas sem a necessidade de um laboratório propriamente dito. Houve a possibilidade de auxílio imediatamente de acordo com as dificuldades encontradas pelos estudantes ao longo das aulas, que possuem potencial para serem aplicadas novamente tanto na disciplina de Práticas Pedagógicas I destinada ao 5º período do curso de Licenciatura em Química quanto para demais turmas de Cursos Superiores ligadas à Química, além de Ensino Fundamental e Médio. A ausência de um laboratório não impede à realização das práticas descritas e realizadas aqui.
Palavras-chave: Atividades lúdicas; aulas práticas; experimentação sem laboratório.
Abstract
Chemistry is often seen as frightening and impossible to empathize with students in general given its somewhat complex content. In view of this problem, there is a search for the demystification of this discipline in relation to students and even some teachers, using artifacts such as recreational activities and practical and experimental classes. The objective of this study was to hold four practical classes, taught by students of the 5th period of the Degree in Chemistry, within the Pedagogical Practices I discipline, at Instituto Federal de Educação, Ciência e Tecnologia do Sul de Minas (IFSULDEMINAS) - Pouso Alegre Campus, to prove that chemistry teaching can be done with some practices without the need for a laboratory itself. There was the possibility of assistance immediately according to the difficulties encountered by the students throughout the classes, which have the potential to be applied again in both the Pedagogical Practices I course for the 5th period of the Degree
332 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 in Chemistry and other classes of Higher Courses. Chemistry, as well as Elementary and High School. The absence of a laboratory does not prevent the practice described and performed here.
Keywords: Playful activities; practical classes; experiment without laboratory.
Introdução
A disciplina de Química muitas vezes é vista como algo amedrontador e até mesmo impossível de criar empatia para os estudantes em geral, dado o seu conteúdo que envolve muitas fórmulas, cálculos e conceitos próprios. Haja vista este problema há uma busca pela desmistificação da referida disciplina em relação aos estudantes e até mesmo alguns docentes, que por muitas vezes não possuem estruturas de laboratório adequadas nas escolas onde lecionam e deixam de lado as aulas práticas que poderiam despertar a curiosidade e propiciar um melhor entendimento da disciplina por parte dos estudantes.
O objetivo deste estudo foi a realização de quatro aulas práticas, ministradas por discentes do 5º período do curso de Licenciatura em Química, dentro da disciplina de Práticas Pedagógicas I, no IFSULDEMINAS – Campus Pouso Alegre, para comprovar que o ensino da química pode ser realizado com algumas práticas sem a necessidade de um laboratório propriamente dito.
Espera-se estender a experiência das aulas práticas aplicadas, tanto para alunos do Ensino Fundamental e Médio quanto para o próprio Curso Superior de Licenciatura em Química, fazendo-se assim, a construção do conhecimento científico, como tem sido sugerido no ensino de Ciências da Natureza atualmente (ZOMPERO et al., 2019).
Referencial Teórico
No ensino tradicional, embora não seja total e amplamente divulgado, percebe-se que a transmissão do conhecimento ainda está presente na sala de aula, posicionando o professor como o único detentor do saber e, assim capaz de evitar conflitos e discussões, (FACHÍN-TERÁN, 2013). A experimentação pode confrontar esse tipo de ensino e, para isso, precisa ser vista como um artefato pedagógico para o ensino de Química (BUENO et al., 2018), uma vez que pode influenciar no modo como os estudantes aprendem, quando realizadas de formas que possibilitem discussões e problematizações dos resultados obtidos e das observações realizadas na experimentação. Assim como Zanon e Freitas (2007, p.94) relataram:
333 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020
Acreditamos que a atividade experimental deve ser desenvolvida, sob orientação do professor, a partir de questões investigativas que tenham consonância com aspectos da vida dos alunos e que se constituam em problemas reais e desafiadores.
Esta linha de raciocínio inclui também a utilização de atividades lúdicas, com o objetivo de melhorias no processo de ensino-aprendizagem que, por muito tempo, foi existente levando-se em consideração artifícios como memorização e repetição, o que é uma característica marcante do modelo tradicionalista. Porém, atualmente, o ambiente escolar tem sido cada vez mais desafiado a integrar técnicas diferenciadas para auxiliar no processo de ensino-aprendizagem, promovendo possibilidades mais dinâmicas e estimulantes. A elaboração de atividades lúdicas tem se tornado o foco de muitos pesquisadores e entusiastas no assunto. Uma das principais características acerca da utilização destas atividades no cotidiano escolar, além de sua elevada possibilidade de atuar como na construção do conhecimento, está respaldada no seu baixo custo de elaboração e aplicação e a possibilidade de promover uma atividade rápida, estimulante e diferente em sala de aula (LACERDA, 2013). Neste contexto, a aplicação de aulas práticas pode ser simplificada e aplicada de forma a agregar conhecimento aos estudantes, facilitar o processo de ensino-aprendizagem, além de inserir e efetuar a importância do trabalho em grupo (DURAZZINI et al., 2018).
Entretanto, para a realização de uma aula prática, existem alguns fatores a serem considerados, tais como: instalações da escola, material e reagentes necessários e as escolhas das experiências (BUENO; KOVALICZN, 2008), pois de nada adianta serem escolhidas práticas aleatórias, sem uma finalidade clara e um objetivo pontual.
Este fato é agravado ainda mais em escolas da rede pública de ensino, onde os laboratórios para a realização dessas aulas são na maioria das vezes precários, não possuindo os materiais necessários a serem utilizados nas práticas propostas, tendo assim o não cumprimento do objetivo a ser alcançado com as atividades, além de colocar em risco todos os envolvidos, devido à falta de equipamentos de segurança no local (SALESSE, 2012).
Neste contexto, pode ser direcionada ao professor a busca por diferenciais adaptáveis, como por exemplo, a utilização de materiais e reagentes alternativos nas aulas práticas, que podem ser adquiridos na própria casa dele ou dos estudantes ou ainda comprados em farmácias, pois o objetivo da experimentação é possibilitar ao estudante a criação de modelos que tenham sentidos para ele, a partir de suas próprias observações (HESS, 1997), sem necessariamente executar tais experimentos em um laboratório, tornando assim uma possível compreensão mais prazerosa dos conteúdos de química.
A demanda atual por inovações tecnológicas e profissionais diferenciados para atuarem em ramos da indústria tanto da química quanto das demais, criou um leque de vertentes profissionais possíveis e ofertadas com o objetivo de formar futuros cientistas, e consequentemente, cidadãos mais conscientes e também o desenvolvimento de conhecimentos aplicáveis ao sistema produtivo, industrial e agrícola (SALESSE, 2012). Apesar disso, no Brasil, a abordagem da Química escolar continua praticamente estagnada,
334 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 mesmo com a elaboração e divulgação da Lei nº 9.394 de 20 de Dez. de 1996 (BRASIL, 1996) e dos PCN’s (Parâmetros Nacionais Curriculares), que dão um rumo do que deveria ser realizado durante as aulas de química, mas na prática não se vê tais ações, e sim livros didáticos impecavelmente fechados em prateleiras, tendo seu conteúdo pouco aprofundado pelos estudantes e professores (DURAZZINI et al., 2018).
Embora às vezes imposta com aparência de modernidade, a essência do que é oferecido para o ensino-aprendizagem de química permanece a mesma, priorizando-se as informações desligadas da realidade vivida pelos alunos, pelos professores e pela comunidade em si (SALESSE, 2012).
Material e Métodos
As aulas práticas foram baseadas em conhecimentos prévios adquiridos ao longo do curso pelos estudantes, literatura consultada e também no projeto sugerido pela docente responsável: “A Química Perto de Você” (SBQ, 2010) e executados antecipadamente pelos discentes envolvidos, com a finalidade de aperfeiçoar as técnicas e/ou materiais antes de sua aplicação. A prática do “Foguete químico” foi sugerida adicionalmente.
Houve a aplicação das aulas práticas, durante quatro aulas sequenciais da disciplina de Práticas Pedagógicas I, com uma turma do 5° período do Curso de Licenciatura em Química do referido IF, sendo devidamente acompanhados pela docente responsável. A turma citada comportava dezessete discentes, que foram divididos em quatro grupos, sendo três grupos com quatro integrantes e um grupo com cinco integrantes. O grupo 1, com cinco integrantes, foi responsável pelas aulas práticas: “Construindo um extintor de incêndio” e também “Foguete químico”; grupo 2, “À procura da vitamina C”; grupo 3, “Cola derivada do leite”; grupo 4, “Ovo engarrafado”.
Apesar das aulas terem sido ministradas no espaço do Laboratório de Iniciação Científica da Instituição (onde as aulas da disciplina foram agendadas), houve a preocupação de utilizar materiais e reagentes simples, de baixo custo e de fácil aquisição, com o objetivo de ser possível repeti-las no espaço de uma sala de aula ou em algum outro espaço (pátio, quadra, refeitório, entre outros) de uma escola qualquer, cujo o laboratório de química é inexistente ou até mesmo desativado.
A avaliação da prática foi realizada concomitantemente à aplicação da mesma. Conforme as dúvidas foram surgindo, fizeram-se pequenas pausas para explicações referentes, assim como indagações sobre tal, com o objetivo de instigar os estudantes a interligarem seus conhecimentos químicos obtidos até então e compreenderem o que estavam executando.
335 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020
Construindo um extintor de incêndio
A metodologia utilizada foi uma adaptação do descrito no SBQ (2010).
Materiais
- 01 frasco de vidro para azeite, com capacidade para 600 mL; - 01 dosador plástico para azeite;
- papel filtro para café; - barbante de algodão.
Reagentes
- Vinagre (CH3COOH);
- bicarbonato de sódio (NaHCO3).
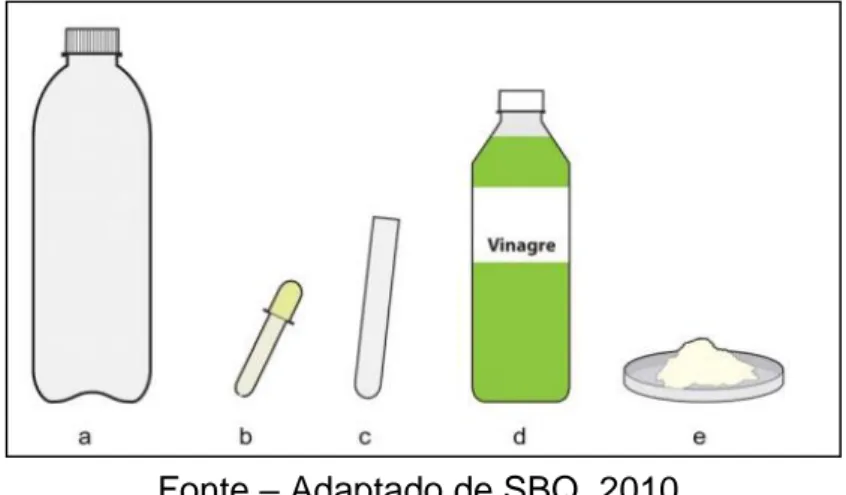
Figura 1 – Materiais e reagentes sugeridos e contidos no projeto do qual as aulas foram baseadas: a. frasco de refrigerante de 600 mL; b. tubo de conta-gotas; c. tubo de
ensaio de 35 mL; d. vinagre; e. bicarbonato de sódio (NaHCO3).
Fonte – Adaptado de SBQ, 2010.
Procedimento experimental
Adicionou-se cerca de 450 mL de vinagre à garrafa de vidro. Com o papel filtro, fez-se uma “trouxinha” com uma boa quantidade (aproximadamente 100g) de bicarbonato de sódio, amarrando-a com o barbante de algodão e posicionando-a no interior da garrafa de
336 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 vidro, de forma que ficasse aproximadamente na altura do meio da referida garrafa, sem entrar em contato com o vinagre. Deixou-se a ponta do barbante para fora da garrafa, prendendo-a na tampa dosadora de azeite.
Para o extintor entrar em funcionamento, tampou-se a abertura do dosador com o dedo indicador e sacudiu-se vigorosamente o extintor, no intuito de provocar a reação química entre o vinagre e o bicarbonato de sódio. Em seguida, inclinou-se o extintor para baixo, dirigindo-o para a região a ser atingida e tirou-se o dedo da abertura, liberando assim a saída do líquido.
Foguete químico
A prática foi sugerida para o estudo de reação química, reaproveitamento de material reciclável (garrafas PET), ângulo de lançamento x distância percorrida pelo foguete, abordagem geral sobre a 3ª Lei de Newton (ação e reação), além de apresentar uma boa aceitação dinâmica dos estudantes ao realizarem a mesma. O vídeo do MANUAL DO MUNDO (2019), foi tido como base para a confecção do foguete químico, salvo as adaptações necessárias para as finalidades aqui presentes, condizentes com a aula a ser ofertada.
Materiais
- Garrafas PET de 250 mL; - rolha de cortiça;
- papel cartão ou cartolina; - papel filtro para café; - barbante de algodão; - cola branca;
- tesoura sem ponta; - fita adesiva.
Reagentes
- Vinagre (CH3COOH);
337 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020
Procedimento experimental
A atividade foi desenvolvida através da construção de protótipos, onde se evidenciou a possibilidade de lançamento de um foguete construído com garrafas PET de 250 mL pela propulsão produzida pela reação química bicarbonato de sódio e vinagre.
Foi importante manter um bom alinhamento entre as partes confeccionadas para as “asas” para que não houvesse maiores complicações durante o vôo. A utilização destes materiais deveu-se ao fato da concepção de que se pode mostrar o princípio de funcionamento de equipamentos e máquinas sofisticadas como um foguete, utilizando materiais de baixo custo, incluindo os recicláveis.
Cada lançamento do foguete requereu aproximadamente 10 gramas de bicarbonato de sódio que reagiram com 100 mL vinagre. Para evitar que o bicarbonato reagisse muito rapidamente com o vinagre, o pó de bicarbonato foi embrulhado em uma “trouxinha” (semelhante à do experimento com o extintor de incêndio) de papel filtro de café e amarrado com o barbante, de forma a entrar com facilidade no gargalo da garrafa. Deixou-se uma sobra de barbante de aproximadamente 10 cm para auxiliar no lançamento. Para fazer um lançamento, inseriu-se a “trouxinha” de bicarbonato, colocou-se os 100 mL de vinagre na garrafa, e fechou-se rapidamente a mesma com a rolha. Colocou-se a garrafa emborcada na base de lançamento e iniciou-se a contagem regressiva para o lançamento.
À procura da vitamina C
Prática destinada à identificação de vitamina C em algumas soluções
Materiais
- 05 pipetas de 10 mL (ou seringas de plástico descartáveis);
- 01 fonte para aquecer a água (aquecedor elétrico ou secador de cabelo); - 06 copos de vidro ou erlenmeyers com capacidade de 250 mL cada; - 01 colher de chá de farinha de trigo ou amido de milho;
- 01 béquer de 500 mL ou frasco semelhante; - 01 conta-gotas;
- 01 garrafa de refrigerante de 1 L.
Reagentes
- água filtrada ou destilada;
- 01 comprimido efervescente de 1 g de vitamina C; - tintura de iodo a 2% (comercial);
338 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020
Procedimento experimental
Colocou-se 200 mL de água destilada em um béquer de 500 mL. Em seguida, aqueceu-se o líquido até uma temperatura próxima a 50 ºC, cujo acompanhamento pode ser realizado com um termômetro ou com a imersão de um dos dedos da mão (nessa temperatura é difícil a imersão do dedo por mais de 3 s). Em seguida, colocou-se uma colher de chá cheia de amido de milho na água aquecida, agitando-se sempre a mistura até atingir a temperatura ambiente.
Em uma garrafa de refrigerante de 1 L, contendo aproximadamente 500 mL de água destilada, dissolveu-se um comprimido efervescente de vitamina C e completou-se o volume até 1L.
Escolheram-se três frutas e um legume, obteve-se o suco dos mesmos.
Cinco erlenmeyers de vidro (podendo utilizar copos americanos também) foram numerados, identificando-os com números de 1 a 6 (1= controle: apenas a mistura de amido e água; 2 = solução de vitamina C; 3 = suco de maracujá; 4 = suco de cenoura; 5 = suco de goiaba; 6 = suco de morango). Colocou-se 20 mL da mistura (amido de milho + água) em cada um desses seis recipientes de vidro numerados. Ao erlenmeyer 2, adicionou-se 5 mL da solução de vitamina C; e, a cada um dos erlenmeyers 3, 4, 5 e 6, adicionou-se 5 mL de um dos sucos a serem testados. A seguir pingou-se, gota a gota, a solução de iodo no erlenmeyer 1, agitando constantemente, até que aparecesse uma coloração azul. Anotou-se o número de gotas adicionado (neste caso, uma gota é geralmente suficiente). Repitiu-se o procedimento para o recipiente 2. Anotou-Repitiu-se o número de gotas necessário para o aparecimento da cor azul. Caso a cor desaparecesse, continueria a adição de gotas da tintura de iodo até que ela persistisse, e anotou-se o número total de gotas necessário para a coloração azul persistir. Repetiu-se o procedimento para os copos que continham as diferentes amostras de suco, anotando-se para cada um deles o número de gotas empregado.
Cola derivada do leite
Com este experimento, pretendeu-se demonstrar o preparo de uma cola, de forma bem simples, utilizando o leite como matéria-prima. Pode ser utilizado para implementar a discussão sobre materiais poliméricos presentes nos alimentos, como a caseína, e suas propriedades físico-químicas.
Materiais
- 01 proveta de 50mL ou seringa plástica; - filtro de papel para café;
339 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 - copo descartável médio.
Reagentes
- 01 g de bicarbonato de sódio (NaHCO3); - 100 mL de leite desnatado;
- 01 limão.
Procedimento experimental
Espremeu-se o limão e coe o suco utilizando um papel filtro para café. Adicionou-se 30 mL do suco de limão a 100 mL de leite desnatado e agitou-se bem em um copo descartável. Sobre um segundo recipiente, colocou-se outro filtro e coou-se a mistura de caseína e soro obtida. Adicionou-se pequenas quantidades da mistura, sempre com a posterior retirada da caseína. Após a separação da caseína, que deveria ter aparência semelhante a um queijo cremoso, adicionou-se o bicarbonato de sódio e misturou-se bem até que a mistura se tornasse homogênea. Acrescentou-se 20 mL de água e agitou-se até que toda a massa fosse dissolvida.
Utilizou-se pequenos pedaços de papel e palitinhos de madeira para testar a cola produzida. O resultado foi observado no dia posterior.
Ovo engarrafado
Com este experimento, objetiva-se demonstrar a ação da pressão atmosférica sobre um sistema, pelo comportamento de um gás com a mudança de temperatura sofrida pelo meio.
Materiais
- 01 ovo cozido;
- 01 frasco erlenmeyer de 250 mL, ou uma garrafa PET cujo gargalo tenha o diâmetro aproximado de um ovo.
Reagentes
- 01 caixa de fósforos; - ar do ambiente.
340 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Cozinhou-se previamente o ovo por cerca de vinte minutos. Acendeu-se cerca de quatro fósforos e colocou-se dentro do frasco erlenmeyer. Manteve-se os estudantes que assistiam à prática, afastados. Colocou-se o ovo descascado no gargalo do erlenmeyer. O gargalo do frasco deve sustentar o ovo. No entanto, ele deve ter um diâmetro próximo ao maior diâmetro do ovo.
Resultados e Discussão
Os testes realizados pelos aplicadores antes mesmo da aula prática, propiciaram uma adequação e adaptação das técnicas a serem utilizadas de forma a serem bem-sucedidas.
A aula prática foi proveitosa, pois houve a interação das equipes aplicadoras com os demais, enriquecendo cada etapa da prática, desconfigurando o modelo tradicionalista, onde o professor é visto como portador de conhecimentos que devem ser repassados aos alunos, que devem decorá-los para logo serem conferidos pelo professor novamente. O ambiente escolar tem sido cada vez mais desafiado a elaborar e aplicar técnicas diferenciadas para auxiliar no processo de ensino-aprendizagem (BUENO et al., 2018), promovendo possibilidades mais dinâmicas e estimulantes, inclusive o diálogo entre professor e aluno, propiciando assim, a formação de pensamento crítico dos discentes (FREIRE, 1996).
Construindo um extintor de incêndio
Na prática de construção de um extintor de incêndio, houveram adaptações do método descrito no SBQ, 2010, pois não se utilizou a garrafa de refrigerante de 600 mL, conta-gotas e tubo de ensaio (Figura 1), pois se procurou reaproveitar o material já disponível no momento, que era a garrafa de vidro de azeite e seu bico dosador. Sobre o tubo de ensaio, o mesmo não foi utilizado pelo fato de serem propostas neste trabalho, práticas com materiais e reagentes acessíveis, como por exemplo, em um caso onde não exista um laboratório em determinada escola e o docente precise improvisar; então, ao invés do tubo de ensaio para comportar o bicarbonato de sódio, fez-se uma trouxinha com papel de filtro para café, amarrando-a com barbante de algodão. Benite e Benite (2009), realizaram um estudo semelhante em relação às práticas alternativas para o ensino de Química utilizando materiais recicláveis e/ou de baixo custo.
O êxito da prática foi unânime em todas as tentativas, tanto de testes prévios quanto no momento da aula prática, ocorrendo-se assim a reação da mistura de água e etanoato (acetato) de sódio sendo “expulsa” do extintor devido à pressão provocada pela formação do dióxido de carbono (CO2). O sucesso observado com a aplicação de atividades envolvendo conhecimentos e teorias mais modernas para uma melhor fixação na prática pelos estudantes e professores é o que Pralon (2009) escreve em seu estudo, dizendo
341 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 ainda que é preciso desenvolver a didática específica da Química com a finalidade de atender a necessidade do ensino-aprendizado mais efetivo.
Para as quantidades de vinagre e bicarbonato de sódio utilizado, o jato inicial do líquido emitido pelo extintor teve um alcance aproximado de três metros de distância. Mantendo-se o extintor inclinado para baixo, como mostra a Figura 2, o líquido continuou a ser expelido durante aproximadamente 30 segundos.
Figura 2 – Utilização do extintor de incêndio confeccionado
Fonte – Adaptado do SBQ, 2010.
Reações ácido-base fazem parte do cotidiano dos estudantes. Entre vários exemplos, pode-se citar: os aspectos relacionados à higiene, como a eliminação dos resíduos ácidos deixados pelos alimentos na boca, pelas pastas de dentes que possuem caráter básico; na ação dos antiácidos, tais como os hidróxidos que são usados contra a acidez estomacal e na correção da acidez do solo, para fins agrícolas (SBQ, 2010).
A equação química responsável pelo jato observado do extintor produzido na aula, produz etanoato de sódio (acetato de sódio) e ácido carbônico, o qual se decompôs em água e dióxido de carbono (gás carbônico, CO2): H3CCOOH(aq) + NaHCO3(s) → H3CCOONa(s) + CO2(g) + H2O(l). O gás produzido na reação aumentou a pressão interna do extintor e, sendo esta maior do que a pressão externa, a água e o sal formados na reação foram expelidos para fora do extintor.
O extintor só pode ser empregado quando o fogo estiver em um nível inferior ao do frasco com a mistura reacional, pois é necessário que o gás carbônico “empurre” a água e o sal formados na reação para fora do extintor. Visando mostrar a importância do experimento, foi possível comentar sobre as classes de incêndio: A (materiais que queimam em profundidade e superfície, como madeira, papel, etc.); B (líquidos que queimam na superfície, como gasolina, álcool, etc.); C (aparelhos elétricos e eletrônicos energizados, como computadores, etc.) e D (materiais que requerem extintores específicos, como sódio, magnésio, etc.). Este extintor é exclusivo para a classe A, mas pode ser empregado na classe C desde que os aparelhos incendiados não estejam ligados à rede elétrica. Pode-se também orientar os estudantes quanto à importância da prevenção de incêndios, como a criação de brigadas de incêndios, colocação de sensores de fogo em ambientes e
342 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 recomendações quanto aos cuidados sobre a evacuação de locais fechados em casos de incêndios (SBQ, 2010).
Os resíduos gerados neste experimento foram descartados no lixo comum. As garrafas de vidro foram lavadas e guardadas para uma próxima prática.
Foguete químico
O foguete funcionou, pois o vinagre e o bicarbonato de sódio (que estava embrulhado em uma “trouxinha” de papel, presa por um barbante ao bocal da garrafa e disposto no interior da mesma, em contato com o vinagre) reagiram entre si formando CO2(g), como descrito na reação: Reação ocorrida: CH3COOH(aq) + NaHCO3(s) → CH3COONa(aq) + CO2(g) + H2O(l).
A pressão aumentou a ponto de a rolha escapar. Quando isso aconteceu, a água e o ar foram fortemente expulsos (ação) empurrando (reação) a garrafa na mesma direção e sentido oposto.
Quanto mais gás foi liberado, maior também foi a pressão no interior da garrafa. A pressão chegou a um ponto, que a rolha foi forçada a sair. Quando isso ocorreu, o vinagre foi empurrado para fora em alta velocidade, fazendo com que a garrafa fosse empurrada para cima.
Aproveitou-se a maioria dos materiais e reagentes utilizados para construir tanto o extintor de incêndio (Figura 2: A, B, C e D) quanto o foguete químico (Figura 2: E, F, G e H), possibilitando assim, uma versatilidade de aplicações dos mesmos itens.
Esta aula prática pode ser empregada em diferentes contextos, pois pode-se trabalhar além das reações químicas, as diferenças de ângulos de lançamento do foguete, Leis de Newton, Lei da gravidade, entre outros conteúdos. Sendo assim, é importante dizer que uma prática envolvendo a Química não quer dizer um custo alto para a realização da mesma, nem mesmo alta tecnologia, mas sim atrair a atenção diretamente para o fenômeno estudado (CASTELEINS, 2011).
343 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Figura 2 – A, B, C e D: Confecção do extintor de incêndio durante a explicação teórica. E: Modelo de foguete químico a ser utilizado. F e G: Preparação para o lançamento do foguete químico. H: Foguete químico, instantes antes de ser lançado.
Fonte – Os autores.
À procura da vitamina C
A adição de iodo à solução amilácea (água + amido de milho) provocou uma coloração azul intensa no meio (Figura 3), devido ao fato de o iodo formar um complexo com o amido (SILVA et al, 1995). Graças a sua bem conhecida propriedade antioxidante, a vitamina C promoveu a redução do iodo a iodeto (I-), que é incolor quando em solução aquosa e na ausência de metais pesados. Dessa forma, quanto mais ácido ascórbico um alimento contiver, mais rapidamente a coloração azul inicial da mistura amilácea desaparecerá e maior será a quantidade de gotas da solução de iodo necessária para restabelecer a coloração azul (SBQ, 2010). A equação química que descreve o fenômeno é: C6H8O6(aq) + I2(aq) → C6H6O6(aq) + 2HI(aq).
Foram necessárias 01 gota de tintura de iodo para tornar a solução padrão, azul; 10 gotas de tintura de iodo para tornar a solução de ácido ascórbico, azul; 22 gotas de tintura de iodo para tornar o suco de maracujá, azul; 01 gota para o suco de cenoura; 05 gotas para o suco de goiaba; 03 gotas para o suco de morango. Considerou-se que o suco de maracujá continha uma maior quantidade de vitamina C entre os produtos naturais testados.
344 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Os resíduos gerados neste experimento foram descartados no lixo comum. As garrafas de plástico (PET) foram destinadas à reciclagem.
Figura 3 – A: Da esquerda para a direita, solução de 1 comprimido efervescente de 1 g de vitamina C diluído em 1 L de água; suco de maracujá; suco de cenoura; suco de goiaba; suco de morango. B: Pipetando a quantidade de suco desejada para o teste. C:
Solução de iodeto de potássio. D: Adição de tintura de iodo nas amostras. E: Amostras após a adição de tintura de iodo.
Fonte – Os autores.
Cola derivada do leite
As formulações de caseína são solúveis em soluções alcalinas e em água, porém sua solubilidade é afetada pela adição de ácidos que, pela diminuição do pH, reduz a presença de cargas na molécula, fazendo com que a sua estrutura terciária seja alterada, levando-a à precipitação. Com a redução do pH, ocorre a perda do cálcio na forma de fosfato de cálcio, que é eliminado no soro. A formação do caseinato de sódio ocorre com a adição de bicarbonato de sódio e possui propriedades adesivas. Na indústria, a precipitação da caseína é favorecida pela adição de ácido clorídrico ou ácido sulfúrico ou ainda pela adição da renina, que é uma enzima presente nos alimentos, como o queijo, são utilizados microrganismos que produzem ácido lático, a partir da lactose (SBQ, 2010).
Com esta atividade pode-se observar que é possível produzir, eficientemente, produtos a partir de matérias-primas naturais, obtendo-se resultados comparáveis aos
345 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 produtos industrializados. A interdisciplinaridade também deve ser ressaltada nesse experimento, para explicar os processos químicos e suas reações bem como os processos biológicos, de uma maneira simples e interligada (SBQ, 2010).
O experimento não gerou resíduos nocivos ao meio ambiente. As garrafas de plástico (PET) foram encaminhadas para reciclagem.
Figura 4 – A: Teoria passada na lousa pelos integrantes do grupo. B: Solução de leite e suco de limão. C e D: Cola de leite sendo preparada. E e F: Exemplos de materiais
colados com a cola produzida na aula prática.
Fonte – Os autores.
Ovo engarrafado
Ao queimar, o fósforo liberou-se fumaça, e esta fumaça era composta pelo gás CO2, que ocupa todo o recipiente da garrafa. Quando um gás é aquecido, ele tende a ocupar um volume maior do que o inicial. Ao tampar o gargalo do frasco com o ovo, obteve-se um sistema fechado. Quando a temperatura interna da garrafa começou a decair, as moléculas de gás se contraíram, aproximando-se umas das outras, fazendo com que a pressão interna
346 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 do frasco diminuísse. Neste momento, o ovo foi empurrado para dentro do erlenmeyer (Figura 5: F) pela pressão externa do sistema, a fim de minimizar a diferença dessas pressões.
No experimento sugerido no SBQ (2010), o mesmo foi realizado utilizando-se uma garrafa PET ao invés de um erlenmeyer, possibilitando assim, uma maior simplificação da prática (Figura 6).
Aprender Química exige a assimilação de muitos conceitos e desenvolvimento de habilidades analíticas. A dificuldade para compreender conceitos básicos é um fator que diminui o interesse pelo tema e desmotiva o estudante no estudo da Química, cujos conceitos podem ser encarados como algo impossível e sem aplicabilidade no cotidiano. Por meio deste experimento, podem-se utilizar figuras ou exemplos para introduzir o conceito de elétron, próton, nêutron e átomos, formando a matéria e as diferenças dos estados físicos da matéria. Pode-se, ainda, explicar o efeito da pressão dos gases em determinados meios (SBQ, 2010).
Os resíduos gerados neste experimento foram descartados no lixo comum. As garrafas de plástico (PET) foram encaminhadas à reciclagem.
Figura 5 – A e B: Teoria passada na lousa pelos integrantes do grupo. C, D, E e F: Prática do ovo engarrafado.
347 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Figura 6 – Passo a passo do experimento.
Fonte – SBQ, 2010.
Conclusões
Mesmo já habituados com certos tipos de reações químicas no curso de Licenciatura em Química do IFSULDEMINAS - Campus Pouso Alegre, houve uma reação muito positiva dos estudantes de tal curso envolvidos neste trabalho, conforme foram sendo executadas as práticas e os resultados foram visualizados, de forma a agregar imagens ao conhecimento abstrato e teórico.
Houve a possibilidade de realizar explicações simultâneas às práticas, possibilitando assim, sanar dúvidas existentes, além de observar e auxiliar imediatamente de acordo com as dificuldades encontradas pelos estudantes, construindo o conhecimento científico em conjunto.
As aulas práticas aqui descritas possuem potencial para serem aplicadas novamente tanto na disciplina de Práticas Pedagógicas I destinada ao 5º período do curso de Licenciatura em Química quanto para demais turmas de Cursos Superiores ligadas à Química, além de Ensino Fundamental e Médio.
A ausência de um laboratório não impede à realização das práticas descritas e realizadas aqui.
Agradecimentos
Os autores agradecem os colegas Ana Beatriz Pereira dos Reis, Bianca Lima, Lara Betsa, Lucas Oliveira, Natália Regina Palazzi, Gabriel Furquim, Rodrigo Gabriel dos Santos, Ricardo Lanzellotti Quintino, Maria do Carmo Silva, Eder Pereira, Douglas Pereira de Azevedo e Caroline Jambasse pelo apoio mediante a realização das aulas práticas.
348 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 Referências
BENITE, A. M. C.; BENITE, C. R. M. O laboratório didático no ensino de química: uma experiencia no ensino público brasileiro. Revista Iberoamericana de Educación, Rio de Janeiro, p.1681-5653, 10 jan. 2009.
BRASIL. Lei de Diretrizes e Bases da Educação Nacional, Lei nº 9394, 20 de dezembro de 1996.
BUENO, R. S. M; KOVALICZN, R. A. O ensino de ciências e as dificuldades das atividades. Curitiba: SEED- PR/ PDE, 2008. <diaadiaeducacao.pr.gov.br> Acessado em 29 de Jul. de 2019.
BUENO, A. J. A.; LEAL, B. E. S.; LEAL, E. S.; BERTONI, D. Atividades
práticas/experimentais para o ensino de ciências além das barreiras do laboratório desenvolvidas na formação inicial de professores. Revista de Ensino de Ciências e Matemática. v.9, n.4, p.94-109, 2018.
CASTELEINS, V. L. Dificuldades e benefícios que o docente encontra ao realizar aulas práticas de química. In: CONGRESSO NACIONAL DE EDUCAÇÃO, 10. 2011, Curitiba. Seminário Internacional de Representações Sociais,Subjetividade e Educação. Curitiba: PUCPR, 2011. p. 16399 - 16407.
DURAZZINI, A. M. S; MACHADO, C. H. M; REIS, A. C. R; JAMBASSE, C. Dominó da Tabela Periódica dos Elementos Químicos. Debates em Ensino de Química. v.4, n.2, p.165-180, 2018.
FACHÍN-TERÁN, A. Fundamentos da Educação em Ciências. In: Fachín-Terán, A; Santos, S.C.S. (Orgs.). Novas perspectivas de Ensino de Ciências em espaços não formais amazônicos. Manaus: UEA edições 2013, PDF. Disponível em:
<file:///C:/Users/usuario/Downloads/2013_Novas%20%20perspectivas%20%20de%20%2 0ensino%20%20de%20%20ci%C3%AAncias%20%20em%20%20espa%C3%A7os%20% 20n%C3%A3o%2 0%20formais%20%20amaz%C3%B4nicos.pdf>. Acesso em: 28 de Jul. 2019.
FREIRE, P. Pedagogia da autonomia: saberes necessários à prática educativa. São Paulo: Paz e Terra, 1996. – Coleção Leitura.
HESS, S. Experimentos de química com materiais domésticos: ensino médio. São Paulo. Moderna, 96p. 1997.
LACERDA, P. L., SILVA, A. C. R., CLEOPHAS, M. G. P. “Dominoando a Química”: Elaboração e Aplicação de um Jogo como Recurso Didático para o Ensino de Química”. Atas do IX Encontro Nacional de Pesquisa em Educação em Ciências – IX ENPEC, p.1-8. Águas de Lindóia, SP – 10 a 14 de Novembro de 2013.
MANUAL DO MUNDO. Foguete caseiro de vinagre e bicarbonato de sódio. Disponível em: <https://www.youtube.com/watch?v=5MdUyZwaFfQ>. Acesso em: 05 de Ago. de 2019.
349 REnCiMa, São Paulo, v. 11, n. 6, p. 330-349, out./dez. 2020 PRALON, A. B. A Experimentação com Alternativa Pedagógica no Ensino da
Química. 2009. 63 p. Pós-graduação (3) - Faculdade Integrada de Jacarepaguá, Serra, 2009.
SALESSE, A. M. T. A experimentação no ensino de química: importância das aulas práticas no processo de ensino aprendizagem. Tese (Especialização em Educação: Métodos e Técnicas de Ensino) – Modalidade de Ensino a Distância, da Universidade Tecnológica Federal do Paraná – UTFPR – Câmpus Medianeira. Madianeira, 40p. 2012. SILVA, S. L. A; FERREIRA, G. A. L; SILVA, R. R. À procura da vitamina C. Química Nova na Escola. nº 2, p.31-32, 1995.
Sociedade Brasileira de Química – SBQ. A química perto de você: experimentos de baixo custo para a sala de aula do ensino fundamental e médio. São Paulo:
Sociedade Brasileira de Química, 146p. 2010.
Zanon, D. V; FREITAS, D. de. A aula de ciências nas séries iniciais do ensino
fundamental: ações que favorecem a sua aprendizagem. Ciências & Cognição, vol.10, p. 93- 103, 2007. Disponível em: <http://www.cienciasecognicao.org.>. Acesso em: 02 de Ago. de 2019.
ZOMPERO, A. F.; SOUZA, C.H.B.; GARBIM, T.H.S.; BARICHELLO, D. Conhecimentos de alunos de iniciação científica júnior sobre procedimentos em ciência.Revista de Ensino de Ciências e Matemática.v.10, n.1, p.48-64, 2019.