UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
VLÁDIA CÉLIA MOREIRA BORELLA
Modelo neurodesenvolvimental de esquizofrenia induzida pela administração neonatal de Cetamina em ratos: avaliação da influencia do sexo e efeito
antipsicótico.
VLÁDIA CÉLIA MOREIRA BORELLA
Modelo neurodesenvolvimental de esquizofrenia induzida pela administração neonatal de Cetamina em ratos: avaliação da influencia do sexo e efeito
antipsicótico.
Dissertação submetida à Coordenação do Programa de Pós-Graduação em Farmacologia, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Mestre em Farmacologia.
Orientadora: Dra. Danielle Silveira Macêdo
Modelo neurodesenvolvimental de esquizofrenia induzida pela administração neonatal de Cetamina em ratos: avaliação da influencia do sexo e efeito
antipsicótico.
Dissertação apresentada a Coordenação do Programa de Pós-graduação em Farmacologia como requisito parcial para a obtenção do título de Mestre em Farmacologia.
BANCA EXAMINADORA
______________________________________________________ Profa. Dra. Danielle Silveira Macêdo (Orientadora)
Universidade Federal do Ceará
______________________________________________________ Prof. Dr. André Férrer Carvalho
Universidade Federal do Ceará
______________________________________________________ Prof. Dr. Mohammed Saad Lahlou.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
B726m Borella, Vládia Célia Moreira.
Modelo neurodesenvolvimental de esquizofrenia induzida pela administração neonatal de cetamina em ratos: avaliação da influencia do sexo e efeito antipsicótico/ Vládia Célia Moreira Borella.– 2013.
75 f. : il.
Dissertação (Mestrado) - Universidade Federal do Ceará. Faculdade de Medicina. Programa de Pós-Graduação em Farmacologia, Fortaleza, 2013.
Orientação: Prof. Dra. Danielle Silveira Macêdo.
1. Modelos Animais. 2. Transtornos Mentais. 3. Receptores de N-Metil-D-Aspartato I. Título.
Agradecer, primeiramente, a Deus e às pessoas envolvidas nessa conquista, pois sozinha eu não conseguiria alcançar meus objetivos.
Agradeço, também, as pessoas especiais que entraram em meu caminho durante essa caminhada.
A minha família, que tanto me apoiou mesmo, às vezes, sem entender o que eu estava fazendo durante o mestrado. Meu marido que sempre esteve do meu lado, principalmente, em momentos difíceis. Sempre tão preocupado e me estimulando. Aos meus pais queridos que me apoiaram em todos os momentos da minha vida e me ensinaram valores importantes. A família do meu marido sempre presente em todos os momentos. As minhas tias, tios, primos e amigos que são muitos especiais na minha vida.
A minha orientadora professora Danielle Silveira Macêdo pela a oportunidade, confiança e orientação. Fui muito feliz em aprender e conviver com sua coragem, sabedoria, conhecimento, alegria e conselhos. Aos professores André Ferrer e Dacid Lucena pela disponibilidade, conselhos, auxílios e colaboração com a pesquisa.
As minhas amigas Mariana Macêdo, Thaísa Marjore, Marília Leite e Taciana Rodrigues por me estimularem na vida acadêmica e vivenciaram momentos especiais em minha vida. Sempre me entenderam, mesmo quando não podia estar com elas, pois era preciso estudar
A todos os amigos e colegas do Mestrado que me ajudaram e estiveram sempre presentes. Todos sabem que em todo o momento tiveram um papel muito importante em todas a caminhada acadêmica.
A todos os professores, técnicas e colegas do Laboratório de Neurofarmacologia da
Cetamina em ratos: avaliação da influencia do sexo e efeito antipsicótico. Orientador (a): Profa. Danielle Silveira Macêdo. Dissertação de Mestrado. Programa de Pós-Graduação em Farmacologia. Departamento de Fisiologia e Farmacologia, UFC, 2013.
A esquizofrenia é um transtorno psiquiátrico grave e, talvez, por isso, um dos mais pesquisados. Apesar dos importantes avanços realizados nos estudos sobre a fisiopatologia da doença, durante o século passado, poucos benefícios foram significativos no tratamento pacientes. A elaboração de novos modelos animais de esquizofrenia é uma ferramenta importante para a compreensão da fisiopatologia da doença e para o desenvolvimento de novas terapias, uma vez que até mesmo os antipsicóticos atípicos não mostraram os resultados esperados em relação à melhora dos sintomas negativos e cognitivos. O objetivo desta pesquisa foi investigar os efeitos da cetamina no sistema nervoso central como um possível agente em um modelo neurodesenvolvimental da esquizofrenia. Procurou-se determinar as alterações de comportamento e estresse oxidativo pela administração de cetamina neonatal, bem como a reversão e prevenção destes efeitos pelo tratamento com clozapina, um antipsicótico atípico. Também realizou-se a avaliação do sexo no desenvolvimento da esquizofrenia, dividindo as fêmeas pelo ciclo estral, cujas fases apresentam concentrações altas e baixas de estrogênio, proestro e diestro, respectivamente, visto que estrogênio apresenta um efeito neuroprotetor. O delineamento experimental seguiu os critérios para determinar um modelo animal: a validade de face (onde se procura imitar o comportamento característico da doença no animal), validade do constructo (a fisiopatologia da doença) e validade preditiva (se os medicamentos estabelecidos para a doença são capazes de inverter e prevenir os efeitos que a droga pesquisada induz). Os animais utilizados no protocolo experimental foram ratos Wistar, divididos em seis grupos e tratados com solução salina ou cetamina intraperitoneal (i.p.) durante cinco dias (7º- 11º dias após o nascimento). Grupo 1 (machos tratados com solução salina); Grupo 2 (fêmeas tratadas com solução salina) ; Grupo 3 (machos tratados com cetamina 2,5 mg/kg), Grupo 4 (fêmeas tratadas com cetamina 2,5 mg/kg), grupo 5 (machos tratados com cetamina 5 mg/kg); Grupo 6 (fêmeas tratadas com cetamina 5 mg/kg). Os testes de inibição pré-pulso e y-maze (testes comportamentais) foram realizados na adolescência (35 dias após o nascimento), e repetidos na fase adulta (65 dias após o nascimento). Na fase adulta, as fêmeas foram divididas de acordo com o ciclo menstrual (diestro e de proestro) para observar a interferência do estrogénio. No 66º dia após o nascimento, os animais tratados com cetamina 5 mg/kg foram submetidos ao tratamento de reversão pela administração de clozapina 10 mg/kg (i.p.), uma vez ao dia, durante 10 dias. Após este período, os testes comportamentais e neuroquímicos (dosagem de BDNF e GSH) foram realizados. Os animais tratados com cetamina 2,5 mg/kg não apresentaram qualquer diferença significativa nos testes comportamentais realizados na fase adulta, quando comparados com os animais tratados com solução salina, e, portanto, a dose escolhida para medir os outros parâmetros foi de 5 mg/kg. O tratamento com cetamina 5 mg/kg reduziu significativamente os parâmetros observados nos testes comportamentais, em machos e fêmeas no diestro, na fase adulta. Os machos e as fêmeas no diestro também apresentaram uma redução significativa nos níveis de GSH. Os machos adultos tratados com cetamina 5 mg/kg apresentaram um aumento significativo de BDNF, enquanto que as fêmeas no diestro os apresentaram uma redução neste parâmetro. As fêmeas no proestro alcançaram um melhor desempenho em todos os testes. No protocolo de prevenção, o tratamento com clozapina 10mg/kg reverteu os efeitos da cetamina para os ensaios de inibição pré-pulso e nos testes neuroquímicos, em machos e fêmeas no diestro, tratados com cetamina 5 mg/kg. Os resultados observados nos testes comportamentais e neuroquímicas demonstraram que a cetamina induziu os parâmetros da esquizofrenia, apresentando-se como uma nova ferramenta para a pesquisa de modelos animais esquizofrenia neonatal. O modelo desenvolvido conseguiu, pela primeira vez, mimetizar as diferenças entre as fases do ciclo estral dos animais, simulando o que acontece em humanos.
ketamin in rats: evaluation of the influence of sex and antipsychotic effects.
Schizophrenia is a severe psychiatric disorder, and maybe, because of this, one of the most researched. Despite the important advances achieved in the studies about the physiopathology of the disease during the last century, few benefits were significant in the treatment of these patients. The construction of new animal models of schizophrenia is an important tool for the comprehension of the physiopathology of the disease and the development of new therapies, since even the atypical antipsychotics did not show the expected results regarding the improvement of negative and cognitive symptoms. The objective of this research was to investigate the effects of ketamine in the central nervous system as a possible agent in a neurodevelopmental model of schizophrenia. We sought to determinate the behavioral changes and oxidative stress by the neonatal administration of ketamine, as well as the reversion and prevention of these effects by the treatment with clozapine, an atypical antipsychotic. We also conducted an analysis of the role of sex at the development of schizophrenia, dividing the females by the estrous cycle, that includes phases presenting high and low concentrations of estrogen, proestrus and diestrus, respectively, since estrogen presents a neuroprotective effect. The experimental design followed the criteria to determine an animal model: the face validity (where one seeks to mimic the characteristic behavior of the disease in the animal), construct validity (the physiopathology of the disease) and predictive validity (if the established medicines for the disease are able to reverse and prevent the effects that the researched drug induces). The animals used at the experimental protocol were Wistar rats, divided in six groups and treated with saline or ketamine intraperitoneal (i.p.) for five days (7th-11th day after birth). Group 1: (males treated with saline) Group 2 (females treated with saline); Group 3 (males treated with ketamine 2,5mg/kg); Group 4 (females treated with ketamine 2,5mg/kg); Group 5 (males treated with ketamine 5 mg/kg); Group 6 (females treated with ketamine 5 mg/kg).The tests of prepulse inhibition and y-maze (behavioral tests) were conducted in adolescence (35 days after birth), and repeated at the adult phase (65 days after birth). At the adult phase, the females were divided according with the estrous cycle (diestrus and proestrus) to observe the influence of estrogen. At the 66th day after birth, the animals trated with ketamine 5 mg/kg were submitted to a reversion treatment by clozapine 10 mg/kg i.p. once a day during 10 days. After this period, the behavioral and neurochemical (dosage of BDNF and GSH) tests were performed. The animals treated with ketamine 2,5 mg/kg did not show any significant difference in the behavioral tests conducted in the adult phase when compared with the animals treated with saline and, therefore, the dose selected to measure the other parameters was 5,0 mg/kg. The treatment with ketamine 5 mg/kg significantly reduced the parameters observed at the behavioral tests, both in adult males and females at the diestrus. The males and females at the diestrus also presented a significant reduction in the GSH levels. The adult males treated with ketamine 5 mg/kg presented a significant increase in BDNF, whereas the females at the diestrus presented a reduction in this parameter. The females at the proestrus achieved a better performance in all tests. In the prevention protocol, the treatment with clozapine 10mg/kg reverted the effects of ketamine in the tests of prepulse inhibition and in the neurochemical testes in males and females in the diestrus that were treated with ketamine 5 mg/kg.The results observed in the behavioral and neurochemical tests showed that ketamine induced the parameters of schizophrenia, presenting itself as a new tool available to the research of animal models of neonatal schizophrenia. The developed model succeeded for the first time in mimicking the differences between the phases of the estrous cycle of the animals, in a close approximation of what happens in humans.
ANOVA Análise de Variância
BDNF Fator Neurotrófico derivado do cérebro Ca2+ Cálcio
CED Corpo estriado direito CEE Corpo estriado esquerdo
CEPA Comitê de Ética em Pesquisa Animal CET Cetamina
CLOZ Clozapina
CPF Cortéx Pré-frontal DA Dopamina
dB Decibéis
EPM Erro Padrão da Média GABA Ácido gama-aminobutírico GSH Glutationa Reduzida HC Hipocampo
I.P Intraperitoneal IPP Inibição Pré-Pulso I.L Interleucina KG Quilograma MG Miligrama
NMDA N-metil-D-aspartato NO Óxido Nítrico
NOS Óxido Nítrico Sintase
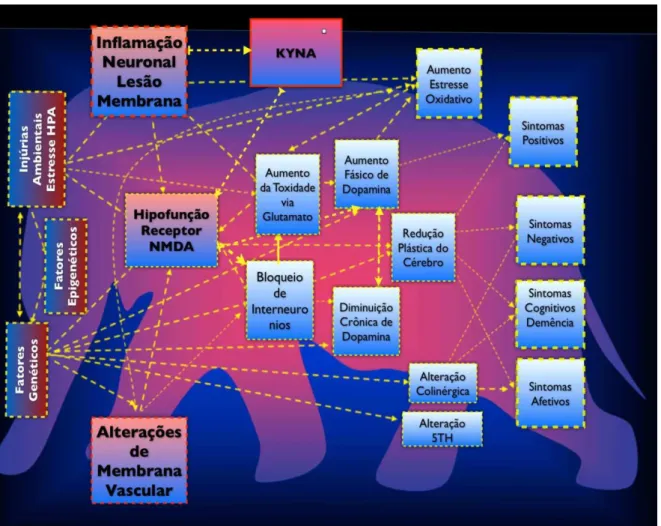
Figura 1: Causalidade ao longo da vida. Os fatores de risco para a esquizofrenia ocorrem tanto no início e no final do ciclo de vida, e interagem uns com os outros de uma forma complexa.
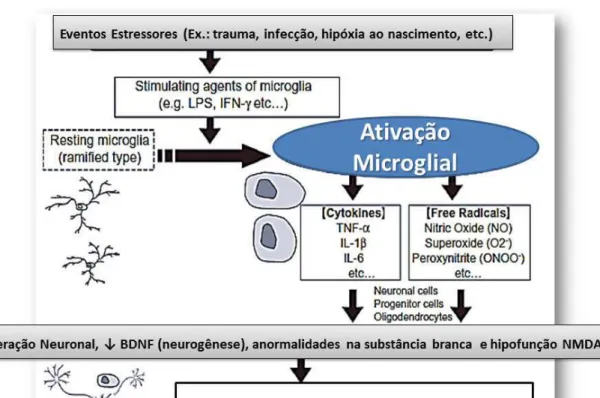
Figura 2. Hipótese inflamatória da esquizofrenia. Ativação da Micróglia e liberação de citocinas pró-inflamatórias e radicais livres. Mediadores que são capazes de causar degeneração neuronal.
Figura 3. Concentração hormonal de acordo com a fase estral.
Figura 4. Concentração hormonal comparando ratos e humanos.
Figura 5. Uma comparação relativa de idades e fases de desenvolvimento humano versus rato.
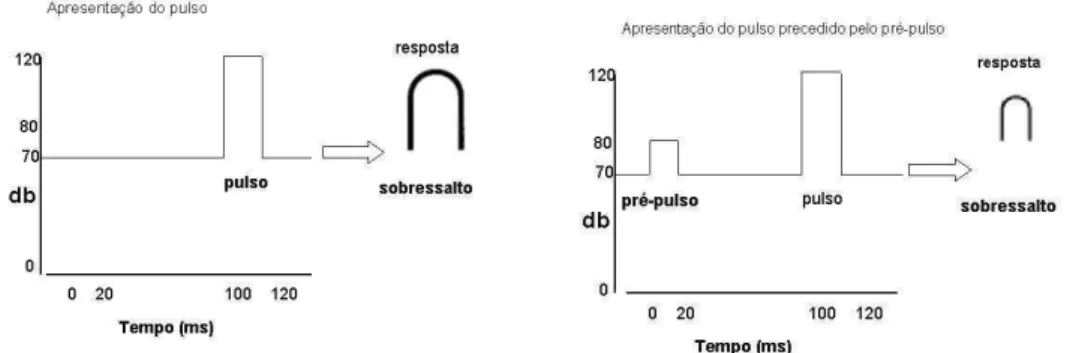
Figura 6. Esquema simplificado do mecanismo de inibição pré-pulso (IPP).
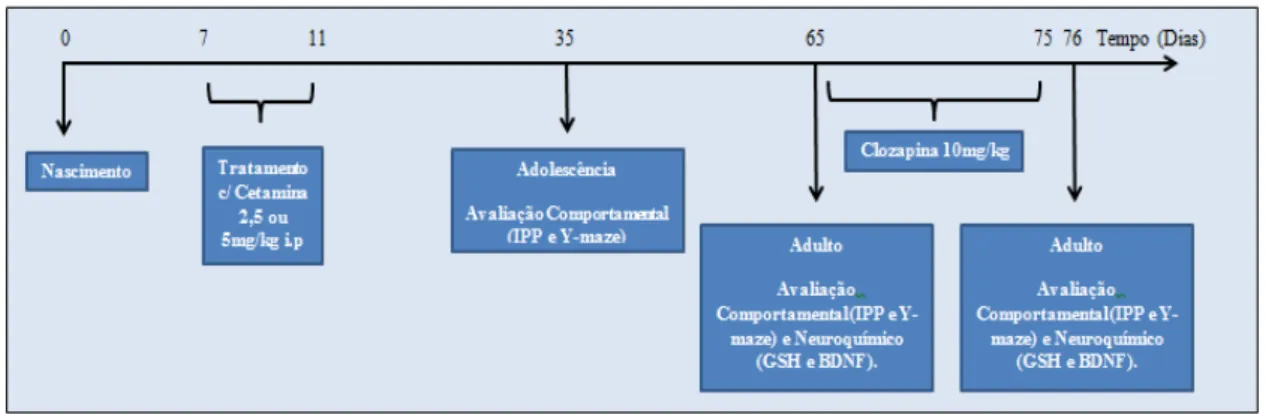
Figura 7. Representação Esquemática do Desenho Experimental.
Figura 8. Curva Dose-Resposta para Cetamina 2,5 e 5,0mg/kg.
Figura 9. Determinação das alterações neuroquímicas induzidas por Cetamina.
Figura 10. Determinação do efeito da Clozapina na reversão das alterações comportamentais e neuroquímicas induzidas por Cetamina.
e fêmeas tratados com cetamina de 2,5mg/kg e 5,0mg/kg no período neonatal (7º a 11º dia de nascidos).
Figura 13: Percentual de Alternâncias corretas nos grupos adolescentes e adultos, machos e fêmeas nas doses de 2,5mg/kg e 5,0mg/kg de Cetamina administradas no período neonatal (7º a 11º dia de nascidos).
Figura 14: Níveis de GSH no CPF e HP nos grupos adultos, machos e fêmeas tratados com 5,0mg/kg de Cetamina no período neonatal (7º a 11º dia de nascidos).
Figura 15: Níveis de BDNF no HP nos grupos adultos, machos e fêmeas na dose de 5,0mg/kg de Cetamina administradas no período neonatal (7º a 11º dia de nascidos). Figura 16: Percentual de Inibição Pré-Pulso nos grupos adultos, machos e fêmeas na dose de 5,0mg/kg de Cetamina administradas no período neonatal (7º a 11º dia de nascidos).
Figura 17: Níveis séricos de estrógenos em fêmeas tratadas na dose de 5,0mg/kg de Cetamina administradas no período neonatal (7º a 11º dia de nascidos).
1. INTRODUÇÃO...15
1.1Esquizofrenia...15
1.2Epidemiologia da Esquizofrenia...16
1.3Etiologia...17
1.4Fisiopatologia...20
1.4.1 Dopamina...20
1.4.2 Glutamato...21
1.4.3 Estresse oxidativo...22
1.4.4 Fatores neurotróficos...25
1.5Modelos Animais de Esquizofrenia...26
1.6Hormônios Sexuais e Esquizofrenia...27
1.7Influência do ciclo menstrual nos sintomas da esquizofrenia...28
1.8Cetamina e Esquizofrenia...30
1.9Tratamento da esquizofrenia...32
1.10 Testes comportamentais da esquizofrenia...33
2. Justificativa...35
3. OBJETIVOS ...36
3.1OBJETIVO GERAL ...36
3.2OBJETIVOS ESPECÍFICOS...36
4. MATERIAIS E MÉTODOS...37
4.1Animais...37
4.2Droga utilizada...37
4.3Determinação da fase do ciclo estral...38
4.4Estratégia experimental...38
4.5Tratamento dos animais e avaliação de parâmetros de um modelo animal de Esquizofrenia...38
4.5.1 Protocolo I – Dose-resposta para avaliar alterações comportamentais induzidas por cetamina...40
alterações comportamentais e neuroquímicas induzidas por Cetamina
...41
4.5.4 Tratamento de reversão...41
4.6Teste de comportamento e neuroquímicos ...43
4.6.1 Teste de inibição pré –pulso...43
4.6.2 Teste de labirinto em Y (Y-maze)...44
4.6.3 Testes neuroquímicos...45
4.7Analise estatística...46
5.0 Resultados...48
5.1 Protocolo I...48
5.1.1 Alterações comportamentais- IPP...48
5.1.2 Alterações comportamentais- Ymaze...50
5.2 Protocolo II...52
5.2.1 Determinação dos níveis de GSH...52
5.2.2 Determinação dos níveis de BDNF...54
5.3 Protocolo III...55
5.4 Níveis de estrógeno...57
6. Discussão...58
7. Conclusão...63
Referências...64
1. INTRODUÇÃO
1.1Esquizofrenia
A esquizofrenia consiste em um transtorno grave das funções mentais, emotivas e
comportamentais que altera processos básicos como percepção e julgamento (MEYER;
FELDON, 2010). Sintomas característicos como delírios e alucinações com duração de
pelo menos seis meses são utilizados como critérios para o diagnóstico deste transtorno
(KAPLAN et al., 2002; BOWIE e & HARVEY, 2006). O surgimento dos primeiros surtos
psicóticos ocorre em geral entre os 16 e 30 anos com variações de acordo com o tipo do
transtorno e o gênero (KAGAN & GALL, 2007). A prevalência estimada da doença é
0,5-1,0% da população mundial e apenas metade dos pacientes é susceptível de obter
tratamento (MEYER; FELDON, 2010). O transtorno é considerado o mais grave dentre os
transtornos mentais (STEFAN et al., 2002). É importante ressaltar que 5 a 10% das pessoas
com esquizofrenia cometem suicídio e que esta doença representa 30% de todas as
hospitalizações (KANDEL, 2000), sendo o transtorno responsável por uma grande parcela
de aposentadorias precoces (LIMA, 2003). Devido o seu inicio precoce sua tendência para
a cronicidade significa que sua prevalência é relativamente significativa (STEFAN et al.,
2002).
Em 1896, o psiquiatra alemão Emil Kraepelin foi quem primeiro descreveu as
condições desse transtorno, em que a denominava de demência precoce. Entretanto, o
termo esquizofrenia foi criado pelo psiquiatra suíço Eugene Bleuler. Depois de ser
denominada esquizofrenia em 1911, o tratamento do transtorno era bastante limitado.
Consistia apenas em hospitalizações em instituições psiquiátricas com práticas terapêuticas
com pouca eficácia. Mas, a partir de 1950 com a descoberta da clorpromazina, sintetizada
por Paul Charpentier, revolucionou o tratamento desse transtorno psiquiátrico (KAPLAN,
2002).
Esse transtorno psiquiátrico é caracterizado por sintomas positivos, negativos e
cognitivos (BOWIE; HARVEY, 2006). Os primeiros episódios de esquizofrenia são
incluem isolamento social, impedimento do desempenho normal das atividades, ideias e
comportamentos estranhos, negligencia na higiene pessoal e afeição áspera. Estes episódios
são algumas vezes separados por longos períodos nos quais o paciente não está
evidentemente psicótico, entretanto, está isolado socialmente e tem um nível reduzido de
ativação emocional (CARPENTER et al., 1994).
Os sintomas negativos refletem a ausência de comportamentos sociais e
interpessoais. As anormalidades do período psicótico são chamadas sintomas positivos
porque refletem a presença de comportamentos anormais como delírios, alucinações
(auditivas geralmente), pensamentos desordenados, incoerentes, perda da associação
normal entre as ideias, perda da expressão emocional. Os sintomas negativos e cognitivos
são crônicos e os mais difíceis de conduzir, visto que os antipsicóticos não conseguem
tratar bem estes sintomas. Existem recaídas frequentes com comportamentos psicóticos e
cada recaída resulta em maior deterioração do paciente. Já as deficiências cognitivas podem
estar presentes antes do início da psicose (período prodrômico) e persistem durante o curso
da doença (KANDEL, 2000).
1.2 Epidemiologia da esquizofrenia
A esquizofrenia é um transtorno que não distingue raça, gênero, classe social e as
taxas de incidência são praticamente iguais em todo o mundo. Seu inicio é mais precoce em
homens entre 16 e 25 anos. Já nas mulheres os sintomas são mais comuns entre 25 e 35
anos e de forma mais branda do que nos homens. E ainda, estudos recentes revelaram que
homens têm maior risco de desenvolver esquizofrenia (MARI & LEITÃO, 2000;
ALEMAN et al, 2003; McGRATH et al., 2004).
A incidência é o número de novos casos de uma doença que ocorre entre as pessoas
que estão em risco de desenvolver a doença durante um período de tempo especificado.
Estudos de meta-análise publicados entre 1965 e 2001 obteve uma taxa média de incidência
de 15,2/100000/ano, com taxas de 80% de intervalo de confiança que vão 8-43 por 100.000
80% da responsabilidade de desenvolver esquizofrenia (McGRATH et al., 2004; TANDON
et al., 2008).
Já a prevalência é dada como a medida da proporção de indivíduos que apresentam
uma determinada doença num período de tempo já determinado. Os estudos realizados nos
últimos anos sugerem prevalência de 0,5-1% na população mundial (MARI & LEITÃO,
2000; SAHA et al., 2005). Com base numa meta-análise de 34 estudos, eles obtiveram uma
média estimativa de prevalência (até 1 ano) de 3,3 por 1000 pessoas com estimativas de
confiança de 80% (SAHA et al., 2005).
Um maior risco para desenvolvimento da esquizofrenia é quando há histórico
familiar, principalmente parentesco de primeiro grau ou mais de um membro da família
afetado (KENDLER, 2000). Alguns estudos afirmam que apenas metade dos pacientes
esquizofrênicos recebe tratamento. Além do problema para os próprios pacientes e
familiares, a esquizofrenia gera um custo importante para a sociedade (DE PÁDUA et al.,
2005).
O sexo é um importante fator preditivo na evolução do transtorno. As mulheres
mostram um melhor prognóstico quando comparadas aos homens em relação à
susceptibilidade a doença e sua progressão (SHEEMAN, 2009).
1.3 Etiologia
Um fator importante que contribui para o desenvolvimento da esquizofrenia é a
predisposição genética. É evidente que não é apenas uma única causa responsável pelo
desenvolvimento da doença. Em alguns casos, observam-se proeminentes anormalidades
anatômicas em pacientes com esquizofrenia (KANDEL, 2000). Estudos genéticos
demostram que a predisposição genética contribui em torno de 50% e os fatores ambientais
são responsáveis pelos 50% restantes. E que, a associação entre esses fatores acarretaria no
desenvolvimento da doença (GARCIA et al.,2004).
Estudos mostram que gêmeos monozigóticos possuem uma concordância maior
para desenvolver esquizofrenia do que os gêmeos dizigóticos. E pesquisas em biologia
esquizofrenia. O fator genético é comprovado por estudos em família, adoção e irmão
gêmeos (TENGAN & MAIA, 2004). Entretanto, mesmo entre gêmeos monozigóticos, que
possuem a mesma carga genética, ainda é provável que um dos irmãos desenvolva a doença
e o outro não (GARCIA et al.,2004).
Além do componente genético da esquizofrenia, que aumenta a vulnerabilidade do
sistema nervoso central, alguns fatores ambientais contribuem para o aparecimento da
doença. Algumas teorias propõe que esse transtorno se origina de anormalidades no
desenvolvimento cerebral devido a exposições ambientais incluindo infecções e
deficiências nutricionais. Foi proposto que esses fatores desempenham um importante papel
na etiologia da esquizofrenia (BROWN et al., 2005). Os fatores genéticos e ambientais
precisam ser considerados em conjunto uma vez que ambos são importantes à etiologia da
esquizofrenia (TSUANG et al., 2004).
Em relação aos fatores ambientais, indivíduos que sofreram complicações
obstétricas tinham mais chances de desenvolver a doença. Visto que, foi constatado que
essas complicações são fatores de risco naqueles indivíduos que tem uma predisposição
genética (GARCIA et al.,2004). Alguns eventos ocorridos durante o período gestacional ou
o parto poderiam levar a algum dano no sistema nervoso central que predisporia ao
desenvolvimento da esquizofrenia. Sobretudo, por meio de insultos hipóxicos ou
isquêmicos. Portanto, acredita-se que os pacientes que se encontram no grupo de risco
(histórico familiar), deveriam ser evitadas complicações obstétricas a fim de diminuir as
chances de desenvolver a esquizofrenia (GARCIA et al.,2004; BRESSAN & FILHO,
2003).
Outro ponto importante é a hipótese neurodesenvolvimental do transtorno. Essa
hipótese propõe a presença de mudanças neurológicas desde o nascimento. Acredita-se que
alterações precoces, ainda no período intrauterino, afetariam diretamente no processo
normal do neurodesenvolvimento. Consequentemente, uma poda neuronal exagerada ou
diminuída (TENGAN & MAIA, 2004). A hipótese das alterações tardias afirma que o
transtorno se inicia na adolescência apenas, durante a poda neuronal nesse mesmo período.
Tanto com alterações precoces e tardias com influencia genéticas interagindo com fatores
ambientais (GARCIA et al.,2004). Além, de observações em cérebros de pacientes
esquizofrênicos que mostraram anormalidades estruturais, como aumento do volume
ventricular, e consequentemente, diminuição do tecido cerebral (LARA et al, 2004).
Os fatores de risco para a esquizofrenia ocorrem tanto no início e no final do ciclo
de vida, e interagem uns com os outros ocasionando os sintomas obervados nos pacientes
esquizofrenicos (Figura 1).
1.4 Fisiopatologia
A fisiopatologia da esquizofrenia não está totalmente esclarecida, entretanto,
existem alterações anatômicas e bioquímicas cerebrais em sua gênese (SWERDLOW et al.,
1997). Muitos estudos demonstraram à existência de desequilíbrios em vários sistemas
neurotransmissores, levando a formação de algumas hipóteses para se explicar a
esquizofrenia.
1.4.1 Dopamina
O sistema dopaminérgico é a hipótese mais antiga estudada na esquizofrenia. A
hipótese de hiperfunção dopaminérgica surgiu para justificar o fato de que os sintomas
positivos (delírios e alucinações) eram desencadeados pela ocupação aumentada dos
receptores D2 pela dopamina (BRESSAN & PILOWSKY 2003). E ainda, os primeiros
antipsicóticos, antagonistas dopaminérgicos, demonstrarem eficácia para tratar os sintomas
positivos da esquizofrenia. Somando ao fato de que surtos psicóticos podem ser induzidos
em indivíduos sadios por fármacos que facilitam ou aumentam a neurotransmissão
dopaminérgica (SEEMAN & KAPUR, 2000). Por exemplo, drogas que aumentam os níveis
da dopamina, tais como L-DOPA, cocaína e anfetaminas podem produzir episódios
psicóticos semelhantes aos da esquizofrenia (GRAFF-GUERRERO et al., 2009).
Seeman et al. (2000) demonstraram que ocorre um aumento do numero de
receptores dopaminérgicos no cérebro de pacientes esquizofrênicos. Principalmente, no
subtipo D4, enquanto que o aumento dos subtipos D2 e D3 foram menos pronunciados.
Portanto, mais uma evidência que relata a hiperatividade dopaminérgica. Os receptores
dopaminérgicos D1 tem ampla distribuição no cérebro e é encontrado em associação com o
receptor D2 na via mesolímbica. O receptor D3 apresenta semelhanças funcionais e
farmacológicas ao receptor D2 e como não é encontrado no corpo estriado pode ser um
possível alvo farmacológico. Os receptores D3 e D4 estão mais localizados em áreas
límbicas, sendo que o D4 apresenta baixa expressão quando comparado aos outros
receptores (JABER et al., 1996). O subtipo D5 tem distribuição, principalmente, em
além de está relacionado com os sintomas negativos da esquizofrenia. Estão envolvidos
nesta patologia o receptor D2, pois representa o principal alvo de ação das drogas
antipsicóticas. O subtipo D2 tem mais afinidade por antipsicóticos típicos, enquanto que o
D3 e D4 tem mais afinidade por antipsicóticos atípicos (GRAFF-GUERRERO et al., 2009).
Dessa forma, o antagonismo de receptores do tipo D2 é um pré-requisito essencial para a
eficácia terapêutica dos antipsicóticos típicos (SEEMAN & KAPUR, 2000).
Os sintomas positivos são atribuídos ao aumento da atividade dopaminérgica no
sistema mesolímbico. A diminuição de liberação de dopamina no córtex frontal, causada
por uma hipofunção glutamatérgica, leva a formação de sintomas negativos (KAHN &
DAVIS, 1995). A neurotransmissão dopaminérgica e glutamatérgica pode contribuir de
forma significativa para a compreensão da esquizofrenia.
1.4.2 Glutamato
O sistema glutamatérgico tem papel importante na fisiopatologia da esquizofrenia.
Uma forte evidência do envolvimento desse neurotransmissor na esquizofrenia se deve ao
fato de que foram encontrados níveis diminuídos de glutamato no líquor de portadores de
esquizofrenia. Ainda podemos destacar que a fenciclidina e a cetamina, antagonistas do
receptor NMDA, induzem um quadro clínico semelhante à esquizofrenia com sintomas
positivos, negativos e cognitivos, ao contrário da anfetamina, que só gera sintomas
positivos, em animais e humanos saudáveis (PARK & HOLZMAN, 1992; KRYSTAL et
al., 1999).
O sistema glutamatérgico atua controlando a liberação cortical de monoaminas. E
isso pode ocorrer devido a um estímulo excitatório através de neurônios glutamatérgicos ou
através de neurônios GABAérgicos inibindo a liberação dessas monoaminas (CARLSSON
et al., 2001). O sistema glutamatérgico envolve uma série de receptores que são ativados
pelo glutamato, entre eles, o receptor N-metil-D-aspartato (NMDA), receptor tipo AMPA e
Kainato (BRESSAN & PILOWSKY, 2003). Quando ocorre uma desregulação do sistema
glutamatérgico pode levar a um aumento ou diminuição de monoaminas em determinadas
esquizofrenia pode ser explicada por duas teorias. A teoria da hipofunção glutamatérgica e
da hiperfunção glutamatérgica.
A teoria da hipofunção glutamatérgica sugere que uma deficiência do receptor
glutamatérgico provoque um estímulo no sistema dopaminérgico em áreas fronto-corticais.
Ou seja, a hiperatividade dopaminérgica mesolímbica, que produz sintomas positivos, pode
ser realmente em decorrência da hipoativação do receptor NMDA. Visto que, o glutamato
regula a liberação de dopamina através de neurônios GABAérgicos (KIM et al, 1980;
CARLSSON & SVENSSON, 1990).
O excesso de glutamato também tem um papel importante na esquizofrenia.
Sugere-se que haja uma hiperfunção do receptor NMDA no córtex temporal. Contribuindo assim,
com a hiperatividade de neurônios glutamatérgicos em diferentes regiões cerebrais. Essa
tentativa de compensação do sistema glutamatérgico no córtex pré-frontal deve-se a maior
ativação de receptores AMPA (ácido α-amino-3-hidroxi-5-metil-4-isoxazolepropionico). E
ainda, uma maior liberação de neurotransmissores como a dopamina. Levando assim, a
alguns sintomas característicos da esquizofrenia (DEAKIN & SIMPSON, 1997; SIMPSON
et al., 1998).
1.4.3 Estresse oxidativo
Sabe-se que o estresse oxidativo tem papel importante na fisiopatologia da
esquizofrenia (CHITTIPROL S. et al, 2009). Foi observado que pacientes esquizofrênicos
apresentavam problemas com suas defesas antioxidantes e aumento da peroxidação
lipídica. Isto inclui pacientes ainda não tratados, bem como os pacientes em tratamento e no
primeiro episódio psicótico (McCREADIE et al, 1995; MAHALDIK et al
1998). A fim de examinar a peroxidação lipídica em pacientes com esquizofrenia, a
avaliação de substâncias reativas ao ácido tiobarbitúrico (TBARS) é, provavelmente, o
método mais utilizado para a avaliação da peroxidação lipídica (ESTERBAUER H, 1993).
Os antioxidantes, produzidos endogenamente, controlam os radicais livres
produzidos pelas reações celulares, a exemplo da Glutationa reduzida (GSH)
(GAWRYLUK et al., 2010). Estudos pré-clínicos mostraram que o N-acetilcisteína,
precursor do GSH, pode diminuir danos na cognição quando está associado a exposições
neonatais a infecções bacterianas e citocinas pró-inflamatórias (LANTE et al., 2007).
O óxido nítrico (NO) é um gás que é gerado pela a enzima óxido nítrico sintase.
Existem três isoformasda enzima: NOS neuronal (nNOS), NOS induzível (iNOS) e NOS
endotelial (eNOS) (MAYER & HEMMENS, 1997, GIRALDI-GUIMARÃES et al., 2004).
Muitos autores discutem o papel do NO na esquizofrenia. SHINKAI et al., 2002,
concluíram que o polimorfismo do gene da nNOS pode resultar num aumento da
susceptibilidade à esquizofrenia. No entanto, esse resultado tem sido questionado por
outros autores (LIOU et al., 2003), que não conseguiram encontrar uma associação no
polimorfismo do gene da nNOS e a esquizofrenia.
A principal ativação para a produção de NO é através do glutamato agindo em
receptores NMDA. NOS está fisicamente ligada ao receptor NMDA através da proteína
PSD-95 (ESPLUGUES, 2002). A ativação desse receptor leva a um influxo de cálcio
tóxico que ativam várias enzimas, incluindo a NOS. Portanto os antagonistas NMDA, ao
bloquearem o receptor promovem a diminuição dos níveis de NO. O óxido nítrico é capaz
de aumentar ainda mais a excitotoxicidade pelo fato de melhorar a liberação de glutamato a
partir de neurônios pré-sinápticos e inibir os transportadores de glutamato glial
(LEVKOVITZ et al., 2007). Estudos tanto in vivo como in vitro sugerem que o NO
endógeno inibe os transportadores de monoaminas. A administração in vivo de doadores de
NO aumenta o nível extracelular de dopamina nos neurônios do estriado (WEST;
GALLOWAY; GRACE, 2002).
O processo inflamatório pode aumentar o estresse oxidativo. Evidências
apontam para a esquizofrenia como uma doença inflamatória e (MACÊDO et al., 2010). De
fato, diversas anormalidades imunológicas, incluindo a expressão de genes relacionados à
inflamação estão associadas a pacientes esquizofrênicos (SAETRE et al., 2007), como
alterações no numero total de células T e T-auxiliares (MULLER et al., 1997) e
concentrações anormais de citocinas e de receptores para citocinas no sangue e líquido
interleucina 1 (IL-1) é uma citocina pró-inflamatória que influencia em processos de
neurodegeneração e neuroproteção no cérebro (ROTHWELL & LUHESHI, 2000), ela está
aumentada em pacientes com esquizofrenia. (WATANABE; SOMEYA; NAWA, 2010),
assim como o fator de necrose tumoral (TNF-α), outra citocina pró-inflamatória (NAUDIN
et al., 1997).
As caspases são proteases, conhecidas por estarem envolvidas na apoptose.
Foram descobertos mais de 14 tipos de caspases no tecido nervoso dos mamíferos, elas
podem agir como iniciadoras da apoptose, executoras da apoptose ou como mediadores
inflamatórios, dependendo do tipo de caspase (WALDMEIER & TATTON, 2004). A
regulação alterada da cascata apoptótica pode reduzir potencialmente a viabilidade neuronal
e glial de vários estágios do desenvolvimento e contribuir para o déficit volumétrico e
funcional do cérebro, que são características observadas na esquizofrenia (BERGER,
WOOD & MCGORRY, 2003).
Micróglia são células apresentadoras de antígenos no cérebro. Quando ativadas por
danos como inflamação ou doença, estas células imunes podem migrar para os locais da
lesão (STREIT; MRAK; GRIFFIN, 2004). A ativação da microglia e a geração dos seus
produtos neurotóxicos são características comuns de distúrbios neurodegenerativos, como
ilustrado na figura 2 (GEHRMANN; MATSUMOTO; KREUTZBERG, 1995; MONJI et
al., 2009). Dois estudos evidenciaram a ativação da micróglia em cérebros post-mortem de
pacientes com esquizofrenia, especialmente na região temporal (BAYER et al., 1999;
Figura 2. Hipótese inflamatória da esquizofrenia. Ativação da Micróglia e liberação de citocinas pró-inflamatórias e radicais livres. Mediadores que são capazes de causar degeneração neuronal (MONJI et al., 2009).
1.4.4 Fatores Neurotróficos
O Fator Neurotrófico Derivado do Cérebro (BDNF) é uma neurotrofina
distribuída no SNC, principalmente no córtex pré-frontal e hipocampo (PEZAMAS et al.,
2004). O BDNF tem seus efeitos mediados pela a interação do seu receptor tirosina-quinase
B (Trk B) (DUMAN, 2002). E, tem influencia diretamente na eficácia sináptica, modulação
do sistema dopaminérgico, respostas a danos cerebrais, conectividade e plasticidade
Diminuições dos níveis de BDNF foram relatadas na esquizofrenia. Essa
diminuição tem sido relacionada com o primeiro surto psicótico. Provavelmente, mostrando
a relação do BDNF e a patogênese do transtorno (JINDAL et al., 2010; GREEN et al.,
2011). Entretanto, outros estudos apontam que o aumento da expressão de BDNF acarreta
em deficiência de aprendizado e prejuízo na memória de curto prazo (CUNHA et al.,
2009). Portanto, sugerem que aumento nos níveis de BDNF poderia refletir num efeito
neurotóxico. Provavelmente, por excitação neuronal excessiva (RANGE et al., 2004).
Portanto, o seu papel na patogénese da esquizofrenia ainda permanece obscura.
1.5 Modelos animais de Esquizofrenia
O conceito de modelo animal é qualquer preparação experimental desenvolvida,
suficientemente similar a quaisquer aspectos de determinada doença (GEYER et al., 2001).
O uso de modelos animais de doenças humanas é imprescindível como ferramenta na
pesquisa experimental.
Como descrito anteriormente à esquizofrenia tem etiologia múltipla, envolvendo
fatores ambientais e genéticos (a chamada interação gene-ambiente) produzindo uma
complexa disfunção nervosa. E, por tanto, muito difícil de ser induzidas em animais
(SALGADO et al., 2005). O desenvolvimento de modelos animais mostra-se importante
para elucidação das suas bases biológicas e para investigação de alvos terapêuticos na fase
pré-clinica (LIPSKA e WEINBERGER, 2000).
Para o modelo animal ser válido, inclusive para transtornos psiquiátricos, devem
atender a três características principais: validade de face (mimetizar os sintomas da doença
determinada), validade de constructo (habilidade do modelo em reproduzir alguns aspectos
fisiopatológicos da doença) e validade preditiva (a avaliação se os medicamentos clássicos
utilizados para tratar a patologia têm o potencial de prevenir e/ou reverter às alterações
comportamentais e neuroquímicas induzidas no animal) (ELLENBROEK e COOLS, 1990;
NESTLER e HYMAN, 2010).
Embora seja notória a dificuldade de se estudar a esquizofrenia através de modelo
contemplar todos os níveis de validade (MACEDO et al., 2012). No quadro 1, estão os
principais modelos existentes.
Quadro 1. Principais modelos de Esquizofrenia em roedores
Modelo Exemplos Comentários Referências
Vantagens Desvantagens
Modelo
neurodesenvolvimetal
Desafio pré-natal
Imunológica em ratos: vírus da gripe humana.
Simula o
curso da
doença em humanos.
Risco biológico.
(Fatemi et al., 2008; Winter et al., 2008)
Modelos induzidos
por drogas
Antagonista do Receptor
NMDA
(MK801, PCP, Ketamine).
Fácil acesso
a essas
drogas.
Não simula o curso da em humanos.
(Manahan-Vaughan, 2008)
Modelos com
preparações genéticas
Nocaute p/
Receptor canabinóide
Simula sintomas da doença nos animais
Dificil acesso
a esses
animais. (Haller, 2005)
Modelos com Lesão Lesão
Hipocampal
ventral em
Neonatos.
Simula sintomas da doença nos animais.
Não é
observado
lesão nos
pacientes com o transtorno.
( Tseng et al., 2008; Endo et al., 2007)
1.6 Hormônios Sexuais e Esquizofrenia
Os estrogênios são um grupo de hormônios esteroides sexuais encontrados
homens. Além do seu controle de funções reprodutivas, os estrógenos exercem diversos
efeitos no cérebro (GRUBER et al., 2002).
A possibilidade da interferência do estrógeno na esquizofrenia surgiu, inicialmente,
motivada por diferenças observadas por diferenças entre o sexo, incidência e curso da
doença (RIECHER-ROSSLER E HAFNER, 2000). Agora, sabe-se, consistentemente, que
os homens são mais propensos a desenvolver esquizofrenia do que as mulheres, com taxa
de risco de incidência de 1,4 (ALEMAN et al., 2003; McGRATH et al., 2004). E ainda, o
início do transtorno é mais comum em homens jovens do que em mulheres, no qual, o pico
de incidência é após 50 anos de idade (RIECHER-ROSSLER E HAFNER, 2000;
HAFNER, 2003). Também tem sido observado que no período de pré-menopausa as
mulheres experimentam uma evolução mais favorável, com menos sintomas negativos e
mostram melhor resposta ao tratamento do que os homens (MORGAN et al., 2008;
COTTON et al, 2009). Estas evidências sugerem informações convincentes que os
estrogênios têm um papel protetor na fisiopatologia da esquizofrenia (GRIGORIADIS e
SEEMAN, 2002, MARKHAM, 2012; KULKARNI et al., 2012).
1.7 Ciclo menstrual/estral
Sabendo da influência dos estrógenos na esquizofrenia se faz importante, ao validar
um modelo experimental deste transtorno, fazer a determinação da fase do ciclo nas fêmeas
para saber a real influência desses hormônios no modelo. Apesar desta evidência até o
presente momento esta abordagem não foi tentada em um modelo animal de (SEEMAN,
2012). esquizofrenia.
Em ratas o equivalente ao ciclo menstrual de mulheres é o ciclo estral. Este ciclo
dura em média de quatro a cinco dias. O ciclo é dividido em quatro fases: diestro-2 ou
diestro, proestro, estro e diestro-1 ou metaestro. Essas fases podem ser identificadas por
esfregaço vaginal (MARCONDES et al., 2002). A fase do proestro dura de 12 a 14 horas.
Posteriormente, precede a fase de estro que dura de 25 a 27 horas (período que a fêmea é
receptiva aos machos). Caso não haja a concepção, após o estro há um perído denominado
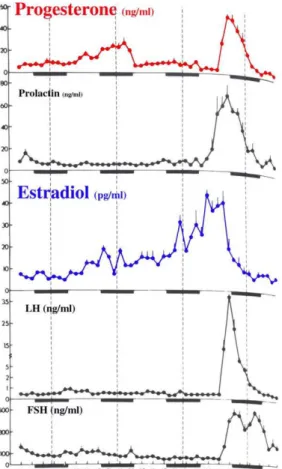
O estradiol começa a aumentar no diestro-2 e alcançam níveis extremos durante o
proestro. Retorna aos níveis mais baixos na fase do estro para diestro-1. A secreção de
progesterona aumenta durante o diestro-1 e 2, mas chega ao seu maior pico no fim do
proestro assim como a prolactina (MARCONDES et al., 2002 ), observado na figura 3 e 4.
Figura 3. Concentração hormonal de acordo com a fase estral.
Fonte:http://www.google.com.br/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0
CD4QFjAC&url=http%3A%2F%2Fwww.cristina.prof.ufsc.br%2Fv2%2Fendocrino%2Frat
o_gona
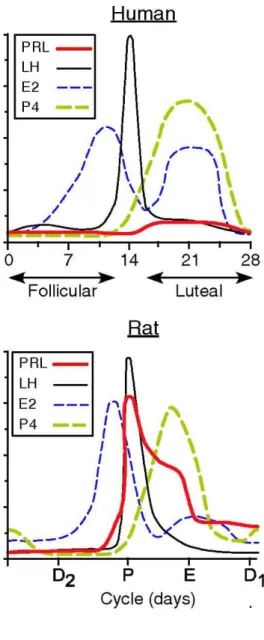
Figura 4. Concentração hormonal comparando ratos e humanos.
1.8 Cetamina e Esquizofrenia
O cloridrato de cetamina é uma droga dissociativa utilizada na clinica com a
finalidade de induzir um estado de anestesia, com efeito hipnótico e características
analgésicas (VASCONCELOS et al., 2005). A cetamina age afetando a atividade
receptor é encontrado em áreas cerebrais importantes para os processos de memória e
cognição em humanos como o hipocampo e córtex cerebral (MORGAN et al., 2004).
Devido ao bloqueio do influxo de Ca2+, os antagonistas do receptor NMDA também
promovem uma diminuição dos níveis de óxido nítrico neuronal (BERBSTEIN et al, 2003).
Este fármaco foi sintetizado pela primeira vez em 1962 por Calvin Stevens, sendo derivado
do cloridrato de fenciclidina (MICALLEF et al., 2003). A cetamina pode provocar perda
sensorial, analgesia e amnésia sem perda real da consciência (MORGAN et al., 2004). E,
ainda, pode provocar delírios (BARASH et al., 1991).
A Cetamina apresenta, também, afinidade pelo receptor D2. Um recente estudo
afirma que a sua administração pode levar a alterações em neurotransmissões
dopaminérgicas, glutamatérgicas e serotoninérgica. Produz, também, aumento do receptor
D2 no hipocampo, aumento do transportador da dopamina no estriado, redução do receptor
glutamatérgico no córtex frontal, e aumento do transportador da serotonina no estriado,
hipocampo e córtex frontal (BECKER et al, 2003).
Correlacionando a hipótese glutamatérgica da esquizofrenia e o bloqueio do
receptor NMDA aos sintomas psicóticos da esquizofrenia, a hipofunção desse receptor por
si só pode ser um possível mecanismo para explicar a esquizofrenia (OLNEY et al., 1995).
A fenciclidina e a cetamina exacerbam os sintomas psicóticos em pacientes esquizofrênicos
e induzem sintomas positivos e negativos em indivíduos saudáveis (ADLER et al., 1999).
Dentre os antagonistas dos receptores NMDA, a cetamina tem recebido atenção numa série
de trabalhos na literatura científica, apresentando validade de face, constructo e preditiva
(MIYAMOTO et al., 2001; BECKER et al., 2003; DUNCAN et al., 2000).
Sabemos que a exposição pré-natal a alguns estímulos nocivos afetam diretamente o
processo normal do neurodesenvolvimento. O período do 7º ao 11º dias de nascimento do
rato, que corresponde ao desenvolvimento cerebral do humano ainda muito jovem. Baseado
no fato de que nesse período algumas conexões importantes estão ocorrendo, neste caso, no
referido período existe uma maior susceptibilidade aos agentes nocivos. Por isso, no
de nascidos correspondem, respectivamente, em humanos a fase periadolescentes e início
da idade adulta (Figura 5). Pois, é sabido que o primeiro surto psicótico em pacientes com o
transtorno inicia no final da adolescência ou inicio da idade adulta (ANDERSEN, 2003).
Ratos expostos a antagonistas do receptor NMDA (Fenciclidina, MK-801) no período
neonatal desenvolveram anormalidades comportamentais quando adultos, como aumento
na atividade locomotora e déficit no filtro sensório motor (UEHARA et al, 2010). Como a
cetamina, antagonista do receptor NMDA, é uma droga de fácil acesso e mais estudada foi
escolhida para validar o modelo.
Figura 5. Uma comparação relativa de idades e fases de desenvolvimento humano
versus rato (ANDERSEN, 2003).
1.9 Tratamentos da Esquizofrenia
Em 1964, a primeira droga a ser utilizada na prática clínica da esquizofrenia foi o
antipsicótico típico clorpromazina por apresentar efeitos nos sintomas psicóticos da
esquizofrenia. Os antipsicóticos típicos, os quais incluem fenotiazinas (iniciado com a
clorpromazina), as butirofenonas (haloperidol), e as tioxantinas, são efetivos na redução dos
sintomas positivos (delírios e alucinações) em uma grande proporção de pacientes.
Entretanto, esses medicamentos têm efeitos mínimos no tratamento dos sintomas negativos
e cognitivos, além de causarem uma série de efeitos colaterais sobre o sistema
extrapiramidal como o Parkinsonismo medicamentoso e a discinesia tardia (NASRALLAH;
O primeiro antipsicótico atípico, a Clozapina, foi introduzida na prática clínica na
década de 60. Esse fármaco não causa os efeitos extrapiramidais causados pelos
antipsicóticos típicos. Mas, pode apresentar outros efeitos adversos como agranulocitose
(CRILLY, 2007). No entanto, atualmente na clínica, a clozapina retornou para o tratamento
dos pacientes em doses menores e com monitoramento sanguíneo.
Devido aos efeitos adversos dos antipsicóticos típicos foram elaborados os
antipsicóticos atípicos. Estes apresentam mais eficácia no tratamento de pacientes
refratários e na diminuição do comportamento suicida, bem como para não ter efeitos
motores secundários a curto e longo prazo levou a otimismo de que melhores tratamentos
antipsicóticos para a esquizofrenia fossem possíveis. Assim, foram desenvolvidos mais
medicamentos da classe dos atípicos, como risperidona, olanzapina, quetiapina, ziprazidona
e amisulpride (TANDON; NASRALLAH; KESHAVAN 2010).
1.10 Testes Comportamentais para o Estudo da Esquizofrenia
Um dos modelos comportamentais mais utilizados para a avaliação dos
sintomas da esquizofrenia, reconhecidamente um endofenótipo para a esquizofrenia, é o
modelo da Inibição Pré-pulso (IPP) do sobressalto, que oferece uma medida operacional do
filtro sensório-motor refletido pela capacidade de inibição de um reflexo de sobressalto,
quando um estímulo sensorial é precedido por outro de menor intensidade (HOFFMAN;
ISON, 1980). A habilidade de discriminar estímulos externos de relevância fisiológica ou
cognitiva, fornecida pelo filtro sensório-motor, está comprometida em indivíduos com
determinadas desordens psiquiátricas (SALUM et al., 2008).
A IPP é uma forma de plasticidade do reflexo do sobressalto, caracterizada por
uma redução normal no sobressalto em resposta a um estímulo auditivo intenso (pulso),
quando este é precedido imediatamente (30-500 ms) por um estímulo mais fraco
Figura 6. Esquema simplificado do mecanismo de inibição pré-pulso (IPP). Modificados de SALUM et al., 2008.
Em resposta ao estímulo fraco a ativação de processos cerebrais é aumentada, o que impede
a responsividade a eventos sensoriais posteriores durante uma rápida janela temporal. Este
período protege a informação contida no estímulo inicial, para que seja adequadamente
processado, durante o qual, somente estímulos suficientemente grandes serão capazes de
ultrapassar este filtro protetor (SALUM et al, 2008).
A inibição pré-pulso ocorre naturalmente em humanos e na maioria dos animais
experimentais, mas é diminuída ou ausente em esquizofrênicos (MANSBACH; GEYER;
BRAFF, 1988). Assim, a IPP tem sido sugerida como um útil endofenótipo em potencial
para a esquizofrenia.
Na esquizofrenia, a disfunção cognitiva não é global e generalizada e sim
específica e seletiva, incluindo problemas de atenção e percepção, resolução de problemas,
memória de curto e longo prazo e em particular a memória de trabalho (BEGOU et al,
2008). O teste comportamental do Y-maze é um teste para medir a memória de trabalho
espacial (memória de curto prazo). É baseado na tendência inata de roedores de explorar
Justificativa
No Brasil a esquizofrenia é responsável por 15% das primeiras consultas nos
ambulatórios psiquiátricos e, também, pela ocupação de 30% dos leitos hospitalares e de
instituições psiquiátricas. Isso acarreta gastos financeiros calculados em bilhões de dólares
por ano, além de produzir incapacidades, impedindo estes indivíduos de contribuírem
plenamente com a sociedade.
Portanto, o desenvolvimento de modelos animais de esquizofrenia é importante para
esclarecer a fisiopatologia dese transtorno e facilitar o desenvolvimento de novas terapias.
Visto que, um dos grandes problemas na clínica é melhorar os sintomas negativos e
cognitivos do transtorno, pois mesmos os antipsicóticos atípicos na clínica não tiveram o
resultado esperado.
Dentre todas as hipoteses da esquizofrenia, a neurodesenvolvimental é a mais aceita
atualmente. E, produzir um modelo neurodesenvolvimental possui vantagens sobre outros
modelos, pois além de simular o curso do transtorno, permite o estudo do efeito de
fármacos na adolescência (pródromo) com possível ação preventiva contra o primeiro
período psicótico, bem como o estudo de fármacos na idade adulta, possibilitando neste
contexto o tratamento farmacológico da esquizofrenia. É importante mencionar que como
os transtornos mentais são tipicamente humanos, envolvendo comportamentos complexos,
é praticamente impossível reproduzir todos estes em roedores, portanto existem limitações
em todos os modelos animais, especialmente no caso da psiquiatria, mas os modelos
animais neurodesenvolvimentais, no caso da esquizofrenia, são os que mais se assemelham
atualmente ao transtorno propriamente dito.
Considerando que a esquizofrenia é um transtorno que ainda não tem sua origem
bem delimitada, e que existe uma complexidade enorme quando se fala em modelo animal
para tal transtorno, viemos com essa pesquisa propor um modelo animal para a
esquizofrenia utilizando a cetamina em doses sub-anestésicas em neonatos machos e
fêmeas (no 7º ao 11º dias de nascidos) visando mimetizar os comportamentos do transtorno
no animal escolhido para ser o modelo na adolescência e na fase adulta, sugerindo assim,
3. OBJETIVOS
Objetivo Geral
Investigar os efeitos da administração neonatal de cetamina em animais de ambos os
gêneros como possível modelo neurodesenvolvimental de esquizofrenia através da
avaliação de critérios de face, constructo e preditivo.
Objetivos Específicos
- Critérios para validade de face (sintomatologia):
• Realizar estudos dose-resposta para a determinação da dose ideal de cetamina para
validação do modelo animal neurodesenvolvimental no teste de Inibição pré-pulso e
Y-maze em animais adolescentes e adultos de ambos os gêneros;
- Critérios para validade de constructo (bases biológicas):
• Determinar, em animais adultos, as alterações em marcadores de estresse oxidativo
(Glutationa Reduzida (GSH)) e do Fator Neurotrófico Derivado do Cérebro (BDNF)
no córtex pré-frontal e hipocampo;
- Critérios para validade preditiva (tratamento):
• Avaliar o efeito antipsicótico da clozapina em animais adultos de ambos os gêneros
submetidos ao modelo animal neonatal de esquizofrenia induzida pela
4. MATERIAIS E MÉTODOS
4.1. Animais
Foram utilizados ratos Wistar machos e fêmeas com sete dias após o nascimento,
provenientes do Biotério Central da Universidade Federal do Ceará (UFC), ambientados
com a mãe até 21 dias de nascidos época em que foi realizado o desmame. Esses animais
foram separados pelo sexo e ambientados em grupos de 6 animais em caixas de propileno
26 ± 2 ºC, a um ciclo claro/escuro de 12 h, recebendo ração padrão e água “ad libitum”. Os
experimentos foram conduzidos de acordo com o Guia de Cuidados e Usos de Animais de
Laboratório do Departamento de Saúde e Serviços Humanos dos Estados Unidos da
América (OLFERT et al, 1993), salientando que todos os esforços foram feitos para
minimizar o sofrimento dos animais. A presente pesquisa foi aprovada pelo Comitê de
Ética e Pesquisa Animal (CEPA) da UFC, com protocolo nº 91/2011.
4.2. Droga utilizada
Cetamina (CET; Vetanarcol®, do Brasil), e Clozapina (LEPONEX®, do Brasil)
foram os fármacos utilizados. Para a Cetamina inicialmente foi realizada uma curva
dose-resposta para a determinação da dose de CET capaz de induzir diminuição da Inibição
pré-pulso e déficit da memoria de trabalho através do teste Y-maze, nas seguintes
concentrações: 2,5 e 5,0mg/kg. Como os resultados na dose mais baixa não foram
significativos a dose 5,0mg/kg foi a dose escolhida para avaliar os outros parâmetros do
estresse oxidativo, do BDNF e reversão pela clozapina. As soluções foram preparadas
diariamente e administradas por via intraperitoneal (1ml/ 100 g de peso corporal) uma vez
ao dia.
A dose de clozapina foi de 10mg/kg sendo preparada diariamente e administrada
por via intraperitoneal uma vez ao dia por 10 dias.
4.3 Determinação da Fase do Ciclo estral
A fase do ciclo estral foi determinada por esfregaço vaginal a fresco (com solução
Os níveis de 17β-estradiol foram determinados com o analisador ADVIA Centaur
(Bayer Diagnostics, Tarrytown, NY, EUA), utilizando um método de quimiolaminescência,
de acordo com as instruções dos fabricantes. Os níveis são expressos apresentados com
ng/ml.
4.4. Estratégia experimental
As metodologias seguidas na pesquisa basearam-se na sequência dos critérios para
validação de um modelo animal de esquizofrenia, os quais são denominados de face,
constructo e preditivo. O protocolo inicial buscou determinar a validade de face, através da
observação de qual dose administrada em ratos mimetizaria o comportamento característico
e já estabelecido na pesquisa em que o animal com esquizofrenia apresentam diminuição da
Inibição pré-pulso e déficit na memória de trabalho através do teste Y-maze e após isto a
escolhida a melhor dose para avaliação quanto à validade preditiva e de constructo.
Com a dose escolhida, foram avaliados parâmetros relacionados à fisiopatologia da
esquizofrenia como estresse oxidativo (GSH), Fator Neurotrófico Derivado do Cérebro
(BDNF), sendo estes os parâmetros que valem como critério para validação de constructo.
Quanto a validade preditiva buscou-se avaliar o potencial terapêutico do fármaco
padrão utilizado para a esquizofrenia, a Clozapina, nas doses 10 mg/kg do fármaco em
animais tratados com a dose de 5mg/kg de Cetamina.
4.5. Tratamento dos animais e protocolo para avaliação de parâmetros de um modelo
animal de esquizofrenia.
Inicialmente, os animais foram tratados com Cetamina do sétimo ao décimo
primeiro dia de nascido (5dias). Grupo 01 (tratamento em machos com Salina por via
intraperitoneal); Grupo 02 (tratamento em fêmeas com Salina por via intraperitoneal);
Grupo 03 (machos tratados com Cetamina 2,5mg/kg via intraperitoneal); Grupo 04 (fêmeas
tratadas com Cetamina 2,5mg/kg via intraperitoneal); Grupo 05 ( machos tratados com
via intraperitoneal). Na adolescência (35 dias) foram feitos testes de Inibição pré-pulso e
Y-maze.
Na idade adulta (65 dias), foram repetidos os testes de IPP e Y-maze em machos e
fêmeas. Para isso, as fêmeas adultas foram separadas por sua fase do ciclo estral (Diestro e
Proestro) para observar a interferência do estrógeno. Nos testes comportamentais, na idade
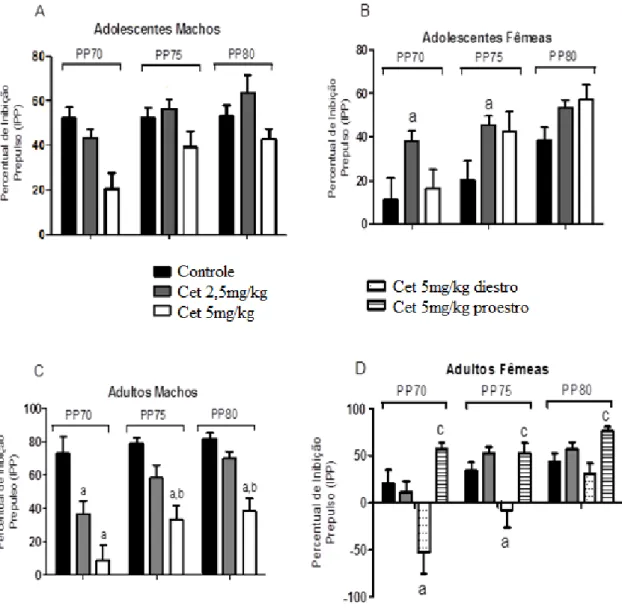
adulta, a dose 2,5mg/kg não conseguiu ter diferença significativa nos resultados e, por isso,
a dose escolhida para prosseguir com os outros parâmetros como estresse oxidativo, BDNF
e reversão pela clozapina foi a dose de 5,0mg/kg tanto em machos e fêmeas adultos. A dose
escolhida foi 5,0mg/kg tanto em machos e fêmeas para avaliar os outros parâmetros do
estresse oxidativo, do BDNF e reversão pela clozapina nos animais adultos.
Com 66 dias de nascidos, os animais machos e fêmeas (Tratados com Cetamina no
período pré-natal na dose de 5mg/kg) foram submetidos ao tratamento de reversão pela
Clozapina na dose de 10mg/kg via intraperitoneal uma vez ao dia. Após o tratamento de 10
dias (76 dias de nascidos), foram realizados os testes comportamentais (IPP e Y-maze) e os
neuroquímicos (GSH e BDNF). Esquematizado no quadro 2 e na figura 6.
Figura 7. Representação Esquemática do Desenho Experimental.
4.5.1. Protocolo I - Dose-resposta para avaliar alterações comportamentais induzidas por Cetamina.
Um estudo de dose-resposta foi realizado para determinar a alteração na Inibição
pré-pulso e Y-maze em ratos. Para este efeito, diferentes grupos de animais foram
administrados por via intraperitoneal durante 5 dias de Cetamina a partir do sétimo dia de
nascido (2,5 e 5,0mg / kg em machos e fêmeas).
Os experimentos foram realizados na fase de adolescência e na fase adulta para a
determinação da melhor dose de Cetamina. Estes testes estão descritos na sessão 4.6.1. e
4.6.2.
4.5.2. Protocolo II – Determinação das alterações neuroquímicas induzidas por
Cetamina
Os animais tratados com Cetamina na dose de 5,0mg/kg foram sacrificados por
decapitação e as áreas cerebrais córtex pré-frontal (PFC), hipocampo (HC), corpo estriado
esquerdo (CEE) e corpo estriado direito (CED) foram dissecadas e congeladas
(armazenadas a -70 ° C) até a determinação dos testes neuroquímicos, os quais foram:
Análise de Presença de Estresse Oxidativo ( GSH e Dosagem de níveis do Fator
alterados e presentes na fisiopatologia do esquizofrenia. Estes testes estão descritos
detalhadamente nas seções 4.6.3.2 e 4.6.3.3.
4.5.3. Protocolo III - Determinação do efeito da Clozapina na reversão das alterações
comportamentais e neuroquímicas induzidas por Cetamina
Com base na avaliação da dose-resposta da Cetamina foi selecionada a dose 5,0 mg
/ kg da droga visando observar o efeito reversão dos efeitos do quando tratados com
Cetamina neonatal.
4.5.4. Tratamento de reversão
Os animais adultos, machos e fêmeas, receberam como tratamento de reversão a
Clozapina (antipsicótico atípico) 10mg/kg via intraperitoneal ou solução salina durante 10
dias. O teste de IPP foi realizado no décimo primeiro dia, assim como o teste Y-maze.
Após, as determinações comportamentais, os ratos foram sacrificados por decapitação e o
PF, HC e CEE e CED dissecados e armazenados a -70 ºC até a determinação dos testes
neuroquímicos.
Protocolo I
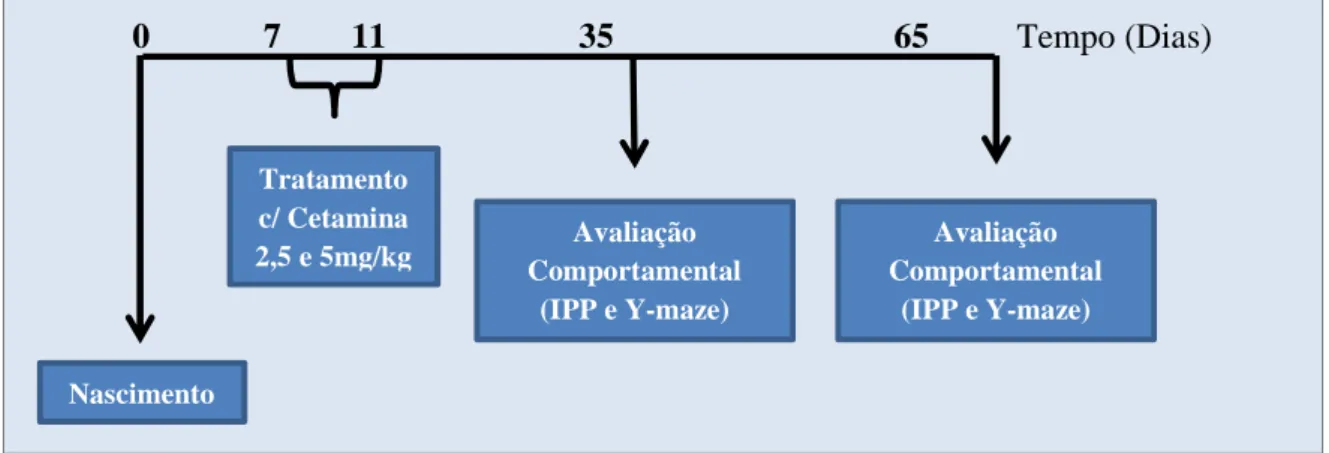
Figura 8. Curva Dose-Resposta para Cetamina 2,5 e 5,0mg/kg.
0 7 11 35 65 Tempo (Dias)
Tratamento c/ Cetamina
2,5 e 5mg/kg Comportamental Avaliação
(IPP e Y-maze)
Avaliação Comportamental
(IPP e Y-maze)
Protocolo II
Figura 9. Determinação das alterações neuroquímicas induzidas por Cetamina
Protocolo III
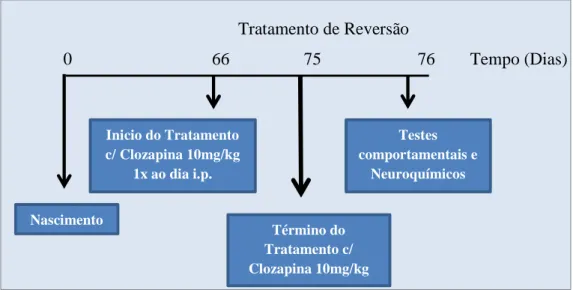
Figura 10. Determinação do efeito da Clozapina na reversão das alterações comportamentais e neuroquímicas induzidas por Cetamina.
Tratamento de Reversão
0 66 75 76 Tempo (Dias)
Inicio do Tratamento c/ Clozapina 10mg/kg
1x ao dia i.p.
Término do Tratamento c/ Clozapina 10mg/kg
Testes comportamentais e
Neuroquímicos