Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação Stricto Sensu em em Educação
Física
EFEITOS DO EXERCÍCIO FÍSICO SOBRE PARÂMETROS
METABÓLICOS EM CAMUNDONGOS OBESOS E NOCAUTES
PARA O RECEPTOR B2 DE CININAS
Brasília - DF
2012
PÂMELLA KAROLINE DE MORAIS
EFEITOS DO EXERCÍCIO FÍSICO SOBRE PARÂMETROS METABÓLICOS EM
CAMUNDONGOS OBESOS E NOCAUTES PARA O RECEPTOR B2 DE CININAS
Dissertação apresentada ao Programa de Pós-Graduação Stricto Sensu em Educação Física da Universidade Católica de Brasília, como requisito parcial para obtenção do Título de Mestre em Educação Física.
Orientador: Prof. Dr. Herbert Gustavo Simões
Co-orientadores: Prof. Dr. Octávio Luiz Franco / Profa Dra Taia Maria Berto Rezende
BRASÍLIA
12,5 cm
7,5 cm 7,5cm
Ficha elaborada pela Biblioteca Pós-Graduação da UCB 28/08/2012 M828e Morais, Pâmella Karoline de.
Efeitos do exercício físico sobre parâmetros metabólicos em camundongos obesos e nocautes para o receptor B2 de cininas. / Pâmella Karoline de Morais – 2012.
71f. : il.; 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2012. Orientação: Prof. Dr. Herbert Gustavo Simões
Coorientações: Prof. Dr. Octávio Luiz Franco / Profa. Dra. Taia Maria Berto Rezende
1. Exercícios físicos. 2. Obesidade. 3. Diabetes mellitus. I. Simões, Herbert Gustavo, orient. II. Franco, Octávio Luiz, coorient. III. Rezende, Taia Maria Berto, coorient. IV. Título.
AGRADECIMENTOS
A Deus, por todo seu amor e pela força dada em todos os momentos de dificuldade, só tenho a agradecer.
À minha mãe, Abadia Rosária de Morais, por sempre confiar e acreditar em mim e no meu trabalho. Sem você nada disso seria possível. És o meu maior exemplo. Te amo!
Ao meu amor lindo, futuro esposo, Jeeser Alves de Almeida. Você sabe que sem você nada disso seria possível. Obrigada por tudo, principalmente pela paciência sem fim, pelo companheirismo, pelo amor sem medida, por tornar minha vida tão diferente e tão mais feliz. Amo você!
À minha sogrinha Sônia, ao meu sogro Jeeser, a minha cunhada Lalá e sobrinha Clarisse (Diga lá rs) pelo carinho e torcida.
Ao Prof. Dr. Herbert Gustavo Simões pelas oportunidades, por acreditar em meu potencial desde a Iniciação Científica. Obrigada pela orientação. À Profa Dra Carmen Sílvia Grubert Campbell, pelo seu carinho e colaboração.
Ao Prof. Dr. Octávio Franco e à Profa Dra Taia Rezende pela ajuda, colaboração, orientação e sobretudo pela amizade. A vocês a minha eterna admiração.
Ao Prof. Dr. Ronaldo de Carvalho Araújo pela colaboração, por ter disponibilizado os animais utilizados neste estudo e à sua aluna Fernanda Russo pelo carinho e atenção.
Ao Grupo de Estudos do Desempenho Humano e das Respostas Fisiológicas ao Exercício, em especial ao Marcelo Sales, Ricardo Asano (Japa), Verusca Najara, Rafael Sotero, Laila Lima, Pedro Farol, Patrícia, Isabela Ramos (Belinha), José Fernando, Rafaello Mazzocante pela amizade e pelas contribuições diárias.
Aos alunos de Iniciação Científica Júnior (Keila, Luana, Roberto, Sarah, Elias e Cairo) e Iniciação Científica (Weverton, Danilo e Renan), vocês foram essenciais para a realização deste trabalho.
Aos amigos Bernardo, Mirna, Osmar e Nelson Júnior - Centro de Análises Proteômicas e Bioquímicas - pela ajuda, amizade e por todos os momentos que passamos juntos.
À minha querida amiga Daisy Motta, pela amizade e exemplo. Apesar de longe continua sendo uma pessoa muito importante para mim. Te amo amiga!
Ao pessoal do LAFIT, Carlos Ernesto, Dr. Benford, Júlio, Eduardo, Alessandra, Danielle; do LEEFS, Darlan e Tânia.
Aos colegas do Hospital Santa Marta pela torcida e por me ajudarem durante esses anos. Aos professores e alunos do Centro Universitário do Planalto Central – Uniplan, pelo apoio. Ao CNPq por financiar meus estudos.
“Tudo caminhando num processo longo de ser gente
Está em nossas mãos
É a nossa vida
Cada escolha sempre determina
O que vem em seguida”
RESUMO
MORAIS, Pâmella Karoline. Efeitos do exercício físico sobre parâmetros metabólicos em camundongos obesos e nocautes para o receptor B2 de cininas. 2012. 72 páginas. Programa de Pós Graduação Stricto Sensu em Educação Física – Universidade Católica de Brasília, Brasília, 2012.
O Diabetes Mellitus tipo 2 (DM2) é um grupo de doenças metabólicas caracterizado por uma hiperglicemia crônica ocasionada por uma ação insulínica insuficiente e consequente redução na translocação do transportador de glicose do tipo 4 (GLUT4). Normalmente está associada à
inatividade física, envelhecimento e aumento de gordura corporal. O DM2 e a obesidade geram um
processo inflamatório, responsável por disfunção endotelial e geração de maior resistência à insulina. Modificações no estilo de vida, como a realização de exercícios físicos, poderiam reverter esses quadros, constituindo uma compreensiva estratégia para o tratamento e prevenção dessas patologias. O exercício físico (EF) conta com mecanismos que promovem maior translocação de GLUT4, entre eles a maior liberação e atividade de bradicinina (BK) e óxido nítrico (NO) resultando em melhor controle glicêmico. Porém, ainda não está esclarecido a “dose ideal” do EF, como de intensidade e duração que potencializem estes benefícios. Assim, o objetivo do Estudo 1 foi analisar o efeito da intensidade e duração do EF na liberação de óxido nítrico, citocinas e conteúdo de GLUT4 em camundongos. Já o Estudo 2 objetiva investigar o papel da BK na disponibilidade de NO e o papel deste na concentração de GLUT4 com e sem a presença da obesidade e da resistência à insulina. Para tanto, no Estudo 1 utilizamos 16 camundongos C57BL/6, em idade adulta (7-8 meses), separados em 4 grupos experimentais, 1) sessão controle (CON); 2) sessão de natação de baixa intensidade e duração (3% peso corporal – PC/20min), 3) alta intensidade (6%PC/20min), 4) natação de maior duração (3%PC/40min). A amostra do Estudo 2 foi composta de 16 camundongos de ambos os sexos (3 fêmeas e 13 machos) com meia idade (8-12 meses), sendo 4 obesos resistentes à insulina (ob/ob), 4 heterozigotos não resistentes à insulina (OB/ob), 4 nocautes para o receptor B2 de cininas e obesos (Bk2r-/-/ob) e 4 Bk2r -/-/OB (magros); todos realizaram uma sessão de 20min de exercício a uma intensidade correspondente ao limiar de lactato (LL). Após as sessões todos os animais foram sedados e eutanasiados para coleta de sangue e de tecido muscular (gastrocnêmio) para posteriores análises. Os resultados do Estudo 1 demonstraram o benefício da intensidade do EF na liberação de NO e no conteúdo de GLUT4, com maior NO (7.6 ± 0.3μM p≤0.05) comparado com baixa intensidade e CON (5.3 ± 0.7 e 4.8 ± 0.7μM respectivamente), e maior GLUT4 em relação ao CON (≅10.44pg/mL - 29.2 ± 4,1 vs 18.8 ± 1.1 pg/mL), o que não foi observado em comparações para se identificar o benefício da duração do EF. Observamos no Estudo 2 que a ausência do receptor B2 reduz a disponibilidade de NO em ambos os grupos (p≤0.05), Bk2r-/-/ob (8.3 ± 1.8μM) versus ob/ob (20.1 ± 5.4μM) e Bk2r-/-/OB (19.4 ± 4.6μM) versus OB/ob (39.1 ± 8.7μM), além de menor GLUT4 nos magros (Bk2r-/-/OB 24.2 ± 1.8 e OB/ob 35.4 ± 2.3pg/mL), essas diferenças também foram observadas na presença da obesidade e resistência à insulina. Os grupos Bk2r-/- também apresentaram maiores concentrações de TNFα muscular. Deste modo, o presente estudo demostra primeiramente que o EF realizado de forma intensa gera maior disponibilidade de NO e aumento na concentração de GLUT4 em animais convencionais, além de demonstrar que o receptor B2 de cininas, bem como a presença obesidade e a resistência à insulina influenciam de forma direta a liberação de NO e no conteúdo de GLUT4.
ABSTRACT
MORAIS, Pâmella Karoline. Effects of physical exercise on metabolic parameters in obese mice and knockouts for kinin B2 receptor. 2012. 72 pages. Strict Sensu Physical Exercise Post-graduation Program – Catholic University of Brasilia, Brasília, 2012.
Type 2 Diabetes (T2D) is a group of metabolic diseases characterized by chronic hyperglycemia caused by insufficient insulin action and a consequent reduction in the translocation of glucose transporter type 4 (GLUT4). It is usually associated with physical inactivity, aging and increased body fat. The T2D and obesity promote an inflammatory, process responsible for generating endothelial dysfunction and insulin resistance. Changes in lifestyle such as physical exercises, could reverse these conditions, constitute a comprehensive strategy for the treatment and prevention of these diseases. Physical exercise (PE) has mechanisms that promote increased of GLUT4 translocation, among them the increased release and activity of bradykinin (BK) and nitric oxide (NO) resulting in better glycemic control. But it is still unclear the "optimal dose" of PE, such as intensity and duration that enhance these benefits. Thus the aim one study was to analyze the effect of intensity and duration of PE in the release of nitric oxide, cytokines and GLUT4 translocation in mice. The study 2 to investigate the role of NO in the availability of BK its role in the GLUT4 concentration with and without the presence of obesity and insulin resistance. Used for the one study 16 C57BL/6 mice (7-8 months), separated into four experimental groups: 1) control session (CON); 2) short bout at low intensity (3% of body weight –BW/20min); 3) short bout at high
intensity (6% of BW/20min); 4) long-term session at low intensity (3%BW/40min). The sample of
two study consisted of 16 mice (3 females and 13 males) with middle-aged (8-12 months), and 4 insulin-resistant obese (ob/ob), 4 non-insulin resistant heterozygous (OB/ob), 4 knockouts of BK B2 receptors and obese (Bk2r-/-/ob) and 4 Bk2r-/-/OB, all animals subject a session of 20 minutes of
exercise at an intensity corresponding to the threshold lactate (LL). After the sessions, all animals were sedated and euthanized to collect blood and muscle tissue (gastrocnemius) for further analysis. The results of a one study demonstrated the benefit of the intensity of the PE in releasing NO and the GLUT4 content, more NO (7.6 ± 0.3µM P ≤ 0.05) compared to low intensity and CON (5.3 ± 0.7 and 4.8 ± 0.7µM respectively) and higher GLUT4 in relation the CON (≅ 10.44pg/mL - 29.2 ± 4.1 vs 18.8 ± 1.1 pg/ml) which was not observed in comparison to identify the effective duration of PE. Observed in two study the absence of the B2 receptor reduces the availability of NO in both groups (P ≤ 0.05), Bk2r-/-/ob (8.3 ± 1.8µM) versus ob/ob (20.1 ± 5.4µM) and Bk2r-/-/OB (19.4 ± 4.6µM) versus OB/ob (39.1 ± 8.7µM), and lower GLUT4 in lean (Bk2r-/-/OB 24.2 ± 1.8 e OB/ob 35.4 ± 2.3pg/mL), these differences were also observed in the presence of obesity and insulin resistance. The groups Bk2r-/- also showed higher concentrations of TNF muscle. Thus, this study shows that the first PE performed intensively generates greater availability of NO and increase in concentration of GLUT4 in conventional mice, and demonstrate that the BK B2 receptor, as well as the presence of obesity and insulin resistance influence directly NO release and the GLUT4 content.
LISTA DE ILUSTRAÇÕES
Figura 1: Esquema da via de sinalização intracelular da insulina.
Figura 2: Esquema da resistência à insulina e DM2.
Figura 3: Esquema dos mecanismos envolvidos na translocação de GLUT4 e na captação de glicose.
Figura 4: Esquema do Sistema Calicreína-Cininas e formação de óxido nítrico.
Figura 5: Resposta do lactato sanguíneo pré e pós sessões em camundongos convencionais do
Estudo 1.
Figura 6: Foto ilustrativa dos procedimentos.
Figura 7: Resposta de nitrito (NO2
-) após sessões realizadas em diferentes intensidades (A-) e durações (B).
Figura 8: Conteúdo de GLUT4 nos grupos experimentais após sessões de diferentes intensidades
(A) e durações (B)
Figura 9: Resposta de nitrito (NO2
-) após sessões experimentais em diferentes grupos.
LISTA DE TABELAS
Tabela 1. Valores de referência para diagnóstico de Diabetes Mellitus a partir do Teste de Glicemia de Jejum (GJ), do Teste de Tolerância à Glicose (TTG) e Hemoglobina glicada (HbA1c).
Tabela 2. Caracterização da amostra do Estudo 1 (n=16).
Tabela 3. Caracterização da amostra do Estudo 2 (n=16).
Tabela 4.Correlações entre variáveis obtidas após sessões experimentais.
Tabela 5. Valores absolutos de IL-6 (plasma e músculo) e TNFα (plasma e músculo) nas quatro
sessões experimentais (n=16).
Tabela 6.Correlações entre variáveis obtidas após sessões experimentais nos grupos ob/ob e Bk2r
-/-/ob.
Tabela 7.Correlações entre variáveis obtidas após sessões experimentais do estudo 1 e 2.
Tabela 8. Valores absolutos de IL-6 (plasma e músculo) e TNFα (plasma e músculo) dos quatro
LISTA DE ABREVIATURAS
ECA: enzima conversora de angiotensina
ADA: American Diabetes Association
ADP: Adenosina difosfato
ACMS: American College of Sports Medicine
AGLs: Ácidos graxos livres
AICAR: 5-aminoimidazole-4-carboxamida-ribonucleotídeo AMPK: Proteína quinase ativada por AMP
AMP: Adenosina monofosfato
ANOVA: Análise de variância ATP: Adenosina trifosfato
BK: Bradicinina
Bk2r-/-/ob: Obesos nocautes Bk2r-/-/OB: Magros nocautes B1R: Receptor B1 de bradicinina B2R: Receptor B2 de bradicinina Ca+
: Cálcio
CaMK: Proteína quinase dependente de cálcio-calmodulina C57BL/6: Linhagem dos animais
CEDEME: Centro de Desenvolvimento de Modelos Experimentais
cGMP: Guanosina 3,5-monofosfato cíclico CON: Sessão controle
des-Arg9-BK: Arginina carboxipeptidase DM: Diabetes Mellitus
DM1: Diabetes Mellitus tipo 1 DM2: Diabetes Mellitus tipo 2 EF: Exercício físico
EPM: Erro padrão da média eNOS: NO sintase endotelial
GJ: Glicose de jejum
HbA1c: Hemoglobina glicada
HK: Cininogênio de alto peso molecular
HQ: Hexoquinase IL: Interleucina iNOS: NOS indutível
IP3: Trifosfato de inositol IR: Receptor de insulina
IRS1: Substratos do receptor de insulina 1 LA: Limiar anaeróbio
[lac]: Concentração de lactato
LEEFS: Laboratório de Estudos em Educação Física e Saúde
LK: Cininogênio de baixo peso molecular LL: Limiar de lactato
LNAME: Inibidor de NOS
MEEL: Máximo estado estável de lactato nNOS: NOS neuronal
NO: Óxido nítrico NO2
-: Nitrito
NOS: Óxido nítrico sintase
ob/ob: camundongos obesos e resistentes à insulina
OB/ob: camundongos heterozigotos magros não resistentes à insulina PC: Peso corporal
PDK: Quinase dependente de fosfoinositídeo
PI3K: Fosfatidilinositol 3-quinase PK: Pré-calicreína
PKB/Akt: proteína quinase B ou Akt RM: Repetição máxima
SCC: Sistema calicreína-cininas
SNC: Sistema Nervoso Central
SOCS: Supressor de sinalização de citocinas TNFα: Fator de necrose tumoral alfa
UCB: Universidade Católica de Brasília UNIFESP: Universidade Federal de São Paulo
SUMÁRIO
1. INTRODUÇÃO ... 16
2. OBJETIVOS ... 18
2.1. ESTUDO 1 ... 18
2.1.1. Objetivo geral ... 18
2.1.2. Objetivos específicos ... 18
2.2. ESTUDO 2 ... 18
2.2.1. Objetivo geral ... 18
2.2.2. Objetivos específicos ... 18
3. JUSTIFICATIVA E RELEVÂNCIA ... 19
4. REVISÃO DE LITERATURA ... 21
4.1. METABOLISMO DA GLICOSE E SUA REGULAÇÃO ... 21
4.1.1. Transportadores de glicose ... 22
4.2. DIABETES MELLITUS ... 23
4.2.1. Definição e Prevalência ... 23
4.2.2. Sintomas, diagnóstico e classificação ... 24
4.2.3. Fisiopatologia da DM2 ... 25
4.2.4. Importância do controle glicêmico no DM2 ... 27
4.3. EXERCÍCIO FÍSICO E DIABETES ... 28
4.3.1. Efeitos do exercício físico ... 28
4.3.2. Duração do exercício ... 31
4.3.3. Intensidade do exercício ... 31
4.3.4. Parâmetros para prescrição da intensidade de exercício ... 32
4.3.5. Mecanismos moleculares da captação de glicose estimulada pelo exercício agudo ... 33
4.4. SISTEMA CALICREÍNA-CININAS ... 36
4.4.1. Óxido Nítrico ... 38
4.5. INFLUÊNCIA DAS CITOCINAS NO CONTROLE GLICÊMICO ... 39
4.6. UTILIZAÇÃO DE MODELOS ANIMAIS NA PESQUISA CIENTÍFICA ... 42
5. MATERIAIS E MÉTODOS ... 43
5.1. ANIMAIS E GRUPOS EXPERIMENTAIS ... 43
5.1.1. Estudo 1 ... 43
5.1.2. Estudo 2 ... 44
5.2. ADAPTAÇÃO AO MEIO LÍQUIDO ... 45
5.3. DETERMINAÇÃO DE INTENSIDADE E PROTOCOLO DE EXERCÍCIO ... 45
5.4. EUTANÁSIA ... 47
5.5. VARIÁVEIS ANALISADAS ... 47
5.5.2. Detecção de Óxido Nítrico (NO) ... 48
5.5.3. Quantificação do transportador de glicose – GLUT4 ... 48
5.5.3.1. Preparação da amostra ... 49
5.5.4. Detecção de Interleucina-6 (IL-6) e Fator de Necrose Tumoral (TNFα) ... 49
5.6. TRATAMENTO ESTATÍSTICO ... 50
6. RESULTADOS ... 51
6.1. ESTUDO 1 ... 51
6.2. ESTUDO 2 ... 53
7. DISCUSSÃO ... 57
8. REFERÊNCIAS ... 61
1. INTRODUÇÃO
O Diabetes Mellitus (DM) é um grupo de doenças metabólicas caracterizado por uma hiperglicemia crônica decorrente da ação insuficiente da insulina (Association, 2010). Os termos do tipo 1 (DM1) e tipo 2 (DM2) são comumente utilizados para a classificação com base na etiologia. O DM1 desenvolve-se em função de uma deficiência na secreção de insulina devido à destruição das células pancreáticas, geralmente causada por uma reação auto imune. Já o DM2, que atinge cerca de 90 a 95% dos indivíduos, caracteriza-se por resistência à insulina (Association, 2010), comumente associada à inatividade física, o envelhecimento e o aumento de gordura corporal (Koistinen e Zierath, 2002; Virally, Blicklé et al., 2007; Nyenwe, Jerkins et al., 2011).
O acréscimo de gordura corporal, e, por conseguinte a obesidade devem-se a uma maior ingestão calórica e/ou redução do gasto energético. A obesidade está vinculada a alterações na função secretora dos adipócitos e macrófagos, inflamação crônica, resistência à insulina e doenças cardiovasculares (Hajer, Van Haeften et al., 2008). Assim, o aumento da prevalência global de DM2 está relacionada a taxas crescentes de obesidade, sendo estes problemas sérios e desafiadores para o século XXI.
O transporte e metabolismo da glicose são regulados pela via de sinalização da insulina. O sinal de transdução insulínico é mediado por uma série de fosforilações intracelulares em cascatas. A partir desta cascata de ação insulínica ocorre a translocação da
molécula transportadora de glicose, o GLUT4, do meio intracelular para a membrana celular (Henriksen, 2002; Krook, Wallberg-Henriksson et al., 2004). Segundo Hawley e Houmard, (2004), a translocação do GLUT4 e a função celular de captação de glicose estão prejudicadas
no DM2 devido ao acúmulo de gordura intracelular, que resulta em resistência à insulina e hiperglicemia crônica.
Conhecida por desempenhar um papel importante no metabolismo da glicose, a
bradicinina (BK) também possui uma variedade de efeitos biológicos, tais como a
vasodilatação, permeabilidade vascular e participação em processos inflamatórios. (Bhoola,
Figueroa et al., 1992; Duka, Shenouda et al., 2001). Estes efeitos da BK são, na sua maioria,
mediados pelos receptores de cininas B1 e B2 (B1R e B2R), sendo o B2R um dos principais
responsáveis pela liberação de substâncias como prostaciclinas e óxido nítrico (NO) (Bhoola,
Figueroa et al., 1992). O NO, por sua vez, é um gás difusível e lipossolúvel produzido a partir
(Farrell e Blake, 1996). Sob condições fisiológicas, a liberação de NO via NOS endotelial
(eNOS) contribui, através do seu efeito vasodilatador, para a captação de glicose pelo
músculo, mediada pela ação da insulina (Patrice e André, 2004). Devido à instabilidade do
NO e a dificuldade de mensuração, utiliza-se a medida dos seus produtos finais, como o
nitrito (NO2
-) para determinar a sua produção (Moshage, Kok et al., 1995; Guevara, Iwanejko
et al., 1998; Calvert, 2011).
No entanto, condições associadas com a resistência à insulina, tais como o DM2 e
obesidade, prejudicam a produção de NO (Patrice e André, 2004), uma vez que concentrações
elevadas de ácidos graxos livres e a disfunção endotelial tem sido relacionados a menores
níveis de NO circulante e função endotelial prejudicada (Abate, 2000; Van Den Oever,
Raterman et al., 2010). O processo inflamatório gerado por tais doenças está ligado com
maior liberação de citocinas pró-inflamatórias (IL-6 e TNFα), que também relaciona-se a resistência insulínica e alterações associadas (Alexandraki, Piperi et al., 2006). Assim,
estratégias como práticas frequentes de atividade física e modificações de hábitos alimentares poderiam reverter esses quadros, constituindo uma compreensiva estratégia para o tratamento e prevenção dessas patologias.
Os principais benefícios do exercício físico incluem a redução do peso corporal, aumento da sensibilidade à insulina e controle glicêmico, melhora do perfil lipídico e melhora da função endotelial (Maiorana, O'driscoll et al., 2003; Bassuk e Manson, 2005). Para pacientes resistentes à insulina, o exercício atua de forma similar à insulina por proporcionar aumento da captação celular de glicose pela musculatura exercitada por intermédio da translocação de GLUT4, sem que para isso seja necessária à participação da insulina. (Röckl, Witczak et al., 2008). Pouco se conhece sobre o mecanismo pelo qual o exercício físico induz a captação da glicose não dependente de insulina, mas acredita-se na possível participação da BK e do NO nesse processo (Hayashi, Wojtaszewski et al., 1997).
Além disso, estudos demonstram (Gondoh, Tashiro et al., 2009; Medicine e Association, 2010) que a captação celular de glicose durante o exercício dependa da potência gerada (intensidade de exercício) assim como da massa muscular recrutada. Sendo assim é
2. OBJETIVOS
2.1. ESTUDO 1
2.1.1. Objetivo geral:
• Analisar os efeitos da intensidade e duração do exercício aeróbio na liberação de NO, e conteúdo de GLUT4 em camundongos C57BL/6.
2.1.2. Objetivos específicos:
• Verificar a influência da intensidade do exercício aeróbio na liberação de NO,
citocinas (IL-6 e TNFα) e conteúdo de GLUT4.
• Averiguar se a duração do exercício aeróbio exerce alguma influência na
liberação de NO, citocinas (IL-6 e TNFα) e conteúdo de GLUT4.
2.2. ESTUDO 2
2.2.1. Objetivo geral:
• Analisar as respostas de NO, citocinas e concentração de GLUT4 em
decorrência de uma sessão de exercício físico realizada no Limiar de Lactato (LL) por camundongos com deficiência de leptina e resistentes à insulina e o papel da BK nestas respostas.
2.2.2. Objetivos específicos:
• Analisar o papel da BK na produção de NO e conteúdo de GLUT4 em camundongos obesos e resistentes à insulina.
• Averiguar o papel do NO na concentração de GLUT4 após realização de
exercício aeróbio.
• Comparar a concentração de NO, citocinas e o conteúdo de GLUT4 após
realização de uma sessão de exercício aeróbio em animais resistentes à insulina e nocautes
para o receptor B2 de cininas.
3. JUSTIFICATIVA E RELEVÂNCIA
A incidência de doenças crônicas não-transmissíveis, como o diabetes e a obesidade, vem crescendo de forma assustadora nas últimas décadas, representando um problema de saúde pública, com prejuízos socioeconômicos importantes. Além disso, as complicações associadas a essas patologias alteram significativamente a qualidade de vida desses indivíduos, o que reforça a importância de medidas para a manutenção do peso corporal e adequação do controle glicêmico (Virally, Blicklé et al., 2007; Association, 2010; Nyenwe, Jerkins et al., 2011).
Sabe-se que maus hábitos alimentares e o sedentarismo aumentam a incidência de tais doenças, e que práticas frequentes de exercício físico poderiam ser úteis para tratar e até prevenir essas alterações (Bassuk e Manson, 2005). Em indivíduos diabéticos, devido à ausência e/ou incapacidade da insulina de exercer suas funções, o controle glicêmico fica prejudicado por um transtorno no mecanismo de ativação e translocação do GLUT4. Mas, o exercício físico promove translocação desta proteína independente da insulina (Röckl, Witczak et al., 2008). No entanto, os mecanismos que atuam nessa translocação ainda permanecem controversos, principalmente no que diz respeito à intensidade e duração do exercício. Assim o presente estudo mostra-se relevante por analisar os efeitos da intensidade e duração do exercício agudo sobre variáveis relacionadas à translocação de GLUT4, em animais saudáveis e patológicos (obesos e resistentes à insulina).
4. REVISÃO DE LITERATURA
4.1. METABOLISMO DA GLICOSE E SUA REGULAÇÃO
Os carboidratos, particularmente a glicose, são uma importante fonte de energia para a maioria dos organismos vivos. A manutenção da homeostase da glicose depende da interação entre mecanismos neurais e hormonais, sendo a insulina e o glucagon fatores endócrinos
primários responsáveis pela regulação dos níveis glicêmicos (Shepherd e Kahn, 1999; Bansal e Wang, 2008).
A insulina é um hormônio peptídeo sintetizado, secretado e armazenado pelas células β das ilhotas pancreáticas (Pattaranit, Van Den Berg et al., 2008). Durante períodos de hiperglicemia (p.e. após as refeições), a secreção desse hormônio é aumentada, enquanto a
secreção do glucagon é reduzida, a fim de promover a facilitação de transporte de glicose no músculo esquelético e tecido adiposo (Shepherd e Kahn, 1999).
A ação insulínica inicia-se a partir da ligação com o receptor transmenbrana (IR) para a ativação de uma cascata de sinalização que finaliza com a captação de glicose pela célula. O receptor de insulina é uma glicoproteína composta por duas subunidades, uma α (extracelular) e outra β (transmenbrana). A insulina liga-se então a subunidade α que provoca a ativação da tirosina quinase da sua subunidade β levando à fosforilação em tirosina dos substratos de receptores de insulina (IRS 1-4). O IRS-1 associa-se à subunidade regulatória da p85 da fosfatidilinositol-3 quinase (PI3K) e ativa a unidade catalítica p110, que por sua vez catalisa a produção de fosfoinositídeos que ativam a quinase dependente do fosfoinositídeo (PDK), resultando na ativação da proteína quinase B ou Akt (PKB/Akt) (Shepherd e Kahn, 1999;
Figura 1: Esquema simplificado da via de sinalização intracelular da insulina. IRS1: substrato do receptor de insulina; PI3K: fosfatidilinositol 3-quinase; PKB/AKT: proteína quinase B; GLUT4: transportador de glicose do tipo 4; BK: Bradicinina; NO: óxido nítrico; G6P: Glicose-6-fosfato. Adaptado de Henriksen e Jacob, 2003; Merry e Mcconell, 2009.
4.1.1. Transportadores de glicose
A glicose necessária como combustível para todas as células é transportada por difusão facilitada através da membrana plasmática (Tremblay, Dubois et al., 2003). Este processo é mediado por proteínas transportadoras de glicose (GLUTs). Eles são caracterizados por 14 proteínas que diferem quanto a sua distribuição nos tecidos e propriedades cinéticas.
O GLUT1 é expressa na maioria dos tecidos, especialmente em eritrócitos e cérebro, e acredita-se mediar a oferta de glicose basal. O GLUT2 é predominantemente expressa em hepatócitos. O GLUT3 está presente no cérebro e neurônios. O GLUT4 se expressa
exclusivamente nos tecidos com sensibilidade à insulina como o tecido muscular, cardíaco e adiposo. O GLUT5 tem maior expressão no intestino delgado, rins e possui afinidade principalmente pela frutose. O GLUT6 expressa-se principalmente no baço, leucócitos e cérebro. O GLUT8 é abundante nos blastocistos e no cérebro. GLUT9 é detectada principalmente em rins e fígado. GLUT10 é expresso no fígado e no pâncreas e GLUT11 no
principalmente no coração e na próstata. GLUT13 é predominantemente expressa no cérebro
e o GLUT14 no testículo (Gaster, 2007; Thorens e Mueckler, 2010).
Sabe-se que o músculo esquelético compõe cerca de 40% da massa corporal e é
responsável por 25% da captação de glicose em condições basais e 75% durante a
estimulação pela insulina (Gaster, 2007). No entanto, apenas seis desses transportadores
(GLUT1, 4, 5, 8, 11 e 12) são expressos no músculo esquelético (Doege, Schürmann et al.,
2000; Tremblay, Dubois et al., 2003; Seki, Berggren et al., 2006). A expressão do GLUT1 no
músculo é cerca de 20 vezes menor que a do GLUT4 (Tremblay, Dubois et al., 2003) e
acredita-se contribuir para a captação de glicose basal e assim como o GLUT5 não se
translocam em resposta à insulina e ao exercício físico (Hundal, Darakhshan et al., 1998), ao
contrário do GLUT4 (Kennedy, Hirshman et al., 1999).
Já o GLUT8 e 12 facilitam o transporte de glicose pelo estímulo da insulina, similar ao
GLUT4 (Doege, Schürmann et al., 2000; Rogers, Macheda et al., 2002). Porém perante o
treinamento físico eles apresentam respostas diferentes, Seki, Berggren et al., (2006), ao
comparar mRNA das isoformas GLUT4, 8 e 12 em músculos esqueléticos de indivíduos
treinados e sedentários, demonstraram redução de GLUT12 em indivíduos fisicamente ativos
e nenhuma alteração do GLUT8. Em contraste, o conteúdo de GLUT4 manteve-se elevada
nos indivíduos treinados. Salientando assim, a importância deste transportador para a
captação de glicose em resposta ao exercício.
4.2. DIABETES MELLITUS
4.2.1. Definição e Prevalência
O Diabetes Mellitus (DM) é um distúrbio metabólico progressivo caracterizado por uma hiperglicemia crônica, decorrente da falta de insulina e/ou da incapacidade da insulina de exercer adequadamente seus efeitos (Virally, Blicklé et al., 2007; Association, 2010). Quando mantida por um longo período, o aumento da glicose circulante gera danos como: disfunção endotelial e falência de vários órgãos, especialmente os olhos, rins, nervos, coração e vasos sanguíneos (Association, 2010).
indivíduos tem seu diagnóstico comprovado (Shaw, Sicree et al., 2010). Com isso, acredita-se que medidas de prevenção à doença e o combate a suas próprias complicações podem reduzir os custos no seu tratamento e melhorar a qualidade de vida de seus portadores.
4.2.2. Sintomas, diagnóstico e classificação
Entre os primeiros indícios da existência do DM, estão sintomas como: poliúria (aumento do volume urinário), polidipsia (aumento da sensação de sede), perda de peso brusca, associados com polifagia (fome excessiva) e visão turva, dificuldade de cicatrização, entre outros (Association, 2010); e o diagnóstico deve ser confirmado por meio de testes laboratoriais.
Por décadas, o diagnóstico de DM era realizado apenas com medidas da glicose sanguínea de jejum (GJ) de no mínimo oito horas e o teste de tolerância à glicose (TTG) após a administração de 75 gramas de glicose anidra por via oral, com medidas de glicose nos tempos 0 a 120 minutos após a ingestão (Association, 2010). Hoje considera-se a hemoglobina glicada (HbA1c) um importante marcador de hiperglicemia crônica, de 2 a 3 meses. Os critérios recentes para a classificação são descritos na Tabela 1.
Tabela 1. Valores de referência para diagnóstico de Diabetes Mellitus a partir do Teste de Glicemia de Jejum (GJ), do Teste de Tolerância à Glicose (TTG) e Hemoglobina glicada (HbA1c).
Normal Resistência à insulina
(Pré-Diabetes) Diabetes Mellitus
GJ < 100 mg.dL-1 100-125 mg.dL-1 ≥ 126 mg.dL-1
TTG < 140 mg.dL-1 140 a 199 mg.dL-1 ≥ 200 mg.dL-1
HbA1c --- --- ≥ 6.5%
Adaptado de American Diabetes Association (2010).
Indivíduos que se enquadram na classificação de resistência à insulina, caracterizada por glicemia de jejum alterada ou intolerância à glicose no TTG, apresentam altos riscos de progressão do DM e para o desenvolvimento de doenças cardiovasculares (Association, 2010).
acarretar no surgimento de algumas complicações incluindo retinopatias, nefropatias, neuropatias periféricas e autonômicas, doenças cardiovasculares, aterosclerose cardiovascular, arterial periférica e doenças cerebrovasculares (Association, 2010; Seino, 2010).
O DM1 corresponde a 5-10% dos casos e é caracterizado por uma doença auto-imune onde há a destruição das células beta do pâncreas levando a uma diminuição ou ausência da produção de insulina. Ele acomete de forma rápida e progressiva crianças e adolescentes, porém pode ocorrer também em adultos, mas de forma lenta. Muitos pacientes apresentam cetoacidose como manifestação da doença (Association, 2010).
Já o DM 2 representa o um dos maiores problemas de saúde pública no mundo, que resulta em geral da resistência à insulina e deficiência relativa de secreção da mesma. Com isso, a insulina torna-se incapaz de exercer suas funções. Este tipo acomete cerca de 90-95% dos indivíduos e normalmente é diagnosticado a partir dos 40 anos, embora possa ocorrer em outras idades. O risco de desenvolver tal forma cresce com a idade, obesidade e falta de atividade física (Hu, 2003; Virally, Blicklé et al., 2007; Association, 2010; Nyenwe, Jerkins et al., 2011).
Embora o defeito primário no desenvolvimento de DM2 ainda seja pouco conhecido, impedimentos na ação insulínica no músculo esquelético tem sido claramente estabelecidos como defeito precoce na patogênese do DM2. A causa da resistência à insulina pode estar relacionada a diversos fatores, onde uma hiperinsulinemia compensatória inicial pode potencializar a manutenção da glicemia em valores normais. Todavia, em estágios mais avançados da doença isso pode não ocorrer de forma satisfatória, resultando no quadro de intolerância à glicose, levando o indivíduo ao DM2 descompensado (Hawley e Houmard, 2004).
4.2.3. Fisiopatologia da DM2
A resistência à insulina presente em cerca de 25% da população adulta, tem um papel patogênico importante no desenvolvimento do DM2. A presença da hiperglicemia provocará alterações em vários órgãos (Defronzo, 2004).
O mecanismo exato responsável pela resistência à insulina ainda não foi totalmente explicado. Contudo, alterações moleculares como a inibição da fosforilação do IRS e consequente decréscimo na associação com a PI3K geram redução na cascata de sinalização do transportador de glicose (GLUT4), que determina um estado de resistência à insulina em tecidos periféricos (Krook, Wallberg-Henriksson et al., 2004; Virally, Blicklé et al., 2007; Pauli, Cintra et al., 2009) (Figura 2). No entanto, sabe-se que cerca de 85% da população de DM2 apresentam sobrepeso (Abate, 2000). Assim a obesidade torna-se um fator contribuinte para patogênese dessa doença.
Figura 2: Esquema da resistência à insulina e DM2. IRS1: substrato do receptor de
insulina; PI3K: fosfatidilinositol 3-quinase; PKB/AKT: proteína quinase B; GLUT4: transportador de glicose do tipo 4; TG: triglicerídeos; AGLs: ácidos graxos livres G6P: Glicose-6-fosfato. Adaptado de Henriksen e Jacob, 2003; Merry e Mcconell, 2009.
ativar a PI3K, resultando na diminuição do tráfego de GLUT4 para a superfície da célula, sendo esses importantes mecanismos que explicam a relação entre acúmulo de gordura tecidual e resistência à insulina (Mittra, Bansal et al., 2008).
Goodyear, Giorgino et al. (1995) mostraram que em músculo esquelético de pacientes obesos há uma redução da expressão (54%) e fosforilação de IRS-1 e diminuição da ativação da PI3K. Em diabéticos tipo 2 magros e moderadamente obesos, a redução dos níveis dessas proteínas também tem sido relatadas (Ryder, Gilbert et al., 2001). Ainda, existe no músculo esquelético de DM2 uma menor concentração de GLUT4 e uma redução, de até 50%, na estimulação deste em resposta à insulina (Zierath, Krook et al., 2000).
4.2.4. Importância do controle glicêmico no DM2
Indivíduos com DM2 apresentam maior risco de complicações microvasculares e doenças cardiovasculares em comparação com a população geral, podendo estar associado a fatores de risco como obesidade, hipertensão arterial e dislipidemia, porém mais diretamente relacionado à hiperglicemia. Existem evidências que mostram que qualquer aumento de HbA1c acima dos níveis normais está associada com tais complicações (Stratton, Adler et al., 2000; Khaw, Wareham et al., 2004; Benhalima, Standl et al., 2011), o que salienta a importância de intervenções diárias a fim de se obter maior controle e redução glicêmica.
Alterações nos hábitos alimentares, no estilo de vida e o uso de medicações hipoglicemiantes consistem em importantes estratégias para o controle da glicemia em DM2. No que diz respeito à dieta, sabe-se que um menor consumo de alimentos ricos em gordura e açucares e uma maior ingesta de fibras, frutas e vegetais promovem uma melhoria no controle glicêmico (Nyenwe, Jerkins et al., 2011).
De acordo com Stratton et al. (2000), cada 1% de redução da HbA1c está associado a diminuição da mortalidade pelo DM (21%), menor risco de infarto do miocárdio (14%) e complicações microvasculares (37%).
4.3. EXERCÍCIO FÍSICO E DIABETES
A sensibilidade à insulina está diretamente relacionada ao grau de atividade física, enquanto o sedentarismo eleva o risco de DM2 (Hawley e Houmard, 2004). Assim, o EF compreende uma importante ferramenta na prevenção e no tratamento do DM2 e doenças associadas.
Em sua definição, o EF compreende um tipo de atividade física realizada de forma estruturada e planejada com movimentos repetidos com o objetivo de melhorar e manter componentes da aptidão física (Sigal, Kenny et al., 2004; Sigal, Kenny et al., 2006). Para os DM2, tradicionalmente recomenda-se programas de exercício aeróbios, resistidos ou a associação dos dois (Medicine e Association, 2010). O exercício aeróbio consiste em movimentos contínuos normalmente envolvendo grandes grupos musculares, que incluem corridas, caminhadas, natação, dentre outros. Já os de resistência utilizam a força muscular para mover um peso ou contra uma carga resistiva, que englobam a exercícios em aparelho de musculação ou levantamento de peso (Sigal, Kenny et al., 2004; Sigal, Kenny et al., 2006).
Independente do tipo, quando realizados de forma aguda ou crônica, o EF promove benefícios metabólicos, cardiovasculares, na composição corporal, na capacidade funcional, dentre outros.
4.3.1. Efeitos do exercício físico
Os benefícios da contração muscular tais como o transporte e o metabolismo da glicose e a melhora da sensibilidade à insulina podem ser vistos após uma única sessão de exercício prolongando-se até algumas horas (24 a 72h) após o seu término (Goodyear e Kahn, 1998; Gulve, 2008; Medicine e Association, 2010).
sanguíneo e mudanças na glicemia ou do estado metabólico podem desempenhar um papel nesse controle (Sigal, Kenny et al., 2004; Sigal, Kenny et al., 2006).
A captação da glicose pelo músculo é um processo complexo. Para ser metabolizada ela deve ir do sangue para o interstício e espaço intracelular e em seguida fosforilada para Glicose-6-fosfato (G6P). O movimento da glicose a partir do sangue é determinado pelo fluxo sanguíneo muscular, recrutamento capilar e pela permeabilidade endotelial. O número e a atividade dos transportadores de glicose definem a capacidade de sua condução para o interior da célula; enquanto que a capacidade de fosforilar a glicose é determinada pela quantidade de HQ (Wasserman e Ayala, 2005; Torres-Leal, Capitani et al., 2009).
Durante a atividade muscular a entrega de glicose é facilitada pelo aumento do fluxo sanguíneo para os músculos em contração (Gulve, 2008), que se eleva cerca de vinte vezes durante um exercício intenso (Rose e Richter, 2005); o transporte de glicose é aumentado através da translocação insulino-independente de GLUT4 para a superfície celular (Krook, Wallberg-Henriksson et al., 2004), uma vez que não se observa na atividade contrátil uma fosforilação de IRS ou atividade da PI3K (Goodyear e Kahn, 1998; Jessen e Goodyear, 2005), associado ao acréscimo da fosforilação de glicose pelo aumento de HK visto após uma sessão de exercício (Kraniou, Cameron-Smith et al., 2000).
A evidência que reflete a translocação de GLUT4 como um importante mecanismo pelo qual o exercício agudo aumenta a absorção de glicose pelo músculo esquelético em DM2 foi descrito por Kennedy, Hirshman et al. (1999), que encontraram uma maior concentração de GLUT4 na membrana (74%) de DM2, após exercício em cicloergômetro, quando comparada aos valores de repouso. Em humanos saudáveis, o resultado foi semelhante, observando em nove voluntários um maior conteúdo de GLUT4 (35%) após a realização de uma sessão de exercício (60min a 70% do VO2máx) (Thorell, Hirshman et al., 1999).
(1998) verificaram que o aumento na sensibilidade à insulina após o exercício (4x30 minutos) em ratos é devido a maior translocação de GLUT4 para a superfície celular, mas não pela potencialização da fosforilação do IRS.
Praet, Manders et al. (2006) avaliaram o impacto de uma sessão de exercício, realizado em circuito (aeróbio e resistido), na homeostase da glicose por 24h em indivíduos com DM2 e verificaram uma redução na prevalência na hiperglicemia (39% cerca de 3h). Resultados semelhantes foram encontrados por Gillen, Little et al. (2012) que verificaram melhor controle glicêmico por 24h em DM2 que realizaram uma sessão de treinamento intervalado de alta intensidade (10x60s a 90% da FCmáx). Já Baynard, Franklin et al. (2005) não verificaram melhora na tolerância à glicose ou na sensibilidade à insulina após uma única sessão de 30 minutos ou 3x10 minutos a 60% do VO2pico,em mulheres com DM2 e no grupo controle não obesos.
As adaptações promovidas pelo treinamento devem-se ao acúmulo de respostas agudas advindas de sessões isoladas de EF. Como alterações crônicas podemos destacar o aumento na expressão de GLUT4, acréscimo da autofosforilação dos IRS e consequente atividade da PI3K e Akt, além de transformações no tipo de fibra muscular e aumento no conteúdo e atividade mitocondrial (Röckl, Witczak et al., 2008; Torres-Leal, Capitani et al., 2009).
Christ-Roberts, Pratipanawatr et al. (2004) analisaram o efeito de oito semanas de treinamento (20 minutos a 60% VO2pico 3 vezes na semana aumentando para 45 minutos a 70% VO2pico por 4 vezes) em indivíduos saudáveis e com DM2 e verificaram o aumento do GLUT4 de 8% para 38% nos não diabéticos e de 10% para 22% nos DM2, juntamente com maior expressão da Akt .
Os tipos de fibras musculares são classificadas como fibras de contração lenta (tipo I) e contração rápida (tipo II). As do tipo I tendem a ter maior abundância de mitocôndrias que as do tipo II. Curiosamente, os indivíduos com DM2 ou resistentes à insulina possuem menor % de fibras lentas e redução do GLUT4. Em contrapartida, têm sido mostrado que o EF induz um aumento do teor mitocondrial e adaptações nas fibras musculares, melhorando seu “maquinário oxidativo” e tornando-os mais resistentes, com maior conteúdo de GLUT4 e por conseguinte contribuindo para o tratamento dessa patologia (Gaster, 2007; Röckl, Witczak et al., 2008).
neuropatia, pé diabético, retinopatia avançada ou qualquer doença que ofereça risco ao participante (Nyenwe, Jerkins et al., 2011).
4.3.2. Duração do exercício
As mais recentes recomendações do American Diabetes Association (ADA) e American College of Sports Medicine (ACMS) preconizam para DM2 150 minutos de atividade moderada (30 minutos, 5 dias na semana) ou 60 minutos de vigorosa (20 minutos em 3 vezes por semana) (Medicine e Association, 2010).
Existem poucas evidências quanto a melhor duração do EF para os indivíduos com
DM2. Eriksen, Dahl-Petersen et al. (2007) analisaram os efeitos de dois protocolos de exercício (três sessões de curta duração e uma de longa duração a 60% VO2máx) no controle glicêmico em dezoito homens idosos com DM2 e concluíram que o EF realizado a 3x10min é melhor do que 1x30min no que diz respeito ao controle da glicemia, enquanto que ambos os grupos aumentaram a aptidão cardiorespiratória.
4.3.3. Intensidade do exercício
De acordo com as mesmas recomendações anteriores, o exercício aeróbio para os DM2 deve ser realizado em intensidade moderada, correspondente a 40 a 60% de VO2máx. Porém benefícios adicionais como os cardiovasculares são obtidos a partir da realização de exercício mais vigoroso (acima de 60% de VO2máx) (Medicine e Association, 2010).
A partir disto alguns estudos foram realizados afim de se verificar a melhor intensidade de exercício para os DM2, Kraniou, Cameron-Smith et al. (2006) verificaram a influência da intensidade do exercício agudo sobre a expressão de GLUT4 em seis homens sedentários e constataram que tanto a sessão ≅ 40% VO2máx quanto a de ≅ 80% VO2máx, com
total de trabalho igual, produziram aumento no mRNA e na quantidade de GLUT4 até 3h após a sessão.
perfil glicêmico, somente nos animais que se exercitaram em alta intensidade (20min 6%PC) quando comparados aos sedentários.
Quanto ao controle glicêmico os resultados também se mantêm controversos. Manders, Van Dijk et al. (2010) ao analisarem o efeito de duas sessões de exercício de baixa (60min a 35% Wmáx) e alta (30min a 70% Wmáx) intensidade em nove indivíduos com DM2 concluíram que somente o exercício de baixa intensidade foi capaz de reduzir a prevalência de hiperglicemia por 24h. Moreira, Simões et al., (2011) ao compararem duas intensidades de exercícios agudos de resistência (23% e 43% de 1RM) sugeriram que tanto baixas quanto moderadas intensidades são eficazes para o controle glicêmico em portadores de DM2.
Contudo, o efeito da intensidade do EF em DM2 se estende a outros benefícios como o controle da pressão arterial. Lima, Assis et al. (2008) sugeriram a utilização de maiores intensidades de exercício (110% do limiar de lactato) para o controle pressórico 2h pós-exercício em DM2.
Como visto, faz-se necessários novos estudos para verificar o papel da intensidade do exercício nas respostas glicêmicas, bem como nos seus mecanismos, afim de potencializar o benefícios da sua realização e minimizar os riscos oriundos da prática regular do EF em indivíduos com DM2, com e sem complicações associadas.
4.3.4. Parâmetros para prescrição da intensidade de exercício
Recomenda-se para populações especiais (DM2 e obesos), uma adequada prescrição de EF, baseada em intensidades que representem a capacidade aeróbia e física destes indivíduos. Para isso, é necessária a realização de testes incrementais para a avaliação da aptidão funcional, como o consumo máximo de oxigênio (VO2máx) e o limiar anaeróbio (LA) (Simões, H., Campbell, C. et al., 2003).
O LA consiste um marcador da transição aeróbia-anaeróbia dos processos de produção de energia (Faude, Kindermann et al., 2009). Respostas de ventilação (Wasserman, Whipp et al., 1973; Belli, Ackermann et al., 2007), glicemia (Simões, H. G., Campbell, C. S. et al.,
2003) e de lactato sanguíneo (Macintosh, Esau et al., 2002), além da variabilidade da frequência cardíaca (Sales, Campbell et al., 2011), vêm sendo utilizadas na identificação do LA durante testes incrementais. Quando utilizamos a resposta do lactato sanguíneo para a sua identificação, damos a denominação de limiar de lactato (LL).
considerado o padrão ouro entre os protocolos. O MEEL é definido como a maior intensidade de exercício em que há um equilíbrio entre a produção e a remoção de lactato durante o exercício de carga constante (Svedahl e Macintosh, 2003).
Considerando modelos animais, protocolos para a determinação do LL e MEEL têm sido descritos em exercícios de natação (Gobatto, De Mello et al., 2001; Cunha, Cunha et al., 2009; Almeida, Lima et al., 2011), o que facilita o estudo dos efeitos de diferentes intensidade em aspectos relacionados a doenças crônicas não trasnmissíveis. Desta forma, essas descobertas poderiam contribuir posteriormente para uma prescrição de exercício em seres humanos com objetivo de otimizar o controle glicêmico e perfil lipídico, além de reduzir riscos de doenças metabólicas e cardiovasculares.
4.3.5. Mecanismos moleculares da captação de glicose estimulada pelo exercício
agudo
Os efeitos do EF no controle glicêmico vem sendo amplamente pesquisados (Mcclean, Mcneilly et al., 2009; Moreira, Simões et al., 2011). Tanto a insulina como o EF são estimuladores fisiológicos do transporte de glicose pelo músculo esquelético. Porém, em DM2 a regulação da glicose via insulina está prejudicada, mas mecanismos como os mediados pela contração muscular permanecem intactos promovendo assim essa regulação (Röckl, Witczak et al., 2008).
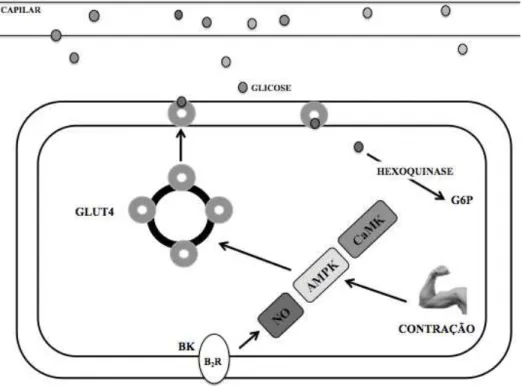
Entre os mecanismos envolvidos na translocação de GLUT4 e na captação de glicose estão a proteína quinase ativada por AMP (AMPK), o NO, o Ca+, a proteína quinase dependente de cálcio-calmodulina (CaMK) (Merry e Mcconell, 2009) e a BK (Mcconell e Kingwell, 2006) (Figura 3).
possível mecanismo para a elevação da translocação de GLUT4 no pós-exercício (Torres-Leal, Capitani et al., 2009).
Figura 3: Esquema dosmecanismos envolvidos na translocação de GLUT4 e na
captação de glicose durante a contração muscular. GLUT4: transportador de glicose do tipo 4; BK: Bradicinina, B2R: receptor B2 de bradicinina; G6P:
Glicose-6-fosfato; NO: óxido nítrico; AMPK: proteína quinase ativada por AMP; CaMK: proteína quinase dependente de cálcio-calmodulina. Adaptado de Henriksen e Jacob, 2003; Merry e Mcconell, 2009.
Existe uma interação entre AMPK, NOS e níveis de NO no músculo. Sendo que a ativação da AMPK inibe a expressão de iNOS, enquanto fosforila e ativa a eNOS e nNOS. A nNOS é a principal forma expressa no músculo esquelético e a sua atividade e consequentemente o NO aumentam cerca de 1,5 a 2 vezes com a contração muscular, sendo também responsável pelo transporte de glicose independente da insulina (Merry e Mcconell, 2009). Alguns estudos tem investigado o efeito da inibição da NOS sobre a captação de glicose durante e após o EF. Roberts, Barnard et al. (1997), examinaram o efeito do NO no transporte de glicose no músculo esquelético de ratos submetidos a uma sessão de exercício e ao tratamento com inibidor de NOS, o N-nitro-L-arginina-metil-ester (L-NAME) e verificaram que o exercício aumentou o conteúdo de GLUT4 no sarcolema, o que não ocorreu
DM2 e concluíram que o L-NAME promoveu uma maior redução na absorção de glicose no
grupo DM2 quando comparado com os saudáveis, mostrando assim a importância do NO no
metabolismo da glicose principalmente em indivíduos patológicos.
Ainda, Pereira e Lancha, (2004) afirmam que o Ca+ que entra no sarcoplasma não só induz a contração muscular, mas também ativa a NOS cálcio-dependente, que, por sua vez,
faz com que haja translocação de GLUT4 e transporte de glicose.
A contração das fibras musculares esqueléticas é iniciada pela despolarização da
membrana plasmática e túbulos T, desencadeando a liberação de Ca+ do retículo sarcoplasmático e consequente interação dos filamentos de actina e miosina (Jessen e Goodyear, 2005). Wright, Hucker et al. (2004) propuseram que o aumento na concentração de
Ca+ é o mecanismo inicial do transporte de glicose e translocação de GLUT4 estimulada pela contração, mas faz-se necessário a ligação com proteínas para que isso ocorra. Uma importante candidata para esse fenômeno é calmodulina, a CaMK (Röckl, Witczak et al., 2008). Wright, Hucker et al. (2004) demonstraram que uma inibição da CaMK por agentes farmacológicos leva a uma redução da captação de glicose estimulada pela contração muscular, afirmando assim a dependência dessa proteína para que a absorção de glicose ocorra de forma eficaz.
Já foi mostrando que a BK também está relacionada com o metabolismo da glicose por atuar sobre a via de sinalização insulínica (Miyata, Taguchi et al., 1998). No entanto, Kishi, Muromoto et al. (1998) mostraram que a BK desencadeia a translocação de GLUT4 e absorção de glicose independente da insulina, provavelmente pelo número de receptores B2 presentes na superfície celular e pela concentração de Ca+ intracelular. Taguchi, Kishikawa et al. (2000) avaliaram o envolvimento da BK na captação de glicose em humanos e ratos. Em
humanos, as concentrações plasmáticas de BK aumentaram significativamente durante um exercício de 20min em cicloergômetro, porém somente em indivíduos saudáveis e com DM2 controlada. Resultado similar foi encontrado com o estudo em ratos, que apresentaram aumento de BK e maior translocação de GLUT4 após 1h de natação, exceto em ratos DM-STZ graves. Assim, o aumento de BK induzido pelo exercício, bem como a melhoria da via insulínica no pós-exercício, resulta na diminuição da glicose sanguínea. Ainda, utilizando exercício resistido e aeróbio, Moraes et al. (2007) mostraram que a concentração de BK aumentou no final 35min de exercício e permaneceu por 60min pós-exercício.
exercício (60min) e controles. Assim, mostraram uma menor captação de glicose pelos Bk2r -/- quando comparados com o WT, mas a ausência do B2r não alterou os efeitos do exercício sobre a glicose circulante no pós-exercício.
4.4. SISTEMA CALICREÍNA-CININAS
A existência do Sistema calicreína-cininas (SCC) foi descrito em 1909 por Abelous and Bardier. Este sistema constitui uma cascata metabólica, que quando ativado promove a
liberação de cininas vasoativas. Este complexo sistema é composto por enzimas calicreínas que liberam cininas a partir de precursores cininogênios de alto e baixo peso molecular, que por sua vez exercem suas atividades ligando-se a receptores específicos (Pesquero e Bader, 1998; Moreau, Garbacki et al., 2005) (Figura 4).
As Calicreínas são serino-proteases encontradas em células glandulares, fluídos
biológicos e neutrófilos e são divididos em dois grupos principais: calicreína plasmática e tecidual. O dois tipos se diferem de acordo com o peso molecular, a característica imunológica, a especificidade do substrato, o tipo de cinina ativada e a importância funcional (Bhoola, Figueroa et al., 1992). A calicreína plasmática participa da ativação da coagulação do sangue, da regulação do tônus vascular, da fibrinólise e do processo inflamatório. Essa pode circular ainda em um estado inativo, conhecida como pré-calicreína (PK) plasmática ou
fator de Fletcher. A PK é uma glicoproteína sintetizada no fígado e está presente no plasma como um complexo ligado ao cininogênio de alto peso molecular (HK). Para formar a calicreína, a PK se torna ativa pelo fator de Hageman ou XIIa (Sharma, Uma et al., 1996).
Os cininogênios são proteínas multifuncionais envolvidas na inflamação, na coagulação e na proteção a danos celulares. Eles são sintetizados no fígado e circulam no
plasma e em outros fluídos corporais. Na circulação humana estão presentes em duas formas: alto (HK) e baixo peso molecular (LK), que se diferem pelo tamanho molecular, sensibilidade
à calicreína e funções fisiológicas. A calicreína plasmática atua sobre HK para produzir a bradicinina (BK), enquanto que a liberação da calidina depende da ação de ambos
cininogênios, LK e HK (Sharma, Uma et al., 1996).
A família das cininas inclui principalmente a BK, a calidina e a metionil-lisil-BK
(Sharma, Uma et al., 1996). Estas são peptídeos ativos derivados dos cininogênios pela ação
da calicreína e estão envolvidas em uma série de processos biológicos como: vasodilatação,
broncopulmonar) e metabolismo da glicose (Bhoola, Figueroa et al., 1992), uma vez que
promove aumento na fosforilação do receptor de insulina estimulando a translocação de
GLUT4 para a membrana plasmática (Duka, Shenouda et al., 2001; Henriksen e Jacob, 2003).
Para que essas atividades biológicas aconteçam faz-se necessário a ligação com
Figura 4: Esquema do Sistema Calicreína-Cininas e formação de óxido nítrico. HK: cininogênio de alto peso molecular; LK: cininogênio de baixo peso molecular; CPM/CPN: carboxipeptidases M ou N; Des-Arg9-BK: arginina carboxipeptidase; ECA: enzima conversora de angiotensina; Ca+: cálcio; NOS: óxido nítrico sintase; NO: óxido nítrico. Adaptado de Sharma, Uma et al., 1996; Marcondes e Antunes, 2005.
Uma vez liberada na circulação, as cininas são rapidamente inativadas por um grupo de enzimas chamadas cininases, entre elas estão a cininase I e a II. Estão presentes no plasma, células endoteliais, tecidos, urina e fluídos corporais (Sharma, Uma et al., 1996). A cininase I é o nome genérico dado as carboxipeptidases M ou N (CPM e CPN) que transformam a BK no metabólito des-Arg9-BK mais comumente pelos receptores B1 (Mitsui, Nomura et al., 2004). A cininase II ou enzima conversora de angiotensina (ECA) é a principal enzima responsável pela metabolização de BK em leitos vasculares, produzido no pulmão ela é responsável por inativar a BK no metabólito BK1-5 (Bhoola, Figueroa et al., 1992; Sharma, Uma et al., 1996).
4.4.1. Óxido Nítrico
O NO é um gás difusível e lipossolúvel, envolvido no processo de regulação do sistema cardiovascular, nervoso e imunológico (Zhou e Zhu, 2009). Foi descrito pela primeira
vez como principal mediador da vasodilatação endotélio dependente em 1980 (Furchgott e
Zawadzki, 1980; Palmer, Ferrige et al., 1987), sendo posteriormente encontrado como
importante regulador de várias funções corporais. Em 1998, Robert F. Furchgott, Louis
Ignarro e Ferid Murad foram premiados com o Nobel pela descoberta das propriedades e
sinalização do NO (Gao, 2010) .
Esse gás é basicamente gerado pela ação das NOS na L-arginina (Figura 4). Três
isoformas da NOS são descritas: NOS neuronal (nNOS), NOS indutível (iNOS) e NOS endotelial (eNOS) (Reid, 1998; Govers e Rabelink, 2001). A nNOS foi identificada primeiramente no cérebro, onde é altamente expressa pelos neurônios, além de ser abundante em fibras musculares IIb e coração, sendo o NO derivado da nNOS responsável pela modulação da função neuromuscular e da contratilidade. No sistema nervoso central (SNC), o NO derivado dessa isoforma atua como neurotransmissor envolvido na plasticidade neuronal (formação da memória) (Melikian, Seddon et al., 2009).
produção pode ser importante para os mecanismos de defesa, pois levam à apoptose e/ou necrose de microrganismos. Porém, sua produção crônica e acentuada levam a efeitos patológicos sistêmicos, como por exemplo a resistência à insulina. Shimabukuro, Ohneda et al. (1997) ao investigarem ratos Zucker obesos diabéticos e magros verificaram o papel
citotóxico do NO induzido pelo iNOS por AGLs nas ilhotas pancreáticas. Assim, quando administravam inibidores de iNOS, impediam a sua liberação, reduzia a disfunção e destruição das células β do pâncreas e possível hiperglicemia.
A eNOS está localizada nas cavéolas, onde se liga a proteínas denominadas caveolinas, sendo expressa principalmente na vasculatura endotelial do músculo esquelético, coração, pâncreas e tecido adiposo (Patrice e André, 2004). Em qualquer localização ela promove vasodilatação e disponibilidade de substratos. Nas células endoteliais, mediante a um estímulo da BK ou da acetilcolina e aumento do fluxo de Ca+ para o interior da célula, haverá uma ligação da NOS com o Ca+ e com a calmodulina para a ativação da transformação do aminoácido L-arginina em L-citrulina e NO. Ao difundir-se para as células da musculatura lisa, o NO irá estimular a enzima guanilato ciclase solúvel, resultando no aumento da síntese de cGMP. Este acréscimo é responsável pelo relaxamento dessa musculatura e consequente aumento do diâmetro dos vasos sanguíneos e fluxo de sangue (Moncada e Higgs, 1993; Farrell e Blake, 1996). Tanto a eNOS, quanto a nNOS são dependentes da elevação do Ca+ intracelular, que é fortemente regulada pela calmodulina (Pautz, Art et al., 2010).
No entanto, a mensuração do NO torna-se dificultada, por ser uma molécula com meia-vida curta e por reagir rapidamente com o oxigênio livre, hemoglobina, dentre outros. Assim é realizada normalmente através dos produtos finais de NO, como o nitrito (NO2-) (Moshage, Kok et al., 1995; Guevara, Iwanejko et al., 1998; Calvert, 2011).
4.5. INFLUÊNCIA DAS CITOCINAS NO CONTROLE GLICÊMICO
As citocinas são um grupo de proteínas ativas de baixo peso molecular (8 a 40.000 d.) que possuem atividade autócrina e parácrina (Dinarello, 2000; Alexandraki, Piperi et al., 2006). Existem cerca de 18 citocinas da família interleucina (IL), enquanto que outras mantém a sua descrição biológica original, como o fator de necrose tumoral (TNF). Algumas dessas promovem a inflamação (TNF-α, IL-1 e IL-6), chamadas de pró-inflamatórias, enquanto que outras recebem a denominação de anti-inflamatórias (IL-10 e IL-6) por suprimirem a ação das citadas anteriormente (Dinarello, 2000; Opal e Depalo, 2000).
Quando produzidas localmente, as citocinas pró-inflamatórias exercem efeitos nas células endoteliais promovendo estresse oxidativo e disfunção endotelial. E quando secretadas no tecido adiposo, um órgão endócrino, são denominadas as adipocinas, entre elas a IL-6 e TNF-α. Estas produzem efeitos sobre as ilhotas pancreáticas comprometendo sua função secretora (Alexandraki, Piperi et al., 2006).
A TNF-α é uma citocina pró-inflamatória produzida por macrófagos, linfócitos e em menor quantidade pelo tecido adiposo (Bastard, Maachi et al., 2006) e desempenha um papel importante na mediação de respostas imunes. Ela tem sido considerada uma importante mediadora da resistência à insulina, particularmente relacionada à obesidade (Dyck, Heigenhauser et al., 2006; Mirza, Hossain et al., 2012). De Alvaro, Teruel et al. (2004) verificaram que a resistência à insulina ocasionada pela TNF-α, ocorre mediante uma cascata que gera uma fosforilação em serina do IRS, o que prejudica a ativação de PI3K e Akt e menor translocação de GLUT4.
Em contrapartida, uma terapia anti-TNFα pode contribuir para um melhor controle glicêmico. Gupta-Ganguli, Cox et al. (2011) projetaram um estudo retrospectivo em oito pacientes DM2 que realizavam terapia anti-TNFα para o tratamento de Artrite reumatóide e doença da Crohn e após 10 anos de uso puderam verificar uma redução na glicemia de jejum (142 para 126 mg/dL) e na HbA1c (6,5 para 5,5%). Porém estudos adicionais devem ser feitos para elucidar a utilização dessa terapia.
Além disso, ao se utilizar roedores magros e obesos com interrupção do gene da TNFα, foi observado que essa citocina contribuiu para a redução da sensibilidade à insulina em ratos obesos e mais velhos, porém a sua ausência não é o suficiente para proteger contra a resistência insulínica (Ventre, Doebber et al., 1997).
No entanto, um possível mecanismo constitui a fosforilação em serina do IRS1 e inibição da cascata de sinalização da insulina (Glund e Krook, 2008). Além disso, as citocinas induzem a expressão de proteínas celulares, como membros do supressor de sinalização de citocinas (SOCS), que desempenham um papel negativo na sinalização da insulina (Emanuelli, Peraldi et al., 2000).
Rieusset, Bouzakri et al. (2004) realizaram um estudo com o objetivo de investigar o
papel da IL-6 e do SOCS-3 na resistência à insulina em células musculares de humanos e verificaram que a IL-6 inibe a sinalização de insulina e induz a expressão de SOCS-3. Em DM2 os níveis de SOCS-3 foram significativamente maiores em comparação com o grupo controle e ainda menor absorção de glicose foi observada, o que não ocorreu em obesos não DM2, apesar de semelhantes níveis de IL-6.
Curiosamente, a IL-6 também pode promover a utilização de glicose mediada pela insulina. Através de biopsia muscular, tiras de vasto lateral de humanos foram incubadas com e sem IL-6, assim Glund e Krook (2008) puderam observar aumento no transporte de glicose no músculo esquelético humano após exposição aguda ao IL-6.
Além da sua ação pró-inflamatória, a IL-6 ainda pode suprimir a produção da IL-1 e TNF-α (Starkie, Ostrowski et al., 2003; Steensberg, Fischer et al., 2003; Pedersen, 2007). Não obstante, sabe-se que situações como o EF promovem um aumento de citocinas circulantes. De acordo com Petersen e Pedersen (2004) a cascata de citocinas induzida pelo EF difere da liberada por infecções, indicando vias independentes. Normalmente as pró inflamatórias,
como TNF-α e IL-1, não são liberadas com a contração muscular. Porém as concentrações de IL-6, seguidas por IL-10, aumentam de forma substancial com o EF, mostrando assim o seu efeito anti-inflamatório. Starkie, Ostrowski et al. (2003) verificaram que a IL-6 induzida pelo EF inibe a produção de TNF-α mediada por endotoxemia.
Os aumentos de IL-6 durante o EF depende da massa muscular envolvida, bem como da duração e intensidade. Caso contrário, o aumento dessa poderá ser ausente ou reduzida.
Mas os seus efeitos podem ocorrer mesmo durante a recuperação do EF (Fischer, 2006). Desta forma, existem evidências de que essa liberação de IL-6 durante o EF pode ter propriedades benéficas na estimulação da captação de glicose do músculo esquelético por meio da ativação da AMPK (Pedersen e Febbraio, 2008).
Macdonald, Wojtaszewski et al. (2003) testaram a hipótese de que a liberação de IL-6 durante o exercício pode estar relacionada com a atividade da AMPK, para isso utilizaram oito indivíduos saudáveis que se exercitaram por 60 min a 70% do VO2máx e observaram um