UNIVERSIDADE FEDERAL DA PARAÍBA
CENTRO DE CIÊNCIAS DA SAÚDE
LABORATÓRIO DE TECNOLOGIA FARMACÊUTICA
“PROF. DELBY FERNANDES DE MEDEIROS”
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E
SINTÉTICOS BIOATIVOS
THYAGO MOREIRA DE QUEIROZ
AVALIAÇÃO DA ATIVIDADE VASORRELAXANTE DA ALGA
MARINHA BRASILEIRA Dictyota pulchella Hörnig &
Schnetter EM RATOS NORMOTENSOS
THYAGO MOREIRA DE QUEIROZ
AVALIAÇÃO DA ATIVIDADE VASORRELAXANTE DA ALGA
MARINHA BRASILEIRA Dictyota pulchella Hörnig &
Schnetter EM RATOS NORMOTENSOS
Dissertação apresentada ao Programa de Pós-graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde, Laboratório de Tecnologia Farmacêutica “Prof. Delby Fernandes de Medeiros” da Universidade Federal da Paraíba, como parte dos requisitos para a obtenção do título de MESTRE EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS. Área de concentração: FARMACOLOGIA
Orientador: Prof. Dr. Isac Almeida de Medeiros
Q3a Queiroz, Thyago Moreira de.
Avaliação da atividade vasorrelaxante da alga marinha brasileira Dictyota pulchella Hörning & Schnetter em ratos
normotensos / Thyago Moreira de Queiroz.-- João Pessoa, 2011.
108f. : il.
Orientador: Isac Almeida de Medeiros Dissertação (Mestrado) – UFPB/CCS/LTF
1. Produtos Naturais. 2. Dictyota pulchella. 3. Vasorrelaxa-mento. 4. Artéria mesentérica. 5. Bloqueador de canais Ca²+.
UFPB/BC CDU: 547.9(043)
THYAGO MOREIRA DE QUEIROZ
AVALIAÇÃO DA ATIVIDADE VASORRELAXANTE DA ALGA
MARINHA Dictyota pulchella Hörnig & Schnetter EM
RATOS NORMOTENSOS
Aprovada em ____/____/____
Banca examinadora
_________________________________________________ Prof. Dr. Isac Almeida de Medeiros
(Universidade Federal da Paraíba) Orientador
_________________________________________________ Profª. Drª Êurica Adélia Nogueira Ribeiro
(Universidade Federal de Alagoas) Examinador Externo
_________________________________________________ Prof. Dr. Luis Fernando Marques dos Santos
Eu não sei se você se recorda do seu primeiro caderno, eu me recordo do meu. Com ele eu aprendi muita coisa, foi nele que eu descobri que a experiência dos erros Ela é tão importante quanto às experiências dos acertos
Porque vistos de um jeito certo, os erros,
Eles nos preparam para nossas vitórias e conquistas futuras
Porque não há aprendizado na vida que não passe pelas experiências dos erros O caderno é uma metáfora da vida,
Quando os erros cometidos eram demais, eu me recordo, Que a nossa professora nos sugeria que a gente virasse a página. Era um jeito interessante de descobrir a graça que há nos recomeços.
Ao virar a página, os erros cometidos deixavam de nos incomodar e a partir deles, A gente seguia um pouco mais crescido.
O caderno nos ensina que erros não precisam ser fontes de castigos. Erros podem ser fontes de virtudes!
Na vida é a mesma coisa, o erro tem que estar à serviço do aprendizado; Ele não tem que ser fonte de culpas e vergonhas.
Nenhum ser humano pode ser verdadeiramente grande
sem que seja capaz de reconhecer os erros que cometeu na vida.
Uma coisa é a gente se arrepender do que fez! Outra é a gente se sentir culpado. Culpas nos paralisam. Arrependimentos não!
Eles nos lançam pra frente, nos ajudam a corrigir os erros cometidos. Deus é semelhante ao caderno.
Ele nos permite os erros pra que a gente aprenda a fazer do jeito certo. Você tem errado muito?
Não importa, aceite de Deus essa nova página de vida que tem nome de hoje! Recorde-se das lições do seu primeiro caderno.
Quando os erros são demais, vire a página
Aos meus pais (Mário Queiroz e
Veracélida Queiroz), exemplos de
dedicação e amor, sempre trabalhando arduamente para proporcionarmos mais conforto. Painho, estou certo de que o obstáculo que ultrapassamos foi para fortificarmos ainda mais e para mostrar que de tão grande é o amor que sente por seus filhos, que foram feitas pontes no seu coração, pois não havia mais espaço para tanto. Mainha, com seu amor incondicional, com seu zelo e preocupação, sempre foi capaz de deixar de ser saciada para saciar seus filhos, és um exemplo do que é ser mãe. Amo muito vocês.
Aos meus avós paternos, Amaro Limeira (in memorian) e Maria Queiroz (in
memorian), e maternos João Moreira e
Bernardina Moreira, por todo apoio dado
aos meus pais, contribuindo para minha criação. Aos últimos agradeço, de forma especial, a oportunidade de morar em João Pessoa e contribuir para os estudos nos melhores colégios e cursos.
À minha irmã Veruska, que sempre torceu por mim e vibrou com minhas vitórias. Sempre com palavras de conselhos, ajuda a tornar-me um ser humano melhor.
À DEUS por seu amor incondicional, sempre ao meu lado, percebi que tudo se torna mais fácil quando se tem fé. O dom de viver é muito bom, mas viver na presença DELE é muito melhor.
Ao meu orientador Prof. Isac Almeida de Medeiros por todas as oportunidades oferecidas durante mais de seis anos de laboratório, e mais, por acreditar e confiar na minha vontade de tornar-me um pesquisador. Professor, como o Senhor sempre fala, humildade, curiosidade e persistência são qualidades que um pesquisador deve apresentar, sendo assim, eu as busco constantemente. Muito obrigado por todos os ensinamentos.
À aluna de iniciação científica, Natália Tabosa, sempre presente na execução do nosso trabalho, exemplo de dedicação e esforço, tenho certeza que será uma ótima pesquisadora. Muito obrigado por ajudar a realizar parte do meu sonho.
À “minha comissão de frente” Abrahão Filho, Fabíola Furtado (e família),
Maria do Carmo e Raline dos Anjos, que me ajudaram diretamente na elaboração
deste trabalho, seja em experimentos, discussão de artigos ou em leituras incansáveis deste trabalho. Momentos como esses me confirmaram que posso contar com vocês sempre. Cada um da sua forma, seja ela, alegre, preocupada, sincera e bem humorada, fizeram-me continuar na caminhada e torná-la mais agradável.
À equipe do Laboratório de Farmacologia Cardiovascular: Abrahão filho (Msc), Ana Letícia (IC), Aurylenne Carlos (PhD), Bruna Priscilla (PhD), Camilla Pinheiro (IC), Dayanne Porto (Msc), Fabíola Furtado (PhD), Islânia Araújo (PhD), José George (Msc) , Juliane (IC), Kívia (IC), Leônidas (IC), Maria Angélica (PhD), Maria do Socorro (PhD), Melissa Luciano (PhD), Raline dos Anjos (PhD), Mônica Almeida (Msc), Natália Tabosa (IC), Socorro Cartágenes (PhD), Thais Josy (PhD), Thais Porto (PhD), Valéria Assis (Msc), e aos professores Darízy Flávia, Jacicarlos Alencar, Katy Lísias, Nadja Correia, Robson Veras e Valdir
Braga por toda a ajuda, pela partilha de conhecimentos e pela paciência com meus
momentos de intempestividade, principalmente neste último ano.
prontamente me aceitou para esse novo desafio e tem me ajudado bastante para que eu consiga dar mais um paço nessa longa caminhada.
À Professora e tia Drª. Suely Galdino pelos conselhos sempre muito sábios e pela indicação do Professor Isac para minha orientação. Com certeza, considerá-la como Tia, foi de grande importância para minha aceitação como aluno de IC. A Senhora é um exemplo de profissional e pesquisadora a ser seguido.
Aos professores Darízy Flávia Vasconcelos, Robson Veras, Katy Lísias e
Nadja Corrêa, que fazem parte do laboratório de Farmacologia Cardiovascular,
pelas discussões e ensinamentos e por estar certo de que posso contar com eles, independente de suas ocupações.
À Aldeídia Oliveira, Êurica Nogueira, Robson Veras, Islânia Araújo,
Darízy Flávia, Karla Costa, Raline dos Anjos e Katy Lisias que foram muito importantes durante minha iniciação científica, tornando-os exemplos na minha caminhada para a Pós-graduação.
À grande turma do mestrado, Aline Xavier, Augusto Souto, Amanda
Bezerra, Camila Montenegro, Gedson Rodrigues, Isis Fernandes, Ana Silvia,
Mônica Almeida, Raquel Bezerra, Jocelmo, Lázaro Brito, Ingrid Melo, Maria do
Socorro, Luciana, Rafael Travassos, Hariad Ribeiro, Mônica Lorena, Paula e
Yanna.
A duas pessoas especiais, Juliana Brandi e Jaime Ribeiro que doaram o sangue para meu pai. Amigos, esse gesto tão simples e grandioso eu não tenho palavras pra agradecer. Vocês estão indo fazer doutorado fora, mas saibam que nunca esquecerei aquele momento. Muito sucesso pra vocês.
As grandes amigas Camila Figueiredo, Karine Queiroga, Kelly Lira, Hellane Fabrícia e Priscilla Neris por todo carinho, amizade, por todo o estímulo que me deram nessa jornada, que sempre me apoiaram e me deram força tanto fora como dentro do LTF.
Aos professores da graduação por toda a minha formação, os quais possibilitaram à minha chegada até aqui, em especial à Rossana Souto Maior por ter me iniciado nos projetos de extensão, onde pude conviver com realidades diferentes, e aprender muito mais que ensinar. E a professora Leônia Maria Batista,
À todos que fizeram o PET-FARMÁCIA, Ana Paula, Bruno Vinicius, Carla Carreiro, Diego Dantas, Jacqueline Alves, Larissa Bakke, Mayrielle, Nathália
Martins, Renata Leite e Sabrina Melo. À querida Ivoneide e a professora Leônia
Batista. Durante 18 meses fiz parte desse grupo, aprendi bastante; levarei os ensinamentos por toda minha vida.
À todos do projeto de Monitoração de Propaganda da ANVISA, uma excelente contribuição para minha formação acadêmica.
Aos amigos da graduação Aline Muriel, Camila Montenegro, Bruno
Vinicius, Juliana Queiroga, Flavia Fonseca, Gedson Rodrigues, Hyale da Cunha
e Rafael Travassos (apelidados de “os legais”), aos grandes amigos Bruno Rolim,
Caio Matias e Leonardo Beserra, que me faziam sair da rotina, mesmo nos
momentos de grande tensão. E aos meus companheiros das análises João Carlos
Pita e Rubens Batista. Amigos, apesar da diversidade de caminhos seguidos
sempre lembrarei de vocês. Vocês simplificaram a Farmácia.
Aos amigos André Clementino, Felipe Cajueiro, Rafael Mendes, Marina
Domingues, Cecília Vitorino, Raquel Kelly, Família Colaço, Isabela Fernandes,
Juliana Moura, Marcus Vale, Pollyana Henrique, Indiara, Carol Lianza, Aline
Coutinho, Daniele e Fernanda Farias por todos os momentos alegres que me
proporcionaram fora das dependências do LTF , ajudando-me à atravessar as barreiras que a vida nos apronta.
À equipe do Laboratório de Farmacologia Funcional da Profa. Bagnólia, por ser uma extensão do nosso, sempre solícitos quando requisitados.
Aos professores José Maria Barbosa, Josean Fechine e à aluna de doutorado Camila Figueiredo, pela grande presteza de obter e ceder as substâncias para este estudo.
A todos os professores do mestrado, Demétrius Machado, José Maria
Barbosa, Celidarque Dias, Luis Cezar, Reinaldo Nóbrega, Margareth Diniz,
Mariana Nóbrega, Isac Medeiros, Bagnólia Silva, Luis Fernando, Márcia
Piuvezan, Cláudio Bezerra, Rui Macedo.
A Crispim Duarte, por seu grande trabalho desempenhado junto ao Biotério
e pelo suporte imenso ofertado a todos que fazem parte do LTF.
Aos funcionários Luiz Cordeiro, Adriano Cordeiro, Maria e Mônica
A Sócrates Golzio, TâniaMaria, Carol Mangueira e aos professores Maria
de Fátima Agra e Josean Fechine pelo grande trabalho desempenhado, que
contribui para o crescimento da nossa pós-graduação. Bem como a Hélia (PRPG) por sua grande ajuda que temos na Reitoria, sempre solícita para os assuntos buracráticos.
À todos que fazem o PgPNSB e o LTF.
Ao CNPq e CAPES pelo apoio financeiro e pelo portal de periódicos CAPES.
Avaliação da atividade vasorrelaxante da alga marinha brasileira Dictyota pulchella Hörnig &
Schnetter em ratos normotensos. QUEIROZ, T. M.; Dissertação de Mestrado, Programa de pós-graduação em Produtos Naturais e Sintéticos Bioativos, PgPNSB/CCS/UFPB (2011)
RESUMO
Os efeitos farmacológicos do extrato CH2Cl2:MeOH (EDP) e fase Hexano:AcOEt
(FDP) da alga marinha brasileira Dictyota pulchella foram estudados sobre o sistema cardiovascular de ratos, utilizando uma abordagem in vivo e in vitro. Em ratos normotensos não anestesiados, EDP (5; 10; 20 e 40 mg/kg, i.v., randomicamente) promoveu hipotensão (-4,1 ± 1,34; -7,0 ± 2,4; -46,9 ± 1,3 e -54,8 ± 4,3%, respectivamente) acompanhada de bradicardia (2,1 ± 1,6; 4,0 ± 2,3; 66,8 ± 5,2 e -74,7 ± 4,5%, respectivamente) (n=5). Em anéis de artéria mesentérica superior isolada de rato pré-contraídos com Fenilefrina (FEN) 1 µM, EDP (0,01 – 500 µg/mL) promoveu um efeito vasorrelaxante dependente de concentração na presença do endotélio vascular (Emáx = 101,4 ± 4,5%; CE50 = 22,35 ± 5,09 µg/mL), e este efeito
não foi alterado após a remoção do endotélio (Emáx = 103,3 ± 8,3%; CE50 = 21,43 ±
8,98 µg/mL) (n=7). Resultados semelhantes foram obtidos na presença de FDP (0,01 – 500 µg/mL), observando-se um vasorrelaxamento tanto na presença (Emáx =
80,6 ± 5,8%; CE50 = 24,1 ± 8,9 µg/mL), quanto na ausência do endotélio funcional
(Emáx = 95,6 ± 7,5%; CE50 = 23,70 ± 5,65 mg/mL). Para avaliar se o efeito de EDP
era dependente do tônus vascular, este extrato foi testado no tônus basal, na presença ou ausência do endotélio, demonstrando que a resposta não foi alterada em nenhuma das duas situações. Baseado nos resultados preliminares, os experimentos subseqüentes foram realizados com endotélio desnudo. Para avaliar a participação dos canais para potássio (K+), utilizou-se uma solução com 20 mM de KCl ou tetraetilâmonio (TEA) 3 mM. Em ambas as preparações (Emáx = 102,3 ±
4,8%; CE50 = 25,40 ± 6,05 µg/mL) ou (Emáx = 111,2 ± 5,3%; CE50 = 16,70 ± 3,61
µg/mL) (n=7), respectivamente, a atividade vasorrelaxante de EDP não foi alterada. Na presença de outro agente contracturante, U46619 (100 nM), EDP promoveu um efeito vasorrelaxante (Emáx = 90,3 ± 7,8%; CE50 = 24,63 ± 4,04 µg/mL) de maneira
similar aos anéis pré-contraídos com FEN. Em experimentos contendo uma solução despolarizante de 60 mM de KCl, EDP causou vasorrelaxamento dependente de concentração (Emáx = 97,7 ± 4,0%; CE50 = 34,57 ± 5,11 mg/mL; n=6). Na mesma
condição experimental, FDP também promoveu um efeito vasorrelaxante (Emáx =
113,5 ± 6,1%; CE50 = 10,92 ± 2,81 µg/mL; n=6), não havendo diferença significante,
para os dois compostos, quando comparados aos anéis pré-contraídos com FEN. Sugere-se que tanto EDP quanto FDP atuem sobre os canais para cálcio sensíveis a voltagem (Cav). Além disso, EDP e FDP (0,03; 0,3; 10; 30 e 100 µg/mL)
antagonizaram as contrações induzidas por CaCl2. O extrato ainda produziu
vasorrelaxamento na presença de um agonista de canais para Ca2+ tipo-L (Bay K 8644; 200 nM) (Emáx = 113,3 ± 6,7% e CE50 = 19,45 ± 6,66 µg/mL, n=7). Esses
resultados sugerem que EDP produz hipotensão e bradicardia transientes, e tanto EDP quanto FDP promovem vasorrelaxamento independente do endotélio vascular por inibição do influxo de Ca2+, por meio do bloqueio dos Ca
v.
Palavras-chave: Dictyota pulchella. Vasorrelaxamento. Artéria mesentérica.
Evaluation of vasorelaxant activity from brazilian marine algae Dictyota pulchella Hörnig &
Schnetter in normotensive rats. QUEIROZ, T. M.; Dissertação de Mestrado, Programa de pós-graduação em Produtos Naturais e Sintéticos Bioativos, PgPNSB/CCS/UFPB (2011)
ABSTRACT
The pharmacological effects induced by CH2Cl2/MeOH extract (EDP) and
Hexane/EtOAc phase (FDP) from the Brazilian alga Dictyota pulchella were studied on the cardiovascular system of Wistar rats using a combined in vivo and in vitro approach. All protocols in this study were approved by the CEPA/LTF (protocol nº 0208/10). In normotensive conscious male rats, EDP injections (5; 10; 20 and 40 mg/kg, i.v., randomly) produced hypotension (4.1 ± 1.34; 7.0 ± 2.4; 46.9 ± 1.3 and 54.8 ± 4.3%; respectively) and bradycardia (2.1 ± 1.6; 4.0 ± 2.3; 66.8 ± 5.2 and -74.7 ± 4.5%; respectively) (n=5). Isolated superior mesenteric artery rings (1-2 mm) were suspended by cotton threads for isometric tension recordings in a Tyrode’s solution at 37 ºC, gassed with a 95% O2 and 5% CO2, under a resting tension of
0.75g. In phenylephrine (Phe, 1µM)-pre-contracted rings, EDP (0.01 – 500 µg/mL) induced a concentration-dependent relaxation (Maximum Response= 101.4 ± 4.5%; EC50 = 22.35 ± 5.09 µg/mL) and this effect was not modified by removal of the
vascular endothelium (MR = 103.3 ± 8.3%; EC50 = 21.43 ± 8.98 µg/mL, n=7). Similar
results were found in the presence of FDP (0.01 – 500 µg/mL). FDP induced a concentration-dependent vasodilatation in both endothelium-intact (MR= 80.6 ± 5.8%; EC50 = 24.1 ± 8.95 µg/mL, n=6) or endothelium-denuded mesenteric artery
rings (MR = 95.6 ± 7.5%; EC50 = 23.7 ± 5.65 µg/mL, n=6). Based on the preliminary
results, the subsequent experiments were performed in rings without endothelium. To appreciate the involvement of potassium channels, the preparations were pre-incubated with Tyrode’s modified solution, KCl (20 mM) or with non-selective K+
channel blocker, tetraethylammonium (TEA, 3 mM). In both preparations the vasorelaxant activity was not changed. In the presence of a tromboxane A2 agonist
U-46619 (100 nM), EDP induced concentration-dependent vasodilatation (MR= 90.3 ± 7.8%; EC50 = 24.63 ± 4.04 µg/mL, n=6) was similar to the response found under
Phe-induced. After exposure to high concentrations of extracellular K+ (KCl, 60 mM), the EDP induced concentration-dependent vasodilatation (MR = 97.7 ± 4.0%; EC50 =
34.57 ± 5.11 mg/mL; n=6). In the same experimental condition, FDP induced concentration-dependent vasodilatation (MR = 113.5 ± 6.1%; EC50 = 10.92 ± 2.81
µg/mL; n=6). This result indicates that both EDP and FDP act on voltage-operated calcium channel (Cav). Furthermore, EDP and FDP (0.03; 0.3; 10; 30 e 100 µg/mL)
antagonized CaCl2-induced contractions. The extract also induced vasodilatation in
the contraction evoked by L-type Ca2+ channel agonist (Bay K 8644, 200 nM) (MR= 113.3 ± 6.7%; EC50 = 19.45 ± 6.66 µg/mL, n=7). These results suggest that EDP
induces hypotension and bradycardia. Both EDP and FDP induce endothelium-independent vasodilatation that involves the inhibition of the Ca2+ influx through blockade of Cav.
LISTA DE FIGURAS
Figura 1 - Representação esquemática do canal de cálcio operado por voltagem (CaV)... 32
Figura 2 - Representação esquemática do mecanismo de contração na célula
muscular lisa vascular... 33
Figura 3 - Diterpenos isolados da alga Dictyota pulchella... 38
Figura 4 - Representações esquemáticas dos vasos aonde foram implantados os
cateteres para o registro dos parâmetros cardiovasculares e administração das drogas... 48
Figura 5 - Sistema de aquisição de dados para medida de PA e FC em ratos acordados... 49
Figura 6 - Representação esquemática do protocolo experimental para avaliação do
efeito de EDP sobre PAM e FC em ratos normotensos acordados... 49
Figura 7 - Sistema de cubas e aquisição de dados de tensão isométrica para órgão
isolado... 51
Figura 8 - Representação da verificação da viabilidade do órgão e da integridade do
endotélio vascular. A) Ausência do endotélio e B) Presença do endotélio funcional... 52
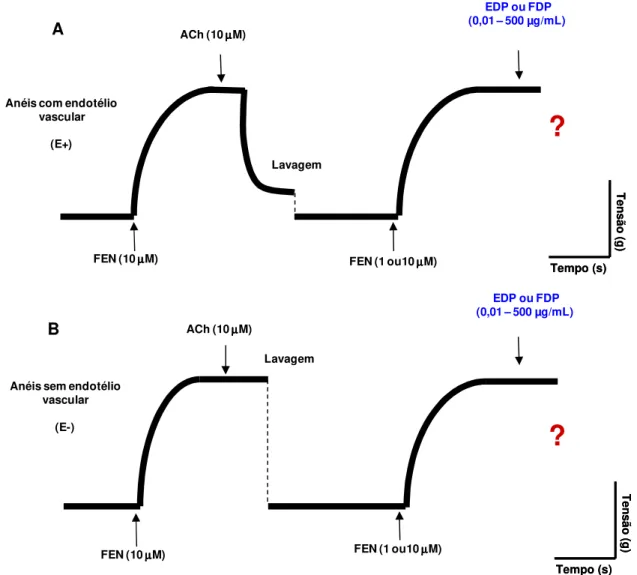
Figura 9 - Representação esquemática do protocolo experimental para avaliação dos efeitos de EDP e FDP (0,01 - 500 µg/mL) em anéis de artéria mesentérica superior isolada de rato, pré-contraídos com FEN (1 ou 10 µM). A) Anéis com endotélio intacto; B) Anéis sem endotélio... 53
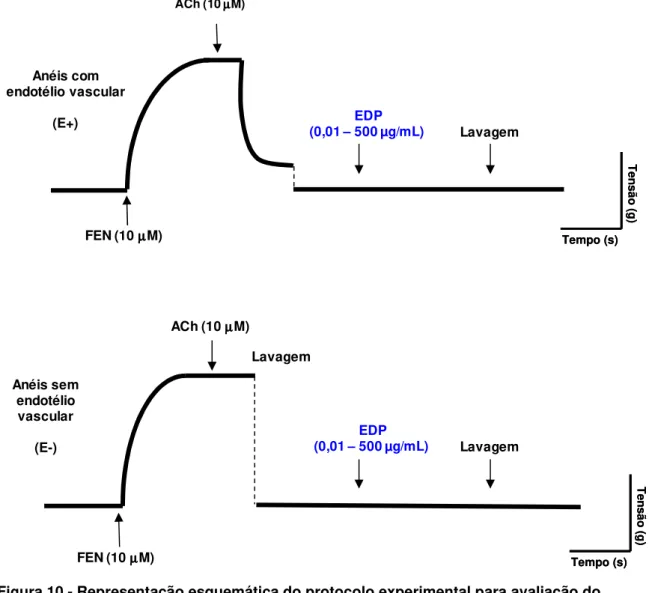
Figura 10 - Representação esquemática do protocolo experimental para avaliação
do efeito de EDP (0,01 - 500 µg/mL, ambos) em anéis de artéria mesentérica superior isolada de rato, sobre o tônus intrínseco vascular. A) Anéis com endotélio intacto; B) Anéis sem endotélio... 54
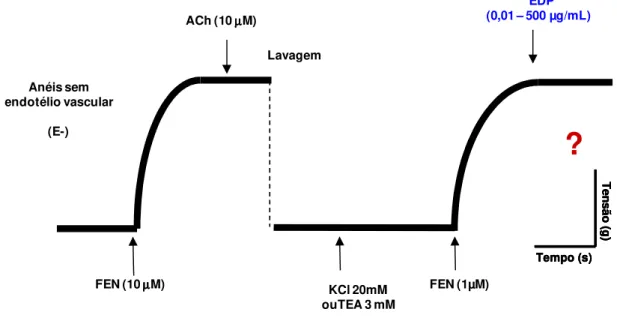
Figura 11 - Representação esquemática do protocolo experimental para avaliação
da participação de canais para K+ na resposta vasorrelaxante induzida por EDP (0,01 – 500 µg/mL) em anéis de artéria mesentérica superior isolada de rato... 56
Figura 12 - Representação esquemática do protocolo experimental para avaliação
do efeito de EDP (0,01 - 500 µg/mL) em anéis de artéria mesentérica superior isolada de rato, pré-contraídos com U 46619 (100 nM)... 57
Figura 13 - Representação esquemática do protocolo experimental para avaliação
solução despolarizante (KCl 60 mM)... 58
Figura 14 - Representação esquemática do protocolo experimental para avaliação
dos efeitos de EDP e FDP (0,03; 0,3; 10; 30 e 100 µg/mL, ambos) sobre as contrações induzidas por concentrações cumulativas de CaCl2 (10-6 – 3 x 10-2) em
meio despolarizante (KCl 60 mM) nominalmente sem cálcio... 59
Figura 15 - Representação esquemática do protocolo experimental para avaliação
do efeito de EDP (0,01 - 500 µg/mL) em anéis de artéria mesentérica superior isolada de rato, pré-contraídos com S(-)-Bay K 8644 (200 nM)... 60
Figura 16 - Registro original representativo ilustrando o efeito do veículo ou de doses crescentes de EDP (5; 10; 20 e 40 mg/kg) sobre: A) Pressão de Pulso B) Pressão Arterial Média (PAM) e C) Frequência Cardíaca (FC) em ratos normotensos não anestesiados. As setas mostram o momento da administração de EDP... 63
Figura 17 - Registros originais das resposta de EDP (0,01 – 500 µg/mL) em anéis
pré-contraídos com FEN (10 µM) com o endotélio intacto (A) ou após sua remoção (B)... 66
Figura 18 - Registros originais das resposta de FDP (0,01 – 500 µg/mL) em anéis
LISTA DE GRÁFICOS
Gráfico 1 - Efeitos de EDP (5; 10; 20 e 40 mg/kg) sobre: A) Pressão Arterial Média
(PAM) e B) Frequência Cardíaca (FC) em ratos normotensos não anestesiados (n=5)... 64
Gráfico 2 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por
EDP (0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos com endotélio intacto (▲) ou endotélio ausente (□), pré-contraídos com FEN (10 µM) (n=6)... 67
Gráfico 3 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por
EDP (0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos com endotélio intacto (▲) ou endotélio ausente (□), pré-contraídos com FEN (1 µM) (n=6)... 67
Gráfico 4 - Efeito de EDP (0,01 – 500 µg/mL) sobre o tônus basal em anéis da artéria de artéria mesentérica superior isolada de ratos com endotélio intacto (■) ou
endotélio ausente (□), (n= 6)... 68
Gráfico 5 - Curvas concentração-resposta para o efeito relaxante induzido por EDP
(0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou na presença de 20 mM de KCl (▲) (n= 7)... 69
Gráfico 6 - Curvas concentração-resposta para o efeito relaxante induzido por EDP
(0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou na presença de TEA 3 mM (▲) (n= 7). Os valores estão expressos com média ± e.p.m... 70
Gráfico 7 - Curvas concentração-resposta para o efeito relaxante induzido por EDP
(0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou pré-contraídos com U 46619 (100 nM) (▲) (n= 7)... 71
Gráfico 8 - Curvas concentração-resposta para o efeito relaxante induzido por EDP
(0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou pré-contraídos com 60 mM de KCl (●) (n= 6)... 72
Gráfico 9 - Efeito de EDP frente às curvas concentrações-resposta cumulativas de
CaCl2 (10-6 – 10-2) em meio despolarizante nominalmente sem Ca+2 em anéis de artéria mesentérica superior isolada de rato (n = 6). Curva controle (■) e na
presença de concentrações isoladas de EDP (em µg/mL): 0,03 (●); 0,3 (▼); 10 (∆); 30 (◊) e 100 (x), *p<0,05 ([EDP] versus controle)... 73
EDP (0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou pré-contraídos com S(-)-Bay K 8644 na presença de 20 mM de KCl (▲) (n= 7)... 74
Gráfico 11 - Curvas concentração-resposta para o efeito relaxante induzido por FDP (0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos com endotélio intacto (▼) (n=6) ou endotélio ausente (□) (n=7), pré-contraídos com FEN (1 µM)... 77
Gráfico 12 - Curvas concentração-resposta para o efeito relaxante induzido por FDP (0,01 – 500 µg/mL) em anéis da artéria de artéria mesentérica superior isolada de ratos sem endotélio, pré-contraídos com FEN (1 µM) (□) ou pré-contraídos com KCl 60 mM (●) (n= 7)... 78
Gráfico 13 - Efeito de FDP frente às curvas concentrações-resposta cumulativas de
CaCl2 (10-6 – 10-2) em meio despolarizante nominalmente sem Ca+2 em anéis de
artéria mesentérica superior isolada de rato (n = 6). Curva controle (■) e na
LISTA DE QUADROS
Quadro 1 – Composição da solução de Tyrode para artéria mesentérica... 44
Quadro 2 – Composição da solução de Tyrode nominalmente sem cálcio... 44
Quadro 3 – Composição da solução de Tyrode livre de cálcio... 44
Quadro 4 – Composição da solução de Tyrode com KCl a 20 mM... 45
Quadro 5 – Composição da solução de Tyrode com KCl a 60 mM... 45
LISTA DE ABREVIATURAS E SIGLAS
ACh Acetilcolina
[Ca2+] Concentração de cálcio
[Ca2+]
i Concentração de cálcio intracelular
(Ca2+)
4-CaM Quatro íons Ca2+ ligados a uma molécula de calmodulina
[K+] Concentração do íon potássio
ANOVA Análise de variância
Bay K 8644 S(-)-Bay K 8644
bpm Batimento por minuto
Cav Canais de cálcio sensíveis a voltagem
CE50 Concentração da droga que produz 50% do efeito máximo
CMLV Células musculares lisas vasculares
DAG Diacilglicerol
DC Débito cardíaco
DCV Doenças cardiovasculares
DMSO Dimetilsulfóxido
e.p.m. Erro padrão da média
EB Extrato bruto
EDHF Fator hiperpolarizante derivado do endotélio
EDP Extrato CH2Cl2: MeOH de Dictyota pulchella
EGTA Ácido tetracético (N,N,N´,N´) bis (beta amino etil éter)
etilenoglicol
Emáx Efeito máximo
ET-1 Endotelina-1
FC Frequência cardíaca
FDP Fase hexano:acetato (90:10) de Dictyota pulchella FEN Fenilefrina
i.p. Intraperitoneal
IP3 1,4,5 - trifosfato de inositol
KCa Canais para K+ sensíveis ao Ca2+
KCl 20 mM Solução de Tyrode com [KCl] a 20 mM
KCl 80 mM Solução de Tyrode com [KCl] a 80 mM
Kv Canais para K+ sensíveis à voltagem
LTF Laboratório de Tecnologia Farmacêutica
MLC Cadeia leve da miosina
MLCK Cinase da cadeia leve da miosina
MLCP Fosfatase da cadeia leve da miosina
MSCC Canais de cálcio mecanosensíveis
MYPT1 Subunidade regulatória da MLCP
n Número de experimentos
NO Óxido nítrico
NPS Nitroprussiato de sódio
O-2 Espécie reativa de oxigênio
OMS Organização mundial da saúde
p Significância Estatística
PA Pressão arterial
PAM
PE
Pressão arterial média Polietileno
PGI2 Prostaciclina
PIP2 Fosfatidil-inositol 4,5 bifosfato
PKC Proteína cinase C
PLC Fosfolipase C
ROC Canal operado por receptor
rpm Rotação por minuto
SOCs Canais de cálcio operados por estoques
TEA Brometo de tetraetilamônio
TRPs Canais potenciais receptores transientes
TXA2 Tromboxano A2
U 46619 9,11-dideoxi-11α,9α-epoximetano prostaglandina F2α
UFPB Universidade Federal da Paraíba
SUMÁRIO
1 INTRODUÇÃO ... 28
2 OBJETIVOS ... 40
2.1 Geral ... 40
2.2 Específicos ... 40
2.2.1 Testes in vivo ... 40
2.2.2 Testes in vitro ... 40
3 MATERIAL ... 42
3.1 Animais ... 42
3.2 Drogas ... 42
3.3 Obtenção e preparação das drogas teste ... 43
3.4 Soluções fisiológicas ... 43
4. MÉTODOS ... 47
4.1 Ensaios Farmacológicos para estudos in vivo ... 47
4.1.1 Implantação de cateteres vasculares para medida direta de
PAM e FC ... 47
4.1.2 Avaliação do efeito da administração aguda de EDP sobre
PAM e FC em ratos normotensos não anestesiados ... 48
4.2 Ensaios farmacológicos para estudos in vitro... 50
4.2.1 Ensaios farmacológicos utilizando anéis de artéria mesentérica
4.2.2 Protocolos experimentais utilizando anéis de artéria
mesentérica superior isolada de ratos ... 51
4.2.3 Avaliação do efeito de EDP ou FDP em anéis de artéria
mesentérica isolada de rato pré-contraídos com FEN ... 52
4.2.4 Investigação do efeito de EDP em anéis de artéria mesentérica
isolada de rato sobre o tônus intrínseco vascular ... 54
4.2.5 Avaliação da participação de canais para potássio (K+) na
resposta vasorrelaxante induzida por EDP em anéis de artéria mesentérica
isolada de rato ... 55
4.2.6 Avaliação do efeito de EDP em anéis de artéria mesentérica
superior isolada de rato pré-contraídos com U46619 ... 56
4.2.7 Avaliação do efeito de EDP em anéis de artéria mesentérica
superior isolada de rato pré-contraídos com solução despolarizante de 60
mM de KCl... 57
4.2.8 Avaliação do efeito de EDP ou FDP sobre as concentrações
induzidas por CaCl2 em anéis de artéria mesentérica superior isolada de
rato ... 58
4.2.9 Avaliação do efeito de EDP sobre as concentrações induzidas
por S(-)- Bay K 8644 em anéis de artéria mesentérica isoladas de ratos ... 59
4.3 Análise estatística... 60
5 RESULTADOS ... 62
5.1 Resultados do Extrato CH2Cl2:MeOH de Dictyota pulchella (EDP) ... 62
5.1.1 Resultados in vivo ... 62
anestesiados ... 62
5.1.2 Resultados in vitro ... 65
5.1.2.1 Efeito de EDP em anéis de artéria mesentérica isolada de
rato pré-contraídos com FEN (1 e 10 µM) ... 65
5.1.2.2 Efeito de EDP em anéis de artéria mesentérica isolada de
rato sobre o tônus intrínseco vascular ... 68
5.1.2.3 Efeito de EDP em anéis de artéria mesentérica superior
isolada de rato pré-contraídos com FEN na presença de 20 mM de KCl ou
de TEA ... 68
5.1.2.4 Efeito de EDP em anéis de artéria mesentérica superior
isolada de rato pré-contraídos com U46619 ... 70
5.1.2.5 Efeito de EDP em anéis de artéria mesentérica superior
isolada de rato pré-contraídos com solução despolarizante de 60 mM de
KCl ... 71
5.1.2.6 Efeito de EDP sobre as concentrações induzidas por CaCl2
em anéis de artéria mesentérica superior isolada de rato ... 72
5.2.1.7 Efeito de EDP sobre as concentrações induzidas por S(-)-
Bay K 8644 em anéis de artéria mesentérica isoladas de ratos ... 74
5.2 Resultados da fase hexano:acetato (90:10) de Dictyota pulchella
(FDP) ... 75
5.2.1 Resultados in vitro ... 75
5.2.1.1 Efeito de FDP em anéis de artéria mesentérica isolada de
rato pré-contraídos com FEN (1 µM) ... 75
isolada de rato pré-contraídos com solução despolarizante de 60 mM de
KCl ... 77
5.2.1.3 Efeito de FDP sobre as concentrações induzidas por CaCl2
em anéis de artéria mesentérica superior isolada de rato ... 78
6 DISCUSSÃO ... 82
7 CONCLUSÕES ... 90
8 PERSPECTIVAS ... 92
REFERÊNCIAS ... 94
QUEIROZ, T. M. 28 1 INTRODUÇÃO
O sistema cardiovascular é o principal sistema responsável pela regulação e manutenção da pressão arterial (PA) (CAMPAGNOLE-SANTOS; HAIBARA, 2001), sendo a pressão arterial média (PAM) o produto do débito cardíaco (DC) pela resistência vascular periférica total (RVPT), expressa pela seguinte equação: PAM = DC x RVPT. O DC é definido pelo volume de sangue bombeado pelo coração por unidade de tempo e é determinado pelo volume de ejeção sistólica (VES) e frequência cardíaca (FC), expressa pela equação DC = VES x FC (OATES; apud HARDMAN et al., 1996).
As doenças cardiovasculares (DCV) compreendem um grupo de doenças do coração (cardiomiopatia, disfunção isquêmica do coração, insuficiência cardíaca congestiva) e dos vasos sanguíneos (doença arterial coronariana, hipertensão e aterosclerose) (KUMAR; SINGH; BAKER, 2007), sendo as principais causas de morbimortalidade no mundo (HAJJAR, KOTCHEN, KOTCHEN, 2006; NOGUEIRA, 2010). Estas são responsáveis por uma alta frequência de internações, ocasionando custos médicos e socioeconômicos elevados (SOCIEDADE BRASILEIRA DE HIPERTENSÃO, 2010).
A sociedade moderna apresenta hábitos de vida que desencadeiam o surgimento de enfermidades que favorecem as incidências de doenças crônicas, resultando em comprometimento de órgãos nobres e interferindo na qualidade, na estimativa de vida e saúde da população (DREXLER; HORNIG, 1999). Estas enfermidades têm como fatores de risco uma má qualidade de vida, abrangendo o estresse, maus hábitos alimentares, sedentarismo, fumo, álcool e obesidade (SCHENCK-GUSTAFSSON, 2009).
Estudos mostram que a prevenção desses fatores de risco em jovens pode ser a chave para um envelhecimento bem sucedido, e destacam a necessidade de esforços intensivos de prevenção em indivíduos jovens e de meia idade, uma vez que combater estes fatores aumenta o tempo de vida saudável, fazendo com que haja uma regressão dos fatores que culminam em alterações no sistema cardiovascular (LLOYD-JONES et al., 2010)
QUEIROZ, T. M. 29
independente (SOCIEDADE BRASILEIRA DE HIPERTENSÃO, 2010). De acordo com dados do Ministério da Saúde, a hipertensão arterial se destaca entre as doenças crônicas não transmissíveis, com característica multifatorial, multicausal e assintomática (BRASIL, 2002).
Com o intuito de controlar os níveis da PAM e evitar a instalação da hipertensão arterial, o organismo possui sistemas de controle integrados como: o sistema neural, representado pelos barorreceptores, quimiorreceptores e receptores cardiopulmonares, que respondem rapidamente às modificações na pressão arterial, sendo responsável pelo controle a curto prazo (HEYMANS; NEIL, 1958); o sistema renal, que pode ser representado pelo controle a longo prazo e é determinado pelo balanço hídrico dos fluidos corporais (INOUE et al., 2006), e o controle hormonal, representado pelo sistema renina-angiotensina-aldosterona (SRAA) (CONTRERAS et al., 2003), o sistema endócrino exerce uma importante participação com ativação e liberação de hormônios que vão interferir sistemicamente na modulação da PA, como por exemplo o sistema simpático (adrenalina e noradrenalina) (LI et al., 2008), hormônio antidiurético e mecanismos intrínsecos do sistema cardiovascular, onde se destacam substâncias vasoativas produzidas localmente pelo endotélio (ações autócrinas e parácrinas) que contribui com a homeostase vascular (EVORA et al., 1995, GROSS; AIRD, 2000).
As células endoteliais fazem parte da camada íntima dos vasos sanguíneos. Estes são anatomicamente divididos em três camadas, da mais externa para mais interna: adventícia, média e íntima. O endotélio regula a camada de células musculares lisas (camada média) e o diâmetro dos vasos, por meio de mudanças na resistência vascular, que estão sob um balanço preciso entre contração e relaxamento dos vasos sanguíneos. Este balanço acontece devido à produção e liberação de fatores vasoativos (FURCHGOTT; ZAWADZKI, 1980; FURCHGOTT; VANHOUTTE, 1989; KIM et al., 2011). Dentre estes fatores compreendem-se as substâncias vasodilatadoras como: óxido nítrico (NO) (PALMER; FERRIGE; MONCADA, 1987), prostaciclinas (MONCADA; VANE, 1978) e fator hiperpolarizante derivado do endotélio (EDHF) (FÉLÉTOU; VANHOUTTE, 2007; KIM et al., 2011), bem como substâncias vasoconstritoras como a endotelina-1, tromboxano A2 e espécies
QUEIROZ, T. M. 30
Pesquisas têm demonstrado que a camada adventícia, até então considerada apenas como um suporte estrutural, também exerce efeito modulador sobre a regulação do tônus vascular. Esta camada é a fonte primária de O2-, devido à presença da enzima NADP(H) oxidase, uma espécie
reativa de oxigênio capaz de sequestrar NO, diminuindo sua disponibilidade e ação. De acordo com Somoza (2005) a ativação dos receptores de angiotensina AT2 na adventícia induz a liberação de NO no endotélio. Desta
forma, esta camada é responsável pela modulação da RVP em resposta a angiotensina II devido a um balanço entre NO e O2- (SOMOZA et al., 2005).
A RVP é um parâmetro que está constantemente alterado durante a hipertensão arterial, sendo determinada principalmente pela parte distal da vasculatura arterial (vasos de resistência), que inclui as pequenas artérias e arteríolas (as artérias que levam até os capilares). Evidências têm indicado que o aumento da resistência periférica é devido, em parte, ao estreitamento dos vasos de resistência e redução do número de arteríolas, um processo conhecido como “rarefaction” (CHRISTENSEN, MULVANY, 2001; MULVANY, 2002).
A regulação da RVP é dependente de um equilíbrio entre as substâncias vasodilatadoras e vasoconstritoras, liberadas por estímulos variados, tais como: hormônios circulantes, neurotransmissores e sinais elétricos e/ou mecânicos (JACKSON, 2000; CRIBBS, 2006). Todos estes sinais são integrados no miócito vascular para determinar o estado contrátil do músculo, estabelecendo, assim, o diâmetro e a resistência dos vasos sanguíneos (JACKSON, 2000).
Estudos mostram que o estado de contratilidade vascular das células musculares lisas (CMLV) dos vasos sanguíneos pode ser regulado pela concentração de cálcio intracelular ([Ca2+]
i). Os agentes vasoconstritores agem
elevando a [Ca2+]
i, bem como, aumentando a aparente sensibilidade ao Ca2+
dos processos contráteis na célula muscular lisa. Por outro lado, as substâncias vasodilatadoras exercem efeitos opostos na [Ca2+]i (LEDOUX et
al., 2006).
O aumento da [Ca2+]i pode ser alcançado por meio de ligação de um
agonista a um receptor α1-adrenérgico que está acoplado à proteína G,
QUEIROZ, T. M. 31
influxo de Ca2+ do fluido extracelular. Assim, a ativação da fosfolipase C (PLC)
e formação de 1,4,5-trifosfato de inositol (IP3) medeiam primariamente a
liberação do Ca2+ dos estoques após uma ativação do receptor α
1-adrenérgico
(BERRIDGE, 2003; VILLALBA et al., 2007). No entanto, em vários vasos de resistência, a liberação sustentada da [Ca2+]
i é gerada por meio da entrada de
Ca2+ a partir do meio extracelular, induzida por agonista, através dos canais
dependentes de voltagem (CaV): tipo-L sensíveis a dihidropiridinas e tipo-T,
como também dos canais não ativados por voltagem (“non-voltage-gated”) que incluem os canais de Ca2+ operados por estoques (SOC) e os canais de Ca2+ operados por receptor (ROC) (MCFADZEAN; GIBSON, 2002; VILLALBA et al., 2007).
As vias de entrada de Ca2+ melhores caracterizadas utilizam os CaV
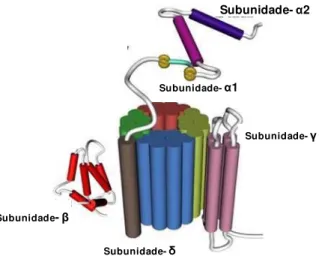
(MCFADZEAN; GIBSON, 2002). Estes canais são proteínas transmembranares, que promovem o influxo de Ca2+ para uma variedade de atividades em células excitáveis, sendo formados por diferentes subunidades: (i) a subunidade α1, que contém quatro domínios transmembranares
homólogos abrangendo o poro, o sensor de voltagem e o filtro de seletividade; e (ii) as subunidades auxiliares β, α2δ e γ (Figura 1). As subunidades α1 sido
classificadas como Cav 1.1, Cav 1.2, Cav 1.3 e Cav 1.4, que caracterizam os CaV
tipo-L, e as subunidades α1 classificadas como Cav 3.1, Cav 3.2 e Cav 3.3
caracterizam os CaV tipo-T (NAVARRO-GONZALEZ et al.,2009).
Os canais Cav 1 (tipo-L) e os Cav 3 (tipo-T) são os canais mais
expressos nas CMLV. Os canais Cav tipo-L são caracterizados por gerar
correntes de Ca2+ ativadas por altos valores de voltagens (-30 a -50 mV)
(PEREZ-REYEZ, 2003). Quando as CMLV despolarizam ocorrem abertura dos CaV tipo-L, levando ao aumento de Ca2+ intracelular, contração celular e
vasoconstrição (CRIBBS, 2006). Entretanto, a hiperpolarização induz o fechamento destes canais, resultando em vasorrelaxamento (JACKSON, 2000). Já os CaV tipo-T são ativados em baixos valores de voltagem
QUEIROZ, T. M. 32
Subunidade-αααα2
Subunidade-γγγγ
Subunidade-δδδδ
Subunidade-ββββ
Subunidade-αααα1
Subunidade-α2
Subunidade-γ
Subunidade-δ
Subunidade-β
Subunidade-α1
Figura 1 - Representação esquemática do canal para cálcio operado por voltagem (CaV) Fonte: www.chemsoc.org/.../channels/calcium/calcium.jpg
Dados na literatura têm reportando a presença de CaV do tipo-L nos
miócitos vasculares, sendo, porém, dominantes na maioria dos leitos vasculares (JACKSON, 2000). Os CaV do tipo-L são sensíveis a
1,4-diidropiridinas, uma ampla classe de fármacos, que tanto são ativadores (Bay K 8644), como bloqueadores (mimodipino, nisoldipino e nifedipino) do canal (LACINOVÁ, 2005). Os estudos mais confiáveis têm envolvido o bloqueador específico dos canais tipo-L, o nifedipino (NAVARRO-GONZALEZ et al., 2009), que age por interferência alostérica no mecanismo básico de comporta do CaV do tipo-L para evitar o influxo de Ca2+ necessário para ativar a
maquinaria contrátil da célula (GODFRAIND, 1994; BROADLEY; PENSO, 2006).
Com a entrada de Ca2+ por meio dos vários canais citados
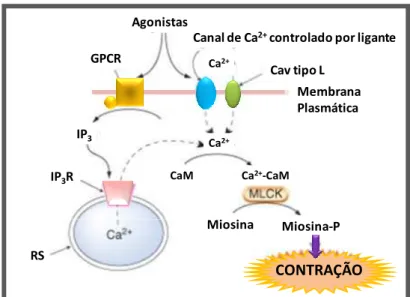
anteriormente, associado ao aumento da [Ca2+]
i, há uma facilitação da
interação do complexo (Ca2+)
4-CaM (calmodulina), que ao sofrer uma alteração
conformacional, ativa a cinase da cadeia leve da miosina (MLCK). Esta, por sua vez, irá fosforilar a cadeia leve da miosina (MLC 20) favorecendo o deslizamento dos filamentos de actina sobre os de miosina e gerando, consequentemente, a força de contração do músculo liso (Figura 2) (JOHNSON; SNYDER, 1995). Devido a estas importantes funções da [Ca2+]i no
QUEIROZ, T. M. 33
Figura 2 - Representação esquemática do mecanismo de contração na célula muscular lisa vascular
Estudos revelaram a existência de mais de 200 drogas empregadas no tratamento da hipertensão, porém menos de 1/3 dos pacientes tratados alcançam níveis de pressão sanguínea desejados, e quase 50% suspendem o tratamento dentro de seis meses devido à baixa eficácia e aos efeitos colaterais. Estas limitações têm impulsionado a pesquisa em busca e desenvolvimento de novas drogas anti-hipertensivas (COGOLLUDO; VIZCAÍNO-PÉREZ; TAMARGO, 2005).
Os produtos naturais tanto de origem terrestre quanto marinha, constituem uma excelente fonte de moléculas com atividades biológicas promissoras, não apenas pelo grande número de espécies encontradas nos habitats naturais, mas principalmente pela variedade estrutural dos compostos produzidos e pelas propriedades medicinais inexploradas (NIELSEN, 2002; NEWMAN; CRAGG; SANDER, 2003).
O uso de plantas medicinais pelo homem é uma prática milenar que ainda hoje aparece como o principal recurso terapêutico de muitas comunidades e grupos étnicos (VEIGA et al., 2005). O Brasil é o país de maior biodiversidade do planeta e detém 15 a 20% do total mundial. Esta riqueza de recursos naturais traduz-se em importante acervo genético, que associado à diversidade étnica e cultural brasileira, representa o potencial necessário para o desenvolvimento de pesquisas com resultados na terapêutica (BRASIL, 2006).
CONTRAÇÃO
Miosina Miosina-P
RS IP3R
IP3
CaM Ca2+-CaM
Ca2+
Membrana Plasmática Agonistas
GPCR Ca2+
Cav tipo L
QUEIROZ, T. M. 34
Nos dias atuais, muitas são as abordagens científicas acerca das plantas medicinais. Segundo a Organização Mundial de Saúde (OMS), as plantas medicinais são “todo e qualquer vegetal que possui, em um ou mais órgãos, substâncias capazes de serem utilizadas com fins terapêuticos ou que sejam precursores de fármacos semissintéticos”. As plantas são empregadas para diversas finalidades, dentre elas, destaca-se a elaboração de fitoterápicos, que são medicamentos obtidos a partir de matéria-prima vegetal, com eficácia e segurança validadas e constância de sua qualidade. Outro emprego destes vegetais é para o isolamento de substâncias ou mistura de compostos ativos, considerados como fitofármacos (CALIXTO et al., 2001). As plantas medicinais podem ser ainda fontes de substâncias ativas a serem utilizadas como protótipos para síntese de novos fármacos (ELIZABETSKY, 1986).
Até a década de 50, a utilização de organismos marinhos com propriedades medicinais, principalmente algas, era restrita à medicina popular. A partir da década de 60, as indústrias farmacêuticas iniciaram uma busca por novos fármacos de origem natural, e o mar mostrou-se uma fonte bastante promissora (SMIT, 2004).
Com espécies marinhas compondo aproximadamente metade da biodiversidade global total, o mar oferece um enorme recurso para novos compostos (VRIES; BEART, 1995), sendo classificado como a maior reserva de moléculas naturais a serem avaliadas tanto do ponto de vista químico quanto farmacológico (ANEIROS; GARATEIX, 2004).
Os oceanos possuem uma enorme biodiversidade, contendo 34 dos 36 filos de todo o globo terrestre, com 200.000 espécies relatadas de seres vivos, tais como esponjas, tunicados, briozoários, moluscos, peixes e algas (PINTO et al., 2002; BLUNT et al., 2006). Esses organismos se desenvolvem em condições adversas quando comparadas às espécies de vida terrestre, como a alta salinidade da água, ausência ou pequena presença de luz e, ainda, grandes variações de temperatura (FAULKNER, 2000; KELECOM, 2002).
QUEIROZ, T. M. 35
Universidade Federal Fluminense realizou um “screening” de extratos de várias algas, esponjas, estrelas do mar e anêmonas do mar frente às mais diversas atividades biológicas, dando um salto na evolução das pesquisas com organismos marinhos (KELECOM, 1997).
As algas, integrantes da flora marinha, são alvos de pesquisas científicas nos últimos anos, de onde foram isolados e caracterizados um grande número de metabólitos secundários, com ampla variedade estrutural, podendo caracterizar as classes de algas, fato de grande importância para os fitoquímicos, taxonomistas e ecologistas. Estas substâncias exercem inúmeras atividades biológicas como, por exemplo: defesa contra consumidores, competidores, organismos coloniais e patógenos (GOTTLIEB et al., 1991; HAY, 1997).
As algas são muito similares, tanto na bioquímica quanto na fisiologia, às outras plantas, possuindo as mesmas vias biossintéticas básicas. Possuem clorofilaa como principal pigmento fotossintético e carotenoides (beta-caroteno e fucoxantina), ficocianina e ficoeritrina como pigmentos acessórios. Ainda, seus polissacarídeos e proteínas biossintetizadas são comparáveis àquelas das plantas superiores (SOUTH; WHITTICK, 1987).
Harvey (1836) classificou as algas baseando-se na sua composição pigmentar e esta persiste até hoje. Dentre as principais linhagens eucarióticas podemos citar: Chlorophyta (algas verdes), Euglenophyta (algas flageladas), Rhodophyta (algas vermelhas), Phaeophyta (algas pardas), Bacillariophyta (diatomáceas) e Dinophyta (dinoflagelados) (LHULLIER, 2005).
QUEIROZ, T. M. 36
ordens pertencentes à classe Phaeophyceae, tem destaque a presença de algas que compõem as ordens Dictyotales e Fucales (BOLD; WYNNE, 1985).
A família Dictyotaceae pertence à ordem Dictyotales, a mais bem estudada entre as pardas, e tem se revelado uma fonte excepcional de compostos biologicamente ativos (TEIXEIRA; TOMASSINI; KELECOM, 1985). Esta família é mais abundante em águas tropicais e subtropicais e inclui 18 gêneros de algas pardas (DE PAULA, et al., 2001).
O gênero Dictyota, constituído por mais de 40 espécies, representa o gênero com maior número de espécies da família Dictyotaceae, sendo um dos componentes mais importantes nas floras algáceas das regiões tropicais e subtropicais de todo o mundo, onde uma grande quantidade de espécies é encontrada (SIAMOPOULOU et al., 2004).
Dentre as algas pardas, as espécies de Dictyota são as produtoras mais significantes de metabólitos secundários, especialmente diterpenoides, compostos químicos que estão inseridos na classe dos terpenoides, estes conhecidos pelas suas importantes funções biológicas e fisiológicas, sendo muito utilizados na área farmacêutica (DEWICK, 2002). Os terpenos são classificados de acordo com o número de unidades de isopreno, que vão se ligando entre si, orientadas no sentido cabeça-cauda: hemiterpenoides, C5;
monoterpenoides, C10; sesquiterpenoides, C15; diterpenoides, C20; sesterpenos,
C25; triterpenoides C30 e tetraterpenoides C40 (DUBEY, et al., 2003).
Os diterpenos são excelentes marcadores taxonômicos e biogeográficos para as espécies do gênero Dictyota (KELECOM, TEIXEIRA, 1986; VALLIM et al., 2005). Geralmente, podem ser divididos de acordo com seus esqueletos de carbono em três grupos: xenicanos, dolabelanos e sesquiterpenos estendidos (BLUNT et al., 2008; VIANO, et al., 2009). Estudos biológicos têm demonstrado que esses diterpenos apresentam atividades antibacteriana contra Staphylococcus aureus (OCHI et al., 1986), antifúngica (TRINGALI et al., 1986 ), antiviral (PEREIRA et al., 2004) e citotóxica (VIANO, et al., 2009).
QUEIROZ, T. M. 37
alternativas terapêuticas eficazes, seguras e de baixo custo para o tratamento da hipertensão.
Recentemente, a UFPB, com o Programa de Pós-graduação em Produtos Naturais e Sintéticos Bioativos, se inseriu na linha de pesquisa com produtos marinhos, trazendo os primeiros resultados do estudo fitoquímico da alga parda do litoral da Paraíba, a Dictyota pulchella, o que estabelece um novo e promissor cenário na pesquisa de organismos marinhos no país. (FIGUEIREDO, 2009).
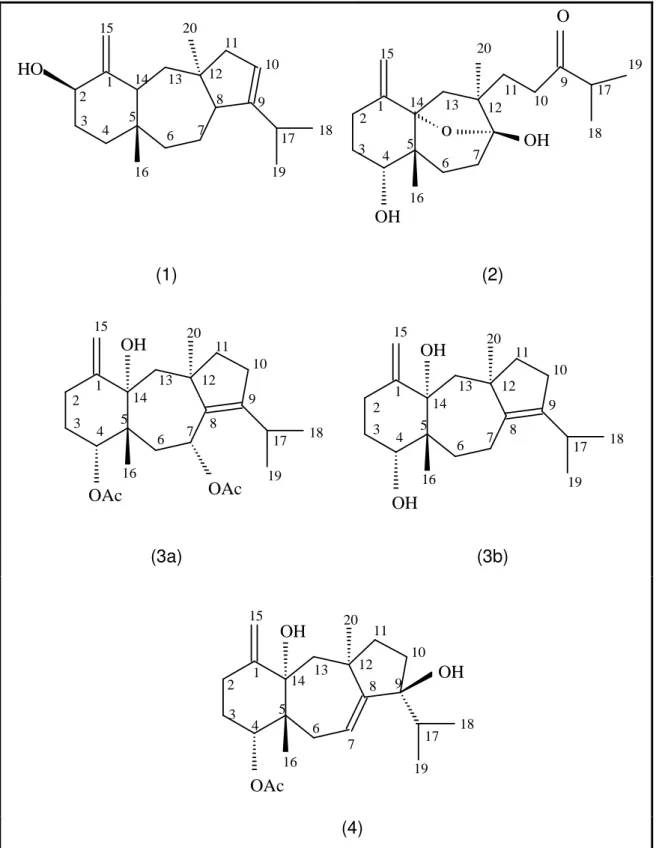
Estudos fitoquímicos realizados no Laboratório de Tecnologia Farmacêutica, culminaram no isolamento de cinco diterpenos derivados da espécie Dictyota pulchella, sendo quatro do tipo dolastano: (4S,9R,14S)-4α -acetoxi-9β,14α-dihidroxidolasta-1(15),7-dieno (4); (4R,7R,14S)-4α,7α -diacetoxi-14α-hidroxidolast-1(15),8-dieno (3a); (4R,14S)-4α,14α -dihidroxidolast-1(15),8-dieno (amijiol) (3b); estes isolados pela primeira vez na espécie em estudo, porém já isolados em outras espécies de Dictyota, um diterpeno inédito, o 2β -hidroxidolast-1(15),9-dieno (1), denominado de pulchellol, e um do tipo seco-dolastano: isolinearol (2), já tendo sido isolado de outras espécies do gênero, mas pela primeira vez isolado da espécie Dictyota pulchella (Figura 3) (FIGUEIREDO, 2009).
Baseado nas importantes propriedades dos constituintes bioativos presentes nas espécies do gênero Dictyota, optou-se por estudar a espécie
QUEIROZ, T. M. 38
HO
1 2
3
4 5 6 7
8 9 10 11 12 13 14 15 16 17 18 19 20
(1) (2)
(3a) (3b)
(4)
Figura 3 – Diterpenos isolados da alga Dictyota pulchella
Fonte: Modificado de FIGUEIREDO, 2009
o
OH O OH 1 23 4 5
QUEIROZ, T. M. 40 2 OBJETIVOS
2.1 Geral
Avaliar os efeitos vasorrelaxantes do extrato CH2Cl2: MeOH e da fase
hexano:acetato (90:10) da alga Dictyota pulchella (EDP e FDP, respectivamente) em ratos, através de uma abordagem in vivo e in vitro, procurando elucidar os possíveis mecanismos implicados nestes efeitos.
2.2 Específicos
2.2.1 Testes in vivo
Caracterizar os efeitos da administração aguda com EDP sobre a PA e FC em ratos normotensos não anestesiados.
2.2.2 Testes in vitro
Caracterizar o efeito de EDP e FDP em anéis de artéria mesentérica superior isolada de rato, avaliando os seguintes parâmetros:
a) Envolvimento dos fatores vasoativos liberados pelo endotélio;
b) Participação dos canais para K+ nas respostas vasculares induzidas por EDP;
QUEIROZ, T. M. 42 3 MATERIAL
3.1 Animais
Foram utilizados em todos os experimentos ratos Wistar (Rattus novergicus), pesando entre 250 – 300 g. Estes animais foram provenientes do Biotério Prof. George Thomas, do Laboratório de Tecnologia Farmacêutica Prof. Delby Fernandes de Medeiros (LTF) da Universidade Federal da Paraíba (UFPB), mantidos sob condições controle de temperatura (21 ± 1 ºC) e ciclo claro-escuro de 12 horas (6 – 18 horas), com livre acesso à água e alimentação (ração Purina®). Todos os experimentos foram aprovados pelo Comitê de Ética em Pesquisa Animal (CEPA), com certidão nº 0208/10 (Anexo).
3.2 Drogas
Durante a realização dos experimentos foram utilizadas as seguintes drogas: tiopental sódico (Cristália®), sal sódico de heparina (Roche®), Nitroprussiato de sódio (NPS) (Sigma®), cloridrato de L (-) fenilefrina (FEN)
(Sigma®), cloridrato de acetilcolina (ACh) (Sigma®), ácido tetracético (N,N,N´,N´) bis (beta amino etil éter) etilenoglicol (EGTA), 9,11-dideoxi-11α,9α -epoximetano prostaglandina F2α (U 46619) (Sigma®), brometo de
tetraetilamônio (TEA) (Sigma®), S(-)-Bay K 8644 (RBI/Sigma®).
QUEIROZ, T. M. 43 3.3 Obtenção e preparação das drogas teste
Dictyota pulchella Hörnig & Schnetter foi coletada na praia do Bessa, na cidade de João Pessoa - PB, em fevereiro de 2009 e identificada pelo Prof. George Emmanuel Cavalcanti de Miranda do Departamento de Sistemática e Ecologia da Universidade Federal da Paraíba. Uma exsicata da espécie (registro JPB 41771) está depositada no Herbário Prof. Lauro Pires Xavier (CCEN/UFPB).
Para a preparação do extrato, o liofilizado foi macerado com uma mistura de diclorometano e metanol (CH2Cl2:MeOH) na proporção 2:1 por 72
horas, sendo este processo repetido exaustivamente, para se obter a máxima extração dos constituintes químicos. A solução extrativa resultante foi filtrada e concentrada com o auxílio de evaporador rotativo, sob pressão reduzida, a uma temperatura não superior a 40°C, ob tendo-se, assim, o Extrato Bruto (EB) que pesou 10 g. O EB foi submetido a uma filtração à vácuo em sílica-gel com os solventes hexano e acetato de etila, obtendo assim a fase hexano:acetato de etila (90:10). Esta foi submetida aos testes farmacológicos, já que apresentou um excelente rendimento e dela foi obtido um diterpeno inédito.
O extrato e a fase de Dictyota pulchella foram cedidos pela equipe dos professores doutores José Maria Barbosa Filho e Josean Fechine Tavares do Laboratório de Fitoquímica do Laboratório de tecnologia Farmacêutica (LTF) da UFPB. Para a realização dos ensaios farmacológicos, EDP e FDP foram solubilizadas em cremofor e diluída em água destilada (experimentos in vitro) ou em solução de NaCl 0,9% (experimentos in vivo). A concentração de cremofor foi de 0,013% v/v.
3.4 Soluções fisiológicas
QUEIROZ, T. M. 44
(CaCl2), cloreto de magnésio (MgCl2), glicose (C6H12O6), bicarbonato de sódio
(NaHCO3) e fosfato de sódio (NaH2PO4). Todos estes sais foram obtidos da
SIGMA®.
Sais Concentração (mM)
NaCl 158,3
KCl 4,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 1 – Composição da solução de Tyrode para artéria mesentérica Fonte: Tanaka et al., 1999
Sais Concentração (mM)
NaCl 158,3
KCl 4,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 2 – Composição da solução de Tyrode nominalmente sem cálcio Fonte: adaptada de Tanaka et al., 1999
Sais Concentração (mM)
NaCl 158,3
KCl 4,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
EGTA 1,0
QUEIROZ, T. M. 45
Nas soluções de Tyrode 20 ou 60 mM de KCl, houve uma substituição equimolar do Na+ pelo K+, ajustando isosmoticamente as soluções, conforme os quadros abaixo:
Sais Concentração (mM)
NaCl 142,3
KCl 20,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 4 – Composição da solução de Tyrode com KCl a 20 mM Fonte: adaptada de Tanaka et al., 1999
Sais Concentração (mM)
NaCl 102,3
KCl 60,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 5 – Composição da solução de Tyrode com KCl a 60 mM Fonte: adaptada de Tanaka et al., 1999
Sais Concentração (mM)
NaCl 102,3
KCl 60,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 6 – Composição da solução de Tyrode com KCl a 60 mM nominalmente sem cálcio
QUEIROZ, T. M. 47 4 MÉTODOS
4.1 Ensaios farmacológicos in vivo
Os ensaios farmacológicos in vivo foram realizados no Centro de Ciência Agrárias CCA/UFPB da cidade de Areia – PB, no laboratório de Fisiologia aplicada, com a colaboração do professor Dr. Valdir de Andrade Braga.
4.1.1 Implantação de cateteres vasculares para medida direta da PAM e FC
Os animais foram anestesiados com tiopental sódico (45 mg/kg, i.p.) e em seguida, foram colocados em decúbito dorsal em uma prancha cirúrgica. Uma pequena incisão na região iguinal dos animais foi realizada separando a musculatura para localização do feixe vasculonervoso, seguido da dissecação e exposição da artéria e veia femorais (Figura 4). Cateteres de polietileno (PE), um segmento de PE-10 (diâmetro interno e externo de 0,28 e 0,61 mm, respectivamente), soldado a um seguimento de PE-50 (diâmetro interno e externo de 0,58 e 0,96 mm, respectivamente), foram implantados na aorta abdominal e veia cava inferior via artéria e veia femoral esquerdas, respectivamente. Após a inserção e fixação, os cateteres foram tunelizados subcutaneamente e exteriorizados através de uma incisão na região cervical posterior do animal.
QUEIROZ, T. M. 48
4.1.2 Avaliação do efeito da administração aguda de EDP sobre PAM e FC em ratos normotensos não anestesiados
Após um período de 24 h, a PAM e FC foram aferidas pela conexão do cateter arterial a um transdutor de pressão pré-calibrado (MLT0380/D, ADInstruments, Austrália) acoplado a um sistema de aquisição de sinais biológicos (Mikro-tip Blood pressure system, ADInstruments, Austrália) com um programa de aquisição (LabChart versão 7.0, ADInstruments, Austrália) para determinação de sinais biológicos em animais de laboratório (Figura 5) A frequência escolhida para amostragem dos dados foi, de no mínimo 1000Hz. Para cada ciclo cardíaco, o computador calculará a pressão de pulso, pressão arterial média e frequência cardíaca. O cateter venoso foi implantado para a administração das drogas. Todos os experimentos foram realizados em ratos não anestesiados.
Após 30 minutos de aclimatação para estabilização dos parâmetros hemodinâmicos, foi administrado NPS (10 mg/kg, i.v.), um clássico doador de NO, para verificar a correta implantação do cateter venoso. Após 15 minutos, doses crescentes de EDP foram administradas randomicamente com intervalos de tempo suficiente para que os parâmetros analisados retornassem aos valores da linha de base. Os valores de PAM e FC foram registrados antes e após a administração de EDP (Figura 6).
Figura 4 - Representação esquemática dos vasos aonde foram implantados os cateteres para o registro dos parâmetros cardiovasculares e administração das drogas
QUEIROZ, T. M. 49
Figura 5 - Sistema de aquisição de dados para medida de PA e FC em ratos não anestesiados
As variações de PAM foram expressas em valores percentuais para cada dose, calculadas como mostrado na fórmula a seguir. O mesmo cálculo foi realizado para obtenção dos valores de variação de FC.
Resposta (%) = (PA depois – PA antes) x 100 PA antes
Figura 6 – Representação esquemática do protocolo experimental para avaliação do efeito de EDP sobre PAM e FC em ratos normotensos não anestesiados
Estabilização NPS
(10 µµµµg/Kg, i.v.)
15 min.
EDP
(5; 10; 20 e 40 mg/Kg, randomicamente)
Dia 1 Cirurgia
QUEIROZ, T. M. 50
4.2 Ensaios farmacológicos in vitro
4.2.1 Ensaios farmacológicos utilizando anéis de artéria mesentérica superior isolada de rato
Os ratos foram eutanasiados por deslocamento cervical seguida por secção dos vasos cervicais. Após ter sido identificada, a artéria superior foi retirada através de uma laparotomia e seccionada em anéis de 1-2 mm. A remoção do endotélio foi realizada por atrito mecânico entre as paredes internas do vaso e uma haste de metal (COX et al., 1989). Os anéis livres de tecido conectivo e adiposo foram colocados num sistema de banho para órgãos isolados, em cubas contendo 10 mL de solução de Tyrode (TANAKA et al., 1999), a 37 ºC e aerados com uma mistura carbogênica (95% de O2 e 5% de
CO2) para prover um pH relativamente constante de 7,2 - 7,4 (TEIXEIRA;
QUEIROZ, T. M. 51
Figura 7 - Sistema de cubas e aquisição de dados de tensão isométrica para órgão isolado
4.2.2 Protocolos experimentais utilizando anéis de artéria mesentérica superior isolada de ratos
Para a realização de todos os protocolos experimentais, após um período de estabilização de 60 minutos, foi obtida uma contração com fenilefrina (FEN) 10 µM, um agonista dos receptores α1 adrenérgicos