UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA
DEPARTAMENTO DE QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
TESE DE DOUTORADO
Avaliação dos tratamentos oxidativos avançados em
água de lavagem de biodiesel e ensaios de
fitotoxicidade
Rosa Virgínia Tavares Grangeiro
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DANATUREZA
DEPARTAMENTO DE QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
TESE DE DOUTORADO
Avaliação dos tratamentos oxidativos avançados em
água de lavagem de biodiesel e ensaios de
fitotoxicidade
Rosa Virgínia Tavares Grangeiro
Tese apresentada ao Centro de Ciências
Exatas e da Natureza da Universidade
Federal da Paraíba, em cumprimento às
exigências para obtençãodo título de
Doutor em Química.
Orientadora: Profa. Dra. Ilda Antonieta Salata Toscano Co–Orientadora: Prof. Dr. Antônio Gouveia de Souza
G757aGrangeiro, Rosa Virgínia Tavares.
Avaliação dos tratamentos oxidativos avançados em água de lavagem de biodiesel e ensaios de
fitoxicidade/ Rosa Virgínia Tavares Grangeiro.-- João Pessoa, 2014.
84f. : il.
Orientadora: Ilda Antonieta Salata Toscano Coorientador: Antônio Gouveia de Souza Tese (Doutorado) – UFPB/CCEN
DEDICO!
Aos meus pais Jonas e Lúcia. Aos meus irmãos,
a Bruno Leal Viana Filho e Lucas, presentes de Deus.
OFEREÇO!
AGRADECIMENTOS
A Deus, pelas graças concedidas e amor incondicional.
Ao ProfessorDr. Antônio Gouveia de Souza, pela orientação, acolhimento e contribuição no trabalho.
À Professora Dra.Ilda Toscano, pela sua orientação, incentivo e contribuição no trabalho.
ÀProfessora Dra.Claudia Cunha pela colaboração, paciência e suas valiosas sugestões.
ÀProfessora Dra. Neide pela contribuição, sugestões e incentivo para a conclusão desse trabalho.
Ao professor Dr. José Rodrigues pelas sugestões, contribuição e palavras de apoio.
Ao grupo LEQA, Karina Beltrão, Karina Porpino, Anderson Simões, Rene, Welligton, Lucas, Levie Kátia Bichinhopela convivência amorosa e amizade.
Ao grupo LACOM,pela atenção e amizade.
À coordenação de Pós-graduação em química e, em especial, a Marcos Pequeno pela atenção e amizade.
À Capes pela bolsa concedida.
Aos meus pais Jonas e Lúcia, pelo apoio, incentivo, dedicação e confiança para construção desse sonho.
Ao meu esposo, Bruno Leal Vianapela dedicação, amor e aos meus filhos Bruno Leal Viana Filho e Lucas por tudo que representam para mim.
Aos meus irmãos, Aldo, Luciano, Tanei, Gil e Aurea, pelo amor, confiança e aos meus sobrinhos, Joyce, Basílio, Gabriel, Talles, Jonas, Betinha, Sofia, Clara, Jéssyca e Ian.
Às minhas cunhadas, Jussara, Adalgisa, Frinéia, Daniela e Patrícia, pela amizade e apoio, como também aos meus cunhados Bruno Catão e Alexandre Couto.
A todos os familiares, tia Deoclécia, Neidee, em especial,à tia Zélia pelo o amor e grande colaboração para a conclusão deste trabalho.
“A fé é a certeza daquilo que esperamos e a prova das coisas que não vemos”
RESUMO
Diante da crescente tendência de se explorar os biocombustíveis como a fonte de energia renovável e com menor impacto ambiental e considerando que a transesterificação pela catálise básica é a mais utilizada na purificação do biodiesel, torna-se relevante realizar tratamentos visando à reutilização da água de lavagem do biodiesel. Neste sentido, o objetivo deste trabalho foi aplicar e comparar aFotólise (UV)seguidados tratamentos oxidativos avançados; UV/H2O2; Fenton (Fe2+/H2O2) e foto-Fenton (Fe2+/UV/H2O2), bem
como realizar ensaios de toxicidade usando sementes de alface (lactuca sativa), antes e após o tratamento dos efluentes. A água de lavagem foi coletada na usina de biodiesel localizada na cidade de Caetés – PE. O biodiesel obtido a partir do óleo de algodão foi lavado, sequencialmente, com duas porções de cem litros de água. Foram encontrados valores de pH de 3,8 e 3,4; a turbidez apresentou valor mínimo de 158 e máximo de 7369 UNT; a CE foi de 0,25 e 0,86; o valor mínimo de 160.000 e máximo de 184.000 mg.L-1de DQO; a DBO variou de 830 a 2.150 mg.L-1 e o teor de óleos e graxas oscilaram de 2.852 a 21.761 mg.L-1, respectivamente, para água de primeira e segunda lavagem. Após a aplicação do processo por fotólise, ocorreu redução (82,6% e 72,5%) da turbidez para as águas resultantes das duaslavagens. Para a água da primeira lavagem, o tratamento por UV/H2O2
resultou na melhor redução da turbidez (91,4%) e DQO (70,4%). Para a água resultante da segunda lavagem a turbidez reduziu em (84%) e a DQO em (80%), determinadas pelo processo de foto-Fenton.Através dos testes de toxicidade utilizando sementes de alface, ficou comprovado que o melhor IG% ocorreu nos tratamentos por fotólise (95,3%) e UV/H2O2 (92,8%).
ABSTRACT
Given the growing trend to explore biofuels as a renewable energy source with less environmental impact and considering that the transesterification by basic catalysis is the most used in the biodiesel purification, it becomes importantperform treatments order to reuse of wash water biodiesel. In this sense, the objective of this study was to apply and compare photolysis (UV) followed by advanced oxidation treatment; UV/H2O2; Fenton (Fe2+/H2O2) and
photo-Fenton (Fe2+/UV/H2O2)as well as perform toxicity tests using seeds
lettuce (Lactuca sativa) before and after treatment of effluents.washing water was collected in biodiesel industry located in Caetés - PE. Biodiesel obtained from cotton oil was washed sequentially with two portions of one hundred liters of water. It was found pH values of 3.8 and 3.4; The minimum turbidity of 158 NTU and a maximum of 7.369 and EC was 0.25 and 0.86, minimum of 160,000 and maximum of 184.000 mg.L-1 COD, BOD ranging 830 and 2,150 mg.L-1 and the content of oils and greases varied 2,852 and 21,761 mg.L-1, respectively for first and second washing water. After application of photolysis process, reduction occurred (82.6% and 72.5%) for the water turbidity resulting from two washes.For the first rinse water, UV/H2O treatment resulted in a reduction of turbidity (91.4%) and COD (70.4%). For water resulting from second wash, reduced turbidity (84%) and in COD (80%), determined by photo-Fenton process. Through toxicity tests using lettuce seeds, it was proven that the best IG% occurred in treatments photolysis (95.3%) and UV/H2O2 (92.8%).
SUMÁRIO
LISTA DE FIGURAS... i
LISTA DE TABELAS... ii
LISTA DE SIGLAS... iii
1 INTRODUÇÃO... ... 1
2 OBJETIVOS ... 3
2.1 OBJETIVO GERAL... 3
2.1. OBJETIVOS ESPECÌFICOS... .... 3
3 REVISÃO BIBLIOGRÁFICA... 4
3.1 Biodiesel... 4
3.2 Água na purificação do biodiesel... 11
3.3. Água e o meio ambiente... 13
3.4 Tratamento de efluente... 15
3.4.1 Fotólise direta com ultravioleta (UV)... 17
3.4.2Processos Oxidativosavançdos... ... 18
3.4.2.1 Sistemas homogêneos... 20
3.4.2.2 Sistemas heterogêneos... 20
3.4.3 H2O2 e H2O2/UV... 21
3.4.4 Processos Fenton (H2O2/Fe2+)... 23
3.4.5 Processos foto-Fenton (H2O2/Fe2+/UV)... 25
3.4.6 Parâmetros de qualidade de água... 27
3.4.6.1 Turbidez... 27
3.4.6.2 Potencial hidrogeniônico (pH)... 27
3.4.6.3 Demanda bioquímica de oxigênio (DBO5)... 28
3.4.6.4Demanda química de oxigênio (DQO)... 29
3.4.6.5Óleos e graxas... ... 29
3.4.7 Testes de toxicidade... . 30
3.4.7.1 Estudo toxicológicos utilizando sementes... 32
4 METODOLOGIA... . 35
4.2 Caracterização das águas de lavagens do biodiesel metílico de
algodão... 36
4.2.1 pH... . 36
4.2.2 Turbidez... 36
4.2.3 Condutividade elétrica... 36
4.2.4 Demanda química de oxigênio (DQO)... 36
4.2.5 Demanda bioquímica de oxigênio (DBO5)... 37
4.2.6 Óleos e graxas... .... 37
4.3Avaliação dos tratamentos oxidativos avançados... 37
4.3.1Fotólise (UV)... 38
4.3.2 H2O2/UV... 40
4.3.3Fenton (H2O2/Fe2+) e foto-Fenton (H2O2/Fe2+/UV)... 40
4.4 Determinação dos testes de toxicidade... 41
5 RESULTADO E DISCUSSÃO... . 43
5.1 Caracterização das águas provenientes da purificação do biodiesel... 43
5.2 Tratamentos das águas provenientes da purificação do biodiesel... 45
5.3 Testes de toxicidade... 51
6 CONCLUSÕES... . 54
7SUGESTÕES PARA TRABALHOS FUTUROS... 55
i LISTA DE FIGURAS
Figura 1.Reação de transesterificação do triacilglicerídeo... 6 Figura 2. Potencial na redução percentual da emissão de gases de efeito estufa pelo uso de biocombustíveis... 9 Figura 3.Recuperação do metanol e a purificação da glicerina no
processo industrial... 10 Figura 4. Produção de biodiesel, na planta piloto do Cetene... 35 Figura 5. Reator utilizado nos tratamentos oxidativos avançados.... 39 Figura 6. Valores da turbidez por fotólise das águas de lavagens
provenientes da purificação do biodiesel... 45 Figura 7. Valores da demanda química de oxigênio por fotólise das
águas de lavagens provenientes da purificação do biodiesel... 46 Figura 8. Valores da turbidez por UV/H2O2,Fenton e foto-Fenton
daágua proveniente da primeira lavagem do
biodiesel...
47
Figura 9. Valores da turbidez por UV/H2O2,Fenton e foto-Fenton
daágua proveniente da segunda lavagem do
biodiesel...
48
Figura 10. Valores da demanda química de oxigênio por UV/H2O2,Fenton e foto-Fenton daágua proveniente da primeira
lavagem do
biodiesel... 46
Figura 11. Valores da demanda química de oxigênio por UV/H2O2,Fenton e foto-Fenton daágua proveniente da segunda
lavagem do
biodiesel...
50
Figura 12. Índice de germinação (IG%) da água resultante da segunda lavagem do biodiesel (AG II), do controle positivo (CP) e
ii LISTA DE TABELAS
Tabela 1. Potencial de oxidação eletroquímica de diferentes oxidantes... 19 Tabela 2. Sistemas típicos de processos oxidativos avançados ... 19 Tabela 3. Planejamento fatorial 22 para os experimentosH2O2/UV...
...
39
Tabela 4. Planejamento fatorial 22 para os experimentos H2O2/Fe2+ e H2O2/Fe2+/UV... 40
iii LISTA DE SIGLAS
ANP Agência Nacional de Petróleo CE Condutividade Elétrica
CP Controle Positivo
CO Monóxido de Carbono
DBO Demanda Bioquímica de Oxigênio DQO Demanda Química de Oxigênio
EPA Agência de Proteção Ambiental dos Estados Unidos HAPs Hidrocarbonetos Poliaromáticos
IG Índice de Germinação NOx Óxidos de Nitrogênio
POAs Processos Oxidativos Avançados SO2 Dióxido de Enxofre
TOG Teor de óleos e Graxas
UV Fotólise
1
1 INTRODUÇÃO
Nos últimos 200 anos a dependência tecnológica do petróleo
criou muitos efeitos colaterais indesejados causando impactos a vida
humana e ao meio ambiente. Além disso, a produção de resíduos
não gerenciados é enorme e cada vez mais difícil de lidar
(SUKKASEM et al., 2011).Dessa forma, os biocombustíveis surgem
comoalternativa em relação ao petróleo e seus derivados, já que sua
produção leva a umadiminuição considerável de poluentes
(GOLDEMBERG, 2003).
Segundo Mota (2009), o biodiesel contribui para o ciclo do
carbono na atmosfera e por isto é considerado renovável, já que o
CO2 emitido durante a queima é reabsorvido pelas plantas que irão
produzi-lo, causando um impacto muito menor no aquecimento do
planeta, diminuindo assim, as emissões de CO2.
A substituição total ou parcial de combustíveis de origem
fóssil, a exemplo do óleo diesel,sempre teve um claro apelo
ambiental, pois é de domínio público queas emissões derivadas de
seu uso gerem um aumento naconcentração atmosférica dos gases
causadores do efeito estufa,chuva ácida e redução da camada de
ozônio(VASCONCELLOS, 2002).
Durante a etapa de purificação do biodiesel são retirados
resíduos de glicerina, sabões e ácidos graxos. Essa purificação é
feita pela lavagem do produto, seguida por filtração e secagem do
biodiesel. Assim, as águas de lavagem contêm basicamente resíduos
de sabões de sódio ou potássio, além dos ácidos graxos, glicerina,
alcoóis (metanol ou etanol) e outros contaminantes (NOUREDDINI,
2001).
Um dos principais inconvenientes na produção do biodiesel,
pelo processo de catálise alcalina, é a geração de grandes
2 lavagem pode ser feita empregando adsorventes ou resinas de troca
iônica.
Novas rotas de transesterificação, como por exemplo, o uso
de catalisadores enzimáticos empregando lipases extracelulares
pode ser utilizado na tentativa de superar os problemas que estão
associados à catálise homogênea alcalina, pois o biodiesel obtido
enzimaticamente poderia ser usado diretamente sem a necessidade
de nenhuma purificação.Entretanto, mesmo cm os mais recentes
avanços tecnológicos no sentido de se obter biodiesel que não exija
purificação através da lavagem com água, estes ainda são
economicamente inviáveis (DABDOUB et al., 2009).
Em geral, utilizando métodos tradicionais de lavagem, para
cada litro de biodiesel produzido, são necessários, no mínimo, 3
litros de água de lavagem.As águas resultantes do processo de
lavagem apresentam-se quimicamente inadequadas para serem
lançadas a qualquer corpo hídrico(DE BONI et al., 2007).
Levando-se em consideração que a etapa de lavagem do
biodiesel é uma das mais importantes e também uma das mais
críticas, fica clara a importância de se caracterizar e tratar as águas
resultantes do processo de lavagem, a fim de serem descartadas
sem causar efeitos danosos aos corpos hídricos. Portanto,como uma
alternativa eficiente para o tratamentodesses efluentes surge os
processos oxidativos avançado (POAs) que tem por finalidade
substituir ou complementar técnicas convencionais de degradação
de poluentes químicos mais persistentes como a incineração, a
digestão anaeróbia e o tratamento físico-químico convencional
3 2 OBJETIVOS
2.1 OBJETIVOS GERAL
Este trabalho objetivouaplicar e comparar aFotólise (UV)
seguida dos tratamentos oxidativos avançados
UV/H2O2;Fenton(Fe2+/H2O2) e foto-Fenton(Fe2+/UV/H2O2) na água
de lavagem do biodiesel.
2.2 OBJETIVOS ESPECÍFICOS
Caracterizar as águas da primeira e segunda lavagem do biodiesel
metílico de algodão em relação a: pH, turbidez, condutividade
elétrica (CE), demanda química de oxigênio (DQO), demanda
bioquímica de oxigênio (DBO5) e óleos e graxas.
Avaliar a eficiência dos processos oxidativos avançados das águas
da primeira e segunda lavagem em relação a: demanda química
de oxigênio (DQO), turbidez e aos ensaios toxicológicos.
Realizar ensaios de toxicidade usando sementes de alface (lactuca
4 3 REVISÃO BIBLIOGRÁFICA
3.1 BIODIESEL
Devido à elevada energia consumida no mundo industrializado
e aos problemas ambientais causados pelo uso de combustíveis de
origem fóssil, bem como fortes incentivos governamentais para o
aumento da utilização de energias renováveis em muitos países,
justificam-se as perspectivas para a expansão das fontes
renováveiscom menor impacto ambiental(KNOTHE, 2010; HOEKMAN
et al., 2012), surgindo assim, o biodiesel como alternativa à
substituição de combustível proveniente do petróleo
(RAMÍREZ-VERDUZCO, 2013).
De acordo com ANP (2011),o biodiesel é definido como
combustível derivado de biomassa renovável para uso em motores
de geração interna ou, conforme regulamentos, para outro tipo de
geração de energia que possa substituir parcial ou totalmente
combustíveis de origem fóssil.
Enfim, o biodiesel para ser comercializado deverá atender às
especificações estabelecidas pelas agências regulamentadoras. No
Brasil, o órgão responsável por estabelecer as especificações e por
fiscalizar as atividades relativas à produção, controle de qualidade,
distribuição, revenda e comercialização do biodiesel e das misturas
com diesel é a ANP. A Resolução ANP N° 7 de 2008 apresenta as
especificações para o biodiesel comercializado em todo o território
nacional (ANP, 2011).
Muitas estratégias foram traçadas pelo ministério brasilei ro,
dentre elas, foi criado o Programa Brasileiro de Desenvolvimento
Tecnológico do Biodiesel (PROBIODIESEL) que visa à gradual
substituição do diesel provenientedo petróleo pelo biodiesel. Em
2005, afabricação do biodiesel chegou a dois milhões de litros,
5 um impacto positivo de US$ 2,6 bilhões na balança comercial(ALÉM
DE ECONOMIA, 2011).
Segundo Muniz (2011), o B5 (mistura composta de 5% de
biodiesel e95% de diesel) deveria vigorar a partir janeiro de 2013,
mas a regra foi antecipada para2010. No primeiro semestre de
2010, a produção de biodiesel no paíscresceu 64% em relação ao
mesmo período de 2009, passando de 807 milhões de litrospara 1,3
bilhão, aumentando em 11% o consumo total do biocombustível.
A produção nacional do biodiesel até maio de 2013 foi superior
a 1,15 bilhão de litros.A região Centro-Oeste manteve-se como líder
do ranking de produção, com quase 494 milhões de litros, seguida
pelas regiões Sul, com 381 milhões de litros, e Nordeste, com 134
milhões. Atualmente o Rio Grande do Sul respondeu por 29% do
volume total produzido, seguido por Goiás 21% e Mato Grosso 16%
(ANP, 2013).
Como matéria prima para a produção nacional do
biocombustível, o óleo de soja respondeu a 71% de todo o biodiesel
fornecido, seguido do sebo bovino com 20% (ANP, 2013).
Segundo Rocha (2009), a exploração nacional é de menos de
um terço de sua área agricultável, o que constitui amaior fronteira
para expansão agrícola do mundo. O potencial é de cerca de
150milhões de hectares, sendo 90 milhões referentes às novas
fronteiras, e outros 60referentes às terras de pastagens que podem
ser convertidas em exploração agrícola emcurto prazo. O Programa
Biodiesel visa à utilização apenas de terras inadequadas para
oplantio de gêneros alimentícios.
O Brasil por se situar em uma região tropical, com altas taxas
de luminosidade e temperaturas médias anuais, apresenta grandes
vantagens agronômicas. Associada à disponibilidade hídrica e
regularidade de chuvas, torna-se o país com maior potencial para
6 Por apresentar uma grande variedade de grãos e uma extensa
criação de animais bovinos, o Brasil vem se destacando cada vez
mais no cenário mundial do biodiesel. Em consequência desses
potenciais, o Governo Federal intensificouas discussões sobre a
produção e uso do biodiesel, sendo efetuados vários estudospor
comissões interministeriais em parceria com universidades e centros
de pesquisa.
O biodiesel pode ser obtido a partir de óleos vegetais extraídos
de diferentes oleaginosas, além de gordura animal e algas por meio
da reação de transesterificação(HOEKMAN et al., 2012).
Do ponto de vista químico, o óleo vegetal usado na produção
de biodiesel é um triglicerídeo, ou seja, um triéster derivado da
glicerina.O processo global de transesterificação de óleos vegetais e
gorduras é uma sequência de três reações reversíveis e
consecutivas, em que os monoglicerídeos e os diglicerídeos são os
intermediários (KAPILAN et al., 2009).
Sob ação de um catalisador o óleo sofre uma
transesterificação formando três moléculas de ésteres metílicos ou
etílicos dos ácidos graxos, que constituem o biodiesel em sua
essência, e libera uma molécula de glicerina Figura 1 (MOTA et al.,
2009).
Figura 1 - Reação de transesterificação do triacilglicerídeo.
7 Dentre os combustíveis renováveis mais promissores, o
biocombustível se destaca por ser uma mistura de ésteres metílicos
ou etílicos de ácidos graxos, produzido pela reação de um óleo ou
gordura com um álcool, na presença de um catalisador. Podendo ser
utilizado puro ou em misturas com o diesel em motores ciclo diesel,
sendo, em alguns aspectos, comparativamente menos poluente que
o diesel(BEATRIZ et al., 2011).
Os processos químicos utilizados para obtenção do biodiesel
envolvem reações de transesterificação que ocorrem quando
triglicerídeos reagem com álcool de cadeia curta, na presença de
catalisadores ácidos (MEHER et al., 2006; HELWANI et al., 2009),
básicos (FERRARI et al., 2005; KAPILAN et al., 2009), heterogêneos
(SILVA et al., 2008; CALAND etal., 2009) e enzimáticos (KAPILAN et
al., 2009).
Na esterificação pelo processo de catálise ácida, os ácidos
mais comumente utilizados são ácido sulfônico ou sulfúrico. Nessa
reação, o rendimento obtido é muito elevado (99%), mas a reação é
lenta, sendo necessárias temperaturas elevadas (acima de 100 oC) e
mais de 3 horas para alcançar o rendimento (FUDUKA et al., 2001;
GERPEN, 2005; ZHENG et al., 2006).
O processo de produção do biodiesel pela transesterificação
por catálise básica usando a rota metílica é a mais atrativa sob o
ponto de vista industrial por ser rápida e mais econômica. Os
catalisadores mais comumente utilizados nessa reação são o NaOH
e o KOH(BERRIOS et al., 2010).
Os catalisadores heterogêneos ácidos, os quais promovem
reações de alcoólise e triacilgliceróis e de esterificação dos ácidos
graxos livres, surgem como substitutos dos catalisadores
homogêneos básicos, apresentando vantagens, tais como: redução
no processo de purificação do biodiesel e a possibilidade de
reutilização durante a produção desse biocombustível(XIE et al.,
8 Na catálise enzimática, não ocorrem reações de formação dos
subprodutos. Com isso, não é necessário que se lave o biodiesel
para sua a purificação.Esse método apresenta como vantagens:
inexistência do rejeito alcalino, menor número de contaminantes,
maior seletividade e bom rendimento. A desvantagem desse
processo é a inviabilidade devido seu alto custo.A imobilização de
enzimas permite a sua reutilização barateando o processo. Assim,
vêm sendo desenvolvidas muitas rotas de transesterificação usando
como enzimas lipases imobilizadas (BELAFI et al., 2002; ISO et al.,
2001).
De acordo com alguns autores (WANG et al., 2000; OLIVEIRA
e COSTA, 2002; BIODIVERSIDADE, 2009; TECBIO, 2009), o
biodiesel como combustível apresenta vantagens e
desvantagens.Como vantagens podem ser citadas:apresenta
características necessárias para substituir o óleo diesel possibilitando
sua utilização em motor a diesel,além disso, é biodegradável, possui
um alto valor energético, contendo baixos níveis de enxofre e
compostos aromáticos, o que proporciona uma combustão limpa e
sem a formação de SO2 (DIAS et al., 2008; CANDEIA et al., 2009).
Como desvantagens citam-se, menor poder calorífico, mas
esta desvantagem é bastante pequena, em torno de 5%, em relação
ao diesel convencional,ocorre cristalização em baixas temperaturas,
o elevado custo de produção quando comparado ao diesel, além da
baixa estabilidade oxidativa(DIAS et al., 2008).
Em comparação ao diesel proveniente do petróleo
(petrodiesel),o biodiesel é um combustível ambientalmente limpo,
pois além de ser biodegradável e não ser tóxico reduz as emissões
9 Figura 2 – Potencial na redução percentual da emissão de gases
de efeito estufa pelo uso de biocombustíveis.
Fonte: VICHI E MANSOR (2009).
Apesar de ser considerado ambientalmente limpo, dependendo
da composição química do biodiesel em relação ao diesel comum a
Agência de Proteção Ambiental dos Estados Unidos (EPA), em 2002,
alertavaque a taxa de emissão de NOx (também responsáveis pelas
chuvas ácidas) pode aumentar entre 10% a 25% (VICHI e MANSOR,
2009).
Outro problema ambiental ocorre quando se faz uso de
metanol na síntese do biodiesel, que acaba gerando resíduos tóxicos
na etapa de lavagem. Desta maneira, a água de lavagem do
biocombustível é rica em metanol, além de outros subprodutos, que
acabam sendo descartados sem nenhum tipo de tratamento. O
impacto ambiental causado por este tipo de efluente é de difícil
avaliação, por causa da variedade de compostos oriundos da
10 Pelo fato do metanolapresentar maior reatividade quando
comparado ao etanol,a rota metílica vem sendo amplamente
utilizada, o que implica em menor tempo e temperatura de reação.
Já a rota etílica, por ser obtida a partir de fontes renováveis, é
considerada menos tóxica, tendo como desvantagem uma maior
dispersão da glicerina proveniente da reação de transesterificação, o
que dificulta a separação das fases que, consequentemente, requer
uma maior razão molar álcool/óleo para aumentar o rendimento da
reação (BOUAID et al., 2007; ENCINAR et al., 2007).
Devido ao baixo ponto de fulgor do metanol, a EPA (2008)
observou que os resíduos de glicerina contêm quantidades
significativas de metanol não recuperados, fazendo com que a
glicerina seja considerada como resíduo perigoso.
A glicerina e o metanol que não reagiram durante a
transesterificação, são gerados como subprodutos. O metanol pode
ser recuperado e reutilizado novamente no processo, reduzindo
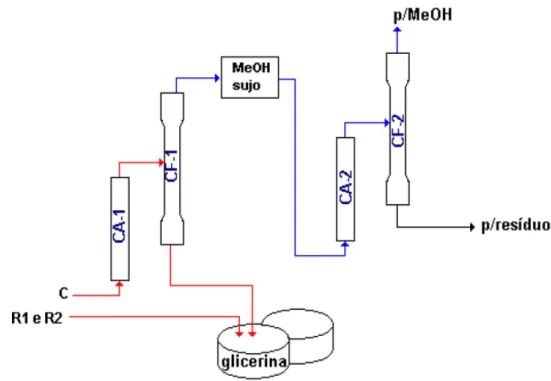
assim, a geração de poluentes das águas residuais Figura 3.
Figura 3 – Recuperação do metanol e a purificação da glicerina.
11 A glicerina bruta pode ser refinada e vendida. No entanto,
dependendo do tamanho da usina alguns fabricantes são incapazes
de refiná-la e vendê-la como subproduto. Com isso, o descarte
inadequado desse subproduto causa danos tanto ao sistema de
bombeamento da própria usina, como ao meio ambiente (EPA,
2008).
De acordo com Suarez et al. (2007), para cada 90 m3de
biodiesel produzidos são gerados, aproximadamente, 10 m3de
glicerina. Com a entrada do B5estimam-se 250 mil toneladas de
glicerina como subproduto do biodiesel. A glicerina proveniente da
produção do biodiesel apresenta uma elevada DBO e quando
depositada em aterros gera sérios problemas ambientais (MCCOY,
2006).
Apesar da aplicabilidade do glicerol na indústria farmacêutica,
tais como aditivos químicos e rações animais, dentre outras, sua
demanda exagerada produzirá um excedente, que provavelmente
será despejado na água e no solo trazendo consequências ainda não
conhecidas para outras formas de vida no meio ambiente. Assim, se
faz necessário desenvolver pesquisas com o glicerol, para a
avaliação das respostas às espécies vivas em corpos de água ou no
solo (ARRUDA, 2007).
As Secretarias Estaduais do Meio Ambiente, que controlam a
forma de descarte dos efluentes industriais, não possuem legislação
específica para o seu descarte. Esses resíduos quando despejados
nos rios provocam consumo excessivo de oxigênio, causando
desequilíbrio na população aquática e sua queima libera na
atmosfera a cloreína, que é uma substância com caráter cancerígeno
12 3.2 Água na purificação do biodiesel
Durante a etapa de purificação do biodiesel são retirados
resíduos de glicerina, mono-, di-, tri-glicéridos, metanol e os seus
sais (SABUDAK, 2010). O processo de lavagem é repetido 2 a 5
vezes dependendo da quantidade de impurezas presentes. Em
média, para cada 100 litros de biodiesel produzidos são gerados
de20 a120 litros de águas residuais (SUEHARA et al., 2005;
MARCHETTI et al., 2007; PHUKINGNGAM et al., 2008).
As águas de lavagem do biodiesel apresentam valores
elevados de óleos, sólidos e uma baixa concentração de nitrogênio,
o que inibe o crescimento dos microrganismos dificultando a
degradação de forma natural (JARUWAT et al., 2010). Do ponto de
vista químico, estas águas apresentam-se inadequadas para serem
lançadas nos corpos hídricos sem que antes sejam submetidas a
qualquer tratamento (DE BONI et al., 2007).
Portanto,ambientalmente, torna-se indispensável a adoção de
técnicas de tratamento para estes efluentes (SUEHARA et al., 2005).
Christoff (2007) afirma que o método mais simples de purificar
o biodiesel é lavando com água. Então,em água todas as impurezas
do biodiesel são solúveis e o biodiesel é pouco solúvel. Com isso, o
biodiesel deve ter suas características enquadradas nas
especificações das normas técnicas estabelecidas para esse
biocombustível, como combustível para uso em motores do ciclo
diesel, que atende aos parâmetros fixados pela Portaria n0 255/03
de 15 de setembro de 2003 da Agência Nacional do Petróleo.
Neste sentido a legislação brasileira, particularmente a
Resolução 357/2005, CONAMA, estabelece no art. 24 que “os
efluentes de qualquer fonte poluidora somente poderão ser
lançados, direta ou indiretamente, nos corpos de água, após o
devido tratamento e desde que obedeçam as condições, padrões e
exigências dispostos nesta Resolução e em outras normas
13 Esta Resolução também estabelece que um efluente só poderá
ser lançado, direta ou indiretamente, desde que não altere a
qualidade do corpo receptor.
As águas residuárias da purificação do biodiesel apresentam
parâmetros com elevados valores de Demanda Química de Oxigênio
(DQO), Demanda Bioquímica de Oxigênio (DBO) e óleos e graxas, os
quais têm potenciais para contaminar corpos d’água prejudicando o
equilíbrio necessário à manutenção do ecossistema aquático. Com
isso, são consideradas um desperdício de alta resistência se forem
despejadas em uma estação de tratamento (DRANKA et al., 2008).
De acordo com Grangeiro (2009), os teores de óleos e graxas
presentes na água que purifica o biodiesel são de 1648 mg.L-1. Já
Drankaet al., (2008) apresentaram valores de 2678 mg.L-1.
A Resolução 430/2011 do CONAMA estabelece valores de até
20 mg.L-1 de óleos vegetais e até 50 mg.L-1 de gorduras animais.
Nessas condições, as indústrias que apresentam efluentes com
elevados teores de lipídios enfrentam um grande desafio, pois o óleo
e outros derivados do petróleo possuem substâncias recalcitrantes
para o meio ambiente, podendo causar vários danos ecológicos
afetando a saúde dos seres humanos (COSTA et al., 2007).
Enquanto as águas domésticas apresentam valores de DBO
em torno de 200 mg.L-1, as águas provenientes da purificação do
biodiesel apresentam uma DBO em torno de 10-15.000 mg.L-1. Com
isso, o descarte indevido destes resíduos em uma estação de
tratamento acarreta sérios danos ao meio ambiente (EPA, 2008).
3.3 Água e o Meio Ambiente
A água é um dos recursos mais importantes para a existência
e manutenção da vida e, para isso, deve estar presente no ambiente
em quantidades e qualidades apropriadas(BRAGA, 2001).
Atualmente a preocupação com a água, adquire complexidade,
quando se trata dos aspectos econômicos, ambiental, políticos e
14 dos lagos e rios, provenientes do grande desenvolvimento industrial,
são fatores que atuam de maneira negativana atual situação do
país.
Segundo dados da organização mundial da saúde
aproximadamente 1,2 bilhões de pessoas não têm acesso à água
para consumo doméstico, e cerca de 2,18 milhões de pessoas
morrem por ano devido ao fato de não possuírem água com
qualidade aceitável para consumo, higiene pessoal e outros usos
diários. As projeções indicam que, até 2050, mais de 45% da
população mundial não terá acesso à água potável(WHO, 2006).
Além dos aspectos qualitativos, a problemática da água
envolve também fatores quantitativos. Analisando a quantidade de
água disponível no planeta, é sabido que dois terços da superfície da
Terra ou 71% são cobertos por água, sendo 97% deste total
constituídos de água salgada e apenas 3% de água doce. Desta
porção de água doce, 2% estão disponível nos rios, lagos
(reservatórios superficiais) e aqüíferos (reservatórios subterrâneos),
1% fica armazenado nas geleiras e uma quantidade mínima
(0,0005%) está na forma de vapor d’água espalhada na atmosfera (WEBER, 1992).
É relevante destacar que a disponibilidade de água nem
sempre induz a uma boa qualidade, pois uma dada região pode
apresentar uma grande quantidade desse recurso, embora a sua
qualidade não seja satisfatória para suprir as necessi dades de uma
biota (BRAGA et al., 2010).
Em muitos países, devido à crescente população e às
atividades econômicas, percebe-se a escassez de água e o limite da
mesma para o desenvolvimento econômico. O manejo da água doce
como um recurso finito e vulnerável e a integração de planos e
programas hídricos setoriais aos planos econômicos e sociais
15 De modo a diminuir o impacto ambiental e social da escassez
de água no planeta, programas de reutilização de água têm crescido
e vêm sendo incentivados nos últimos anos. A reutilização da água
corresponde ao uso de efluentes, tratados ou não, para fins
benéficos, tais como irrigação, uso industrial e fins urbanos não
potáveis, desta forma diminuindo problemas de demanda de água
para a população (WEBER, 2010).
Diante dos impasses enfrentados pela gestão integrada dos
recursos hídricos, torna-se imprescindível diagnosticar a qualidade
das águas para suas diversas utilidades, uma vez que esse bem
deve ser monitorado para a boa saúde do meio ambiente em seu
todo.
Em relação aos efluentes gerados na lavagem do biodiesel, na
literatura internacional foi possível encontrar um trabalho
empregando eletrocoagulação(SRIRANGSAN e CHAVALPARIT,
2008).
Relacionado com o ciclo de produção do biodiesel a partir do
óleo de palma, o trabalho de Pleanjaiet al. (2007) realiza a
caracterização físico-química do efluente e a proposta de tratamento
com digestão anaeróbia.
A maioria dos trabalhos sobre a disposição dos efluentes se
refere à presença/remoção do metanol, por aquecimento e
recolhimento da glicerina (subproduto). E queapós o metanol ser
removido, se faça a neutralização da primeira água de lavagem com
a adição de ácidos e, em seguida, a água poderia ser descartada de
maneira segura (MAHER, 2009).
A Resolução CONAMA 357/05 estabelece os padrões de
lançamento de efluentes de qualidade de corpos receptores
objetivando a preservação dos corpos d’água. Os mais graves
problemas que afetam a qualidade da água de rios e lagos decorrem
de vários fatores, dentre eles, o tratamento inadequado das águas
16 3.4 Tratamento de efluentes
Os sistemas de tratamento de efluentes são baseados na
transformação dos poluentes dissolvidos e em suspensão em gases
inertes e ou sólidos sedimentáveis para a posterior separação das
fases sólida e líquida. Sendo assim, se não houver a formação de
gases inertes ou lodo estável, não se pode considerar que houve
tratamento(CASTELO BRANCO, 2013).
É necessário conhecer o princípio de funcionamento de cada
operação unitária utilizada, bem como a ordem de associação dessas
operações que definem os processos de tratamento. Antes de iniciar
qualquer projeto de tratamento de efluentes é preciso avaliar a
possibilidade de minimização da geração da carga poluidora e do
possível reuso da água do efluente
A complexidade dos efluentes do processo de produção de
biodiesel, não permite que estes sejam tratados da maneira
convencional. Diante disto, tem-se buscado novas tecnologias como
a aplicação de processos mais limpos e menor geração de resíduos.
Diversos tratamentos já foram desenvolvidos e testados para
o efluente gerado a partir da lavagem do biodiesel, dentre eles
podem ser citados os tratamentos eletroquímicos, combinados,
físico-químicos e biológicos.
Srirangsanet al. (2009) e Chavalp et al. (2009) utilizaram
tratamentos com eletrocoagulação e verificaram que a combinação
de um ânodo de alumínio e um cátodo de grafite (Al–C), em pH 6,
foi eficiente na remoção de 55,7% da demanda química de oxigênio
(DQO), 97,5% de sólidos suspensos e 97,8% do teor de óleos e
graxas (TOG), enquanto as remoções relacionadas aos teores de
glicerina e metanol foram de 3,5 e 16,9%, respectivamente.
Meneses et al. (2012) estudaram o efluente do biodiesel
produzido pelo processo de transesterificação alcalina do óleo de
algodão comercial em escala laboratorial e observaram que a
17 99,23% dos óleos e graxas, mostrando-se ser uma técnica de
tratamento de efluente bastante eficiente.
Sileset al. (2010) também utilizaramum processo combinado
de eletrocoagulação associado a um tratamento anaeróbio, com
objetivo de reduzir o teor de óleo do efluente e obtiveram uma
remoção de 45% da DQO, favorecendo um posterior tratamento
biológico.
O tratamento por oxidação eletroquímica também mostrou-se
eficiente na redução demanda bioquímica de oxigênio, DBO (90%),
DQO (100%) e TOG (100%). A diminuição nas concentrações
destes parâmetros foi atribuída à oxidação eletroquímica dos
poluentes orgânicos presentes no efluente que ocorre devido à
interação com espécies de cloro ativo (Cl2/OCl–), geradas
eletroquimicamente no reator (PATTARALUK et al., 2010).
Jaruwatet al. (2010) adotaram um tratamento capaz de
remover completamente a DQO e TOG do efluente obtido do
biodiesel obtido em escala laboratorial a partir do óleo de fritura que
reduziu o nível de DBO em 95%. Primeiramente o efluente foi
acidificado e posteriormente submetido a um processo de
eletro-oxidação.
Os métodos citados anteriormente mostraram-se eficientes na
redução de DBO, DQO e TOG. Entretanto a utilização da fotólise
seguida dos processos oxidativos avançados (POAs), tais como
UV/peróxido, Fenton e foto-Fenton são opções interessantes, pois já
se mostraram eficientes no tratamentode efluentes industriais e têm
como princípio a utilização de reações de oxidaçãoiniciadas por
radicais hidroxilas (FREIRE, 2007).
3.4.1 Fotólise direta com ultravioleta (UV)
Na fotólise direta, através da luz ocorre a degradação do
poluente.Quando comparada com outros processos que envolvem a
18 Sendo assim, estudos são realizados juntamente com: H2O2/UV,
O3/UV e H2O2/O3/UV para quantificar sua eficiência na matéria
orgânica.
Além da sua aplicação na degradação de poluentes, a
irradiação em comprimento de onda 253,7 nm, apesar de não
remover matéria orgânica na água, apresenta-se eficiente na sua
desinfecção(TEIXEIRA et al., 2004).
Segundo Dantas (2010), a radiação UV tem sido aplicada com
êxito no tratamento da água emprocessos de desinfecção e
degradação de contaminantes orgânicos por fotólise direta.
De acordo com Cairns (1995) e Souza (2000) são várias as
vantagens do uso da radiação UV no tratamento da água, dentre
elas podem-se destacar:é efetiva para grande variedade de
bactérias e vírus, usando doses relativamente pequenas; não
necessita da adição de reagentes químicos; evita mudanças bruscas
no pH. Como principais desvantagens, podem-se citar:a matéria
dissolvida ou em suspensão reduz a intensidade de radiação quando
atravessa a lâmina líquida; a geometria do reator e o tipo de
lâmpada utilizada pode aumentar o consumo de energia;a exposição
à radiação UV pode causar lesões nos olhos e câncer de pele.
3.4.2 Processos oxidativos avançados (POAs)
A principal vantagem desses processos é a completa
degradação de contaminantes orgânicos, convertendo-os em dióxido
de carbono, água e sais inorgânicos. Tais processos vêm sendo
muito estudados e empregados no tratamento de efluentes de
indústrias (NOGUEIRA et al., 2007).
SegundoCarballaet al. (2004),POAs são definidos como os
processos baseados na formação de radical hidroxila (OH•), altamente oxidante com contaminantes orgânicos em água Equação
19 HO•+ e- +H+ H2O (1)
O radical hidroxila é geralmente formado em reações que
resultam da combinação de oxidantes como ozônio e peróxido de
hidrogênio com radiação ultravioleta (UV) ou visível (Vis) e
catalisadores, como íons metálicos ou semicondutores. Estes
radicais têm potencial de oxidação de 2,8 V que é inferior apenas ao
do flúor, de acordo com a Tabela 1.
Tabela 1 – Potencial de oxidação eletroquímica de diferentes
oxidantes.
Agente Oxidante Potencial de Oxidação (V)
Flúor (F) 3,03
Radical hidroxil (HO.) 2,8
Oxigênio atômico 2,42
Ozônio(O3) 2,07
Peróxido de hidrogênio (H2O2) 1,78
Radical peridroxil (HO2.) 1,7
Fonte: Legriniet al., (1993).
De acordo com Teixeira e Jardim (2004), os radicais hidroxilas
são os responsáveis pela oxidação de uma variedade de
componentes e o seu resultado positivo refere-se aos elevados
valores das constantes de geração dos radicais HO•.
Existem duas formas de dividir os POAs: processos
homogêneos e heterogêneos. Os processos homogêneos ocorrem
em uma única fase. Já os heterogêneos são realizados em sistema
polifásico na presença de catalisadores sólidos, como pode -se
20 Tabela 2 –Sistemas típicos de processos oxidativos avançados.
Sistemas Tipos
Homogêneos H2O2; O3; Fenton; ultrassom
(combinados ou não de UV); UV, feixe de elétrons
Heterogêneos H2O2/Sc; H2O2/Sc/UV
Sc = semicondutor sólido (TiO2, ZnO, MnO2)
Fonte: HUANG et al., (1993).
3.4.2.1 Sistemas homogêneos
Nos sistemas homogêneos, a degradação do poluente orgânico
pode ser efetuada por dois diferentes mecanismos: fotólise direta
com ultravioleta (UV) e geração do radical hidroxila (HO•). Neste sistema, a presença de catalisadores sólidos é inexistente (TEIXEIRA
E JARDIM, 2004).
3.4.2.2 Sistemas heterogêneos
De acordo com Ciola (1981), nos sistemas heterogêneos são
utilizados semicondutores sólidos, os quais aumentam a velocidade
de reação para que o equilíbrio químico seja atingido sem sofrer
alteração química.
A sua principal vantagem é evitar a adição de produtos
químicos e obter a recuperação do catalisador. As reações feitas na
presença desses condutores são denominadas reações catalíticas.
A importância dos POAs foi reconhecida pela USEPA (Agência
de Proteção Ambiental dos Estados Unidos) com a publicação do
Handbook “AdvancedOxidationProcess” (GHISELLI, 2002). Devido à alta eficiência e versatilidade, os POAs vêm sendo tratados, entre os
pesquisadores, como uma das alternativas mais promissoras entre
21 águas e efluentes, bem como remediação de solos (NOGUEIRA,
2002).
SegundoWOLS (2012), uma das pioneiras na aplicação prática
dos POAs foi a empresa Solarchem Environmental Systems no
Canadá (agora Chemviron Carbono nos EUA), a qual apresenta mais
de 50 instalações, em todo o mundo, tratando uma variedade de
contaminantes em águas residuais, águas subterrâneas e águas
potáveis utilizandoos raios UV, UV/H2O2, ou O3/H2O2.
3.4.3 H2O2 eH2O2/UV
O H2O2 é um poderoso agente oxidante com potencial de
oxidação de 1,8 V. Tem uma larga aplicação na indústria têxtil,
alimentícia, petroquímica, entre outras. Também tem sido usado
como tratamento em solos e efluentes contaminados.
Muitas vezes adiciona-se o H2O2 em concentrações que
variam entre 35, 50 ou 70% p/p no sistema reacional. Contudo,
estudos mostram que esse oxidante pode ser gerado
eletroquimicamente através do oxigênio dissolvido em soluções
ácidas (QUIANG et al., 2002).
OH2O2 quando utilizado juntamente com a radiação
ultravioleta se decompõe formando dois radicais HO•, conformeEquação 2.
H2O2 → 2HO• (2)
Segundo a EPA (1998), utiliza-se como fonte de radiação
ultravioleta para sistemas fotoassistidos lâmpadas de vapor de
mercúrio de baixa pressão, as quais apresentam pico de emissão
em 254 nm. Estas lâmpadas por apresentaremmáxima absorção
UV pelo H2O2 a 220 nm não são recomendadas para esse processo
22 esse comprimento de onda, se decompõe em radical hidroxil com
rendimento quântico igual a um.
De acordo com Dantas (2005), para todo fóton absorvido, um
radical HO• é formado. Com isso, o uso de concentrações elevadas de H2O2 é inerente à utilização de lâmpadas de vapor de mercúrio.
Alnaizy e Akgerman (2000) mostram que devido a auto
decomposição do H2O2 em HO2• e água, o processo é menos
eficiente, como pode-se constatar pela Equação 3.
H2O2 +HO•→H2O + HO2•(3)
OH2O2podeoxidar um determinado poluente mesmo na
presença de outro, ou originar diferentes produtos de oxidação
para uma mesma espécie oxidável. Para isso, é necessário que o
tempo de reação, temperatura, concentração seja controlado
(MATTOS et al., 2003). O mesmo, quando utilizado em meio
ácido,é um poderoso agente oxidante. Já em soluções alcalinas
apresenta-se estável se decompondo em água e oxigênio
molecular, conforme a Equação 4.
H2O2→H2O + O2(4)
O peróxido de hidrogênio quando reagido com a matéria
orgânica da água e efluentes pode se comportar como agente
oxidante e redutor, conforme as Equações 5 e 6 (MAMBRIM
FILHO,1999).
H2O2 + 2H++2e-→H2O E0 = 1,776 V (5)
H2O2 + 2e-→O2 + 2H+E0 = - 0,7 V (6)
Vários mecanismos influenciam para que o H2O2 seja quebrado
citam-23 se: pH, temperatura, concentração de H2O2 e presença ou ausência
de matéria orgânica e/ou contaminantes.
Andreozziet al. (2002), mostraram através das Equações 7 a
9, reações paralelas nas quais ocorre a quebra do substrato. Os
radicais hidroxila gerados nessas reações podem atacar diretamente
o substrato S, oxidando-o a S*. Porém, em consequência do
excesso de oxidante, o H2O2 pode formar radicais hidroperoxilHO2•
Equação 3. Sendo assim, esse radical pode reagir com o H2O2
formando radicais hidroxila, os quais podem gerar mais H2O2 na
reação.
HO• + S→ S* (7)
H2O2 + HO•→H2O + HO2• (3)
H2O2 + HO2•→ HO• + O2 + H2O (8)
2 HO•→ H2O2 + O2 (9)
Estudos têm mostrado várias pesquisas sobre a utilização do
métodoUV/H2O2, dos quais podem-se destacar:a degradação do
corante metilorange (HAJI, 2011), remoção da matéria orgânica de
diferentes matrizes aquáticas (VILHUNEN et al.,2010), degradação
do n-butilparabeno e 4-terc-octilfenol (BLEDZKA et al., 2010) e
tratamento de produtos farmacêuticos em águas
residuais(ROSARIO-ORTIZ, 2010).
3.4.4 Processos Fenton (H2O2/Fe2+)
Há mais de um século, a oxidação catalítica de ácido tartárico
na presença de sais ferrosos e peróxido de hidrogênio foi relatada
por Fenton. Foi proposto que o radical hidroxila é a espécie oxidante
neste sistema, capaz de oxidar várias classes de compostos
orgânicos em uma reação espontânea que ocorre no escuro
24 Dentre os POAs o processo de Fentonse destaca por ser uma
poderosa fonte de radicais hidroxila a partir da mistura de sais de
ferro (Fe2+) eperóxido de hidrogênio(H2O2). Os sais de ferro(Fe2+)
iniciam e catalisam a reação de decomposição do (H2O2) (AY, 2010),
produzindo radicais e íons hidroxilas conformeEquações 10 a 13
(SUGAWARA, 2011).
Fe2+ + H2O2→Fe3+ + OH- + HO• (10)
Fe3+ + H2O2→Fe2+ + HO2• + H+ (11)
Fe3++ HO2•→Fe2+ + H+ + O2 (12)
HO• + H2O2→ HO2• + H2O (13)
A reação de Fenton é totalmente dependente do pH do meio e
somente em condições ácidas (pH de 2,5-3,0) é que o HO•é o oxidante reativo predominante. Devido à alta reatividade do radical
hidroxila, este pode iniciar diferentes tipos dereações com diferentes
grupos funcionais formando radicais orgânicos instáveis que são
posteriormente oxidados até CO2, H2O e ácidosinorgânicos
provenientes do heteroátomo presente(SILVA et al., 2004).
A potencialidade do processo para o tratamento de efluentes é
devida à simplicidade de sua aplicação, uma vez que a reação ocorre
à temperatura e pressão ambiente, não requer nenhum reagente ou
equipamento especial e se aplica a uma grande variedade de
compostos(TEIXEIRA E JARDIM, 2004).
Segundo Bensalah (2011), o processo Fenton tem sido
empregado no tratamento de água para compostos orgânicos e
inorgânicos, em escala laboratoriale também em amostras de
efluentes reais. O tratamento por Fenton tem sido atrativo para
águas residuais, devido à abundância e a não toxicidade do íon Fe2+,
como também devido ao fato de que o H2O2 é um reagente de fácil
25 Para Chamarro(2001), o H2O2 é importante para degradar o
contaminante presente no efluente, enquanto que, a concentração
de Fe2+ é importante para a cinética da reação. Independentemente
da concentração de poluente orgânico utilizado, a mínima
concentração de sais de Fe2+ que permite que reação aconteça
dentro de um tempo razoável é de 3 a15 mg.L-1 (KUSICet al.,
2006).
De acordo com Neyens e Baeyens (2003), dependendo da
razão H2O2/Fe2+, o reagente Fenton pode apresentar diferentes
funções no tratamento do efluente. Em relação ao H2O2, quando os
sais de Fe2+ empregados apresentam-se em excesso
estequiométrico, o tratamento tende ao efeito de coagulação e
quando essas quantidades são revertidas, apresenta-se um efeito de
oxidação química.
Para vários autores o processo Fenton tem sido bastante
eficiente no tratamento de diversos tipos de contaminações de
efluentes. Para Kwonet al. (1999), Kang et al. (2003) e Wang
(2000), o reagente de Fenton tem uma larga aplicação na
degradação de efluentes e na lixiviação de aterros.
No tratamento de corantes, quando comparado com o ozônio e
processos eletroquímicos, o processo apresenta uma melhor
eficiência (SZPYRCOWICZ et al., 2001).Bautistaet al. (2007),
trataram efluentes contendo cosméticos,Bouasla et al. (2010),
utilizaram o processo na degradação do corante violeta de metila,
Oturanet al.(2011), realizaram degradação oxidativa do herbicida
diuron, adicionando o peróxido de hidrogênio eletroquimicamente.
Ele também pode ser aplicado para aumentar a biodegradabilidade
do contaminante visando um futuro tratamento biológico (ZHU et
26 3.4.5 Processos foto-Fenton (H2O2/Fe2+/UV)
A oxidação de compostos orgânicos sob irradiação UV na
presença de íon férrico em meio ácido foi verificada na década de
50, quando foi postulado que a transferência eletrônica iniciada pela
irradiação resultava na geração deHO•, responsável pelas reações de oxidação (BATES e URI, 1953).
A eficiência desta reação pode ser amplamenteaumentada,
quando se incide luz, o que é atribuídoprincipalmente à fotorredução
de Fe3+ a Fe2+, ao aumentoda decomposição de H2O2 pela absorção
da luzUV e à fotólise de complexos orgânicos de Fe3+gerados
durante a decomposição conforme Equações de 14 a17.
Fe (OH)2+ + h→ Fe2+ + HO• (14) H2O2+ h→2 HO•(15)
H2O2→HO2- + H+(16)
HO2- + h→HO- + O-(17)
De acordo com Nogueira et al. (2009),o processo foto-Fenton
tem como vantagem o emprego de reagentes debaixo custo e não
tóxicos ao ambiente nas concentrações empregadas. Podendo
seraplicado para o tratamento de espécies com alta absorbância, o
que permite melhoraproveitamento da radiação solar e,
consequentemente, torna-se atrativo do pontode vista econômico.
A simplicidade de aplicação dos processos e sua alta eficiência
de degradação são seus principais atrativos. Suas limitações
referem-se principalmente à estreita faixa de pH em que a eficiência
de degradação é máxima (2,5-3,0), que tem sido contornada pela
utilização de complexos de ferro que, além de estabilizar o ferro em
uma faixa mais ampla de pH, aumentam a eficiência de degradação
27 Segundo Santos-Juanes (2011), o controle de
parâmetrosoperacionais como: concentração de H2O2, concentração
de Fe2+ e pH se faznecessário. Em adição a esses parâmetros, o
processo foto- Fenton também necessita de um controle da dose de
radiação UV utilizada.
Na literatura, são encontradas inúmeras pesquisas que
utilizaram o processo foto-Fenton no tratamento de efluentes.
Ravichandran (2010) realizou o processo na mineralização do
pentafluorofenol, Mendonza-Marin (2010) empregou o tratamento
de foto-Fenton solar combinado com tratamento biológico na
descontaminação de efluentes industriais de culturas de
cana-de-açúcar e Navarro et al. (2011), removeu dez pesticidas em água de
lixiviação em escala piloto.
3.4.6 Parâmetros de qualidade de água
As características dos efluentes industriais são inerentes à
composição das matérias primas, das águas de abastecimento e do
processo industrial.
Os parâmetros físicos, químicos e toxicológicos são de grande
importância na caracterização das águas e a sua determinação é
exigida pelos órgãos responsáveis pela gestão dos recursos hídricos.
Dentre eles, alguns são pertinentes ao tipo de efluente
estudado neste trabalho como, por exemplo, os parâmetros citados
a seguir.
3.4.6.1 Turbidez
A turbidez está relacionada à aparência turva da
água,podendo ser entendida como a alteração da penetração da luz
causada pelas partículas em suspensão ou coloidal, que provocam a
sua difusão e absorção,sendo essas partículas constituídas por
plânctons, bactérias, algas, argilas, silte em suspensão e detritos
28 vez que reduz a fotossíntese da vegetação aquática(MACÊDO,
2004).
3.4.6.2 Potencial Hidrogeniônico (pH)
OpH, em solução, indica o caráter ácido, básico ou neutro do
meio causado por sólidos e gases dissolvidos provenientes da
dissolução de rochas, absorção de gases da atmosfera, oxidação da
matéria orgânica e fotossíntese.
Dependendo do seu valor, os sistemas aquáticos podem
apresentar características corrosivas ou incrustantes, bem como
interferir na vida aquática e influenciar na taxa de crescimento de
microrganismos (MACEDO, 2004; BAIRD, 2002).
3.4.6.3 Demanda bioquímica de oxigênio (DBO5)
O decréscimo de oxigênio dissolvido é o principal efeito
ecológico da poluição orgânica em um curso d’água. Entretanto, é
de grande importância o fornecimento adequado de oxigênio no
tratamento de esgotos por processo aeróbio para que os
microrganismos possam realizar os processos metabólicos
conduzindo à estabilização da matéria orgânica (MACEDO, 2003).
Com isso, surgiu a idéia de medir a força de poluição de um
determinado despejo pelo consumo de oxigênio, ou seja, quantificar
de forma indireta a potencialidade da geração de um impacto (VON
SPERLING, 2005).
A DBO representa de forma indireta a quantidade de matéria
orgânica biodegradável que foi consumida pelos microrganismos
aeróbios presentes no sistema aquático e constitui um importante
parâmetro na caracterização de seu grau de poluição (BAIRD,
2002). Indica a quantidade de oxigênio resultante após incubação
(estabilização da matéria orgânica carbonácea) da amostra por um
29 O conhecimento da DBO juntamente com a DQO é de
fundamental importância em estudos sobre a qualidade de águas,
bem como para projetos e controle operacional de estações de
tratamento de efluentes. Também serve como base para estudos de
autodepuração natural de um corpo aquático.
Nas águas naturais a DBO representa a demanda potencial de
oxigênio dissolvido que ocorre devido à estabilização dos compostos
orgânicos biodegradáveis. Níveis de DBO muito elevados podem
levar os níveis de oxigênio nas águas abaixo dos exigidos pelos
peixes, levando-os à morte. É uma variável da qualidade da água
que, de certa forma, quantifica a poluição orgânica pela depleção do
oxigênio, conferindo condição anaeróbia ao ecossistema aquático,
pela oxidação da matéria orgânica biodegradável (CETESB, 2009).
3.4.6.4 Demanda química de oxigênio (DQO)
A DQO é um parâmetro indispensável nos estudos de
caracterização de esgotos sanitários e de efluentes industriais,
porque avalia a quantidade de oxigênio dissolvido(OD) consumido,
em meio ácido, que leva à degradação de matéria orgânica. A
análise de DQO em efluentes e em águas de superfície é uma das
mais expressivas para determinação do grau de poluição da
água(MACEDO, 2003).
Os valores da DQO normalmente são maiores que os da DBO,
sendo o teste realizado em um prazo menor e em primeiro lugar,
orientando o teste da DBO. A análise da DQO é útil para detectar a
presença de substâncias resistentes à degradação biológica.
O aumento da concentração da DQO num corpo d'água se
deve principalmente a despejos de origem industrial. Assim, pode-se
considerar que a DQO é a demanda total de O2, devido a
substâncias recalcitrantes (não biodegradáveis),somada à demanda
30 A causadora do principal problema de poluição de esgotos e
corpos d’água é a matéria orgânica presente. Utilizam-se métodos indiretos para a quantificação da matéria orgânica, ou do seu
potencial poluidor, sendo a DQO e a DBO os parâmetros de maior
importância na caracterização do grau de poluição de um corpo
d’água de efluentes brutos e tratados (VON SPERLING, 2005).
3.4.6.5 Óleos e graxas
Estas substâncias são geralmente gorduras, ésteres, entre
outros e raramente encontrados em águas naturais.Normalmente,
são oriundos de despejos e resíduos industriais, esgotos domésticos,
efluentes de oficinas mecânicas, postos de gasolina, em que os
despejos de origem industrial são os que mais contribuem para o
aumento de matérias graxas nos corpos d’água (VON SPERLING,
2005).
A presença de óleos e graxas diminui a área de contato entre
a superfície da água e o ar atmosférico impedindo, dessa forma, a
transferência do oxigênio da atmosfera para a água.
Em processo de decomposição a presença dessas substâncias
reduz o oxigênio dissolvido elevando a DBO e a DQO, causando
alteração no ecossistema aquático.
3.4.7Testes de toxicidade
A toxicologia é definida como a ciência que estuda o efeito das
substâncias naturais ou sintéticas sobre os organismos vivos;
populações e comunidades, animais ou vegetais, terrestres ou
aquáticos (ZAGATTO e BERTOLETTI, 2006).
De acordo com Costa et al. (2008), testes de toxicidade são
ensaios realizados em laboratório, sob condições experimentais
específicas e controladas, utilizados para estimar a toxicidade de
31 O seu monitoramento tem a capacidade de prevenir impactos
ecológicos catastróficos sobre os ecossistemas aquát icos uma vez
que detectam seus efeitos antes de causar a mortalidade dos
organismos (MELO e ABESSA, 2002). A avaliação dos efeitos, por
meio destes testes, representa uma forma efetiva para avaliar o
efeito global dos impactos de contaminantes sobre os sis temas
bióticos.
Para Magalhães e Ferrão-Filho (2008), esses testes são
realizados com organismos indicadores, que apresentam baixa
tolerância quando expostos a determinados poluentes, apresentando
modificações fisiológicas, morfológicas ou comportamentais .
Raya-Rodriguez (2000), afirma queao se lançar elevadas
quantidades de substâncias provenientes de atividades industriais
noambiente aquático, torna-se analítica e economicamente inviável
a identificação e estabelecimento de padrões de emissão para todas
essas substâncias. Assim, através destas é impossível avaliar os
efeitos tóxicos que estas substâncias podem apresentar à biota e a
possível existência do efeito sinérgico entre as substâncias lançadas
no ambiente.
Com isso, o uso de análises toxicológicas para o
monitoramento biológico é de fundamental importância na avaliação
da toxicidade conjunta dos constituintes de um efluente aos
organismos aquáticos (BERTOLETTI et al.,1992).
De acordo com a CETESB - Companhia de Tecnologia de
Saneamento Ambiental (1990), a toxicidade dos efluentes pode não
ser detectada por todos os organismos. Behrens (1995) afirma que
é importante a avaliação do efeito da toxicidade de um determinado
efluente no mínimo a duas espécies representativas da biota
aquática para que se possa estimar o impacto do mesmo ao corpo
receptor.
Os monitoramentos químicos e biológicos através da
32 amostras permitem uma avaliação mais eficiente nos organismos.
Com isso, realizar trabalhos que avaliem os efeitos de efluentes
líquidos aos organismos aquáticos verificando a relação entre a
toxicidade e os parâmetros físicos e químicos analisados é de
fundamental importância (RAVERA, 1998 e CAIRNS, 2002).
Segundo Arenzon (2004), os ensaios de toxicidade têm
assumido um papel fundamental nas avaliações dos efeitos de
substâncias químicas específicas, amostras de água e sedimentos
sobre os organismos aquáticos.
Dentre estes testes, têm se destacado os ensaios de
toxicidade aguda e de toxicidade crônica. O ensaio de toxicidade
aguda é realizado para a avaliação de uma resposta rápida dos
organismos aquáticos, num intervalo curto de 0 a 96 horas. Através
desse ensaio, determina-se o parâmetro LC50, que é a concentração
do agente tóxico que causa letalidade ou outro efeito a 50% dos
organismos-teste (DELLAMATRICE, 2005).
Segundo Restani (2011), os ensaios de toxicidade crônica
apresentam um tempo de exposição que deve ser maior que 10%
da duração do ciclo de vida do organismo, uma vez que os
lançamentos contínuos de efluentes aquáticos ou o contato
prolongado com substâncias tóxicas podem provocar efeitos crônicos
em funções biológicas.
Nos bioensaios, os organismos testes utilizados podem ser
agrupados em: microrganismos, plantas e peixes (RIZZO, 2011). O
seu estudo vem sendo empregado para determinar o potencial
tóxico de diferentes tipos de contaminação no meio ambiente e,
juntamente com os parâmetros físico-químicos, permitem o
biomonitoramento de diversos tipos efluentes (YOUNG et al., 2012).
Assim, testes de toxicidade aguda são ferramentas
importantes e confiáveis para estimar as concentrações nas quais
um determinado produto tóxico provoca efeitos deletérios em uma