UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
CARLOS DANIEL SILVA DA SILVA
SÍNTESE, CARACTERIZAÇÃO, REATIVIDADE E APLICAÇÕES BIOLÓGICAS DE COMPLEXOS DE Ru(II) CONTENDO TIOAMIDAS
CARLOS DANIEL SILVA DA SILVA
SÍNTESE, CARACTERIZAÇÃO, REATIVIDADE E APLICAÇÕES BIOLÓGICAS DE COMPLEXOS DE Ru(II) CONTENDO TIOAMIDAS
Tese de doutorado apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Química. Área de concentração: Inorgânica.
Orientador: Prof. Dr. Luiz Gonzaga de França Lopes.
Coorientador: Prof. Dr. Eduardo Henrique Silva de Sousa.
CARLOS DANIEL SILVA DA SILVA
SÍNTESE, CARACTERIZAÇÃO, REATIVIDADE E APLICAÇÕES BIOLÓGICAS DE COMPLEXOS DE Ru(II) CONTENDO TIOAMIDAS
Tese de doutorado apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Química. Área de concentração: Inorgânica.
Aprovado em ___ / ___ /___
BANCA EXAMINADORA
___________________________________________________ Prof. Dr. Luiz Gonzaga de França Lopes (Orientador)
Universidade Federal do Ceará (UFC)
___________________________________________________ Prof. Dra. Izaura Cirino Nogueira Diógenes
Universidade Federal do Ceará (UFC)
___________________________________________________ Prof. Dr. Pierre Basílio Almeida Fechine
Universidade Federal do Ceará (UFC)
___________________________________________________ Prof. Dr. Adonay Rodrigues Loiola
Universidade Federal do Ceará (UFC)
___________________________________________________ Prof. Dr. Francisco Ordelei Nascimento da Silva
AGRADECIMENTOS
Caminhar para a conclusão de uma etapa como o doutorado me faz refletir que as contribuições para eu chegar até aqui são de diversas naturezas. Concluo com a ideia de superação do inimaginável, já que muitos foram os desafios, alguns dos quais não esperava encontrar.
No contexto do inimaginável, sou imensamente grato aos meus orientadores, professor Luizinho (Luiz Gonzaga de França Lopes) e professor Eduardo (Eduardo Henrique Silva de Sousa). São muitos os motivos a agradecer: são um exemplo de parceria com muita dedicação, responsabilidade, estudo, preocupação com a formação dos orientandos, rigor e seriedade com a obtenção dos resultados. No meu caso específico, gostaria de agradecer pelo estímulo em momentos que estava cansado e/ou desmotivado, que desacreditei no meu potencial, e vocês, com toda serenidade e firmeza, me ajudaram a me recompor e seguir! Então, para mim, era inimaginável encontrar em um ambiente tão denso como a academia, profissionais assim! Muito obrigado mesmo!
Agradeço a UFC, pela infraestrutura e formação pessoal e profissional. Destaco aqui o Programa de Pós-Graduação em Química, que, para mim, tem como marca a luta pelo crescimento institucional, independente das dificuldades e divergências. Profissionalmente, foi muito salutar conhecer e fazer parte deste programa. Destaco aqui o professor Antoninho Valentini, que contribuiu significativamente como membro da banca de qualificação.
Ainda no âmbito da UFC, em nome dos professores Edilberto Rocha Silveira e Tércio de Freitas Paulo, e do operador Herbert de Sousa Magalhães, agradeço ao Centro Nordestino de Aplicação e Uso da RMN (CENAUREM) e ao Centro Nacional de Processamento de Alto Desempenho (CENAPAD). O aprendizado construído a partir dos resultados obtidos por esses centros (Ressonância Magnética Nuclear e Cálculos Computacionais por DFT) era, por mim, inimaginável!
do Ceará), com os quais foram obtidos os ensaios de vasodilatação dos compostos; a estudante Carla Veríssimo e professora Loraine Campanati Andrade (Instituto de Ciências Biomédicas da Universidade Federal do Rio de Janeiro), pelos ensaios de citotoxicidade; os professores Davila Zampieri (Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará) e Marcos Eberlin (Laboratório ThoMSon de Espectrometria de Massa do Instituto de Química da Unicamp, pelos espectros de massa e auxílio na discussão dos mesmos; o professor Tércio de Freitas Paulo (Grupo de Pesquisa em Bioinorgânica da Universidade Federal do Ceará), pela obtenção e discussões dos dados obtidos por cálculos computacionais; o estudante e colega de doutorado Felipe Diógenes Abreu (Grupo de Pesquisa em Bioinorgânica da Universidade Federal do Ceará), pela obtenção e discussões acerca do ensaio de clivagem de DNA; o estudante e colega de doutorado Walysson Pereira Gomes (Grupo de Pesquisa em Bioinorgânica da Universidade Federal do Ceará), pelas medidas de análise elementar de Ru. Ainda nesse contexto, agradeço aos órgãos de fomento (CNPq, CAPES e FUNCAP) pelo suporte financeiro, sem o qual a execução do trabalho seria inviável.
Ao grupo de pesquisa em Bioinorgânica, por todo aprendizado a cada discussão, pela infraestrutura, pelas reuniões que me fizeram enxergar a imensidão da Química Inorgânica! Agradeço a cada professor em especial à professora Izaura Diógenes e o professor Audísio Dias Filho, que contribuíram bastante na banca de minha qualificação, e a cada colega/amigo pelo aprendizado e pela atenção, em especial Ana Claúdia, André Luiz, André Florêncio, Amanda, Caio, Catherine, Dani (Danielle), Denise, Dieric, Felipe, Manu (Manuela), Marta, Ramon, Ricardo, Sérgio, Ticyano e Vivania! Inevitável destacar os colegas e amigos que estiveram mais próximos, aqueles cujos projetos de pesquisa mais se assemelhavam e, consequentemente, as dores e delícias de cada trabalho também! Agradeço especialmente àqueles que mais tiraram do seu tempo para fazer com que o nosso tempo fosse melhor aproveitado! Isto foi uma marca que tornou tudo menos difícil! Destaco aqui: Aurideia, Edinilton, Florêncio, Gilmara, Marquinhos (José Marcos), Mikael e Wellinson.
engenhoso de solucionar problemas e o aprendizado com cada pergunta, cada reflexão, cada informação nova que vocês traziam!
À Lilia Janbartolomei, minha psicanalista, por ter me ajudado a cuidar mais e melhor da minha psique, aspecto indispensável para a minha trajetória.
Às professoras Adelaide Maria Vieira Viveiros e Zênis Novais da Rocha, pela formação acadêmica que me proporcionaram e pela atenção ao longo do doutorado;
Aos colegas do IFBA que me incentivaram e que sempre foram solícitos em momentos que precisei, em especial Paulo Daniel, Robert Newton, Rosângela Novaes e Walter Gomes.
Aos amigos que se fizeram presentes nesse período e me deram apoio constante: Adalberto Santana, Danilo Kleber, Ernani Lacerda, Marcelo Alisson, Vinicius Alexandre, Vinicius Oliveira.
A todos que torceram, acreditaram e oraram por mim.
Agradeço à família, em especial a meus pais, que estiveram diariamente comigo na luta, na torcida, na oração, no antagonismo, e a Luis, que, no tempo possível, procura se inteirar das minhas dificuldades.
RESUMO
Quatro novos compostos de coordenação contendo tioureia (Tu) e tiobenzamida (TBz) apresentaram atividades biológicas interessantes. Os nitrosilocomplexos, de formulação cis-[Ru(NO)(L)(phen)2](PF6)3. H2O, em que L = Tu ou TBz, apresentam
citotoxicidade frente a células de glioblastoma humano (GBM02 e U87), ação fotoclivativa de DNA plasmidial pBR322 com luz visível e dilatação de anéis de aorta de rato Wistar, dependente do grupo heme. Os complexos precursores, de formulação cis-[RuCl(L)(phen)2]PF6 H2O, tal como o nitrosilo com tioureia, também
clivam DNA na ausência de luz. Além disso, são fotoclivadores melhores que os respectivos nitrosilos, mas não dilatam tão bem os anéis de aorta (entre 30 e 40%). As propostas de formulação dos compostos foram baseadas em correlações de dados de cálculos computacionais (DFT e TD-DFT) com espectroscopia nas regiões do infravermelho e do ultravioleta-visível. Espectrometria de Massa, Análise Elementar, 1H RMN e 13C RMN endossaram as propostas feitas. Nos voltamogramas
cíclicos dos compostos há ondas correspondentes à redução do grupo nitrosil – {RuNO6/7} – para os nitrosilocomplexos, e de oxidação do centro metálico, nos
complexos precursores, em potenciais distintos do complexo cis-[Ru(phen)2Cl2]. Isso
indica a formação de complexos quimicamente distintos deste. Os compostos contendo o grupo nitrosil liberam NO sob luz visível e exibem 50% de conversão nitrosilo-nitrocomplexo em pH elevados em relação a maioria dos complexos análogos; ambas propriedades são relevantes para aplicação biológica. Além disso, todos os complexos reagem frente a GSH e L-cisteína. Isso indica que estes tióis, presentes no organismo humano, reagem não somente com o grupo nitrosil, mas também com o fragmento L dos compostos.
ABSTRACT
Four news coordinate compounds containing thiourea (Tu) and thiobenzamide (TBz) have interesting biological properties. The complexes nitrosyl, of the formulation cis-[Ru(NO)(L)(phen)2](PF6)3. H2O, where L = Tu ou TBz, have cytotoxicity to human
glioblastoma cells (GBM02 and U87), photoclivory action of plasmid pBR322 DNA, and ring dilation heme-dependent Wistar rat aort. Precursor complexes, of the formulation cis-[RuCl(L)(phen)2]PF6 H2O, such as nitrosyl with thiourea, also cleave
DNA in the absence of light. In addition to that, the best photocleavage results are from nitrosyl complexes, but they do not dilate the aortic rings so well (between 30 and 40%). Compound formulation proposals were based on data computational correlations (DFT and TD-DFT) with spectroscopy in the infrared and ultraviolet-visible regions. Mass Spectrometry, Elemental Analysis, 1H NMR and 13C NMR
endorsed the proposals made. In the cyclic voltammograms of the compounds there are waves corresponding to the reduction of the nitrosyl group – {RuNO6/7} – for the
nitrosylocomplexes and oxidation of the metal center in the precursor complexes to distinct potentials of the cis-[Ru(phen)2Cl2]. This indicates the formation of chemically
distinct complexes. Compounds containing the nitrosyl group release NO under visible light and exhibit 50% nitrosyl-nitro complex conversion at high pH relative to most analogous complexes; both properties are relevant for biological application. Furthermore, all complexes react against GSH and L-cysteine. This indicates that these thiols, present in the human body, react not only with the nitrosyl group, but also with the L fragment of the compounds.
LISTA DE FIGURAS
Figura 1 – Fórmula química do nitroprussiato de sódio... 34 Figura 2 – Representação da interação do óxido nítrico com o átomo de
Fe(II) do grupo heme, em que as esferas cinzas, azuis, rosas e brancas representam, respectivamente, os átomos de carbono, nitrogênio, oxigênio e hidrogênio... 36 Figura 3 – Diagrama qualitativo de energia de orbitais moleculares da
molécula de óxido nítrico... 37 Figura 4 – Estruturas das moléculas de (a) glutationa reduzida e (b)
L-cisteína. ... 38 Figura 5 – Estrutura da molécula de glutationa (GSSG)... 39 Figura 6 – Estrutura da molécula de cistina, produto de oxidação da
cisteína. ... 39 Figura 7 – Estrutura do complexo cis-[Ru(bpy)2(NO)(SO3)]+... 41
Figura 8 – Estruturas de complexos usados como agentes quimioterápicos. 42 Figura 9 – Estrutura dos complexos NAMI-A (a) e KP-1019 (b)... 42 Figura 10 – Estrutura molecular da temolozomida, um agente quimioterápico
do glioblastoma humano... 43 Figura 11 – Estrutura das substâncias 2,2-bipiridina (bpy), o-fenantrolina
(phen), dipiroquinoxalina (dpq) e dipirofenazina (dppz)... 43 Figura 12 – Eletroforese em gel de agarose, indicando as três formas de DNA
plasmidial. ... 45 Figura 13 – Estruturas dos ligantes tioureia (tu) e tiobenzamida (tbz),
respectivamente. ... 47 Figura 14 – Estruturas propostas para os nitrosilocomplexos sintetizados
neste trabalho: FOR0912, cis-[Ru(phen)2(NO)(tu)]3+, e
FOR0912A, cis-[Ru(phen)2(NO)(tbz)]3+... 47
Figura 15 – Estruturas propostas para os clorocomplexos, precursores do nitrosilocomplexos, sintetizados neste trabalho: FOR0212, cis-[Ru(phen)2Cl(tu)]+, e FOR0212A, cis-[Ru(phen)2Cl(tbz)]+... 48
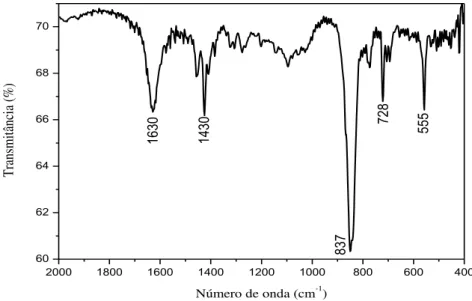
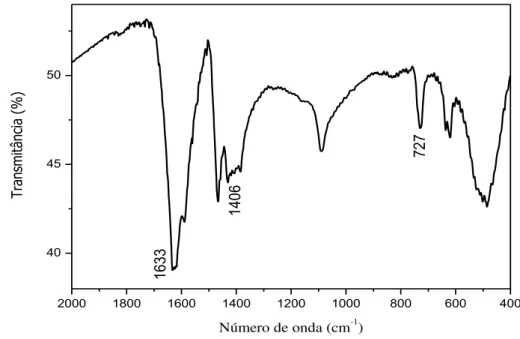
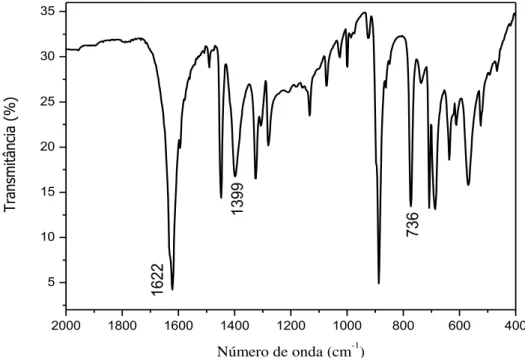
sódio; c- solução saturada de hidróxido de sódio; d- água destilada; e- solução do complexo precursor em acetona; : sentido do fluxo do óxido nítrico. ... 52 Figura 17 – LED azul utilizado nos experimentos de fotorreatividade e
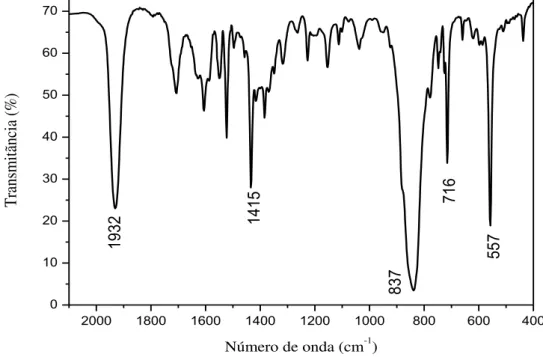
fotoliberação. ... 56 Figura 18 – Espectro, na região do IV, do composto FOR0212 em pastilha de
brometo de potássio. ... 59 Figura 19 – Espectro, na região do IV, do composto FOR0212A em pastilha
de brometo de potássio. ... 59 Figura 20 – Espectro na região do infravermelho da tioureia em pastilha de
brometo de potássio. ... 60 Figura 21 – Espectro na região do infravermelho da tiobenzamida em pastilha
de brometo de potássio. ... 61 Figura 22 – Espectro, na região do IV, de FOR0912 em pastilha de brometo
de potássio... 63 Figura 23 – Espectro, na região do IV, de FOR0912A em pastilha de brometo
de potássio. ... 63 Figura 24 – Espectros experimentais (preto) e calculados por DFT
(vermelho), dos nitrosilocomplexos na região do infravermelho.... 65 Figura 25 – Espectro de absorção na região do UV-vis do complexo
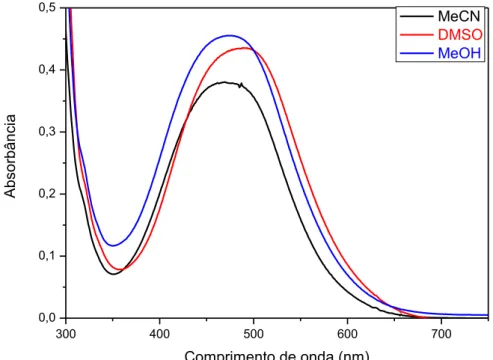
FOR0212 a 40 mol L-1 em acetonitrila (preto), dimetilsulfóxido
(vermelho) e metanol (azul)... 66 Figura 26 – Espectro UV-vis do complexo FOR0212A a 40 mol L-1 em
acetonitrila (preto), dimetilsulfóxido (vermelho) e metanol (azul).... 66 Figura 27 – Espectros de absorção, nas regiões do UV-vis, dos complexos
FOR0212 a 15 molL-1 (preto) e FOR0212A a 90 mol L -1(vermelho), em acetonitrila... 68
Figura 28 – Espectros dos complexos FOR0912 (vermelho) e FOR0912A (preto) nas regiões do ultravioleta, a 10 e 15 mol L-1, e do visível
(inset), a 140 e 215 molL-1... 69
Figura 30 – Espectro teórico de absorção, nas regiões do UV-vis, para o complexo FOR0212A, em que * indica a transição que possui maior força do oscilador... 71 Figura 31 – Espectros de absorção teórico e experimental do complexo
FOR0212 em acetonitrila, nas regiões do UV-vis, em que H e L expressam HOMO e LUMO, respectivamente... 72 Figura 32 – Espectros de absorção teórico e experimental do complexo
FOR0212A em acetonitrila, nas regiões do UV-vis, em que H e L expressam HOMO e LUMO, respectivamente... 72 Figura 33 – Composição percentual dos orbitais de fronteira do complexo
FOR0212. ... 74 Figura 34 – Composição percentual dos orbitais de fronteira do complexo
FOR0212A. ... 74 Figura 35– Composição percentual dos orbitais de fronteira do complexo
FOR0912. ... 79 Figura 36 – Composição percentual dos orbitais de fronteira do complexo
FOR0912A. ... 79 Figura 37 – Espectro teórico de absorção, nas regiões do UV-vis, para o
complexo FOR0912. ... 80 Figura 38 – Espectro teórico de absorção, nas regiões do UV-vis, para o
complexo FOR0912A... 80 Figura 39 – Espectros de absorção teórico e experimental do complexo
FOR0912 em acetonitrila, nas regiões do UV-vis, em que H e L expressam HOMO e LUMO, respectivamente... 81 Figura 40 – Espectros de absorção teórico e experimental do complexo
FOR0912A em acetonitrila, nas regiões do UV-vis, em que H e L expressam HOMO e LUMO, respectivamente... 81 Figura 41 – Espectro de RMN de 13C BB da tiobenzamida (500 MHz,
DMSO-d6). ... 82 Figura 42 – Espectro de RMN de 13C DEPT-135 da tiobenzamida (500 MHz,
Figura 45 – Estrutura numerada do ligante tioureia... 84 Figura 46 – Espectro de RMN de 13C BB da tioureia (500 MHz, DMSO-d6).... 85
Figura 47 – Estrutura numerada do complexo FOR0212A... 85 Figura 48 – Espectro 1H do complexo FOR0212A (500 MHz, acetona-d6)... 86
Figura 49 – Espectro COSY do complexo FOR0212A [(500 MHz, acetona-d6). ... 86 Figura 50 – Espectro de 13C do complexo FOR0212A [(500 MHz,
acetona-d6). ... 89 Figura 51 – Espectro APT do complexo FOR0212A [(300 MHz, acetona-d6)... 89 Figura 52 – Espectro HMBC do complexo FOR0212A (500 MHz, acetona-d6). 91 Figura 53 – Espectro HMQC do complexo FOR0212A (500 MHz,
acetona-d6). ... 91 Figura 54 – Espectro 1H do complexo FOR0212 (500 MHz, acetona-d6)... 93
Figura 55 – Espectro 1H do complexo FOR0212 (500 MHz, DMSO-d6)... 93
Figura 56 – Estruturas numeradas dos complexos FOR0912 e FOR0912A.... 94 Figura 57 – Espectro de 1H do complexo FOR0912 (500 MHz, DMSO-d6)... 95
Figura 58 – Espectro de 1H do complexo FOR0912A [(500 MHz, DMSO-d6)... 95
Figura 59 – Espectro COSY do complexo FOR0912 [(500 MHz, DMSO-d6).... 96 Figura 60 – Espectro COSY do complexo FOR0912A [(500 MHz, DMSO-d6).. 96 Figura 61 – Espectros de 13C do complexo FOR0912 (500 MHz, DMSO-d6)
em diferentes faixas. ... 98
Figura 62 – Espectro DEPT 135 do complexo FOR0912 (500 MHz, DMSO-d6). ...
99
Figura 63 – Espectro HMQC do complexo FOR0912 [(500 MHz, DMSO-d6)... 99 Figura 64 – Espectro HMBC do complexo FOR0912 [(500 MHz, DMSO-d6).... 100 Figura 65 – Espectro de 13C do complexo FOR0912A [(500 MHz, DMSO-d6).. 100
Figura 66 – Espectro DEPT 135 do complexo FOR0912A (500 MHz, DMSO-d6). ...
101
Figura 67 – Espectro HMQC do complexo FOR0912A (500 MHz, DMSO-d6).. 101 Figura 68 – Espectro HMBC do complexo FOR0912A (500 MHz, DMSO-d6)... 102 Figura 69 – Padrão isotópico do rutênio. ... 105 Figura 70 – Espectro de massa ESI(+) do complexo FOR0212A. Íons
Figura 71 – Espectro de massa ESI(+) do complexo FOR0212A. Íon
detectado: m/z 573,0202. ... 106
Figura 72 – Espectro de massa ESI(+) do complexo FOR0212A. Íon detectado: m/z 724,0421. ... 106
Figura 73 – Estrutura do complexo [Ru(phen)2(NCCH3)2]2+... 107
Figura 74 – Estrutura do complexo [Ru(phen)2(tu)(NCCH3)]2+... 107
Figura 75 – Estrutura do complexo [Ru(phen)2(tu)Cl]+. ... 108
Figura 76 – Estrutura do complexo {[Ru(phen)2(tu)(NCCH3)]PF6}+... 108
Figura 77 – Espectro de massa ESI(+) do complexo FOR0912. Íons detectados: m/z 272,0475 e 289,5390. ... 109
Figura 78 – Espectro de massa ESI(+) do complexo FOR0912A. Íons detectados: m/z 272,0475 e 289,5390. ... 109
Figura 79 – Espectro de massa ESI(+) do complexo FOR0912. Íons detectados: m/z 689,0591 e 724,0421. ... 110
Figura 80 – Espectro de massa ESI(+) do complexo FOR0912A. Íons detectados: m/z 689,0591 e 724,0421. ... 110
Figura 81 – Estrutura do complexo {[Ru(phen)2(NCCH3)2]PF6}+... 110 Figura 82 – Espectro de massa ESI(+) do complexo FOR0912. Íon detectado: m/z 561,0435. ... 111
Figura 83 – Estrutura do complexo [Ru(phen)2(SCN)(NCCH3)]+. ... 111
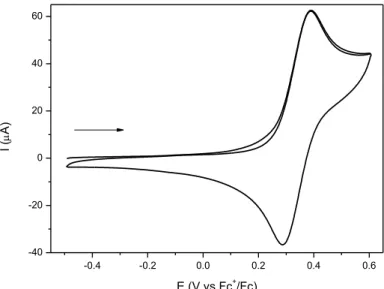
Figura 84 – Voltamograma cíclico do eletrodo de carbono vítreo a 100 mV s-1 em 0,1 mol L-1 de PTBA em MeCN contendo o complexo FOR0212. ... 112
Figura 85 – Voltamograma cíclico do eletrodo de carbono vítreo a 100 mV s-1 em 0,1 mol L-1 de PTBA em MeCN contendo o complexo FOR0212A. ... 112
Figura 86 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo solução: 0,1 mol L-1 de PTBA em MeCN, contendo o complexo FOR0212. Curva anódica. Eletrólito suporte v = 5 mV s-1... 114
Figura 88 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo solução: 0,1 mol L-1 de PTBA em MeCN, contendo o complexo
FOR0212A. Curva anódica. Eletrólito suporte v = 5 mV s-1... 115
Figura 89 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo solução: 0,1 mol L-1 de PTBA em MeCN, contendo o complexo
FOR0212A. Curva catódica. Eletrólito suporte v = 5 mV s-1... 115
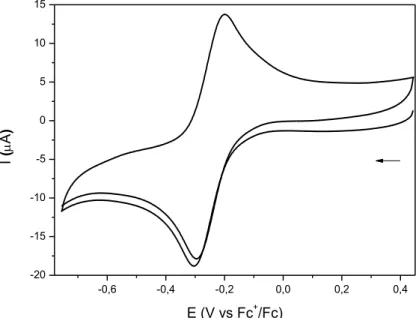
Figura 90 – Voltamograma cíclico do eletrodo de carbono vítreo em presença do complexo FOR0912. Eletrólito suporte: 0,1 mol L-1 de PTBA
em MeCN. v = 100 mV s-1. ... 116
Figura 91 – Voltamograma cíclico do eletrodo de carbono vítreo em presença do complexo FOR0912A. Eletrólito suporte: 0,1 mol L-1 de PTBA
em MeCN. v = 100 mV s-1. ... 116
Figura 92 – Voltamograma cíclico do eletrodo de carbono vítreo em presença do complexo FOR0912, a 100 mV s-1, em PTBA/MeCN 0,1 mol L
-1, na ausência (preto) e na presença de azida de sódio (azul)... 117
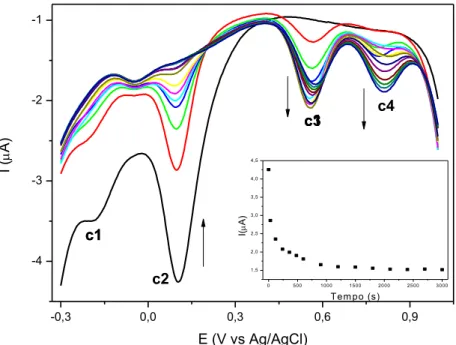
Figura 93 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo em presença do complexo FOR0912 (curva preta) frente à azida, em diferentes tempos. Curvas catódicas. Eletrólito suporte: 5%(v/v) MeCN / NaTFA 0,1 mol L-1 pH = 4,7. v = 5 mV s-1. Em
destaque: curva de corrente em E = + 0,1 V (onda c2) em função do tempo. ... 118 Figura 94 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo
em presença do complexo FOR0212 (curva preta) frente à azida, em diferentes tempos. Curvas catódicas. Eletrólito suporte: 5%(v/v) MeCN / NaTFA 0,1 mol L-1 pH = 4,7. v = 5 mV s-1... 120
Figura 95 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo em presença de tioureia (curva preta), de azida (curva azul) e da mistura de tioureia e azida (curva vermelha). Eletrólito suporte: 5%(v/v) MeCN / NaTFA 0,1 mol L-1 pH = 4,7. v = 5 mV s-1. Curvas
catódicas. ... 121 Figura 96 – Voltamograma de pulso diferencial do eletrodo de carbono vítreo
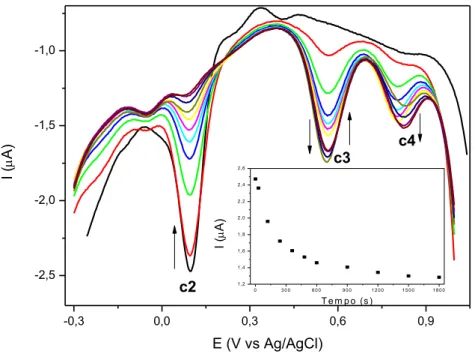
5%(v/v) MeCN / NaTFA 0,1 mol L-1 pH = 4,7. v = 5 mV s-1. Em
destaque: curva de corrente em E = + 0,1 V (onda c2) em função do tempo. ... 122 Figura 97 – Monitoramento da variação espectral do complexo FOR0912, a
90 mol L-1, em diferentes pH. ... 123
Figura 98 – Monitoramento da variação espectral do complexo FOR0912A, a 70 mol L-1, em diferentes pH. ... 123
Figura 99 – Curva de pH em função da absorbância em 410 nm para o complexo FOR0912. ... 124 Figura 100 – Curva de pH em função da absorbância em 414 nm para o
complexo FOR0912A. ... 124 Figura 101 – Alteração espectral do ligante tioureia (10 mol L-1), frente a GSH
a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4, por 10
h, na razão GSH/composto = 30. inset: recorte do espectro com destaque para a banda em 302 nm e a variação da absorbância em função do tempo. ... 126 Figura 102 – Alteração espectral do ligante tiobenzamida (10 mol L-1), frente
a GSH a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4,
por 10 h, na razão GSH/composto = 30. inset: recorte do espectro com destaque para a banda em 302 nm e a variação da absorbância em função do tempo. ... 126 Figura 103 – Alteração espectral do complexo FOR0212 (10 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4, por 10 h, na razão GSH/complexo =
30. ... 128 Figura 104 – Alteração espectral do complexo FOR0212A (10 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4, por 10 h, na razão GSH/complexo =
30. ... 128 Figura 105 – Alteração espectral do complexo FOR0212 (50 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4, por 10 h, na razão GSH/complexo =
Figura 106 – Alteração espectral do complexo FOR0212A (50 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução tampão fosfato 0,1 mol L-1, pH = 7,4, por 10 h, na razão GSH/complexo =
30. ... 129 Figura 107 – Alteração espectral do ligante tioureia (10 mol L-1), frente a GSH
a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10 h, na
razão GSH/composto = 30. ... 131 Figura 108 – Alteração espectral do ligante tiobenzamida (10 mol L-1), frente
a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por
10 h, na razão GSH/composto = 30. ... 131 Figura 109 – Alteração espectral do complexo FOR0212 (10 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10 h, na razão GSH/complexo = 30... 132
Figura 110 – Alteração espectral do complexo FOR0212A (10 mol L-1), na
região do ultravioleta, frente a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10 h, na razão GSH/complexo = 30... 132
Figura 111 – Alteração espectral do complexo FOR0212 (50 mol L-1), na
região do visível, frente a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10 h, na razão GSH/complexo = 30. ... 133
Figura 112 – Alteração espectral do complexo FOR0212A (50 mol L-1), na
região do visível, frente a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10 h, na razão GSH/complexo = 30. ... 133
Figura 113 – Alteração espectral do complexo FOR0912 (50 mol L-1) frente a
GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 10
h, na razão GSH/complexo = 30. ... 134 Figura 114 – Alteração espectral do complexo FOR0912A (50 mol L-1) frente
a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por
10 h, na razão GSH/complexo = 30. ... 135 Figura 115 – Alteração espectral do complexo cis-[RuCl2(phen)2] (50 mol L-1),
frente a GSH a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7,
por 10 h, na razão GSH/complexo = 1. ... 136 Figura 116 – Alteração espectral do complexo FOR0912 (50 mol L-1) frente a
1,5 h, na razão L-cisteína/complexo = 30. ... 137
Figura 117 – Alteração espectral do complexo FOR0912A (50 mol L-1) frente a L-cisteína a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 1,5 h, na razão L-cisteína/complexo = 30. ... 137
Figura 118 – Alteração espectral do complexo cis-[RuCl2(phen)2] (50 mol L-1), frente a L-cisteína a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 1,5 h, na razão L-cisteína/complexo = 1. ... 138
Figura 119 – Alteração espectral do complexo FOR0212 (50 mol L-1) frente a L-cisteína a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, por 1,5 h, na razão L-cisteína/complexo = 30. ... 138
Figura 120 – Alteração espectral do complexo FOR0212A (50 mol L-1) frente a L-cisteína a 37˚C em solução de NaTFA 0,1 mol L-1, pH = 4,7, na razão L-cisteína/complexo = 30. ... 139
Figura 121 – Monitoramento da variação espectral do complexo FOR0912 em solução 2%(v/v) MeCN NaTFA pH 4,7 frente a luz azul ( =450 nm) por 180 min. ... 140
Figura 122 – Monitoramento da variação espectral do complexo FOR0912A em solução 2%(v/v) MeCN NaTFA pH 4,7 frente a luz azul ( =450 nm) por 180 min. ... 140
Figura 123 – Espectros, nas regiões do UV-Vis, dos compostos FOR0212 (preto) e FOR0212A (vermelho) em solução 2%(v/v) MeCN NaTFA pH 4,7. ... 141
Figura 124 – Estrutura do cPTIO, um supressor de NO/HNO. ... 141
Figura 125 – Estrutura do cPTI, produto da reação entre cPTIO e NO. ... 142
Figura 126 – Estrutura do cPTI-H, produto da reação entre cPTIO e HNO. ... 142
Figura 127 – Monitoramento do perfil espectral do complexo FOR0912 (25 molL-1) por 3h em presença de cPTIO (150 molL-1), a 25˚C, em diferentes tempos de irradiação com LED azul. ... 143
Figura 128 – Monitoramento do perfil espectral do complexo FOR0912A (25 molL-1) por 3h em presença de cPTIO (150 molL-1), a 25˚C, em diferentes tempos de irradiação com LED azul. ... 143 Figura 129 – Monitoramento do perfil espectral do complexo FOR0912 (25
ausência de luz. ... 144 Figura 130 – Monitoramento do perfil espectral do complexo FOR0912A (25
molL-1) por 3h em presença de cPTIO (150 molL-1), a 25˚C, na
ausência de luz. ... 144 Figura 131 – Eletroforese em gel de agarose (1%) dos clorocomplexos
FOR0212 e FOR0212A em diferentes concentrações, frente ao DNA plasmídico pBR322, na ausência de luz (faixas 3 a 8) e após irradiação por 30 min com LED azul (faixas 9 a 14). DNA controles positivo (com luz) e negativo (sem luz) nas faixas 1 e 2, respectivamente. Concentração em mol L-1 (faixas): 5 (3 e 9), 10
(4 e 10), 20 (5 e 11), 40 (6 e 12), 60 (7 e 13) e 100 (8 e 14). 300 ng de DNA, 20 mol L-1 em pares de base. ... 145
Figura 132 – Eletroforese em gel de agarose (1%) dos nitrosilocomplexos FOR0912 e FOR0912A em diferentes concentrações, frente ao DNA plasmídico pBR322, na ausência de luz (faixas 3 a 8) e após irradiação por 30 min com LED azul (faixas 9 a 14). DNA controles positivo (com luz) e negativo (sem luz) nas faixas 1 e 2, respectivamente. Concentração em mol L-1 (faixas): 5 (3 e 9), 10
(4 e 10), 20 (5 e 11), 40 (6 e 12), 60 (7 e 13) e 100 (8 e 14). 300 ng de DNA, 20 mol L-1 em pares de base. ... 145
Figura 133 – Eletroforese em gel de agarose dos clorocomplexos FOR0212 e FOR0212A a 20 molL-1, frente ao DNA plasmídico pBR322, na
presença de supressores de radicais, sob luz. DNA controles positivos nas faixas 1; DNA + complexo nas faixas 2; com supressor (faixas): Manittol (3), L-histidina (4), TEMPO (5), SOD (6), cPTIO (7) e DMSO (8). 300 ng de DNA, 20molL-1 em pares
de base. ... 148 Figura 134 – Eletroforese em gel de agarose dos nitrosilocomplexos FOR0912
(faixas 2 a 8) e FOR0912A (faixas 9 a 15) a 60 molL-1, frente ao
(7 e 14) e DMSO (8 e 15). 300 ng de DNA, 20molL-1 em pares
de base. ... 148 Figura 135 – Eletroforese em gel de agarose dos complexos FOR0212 (faixas
2 a 4),FOR0212A (faixas 5 a 7) a 20 molL-1 e FOR0912 (faixas
8 a 10) e FOR0912A (faixas 11 a 13) a 60 molL-1, frente ao DNA
plasmídico pBR322, na presença de cloreto de sódio 150 (faixas 3, 6, 9 e 12) e 450 mmolL-1 (faixas 4, 7, 10 e 13). DNA controle negativo (sem luz) na faixa 1. DNA e complexo nas faixas 2, 5, 8 e 11. ... 150 Figura 136 – Eletroforese em gel de agarose dos complexos FOR0212 (faixas
2 e 3), FOR0212A (faixas 4 e 5) a 20 molL-1 e FOR0912 (faixas
6 a 8) e FOR0912A (faixas 9 a 11) a 60 molL-1, frente ao DNA
plasmídico pBR322, na presença de GSH (faixas 3, 5, 7 e 9) e de GSH e cPTIO (faixas 8 e 11). DNA controle negativo (sem luz) na faixa 1. DNA e complexo nas faixas 2, 4, 6 e 9. ... 150 Figura 137 – Curva de dose-resposta dos complexos cis-[RuCl2(phen)2],
FOR0212 e FOR0212A, em ensaios de vasodilatação de aortas de rato, em que [n] indica quantidade de anéis de aorta testados. 152 Figura 138 – Curva de dose-resposta dos complexos FOR0912, FOR0912A e
nitroprussiato de sódio, em ensaios de vasodilatação de aortas de rato, em que [n] indica quantidade de anéis de aorta testados. 152 Figura 139 – Estrutura do 1H-[1,2,4]oxadiazol[4,3-a]quinoxalinona, um
inativador do grupo heme... 154 Figura 140 – Estrutura do N-nitro-L-argininametilester (L-NAME), um inibidor
da enzima óxido nítrico sintetase... 154 Figura 141 – Curva de dose-resposta dos complexos FOR0912 e FOR0912A,
em ensaios de vasodilatação de aortas de rato, na presença de ODQ, em que [n] indica quantidade de anéis de aorta testados... 155 Figura 142 – Curva de dose-resposta do complexo FOR0912, em ensaio de
vasodilatação de aorta de rato, na presença de L-NAME, em que [n] indica quantidade de anéis de aorta testados... 155 Figura 143 – Curva de dose-resposta do complexo FOR0912A, em ensaio de
[n] indica quantidade de anéis de aorta testados... 156 Figura 144 – Viabilidade celular da linhagem de glioblastoma humano GBM02
sem adição (preto) e com adição de GSH (cinza), após 24 h de adição do complexo FOR0912 em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 158
Figura 145 – Viabilidade celular da linhagem de glioblastoma humano GBM02 sem adição (preto) e com adição de GSH (cinza), após 24 h de adição do complexo FOR0912A em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 158
Figura 146 – Viabilidade celular da linhagem de glioblastoma humano U87 sem adição (preto) e com adição de GSH (cinza), após 24 h de adição do complexo FOR0912 em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 159
Figura 147 – Viabilidade celular da linhagem de glioblastoma humano U87 sem adição (preto) e com adição de GSH (cinza), após 24 h de adição do complexo FOR0912A em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 159
Figura 148 – Viabilidade celular da linhagem de glioblastoma humano GBM02 sem adição (preto) e com adição de GSH (cinza), após 48 h de adição do complexo FOR0912 em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 160
Figura 149 – Viabilidade celular da linhagem de glioblastoma humano GBM02 sem adição (preto) e com adição de GSH (cinza), após 48 h de adição do complexo FOR0912A em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 160
Figura 150 – Viabilidade celular da linhagem de glioblastoma humano U87 sem adição (preto) e com adição de GSH (cinza), após 48 h de adição do complexo FOR0912 em diferentes concentrações. [GSH] no poço = 5 mmol L-1. ... 161
LISTA DE EQUAÇÕES
Equação 1 – Processo redox envolvendo o centro metálico nos
clorocomplexos (L= tioureia ou tiobenzamida) nos complexosexo FOR0212 e FOR0212A... 113 Equação 2 – Processo redox envolvendo o centro metálico no produto de
solvólise do complexo FOR0212 em acetonitrila... 117 Equação 3 – Representação da reação de substituição da molécula de óxido
nítrico pela de acetonitrila... 118 Equação 4 – Representação da reação de substituição da molécula de óxido
LISTA DE ESQUEMAS
Esquema 1 – Processos redox envolvendo o grupo NO coordenado. ... 119 Esquema 2 – Processos redox envolvendo o centro metálico nos
aquocomplexos formados. ... 120 Esquema 3 – Processos redox envolvendo o centro metálico nos
clorocomplexos associados à reatividade do complexo FOR0212 (Figura 94). ... 120 Esquema 4 – Possível mecanismo de formação de hidrogenossulfeto a partir
LISTA DE TABELAS
Tabela 1 – Substâncias comercialmente usadas durante o trabalho... 49 Tabela 2 – Números de onda e respectivas atribuições para os
clorocomplexos...
60 Tabela 3 – Números de onda e respectivas atribuições para os ligantes Tu e
TBz. ... ... 61
Tabela 4 – Números de onda e respectivas atribuições para os nitrosilocomplexos. ... 64
Tabela 5 Deslocamentos químicos de carbono do grupo CS nos ligantes e nos complexos. ... 64
Tabela 6 – Momento de dipolo e constante dielétrica dos solventes em que os complexos FOR0212 e FOR0212A foram dissolvidos e máximos de absorbância, na região do visível, das soluções. ... 67
Tabela 7 – Máximos de absorbância, em acetonitrila, dos ligantes envolvidos neste trabalho. ... 68
Tabela 8 – Dados espectroscópicos nas regiões do UV-vis: absortividades molares dos complexos FOR0212 e FOR0212A, em acetonitrila, em cada comprimento de onda e respectivos coeficientes de correlação. ... 68
Tabela 9 – Dados espectroscópicos nas regiões do UV-vis: absortividades molares dos complexos FOR0912 e FOR0912A em cada comprimento de onda e respectivos coeficientes de correlação... 69 Tabela 10 – Contribuição das transições calculadas por DFT para a absorção
do complexo cis-[Ru(phen)2Cl(tu)]+ (FOR0212) nas regiões do
UV-vis... 73
Tabela 11 – Contribuição das transições calculadas por DFT para a absorção do complexo cis-[Ru(phen)2Cl(tbz)]+ (FOR0212A) nas regiões do
UV-vis. ... 75
Tabela 12 – Contribuição das transições calculadas por DFT para a absorção do complexo FOR0912 nas regiões do UV-vis. ... 77
Tabela 13 – Contribuição das transições calculadas por DFT para a absorção do complexo FOR0912A nas regiões do UV-vis. ... 78
1H do TBz. ...
Tabela 15 – Deslocamentos químicos () dos prótons no complexo cis-[RuCl(TBz)(phen)2]+. ...
87
Tabela 16 – Deslocamentos químicos de 13C do complexo FOR0212A. ... 92
Tabela 17 – Deslocamentos químicos (ppm) de 1H dos compostos FOR0912 e FOR0912A. ... 94
Tabela 18 – Deslocamentos químicos (ppm) de 13C dos compostos FOR0912
e FOR0912A. ... 103
Tabela 19 – Comprimentos médios84, 85 e otimizados por DFT das ligações CS
e CN para os complexos e os ligantes tioureia e tiobenzamida. ... 104
Tabela 20 – Porcentagens dos elementos C, H, N e Ru nos nitrosilocomplexos. ... 105
Tabela 21 – Valores de m/z e respectivos erros e atribuições para o complexo FOR0212A. ... 106
Tabela 22 – Valores de m/z e respectivos erros e atribuições exclusivamente para os complexos FOR0912 e FOR0912A. ... 111
Tabela 23 – Energia dos orbitais de fronteira, determinados por DFT, e potenciais de meia-onda dos processos envolvendo o centro metálico e o grupo nitrosil nos complexos sintetizados neste trabalho. ... 113
Tabela 24 – Radicais e seus respectivos supressores. ... 147
Tabela 25 – Potência e eficácia dos complexos discutidos neste trabalho em comparação ao nitroprussiato de sódio. ... 151
LISTA DE ABREVIATURAS
APT Attached proton test BB Broad band
Bpy 2,2-bipiridina Cyst L-cisteína
COSY Homonuclear correlation spectroscopy
cPTIO 2-(4-Carboxifenil)-4,4,5,5-tetrametilimidazol-1-oxi-3-óxido DNA Ácido desoxirribonucleico
DMF N,N-dimetilformamida DMSO Dimetilsulfóxido
DTPA ácido dietielenotriaminpentaacético
Fc Ferroceno
FOR0212 cis-[RuCl(Tu)(phen)2]+ ou cis-[RuCl(Tu)(phen)2]PF6 . H2O
FOR0212A cis-[RuCl(TBz)(phen)2]+ ou cis-[RuCl(TBz)(phen)2]PF6 . H2O
FOR0912 cis-[Ru(NO)(Tu)(phen)2]3+ ou cis-[Ru(NO)(Tu)(phen)2](PF6)3.
H2O
FOR0912A cis-[Ru(NO)(TBz)(phen)2]3+ ou
cis-[Ru(NO)(TBz)(phen)2](PF6)3 . H2O
GSH Glutationa reduzida
HMBC Heteronuclear multiple quantum coherence HMQC Heteronuclear multibond coherence
IL Transição interna do ligante
ImN Imidazol
IV Infravermelho MeOH Metanol MeCN Acetonitrila
MTT Brometo de metiltiazoldifeniltetrazólio phen o-fenantrolina ou 1,10- fenantrolina PE Fenilefrina
PTBA Perclorato de tetrabutilamônio RMN Ressonância Magnética Nuclear SOD Superóxido Dismutase
TCML Transferência de carga metal-ligante TCLL Transferência de carga interligante TEMPO N-oxil-2,2,6,6-tetrametilpiperidina
Tu Tiouréia
UV Ultravioleta
UV-vis Ultravioleta-visível VC Voltamteria cíclica
SUMÁRIO
1 INTRODUÇÃO... 34
1.1 Contexto... 34
1.2 O óxido nítrico... 35
1.3 Complexos: NO e HNO... 38
1.4 Complexos e câncer... 41
1.5 Complexos: o centro metálico e os ligantes... 45
2 OBJETIVOS... 47
3 MATERIAIS... 49
4 PROCEDIMENTO EXPERIMENTAL... 51
4.1 Sínteses... 51
4.1.1 Síntese do complexo cis-[RuCl(tu)(phen)2]PF6 . H2O (FOR0212)... 51 4.1.2 Síntese do complexo cis-[Ru(NO)(Tu)(phen)2](PF6)3 . H2O
(FOR0912) ...
51
4.1.3 Síntese do complexo cis-[RuCl(tbz)(phen)2]PF6 . H2O
(FOR0212A) ...
51
4.1.4 Síntese do complexo cis-[Ru(NO)(Tu)(phen)2](PF6)3 . H2O (FOR0912A) ...
52
4.2 Caracterização... 52
4.2.1 Espectroscopia de ressonância magnética nuclear... 53 4.2.2 Análise elementar... 53 4.2.3 Espectrometria de Massa... 53 4.2.4 Voltametria cíclica e de pulso diferencial... 54 4.2.5 Estudos computacionais... 54 4.2.6 Medidas de conversão nitrosilo-nitrocomplexo... 55
4.3 Reatividade... 55
4.3.1 Frente a redutores biológicos... 55 4.3.2 Fotorreatividade... 56 4.3.3 Fotoliberação... 56
4.4 Dados biológicos... 57
5 RESULTADOS E DISCUSSÃO... 59
5.1 Caracterização... 59
5.1.1 Espectroscopia vibracional na região do infravermelho... 59 5.1.2 Espectroscopia nas regiões do ultravioleta-visível... 65
5.1.2.1 Clorocomplexos... 65 5.1.1.2 Nitrosilocomplexos... 69
5.1.3 Cálculos computacionais... 70
5.1.3.3 Clorocomplexos... 70 5.1.3.2 Nitrosilocomplexos... 76
5.1.4 Espectroscopia de Ressonância Magnética Nuclear... 82
5.1.4.1 Tiobenzamida e tioureia... 82 5.1.4.2 Complexo FOR0212A... 85 5.1.4.3 Complexo FOR0212... 92 5.1.4.4 Nitrosilocomplexos... 93
5.1.5 Análise elementar... 104 5.1.6 Espectrometria de massa... 105 5.1.7 Voltametria... 111
5.1.7.1 Em meio orgânico (acetonitrila) ... 111 5.1.7.2 Em meio aquoso... 118
5.1.8 Conversão nitrosilo-nitrocomplexo... 122
5.2 Reatividade... 125
5.2.1 Reatividade frente a tióis... 125
5.2.1.1 Frente à glutationa reduzida a pH = 7,4... 125 5.2.1.2 Frente à glutationa reduzida a pH = 4,7... 130 5.2.1.3 Frente à L-cisteína a pH = 4,7... 136
5.2.2 Fotorreatividade... 139 5.2.3 Fotoliberação... 141
5.3 Dados biológicos... 145
5.3.1 Ensaio de clivagem do DNA... 145 5.3.2 Ensaio de vasodilatação... 151 5.3.3 Citotoxicidade... 157
6 CONCLUSÕES... 162
REFERÊNCIAS... 164
APÊNDICE A – CURVA DE ABSORBÂNCIA EM FUNÇÃO DA CONCENTRAÇÃO DO COMPLEXO FOR0212... 174
APÊNDICE B – CURVA DE ABSORBÂNCIA EM FUNÇÃO DA CONCENTRAÇÃO DO COMPLEXO FOR0212A... 177
APÊNDICE C – CURVA DE ABSORBÂNCIA EM FUNÇÃO DA CONCENTRAÇÃO DO COMPLEXO FOR9212... 180
1 INTRODUÇÃO 1.1 Contexto
De acordo com a Organização Mundial de Saúde (OMS), as doenças cardiovasculares foram a principal causa de morte, equivalendo a 31% dos óbitos. Além disso, dentre os falecimentos de pessoas abaixo de setenta anos, causados por doenças não contagiosas, 37% está associado a patologias cardiovasculares.1
No que tange a indicadores socioeconômicos, 75% dos óbitos causados por esse tipo de patologia ocorrem em países de baixa ou média renda. Esse percentual se torna maior (82%) quando se refere às mortes, por doenças não contagiosas, de pessoas com menos de setenta anos residentes no referidos países.1
Para além disto, a alimentação saudável, um dos fatores que dificulta o desenvolvimento de tais doenças, tem ficado cada vez mais comprometida, devido ao aumento de consumo de alimentos industrializados, muitos dos quais contêm, em grande quantidade, sódio, íon responsável por elevação da pressão arterial.2 Tendo
em vista essa realidade, a administração de fármacos eficientes é uma estratégia adicional para a atenuação dos dados acima citados.
Uma das substâncias usadas no tratamento de hipertensão aguda é o nitroprussiato de sódio (NPS) 3-5, que se trata de um composto de coordenação
(Figura 1) que contém os grupos ciano e nitrosil coordenados ao Fe(II).
Figura 1 - Fórmula química do nitroprussiato de sódio.
Fonte: o autor.
De acordo com a literatura, a atuação deste complexo metálico como vasodilatador consiste na formação do óxido nítrico a partir do grupo nitrosil e liberação deste óxido3. Contudo, antecedente à liberação de óxido nítrico, há
liberação de cianeto,5 que pode se coordenar ao ferro da hemoglobina,
inviabilizando o transporte de oxigênio.6 Esta situação poderia inviabilizar o uso
sódio, o que propicia a geração de tiocianato, que é excretado sem causar efeitos colaterais.4
Entretanto, embora usado em casos de hipertensão aguda, o nitroprussiato de sódio pode promover um decréscimo tão brusco da pressão arterial que o paciente no qual o mesmo foi administrado pode apresentar um quadro de hipotensão. Isso ocorre porque a liberação de óxido nítrico a partir desse composto é rápida.5 Assim, a busca por outros nitrosilocomplexos 7-13 que sejam tão eficientes
quanto o nitroprussiato e que liberem óxido nítrico de modo controlado tem crescido, sobretudo depois que se descobriram as relevâncias biológicas deste óxido.14
1.2 O óxido nítrico
O óxido nítrico é uma substância biossintetizada a partir da L-arginina, num processo intermediado pela enzima óxido nítrico sintetase (ONS). Esta enzima pode estar presente no endotélio, no cérebro ou sistema nervoso. Nestes casos as denominações são ONS endotelial e ONS neuronal, respectivamente. Há também a possibilidade de produção desta enzima por indução imunológica; nessa situação a denominação é ONS induzida.
A distinção entre as isoformas da enzima não se restringe ao modo como são chamadas; indica também a função que o óxido nítrico, gerado por intermédio das mesmas, possui. Quando produzido pela enzima ONS induzida, o óxido nítrico é responsável pela citotoxicidade. Neste caso, a referida produção é dependente de alguma perturbação, anomalia, no funcionamento do organismo, a exemplo do desenvolvimento de células tumorais. Neste sentido, o supracitado óxido tem ação antitumoral.15 e sua atuação consiste na inativação de enzimas associadas à
respiração celular, seja por reações redox – oxidação do Fe(II) – ou reação ácido-base de Lewis – coordenação ao Fe(II), de modo a inviabilizar a coordenação da molécula de oxigênio.6
proporcional à concentração de glutamato, proveniente da guanosina monofosfato cíclica (cGMP).
cGMP é produzida a partir de guanosina trifosfato (GTP) catalisada pela guanilato ciclase solúvel (sGC), uma enzima que possui um grupo heme e um resíduo de histidina coordenado ao átomo de Fe(II) do grupo heme (Figura 2). Para ser ativada, o óxido nítrico se coordena ao referido centro metálico.16 Assim,
substâncias que oxidam o átomo de Fe(II) inativam a enzima17, já que a molécula
NO não se liga ao Fe(III), de modo a ativá-la. Daí a correlação do óxido nítrico com o desenvolvimento da memória tardia.
Figura 2 - Representação da interação do óxido nítrico com o átomo de Fe(II) do grupo heme, em que as esferas cinzas, azuis, rosas e brancas representam, respectivamente, os átomos de carbono, nitrogênio, oxigênio e hidrogênio.
Fonte: adaptado da referência.18
cGMP também propicia a abertura de canais de íons Ca2+, diminuindo a
quantidade destes na célula. Posto que a concentração destes íons é diretamente proporcional à contração muscular, a ativação da sGC pelo NO também promove relaxamento dos vasos sanguíneos, o que possibilita o aumento da área de circulação do sangue e, por conseguinte, a força com que o mesmo se movimenta decresce. Portanto, a pressão arterial diminui.19 Nesta situação, contudo, NO é
produzido pela enzima ONS endotelial.15
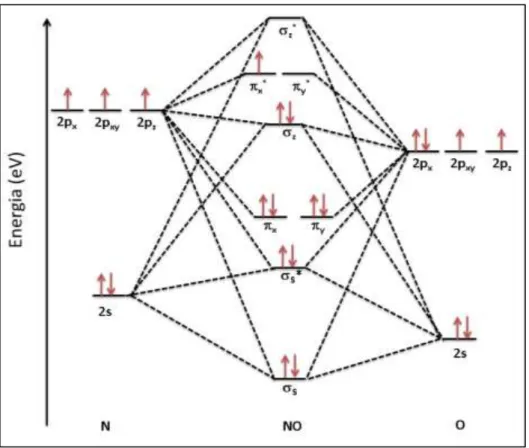
Para se ligar ao Fe(II) da guanilato ciclase solúvel, o óxido nítrico atua como base de Lewis, usando os elétrons do orbital σz (Figura 3), correspondente a
um par dos pares de elétrons não ligantes do átomo de nitrogênio, já que a diferença de energia entre os orbitais deste átomo e do orbital σz é menor aquela para orbitais
Figura 3 - Diagrama qualitativo de energia de orbitais moleculares da molécula de óxido nítrico.
Fonte: o autor.
Como pode ser visto tanto no diagrama de orbital molecular, quanto na estrutura de Lewis, o óxido nítrico possui uma quantidade ímpar de elétrons e, portanto, possui natureza química radicalar, o que indica que esta espécie possui elevada reatividade e, portanto, baixa seletividade. Associando-se estas propriedades à alta velocidade de difusão no sangue (3,3 . 10-3 mm2 s-1)15 e à rápida
reação com oxigênio, formando dióxido de nitrogênio,6 a possibilidade de
administração direta do óxido nítrico para qualquer fim farmacológico é inviável. Nesta perspectiva, o conhecimento e uso adequado das propriedades químicas associadas ao grupo NO pode ser bastante salutar para investir em fármacos à base de NO.
o único elétron do orbital *, formando NO+. Tendo em vista que NO+ não possui
elétrons nos orbitais *, este aceita mais densidade eletrônica de um dado centro metálico (M) que o NO. Assim, a ligação M – NO é mais fraca que M – NO+,
admitindo neste caso que M é um metal mole, capaz de retrodoar densidade eletrônica. Nessa perspectiva, a modificação dos centros metálicos e dos ligantes, em um nitrosilocomplexo, pode modelar uma liberação controlada de óxido nítrico, diferentemente do que ocorre com o nitroprussitato de sódio, o qual possui limitações, como já foi citado.20
1.3 Complexos: NO e HNO
Para que haja liberação de NO a partir de um nitrosilocomplexo, é preciso que ocorra uma redução do grupo nitrosil envolvendo um elétron. Esse fenômeno pode ocorrer através de incidência de radiação ou via transferência de elétrons, seja de alguma espécie redutora ou de um eletrodo polarizável.
Uma vez que a maioria destes complexos possui banda de transferência de carga metal- ligante, com maior contribuição do NO, na região do ultravioleta21-24,
a liberação fotoquímica do NO geralmente é dependente de fontes de irradiação nesta região (UV). Na ausência de luz, redutores como azida25, 26, glutationa
reduzida27, 28 e L-cisteína27 têm sido usados pra propiciar a conversão do grupo
nitrosil em óxido nítrico.
Glutationa reduzida (GSH) e L-cisteína (Figura 4) são substâncias que, em sistemas biológicos, atuam como redutores, formando glutationa (Figura 5) e cistina (Figura 6), respectivamente. A L-cisteína é um aminoácido e a glutationa reduzida é um tripeptídeo, constituído a partir de três aminoácidos: glicina, cisteína e ácido glutâmico.29-31
Figura 4 - Estruturas das moléculas de (a) glutationa reduzida e (b) L-cisteína.
(a) (b)
Figura 5 – Estrutura da molécula de glutationa (GSSG) .
Fonte: o autor.
Figura 6 - Estrutura da molécula de cistina, produto de oxidação da cisteína.
Fonte: o autor.
GSH é uma espécie encontrada na maioria dos organismos vivos. Em seres humanos, é encontrada em pequenas quantidades no plasma sanguíneo (10 a 30 mol L-1)29, apesar de nas proximidades dos sítios enzimáticos está em
concentração maiores (3 mmol L-1), tal como no fígado (5 a 10 mmol L-1), onde
metaboliza xenobióticos, substâncias estranhas ao organismo que comprometem o funcionamento deste. Essa função da GSH consiste na interação desta espécie, através do grupo tiol, com centros nucleofílicos do xenobiótico ou com enzimas que facilitam a interação do substrato com GSH. Neste último caso, a maioria das enzimas são do tipo trans-membrana, o que reforça a função da glutationa reduzida como agente citotóxico.31
Além disso, a depender também da quantidade de resíduos de cisteína, a resistência mecânica das proteínas difere. Isso fica bem ilustrado no fato de que tanto a definição de cachos em cabelos crespos quanto a rigidez dos chifres de rinocerontes está associada às ligações de dissulfeto, proveniente de resíduos de cisteína.30 Assim, tendo em vista a relevância da cisteína e da GSH em sistemas
biológicos e sabendo-se que ambas reduzem nitrosilocomplexos a óxido nítrico27, 32,
o uso desses redutores em ensaios químicos pode mimetizar a atuação de um composto em meio biológico.
De acordo com Souza e colaboradores33, a depender das condições de
pH e teor de oxigênio, além da formação de óxido nítrico, há indícios de geração de ácido hiponitroso monomérico ou nitroxil (HNO) a partir da reação entre nitroprussiato e tióis como L-cisteína e GSH. Esse aspecto é relevante já que recentemente funções biológicas relevantes associadas ao HNO têm sido descobertas.34, 35
Tal como a molécula NO, a molécula HNO é produzida endogenamente, inclusive pela NOS, em condições de estresse oxidativo36; é produzida também a
partir de nitrosotióis, os quais são gerados a partir da reação entre óxido nítrico e tióis37. Entretanto, NO e HNO possuem funções biológicas distintas34, o que
potencializa a atuação farmacológica dos nitrosilocomplexos.
Dentre as funções da molécula HNO, destacam-se a relevância no tratamento de: insuficiência cardíaca, já que aumenta a capacidade de contração do músculo cardíaco; alcoolismo, visto que inibe a enzima aldeidodesidrogenase; e câncer, uma vez que inibe a vascularização em células tumorais, impedindo o desenvolvimento das mesmas.34
Neste contexto, o nitrosilocomplexo cis-[Ru(bpy)2(NO)(SO3)]+ (Figura 7),
em que bpy = 2,2’-bipiridina, em presença de GSH e N-acetil-L-cisteína, exibiu atividade antiangiogênica, ou seja, inibiu a vascularização em células tumorais, o que se configura um indício de liberação de HNO. Paralelamente, através de ensaio com capturadores seletivos de NO/HNO, cPTIO e mioglobina, constatou-se a liberação de HNO.38 Posto que os liberadores de HNO relatados na literatura são
Figura 7 - Estrutura do complexo cis-[Ru(bpy)2(NO)(SO3)]+.
Fonte: o autor.
1.4 Complexos e câncer
Complexos metálicos já são aplicados em terapia de câncer (Figura 8). Além disso, alguns outros estão em fase clínica por inibir metástase (Figura 9- a) e induzir apoptose em células de carcinoma colorretal (Figura 9- b), neste caso incluem-se complexos de rutênio.40 Porém, devido aos tumores se manifestarem
Figura 8 - Estruturas de complexos usados como agentes quimioterápicos.
Fonte: adaptado da referência.41
Figura 9 - Estrutura dos complexos NAMI-A (a) e KP-1019 (b).
Fonte: adaptado da referência.42
Dentre os tumores que atingem os humanos, um dos mais agressivos é o glioblastoma. Este tipo de câncer é o mais agressivo do sistema nervoso central43 e
Figura 10 - Estrutura molecular da temolozomida, um agente quimioterápico do glioblastoma humano.
Fonte: o autor.
A temolozomida modifica o DNA, ao ser fonte de grupo metila para as bases nitrogenadas adenina e guanina. Complexos metálicos também atuam frente ao DNA, ao interagirem com essas bases nitrogenadas, via ligação de hidrogênio44
ou até mesmo se coordenando de modo a gerar adutos, a exemplo da atuação da cisplatina e complexos análogos45-48, e complexos coordenativamente insaturados –
ou com posições lábeis – de rutênio com ligantes polipiridínicos49, 50 e arenos51.
Outro modo de atuação tumoricida consiste na interação do composto com as bases nitrogenadas do DNA via elétrons , como ocorre com espécies aromáticas, a exemplo de heterocíclicos nitrogenados como 2,2’-bipiridina, o-fenantrolina e outros análogos (Figura 11), além dos complexos que os contém52-54.
Nestes casos, ocorre a intercalação da porção plana do agente tumoricida nas fitas do DNA, ou seja, a espécie citotóxica ocupa um espaço entre as fitas e se mantém lá através da interação dos elétrons deslocalizados, denominada - “stacking”. Neste caso, as bases nitrogenadas, inevitavelmente, mudam de posição, mas ainda se mantém voltadas para a região entre as fitas. 41, 55
Figura 11 - Estrutura das substâncias 2,2-bipiridina (bpy), o-fenantrolina (phen), dipiroquinoxalina (dpq) e dipirofenazina (dppz).
Diferentemente, quando ocorre a inserção da espécie citotóxica, esta se posiciona entre as fitas de DNA, de modo que as bases nitrogenadas ficam direcionadas para a região externa às fitas. 56 De modo semelhante à intercalação, a
inserção ocorre do seguinte modo: o movimento dos elétrons em uma das espécies possibilita a geração instantânea de regiões com distintas densidades eletrônicas, de modo a induzir o movimento dos elétrons , na espécie vizinha, e, consequentemente, regiões com elevada densidade eletrônica de uma espécie sejam atraídas por regiões de baixa densidade eletrônica de outra espécie.
Outra possibilidade de interação é aquela em que o agente citotóxico permanece nos espaços existentes na dupla hélice. Esses espaços são denominados sulcos. Nestas situações a perturbação na estrutura da dupla hélice é menor que nos casos anteriores, visto que há compatibilidade entre o tamanho do sulco e da espécie citotóxica. A interação neste caso dependerá da natureza química do agente citotóxico e das espécies próximas às cavidades da dupla hélice. Assim sendo, inclui-se a possibilidade de interações predominantemente iônicas, além das discutidas anteriormente.56, 57
Outro modo de promover a morte de células tumorais é a clivagem de DNA. No DNA plasmidial, o qual é bastante usado em experimentos que avaliam o comportamento de espécies frente ao DNA,58 as fitas estão interagindo de forma que
o DNA está disposto tridimensionalmente como um novelo. Esta disposição das fitas é denominada de forma I ou superenovelada.59 Há espécies que são capazes de
modificar essa estrutura do DNA, de modo a separar as fitas, ou seja, induzem uma clivagem do DNA. Portanto, as funções do mesmo são comprometidas. A clivagem pode resultar na separação de fitas de dois modos: uma forma circular (forma II) ou linear (forma III),59 as quais podem ser identificadas por eletroforese efetuada em um
gel de agarose, que é um material poroso. Assim, as diferentes formas possuem diferentes capacidades de passagem pelos poros, tal que a forma I, a superenovelada, é a que possui maior dificuldade e a forma III, a linear, é a que possui maior facilidade.
Como parâmetro de identificação das formas é usado o DNA “ladder”, ilustrado na Figura 12. Nesta, cada linha indica uma porção de DNA com massa molar específica.60 A partir daí, em comparação com o resultado obtido se identifica
Figura 12 - Eletroforese em gel de agarose, indicando as três formas de DNA plasmidial.
Fonte: o autor.
1.5 Complexos: o centro metálico e os ligantes
Complexos de rutênio constituem uma via alternativa para tratamento de câncer porque possuem atividade biológica relatada desde a década de 5061-63 e
menor citotoxicidade que complexos de platina, os quais são usados em terapia de câncer64. Além do que, há complexos de rutênio que já estão em fase clínica (Figura
9) como antitumorais40, 65, 66. Há também complexos polipiridínicos de rutênio que
foram estudados em linhas celulares de tumor humano67 e, como já foi falado, o
complexo cis-[Ru(bpy)2(NO)(SO3)]+ (Figura 7), é um potencial fármaco antitumoral,
por conta de suas propriedades antiangiogênicas.38 Além disso, este complexo é
doador de óxido nítrico, apresenta 50% de conversão nitrosil-nitro em pH elevado11,
o que indica alta quantidade de nitrosilocomplexo em pH fisiológico e inibe processos inflamatórios68.
Tendo em vista que o complexo cis-[Ru(bpy)2(tu)(NO)]3+, em que tu =
tioureia, tal como aquele expresso na Figura 7, é convertido ao respectivo nitrocomplexo, à taxa de 50%, em pH elevado (6,5)69. Uma hipótese para estes
valores elevados é a presença enxofre como átomo doador que não se ligam tão fortemente ao metal, ou seja, compondo ligantes que não sejam moles o suficiente para serem -retiradores fortes ou simplesmente não o serem, como o caso do ligante sulfito. Nesse sentido, investigar complexos análogos aos supracitados, contendo tioamidas coordenadas pode ser interessante.
Essa proposta torna-se mais promissora por conta dos relatos de efeitos biológicos interessantes que as tioamidas possuem, a saber: i) podem atuar como antioxidantes, ao reagirem com espécies geradas a partir do estresse oxidativo causado quando há elevada concentração de hormônios da tireoide70; ii) são
Forma I Forma III
potenciais agentes antiúlcera71; iii) são doadoras de ácido sulfídrico, um hidreto útil
2 OBJETIVOS
Baseado no exposto anteriormente, foi objetivo deste trabalho, sintetizar e caracterizar nitrosilocomplexos de rutênio contendo o-fenantrolina (um composto polipiridínico) e tioamidas (tioureia e tiobenzamida) como ligantes (Figura 13). Exclusivamente para estes complexos (Figura 14) foram planejados os seguintes objetivos específicos:
✓ Determinar o pH em que há 50% de conversão nitrosil-nitrocomplexo;
✓ Avaliar o comportamento fotoquímico;
✓ Avaliar a possibilidade de liberação fotoinduzida de óxido nítrico e/ou HNO;
Figura 13 - Estruturas dos ligantes tioureia (tu) e tiobenzamida (tbz), respectivamente.
Fonte: o autor.
Figura 14 - Estruturas propostas para os nitrosilocomplexos sintetizados neste trabalho: FOR0912, cis-[Ru(phen)2(NO)(tu)]3+, e FOR0912A, cis-[Ru(phen)2(NO)(tbz)]3+.
Posto que para alcançar o objetivo geral, seria preciso sintetizar complexos análogos com cloreto como ligante (Figura 15), foram planejados objetivos específicos envolvendo todos os complexos:
✓ Caracterizar por voltametria, espectrometria de massa, análise elementar e técnicas espectroscópicas (UV-Vis, infravermelho e ressonância magnética nuclear –
1H, 13C BB, 13C DEPT-135, 13C APT, COSY, HMBC e HMQC);
✓ Utilizar os estudos computacionais por DFT para sustentar a caracterização feita;
✓ Investigar a reatividade frente à glutationa reduzida e à L-cisteína;
✓ Avaliar a interação do DNA plasmidial pBR322 com os compostos e o potencial clivador destes;
✓ Avaliar capacidade vasodilatadora em aortas de rato Wistar;
✓ Avaliar a citotoxicidade frente a células tumorais de glioblastoma humano.
Figura 15 - Estruturas propostas para os clorocomplexos, precursores do nitrosilocomplexos, sintetizados neste trabalho: FOR0212, cis-[Ru(phen)2Cl(tu)]+, e FOR0212A, cis-[Ru(phen)2Cl(tbz)]+.
3 MATERIAIS
Na Tabela 1 encontram-se listadas as substâncias, comercialmente obtidas, que foram usadas para o desenvolvimento do trabalho, com as respectivas procedências. Em todos os ensaios químicos, água Mili-Q foi usada.
Tabela 1 - Substâncias comercialmente usadas durante o trabalho.
Substâncias Procedência Pureza
Tioureia Carlo Erba 99%
Tiobenzamida Aldrich. Chem. Co. 98%
Ácido sulfúrico Synth 98%
Nitrito de sódio Synth 97%
Nitrito de sódio FLuka Guarantee 99%
Hidróxido de sódio Cromoline Química Fina 98%
Etanol grau HPLC Tedia 89 a 91%
Acetona Synth 99,5%
Hexafluorofosfato de potássio Alfa Products 98%
Acetonitrila grau HPLC Tedia 99,9%
Metanol grau HPLC Tedia 99,9%
Cloreto de rutênio hidratado Precious Metal Online (PMO) 99%
Dimetilsufóxido Synth 99,9%
1,10-fenantrolina Aldrich 99%
Brometo de potássio grau espectroscópico
Acros organic 99%
Cloreto de lítio Vetec 98%
Éter dietílico Vetec 99%
Acetona deuterado Cambridge Isotope
Laboratories
_
Dimetilsulfóxido deuterado Cambridge Isotope Laboratories
_
Perclorato de tetrabutilamonio FLuka Analytical _
Ácido clorídrico Vetec 36,5 a 38%
Clorofórmio Synth 99,8%
plasmídeo pBR322 (DNA) New England Biolabs Inc. _
D-manitol Sigma-Aldrich 98%
Superóxido Dismutase (SOD) Sigma (Life Science) _ 2,2,6,6-tetrametilpiperidina-1-oxilo
(TEMPO)
Aldrich (Chemistry) 99%
Agarose Sigma (Life Science) _
L-cisteína Sigma-Aldrich 99%
Glutationa (GSH) Sigma-Aldrich 99%