UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
FRANCISCA RENATA LOPES DA SILVA
Tephrosia toxicaria Pers. e Stemodia maritima Linn.: ESTUDO QUÍMICO E ATIVIDADES BIOLÓGICAS
Tephrosia toxicaria Pers. e Stemodia maritima Linn.: ESTUDO QUÍMICO E ATIVIDADES BIOLÓGICAS
Tese apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como parte dos requisitos para obtenção do Título de Doutora em Química. Área de concentração: Química Orgânica.
Orientadora: Profª. Drª. Angela Martha Campos Arriaga.
Co-orientador: Prof. Dr. Jair Mafezoli
S58t Silva, Francisca Renata Lopes da.
Tephrosia toxicaria Pers. e Stemodia maritima Linn.: Estudo químico e atividades biológicas. / Francisca Renata Lopes da Silva. – 2017.
203 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Programa de Pós-Graduação em Química, Fortaleza, 2017.
Orientação: Prof. Dr. Angela Martha Campos Arriaga. Coorientação: Prof. Dr. Jair Mafezoli.
1. Tephrosia. 2. Stemodia. 3. Lasiodiplodia. I. Título.
Tephrosia toxicaria Pers. e Stemodia maritima Linn.: ESTUDO QUÍMICO E ATIVIDADES BIOLÓGICAS
Tese apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Ceará, como parte dos requisitos para obtenção do Título de Doutora em Química. Área de concentração: Química Orgânica.
Aprovada em: 01 / 09 / 2017
BANCA EXAMINADORA
________________________________________________ Profª. Drª. Angela Martha Campos Arriaga (Orientadora)
UNIVERSIDADE FEDERAL DO CEARÁ (UFC) ________________________________________________
Prof. Dr. Marcos Carlos de Matos
UNIVERSIDADE FEDERAL DO CEARÁ (UFC) ________________________________________________
Profª. Drª. Antonia Torres Ávila Pimenta UNIVERSIDADE FEDERAL DO CEARÁ (UFC) ________________________________________________
Prof. Dr. Francisco Geraldo Barbosa
UNIVERSIDADE FEDERAL DO CEARÁ (UFC) _____________________________________________
Profª. Drª. Mirna Marques Bezerra
A Deus por me dar forças para não desistir e superar os momentos mais difíceis. À minha família pelo apoio e incentivo nos estudos.
Ao Helano por sempre estar ao meu lado, em todos os momentos.
À minha orientadora, Profª. Drª. Ângela M. C. Arriaga, pela dedicação e empenho na orienta-ção da elaboraorienta-ção deste trabalho e pela confiança dedicada a mim.
Ao meu co-orientador Prof. Dr. Jair Mafezoli pela confiança de realizar este trabalho e pelos ensinamentos transmitidos.
Aos professores do curso de Pós-Graduação em Química pela contribuição teórica essencial para minha formação.
Aos professores Dr. Edilberto R. Silveira e Drª. Nilce V. G. P. S. Brasil pela oportunidade de operar os espectrômetros de RMN.
Aos colegas do laboratório LSO: Valdeline, Aldênia, Ítalo e Dilailson.
Aos colegas do laboratório LABFITO: Carlos, Aiêrta, Adriano, Diana e Vandinha.
Aos operadores responsáveis pela obtenção dos espectros de RMN, IV e EM: Chaguinha, Elis e Pedro.
Aos professores Dr. José Galberto Martins (URCA) pelos testes de atividade antibacteriana, Drª. Mirna Marques (UFC-Sobral) pelos testes em atividades antinociceptiva e anti-inflamatória e Dra. Lissiana Magna (UFC-Sobral) pelos testes de ativi-dade ansiolítica.
Aos funcionários do Programa de Pós-graduação em Química: Lana, Célia e Orlando.
Ao CNPq pelo suporte financeiro e bolsa concedida durante minha iniciação científica, mestrado e doutorado.
À banca examinadora pela disponibilidade e atenção dispensada à leitura deste trabalho. A todos que de forma direta ou indireta contribuíram.
“O que sabemos é uma gota; o que ignoramos é um oceano”
Este trabalho descreve o estudo químico e biológico das espécies Tephrosia toxicaria Pers. e Stemodia maritima Linn. A espécie T. toxicaria Pers. é uma planta tropical ictiotóxica, conhe-cida popularmente no Nordeste do Brasil por “timbó de caiena” e conhecida na literatura química como uma fonte de rotenoides. Também é comumente utilizada em lavouras orgâni-cas como defensivo agrícola. O estudo químico das raízes de T. toxicaria levou ao isolamento de compostos flavonoídicos, característicos do gênero. Para o extrato das raízes de T. toxica-ria e dos compostos isolados, obovatina, deguelina e 12a-hidroxi-α-toxicarol foram avaliadas as atividades anti-inflamatória e antinociceptiva em modelo experimental de inflamação por zymosan na articulação temporomandibular de ratos. Neste estudo, todos os compostos rever-teram os efeitos inflamatórios do zymosan. Na avaliação da atividade antibacteriana para os mesmos compostos e extrato verificou-se que a deguelina e o 12a-hidroxi-α-toxicarol apre-sentaram considerável atividade inibitória frente as linhagens de bactérias gram-positivas e gram-negativas. Stemodia maritima Linn. é conhecida popularmente no Nordeste brasileiro por “melosa” e ocorre principalmente em áreas salinizadas, crescendo como mata rasteira. É utilizada na medicina popular para tratar doenças venéreas. O estudo químico das folhas de S. maritima forneceu quatro diterpenos estemodanos: estemodina, estemodinol, estemodina-α-L-arabinopiranosídeo e estemodina-α-L-arabinofuranosídeo. Também foram avaliadas as ativi-dades anti-inflamatória e antinociceptiva, onde o extrato e o composto estemodina demonstra-ram eficácia na redução da nocicepção induzida por formalina. Efeitos neurofarmacológicos e alterações comportamentais foram investigados no extrato etanólico das folhas de S. mariti-ma, tendo este apresentado atividade no sistema nervoso central, sem alterar a atividade fisio-lógica dos animais, exibindo atividade antidepressiva similar ao antidepressivo Imipramina. O diterpeno estemodina, majoritário em S. maritima, foi utilizado como substrato para biotrans-formação por quatorze fungos do gênero Lasiodiplodia. A biotransformação pelo fungo L. pontae conduziu a obtenção de dois derivados hidroxilados: 7β-hidroxiestemodina e 18-hidroxiestemodina. As substâncias isoladas foram identificadas por métodos espectrométricos (IV, EM, RMN 1H e RMN 13C) incluindo técnicas bidimensionas de RMN (COSY, HSQC, HMBC e NOESY) e comparação com dados da literatura.
This work describes the chemical and biological study of the species Tephrosia toxicaria Pers. and Stemodia maritima Linn. The specie T. toxicaria Pers. is a tropical fish-poisoning plant, popularly known as “timbó de caiena” and known in the chemical literature as a source of rotenoids. Also it is commonly used in organics crops as pesticide. The chemical study of roots of T. toxicaria led to the isolation of flavonoid compounds, characteristics of the genus. For extract of the roots of T. toxicaria and the isolated compounds, obovatin, deguelin and 12a-hydroxy-α-toxicarol, the antinociceptive and anti-inflammatory activities were evaluated in a experimental model of zymosan inflammation in the temporomandibular joint in rats. In this study, all compounds reverted the zymosan inflammatory effects. In the evaluation of antibacterial activity for the same compounds and extract it was verified that the deguelin and 12a-hydroxy-α-toxicarol showed considerable inhibitory activity against gram-positive and gram-negative strains. Stemodia maritima Linn. is popularly known in nordheastern Brazil as “melosa” and occurs mainly in salinized areas, growing like a forest. It is used in popular medicine to treat venereal diseases. The chemical study of leaves of S. maritima provided four estemodane diterpenes: stemodin, stemodinol, stemodin-α-L-arabinopyranoside and stemodin-α-L-arabinofuranoside. The anti-inflammatory and antinociceptive activities were also evaluated, where the extract and the compound stemodin demonstrated efficacy in the reduction of formalin-induced nociception. Neuropharmacological effects and behavioral changes were investigated in the ethanolic extract from leaves of S. maritima, having shown activity in the central nervous system, without altering the physiological activity of the ani-mals, exhibiting antidepressant activity like the antidepressant Imipramine. The diterpene stemodin, majority in S. maritima, was used as a substrate for biotransformation by fourteen fungi of Lasiodiplodia genus. The biotransformation by the fungus L. pontae led to the pro-duction of two hydroxylated derivatives: 7β-hydroxystemodin and 18-hydroxystemodin. The substances isolated were identified by spectrometric methods (IR, EM, H1 NMR and C13 NMR), including two-dimensional NMR (HMBC, HSQC, NOESY and COSY) and by com-parison with literature data.
Figura 01 – Tephrosia toxicaria coletada em Guaraciaba do Norte – CE ... 23
Figura 02 – Stemodia maritima Linn. ... 24
Figura 03 – Lasiodiplodia pontae em cultivo em meio de batata-dextrose-ágar (BDA) ... 25
Figura 04 – Estruturas dos esqueletos estemodano (I), estemarano (II), labdano (III), bisepóxido (IV) e abietano (V) ... 30
Figura 05 – Diterpenos de espécies do gênero Stemodia, naturais e sintéticos, agrupados de acordo com seus esqueletos básicos ... 36
Figura 06 – Estrutura de aphidicolina ... 46
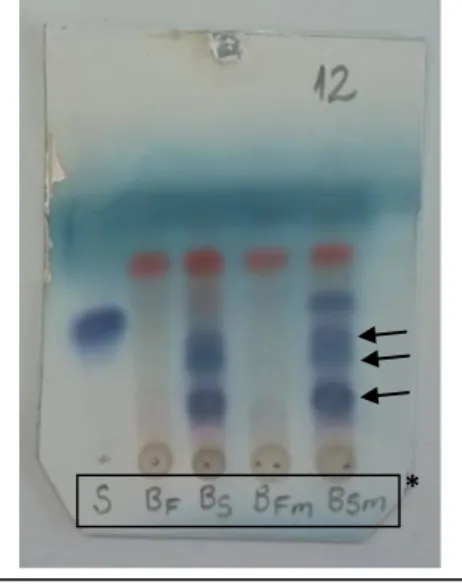
Figura 07 – CCD das frações obtidas da biotransformação de SM-1 por F-12 ... 58
Figura 08 – Espectro de massa IE (70 eV) de TT-1 ... 60
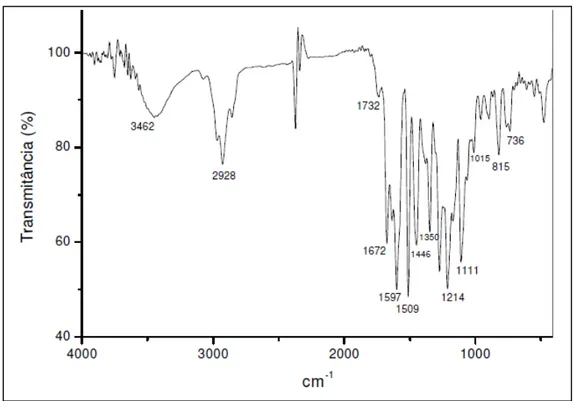
Figura 09 – Espectro de absorção na região do infravermelho de TT-1 ... 61
Figura 10 – Substituinte 6”,6”-dimetilcromeno ... 62
Figura 11 – Acoplamento da hidroxila fenólica nas estruturas angular e linear ... 63
Figura 12 – Unidades estruturais de TT-1 ... 63
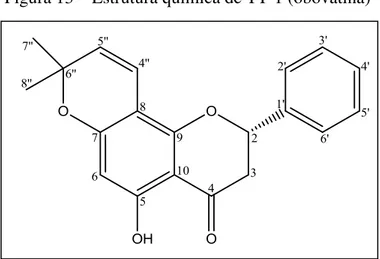
Figura 13 – Estrutura química de TT-1 (obovatina) ... 64
Figura 14 – Espectro de RMN 1H de TT-1 (500 MHz, CDCl3) e expansão ... 65
Figura 15 – Espectro de RMN 13C de TT-1 (125 MHz, CDCl3) ... 65
Figura 16 – Espectro de RMN 13C DEPT 135º de TT-1 (125 MHz, CDCl3) ... 66
Figura 17 – Espectro de RMN 2D 1H,1H-COSY de TT-1 (500 MHz, CDCl3). As setas nume-radas representam as correlações vicinais e sua numeração corresponde aos picos no espectro ... 66
Figura 18 – Espectro de RMN 2D 1H,13C-HSQC de TT-1 (500/125 MHz, CDCl3) ... 68
Figura 19 – Espectro de RMN 2D 1H,13C-HMBC de TT-1 (500/125 MHz, CDCl3). As setas numeradas representam as correlações à longa distância observadas e sua numera-ção corresponde aos picos no espectro ... 68
Figura 20 – Expansão do espectro de RMN 2D 1H,13C-HMBC de TT-1 (500/125 MHz, CDCl3). As setas numeradas representam as correlações à longa distância obser-vadas e sua numeração corresponde aos picos no espectro ... 69
Figura 21 – Espectro de massa IE (70 eV) de TT-2 ... 70
Figura 22 – Espectro de absorção na região do infravermelho de TT-2 ... 71
Figura 23 – Acoplamentos a longa distância do fragmento estrutural A de TT-2 ... 72
Figura 27 – Espectro de RMN 13C de TT-2 (125 MHz, CDCl3) ... 75
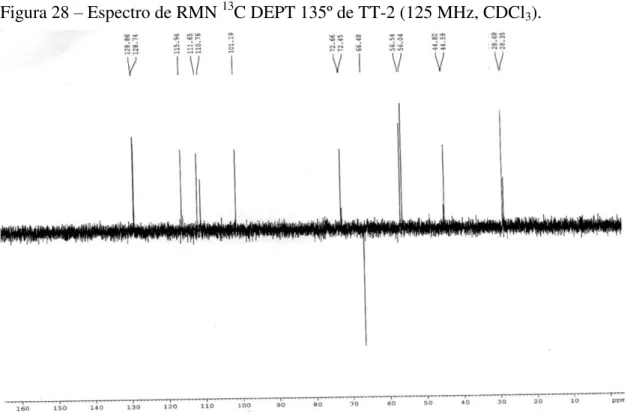
Figura 28 – Espectro de RMN 13C DEPT 135º de TT-2 (125 MHz, CDCl3) ... 76
Figura 29 – Espectro de RMN 2D 1H,1H-COSY de TT-2 (500 MHz, CDCl3). As setas nume-radas representam as correlações vicinais e sua numeração corresponde aos picos no espectro ... 76
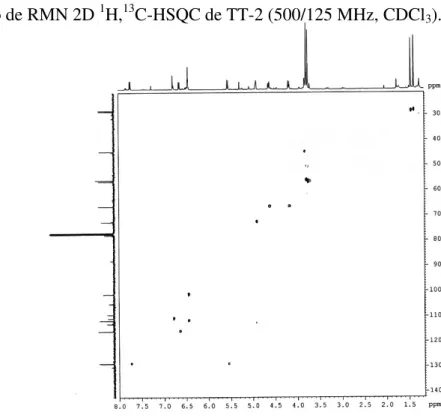
Figura 30 – Espectro de RMN 2D 1H,13C-HSQC de TT-2 (500/125 MHz, CDCl3) ... 77
Figura 31 – Espectro de RMN 2D 1H,13C-HMBC de TT-2 (500/125 MHz, CDCl3). As setas numeradas representam as correlações à longa distância observadas e sua numera-ção corresponde aos picos no espectro ... 77
Figura 32 – Expansão do espectro de RMN 2D 1H,13C-HMBC de TT-2 (500/125 MHz, CD-Cl3). As setas numeradas representam as correlações à longa distância observadas e sua numeração corresponde aos picos no espectro ... 78
Figura 33 – Espectro de massa IE (70 eV) de TT-3 ... 79
Figura 34 – Unidades estruturais de TT-3 ... 80
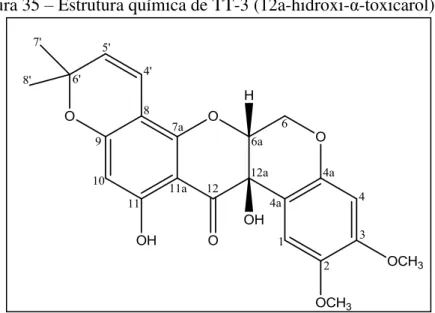
Figura 35 – Estrutura química de TT-3 (12a-hidroxi-α-toxicarol) ... 81
Figura 36 – Espectro de RMN 1H de TT-3 (500 MHz, CDCl3) e expansão ... 82
Figura 37 – Espectro de RMN 13C de TT-3 (125 MHz, CDCl3) ... 82
Figura 38 – Espectro de RMN 2D 1H,1H-COSY de TT-3 (500 MHz, CDCl3). As setas nume-radas representam as correlações vicinais e sua numeração corresponde aos picos no espectro ... 83
Figura 39 – Espectro de RMN 2D 1H,13C-HSQC de TT-3 (500/125 MHz, CDCl3) ... 83
Figura 40 – Espectro de RMN 2D 1H,13C-HMBC de TT-3 (500/125 MHz, CDCl3). As setas numeradas representam as correlações à longa distância observadas e sua numera-ção corresponde aos picos no espectro ... 84
Figura 41 – Espectro de massa de alta resolução de SM-1 ... 85
Figura 42 – Espectro de absorção na região do infravermelho de SM-1 ... 85
Figura 43 – Estrutura parcial obtida através do experimento COSY ... 87
Figura 44 – Acoplamentos a longa distância observados para SM-1 ... 87
Figura 45 – Estrutura química de SM-1 (Estemodina) ... 88
Figura 46 – Correlações dipolares observadas através do NOESY ... 88
no espectro ... 91
Figura 50 – Espectro de RMN 2D 1H,1H-NOESY de SM-1 (300 MHz, C5D5N). As setas nu-meradas representam as correlações dipolares observadas e sua numeração corres-ponde aos picos no espectro ... 92
Figura 51 – Espectro de RMN 2D 1H,13C-HSQC de SM-1 (300/75 MHz, C5D5N) ... 92
Figura 52 – Espectro de RMN 2D 1H,13C-HMBC de SM-1 (300/75 MHz, C5D5N). As setas numeradas representam as correlações à longa distância observadas e sua numera-ção corresponde aos picos no espectro ... 93
Figura 53 – Espectro de massa de alta resolução de SM-2 ... 94
Figura 54 – Espectro de absorção na região do infravermelho de SM-2 ... 94
Figura 55 – Unidade estrutural de SM-2 ... 95
Figura 56 – Acoplamentos a longa distância observados para SM-2 ... 96
Figura 57 – Estrutura química de SM-2 (Estemodinol) ... 96
Figura 58 – Correlações dipolares observadas através do NOESY ... 97
Figura 59 – Espectro de RMN 1H de SM-2 (300 MHz, C5D5N) e espansão ... 98
Figura 60 – Espectro de RMN 13C de SM-2 acima e DEPT 135º abaixo (75 MHz, C5D5N). 99 Figura 61 – Espectro de RMN 2D 1H,1H COSY de SM-2 (300 MHz, C5D5N) ... 100
Figura 62 – Espectro de RMN 2D 1H,1H – NOESY de SM-2 (75 MHz, C5D5N) ... 101
Figura 63 – Espectro de RMN 2D 1H,13C HSQC de SM-2 (300/75 MHz, C5D5N) e expansão ... 102
Figura 64 – Espectro de RMN 2D 1H,13C HMBC de SM-2 (300/75 MHz, C5D5N) e expansão. As setas numeradas representam as correlações à longa distância observadas e sua numeração corresponde aos picos no espectro ... 103
Figura 65 – Expansões do espectro de RMN 2D 1H,13C HMBC de SM-2 (300/75 MHz, C5D5N) ... 103
Figura 66 – Correlações observadas à longa distância para arabinose ... 105
Figura 67 – Estrutura química de SM-3 (estemodina-α-L-arabinopiranosídeo) ... 105
Figura 68 – Espectro de RMN 1H de SM-3 (300 MHz, CD3OD) e expansão ... 107
Figura 72 – Espectro de RMN 2D 1H,13C-HMBC de SM-3 com expansão (300/75 MHz, CD3OD). As setas numeradas representam as correlações à longa distância
obser-vadas e sua numeração corresponde aos picos no espectro ... 109
Figura 73 – Estrutura parcial obtida pelos experimentos COSY e HMBC ... 111
Figura 74 – Estrutura química de SM-4 (estemodina-α-L-arabinofuranosídeo) ... 111
Figura 75 – Espectro de RMN 1H de SM-4 (500 MHz, CD3OD) e expansão ... 113
Figura 76 – Espectro de RMN 13C de SM-4 abaixo e DEPT 135º acima (125 MHz, CD3OD) ... 113
Figura 77 – Espectro de RMN 2D 1H,1H-COSY de SM-4 (500 MHz, CD3OD) e expansão. As setas numeradas representam as correlações vicinais e sua numeração corresponde aos picos no espectro ... 114
Figura 78 – Espectro de RMN 2D 1H,13C-HSQC de SM-4 (500/125 MHz, CD3OD) e expansão ... 114
Figura 79 – Espectro de RMN 2D 1H,13C-HMBC de SM-4 com expansão (500/125 MHz, CD3OD). As setas numeradas representam as correlações à longa distância obser-vadas e sua numeração corresponde aos picos no espectro ... 115
Figura 80 – Correlações observadas no HMBC para BS-1 ... 116
Figura 81 – Estruturas de 7α-hidroxiestemodina e 7β-hidroxiestemodina (BS-1) ... 118
Figura 82 – Espectro de RMN 1H de BS-1 (500 MHz, CD3OD) e expansão ... 120
Figura 83 – Espectro de RMN 13C de BS-1 abaixo e DEPT 135º acima (125 MHz, CD3OD) ... 121
Figura 84 – Espectro de RMN 2D 1H,1H-COSY de BS-1 (500 MHz, CD3OD) ... 121
Figura 85 – Expansão do espectro de RMN 2D 1H,1H-COSY de BS-1 (500 MHz, CD3OD) 122 Figura 86 – Espectro de RMN 2D 1H,13C-HSQC de BS-1 (500/125 MHz, CD3OD) ... 122
Figura 87 – Espectro de RMN 2D 1H,13C-HMBC de BS-1 com expansão (500/125 MHz, CD3OD). As setas numeradas representam as correlações à longa distância obser-vadas e sua numeração corresponde aos picos no espectro ... 123
Figura 88 – Correlações observadas no HMBC para BS-2 ... 125
Figura 89 – Estrutura química de BS-2 (18-hidroxiestemodina) ... 125
Figura 90 – Espectro de RMN 1H de BS-2 (500 MHz, CD3OD) e expansão ... 127
expansão ... 129 Figura 94 – Espectro de RMN 2D 1H,13C-HMBC de BS-2 com expansão (500/125 MHz,
CD3OD). As setas numeradas representam as correlações à longa distância obser-vadas e sua numeração corresponde aos picos no espectro ... 130 Figura 95 – Expansão do espectro de RMN 2D 1H,13C-HMBC de BS-2 (500/125 MHz,
CD3OD). As setas numeradas representam as correlações à longa distância obser-vadas e sua numeração corresponde aos picos no espectro ... 131 Figura 96 – Efeito da administração de TTRE na hipernocicepção articular em ratos
submeti-dos à indução de inflamação por Zymosan na ATM (A) e sobre o número total de leucócitos no lavado sinovial (B). ... 134 Figura 97 – Efeitos da administração de obovatina, deguelina e 12a-hydroxi-α-toxicarol na
hipernocicepção articular em ratos submetidos à indução de inflamação por Zymosan na ATM ... 135 Figura 98 – Efeitos da administração de obovatina, deguelina e 12a-hydroxi-α-toxicarol sobre
o número total de leucócitos no lavado sinovial ... 136 Figura 99 – Efeitos de SMFE na hipernocicepção inflamatória induzida por formalina na
ATM de ratos ... 139 Figura 100 – Efeitos de SMFE na permeabilidade vascular induzida por formalina na ATM de
ratos... 139 Figura 101 – Efeitos de estemodina na hipernocicepção inflamatória induzida por formalina
na ATM de ratos ... 140 Figura 102 – Número de cruzamentos (A), número de rearing (B) número de grooming (C)
em avaliação da atividade motora no Teste de Campo Aberto ... 147 Figura 103 – Número de entradas nos braços abertos (NEBA - A) e tempo de permanência
nos braços abertos (TEBA - B) em modelo comportamental em Teste de Labirinto em Cruz Elevada ... 148 Figura 104 – Tempo de imobilidade nos testes de Nado Forçado (A) e Suspensão da
Tabela 01 – Atividades biológicas de espécies do gênero Tephrosia ... 26
Tabela 02 – Diterpenos de espécies do gênero Stemodia (N-natural, S – sintético, B – biossintético) ... 31
Tabela 03 – Espécies de micro-organismos usados na biotransformação de estemodanos ... 46
Tabela 04 – Dados do fracionamento cromatográfico de TTRE ... 49
Tabela 05 – Frações resultantes do fracionamento cromatográfico de TTRE ... 50
Tabela 06 – Dados para o fracionamento cromatográfico de TTRE – 4 ... 50
Tabela 07 – Dados para o fracionamento cromatográfico de TTRE 13-16 ... 51
Tabela 08 – Dados referentes ao fracionamento de SMFE-LC ... 52
Tabela 09 – Frações resultantes do fracionamento cromatográfico de SMFE-LC 2 ... 53
Tabela 10 – Dados do fracionamento cromatográfico de SMFE-LC 3 ... 53
Tabela 11 – Frações resultantes do fracionamento cromatográfico de SMFE-LC 3 ... 54
Tabela 12 – Fungos endofíticos em estudo, isolados de plantas da Caatinga ... 55
Tabela 13 – Dados da biotransformação de SM-1 por F-12 ... 57
Tabela 14 – Frações obtidas da biotransformação de SM-1 por F-12 ... 58
Tabela 15 – Frações resultantes do fracionamento cromatográfico de Bio-SM-1-F12 ... 59
Tabela 16 – Dados de RMN 1D e 2D 13C e 1H de TT-1 em comparação com dados da Literatura.87 ... 64
Tabela 17 – Dados de RMN 1D e 2D 13C e 1H de TT-2 em comparação com dados da Literatura.92 ... 74
Tabela 18 – Dados de RMN 1D e 2D 13C e 1H de TT-3 em compa ração com dados da Literatura.92 ... 81
Tabela 19 – Dados de RMN 1D e 2D 13C e 1H de SM-1 em comparação com dados da Literatura.74 ... 89
Tabela 20 – Dados de RMN 1D e 2D 13C e 1H de SM-2 (C5D5N, 300/75 MHz) ... 97
Tabela 21 – Dados de RMN 1D e 2D de 13C e 1H para SM-3 em comparação com dados da literatura.79 ... 106
Tabela 22 – Dados de RMN 1D e 2D de 13C e 1H para SM-4 em comparação com dados da literatura.25 ... 116
Tabela 23 – Dados de RMN 1D e 2D de 13C e 1H para BS-1 (CD3OD, 500/125 MHz) ... 117
Tabela 26 – Efeito da administração de TTRE (20 mg/Kg) durante 14 dias sobre os pesos re-lativos de fígado, coração e rim. Grupo controle recebeu apenas veículo (solução salina) ... 137 Tabela 27 – Valores de concentração inibitória mínima (CIM) (μg/mL) de TTRE, obovatina
(1), deguelina (2) e 12a-hidroxi-α-toxicarol (3) ... 142 Tabela 28 – Associação das amostras deguelina (2) e 12a-hidroxi-α-toxicarol (3) com
ATCC American Type Culture Collection ATM Articulação temporomandibular
BB Broadband
BDA Batata Dextrose Ágar
BD Batata Dextrose
BS-1 7β-hidroxiestemodina BS-2 18-hidroxiestemodina CC Cromatografia em Coluna
CCD Cromatografia em Camada Delgada
CENAUREMN Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear CIM Concentração Inibitória Mínima
COSY Correlation Spectroscopy
DEPT Distortionless Enhancement by Polarization Transfer
DZP Diazepam
EM-IE Espectrometria de Massa por Impacto Eletrônico
EM-IES Espectrometria de Massa por Ionização por electrosplay LABFITO Laboratório de Fitoquímica Aplicada
LEMANOR Laboratório de Espectrometria de Massa do Nordeste HMBC Heteronuclear Multiple Bond Connectivity
HSQC Heteronuclear Single Quantum Coherence IDH Índice de Deficiência de Hidrogênio
IMP Imipramina
ITS Internal Transcribed Spacer
IV Infravermelho
NOESY Nuclear Overhauser Enhancement Spectroscopy RMN Ressonância Magnética Nuclear
RMN 1H Ressonância Magnética Nuclear de Hidrogênio RMN 13C Ressonância Magnética Nuclear de Carbono - 13
SM-1 Estemodina
SM-2 Estemodinol
TT-1 Obovatina
TT-2 Deguelina
TT-3 12a-hidroxi-α-toxicarol
TTRE Extrato Etanólico das Raízes de T. toxicaria
[α]T
D Rotação óptica específica
d Dupleto
Da Dalton
dd Dupleto de dupletos δ Deslocamento químico eV Eletrovolt
Φ Diâmetro
ºC Graus Celsius
Hz Hertz
J Constante de acoplamento
L Comprimento
m Multipleto
MHz Megahertz
m/z Razão massa carga pf Ponto de fusão
s Simpleto
t Tripleto
1 INTRODUÇÃO ... 20
2 TAXONOMIA DAS ESPÉCIES ESTUDADAS ... 23
2.1 Sobre Tephrosia toxicaria ... 23
2.2 Sobre Stemodia maritima ... 24
2.3 Sobre Lasiodiplodia pontae ... 25
3 REVISÃO BIBLIOGRÁFICA ... 26
3.1 Das espécies do gênero Tephrosia ... 26
3.2 Dos diterpenos do gênero Stemodia ... 29
3.3 Micro-organismos utilizados nas biotransformações dos diterpenos estemodanos ... 46
4 PARTE EXPERIMENTAL ... 47
4.1 Métodos cromatográficos ... 47
4.1.1 Cromatografia em coluna de fase normal (CC) ... 47
4.1.2 Cromatografia em camada delgada (CCD) ... 47
4.2 Métodos físicos de análise ... 47
4.2.1 Infravermelho (IV) ... 47
4.2.2 Rotação óptica ... 48
4.2.3 Espectroscopia de Ressonância Magnética Nuclear (RMN) ... 48
4.2.4 Espectrometria de massa (EM) ... 48
4.2.5 Ponto de fusão (pf) ... 49
4.3 Estudo de Tephrosia toxicaria ... 49
4.4 Estudo de Stemodia marítima ... 52
4.5 Micro-organismos utilizados nas biotransformações ... 55
4.6 Biotransformação de estemodina (SM-1) ... 56
4.7 Isolamento de BS-1 e BS-2 ... 58
5 RESULTADOS E DISCUSSÃO – DETERMINAÇÕES ESTRUTURAIS ... 60
5.1 Determinação estrutural de TT-1 ... 60
5.2 Determinação estrutural de TT-2 ... 70
5.3 Determinação estrutural de TT-3 ... 79
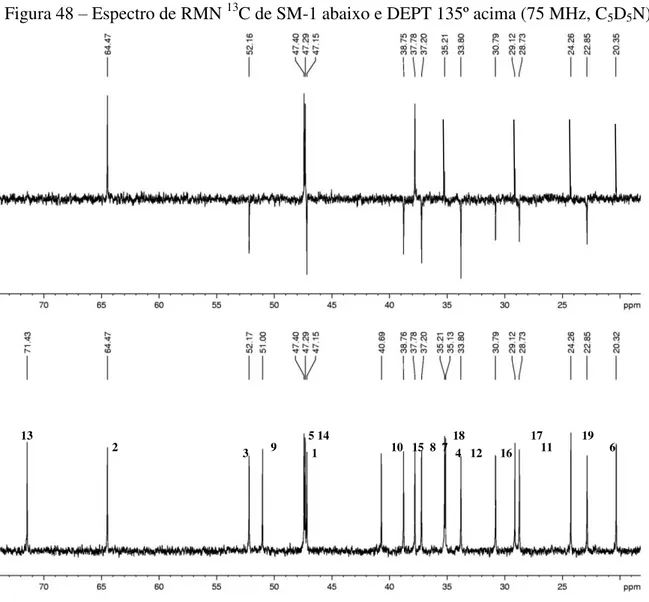
5.4 Determinação estrutural de SM-1 ... 85
5.5 Determinação estrutural de SM-2 ... 94
5.9 Determinação estrutural de BS-2 ... 124
6 ENSAIOS BIOLÓGICOS – PARTE EXPERIMENTAL E RESULTADOS ... 132
6.1 Testes de atividade anti-inflamatória e antinociceptiva com Tephrosia toxicaria ... 132
6.1.1 Parte experimental ... 133
6.1.2 Resultados e discussão ... 134
6.2 Testes de atividade anti-inflamatória e antinociceptiva com Stemodia maritima ... 137
6.2.1 Parte experimental ... 137
6.2.1.1 Análise da permeabilidade vascular por extravasamento de azul de Evans ... 138
6.2.2 Resultados e discussão ... 138
6.3 Teste de atividade antibacteriana com Tephrosia toxicaria ... 140
6.3.1 Parte experimental ... 141
6.3.2 Resultados e discussão ... 141
6.4 Testes de atividade ansiolítica e antidepressiva com Stemodia maritima ... 143
6.4.1 Parte experimental ... 143
6.4.1.1 Teste de Campo Aberto ... 144
6.4.1.2 Teste de Labirinto em Cruz Elevada ... 145
6.4.1.3 Teste de Nado Forçado ... 145
6.4.1.4 Teste de Suspensão de Cauda ... 145
6.4.2 Resultados e discussão ... 146
7 CONCLUSÃO ... 150
REFERÊNCIAS ... 152
APÊNDICE A – RESUMO ILUSTRADO DOS RESULTADOS ... 161
APÊNDICE B – ARTIGO PUBLICADO DA TESE ... 163
APÊNDICE C –ARTIGO SUBMETIDO À REVISTA “MEDICINAL CHEMISTRY RESEARCH” ... 173
1 INTRODUÇÃO
O reino vegetal guarda uma grande quantidade de moléculas novas a serem descobertas. A natureza é como uma enorme biblioteca que agrega valiosas informações, que ainda são praticamente desconhecidas e a versatilidade do metabolismo vegetal faz com que uma única espécie vegetal possa produzir centenas de substâncias.1 É difícil saber quantas micromoléculas extraídas de plantas superiores são conhecidas e é impossível estimar quantas devem existir.1 Nos últimos anos, a importância dos organismos vegetais como fontes produtivas de substâncias biologicamente ativas reativou interesses sociais e econômicos, estimulando a percepção das lideranças industriais empenhadas na fabricação de fármacos.2 Esta perspectiva explica a busca de novos compostos, o que é hoje um papel importante dos fitoquímicos em todo o mundo e, apesar dos grandes avanços tecnológicos nesta área, a determinação da composição química e as atividades biológicas continuam sendo um grande desafio para os pesquisadores.
O Nordeste brasileiro, inserido quase totalmente no bioma da Caatinga, abriga uma imensa flora, de onde podem ser obtidos metabólitos com grande diversidade estrutural. Muitas dessas espécies vegetais são facilmente cultiváveis, podem curar e prevenir graves doenças, e são fontes potenciais de compostos, responsáveis por diversas atividades biológicas, como antimicrobiana, anti-inflamatória, analgésica, antioxidante, larvicida, etc. Além disso, produtos isolados de plantas, de maneira geral, oferecem-se como novos modelos de estruturas químicas, para modificações estruturais, estudos farmacológicos e para o desenvolvimento de novos fármacos.2 Assim, destacamos que a prospecção química em plantas tem crescido de forma exponencial, principalmente devido à modernização das técnicas de separação e de identificação, facilitando o isolamento e a caracterização de seus constituintes químicos. 1,2
Neste contexto, destacamos as espécies pertencentes ao gênero Tephrosia. Estas estão distribuídas em regiões tropicais e subtropicais do mundo e têm sido usadas em preparações fitoterápicas, como inseticidas, veneno para ratos e peixes por vários povos indígenas. Diversas atividades biológicas para espécies deste gênero têm sido relatadas na literatura.4,5
Tephrosia toxicaria Pers. (sinonímia Tephrosia sinapou6) já havia sido objeto de estudo em nosso grupo de pesquisa, e mostrou ser uma rica fonte de rotenoides. Um recente estudo com esta espécie mostrou que tanto os extratos, como os rotenoides isolados, mostraram atividade anti-inflamatória7-9 e larvicida10 sobre Aedes aegypti. Além disso, os extratos também apresentaram excelente atividade antioxidante, reforçando a presença de substâncias flavonoídicas.10
Espécies do gênero Stemodia tem sido usadas na medicina tradicional no tratamento de doenças. A literatura relata o uso de Stemodia durantifolia para o tratamento de infertilidade e Stemodia maritima para o tratamento de doenças venéreas.11,12 Metabólitos secundários como triterpenos, diterpenos e flavonoides foram isolados de espécies do gênero Stemodia, porém, os diterpenos contendo um esqueleto tetracíclico incomum, conhecido como estemodano, são os compostos que caracterizam quimicamente as plantas desse gênero.13
com a aphidicolina, que é um agente citotóxico e antiviral isolado de culturas do fungo Cephalosporium aphidicola.12
2 TAXONOMIA DAS ESPÉCIES ESTUDADAS
2.1 Sobre Tephrosia toxicaria Pers.
Tephrosia toxicaria Pers. (Fig. 01, p. 25) pertence à família Fabaceae, também conhecida como Leguminoseae em função dos frutos do tipo legume presentes na maioria das espécies. Esta família é formada por cerca de 730 gêneros e mais de 19.400 espécies. O gênero Tephrosia é constituído por cerca de 679 espécies, subespécies e variedades. As espécies do gênero estão distribuídas por todas as regiões quentes de ambos os hemisférios, principalmente na América, África, Austrália e Ásia. Muitas dessas são venenosas, especialmente para os peixes.19-21
T. toxicaria Pers. é uma planta tropical ictiotóxica, conhecida popularmente no Nordeste brasileiro por “timbó de caiena” e na literatura científica como uma fonte de rotenoides.19 Apresenta-se como arbusto com folhas imparipinadas, folíolos de dez a vinte jugos, peciolados, oblongos e seríceos. Suas flores são brancas ou amareladas com a base lilás e dispostas em racemos axilares ou terminais. Seu fruto apresenta-se na forma de vagem, curva ou reta.22 A espécie para estudo foi coletada na localidade de Guaraciaba do Norte - CE, onde é cultivada e o extrato aquoso de suas raízes maceradas é utilizado como defensivo agrícola natural.
Figura 01 – Tephrosia toxicaria coletada em Guaraciaba do Norte – CE
2.2 Sobre Stemodia maritima Linn.
Stemodia maritima Linn. pertence à família Plantaginaceae (tradicionalmente o gênero Stemodia era classificado na família Scrophulariaceae), constituída por 120 gêneros distribuídos principalmente nas regiões temperadas do hemisfério norte, sendo relativamente rara na nossa flora.23
O gênero Stemodia é representado por cerca de 127 espécies distribuídas na Ásia, África, Oceania e América. É um gênero de plantas de florescência, perenes com folhas dentadas e racemos de flores coloridas, geralmente em tom roxo.12,21
S. maritima Linn. (Fig. 02, p. 26) é encontrada na parte norte da América do Sul e na maioria das ilhas do Caribe, onde é conhecida como “a força do homem pobre”, por ser usada como remédio para tratar vários tipos de doenças, como dor de estômago, edema e inchaço.24,25 No Nordeste brasileiro é conhecida popularmente como “mastruz-bravo, melosa” e ocorre principalmente em áreas salinizadas. É uma planta herbácea perene, apresenta caule ramificado desde a base, ramos eretos e decumbentes, quadráticos e revestidos por intensa pilosidade branca. Folhas simples, opostas cruzadas, sésseis, pouco anisofilas entre os pares, as folhas inserem-se de forma oblíqua em relação ao ramo. Fruto seco do tipo capsular. Pode ser identificada em campo pelo porte ereto e pelas folhas piloso-glandulosas de margens ondulado-serreadas. As flores de S. maritima são axilares e suas sementes são numerosas e muito pequenas, e a propagação é feita por meio de sementes.26,27
Figura 02 – Stemodia maritima Linn.
2.3 Sobre Lasiodiplodia pontae
Lasiodiplodia pontae pertence à família Botryosphaeriaceae. Os fungos desta família possuem uma distribuição cosmopolita e ocorrem em uma vasta gama de hospedeiros, como monocotiledôneas, dicotiledôneas e gimnospermas. Estes fungos são geralmente considerados como patógenos oportunistas, que causam sintomas de doença em plantas expostas a condições ambientais estressantes, tais como aquelas associadas com a seca, geada, granizo e danos causados por outros patógenos e pragas. Entre as doenças causadas por espécies de Botryosphaeriaceae estão: podridão de frutos, manchas foliares, tombamento e podridão de colo em mudas, cancros, secas em brotos e mudas, gomose, seca descendente, vassoura-de-bruxa e morte de árvore.28, 29
O crescimento micelial em meio de cultura artificial de espécies da família Botryosphaeriaceae, em geral, apresenta-se com coloração cinza a preto, aéreo e em algumas espécies é possível detectar a liberação de pigmentos que se difundem no meio de cultura.30
Espécies do gênero Lasiodiplodia são comuns, especialmente em regiões tropicais e regiões subtropicais, onde causam uma variedade de doenças.31 A literatura não relata estudos para a espécie Lasiodiplodia pontae e nem sua utilização em processos biocatalíticos.
Figura 03 – Lasiodiplodia pontae em cultivo em meio de batata-dextrose-ágar (BDA).
A revisão bibliográfica do presente trabalho relata as atividades biológicas que
ocorrem no gênero Tephrosia, os diterpenos no gênero Stemodia, e os micro-organismos
utilizados em biotransformações descritas na literatura do diterpeno estemodina, observando a ocorrência de publicações para os gêneros entre os anos de 1973 e 2017. Foi utilizado como
ferramenta de pesquisa o SciFinder® (Chemical Abstracts Service) e o site de busca
ScienceDirect®.
3.1 Das espécies do gênero Tephrosia
Plantas do gênero Tephrosia tem apresentado diversas bioatividades, como
inseticida,32 antiviral,33 antiprotozoária,34 antiplasmodial,35 e citotóxica,36 tanto de seus extratos, como de seus compostos isolados. As investigações fitoquímicas têm revelado a presença de glicosídeos, rotenoides, isoflavonoides, chalconas, flavanonas, flavonois e
flavonoides prenilados de importância quimiotaxonômica para o gênero.5
Muitas espécies têm uso medicinal e fitoterápico, como exemplo, T. purpurea,
conhecida por seu potencial farmacêutico, onde as suas folhas têm propriedades laxativas e
também são usadas na cura do reumatismo, hipoglicemia,37 as raízes e sementes apresentam
propriedades inseticidas e piscicidas, a decocção de suas vagens é eficaz para a dor e
inflamação.38 Outras atividades exibidas por espécies de Tephrosia são mostradas na Tabela
01 (p.29).
Tabela 01 – Atividades biológicas de espécies do gênero Tephrosia.
Espécie Atividade Referência
T. apollinea
Antimicrobiana 39
Antifúngica 40
Anti-inflamatória 41
T.calophylla
Antiploriferativa 42
Antiprotozoária 34
Citotóxica 34, 36
T. crassifolia Antiviral 33
T. cinerea Larvicida 44
T. elata Antiplasmodial 35
T. falciformis Antioxidante 45
T. madrensis Antiviral 34
T. máxima Citotóxica 36
T. nubica Antiviral 46
T. pulcherrima
Antiprotozoária 34
Antimicrobiana 47, 48
Citotóxica 34
T. pumila
Antimicrobiana 49
Antiprotozoária 47, 48
Piscicida 49
T. purpurea
Antimicrobiana 37, 50
Antioxidante 3, 38, 50, 51
Analgésica 51
Anti-inflamatória 50, 52
Antitumoral 50
Antiviral 50
Antihiperglicêmica 50
Antilipidiperoxidativa 50
Antidiabética 50
Antiúlcera 50
Antiasmática 53
Antiepiléptica 50
Ansiolítica 50
Antiplasmodial 54, 55
T. purpurea
Citotóxica 36
Diurética 57
Espasmolítica 50
Hepatoprotetora 50, 58, 59
Inseticida 32
Nefroprotetora 50
T. spinosa Antimicrobiana 60
Anti-inflamatória 61
T. tinctoria Antioxidante 20
Antidiabética 20
T. toxicaria
Antioxidante 10
Larvicida 10
Quimiopreventiva 19, 62
T. villosa Antifungica 63
Antiplasmodial 55
T. viridiflora Antiviral 33
T. vogelii
Acaricida 64
Controle de pragas 65
O gênero Stemodia é representado por cerca de 127 espécies distribuídas na Ásia,
África, Austrália e Américas. Destas espécies, apenas oito tem sido previamente estudadas:
S. chilensis, S. durantifolia, S. foliosa, S. grossa, S. kingii, S. maritima, S. trifoliata e S. viscosa.12,13 O estudo químico destas espécies tem apresentado diversas classes de
metabólitos secundários, como flavonoides isolados de S. viscosa,67 diterpenos labdanos
derivados do óxido de manoíla, encontrados em S. trifoliata e S. foliosa,13,68,69 diterpenos com
esqueletos estemodano, estemarano e abietano encontrados nas espécies S. chilensis e
S. maritima.12 Além destes, S. kingii é encontrada na Austrália e considerada uma planta
tóxica, tendo sido responsável pela morte de ovelhas anualmente. O estudo químico desta espécie confirmou a presença de duas toxinas, os estemodinosídeos B3 e B4, definidos como
glicosídeos esteroidais curcubitanos.11,70 S. grossa era tradicionalmente usada por povos
aborígines australianos para o tratamento do reumatismo, dor de cabeça e resfriados, embora
esta espécie não tenha sido quimicamente estudada.71S. durantifolia também não apresentou
relatos de seu estudo químico, embora no Haiti seja usada como agente antifertilidade.72
Neste trabalho, o estudo químico de S. maritima resultou no isolamento de
diterpenos com esqueleto do tipo estemodano, sendo, portanto, uma classe de importância quimiotaxonômica para o gênero. Este fato motivou a realização de um levantamento bibliográfico sobre a ocorrência destes metabólitos secundários em espécies do gênero
Stemodia, além de compostos obtidos como derivados destes metabólitos, seja por meio de
bisepóxido (IV) e abietano (V).
A Tabela 02 (p. 34) apresenta os diterpenos do gênero Stemodia e a suas formas
de ocorrência, produtos naturais, derivados químicos (sintéticos) e de biotransformação (biossintéticos). A Figura 05 (p. 39) contém as estruturas desses compostos, dispostos pela semelhança entre seus esqueletos básicos.
(I) (II) (III)
Composto Nome Origem Referência
1 Estemodano S 73
2 2α-hidroxiestemodano S 73
3 2β-hidroxiestemodano S 73
4 Estemodan-2-ona S 73
5 13(S)-hidroxiestemodano S 25
6 13(R)-hidroxiestemodano S 73
7 13(S)-hidroxiestemodan-2-ona (Estemodinona) N 74
8 13(R)-hidroxiestemodan-2-ona S 73
9 2α,13(S)-dihidroxiestemodano (Estemodina) N 74
10 2α,13(R)-dihidroxiestemodano S 25
11 2β,13(S)-dihidroxiestemodano S 25
12 2β,13(R)-dihidroxiestemodano S 73
13 2α-etilcarboniloxi-13-hidroxiestemodano S 17
14 2α-fenilcarboniloxi-13-hidroxiestemodano S 17
15 2α-dimetilcarbamoxi-13-hidroxiestemodano S 17
16 13-dimetilcarbamoxi-2α-hidroxiestemodano S 17
17 2α,13-bis(fenilcarbamoxi)estemodano S 17
18 2α-fenilcarbamoxi-13-hidroxiestemodano S 17
19 2α-(N-fenilcarbamoxi-N-fenil)-13-hidroxiestemodano S 17
20 2α-difenilcarbamoxi-13-hidroxiestemodano S 17
21 2α-difenilfosfato-13-hidroxiestemodano S 17
22 2α-propioniloxi-13-hidroxiestemodano S 17
23 2α-isobutiroxi-13-hidroxiestemodano S 17
24 2α,7α,13(S)-trihidroxiestemodano B 75
25 2α,7β,13(S)-trihidroxiestemodano B 75
26 2α,7β,13(R)-trihidroxiestemodano B 73
27 2β,7β,13(R)-trihidroxiestemodano B 73
28 2β,7β,13(S)-trihidroxiestemodano B 25
29 7β,13(S)-dihidroxiestemodan-2-ona B 18
30 7β,13(R)-dihidroxiestemodan-2-ona B 73
31 13(S)-hidroxi-estemodan-2,7-diona S 75
32 α-dimetilcarbamoxi-7α,13-dihidroxiestemodano B 17
33 6α,13(S)-dihidroxiestemodan-2-ona B 25
34 6α,13(R)-dihidroxiestemodan-2-ona B 73
35 6α,12α,13(S)-trihidroxiestemodan-2-ona B 18
36 2α,6β,13(S)-trihidroxiestemodano B 18
37 2α-(N,N-dimetilcarbamoxi)-6α,13(S
)-dihidroxiestemodano B 76
38 13,14-dihidroxiestemodano N 12
39 13-hidroxi-14-acetoxiestemodano S 77
40 13-acetoxi-14-hidroxiestemodano S 77
41 13,17-dihidroxiestemodano N 12
42 17-acetoxi-13-hidroxiestemodano N 12
43 19-acetoxi-13-hidroxiestemodano N 12
44 13,17,19-trihidroxiestemodano B 77
45 2α,13,14-trihidroxiestemodano B 75
46 13,14-dihidroxiestemodan-2-ona B 76
47 , , 7-trihidroxiestemodano B 77
48 2α,13,18-trihidroxiestemodano B 24
49 2α,13,18-triacetoxiestemodano S 17
50 2α,18-diacetoxi-13-hidroxiestemodano S 17
51 13,18-dihidroxiestemodan-2-ona B 16
52 2α,13,19-trihidroxiestemodano B 75
53 2α,13,16β-trihidroxiestemodano B 78
54 13,16β-dihidroxiestemodan-2-ona B 78
2α,13,17,19-tetrahidroxiestemodano B 75
59 3α,13-dihidroxiestemodano (Maritimol) N 74
60 13,17-dihidroxiestemodan-3-ona B 77
61 3β,13,17-trihidroxiestemodano B 77
62 2α,3β,13-trihidroxiestemodano (Maristeminol) N 79
63 2α,11β,13-trihidroxiestemodano B 18
64 13-hidroxi-2α,3β,17-triacetoxiestemodano S 77
65 11α,13-dihidroxi-3β,17-diacetoxiestemodano S 77
66 3β,11β,13,17-tetracetoxiestemodano S 77
67 3β,13,14-trihidroxiestemodano B 77
68 2α,8,13-trihidroxiestemodano B 24
69 8,13-dihidroxi-3β,17-diacetoxiestemodano S 77
70 2α,8,13,18-tetrahidroxiestemodano B 24
71 2α,7β,8,13-tetrahidroxiestemodano B 24
72 2α,3β,13,16α-tetrahidroxiestemodano B 25
73 13-hidroxi-3β,7α,17-triacetoxiestemodano S 77
74 7α,13,17,19-tetrahidroxiestemodano B 77
75 13-hidroxi-7α,17,19-triacetoxiestemodano S 77
76 13,19-dihidroxiestemarano (estemarina) N 17
77 Ácido 13-hidroxiestemaran-19-óico B 17
78 19-N,N-dimetilcarbamoxi-13-hidroxiestemarano S 78
79 2α,13,19-trihidroxiestemarano B 78
80 19-N,N-dimetilcarbamoxi-2β,13-dihidroxiestemarano B 76
81 1β,13,19-trihidroxiestemarano B 17
82 Ácido 1β,13-dihidroxiestemarano-19-óico B 78
83 Ácido 13,18-dihidroxiestemaran-19-óico B 78
84 8,13,19-trihidroxiestemarano B 18
85 19-N,N
86 Ácido 7β,13,18-trihidroxiestemaran-19-óico B 78
87 7α,13,18,19-tetrahidroxiestemarano B 78
88 19-N,N
-dimetilcarbamoxi-13,17,18-trihidroxiestemarano B 78
89 Ácido 6α,13-dihidroxiestemaran-19-óico B 76
90 Estemod-12-eno S 25
91 2α-hidroxiestemod-12-eno S 17
92 2β-hidroxiestemod-12-eno S 25
93 2α-fenilcarboniloxiestemod-12-eno S 17
94 2α-dietilfosfatoestemod-12-eno S 17
95 2α-difenilfosfatoestemod-12-eno S 17
96 Estemod-12-en-2-ona S 25
97 7β,17-dihidroxiestemod-12-en-2-ona B 25
98 12-bromoestemod-12-en-2-ona S 80
99 -acetoxiestemod-12-eno S 77
100 14,19-diacetoxiestemod-13(17)-eno S 77
101 Estemod-13(17)-eno S 81
102 13α-hidroxiestemod-11-en-2-ona S 80
103 15β-hidroxiestemar-16-en-2-ona S 80
104 15(13→12)abeo-13β-hidroxiestemaran-2-ona S 82
105 15(13→12)abeo-estemaran-2,13-diona S 82
106 15(13→12)abeo-7β,13β-dihidroxiestemaran-2-ona B 82
107 15(8→9)abeo-12β-hidroxiestachan-2-ona S 82
108 15(8→9)abeo-estachan-2,12-diona S 82
109 15(8→9)abeo-6β,12β-dihidroxiestachan-2-ona B 82
110 15(8→9)abeo-7β,12β-dihidroxiestachan-2-ona B 82
111 15(8→9)abeo-6α,12β,14β-trihidroxiestachan-2-ona B 82
112 15(8→9)abeo-12β,16α-dibromoestachan-2-ona S 80
114 15(8→9)abeo-12α,14β-dibromoestachan-2-ona S 80
115
15(8→9)abeo,14(13→16)abeo-estacha-12,15-dien-2-ona S 80
116
13β-hidroxi-15(8→9)abeo,14(13→16)abeo-estacha-15-en-2-ona S 80
117 Estemodinosídeo A N 79
118 Estemodinosídeo B N 79
119 Estemodinosídeo C N 79
120 Estemodin-α-L-arabinofuranosideo N 25
121 6α-maloniloxi-óxido de manoíla N 68
122 6α-maloniloxi-óxido n-butil éster de manoíla N 68 123 6α-ester etil-maloniloxi-óxido de manoíla N 69
124 bis-6α- dioximalonato de maoíla N 69
125 6α-acetoxi-óxido de manoíla N 68
126 6α-hidróxi-óxido de manoíla N 69
127 (5S*,8S*,9R*,10S*)-11β,12β-epoxi-9α
-hidroxi-19(4→3)abeo-abieta-3,13-dien-9,18-olídeo N 83
128 Estemolídeo N 84
129 Triptolídeo N 84
acordo com seus esqueletos básicos.
R1 R2
(1) H Hα
(2) OHα Hα
(3) OHβ Hα
(4) O= Hα
(5) H OHα
(6) H OHβ
(7) O= OHα
(8) O= OHβ
(9) OHα OHα
(10) OHα OHβ
(11) OHβ OHα
(12) OHβ OHβ
(13) EtOCOO OHα
(14) PhOCOO OHα
(15) (Me)2NCOO OHα
(16) OHα (Me)2NCO
(17) PhHNCOO PhHNCO
(18) PhHNCOO OHα
(19) OHα
(20) (Ph)2NCOO OHα
(21) (PhO)2POO OHα
(22) EtCOO OHα
R1 R2 R3
(24) OHα OHα OHα
(25) OHα OHβ OHα
(26) OHα OHβ OHβ
(27) OHβ OHβ OHβ
(28) OHβ OHβ OHα
(29) O= OHβ OHα
(30) O= OHβ OHβ
(31) O= O= OHα
(32) (Me)2NCO OHα OHα
R1 R2 R3 R4
(33) O= OHα H OHα
(34) O= OHα H OHβ
(35) O= OHα OHα OHα
(36) OHα OHβ H OHα
R1 R2 R3 R4 R5 R6 R7
(38) H H H OH OH H H
(39) H H H OAc OH H H
(40) H H H OH OAc H H
(41) H H H H OH OH H
(42) H H H H OH OAc H
(43) H OAc H H OH H H
(44) H OH H H OH OH H
(45) OHα H H OH OH H H
(46) O= H H OH OH H H
(47) OHα H H H OH OH H
(48) OHα H OH H OH H H
(49) OAc H OAc H OAc H H
(50) OAc H OAc H OH H H
(51) O= H OH H OH H H
(52) OHα OH H H OH H H
(53) OHα H H H OH H OHβ
(54) O= H H H OH H OHβ
(55) O= H H H OH OH OHα
(56) OHα H OH H OH OH H
(57) OAc H OAc H OH OAc H
R1 R2 R3 R4 R5 R6 R7
(59) H OHα H H OH H H
(60) H O= H H OH OH H
(61) H OHβ H H OH OH H
(62) OH OHβ H H OH H H
(63) OH H H OH H OHβ
(64) OAc OAc H H OH OAc H
(65) H OAc H H OH OAc OHα
(66) OAc H H H OAc OAc OAc
(67) H OHβ H OH OH H H
(68) OH H OH H OH H H
(69) H OAc OH H OH OAc H
R1 R2 R3 R4 R5 R6 R7 R8
(70) OH H H OH H OH H H
(71) OH H H H OHβ OH H H
(72) OH OHβ H H H H H OHα
(73) H OAc H H OAc H OAc H
(74) H H OH H OHα H OH H
R1 R2 R3 R4 R5 R6 R7 R8
(76) H H H CH2OH H H H H
(77) H H H COOH H H H H
(78) H H H CH2OCON(Me)2 H H H H
(79) H OHα H OH H H H H
(80) H OHβ H CH2OCON(Me)2 H H H H
(81) OH H H OH H H H H
(82) OH H H COOH H H H H
(83) H H OH COOH H H H H
(84) H H H OH H H OH H
(85) H OHβ H CH2OCON(Me)2 H H OH H
(86) H H OH COOH H OHβ H H
(87) H H OH OH H OHα H H
(88) H H OH CH2OCON(Me)2 H H H OH
R1 R2 R3 R4 R5
(90) H H H H H
(91) OHα H H H H
(92) OHβ H H H H
(93) PhOCOO H H H H
(94) (EtO)2POO H H H H
(95) (PhO)2POO H H H H
(96) O= H H H H
(97) O= H OH OH H
(98) O= H H H Br
(99) H OAc H H H
(102)
R1 R2
(100) OAc OAc
(103)
R1 R2
(104) H OHβ
(105) H O=
(106) OH OHβ
R1 R2 R3 R4 R5
(107) H H H OHβ H
(108) H H H O= H
(109) OHβ H H OHβ H
(110) H OH H OHβ H
(111) OHα H OH OHβ H
(112) H H H Br β Br α
(113) H H H Br β Br β
(116) (115)
(118) (117)
(120)
R
(121) H
(122) C4H9 (123) CH2CH3 (124) C20H33O
R (125) OAc
(128) (127)
R (129) H
Os estemodanos tem atraído interesse não apenas por seu esqueleto carbônico único, mas também por apresentarem uma estreita semelhança com o diterpeno aphidicolina
(Fig. 06, p. 49), um agente citotóxico e antiviral isolado de culturas do fungo Cephalosporium aphidicola. Por esta razão, os diterpenos estemodanos tem sido submetidos a inúmeras
biotransformações.17 Os microorganismos que tem sido usados para biostransformar a
estemodina e seus derivados são apresentados na tabela 3 abaixo.
Figura 06 – Estrutura de aphidicolina
Tabela 03 – Espécies de microorganismos usados na biotransformação de estemodanos.
Microorganismo Referência
Cunninghamella echinulata 75, 76 Polyangium cellulosum 75
Rhizopus oryzae 25, 73, 82
Mucor plumbeus 18, 77
Whetzelinia sclerotiorum 18
Beauveria bassiana 17
Phanerochaete chrysosporium 76 Rhizopus arrhizus 24
Streptomyces sp. 24
Cephalosporium aphidicola 16
Aspergillus niger 78
4 PARTE EXPERIMENTAL
4.1 Métodos cromatográficos
4.1.1 Cromatografia em coluna de fase normal (CC)
As cromatografias de adsorção em coluna foram realizadas utilizando-se gel de sílica 60 (Φ 0,063-0,200 mm) da VETEC®. Os tamanhos das colunas (altura, L e diâmetro, Φ) variaram de acordo com a massa das amostras que foram cromatografadas. Os solventes utilizados nas eluições foram n-hexano, diclorometano, acetato de etila e metanol de
qualidade PA (marca SYNTH®), puros ou em misturas binárias em ordem crescente de polaridade.
4.1.2 Cromatografia em camada delgada (CCD)
Para CCD utilizou-se cromatoplacas de plástico e/ou de alumínio com gel de sílica 60 F254, da MERCK®. Os resultados foram observados pela exposição das cromatoplacas à luz ultravioleta (UV) em dois comprimentos de onda (254 e 365 nm), emitidos por lâmpada modelo VL-4.LC da VILBER LOURMAT® e/ou por imersão em solução de vanilina (C8H8O3) 5g/100 mL de ácido perclórico (HClO4) 0,75 M/100 mL de etanol, seguido de aquecimento em soprador térmico HL-500 da STEINEL® à aproximadamente 150 °C por alguns segundos.
4.2 Métodos físicos de análise
4.2.1 Infravermelho (IV)
4.2.2 Rotação óptica
As medidas de rotação óptica específicas [α]TD foram realizadas em Polarímetro digital da PERKIN ELMER® modelo P-2000, na faixa de sódio (549 nm) a 20 ºC.
4.2.3 Espectroscopia de Ressonância Magnética Nuclear (RMN)
Os espectros de RMN 1H e 13C, uni e bidimensionais foram obtidos em espectrômetro BRUKER AVANCE DRX 500 e DRX 300, situado no Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear (CENAUREMN-UFC), operando nas frequências de 499,60 e 300,13 MHz para o núcleo de 1H, 125,62 e 75,46 MHz para 13C.
Cada amostra foi dissolvida em 0,60 mL do solvente deuterado adequado e acondicionados em tubos de RMN de 5 mm. Os deslocamentos químicos (δ) foram expressos em ppm e referenciados através do pico residual de 1H do solvente deuterado utilizado. As multiplicidades das absorções foram indicadas segundo a convenção: simpleto (s), dupleto (d), tripleto (t) e multipleto (m).
O padrão de hidrogenação dos carbonos foi determinado através da utilização da técnica DEPT (Distortionless Enhancement by Polarization Transfer), com ângulo de nutação de 135° (CH e CH3 com amplitude positiva e CH2 com negativa). Os carbonos não hidrogenados foram caracterizados pela comparação entre os espectros de DEPT 135º e 13C-BB 1HD (Broadband 1H Decoupled).
4.2.4 Espectrometria de massa (EM)
Os espectros de massa de baixa resolução (EM-IE) foram obtidos em espectrômetro de massa SHIMADZU®, modelo QP 5000, DI-50, por impacto eletrônico a 70 eV. Enquanto os espectros de alta resolução foram obtidos em espectrômetro de massa modelo LCMS-IT-TOF (225-07100-34) - SHIMADZU®, com ionização por electrospray
4.2.5 Ponto de fusão (pf)
Os pontos de fusão foram determinados em equipamento de Microquímica® modelo MQAPF, a uma taxa de aquecimento de 3°C/mim, e em aparelho digital METTLER-TOLEDO® modelo FP62, também a uma taxa de aquecimento de 3°C/mim.
4.3 Estudo de Tephrosia toxicaria
As raízes de Tephrosia toxicaria Pers. foram coletadas no município de
Guaraciaba do Norte – CE, em 09 de maio de 2008, pela Professora Ângela Martha Campos Arriaga do Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará (DQOI/UFC). A identificação botânica foi realizada pelo Professor Edson P. Nunes do Departamento de Biologia da Universidade Federal do Ceará. A exsicata da planta encontra-se depositada no Herbário Prisco Bezerra do mesmo Departamento, sob o registro nº 32.139.
Para obtenção do extrato, as raízes (710 g) de T. toxicaria foram trituradas, secas
e submetidas à extração com etanol à temperatura ambiente. A solução obtida foi filtrada e evaporada à pressão reduzida em rota-evaporador, resultando no extrato denominado TTRE (78,90 g) com 11,11% de rendimento.
TTRE (22,01 g), um material sólido de coloração marrom foi adsorvido em gel de sílica, pulverizado em gral de porcelana e submetido à cromatografia filtrante em gel de sílica, em coluna cromatográfica (L=7 cm e Φ=6 cm). A série de eluentes utilizada e suas respectivas frações são apresentadas na tabela abaixo.
Tabela 04 – Dados do fracionamento cromatográfico de TTRE.
ELUENTE FRAÇÕES V/mL
Hexano 1 – 2 50
Hexano/diclorometano 50% 3 – 8 50
Diclorometano 9 – 16 50
Diclorometano/acetato de etila 50% 17 125
Acetato de etila 18 – 19 125
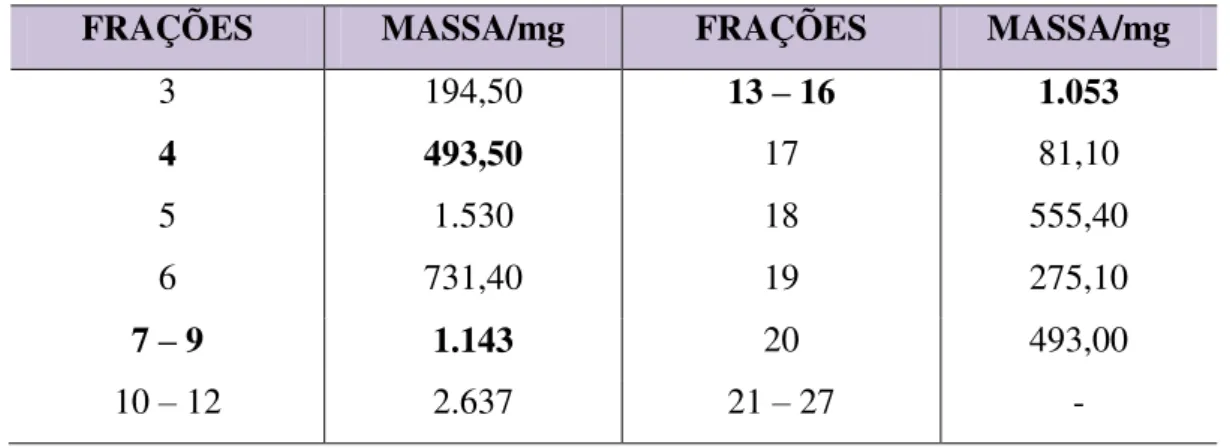
Após análise por CCD as frações foram reunidas de acordo com seu perfil cromatográfico, resultando em doze novas frações, como mostrado na tabela 05 abaixo.
Tabela 05 – Frações resultantes do fracionamento cromatográfico de TTRE.
FRAÇÕES MASSA/mg FRAÇÕES MASSA/mg
3 194,50 13 – 16 1.053
4 493,50 17 81,10
5 1.530 18 555,40
6 731,40 19 275,10
7 – 9 1.143 20 493,00
10 – 12 2.637 21 – 27 -
A fração TTRE 4 (493,50 mg) foi cromatografada em gel de sílica (L=17 cm e Φ=3 cm). O fracionamento cromatográfico foi realizado com a série de eluentes e as respectivas frações descritas na tabela 06, onde foram coletadas frações de 10 mL.
Tabela 06 – Dados para o fracionamento cromatográfico de TTRE – 4.
ELUENTE FRAÇÕES
Hexano/diclorometano 5% 1 – 14 Hexano/diclorometano 10% 15 – 39 Hexano/diclorometano 15% 40 – 71 Hexano/diclorometano 20% 72 – 77 Hexano/diclorometano 30% 78 – 88 Hexano/diclorometano 40% 89 – 93 Hexano/diclorometano 50% 94 – 101 Hexano/diclorometano 60% 102 – 112 Hexano/diclorometano 80% 113 – 120
Diclorometano 121 – 126
Diclorometano/acetato de etila 50% 127 – 135
cristalino, solúvel em clorofórmio, denominado TT-1. Este composto foi caracterizado estruturalmente como sendo a flavanona obovatina (item 5.1, p. 65).
A fração TTRE 7-9 (1.143 mg) (Tabela 05, p. 54) foi cromatografada em gel de sílica (L=8 cm e Φ=5,5 cm), nela foram utilizados hexano, diclorometano, acetato de etila e metanol em misturas binárias e em gradiente de polaridade, tendo sido coletadas cento e sessenta e sete (167) frações com 10 mL cada.
Posterior análise das frações por CCD permitiu reuní-las de acordo com seus perfis cromatográficos, dentre elas, a fração F-28-39 de massa igual a 175,70 mg continha um sólido amarelo de aspecto amorfo, solúvel em clorofórmio, denominado TT-2. O composto foi caracterizado estruturalmente como sendo o rotenoide deguelina (item 5.2, p. 74).
A fração TTRE 13-16 (1.053 mg) (Tabela 05, p. 54) foi cromatografada em gel de sílica (L=18 cm e Φ=3,0 cm). O fracionamento foi realizado com a série de eluentes e respectivas frações descritas na tabela abaixo, onde foram coletadas frações de 10 mL.
Tabela 07 – Dados para o fracionamento cromatográfico de TTRE 13-16.
ELUENTE FRAÇÕES
Hexano/acetato de etila 20% 1 – 6 Hexano/acetato de etila 25% 7 – 15 Hexano/acetato de etila 30% 16 – 24 Hexano/acetato de etila 40% 25 – 33 Hexano/acetato de etila 60% 34 – 38 Hexano/acetato de etila 80% 39 – 47 Acetato de etila 48 – 51
Metanol 52 – 56
4.4 Estudo de Stemodia maritima
As folhas de Stemodia maritima Linn. foram coletadas no município de
Flecheiras-CE, em 14 de janeiro de 2006, pela Professora Ângela Martha Campos Arriaga, do Departamento de Química Orgânica e Inorgânica, da Universidade Federal do Ceará. A identificação botânica desta espécie foi realizada pelo Professor Edson P. Nunes do Departamento de Biologia da Universidade Federal do Ceará. Sua exsicata encontra-se depositada no Herbário Prisco Bezerra do mesmo Departamento, sob o registro de nº 38.483.
As folhas (830 g) de S. maritima foram trituradas, secas e submetidas à extração
com etanol à temperatura ambiente. A solução obtida foi filtrada e evaporada à pressão reduzida em rota-evaporador, resultando no extrato denominado SMFE (65,40 g) com 7,88% de rendimento.
Visando a remoção de clorofila do extrato, uma alíquota de SMFE (30,60 g) foi dissolvida em etanol (500 mL) e a esta solução adicionados 10,0 g de carvão ativado. A mistura ficou sob agitação durante 1 h e 30 min, seguida de filtração a vácuo em funil de Büchner com uma camada de celite. O filtrado foi concentrado à pressão reduzida, dando origem ao extrato de SMFE-LC (Livre de Clorofila).
SMFE-LC (20,20 g), um material sólido de coloração marrom foi adsorvido em gel de sílica (42,00 g) e pulverizado em gral de porcelana, submetido à filtração a vácuo em funil de Büchner com hexano, hexano/acetato de etila 50% e acetona (ver tabela 08 abaixo). A fração extraída com hexano/acetato de etila 50% rendeu 3,50 g, sendo posteriormente utilizada para dar continuidade ao fracionamento.
Tabela 08 – Dados referentes ao fracionamento de SMFE-LC
ELUENTE FRAÇÃO MASSA
Hexano SMFE-LC 1 30,20 mg
Hexano/Acetato de etila 1:1 SMFE-LC 2 3,50 g
Acetona SMFE-LC 3 6,42 g